Онкология РМЖ — это посторонние новообразования, появляющиеся в железистой ткани. Количество подвидов этого заболевания, известных на сегодняшнее время, составляет около двадцати.
От обычных, клетки раковых опухолей отличаются своим ускоренным обменом веществ и ненормальным строением. Когда возникает онкология молочной железы, эти клетки постоянно растут, а позже проникает в лимфоузлы и прочие органы.
Современная наука полагает, что главным катализатором РМЖ является искажение гормонального фона, вследствие чего возникают все прочие симптомы рака. Ведь согласно статистике, обнаруживают его во время климакса чаще. Ведь это период резкого изменения выработки различных гормонов женским организмом, сказывающийся на состоянии молочной железы.
Негативными факторами считаются как избыток, так и недостаток половых гормонов. Так, заболеваемость у прошедших роды и лактацию женщин в несколько раз ниже, чем у нерожавших или совершивших абортов. У последних, признаки онкологии молочной железы встречаются чаще.
Виды рака молочной железы у женщин могут быть по различным признакам, мы приведем простейшую из классификаций, которую легко поймет даже неспециалист.
- Узловой — встречается чаще других и представляет собой образование небольших узелков, которые являются ничем иным, как некротизированными (пораженными) участками. На средней стадии легко пальпируется, имеет неоднородную узелковую структуру. По форме опухоль шарообразна, но может иметь боковые ответвления. Ткань железы изменяется, спаиваясь. Эти первые сигналы онкологии заметны невооруженным глазом, когда руки подняты выше уровня плеч. Визуально также можно диагностировать по смене оттенка кожных покровов (желтого, красного, коричневого) и сосочным выделениям. На последующих этапах ведет к воспалению лимфоузлов, прогрессу новообразования, и, соответственно, к увеличению объема груди. Также может появится характерная ороговевшая кожа и открытые язвы.
- Диффузный — встречается реже, чем узловой, но не в пример более опасен. Ведь развивается он разы быстрее и сопровождается относительно ранним метастазированием. Из-за поражения железы грудь отекает, а кожные покровы изменяются. У диффузного существуют свои типы:
- Инфильтративный — появляется плотное образование, а кожа отекает и покрывается характерной коркой. Помимо этого, поражаются лимфоузлы, а наиболее четко заболевание проявляется возле ареолы соска.
- Воспалительный — иначе может называться маститоподобным и возникает из-за неправильного лечения. Уплотнения внутри груди являются болезненными, грудь отекает и приобретает синюшный оттенок. Страдают лимфоузлы и капиллярные сосуды.
- Панцирный — течение болезни очень длительное, опухоль поражает не только молочные железы, но и может распространиться дальше. Вместо отечности, наблюдаемой в других видах, здесь имеет место уменьшение груди в объеме, ее пигментация и появление множественных узелков, сливающихся затем в одну большую опухоль.
- Рак соска — наименее часто упоминающийся подтип этой сферы, им поражены всего 3% заболевших. Захватывает протоки соска и околососковую область. Первыми признаками рака молочной железы у женщин будут следы на внутренней поверхности чашечек бюстгальтера. Затем возникает отечность, появляются корочки и язвы. С развитием новообразование может затронуть и другие части груди, но прогресс заболевания чрезвычайно медленный.
Чтобы понять, как определить стадию рака молочной железы, следует знать, чем они отличаются. Рассматривается диаметр опухоли, продолжительность заболевания, насколько поражен организм, каков прогноз выживаемости. Выделяют начальную и 4 основных стадий развития заболевания:
- Начальная — опухолевые клетки появились совсем недавно, обычно выявляется случайно при профосмотре. Такой рак молочных желез у женщин малоопасен, шансы успешно излечиться невероятно высоки и составляют выше 98%. Врачи рекомендуют проходить профосмотр самостоятельно и в поликлинике (женской консультации) на регулярной основе.
- Первая — новообразование до 2 сантиметров в диаметре и пока не поразило близлежащие ткани. Выживаемость при раке молочной железы 1 степени превышает 96%, что делает прогноз чрезвычайно благоприятным.
- Вторая — диаметр больше 2 см, но еще не превысил 5см. Выживаемость обусловлена уязвимостью лимфатической системы, но шансы успешного избавления достаточно велики (до 90%).
- Третья — прогноз успешно избавиться от заболевания не столь велик — до 70%, зависит от степени поражения и удаленности от очага болезни лимфатических узлов. Но метастазов в здоровые органы еще нет.
- Четвертая — последняя стадия онкологии, когда клетки с кровотоком и лимфотоком попадают в другие органы, создавая множественные очаги заболевания. Вероятность излечения крайне мала — до 10%
На вопрос о том, как быстро развивается заболевание, нельзя ответить абсолютно точно. Прогресс обусловлен множеством факторов, среди которых:
- Возраст пациента
- Гормональный фон
- Условия жизни
- Сопутствующие заболевания
- Вид рака
Последний по порядку фактор является одним из самых важных, так как существуют более агрессивные по течению виды онкологических заболеваний и менее агрессивные. Таким образом, переход от стадии к стадии и общий прогресс заболевания у одного пациента может занять год, а у другого и 10 лет.
Ответ на вопрос о том, сколько живут с раком молочной железы, заключается в степени распространения онкологического заболевания на молочную железу. Для более точного определения в медицине применяется термин «пятилетняя выживаемость» — вероятность прожить больше 5 лет после диагностирования онкологии в конкретной стадии.
На начальном этапе, как было сказано выше, средняя продолжительность жизни при раке молочных желез практически ничем не отличается от обычной, ведь он успешно излечивается у большинства пациентов. Но проблема заключается в том, что минимум половина пациентов обнаруживает рак на 3-4 степени.
| Стадия | Пятилетняя выживаемость |
| Первая | До 95% |
| Вторая | До 80% |
| Третья | До 40% |
| Четвертая | До 10% |
Помимо выживаемости актуален и вопрос рецидива. Современные медицинские методы лечения не гарантируют стопроцентное убийство раковых клеток. Поэтому через некоторое время болезнь может вернуться с новой силой и поразить другие важные элементы организма пациента. Чем больше разрослись раковые клетки до момента старта терапии или хирургического вмешательства, тем больше вероятность повторного возникновения онкологии груди. При этом самые опасные — первые 5 лет после, казалось бы, успешной терапии. Следовательно, раковые больные регулярно должны наблюдаться и по окончании лечения. Это сделает прогноз при раке молочной железы более благоприятным.
Из всех методов ранней диагностики рака молочной железы, важнейшим является самообследование, ведь крайне важно пораньше заметить симптомы. Медики настаивают на ежемесячном самоосмотре для всех женщин старше 35 лет и тех, кто входит в группу риска.
Начать необходимо с простого осмотра груди с помощью зеркала. Если одна из них увеличена по отношению к другой, наблюдается деформация или кожа постепенно превращается в лимонную корку — стоит немедленно обратиться к специалисту. Это самая простая начальная диагностика онкологии раке молочной железы.
Выявить онкологию груди самостоятельно вероятнее на второй неделе после старта менструального цикла. Распознать ее проще, если при осмотре, стоя или лежа, одну руку закидывать за голову, а второй помогать осмотру.
Кроме осмотра визуального необходимо проверить грудь на ощупь на опухолевые узлы. Если при ощупывании ощущается дискомфорт или боль, посещение маммолога откладывать нельзя. Ненормальные выделения из сосков определяются путем их несильного сдавливания. Быстрое выявление заболевания — гарантия абсолютного излечения, поэтому оно жизненно важно.
Набор инструментов и методик для выявления онкологии молочных желез у медиков довольное широк. Основные из них:
- Маммография
- Термография
- Магниторезонансная терапия
- Ультразвуковое исследование
- Биопсия
- Цитологическое исследование
- Радиоизотопное сканирование
- Сцинтимаммография
Эти современные методики не только позволяют поставить точный диагноз, дифференцировав его от, например, мастопатии, но и дать конкретное представление о положении, размерах опухоли и ее злокачественности.
Признаки рака молочной железы на первой стадии мало проявляются вообще или слабо заметны. Возникают, например, небольшие узелки, проявляющиеся при ощупывании. Любопытно, что болезненные новообразования чаще указывают на доброкачественную опухоль, а вот злокачественная боли на начальных этапах не приносит. Узелок может быть неподвижным, а может незначительно смещаться под давлением пальцев.
Другие сигналы онкологии РМЖ заключаются в изменении фактуры кожи, на ней могут появиться складки, морщины, отеки или корка, похожая на апельсиновую. Также могут появиться и небольшие язвочки, которые на поздних этапах нагнаиваются и кровоточат.
Если болезнь затрагивает сосок, то сигналом этого являются патологические выделения, а также изменения кожи соска и ареола вокруг него. Не стоит путать это с выделениями в период лактации (кормления).
К симптомам рака молочной железы также относят разрастание лимфатических узлов, что характерно для 2 степени. Причем сперва страдают близлежащие узлы, находящиеся под мышками.
Если вас крайне беспокоит — лечится ли рак молочной железы, то мы с уверенностью готовы дать положительный ответ. При лечении необходимо полностью удалить все опухолевые клетки. Естественно, сделать это тем проще, чем раньше было выявлено новообразование.
Современные методы лечения рака молочной железы включают множество различных терапий, но самым действенным способом был и остается хирургический, при котором возможно полное удаление груди или удаление только опухоли при ее небольших размерах.
Мастэктомия — удаление одной из грудей пациентки, показана на поздних стадиях ракового заболевания. При современном уровне развития пластической хирургии такие операции нередко проводят вместе с реконструирующими. То есть сразу после удаления груди вживляется имплантат, внешне имитирующий орган. После мастэктомии, назначающейся обычно с третьей степени рака, проводится тщательное исследование близлежащих тканей и лимфоузлов, чтобы исключить возможные рецидивы.
К другим методам лечения заболевания относятся следующие терапии:
- Лучевая — замедляет рост опухолевых клеток. Актуально, когда хирургическое лечение невозможно или рост опухоли носит агрессивный характер.
- Гормональная — ряд онкологических новообразований уязвим для определенных половых гормонов, поэтому медики могут использовать их искусственные аналоги или антагонисты, но только после тщательного гистологического исследования в лаборатории.
- Таргетная — поскольку раковые клетки вырабатывают собственную защиты от лекарственных препаратов и разрушающих их гормонов, разработаны средства, снижающие данную защиты и действующие избирательно только на клетки злокачественных образований.
- Химическая — заключается в применении лекарств, губительных для раковых клеток. Назначается обычно со второй степени болезни, а также в том случае, если гормонотерапия неэффективна. При этом химиотерапия может, во-первых, подготовить постороннее образование к оперативному вмешательству, во-вторых, помочь обезвредить метастазы, разошедшиеся по организму, и, наконец, уменьшить злокачественное образование до операбельных размеров.
Лечение должно проводиться комплексно под постоянным контролем специалиста, в том числе, и после выздоровления. Отметим, что ряд методов имеют свои осложнения и побочные эффекты, устраняемые другими лекарственными препаратами и иными медицинскими средствами.
Ключевым фактором в возникновении опухолевого очага ученые считают гормональный. Но существуют и другие причины возникновения онкологии рака молочно железы у женщин. Рассмотрим, что увеличивает вероятность заболевания:
- Случаи аналогичных заболеваний у родных
- Ранее обнаруженные неонкологические болезни молочных желез
- Пожилой возраст
- Не было беременности и (или) родов
- Слишком маленький (менее года) период кормления ребенка грудным молоком
- Роды в позднем возрасте (старше 35 лет)
- Ранние месячные или поздний климакс
- Использование гормональных контрацептивов
- Лишний вес
- Злоупотребление алкоголем и табачными изделиями
- Маленький процент жировой ткани в структуре молочной железы
Количество факторов достаточно велико и все они играют свою роль в возникновении данного онкологического заболевания.
Сразу подчеркнем, что на 100% застраховать себя от онкологии груди невозможно. Однако можно значительно снизить вероятность заболевания (алкоголь, табак, лишний вес) и реализовать то, к чему женский организм подготовила природа. Речь здесь, в первую очередь, о родах и грудном вскармливании. Длительная лактация и роды (лучше не одни) в активном возрасте значительно снижают риск рака груди.
Современный мир диктует для девушек определенные модные тенденции, не все из которых безопасны. Например, загар топлес или экстремальный спорт с периодическими травмами в районе груди несут в себе дополнительную опасность онкологических заболеваний. Не последнюю роль играют и стрессы, поэтому спокойный образ жизни, правильное питание и умеренная спортивная нагрузка помогут вам оставаться здоровыми долгие годы!
источник
Рак молочной железы — злокачественная опухоль железистой ткани молочной железы. В мире это наиболее частая форма рака среди женщин, поражающая в течение жизни от 1/13 до 1/9 женщин в возрасте от 13 до 90 лет. Это также второе по частоте после рака лёгких онкологическое заболевание в популяции в целом, рак молочной железы иногда встречается и у мужчин, но случаи этого вида рака у мужчин составляют менее 1 % от общего количества больных данным заболеванием. По данным американских специалистов ежегодно рак молочной железы поражает 180 тыс. женщин, 46 тыс. из них умирают от этой болезни. В России на 100 тыс. женского населения приходится 36, случаев рака.
Молекулярная генетика рака молочной железы:
На сегодняшний день хорошо изучены высоко пенетрантные гены BRCA 1 и BRCA 2, играющие определенную роль при возникновении наследственного РМЖ. Терминальные мутации генов являются этиологичными в отношении специфической индивидуальной и семейной предрасположенности — синдромам Ли-Фраумени, Каудена.
Существуют другие гены и полиморфизмы, имеющие отношение к наследственному предрасположению возникновения рака молочной железы: СНЕК2, NBS1, CYP17, CYP19, NAT2, но их изменения связаны с меньшим риском развития рака молочной железы по сравнению с генами BRCA.
BRCA 1-ген был идентифицирован с помощью позиционного клонирования в 1994г. и соответствует на длинном плече 17-й хромосомы. BRCA 2-ген был найден на 13q — хромосоме и выделен в 1995 г. BRCA 1 и BRCA 2-гены являются супрессорными генами с аутосомно-доминантным типом наследования и высокой пенетрантностью в пределах одной семьи. В совместном исследовании, включившим данные большого количества семей, наследующих терминальные мутации генов BRCA 1 И BRCA 2, было показано, что оба этих гена несут высокий (80— 95 %) риск развития рака молочной железы у женщин в течение всей жизни, однако кривая пенетрантности для носителей мутаций гена BRCA 1 начинает возрастать в более раннем возрасте по сравнению с носителями мутаций гена BRCA 2.
Анализ данных продемонстрировал высокую вероятность возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, меланомы, мочевого пузыря, опухолей головы и шеи при патологическом BRCA 1/2 — генотипе, что необходимо учитывать при медико-генетическом консультировании и наблюдении пациентов-носителей. Риск развития двухстороннего рака молочной железы составляет 64% для носителей мутаций гена BRCA 1 и 58 % — для носителей мутаций гена BRCA 2.
Мутации генов BRCA 1/2 одновременно находят примерно в 80% семей с 4 и более случаями РМЖ, диагностированными после 60 лет.
Молекулярные исследования BRCA 1 и BRCA 2-генов, проведенные за последние годы, демонстрируют огромный спектр мутаций этих генов. Сущкствует свыше 800 различных вариантов мутаций генов BRCA 1/2. Большинство этих мутаций относятся к делеторным, в результате которых структурные перестройки изменяют функциональность белкового продукта, что, в свою очередь, снижает способность клетки к репарации ДНК. Значительная часть (34%) мутаций гена BRCA 1 и 38% BRCA 2-гена, являются миссенс-мутациями. Описано большое количество однонуклеотидных полиморфных вариантов, клиническое значение которых на сегодняшний день не определено. У пациентов, страдающих раком молочной железы или раком яичников, из семей с онкологически отягощенным анамнезом в 52,4% случаев одна аллель гена BRCA 1 содержала 8 полиморфных вариантов, наследуемых в семье как целое.
В отношении оценок пенетрантности генов BRCA 1 и BRCA 2 также важно этническое происхождение пациентов-носителей. Изучение популяций исландцев и евреев Ашкенази выявило низкую пенетрантность этих генов, возможность развития рака молочной железы на протяжении жизни составил 37 %.
В этих популяциях только несколько мутаций являются ответственными за генетическую предрасположенность к раку молочной железы и раку яичников. Они связаны с эффектом родоначальника, то есть мутация, возникшая в одной из гамет предка, так называемая неомутация, или мутация de novo, впоследствии передается из поколения в поколение.
Особенности рака молочной железы у носителей мутаций генов BRCA 1 или BRCA 2:
Различный молекулярный патогенез между BRCA-ассоциированными и ненаследственными опухолями молочной железы предполагает, что эти опухоли могут кардинальным образом отличаться по фенотипическим и прогностическим признакам. Многими группами исследователей отмечена фенотипическая гетерогенность РМЖ, обусловленная терминальными мутациями генов BRCA I или BRCA 2. Показано, что отсутствие пораженных регионарных лимфатических узлов не снижает смертности у носителей мутаций этих генов.
При планировании лечения носителей мутаций BRCA 1 или BRCA 2 больным рака молочной железы следует учитывать, что оставление ткани молочной железы приводит к развитию в ней новых опухолей. Так, Всемирная организация здоровья приводят отдаленные результаты органо-сохраняющего лечения таких больных: операции были выполнены при среднем возрасте 42 года. Средняя длительность наблюдения — 12 лет. Частота вторых РМЖ составила: 42 %.
Классификация рака молочной железы:
По клиническому течению различают несколько форм рака молочной железы:
•инфильтративно-отечную форма, чаще развивается у молодых женщин в период беременности и лактации. Течение острое. Боль чаще отсутствует. Быстро увеличиваются размеры уплотненного участка молочной железы. Характерен отек ткани молочной железы и кожи в результате распространения раковых клеток по внутрикожным лимфатическим сосудам и внутридольковым лимфатическим щелям
•маститоподобную форма, чаще встречается у молодых женщин, беременных и кормящих. Заболевание проявляется подъемом температуры тела, увеличением и плотностью отдельного участка или всей молочной железы, отеком, гиперемией кожи. Болезнь быстро прогрессирует, рано появляются метастазы
•рожистопадобную форма, проявляется уплотненим молочной железы, ее инфильтрацией, местным повышением температуры, краснотой кожи в виде пятна с неровными, языкообразными краями. Опухолевый узел не выявляется при пальпации. Раковые клетки распространяются преимущественно по внутрикожным лимфатическим сосудам раковый лимфангиит
•панцирный вариант рака, плотная инфильтрация кожи над молочной железой. При этой форме раковые клетки распространяются на железистую ткань, кожу и подкожную жировую клетчатку железы. Молочная железа уменьшена в размерах, ограниченно подвижна, кожа над ней уплотнена, поверхность неровная, напоминающая панцирь
Подтипы рака молочной железы:
На основании результатов генетического исследования раковой клетки специалисты выделяют три подтипа рака молочной железы:
1. Эстроген-рецептор положительный (ER-положительный) рак молочной железы. Для развития этого типа рака необходим гормон эстроген, который ускоряет размножение и предотвращает гибель раковых клеток. ER-положительный рак молочной железы – наименее агрессивная форма рака молочной железы, которую часто можно вылечить с помощью назначения лекарственных препаратов из группы селективных модуляторов эстрогеновых рецепторов, таких как тамоксифен, ралоксифен, торемифен, а также ингибиторов ароматазы, например, летрозола, анастрозола и экземестана. Модуляторы эстрогеновых рецепторов предотвращают передачу раковой клетке сигналов, стимулирующих ее рост и деление. Результаты исследований продемонстрировали эффективность применения этой группы лекарственных препаратов как в качестве средств терапии ER-положительного рака молочной железы, так и в качестве средств его профилактики. Ингибиторы ароматазы снижают поглощение эстрогена клетками и снижают концентрацию эстрогена в сыворотке крови, тканях и злокачественных клетках. Обычно препараты этой группы применяются у женщин в постменопаузальном периоде.
2. HER2-положительный рак молочной железы. При этом типе рака злокачественные клетки содержат большое количество специфического белка-протоонкогена HER2, помогающего им расти и размножаться. Такие лекарственные препараты, как трастузумаб, лапатиниб, пертузумаб и трастузумаба эмтансин, блокируют синтез белка и препятствует росту опухоли, уничтожая злокачественные клетки.
3. Тройной негативный (ER-негативный/PR-негативный/HER2-негативный) рак молочной железы – самый агрессивный тип рака молочной железы с наиболее неблагоприятным прогнозом. При этом типе рака злокачественные клетки не содержат рецепторов к эстрогенам, прогестерону и белку HER2. В настоящее время отсутствуют одобренные персонализированные методы лечения пациенток с тройным негативным раком молочной железы, но ученые смогли выделить шесть подтипов опухолей. Это – первый шаг на пути выявления биомаркеров, которые могут помочь разработать персонализированный подход к терапии тройного негативного рака молочной железы.
Предраковые заболевания:
Предраковые заболевания– состояния, предшествующие развитию ракового процесса. Современные ученые предполагают, что злокачественные новообразование практически никогда не развиваются в здоровом организме и каждому раку предшествует определенное предраковое заболевание. Считается, что процесс перехода нормальных клеток в опухоль имеет промежуточные этапы, диагностировать которые можно с помощью морфологических методов (изучения структуры тканей и клеток). Выявление предраковых заболеваний позволяет врачам выделять людей с повышенным риском возникновения рака, проводить систематическое наблюдение за ними и вовремя начинать противораковое лечение.
Выделяют четыре последовательные фазы развития рака:
I — факультативные предраковые заболевания;
II — облигатные предраковые заболевания;
III — прединвазивный рак или carcinoma in situ;
IV — ранний инвазивный рак.
Факультативные предраковые заболевания:
К факультативным предраковым состояниям можно отнести различные хронические болезни, сопровождающиеся атрофическими и дистрофическими изменениями ткани, а также нарушением восстановительных механизмов клеток. Это приводит к возникновению очагов чрезмерного деления клеток, среди которых возможен опухолевый рост. Факультативный предрак переходит в злокачественное новообразование относительно редко
Облигатные предраковые заболевания:
Облигатные предраковые заболевания чаще обусловлены врожденными или генетическими факторами и со временем перерождаются в рак. К ним относят дисплазию тканей и органов, которая сопровождается неполным развитием стволовых клеток ткани, нарушением равновесия между процессами размножения и созревания клеток. В большинстве органов дисплазия развивается на фоне предшествующего увеличения количества клеток (гиперплазии), связанного с хроническим воспалением.
Существует три степени дисплазии:
1)слабо выраженная (I степень),
2)умеренно выраженная (II степень)
Определяющий критерий степени дисплазии – выраженность атипии (изменения структуры) клеток. Со временем дисплазия может развиваться в различных направлениях – прогрессировать или, наоборот, регрессировать. Чем больше выражена дисплазия, тем меньше вероятность ее обратного развития и восстановления нормального строения ткани. Облигатные предраковые процессы требуют обязательного наблюдения у онколога и проведения комплекса мероприятий, направленных на предотвращение рака
Прединвазивный рак:
Прединвазивный рак («рак на месте») представляет собой раковый процесс, ограниченный только эпителиальным пластом при сохранении целостности базальной мембраны. Это скопление измененных клеток, которые не проникают в подлежащую ткань. Подтверждение диагноза прединвазивного рака основано на тщательном изучении пораженной ткани (гистологическом исследовании). Эта фаза может длиться довольно долго – до 10 лет и более. Моментом, определяющим формирование злокачественной опухоли из прединвазивного рака, является инвазивный (проникающий в другие ткани) рост новообразования.
Ранний инвазионный рак:
Микрокарцинома или ранний инвазивный рак – это злокачественная эпителиальная опухоль, которая прорастает за пределы базальной мембраны, но не более чем на 3 мм, не имеет метастазов. На этой фазе опухоль хорошо поддается лечению и имеет благоприятный прогноз (высокий уровень 5-летней выживаемости). При раннем инвазивном раке, как правило, показано хирургического лечения без дополнительного использования лучевой или химиотерапии.
Профилактика рака молочной железы у носителей мутаций генов BRCA 1 или BRCA 2:
В клинической генетике существует несколько подходов для наблюдения носителей мутаций генов BRCA I или BRCA 2. Они различны для больных и клинически здоровых пациентов из группы риска. При наблюдении больных — носителей патологического BRCA l/2-генотипа на первый план выходят вопросы: отличается ли клинико-морфологическая патология опухолей отягощенных пациентов, каковы оценки их выживаемости, какова чувствительность больных — носителей мутаций генов BRCA 1/2 к лучевой и химиотерапии, какие скрининговые методы должны использоваться для выявления вторых первичных опухолей, нужно ли проводить таким пациентам профилактические операции и какова их эффективность?
Для практически здоровых носителей мутаций наиболее актуальным является раннее выявление заболевания посредством скрининговых программ, изменение стиля жизни, химиопрофилактика и клинико-хирургические профилактические методы.
Доказано, что во всех развитых странах маммографический скрининг снижает смертность от рака молочной железы на 20%. Существует общая практика проведения ежегодного маммографического обследования в возрасте 35—50 лет женщинам — носительницам терминальных мутаций BRCA l/2-генов . Многие клиники продолжают настаивать на ежегодной маммографии до 70 лет. Если в семье есть случаи рака молочной железы, возникшего до 30 лет, маммографический скрининг следует начинать в 30 лет, однако нельзя забывать о возможности возникновения индуцированных облучением опухолей. Альтернативным скрининговым методом для наблюдения здоровых носителей мутаций BRCA 1 или BRCA 2 и женщин с неизвестным мутантным статусом из отягощенных семей является ядерно-магнитный резонанс молочных желез. Этот метод признан более чувствительным и безопасным.
Защитный эффект родов:
У женщин, имевших поздние первые роды в возрасте более 30 лет или не имевших родов, риск заболеть РМЖ в 2— 3 раза выше, чем у рожавших до 20 лет.
Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска. Риск заболеть раком молочной железы в возрасте до 40 лет в 5,3 раза выше у женщин, рожавших в возрасте более 30 лет, чем у рожавших до 20 лет.
Ранние роды не оказывают защитного действия у женщин, имеющих мутации BRCA I или BRCA 2. Рожавшие женщины — носительницы мутаций BRCA 1 или BRCA 2 существенно чаще (в 1,71 раза) заболевают раком молочной железы в возрасте до 40 лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска заболеть раком молочной железы в возрасте до 40 лет.
Применение тамоксифена:
Профилактическое применение тамоксифена в группах риска широко обсуждается. В основу предлагаемой на сегодняшний день гормонотерапии положены факты, свидетельствующие о том, что применение тамоксифена в 90 % случаев подавляет опухолевый рост при раке молочной железы. Это позволило предположить, что применение тамоксифена возможно и с профилактической целью. Подробное изучение механизма действия препарата выявило, что тамоксифен блокирует G1-фазу клеточного цикла и подавляет деление опухолевых клеток.
С 1980 г. были проведены большие клинические рандомизированные исследования по определению эффективности профилактического применения тамоксифена у женщин с высоким риском развития ракамолочной железы. Наиболее полные исследования были выполнены в 1986 г. в. Подобные исследования начаты в 1992 г. группой Европейского института онкологии в Италии. Обобщенные результаты этих исследовательских групп были опубликованы в 1998 г.
Рандомизированное исследование включало 13 388 женщин, разделенных на группы, принимающих тамоксифен и плацебо в дозе 20 мг вдень в течение 5 лет.
Участницы исследования были отобраны в связи с наличием факторов высокого риска развития рака молочной железы, который рассчитывался по алгоритму, учитывая возраст, число родственниц 1 степени родства, страдающих раком молочной железы, отсутствие родов в анамнезе или возраст первых родов, число биопсийных исследований ткани молочной железы.
Лечение рака груди:
Основными методами лечения рака молочной железы являются:
хирургическое удаление опухоли;
Хирургическое лечение:
Этот метод является основным и наиболее эффективным. Проводится частичное или полное удаление молочной железы.
Лампэктомия применяется для удаления пораженного небольшой опухолью (не более 4 см) участка молочной железы. При этом вместе с опухолью удаляются здоровые участки близлежащих тканей. После удаления проводится курс облучения или химиотерапии для уничтожения оставшихся раковых клеток и предотвращения повторного образования опухоли.
Если поражены лимфатические узлы, то производят их удаление. При неинвазивных формах рака узлы стараются сохранить, так как после их удаления у женщины развивается отек рук, ограничение движения в плечевом суставе, боли в груди.
Чтобы определить точно, поражены раком лимфоузлы или нет, во время операции обязательно проводится так называемая «биопсия сторожевого узла». Для этого вырезается один из подмышечных лимфатических узлов, обследуется на наличие в нем раковых клеток. Если они не обнаружены, остальные лимфоузлы сохраняются. Если же раковые клетки в лимфоузле обнаруживаются, это является свидетельством высокого риска распространения заболевания в другие органы и участки тела.
Обязательно проводится исследование удаленной ткани гистологическим методом для подтверждения раковой природы новообразования.
Секторальная резекция проводится в том случае, когда уплотнение небольшое (размер опухоли обычно 1-2 см) и не распространяется за пределы молочной железы. Делается надрез, пораженный участок удаляется, накладывается внутрикожный шов.
Центральная резекция применяется при множественных внутрипротоковых папилломах. Разрез проходит через все млечные протоки, вырезается здоровая ткань на 2-3 см вокруг опухоли. После такой операции впоследствии женщина не сможет кормить ребенка грудью.
Резекция соска проводится для диагностики рака соска и ареолы вокруг него. При этом затрагивается часть млечных протоков. После заживления в будущем могут возникнуть осложнения с лактацией.
Онкопластическая резекция — это операция частичного удаления пораженной ткани и ближайших к ней здоровых участков с одновременной пластической операцией по восстановлению формы груди. Используется пересадка здоровых тканей, причем, нередко приходится оперировать и вторую грудь для восстановления симметрии сосков и идентичной формы молочных желез. После такой операции обязательно проводится лучевая терапия.
Мастэктомия. Удаляется молочная железа полностью, но лимфатические узлы не затрагиваются. Такая операция проводится при неинвазивных опухолях большого размера, наличии наследственной предрасположенности к раку груди, а также в профилактических целях. С помощью пластической операции можно восстановить железу.
Радикальная мастэктомия. Оперативное лечение рака молочной железы заключается в удалении не только ее самой, но и полном или частичном удалении соседних мышц и жировой ткани. Метод применяется при запущенных стадиях, когда множественные метастазы находятся в лимфатических узлах, пронизывающих эти ткани и мышцы. «Радикальное» удаление подразумевает полное избавление организма от раковых клеток и защиту от возникновения метастаз. Хирургическое удаление обязательно дополняется последующим радиолучевым и химиотерапевтическим лечением рака молочной железы.
Паллиативная мастэктомия. В том случае, когда метастазы уже появились или опухоль настолько обширна, что метастазы неизбежно должны появиться, проводятся операции, назначением которых является облегчение состояния пациентки. Опухоль устраняется частично для уменьшения площади поражения. При этом удаляются наиболее разрушенные или кровоточащие участки тканей. После этого применяется лекарственное лечение, помогающее снять боль, продлить жизнь.
Химиотерапия:
Лечение рака молочной железы с помощью лекарственных препаратов, убивающих раковые клетки. Лекарства назначаются строго индивидуально, так как выбор препарата зависит от многих факторов, среди которых тип опухоли, степень поражения, характер проведенной операции, орган, где была проведена операция.
Препараты химиотерапии являются сильнейшими аллергенами, вызывают тошноту и сильную рвоту. Они токсичны, влияют на работу сердца, печени, почек и других органов. Поэтому при выборе препаратов учитываются возраст и сопутствующие заболевания. Одновременно с приемом таких препаратов назначаются противоаллергические средства, которые должны приниматься заблаговременно.
Лечение можно проводить амбулаторно или в стационаре. Предпочтительнее проводить его в больнице под постоянным наблюдением врача. Здесь в случае появления рвоты больная может получить квалифицированную помощь, тогда как в домашних условиях ввести противорвотные средства, провести обезболивание в ночное время, как правило, труднее.
Обычно для излечения требуется 5-7 курсов химиотерапии. С учетом побочных действий и индивидуальной реакции организма проводится также лечение сопутствующих болезней, иначе провести курс полностью не удастся.
Гормонотерапия:
Большая часть (около 75%) всех видов злокачественных опухолей молочных желез являются гормонозависимыми. В их клетках имеются рецепторы, чувствительные к действию женских половых гормонов. Воздействуя на эти рецепторы, эстрогены и прогестероны ускоряют рост опухоли. Причем 10% из них чувствительны только к прогестерону, остальные зависят от гормонов обоих видов. Гормонозависимостью объясняется ускорение роста опухоли во время беременности или в разные фазы менструального цикла.
С помощью гормональных препаратов снижается уровень соответствующих гормонов, что приводит к уменьшению размеров опухоли или ее уничтожению. Эффективность гормонотерапии составляет от 10 до 70%.
Гормональная терапия назначается в тех случаях, когда у женщин имеется генетическая предрасположенность к раку молочной железы. Лечение проводится, если биопсия показала аномальный рост клеток какой-либо ткани при мастопатии. Это позволяет предотвратить их злокачественное перерождение.
Гормонотерапия применяется для уменьшения размеров большой опухоли перед проведением операции по ее удалению. Этот метод позволяет снизить риск повторного возникновения опухоли после операции, а также переход неинвазивной формы рака (карциномы) в инвазивную. Гормонотерапия, проведенная после комплексного оперативного, химиотерапевтического, радиолучевого лечения, позволяет защитить организм от распространения метастаз.
Лучевая терапия:
Метод радиоактивного облучения раковых опухолей позволяет на ранней стадии избавиться от них полностью, а на более поздних — существенно увеличить срок жизни пациенток. Особенно важную роль играет такое лечение при неполном удалении железы (органосохраняющих операциях).
Проводится облучение либо самой молочной железы со стороны опухоли, либо лимфатических узлов и мышц в области поражения. В зависимости от характера опухоли проводится наружное облучение или введение радиоактивного препарата в опухоль с помощью катетера.
Такое лечение рака груди не применяется при ряде заболеваний (сердечно-сосудистой недостаточности, анемии, сахарном диабете), а также не используется для лечения повторных опухолей из-за риска возникновения лучевой болезни. Использование современных методик позволяет избежать таких побочных действий, как тошнота и облысение, однако после лечения возможно появление лучевого дерматита, изъязвления кожи, а также болевых ощущений в груди, появления отека руки со стороны облучения, воспаления легкого.
Для наблюдения за ходом лечения рака молочной железы используются сцинтиграфия (рентген) костей грудной клетки и МРТ обследование. Курс облучения длится от 3-4 дней до 3-4 недель в зависимости от вида и стадии опухоли.
Таким образом, генетические подходы к ранней диагностике и профилактике рака молочной железы объединяют формально-генетические, цитогенетические, молекулярные и клинические методы, направленные на создание специализированного клинико-генетического регистра лиц — носителей патологического генотипа, организацию и координацию мониторинга за состоянием их здоровья, решение морально-этических и юридических проблем, связанных с доклинической диагностикой наследственной предрасположенности к развитию рака молочной железы, а также использование лекарственной и хирургической профилактики у таких лиц.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
В статье рассматривается проблема мастопатии и риска рака молочной железы (РМЖ) с позиции трех специалистов: акушера-гинеколога, гинеколога-эндокринолога и онколога.
Представлены данные об эпидемиологии мастопатии и РМЖ, популяционные риски развития РМЖ, причины, предрасполагающие к мастопатии, и факторы риска РМЖ. Обсуждаются понятия мастопатии и масталгии. Подробно описаны клиническая симптоматика, методы физикального осмотра пациенток с нераковыми заболеваниями молочных желез (МЖ), включающие пальпацию МЖ и регионарных лимфоузлов. Представлены правила маммологического скрининга, предложенные Международной ассоциацией специалистов репродуктивной медицины. Среди инструментальных методов диагностики используются маммография, УЗИ, пункции узловых образований и подозрительных участков и цитологическое исследование пунктата.
Особое внимание уделено нарушениям гормонального баланса, поскольку МЖ является не только органом-мишенью для большого количества гормонов (в первую очередь половых) и факторов роста, но и местом локального биосинтеза и метаболизма половых гормонов.
В статье объяснена важность морфологического исследования ткани МЖ у женщин с подозрением на РМЖ и приведены примеры гистологических картин предраковых состояний. Описаны механизмы действия патогенетической терапии с приведением в качестве примеров некоторых лекарственных препаратов.
Ключевые слова: мастопатия, рак молочной железы, постменопауза, гиперэстрогенемия, Мамоклам.
Для цитирования: Керчелаева С.Б., Сметник А.А., Беспалов В.Г. Мастопатия и профилактика рака молочной железы как междисциплинарная проблема // РМЖ. 2016. № 15. С. 1018–1025.
Для цитирования: Керчелаева С.Б., Сметник А.А., Беспалов В.Г. Мастопатия и профилактика рака молочной железы как междисциплинарная проблема // РМЖ. Мать и дитя. 2016. №15. С. 1018-1025
Mastopathy and breast cancer prevention as interdisciplinary problem
Kerchelaeva S.B. 1 , Smetnik A.A. 2 , Bespalov V.G. 3
1 Pirogov Russian National Research Medical University, Moscow
2 Scientific Center for Obstetrics, Gynecology and Perinatology named after academician V.I. Kulakov, Moscow
3 Research Institute of Oncology named after N.N. Petrov, St.-Petersburg
The paper addresses the problem of mastopathy and the risk of breast cancer (BC) from the position of three specialists: obstetrician and gynecologist, endocrinologist and oncologist.
The data on mastopathy and BC epidemiology; population risks for BC; causes, predisposing to mastopathy and BC, and risk factors for BA is provided. The concept of mastopathy and mastalgia is discussed. Clinical symptoms, methods of physical examination for non-cancerous (benign) breast conditions , including palpation of breast and regional lymph nodes, are provided. The paper presents breast screening program proposed by International Federation of Fertility Societies. Instrumental diagnostic methods include mammography, ultrasound, puncture of nodules and suspicious sites, punctate cytology.
Special attention is paid to hormonal imbalance, since breast is not just the target organ for a large number of hormones (especially sex hormones) and growth factors, but a local place for sex hormones’ biosynthesis and metabolism.
The paper explains the importance of morphological examination of breast tissue in women with suspected BC and gives examples of precancerous conditions’ histology. Mechanisms of action of pathogenic therapy are discussed with focus on some drugs.
Key words: mastopathy, breast cancer, postmenopause, hyperestrogenemia, Mamoklam.
For citation: Kerchelaeva S.B., Smetnik A.A., Bespalov V.G. Mastopathy and breast cancer prevention as interdisciplinary problem // RMJ. 2016. № 15. P. 1018–1025.
В статье освещена междисциплинарная проблема мастопатии и профилактики рака молочной железы

Диагностика нераковых заболеваний молочных желез – профилактика рака молочной железы
Профессор С.Б. Керчелаева
ГБОУ ВО «РНИМУ им. Н.И. Пирогова» МЗ РФ, Москва
Эпидемиология. Известно, что в разных странах популяционные риски развития РМЖ неодинаковы. В России в 2013 г. заболеваемость РМЖ составила 320 на 100 тыс. населения, т. е. примерно 0,008% женской популяции ежегодно. Из 741 пациентки, жительниц Ганы, обратившихся за маммологической помощью, масталгия была основным симптомом в 50,2% случаев. РМЖ был диагностирован у 7,8% пациенток, рецидивирующий рак – у 0,8% пациенток. В остальных случаях (около 88%) масталгия не была ассоциирована со злокачественной трансформацией тканей МЖ [1, 2]. В ходе изучения связи между циклической масталгией и РМЖ с участием 5463 женщин 28% (1529 пациенток) сообщили о боли в груди. При этом у 15,8% был диагностирован РМЖ [3]. Таким образом, надо понимать, что масталгия не является маркером раковой трансформации, но ее следует признать значимым фактором риска.
В общей популяции фиброзно-кистозная болезнь встречается у 60–80% женщин, причем пациентки репродуктивного возраста с гинекологическими заболеваниями в анамнезе обеспечивают самый высокий процент. Клинические проявления мастопатии не только ухудшают качество жизни пациенток, но и повышают риск развития РМЖ в десятки раз [4]. Со стороны акушеров-гинекологов незаслуженно мало внимания уделяется доброкачественным заболеваниям МЖ. Клинические симптомы мастопатии приравнивают к норме, хотя это, как правило, свидетельствует о патологическом процессе.
Несмотря на то, что МЖ относится к визуальным локализациям и легко доступна для исследования, РМЖ в 1 и 2 стадии диагностируется лишь у 57,6% пациенток, причем летальность на первом году жизни с момента установления диагноза составляет около 12,6% случаев. Больные с запущенными формами РМЖ составляют высокий процент наблюдений. Анализ причин запущенности заболевания показал, что в значительной степени запущенность связана с низкой медицинской культурой населения: 42% пациенток откладывали свой визит к врачу, мотивируя это занятостью, неблагоприятной ситуацией на работе, семейными обстоятельствами и т. д., у 10,9% пациенток причиной была боязнь идти к врачу, в 6,5% случаев женщины занимались самолечением, что приводило к резкому прогрессированию заболевания. Однако в 32,5% случаев запущенность заболевания лежит на совести врачей общей лечебной сети ввиду их низкой онкологической грамотности и отсутствия онкологической настороженности. У 51,7% больных от момента появления клинических признаков РМЖ до постановки диагноза проходило от 1 до 6 мес. [5].
В любом современном государстве основу профилактики составляют скрининговые программы, причисленные по значимости к государственным программам, а борьба с раковыми опухолями на мировом уровне включена в глобальные задачи человечества.
С 2009 г. на основании приказа № 808 МЗ РФ выявление и терапия заболеваний МЖ входят в сферу ответственности акушеров-гинекологов, тогда как ранее этими вопросами занимались исключительно маммологи и хирурги.
В 2012 г. Минздрав России издал новое руководство к действию – приказ № 572н, регламентирующий, как и приказ № 808, что медицинскую помощь женщинам с целью выявления заболеваний МЖ оказывает врач акушер-гинеколог. Кроме того, в действующем приказе в пункте 85 написано, что женщин с выраженными кистозными узловыми изменениями МЖ направляют в онкологический диспансер для верификации диагноза.
Анатомия и физиология. МЖ – это гормонозависимые органы, входящие в репродуктивную систему женщины, которые развиваются и начинают функционировать под влиянием целого комплекса гормонов: рилизинг-факторов гипоталамуса, гонадотропных гормонов гипофиза (фолликулостимулирующего и лютеинизирующего), хорионического гонадотропина, пролактина, тиреотропного гормона, кортикостероидов, инсулина, эстрогенов, прогестерона, андрогенов. МЖ в своем развитии проходят несколько этапов. После рождения МЖ представляют собой рудиментарные образования. В период полового созревания, когда у девочек начинают функционировать яичники, МЖ начинают увеличиваться в объеме, и с наступлением менструальной функции ткань МЖ подвергается ежемесячным циклическим изменениям в соответствии с фазами менструального цикла. С прекращением менструальной функции ткань МЖ подвергается инволютивным изменениям, а именно жировому перерождению. Паренхима МЖ представлена сложными альвеолотрубчатыми железами, собранными в мелкие дольки, из которых формируются крупные доли. В МЖ имеется от 6 до 24 долей. Каждая из них имеет свой выводной проток, некоторые протоки могут сливаться перед выходом на поверхность соска.
Кровоснабжение МЖ осуществляется за счет внутренней грудной и подмышечной артерий и ветвей межреберных артерий. Вены МЖ сопровождают артерии и широко анастамозируют с венами окружающих областей.
С онкологических позиций большое значение имеет строение лимфатической системы МЖ. Выделяют внутриорганную и внеорганную лимфатическую систему МЖ. Различают следующие пути оттока лимфы от МЖ: подмышечный, подключичный, парастернальный, ретростернальный, межреберный, перекрестный и путь Героты.
Патогенез. По определению ВОЗ, мастопатия – это фиброзно-кистозная болезнь с нарушением соотношения эпителиального и соединительнотканного компонента, с разнообразными пролиферативными и регрессивными изменениями в тканях МЖ. У термина «мастопатия» имеется множество синонимов, наиболее часто используют такие как «фиброзно-кистозная болезнь», «доброкачественная дисплазия молочных желез», однако обобщающим считают термин «нераковые заболевания молочных желез».
В России для диагностики нераковых заболеваний МЖ применяют клинико-рентгенологическую классификацию мастопатии Н.И. Рожковой [6], согласно которой выделяют 5 форм диффузной мастопатии:
с преобладанием:
– железистого компонента;
– фиброзного компонента;
– кистозного компонента;
– смешанную форму диффузной фиброзно-кистозной мастопатии;
– склерозирующий аденоз.
Кроме того, по результатам биопсии устанавливают диагноз в соответствии с гистологической классификацией опухолей МЖ (ВОЗ, 1995).
Различают морфологически непролиферативную и пролиферативную формы доброкачественной дисплазии. При этом риск малигнизации при непролиферативной форме составляет 0,86%, при умеренной пролиферации – 2,34%, при резко выраженной пролиферации – 31,4% наблюдений. По данным гистологических исследований операционного материала, РМЖ сочетается с фиброзно-кистозной болезнью в 46% случаев [7].
Отмечается четкая связь между заболеваемостью РМЖ и детородной функцией. Женщина, родившая впервые в 18 лет, имеет втрое меньший риск заболеть РМЖ, чем впервые родившая в 35 лет. Ранняя первая беременность способствует резкому увеличению продукции одного из 3–х эстрогенов – эстриола, который является продуктом метаболизма эстрадиола и эстрона и тормозит канцерогенное воздействие последних. С другой стороны, поздние роды (после 30–40 лет) приводят к резкому повышению уровня эстрадиола, что может способствовать развитию РМЖ. Также к причинам, предрасполагающим к мастопатии, относят следующие факторы: неблагоприятный репродуктивный анамнез, гинекологические заболевания, гиперпролактинемию, факторы сексуального характера, эндокринные нарушения, повседневные фрустрирующие ситуации, заболевания печени, генетическую отягощенность [8]. Чрезвычайно важными являются факторы риска РМЖ: выделения из соска вне лактации, обнаружение мутации генов семейства BRCA в крови, в перименопаузальном периоде – наличие уплотнения ткани молочной железы по результатам маммографического скрининга.
Из вышеизложенного следует, что в противораковой борьбе большое значение имеют своевременное выявление и лечение нераковых заболеваний МЖ.
Диагностика заболеваний молочной железы основывается на осмотре МЖ, их пальпации, что должно проводиться с особой тщательностью и онкологической настороженностью. Физикальное обследование включает пальпацию МЖ, регионарных лимфоузлов (подключичных, надключичных, подмышечных).
Из дополнительных методов используются маммография, УЗИ, пункции узловых образований и подозрительных участков и цитологическое исследование пунктата. Кроме того, необходимо руководствоваться приказом № 572н, который регламентирует обязательное скрининговое обследование женщин старше 35 лет.
Международная ассоциация специалистов репродуктивной медицины, Российская ассоциация маммологов предложила Правила маммологического скрининга для акушера-гинеколога: каждую женщину моложе 35 лет необходимо опрашивать для выявления прогностических факторов РМЖ (разница между ростом в сантиметрах и массой тела в килограммах более 110, возраст начала менструации – до 13 лет, гинекологические заболевания в анамнезе (миома матки, полип матки, эндометриоз, кисты яичников, дисфункция яичников, бесплодие и др.), отсутствие родов, первые роды в возрасте старше 30 лет, стрессовые ситуации, ушибы, маститы, операции на МЖ, онкологические заболевания у близких родственников). Мануальное обследование проводить всем; при наличии факторов риска РМЖ, но при отсутствии изменений молочных желез направлять на УЗИ. При наличии пальпаторных изменений направлять не только на УЗИ, но и на маммографию.
Каждую женщину старше 35 лет направлять на маммографию с периодичностью 1 раз в 2 года при отсутствии изменений. При наличии рака в семье – направлять на ДНК-исследование крови с целью выявления мутаций генов BRCA-1 и -2. При обнаружении мутаций направлять на консультацию онколога для выработки плана наблюдения или лечения.
Главная цель первичных диагностических мероприятий – определить характер процесса. При обнаружении узлового очага пациентку нужно направить к рентгеномаммологу, который выполнит биопсию с цитологическим и гистологическим исследованием пунктата. С учетом результата пациентка будет направлена к маммологу-онкологу, который будет заниматься ее лечением. При диффузном процессе пациенткой должен заниматься акушер-гинеколог, который проведет полное обследование, в т. ч. и гормонального статуса, для дальнейшего консервативного лечения и мониторинга. При обнаружении галактореи (вне беременности и лактации) необходимо определить концентрацию гормона пролактина и тиреотропного гормона, а также взять отпечаток-мазок отделяемого для цитологического исследования. В зависимости от его результатов решается вопрос о дальнейшем ведении пациентки. Гиперпролактинемия – одна из причин эстроген-прогестеронового дисбаланса, именно пролактин стимулирует рост числа эстрогеновых рецепторов в тканях МЖ, повышает чувствительность клеток к действию эстрадиола и ускоряет пролиферацию эпителиальных клеток.
Профилактика заболеваний молочной железы. Основная задача акушера-гинеколога – вести среди женского населения пропаганду против абортов, проводить своевременное лечение воспалительных заболеваний органов малого таза, коррекцию нарушений менструального цикла на всех этапах жизни женщины, коррекцию хронической ановуляции, лечение эндометриоза, миомы матки, полипов матки, опухоли яичников. Перечисленные состояния характеризуются гормональным дисбалансом и дефицитом прогестерона, все это приводит к отеку и гипертрофии внутридольковой соединительной ткани, пролиферации протокового эпителия, что является причиной обтурации протоков и образования кист. Гиперэстрогенизм вследствие недостаточной лютеиновой фазы цикла обусловливает развитие дисгормональных дисплазий МЖ у женщин репродуктивного возраста.
Негормональная базовая терапия диффузной формы нераковых заболеваний МЖ включает: коррекцию диеты, психологическую коррекцию, нормализацию функционального состояния печени, желудочно-кишечного тракта, использование мочегонных средств, препаратов, улучшающих кровоснабжение, использование арсенала фитотерапии.
Многие специалисты сегодня задаются вопросом: есть ли возможности прогнозирования РМЖ? На основании исследовательских работ результаты экспериментов показали, что большая часть канцерогенного влияния эстрогенов связана с образованием агонистических метаболитов эстрогенов, преимущественно 16-гидроксиэстрогена (16-ОНЕı). Другие метаболиты, такие как 2-гидроксиэстрон (2-ОНЕı) и 2-гидроксиэстрадиол, обеспечивают протективное действие, выступая как антагонисты 16-гидроксиэстрогена [9, 10]. Установлено, что при нормальном соотношении стероидных гормонов в организме женщины концентрация метаболита 2-ОНЕı превышает концентрацию 16-ОНЕı не менее чем в 2 раза. Уменьшение этого соотношения признано фактором риска РМЖ. Таким образом, соотношение 2-ОНЕı к 16-ОНЕı менее 2,0 можно считать адекватным универсальным биомаркером и надежным диагностическим критерием для определения риска и прогноза развития эстрогензависимых опухолей [8, 11].
Заключение. Долгое время считали, что мастопатия – это не заболевание, поскольку очаги фиброза и кисты в МЖ очень распространены, а потому не требуют лечения. Однако сегодня, изучая данную проблему, мы пришли к выводу, что указанные изменения нельзя считать вариантом нормы. Сегодня нераковые заболевания МЖ следует рассматривать как маркер гормонального и тканевого неблагополучия МЖ, а также как фактор онкологической настороженности. Нераковые заболевания МЖ необходимо активно выявлять и лечить, тем самым обеспечить женщине приемлемое качество жизни и проведение онкопрофилактики.
Риск рака молочной железы и половые гормоны
К.м.н. А.А. Сметник
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» МЗ РФ, Москва
Молочная железа является органом-мишенью для большого количества гормонов и факторов роста, среди которых одну из ведущих ролей играют половые гормоны и экспрессия соответствующих рецепторов [12].
Клетки МЖ, экспрессирующие эстрогеновые рецепторы (ЭР), пролиферируют медленно, в отличие от ЭР-негативных клеток, которые митотически активны. Пролиферация здорового эпителия, не содержащего ЭР или прогестероновые рецепторы (ПР), происходит за счет паракринных эффектов от рядом расположенных покоящихся ЭР-позитивных клеток. В отличие от этого в опухолевых рецептор-позитивных клетках митозы регулируются аутокринными механизмами. В менструальном цикле в МЖ происходят последовательные волнообразные процессы пролиферации и апоптоза. Эндогенный прогестерон в синергизме с эстрадиолом способны стимулировать процессы пролиферации и апоптоза в МЖ, васкуляризацию, выработку протеогликанов, аккумуляцию жидкости в ткани МЖ, что приводит к субъективным ощущениям нагрубания МЖ и повышению маммографической плотности в лютеиновую фазу менструального цикла [13]. Именно в лютеиновую фазу в МЖ наблюдается максимальная частота митозов [14].
МЖ является местом локального биосинтеза и метаболизма половых гормонов. К ферментам, участвующим в локальном синтезе и метаболизме эстрогенов, относятся ароматаза (переход андрогенов в эстрогены), сульфатаза (переход неактивных сульфатных форм эстрогенов в активные), 17-дигидрогеназа I и II (из эстрона в эстрадиол и наоборот), сульфотрансфераза (образование сульфатных форм) [15]. Возможно, высокая распространенность гормонально зависимого рака в период низкой продукции половых гормонов яичниками (в постменопаузе) обусловлена отчасти ролью данных ферментных систем. Активность эстронсульфатазы в опухолевой ткани МЖ в 10–500 раз выше активности ароматазы. Также важную роль играют гидроксиметаболиты эстрогенов и ряд метаболитов прогестерона, которые оказывают пролиферативные либо антипролиферативные эффекты [16].
Клинические и экспериментальные данные о роли гормонов в развитии мастопатии зачастую противоречивы. Тем не менее, мастопатия является гормонозависимым заболеванием, обусловленным дисбалансом в гипоталамо-гипофизарно-яичниковой системе.
Если говорить о развитии РМЖ, то переход в гормонозависимой регуляции с паракринного на аутокринный механизм – важная часть опухолевого процесса [12, 17]. Андрогеновые рецепторы присутствуют в 70–80% случаев РМЖ (экспрессируются чаще, чем ЭР или ПР). В случае коэкспрессии андрогеновых рецепторов при ЭР-позитивных раках прогноз обычно лучше. Однако при ЭР-негативном раке андрогеновые рецепторы часто служат компенсаторным механизмом для роста опухоли [18]. Факторы риска РМЖ приведены в таблице 1 [19].
На приеме гинеколога-эндокринолога одним из самых частых вопросов со стороны пациенток является вопрос о возможности назначения им, в зависимости от возраста, комбинированных оральных контрацептивов (КОК) или менопаузальной гормонотерапии (МГТ). Врачу же приходится оценивать безопасность гормональной терапии в каждом конкретном случае, в т. ч. с позиций возможного влияния на риск РМЖ. Общепринятым является положение о том, что изменения синтеза и метаболизма эстрогенов и прогестерона имеют фундаментальное значение для риска развития РМЖ [21].
В случае сочетания мастопатии с гинекологическими заболеваниями, требующими гормональной коррекции, назначение последней возможно.
Метаанализ 13 проспективных когортных исследований КОК не выявил значимого повышения риска РМЖ. Однако различные типы гестагенов в составе КОК также по-разному влияют на различные прогестероновые рецепторы [22]. Например, согласно данным Ruan X. et al. (2012), следующие гестагены, входящие в состав КОК, повышали пролиферацию в культуре клеток РМЖ (MCF-7) при высоких концентрациях: дроспиренон, левоноргестрел, дезогестрел. В отличие от этого, пролиферативный эффект отсутствовал в случае хлормадинона ацетата и номегестрола ацетата [23].
В постменопаузе в опухолевой ткани МЖ концентрация локального эстрадиола в 20–50 раз выше, чем в плазме (результат локальной конверсии из андрогенов, эстрона и эстрона сульфата). При этом не наблюдаются значимые различия в концентрациях эстрадиола: в крови при РМЖ и в норме; в самой МЖ при раке в репродуктивном возрасте и постменопаузе; локально при РМЖ в постменопаузе на фоне приема МГТ и без МГТ. Таким образом, опухолевая концентрация эстрадиола не зависит от уровня в плазме [24].
Согласно рекомендациям Всемирной ассоциации по менопаузе (International Menopause Society) от 2016 г., возможное повышение риска РМЖ, связанное с МГТ, невелико и оценивается менее чем в 0,1% в год, или менее 1,0 случая на 1000 женщин на год использования [25]. Этот уровень схож или ниже, чем повышение риска, связанное с такими частыми факторами образа жизни, как сниженная физическая активность, ожирение и употребление алкоголя. Данные, полученные в исследовании WHI (Women’s Health Initiative – «Инициатива во имя здоровья женщин»), не показали повышения риска РМЖ у женщин, впервые применяющих МГТ в течение 5–7 лет после начала терапии [20]. Исследование WHI также показало, что монотерапия конъюгированными эквин-эстрогенами в течение 7,1 года снижала риск диагностирования РМЖ и смертности у женщин с удаленной маткой [26].
В 3-х исследованиях было высказано предположение, что микронизированный прогестерон или дидрогестерон могут быть связаны с более низким риском, чем синтетический прогестаген [27–29]. Доступные в настоящее время данные не позволяют предположить различия в риске между пероральным и трансдермальным путями применения эстрадиола [30]. Тем не менее в настоящее время недостаточно данных клинических исследований адекватной мощности для полной оценки возможной разницы в частоте развития РМЖ при использовании разных типов, доз и путей введения эстрогенов, типа прогестагена и применения андрогенов.
На сегодняшний день в мировую практику лечения расстройств, связанных с менопаузой, активно внедряется комбинация селективного модулятора эстрогеновых рецепторов – базедоксифена (который блокирует эстрогеновые рецепторы в МЖ и эндометрии) и конъюгированных эквин-эстрогенов [31]. Данный препарат способствует уменьшению плотности МЖ, но требуются дополнительные данные для подтверждения ее влияния на заболеваемость РМЖ [32].
Таким образом, можно сделать вывод, что с точки зрения любого увеличения риска РМЖ более значим именно прогестагенный компонент МГТ и КОК, а не эстроген. Риск может быть ниже при применении микронизированного прогестерона или дидрогестерона, чем при использовании синтетического прогестагена в составе МГТ. Риск РМЖ, связанный с применением МГТ, невелик, зависит от ее длительности и неуклонно снижается после ее прекращения. Имеющихся в настоящее время данных о безопасности недостаточно для поддержки назначения МГТ женщинам, перенесшим РМЖ. До назначения МГТ следует оценить соответствующий риск. Возможное увеличение риска РМЖ, связанное с МГТ, может быть частично снижено путем отбора женщин с исходно более низким индивидуальным риском, включая низкую плотность МЖ, а также путем образования по вопросам превентивных мер, направленных на коррекцию образа жизни (снижение массы тела, приема алкоголя и увеличение физической активности). У женщин, принимающих МГТ, следует проводить ежегодную маммографию [25]. Современные прогестагены, натуральный прогестерон и селективный модулятор эстрогеновых рецепторов оптимизируют влияние гормонотерапии на МЖ. Эти данные следует учитывать гинекологам-эндокринологам при ведении пациенток с мастопатией.
Мастопатия как фактор риска РМЖ: вопросы этиопатогенеза и лечения
Д.м.н. В.Г. Беспалов
ФГБУ «НИИ онкологии им. Н.Н. Петрова» МЗ РФ, Санкт-Петербург
Мастопатия (фиброзно-кистозная болезнь) – распространенная патология, ее частота в женской популяции составляет до 50% [33]. В целом мастопатия не является предраком или стадией онкологического процесса в МЖ. Однако нельзя недооценивать роль мастопатии в развитии РМЖ. Рост заболеваемости РМЖ в XX в. во многих странах сопровождался параллельным ростом частоты мастопатии. В 2014 г. в России зарегистрировано 65 088 новых случаев РМЖ, 21,2% (1-е место) в структуре заболеваемости женщин раком; за 10 лет стандартизованный показатель заболеваемости вырос на 19,79%, рост на 1,78% в год [34]. При этом мастопатия имеется у 50–60% российских женщин [35]. Выделяют более 50 доброкачественных заболеваний МЖ или форм мастопатии, среди которых многие существенно повышают риск РМЖ.
Взаимосвязь этиологии и патогенеза мастопатии и РМЖ
Существует 4 группы доказательств связи мастопатии с РМЖ: 1) у мастопатии и РМЖ общие факторы риска; 2) патогенез мастопатии и РМЖ имеет общие черты, ключевую роль играет относительная или абсолютная хроническая гиперэстрогения; 3) при мастэктомии в связи с РМЖ в тканях МЖ часто обнаруживают морфологические проявления мастопатии и предраковые изменения; 4) у больных РМЖ чаще была предшествующая мастопатия [36].
РМЖ – полиэтиологическое заболевание, идентифицировано более 80 факторов риска РМЖ, которые можно разделить на 5 групп: половые и возрастные, генетические, репродуктивные, гормональные и обменные, внешней среды и стиля жизни. Мастопатия – также полиэтиологическое заболевание, а основные факторы риска РМЖ и мастопатии совпадают [37]. Если РМЖ в большинстве случаев развивается в постменопаузальном возрасте, то пик заболеваемости мастопатии приходится на возраст 30–50 лет, т. е. данная патология предшествует развитию РМЖ. Кровные родственники, больные РМЖ; носительство мутантных генов, отвечающих за репарацию ДНК и биосинтез половых гормонов, являются одновременно факторами риска и РМЖ, и мастопатии. Большинство репродуктивных факторов риска одинаковы для РМЖ и мастопатии: раннее менархе, низкая частота родов, поздние первые роды, отсутствие или короткий период грудного вскармливания, искусственные аборты, высокая рентгеновская плотность маммограмм в позднем репродуктивном возрасте. Гормональные и обменные факторы риска в большинстве одинаковы для РМЖ и мастопатии: гиперэстрогения, гиперпролактинемия, гипотиреоз; гиперпластические заболевания гениталий и гинекологические заболевания, связанные с нарушениями гормонального баланса; ожирение, сахарный диабет, болезни печени. Из факторов внешней среды и стиля жизни одинаковы для РМЖ и мастопатии нарушения питания в виде избытка жиров, калорий, животных белков, алкоголя, недостатка овощей и фруктов, пищевых волокон, витаминов и минералов; депрессия, нарушения сна, работа в ночные смены; сниженная физическая активность.
Мастопатию можно считать биомаркером гормонального неблагополучия на уровне организма и локального неблагополучия в ткани МЖ. Множественные факторы риска нарушают гормональный баланс в организме женщины, вызывают гиперэстрогению и гиперпролиферацию эпителия в ткани МЖ, что приводит к развитию мастопатии, а при наличии врожденных или приобретенных повреждений генов – РМЖ.
Риск РМЖ у больных мастопатией
Мастопатия является и самостоятельным фактором риска РМЖ. В эпидемиологических когортных исследованиях при сроках наблюдения за женщинами от 6 до 20 лет установлено, что относительный риск РМЖ (в сравнении с частотой РМЖ в общей популяции, с женщинами без мастопатии, с непролиферативной мастопатией) при мастопатии без пролиферации эпителия статистически недостоверно, но в некоторых исследованиях и статистически достоверно, повышается в 1,27–2,23 раза; при мастопатии с гиперплазией без атипии достоверно повышается в 1,53–3,58 раза; при мастопатии с атипичной гиперплазией достоверно повышается в 2,03–10,35 раза [38]. Dyrstad S.W. et al. провели метаанализ 32 эпидемиологических ретроспективных и проспективных исследований о связи мастопатии с риском РМЖ; относительный риск РМЖ при непролиферативных формах мастопатии статистически недостоверно повышался до 1,17, при пролиферативных формах без атипии – достоверно повышался до 1,76, при пролиферативных формах с атипией – до 3,93 [39].
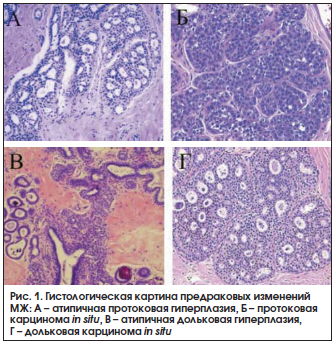
К предраковым изменениям МЖ относят протоковую атипичную гиперплазию и карциному in situ, дольковую атипичную гиперплазию и карциному in situ, склерозирующий аденоз, радиальный рубец [40]. Основные формы предрака МЖ приведены на рисунке 1.
В таблице 2 указывается степень риска РМЖ при мастопатии по данным R.J. Santen и R. Mansel [40].
Коллегия американских патологов рекомендовала подразделять женщин с мастопатией на 3 категории в зависимости от выявленных при биопсии МЖ морфологических изменений: 1) непролиферативная – риск РМЖ не повышен и равен популяционному; 2) пролиферативная без атипии – риск РМЖ повышен в 1,5–2 раза по сравнению с популяцией; 3) пролиферативная с атипией – риск РМЖ повышен в 4–5 раз по сравнению с популяцией [41]. При биопсии МЖ и морфологическом обследовании примерно у 5% женщин с мастопатией выявляется атипическая гиперплазия [42].
Лечение мастопатии и профилактика РМЖ
Стандартов лечения мастопатии на сегодняшний день нет. К общим недостаткам большинства применяемых сегодня средств можно отнести невысокую эффективность, побочное и токсическое действие, необходимость применения в виде комплекса с другими средствами, нацеленность только на облегчение патологической симптоматики, а не на более серьезную задачу – профилактику РМЖ. Поэтому актуальной является проблема создания специальных лекарственных средств для лечения мастопатии. С учетом характера данной патологии такие средства должны быть эффективными, безопасными, пригодными для длительного применения, направленными на профилактику РМЖ. Патогенетическое лечение мастопатии относят к первичной и вторичной профилактике РМЖ [43, 44].
В настоящее время для патогенетического лечения мастопатии существуют лишь единичные препараты. Например, лекарственный препарат Мамоклам, который производят из липидной фракции бурой морской водоросли Laminaria; действующими веществами Мамоклама являются органический йод, полиненасыщенные жирные кислоты омега-3 типа, хлорофилл. Мамоклам разрешен для медицинского применения в качестве лекарственного средства для лечения мастопатии. В эпидемиологических исследованиях показано, что все 3 действующих вещества Мамоклама снижают риск развития РМЖ. В клинических исследованиях доказано, что Мамоклам вызывает регрессию масталгии, ослабляет предменструальное нагрубание МЖ, вызывает регрессию уплотнений и кист в МЖ, снижает маммографическую плотность, нормализует процессы пролиферации эпителия МЖ, нормализует менструальный цикл и баланс тиреоидных и половых гормонов [45–47].
Патогенетическое лечение мастопатии должно быть направлено на нормализацию гормонального баланса в организме женщины, прежде всего баланса половых гормонов; на уменьшение гиперэстрогении как на системном уровне, так и на уровне рецепторного аппарата клеток в ткани МЖ; на подавление процессов гиперпролиферации железистого эпителия МЖ. Основным действующим веществом Мамоклама является йод в органически связанной форме (в составе аминокислот). При поступлении в организм в дозах, превышающих суточную потребность, йод накапливается в тканях МЖ и оказывает прямое действие на патогенетические пути развития мастопатии: подавляет пролиферацию эпителия, индуцирует апоптоз и дифференцировку клеток, снижает чувствительность ткани МЖ к эстрогенам; в щитовидной железе формируются йодолипиды, которые оказывают антиоксидантное действие и контролируют клеточную пролиферацию в МЖ; йод также опосредованно влияет на состояние МЖ, нормализуя баланс тиреоидных и половых гормонов, уменьшая местную гиперэстрогению в тканях МЖ [48–50]. Показано, что при лечении мастопатии йодом в дозах, превышающих суточную потребность, нормализуется архитектоника тканей МЖ [51]. Длительный прием йода в дозах, превышающих суточную потребность, возможен только для органического йода, который содержится в Мамокламе. Другой компонент Мамоклама – полиненасыщенные жирные кислоты омега-3 типа также влияют на патогенетические пути развития мастопатии: формируют структуру и определяют вязкость клеточных мембран, регулируют клеточные сигналы, нормализуют баланс эстрогенов, в результате чего уменьшают гиперэстрогению и ослабляют пролиферацию клеток в ткани МЖ [52].
Выводы
1. К группе повышенного онкологического риска женщины, страдающие мастопатией, могут быть отнесены после оценки всех индивидуальных факторов риска и морфологического анализа тканей МЖ.
2. Решающим в оценке степени риска развития РМЖ у больных мастопатией является морфологическое исследование ткани МЖ, полученной при биопсии. Риск РМЖ не повышается или является минимальным при непролиферативных формах мастопатии, при пролиферативной форме без атипии риск возрастает в 2 раза, при пролиферативной с атипией – в 4 раза и достигает наиболее высоких цифр (до 12 раз) при протоковой или дольковой карциноме in situ.
3. Своевременная диагностика и патогенетическое лечение мастопатии не только улучшают качество жизни, но и должны быть направлены на профилактику РМЖ. Мамоклам – эффективный и безопасный лекарственный препарат для патогенетического лечения мастопатии, при длительном применении Мамоклам снижает риск РМЖ.
источник