Среди огромного количества молекулярно-биологических исследований, относящихся к прогнозированию РМЖ и поиску факторов, предсказывающих чувствительность опухоли к различным способам лечения, необходимо выделить появление молекулярно-генетической классификации РМЖ. К ее достоинствам следует отнести интегральную оценку огромного количества молекулярно-биологических характеристик опухоли, как известных ранее, так и новых. Итак, C.M.Perou и соавт. (Perou C.M., Sorlie T., Eisen M.B., et al. Molecular portraits of human breast tumours. Nature. 2000, 406, 747–752.), T. Sorlie и соавт. (Sorlie T., Perou C.M., Tibshirani R., et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001, 98, 10869–10874.) представили классификацию РМЖ, основанную на вариациях набора экспрессируемых генов и корреляции генетических характеристик опухоли с отдаленными результатами.
Все опухоли были разделены на две большие группы.
- Первая включала 3 подгруппы, опухоли каждой из них характеризовались низкой экспрессией (или отсутствием экспрессии) рецепторов эстрогенов (РЭ) и некоторых дополнительных транскрипционных факторов, экспрессируемых РЭ+ опухолями. 1a. Опухоли подобные базальному эпителию молочной железы. Характеризуются высокой экспрессией кератинов 5 и 17, ламинина, протеина 7, связывающего жирные кислоты. 1b. Подгруппа ERBB2+ (HER2 +). Опухоли с высокой экспрессией некоторых генов 17q22.24, включая ERBB2 (HER2 +) и GRB7. 1c. Опухоли подобные нормальным клеткам молочной железы. Имеют самую выраженную экспрессию многих генов, известных для жировой ткани и клеток других неэпителиальных тканей. Эти опухоли демонстрировали также выраженную экспрессию генов базального эпителия и низкую экспрессию генов люминального эпителия.
- Вторая группа опухолей описывается как опухоли РЭ+, подобные люминальному эпителию. Группа так же делится на 3 подгруппы. 2a. Люминальный подтип А. Клетки демонстрируют высочайшую экспрессию гена РЭ ? и эстроген-регулируемого LIV-1. 2b. Люминальный подтип В. Клетки имеют умеренную или низкую экспрессию генов, специфичных для люминального типа, включая кластер РЭ. 2c. Люминальный подтип С. Клетки имеют те же характеристики, как и клетки люминального типа В, отличаются от последних высокой экспрессией генов, координирующая функция которых неизвестна и которые имеют сходные черты с генами, экспрессирующимися в опухолях, подобных базальному эпителию, и подтипе ERBB2+.
При анализе корреляции экспрессии генов с выживаемостью оказалось, что из 1753 генов влияние на выживаемость имеют 264. Больные с опухолями, подобными базальному эпителию, и с опухолями подтипа ERBB2+ имеют самую короткую длительность жизни. Люминальный подтип С характеризовался более низкой выживаемостью по сравнению с люминальными типами А и В.
Молекулярно-генетические исследования при РМЖ продолжают развиваться очень бурно, и классификация продолжает совершенствоваться. С практической точки зрения широко используется суррогатная классификация РМЖ, основанная на иммуногистохимическом исследовании рецепторов эстрогенов, рецепторов прогестерона (РП), рецепторов эпидермального фактора роста второго типа (HER2), показателя пролиферативной активности Ki67. Выделяются следующие группы опухолей:
- тройной негативный РМЖ (РЭ-РП-HER2-)
- негативный по гормональным рецепторам позитивный по HER2 (РЭ-РП-HER2+)
- позитивный по гормональным рецепторам позитивный по HER2 (РЭ+РП+HER2+)
- позитивный по гормональным рецепторам негативный по HER2 (РЭ+РП+HER2-)
- подобный люминальному А: с высокой экспрессией гормональных рецепторов, низкой пролиферативной активностью, низкой степенью злокачественности
- промежуточный
- подобный люминальному В: с низкой экспрессией гормональных рецепторов, высокой пролиферативной активностью, высокой степенью злокачественности.
источник
Биологическое поведение злокачественной опухоли, которое характеризует скорость ее роста, способность к инвазии и распространению, а, в конечном итоге, и прогноз заболевания, зависит от многих причин, связанных как с ее особенностями, так и с эффективностью или неэффективностью системных защитных механизмов, среди которых важное место занимают иммунные. По-видимому, свойства опухоли и реакции иммунной системы организма на нее тесно взаимосвязаны. С учетом значения иммунокомпетентных клеток в процессах апоптоза, пролиферации, неоангиогенеза (в частности, через продукцию цитокинов), их роль в микроокружении опухоли представляется существенной, однако, не полностью проясненной.
Рак молочной железы (РМЖ) является самой распространенной злокачественной опухолью среди женского населения планеты, и, несмотря на то, что его патогенезу, ранней диагностике и разработке новых методов лечения посвящено множество работ, продолжает оставаться актуальнейшей проблемой онкологии и медицины в целом.
Серьезный прорыв в изучении этого заболевания был сделан с появлением новых методов характеристики опухолевых клеток, в частности, иммуногистохимического (ИГХ)-типирования и ДНК-цитометрии. На основании их результатов были выделены молекулярно-биологические подтипы РМЖ и установлено, что они отличаются различным характером течения, по-разному поддаются химиотерапии и имеют неодинаковый прогноз. Молекулярно-генетическая классификация РМЖ, разработанная на основе иммуногистохимического определения четырех маркеров, была одобрена экспертами Сент-Галленской конференции в 2011 г и уточнена в 2013 г. Эти маркеры (рецепторы эстрогена, прогестерона, Her2+/neu, Кi-67) оцениваются в большинстве работ для решения вопроса о целесообразности назначения гормональной и химиотерапии [6, 7, 8]. Представляется возможной связь подтипов РМЖ с экспрессией опухолевыми клетками рецепторов, характеризующих апоптоз [1]. Согласно данным современной литературы, признаком агрессивного биологического поведения опухоли является анеуплоидия, при которой частота лимфогенного метастазирования различных опухолей существенно повышается; у больных с анеуплоидными опухолями выше частота рецидивов и короче продолжительность клинической ремиссии. ДНК-цитометрические характеристики опухолевых клеток могут прогнозировать их биологические свойства поведение опухоли в будущем [3, 4]. В немногочисленных сообщениях описана лимфоцитарная инфильтрация при РМЖ [2, 5], но не найдено работ, сопоставляющих молекулярно-биологические подтипы РМЖ с пролиферативными свойствами опухоли и особенностями ее лимфоцитарного микроокружения.
Целью работы является характеристика иммунологического микроокружения и пролиферативных свойств опухоли при различных молекулярно-биологических подтипах РМЖ.
Материалы и методы исследования
Материалом для исследования послужили кровь и ткани опухоли и перитуморальной зоны 49 пациенток различными молекулярно-биологическими подтипами РМЖ; у 16 (32,7 %) был определен люминальный А подтип, у 22 (44,9 %) – люминальный В, у 5 – Her2+/neu (10,2 %), у 6 – ТНР (12,2 %). Гомогенизацию тканей осуществляли с использованием BD Medimaсhine. Анализ экспрессии (не менее 20 000 клеток) проводили на проточном цитометре FACSCantoII (Becton Dickinson, USA). Для тестирования и подтверждения оптимальной работы проточного цитометра использовали универсальные биологические частицы DNA QC Particles (BD). Для анализа ДНК в ткани опухоли использовали CycleTESTTMPLUS DNA Reagent Kit. Полученные данные обрабатывали с помощью компьютерной программы ModFit LT, позволяющей анализировать плоидность и распределение клеток опухоли по фазам клеточного цикла и детализировать число клеток в фазах S и G2 + М. Долю клеток с различным содержанием ДНК на гистограмме вычисляли как процент от общего числа исследованных клеток. Опухоль считали диплоидной, если выявлялся один пик, который соответствовал нормальному содержанию ДНК в ядрах клеток. При наличии пиков, отличающихся от диплоидного, опухоль расценивалась как анеуплоидная. Для характеристики степени анеуплоидии клеток опухоли вычисляли индекс ДНК (ИДНК), который характеризует отношение интенсивности флуоресценции пика анеуплоидных клеток (номер канала) к диплоидному. Пролиферативную активность опухолевых клеток оценивали по индексу пролиферации (ИП) – сумме клеток, находящихся в синтетической, постсинтетической фазах цикла и в митозе (S+G2+M).
Популяционный и субпопуляционный состав лимфоцитов периферической крови, ткани опухоли и перитуморальной зоны (ПЗ) оценивали с использованием моноклональных антител панели Т-В-NK (CD3, CD4, CD8, CD19, CD16/56) и CD45. Доля лимфоцитов, положительных по данным маркерам, вычислялась в процентах от общего числа CD45-положительных лимфоцитов. В случае ткани исследовалось не менее 1000 тыс. событий, крови – не менее 30 тыс. событий.
Статистическую обработку результатов проводили параметрическими и непараметрическими методами (t-критерий Стьюдента, критерий Уилкоксона).
Результаты исследования и их обсуждение
Результаты исследования субпопуляций лимфоцитов в крови и в тканевых образцах представлены в табл. 1, 2. Как видно из табл. 1, ткань опухоли характеризовалась статистически достоверно более высоким содержанием Т-лимфоцитов, преимущественно за счет CD3+CD8+ клеток; при этом процент В- и NК-клеток в ней был ниже, чем в крови. В ткани ПЗ наблюдались отличия как от крови, так и от опухоли: в ней отмечено более высокое количество CD3+ и CD3+CD8+ клеток и более низкое CD19+ лимфоцитов, чем в крови; процент CD3+CD4+ лимфоцитов был ниже, а уровень CD3+CD16/56+ выше, чем в опухоли.
В табл. 2 приведено сопоставление субпопуляционного состава тканевых лимфоцитов больных при различных молекулярно-биологических подтипах РМЖ.
Субпопуляционный состав лимфоцитов в крови и в тканях больных РМЖ
источник
Автореферат и диссертация по медицине (14.01.12) на тему: Эффективность лечения различных биологических подтипов рака молочной железы
Автореферат диссертации по медицине на тему Эффективность лечения различных биологических подтипов рака молочной железы
ПЕНЬКОВ Константин Дмитриевич
ЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ РАЗЛИЧНЫХ БИОЛОГИЧЕСКИХ ПОДТИПОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в Федеральном государственном бюджетном учреждении «Научно-исследовательский институт онкологии им. H.H. Петрова» Минздрава России
Заслуженный деятель науки РФ, член-корреспондент РАМН, доктор медицинских наук, профессор
Семиглазов Владимир Федорович
Заслуженный деятель науки РФ, доктор медицинских наук, профессор ФГБУ «РНЦРХТ» Минздрава России, руководитель отделения радиохирургической гинекологии
Владимир Леонидович Винокуров
Адель Феттеховна Урманчеева
Ведущее научное учреждение: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Санкт-Петербургский Государственный Университет».
Защита диссертации состоится « » 2013 г. В _часов на
заседании диссертационного совета Д 208.052.01 при ФГБУ «НИИ онкологии им. H.H. Петрова» Минздрава России (197758, Санкт-Петербург, Песочный,ул. Ленинградская, д.68).
С диссертацией можно ознакомиться в библиотеке ознакомиться в библиотеке ФГБУ «НИИ онкологии им. Н.Н.Петрова» Минздрава России
Автореферат разослан «_»_2013 г.
диссертационного совета, д.м.н. Е.В. Бахидзе
Рак молочной железы (РМЖ) является самой частой опухолью у женщин, особенно
старше 50 лет. Ежегодно в мире регистрируется около 1 млн. 300 тыс. новых случаев рака молочной железы, что составляет 22% от всех злокачественных новообразований у женщин. (Мерабишвили В.М., 2003; Семиглазов В.В., 2009; Семиглазов В.Ф., 2008; Гарин A.M., 2010)
До 1990х годов наблюдался неуклонный рост заболеваемости раком молочной железы. В течение последних 10 лет отмечается более медленное нарастание заболеваемости и снижение смертности от РМЖ, в развитых странах, что обусловлено внедрением национальных программ скрининга и широким применением системного адъювантного лечения. В настоящее время в России ежегодно выявляется свыше 52 тысячи новых случаев РМЖ (Мерабишвили, 2003, 2007; Аксель Е.М., 2006; Давыдов М.И., 2008; Чиссов, 2009, 2010).
Свыше 30 лет назад В.Ф. Семиглазов (1980) на основании изучения клинико-эпидемиологических признаков и анализа уровней продукции эстрогенов, прогестерона и других биохимических показателей впервые в мире обосновал представление о патогенетическом многообразии РМЖ и существовании т.н. овариальной, надпочечниковой, инволютивной и других форм РМЖ, позже (через 10 лет) квалифицированного как открытие.
Прогресс молекулярной генетики, наблюдающийся в последние 5 лет и анализ «сигнатур» генной экспрессии позволил уточнить биологические характеристики этих опухолей и выделить ряд генетических подтипов: люминальные А и В, HER2-экспрессирующий, базально-подобный, нормо-подобный РМЖ. Однако, в клинической практике пока не представляется реальным проведение такого анализа с рутинной целью. Для решения этой проблемы М. Cheang предложил «суррогатную» методику определения различных биологических подтипов, которая основана на иммуногистохимической оценке экспрессии рецепторов эстрогенов (ER), прогестерона (PR), HER2 и маркера пролиферации Ki-67. По данной методике определены близкие по смыслу, но не аналогичные генетическому анализу (gene expression array) «биологические подтипы»: Люминальный А, Люминальный В (HER2- негативный), Люминальный В (HER2-позитивный), Erb-B2 сверхэкспрессирующий, трижды-негативный.
На основании ряда ретроспективных исследований и ИГХ пересмотра архивного патоморфологического материала (парафиновых блоков) высказано общее предположение о том, что прогноз заболевания и ответ на системную терапию и местное лечение может отличаться при различных биологических подтипах РМЖ.
Исходя из такого рода исследований, предполагается, что химиотерапия целесообразна при высокой степени злокачественности, высокой пролиферативной активности (Ki67>14%), отсутствии ER и PR, высокой экспрессии HER2. Остается неясным необходимость применения химиотерапии при лечении «люминального-А» и «люминального-В» (НЕЯ2-негативного) РМЖ. По мнению экспертов 12-й Международной конференции по раку молочной железы в Сан-Галлене «Люминальный А» подтип скорее всего является наименее чувствительным к химиотерапии. А при «Люминальном В» подтипе РМЖ в химиотерапевтические режимы включаются антрациклины, однако, целесообразность включения таксанов пока не обоснована. Это относится и к «трижды-негативному» РМЖ
Таким образом, остается актуальным дальнейшее углубленное изучение особенностей клинического течения, прогноза и чувствительности к отдельным видам системного лечения различных биологических подтипов РМЖ.
В конечном итоге это позволит подойти ближе к индивидуализации (персонализации) планирования как местного (хирургического), так и, в особенности, адъювантного системного лечения РМЖ с целью улучшить показатели выживаемости этих пациентов и качество их жизни, отказавших в ряде случаев от заведомо неэффективной цитотоксической химиотерапии.
Индивидуализация лечения рака молочной железы, основанная на выделении биологических подтипов заболевания
1. На основании ИГХ исследования опухолей больных РМЖ и оценки уровней экспрессии ER, PR и HER2 определить удельный вес различных подтипов рака молочной железы.
2. Изучить особенности клинического течения, частоты и сроков местных рецидивов, отдаленных метастазов, показателей общей и безрецидивной выживаемости при различных подтипах РМЖ.
3. Определить прогностическое значение объема хирургического вмешательства при различных биологических подтипах РМЖ
4. Определить эффективность адъювантной системной терапии при различных биологических подтипах РМЖ
5. Изучить эффективность различных видов неоадъювантного системного лечения при различных биологических подтипах РМЖ.
На основании анализа базы данных канцер-регистра отделения опухолей молочной железы, располагающего информацией более чем о 5000 больных РМЖ с 2000 по 2011 гг, впервые в Российской Федерации определены биологические подтипы заболевания с помощью иммуно-гистохимической оценки уровня экспрессии ER, PR, HER2 и определения степени гистологической злокачественности. Определено прогностическое и предсказывающее значение отдельных биологических подтипов РМЖ. Изучена эффективность адъювантной и неоадъювантной химио-эндокринотерапии и таргетной терапии в зависимости от биологической принадлежности РМЖ.
Научно-практическая значимость: Индивидуализация (персонализация) планирования лечения, основанная на более точных сведениях о прогностических и предсказывающих признаках позволяет улучшить отдаленные результаты лечения РМЖ, а также качество жизни этих больных.
Реализация результатов работы Результаты работы внедрены и используются в практической и научно-исследовательской работе ФГБУ «НИИ онкологии им. H.H. Петрова» Минздрава России. Положения, выносимые на защиту
1. Определение биологического подтипа РМЖ на основании ИГХ анализа и степени гистологической злокачественности позволяет улучшить прогнозирования заболевания.
2. Эффективность адъювантного системного лечения зависит от принадлежности опухолей к различным биологическим подтипам РМЖ.
3. Наиболее благоприятный прогноз наблюдается при люминальном-А РМЖ. Худший прогноз заболевания наблюдается у больных с трижды-негативным и HER2-сверхэкспрессирующим (нелюминальным) РМЖ
4. При проведении неоадъювантного (предоперационного) системного лечения достижение полного патоморфологического регресса (рСЯ) коррелирует с лучшими показателями выживаемости.
Объем и структура диссертации Диссертация состоит из введения, 4 глав, выводов, практических рекомендаций и списка литературы. Диссертационная работа изложена на 104 страницах машинописи, включает 11 таблиц и 26 рисунков. Список литературы состоит из 166 источника, в том числе 69 отечественных и 97 иностранных авторов.
Содержание работы Материалы и методы исследования
В работе проанализирована база данных Ракового регистра отделения опухолей молочной железы. База данных включает информацию о больных, получавших лечение в НИИ Онкологии им. H.H. Петрова с 2000 по 2011 годы. На 2012 год в базе данных зарегистрировано 5102 больных раком молочной железы. В базе данных содержится следующая информация: возраст на момент операции, мультифокальность или мультицентричность опухоли, гистологический тип, (c)TNM и (p)TNM стадии заболевания, степень гистологической злокачественности по Elston-Ellis, наличие инвазии лимфатических сосудов и выраженного внутрипротокового компонента (EIC), уровень экспрессии ER, PR, HER2, вид предоперационного системного лечения, размерах опухоли до и после неоадъювантного лечения определяемые клинически, маммографически и по данным ультразвукового исследования, объем хирургического лечения, степень патоморфологического регресса по Miller-Payne, вид адъювантного лечения, местно-регионарный рецидив [дата], отдаленные метастазы [дата, локализация], жизненный статус на протяжении 10-летнего периода наблюдения (жива, умерла, причины смерти).
Данные для расчета показателей безрецидивной и общей выживаемости больных были получены посредством приглашения больных на периодические обследования, информации из амбулаторных карт, прямых телефонных контактов с больными или их родственниками, а так же из базы данных льготных категорий населения, базы данных ЗАГС’ов и МВД Санкт-Петербурга.
Кроме периодического (один раз в шесть месяцев или ежегодного обследования) больные опрашивались о программе полученного лечения, проводимых контрольных осмотрах и обследованиях, датах появления метастазов и рецидивов, а так же лечении, получаемого по поводу этих «событий».
В соответствии с задачами исследования были сформированы следующие критерии включения и критерии исключения Критерии включения:
1. Наличие у больной РМЖ, подтвержденного данными гистологического исследования.
2. Выполнение радикального хирургического лечения (мастэктомия, органосохраняющая операция, реконструкгивно-пластическая операция).
3. Период наблюдения за больной более 90 дней со дня первичного обращения.
4. Выполненное иммуногистохимическое исследование уровня экспрессии рецепторов эстрогенов (ER), рецепторов прогестерона (PR), HER2/neu на
предоперационном и/или послеоперационном этапах., определение степени гистологической злокачественности
1. Первично метастатический РМЖ (Тлюбая]ЧлюбаяМ1)
2. Больные РМЖ, начавшие лечение в другом лечебном учреждении
3. Протоковый или дольковый рак in situ
4. Рак молочной железы у мужчин
Иммуногистохимическое исследование выполнялось как на материале трепан-биопсии, так и по операционному препарату после выполнения хирургического лечения. Фиксированные формалином парафиновые блоки были окрашены соответствующими антителами для определения ER, PR, HER2. Экспрессия ER и PR оценивались полуколичественно при помощи Allred scoring system. Экспрессия HER2 считалась позитивной при иммуногистохимической оценке как 3+, либо 2+ с последующим подтверждением методом флюоресцентной гибридизации in situ (FISH).
Определение степени гистологической злокачественности проводилось по системе Scarff-Bloom-Richardson в модификации Elston-Ellis. Согласно этой классификации оцениваются 3 параметра: формирование трубочек , ядерный полиморфизм и число митозов. Каждый из этих параметров оценивается в баллах от 1 до 3. Затем баллы суммируются и вычисляется степень гистологической злокачественности (G). Распределение больных на подтипы осуществлялось согласно следующим критериям:
1. Люминальный-А: положительные рецепторы эстрогенов (ER) (по Allred) и рецепторы прогестерона (PR) (по Allred), экспрессия HER2/neu отсутсвует. Низкая(01) и умеренная (G2) степень злокачественности.
2а.Люминальный-В (НЕ112-негативный): положительные рецепторы эстрогенов (ER) (по Allred) и рецепторы прогестерона (PR) (по Allred) Высокой степени злокачественности (G3).
2в.Люминальный-В HER2 — позитивный: положительные рецепторы эстрогенов (ER) (по Allred) и рецепторы прогестерона (PR) (по Allred), наличие сверхэкспрессии HER2 (3+)
3. НЕЯ2-сверхэкспрессируюпшй РМЖ: наличие сверхэкспрессии HER2/neu (3+) или амплификация HER (FISH) и отсутствие определяемых ER, PR.
4. Трижды-негативный РМЖ: отсутствие определяемых рецепторов стероидных гормонов (ER, PR), отсутствие экспрессии HER2/neu ( 0.5)
В связи с тем, что распределение больных по стадиям при различных подтипах заболевания различно, нами отдельно проведен анализ общей выживаемости при самых ранних стадиях заболевания (pTINOMO и pT2N0M0).
Больные люминальным А и В РМЖ ранних стадий (T1NOMO и T2N0M0) имеют хороший прогноз заболевания. 7-летняя выживаемость больных люминальным-А подтипом достигала 98%. люминальным В HER2- отрицательным и HER2-положительным — 96%. Отличия между группами люминального-А и люминального-В и остальными подтипами являются статистически достоверными (р 90%). Выживаемость больных люминальным-В (HER2-) РМЖ в первые 5 лет наблюдения выше, чем в группе трижды-негативного РМЖ однако, в последующем они выравниваются.
Оказалось, что люминальный-В HER2- положительный РМЖ характеризуется плохим прогнозом при общей оценке, включающей все стадии заболевания, но имеет схожую выживаемость с люминальным-В HER2- отрицательным РМЖ при самых ранних стадиях заболевания (pTl-2N0M0).
Самые низкие показатели как общей, так и безрецидивной выживаемости наблюдаются при НЕК2-сверхэкспрессирующем и трижды-негативном подтипах РМЖ.
Даже при ранних стадиях заболевания (pTl-2N0M0) 10-летняя выживаемость больных этой группы не превышает 55%.
Результаты адъювантного с лечение при различных биологических подтипах РМЖ Адъювантное лечение люминального-А РМЖ В анализ адъювантного лечения люминального-А РМЖ вошло 356 больных. Из них 195 в адъювантном режиме получали только гормонотерапию, 114 больных получали химиотерапию с последующей гормонотерапией, 31 больная после химиотерапии не получала адъювантной гормонотерапии. В группу наблюдения вошло 16 больных, которые не получали послеоперационного системного лечения.
При сравнении показателей как 5-летней так и 7-летней общей выживаемости больных люминальным-А РМЖ, получавшим адъювантную гормонотерапию (тамоксифен или ингибиторы ароматазы), и больных, получавших сначала химиотерапию (CMF, FAC, таксаны), достоверных отличий не выявлено (98% и 97%, соответственно, р>0.5). Таким образом, у больных люминальным-А подтипом дополнительная цитотоксическая химиотерапия не улучшает отдаленных результатов лечения.
Такая же закономерность наблюдается и при анализе показателей 5-летней безрецидивной выживаемости (96% в группе, получавшей только гормонотерапию, против 94% в группе, получавшей химиотерапию с последующей длительной гормонотерапией, р>0.5).
Адъювантное лечение люминального-В (HER2- отрицательного) РМЖ В анализ адъювантного лечения люминального-В НЕЯ2-отрицатслыгаго РМЖ вошли данные о 188 больных. Из них 53 получали только гормонотерапию, 90 больных получали адъювантную химиотерапию с последующим переходом на гормонотерапию, 38 больных получали только химиотерапию и 7 больных не получали адъювантного лечения. Однако при анализе адъювантного лечения данного подтипа заболевания безотносительно стадии статистически достоверных отличий в эффективности различных видов адъювантной терапии получено не было (р=0.43).
Отдельно проанализированы данные на больных высокого риска (92 больные с метастатическим поражением подмышечных лимфатических узлов). 14 больных получали только адъювантную гормонотерапию, 54 больных получали химиотерапию с последующим переходом на гормонотерапию, 21 больная получила только химиотерапию и 3 больные не получали никакого адъювантного лечения.
При изучении 5-летней безрецидивной выживаемости у больных люминальным-В (HER2-) РМЖ с наличием регионарных метастазов (pNl-2), они оказались более высокими при последовательном применении сначала химиотерапии (FAC, FEC, таксаны)
с последующей многолетней эндокрннотерапией по сравнению с одной адъювантной эндокринотерапией (85% в группе химиотерапии с последующей гормонотерапией против 72% в группе только адъювантной гормонотерапии, р=0.048)
Показатель общей выживаемости был достоверно выше в группе больных, получавших сначала химиотерапию а затем — эндокринотерапию .
Адъювантное лечение люминального-В НЕЯ2-положительного РМЖ Всего проанализирована выживаемость 85 больных Люминальным-В НЕЯ2-сверхэкспрессирующим РМЖ. Из низ 16 больных получили адъювантную химиотерапию с последующим применением эндокринотерапии, 28 больных получали одну гормонотерапию, 20 больных — одну химиотерапию, 18 больных после химиотерапии получали таргетную терапию трастузумабом до года с последующей гормонотерапией.
У больных люминальным-В (НЕЯ2-положительным) РМЖ комбинированное лечение (последовательно химиотерапия и многолетняя гормонотерапия) оказалась эффективнее чем одна химиотерапия или одна гормонотерапия. Показатели 10-летней безрецидивной выживаемости равнялись 87,5%, 60% и 62%, соответственно (значение р 0,5).
Рис.4 Безрецидивная выживаемость больных трижды-негативным
РМЖ в зависимости от получаемого лечения (Kaplan-Meier)
адьгавантного системного лечения р = 0.043
Безрецидивная выживаемость больных трижды-негативным РМЖ, получавших химиотерапию была выше, чем в группе больных, не получавших послеоперационного системного лечения (показатель 5- летней безрецидивной выживаемости 83% против 50%, р=0.043). (рис.4)
Показатель 5-летней общей выживаемости больных трижды-негативным РМЖ также был выше у получавших адъювантную химиотерапию (92%). Среди больных не получавших послеоперационного системного лечения показатель 5-летней общей выживаемости был равен 50% (р=0.003)
Неоадъювантное лечение при различных биологических подтипах РМЖ В исследование неоадъювантного лечения вошло 369 больных. В табл. 4 отражена частота объективных клинических ответов на проведение неоадъювантного системного лечения. Объективный ответ на проведение гормонотерапии в группах люминапьного-А и люминального-В НЕ112-отрицательного РМЖ достаточно высокий и достигает 75-78% при проведении эндокринотерапии ингибиторами ароматазы. Оценить эффективность неоадъювантной гормонотерапии тамоксифеном не представляется возможным из-за
небольшого числа больных, получавших данный вид эндокринотерапии. В группе Люминального-В HER2+ РМЖ ответ на неоадъювантную гормонотерапию значительно ниже и не превышает 25%. Это подтверждает мнение Baselga (2008) и Kaufmann (2010) о том, что коэкспрессия рецепторов стероидных гормонов и HER2 заметно снижает позитивный эффект одной неоадъювантной гормональной терапии. В нашем исследовании не было больных, которые получали комбинированную гормональную и анти HER2 терапию, однако данная комбинация может оказаться эффективной при лечении люминального-В НЕИ2-положительного РМЖ.
Химиотерапия с включением антрациклинов и таксанов, в большинстве случаев, оказалась эффективной, за исключением люминального-А РМЖ. Частота объективных ответов при лечении антрациклин-содержащими схемами равнялась 78.5%, таксан-содержащими — 82,7%.
Дополнительное применение анти-НЕЯ2 терапии и химиотерапии увеличило эффективность лечения при люминальном-В HER2+ и при нелюминальном HER2-положительном РМЖ. Объективный клинический ответ при проведении комбинированной анти-НЕИ2-тсрапии и химиотерапии достигнут соответственно в 91,6% и 100% случаях.
В целом, наиболее чувствительным к химиотерапии оказались трижды-негативные и НЕЯ2-сверхокспрессиругащие опухоли. При трижды-негативном РЖМ отмечается наибольшая чувствительность к химиотерапии антрациклинами и таксами, которая достигает 85,1 и 93,5%, соответственно.
Табл. 4 Частота объективных клинических ответов при различных подтипах РМЖ в зависимости от вида неоадъювантного системного лечения
Люм-А Люм-В HER2-Her Люм-В HER2-no3 HER2-сверхэкспр. Трижды-негативный
Объективный ответ 92 60% 86 78,1% 50 71,6% 48 77% 78 84,7%
Ингибиторы ароматазы 20 75% 18 77,7% 8 25% «
Антрациклин-содержащие схемы 44 37,1% 43 72,0% 20 75% 23 71,3% 47 85,1%
Таксан- содержащие схемы 28 40,5% 24 75% 10 90% 17 94,1% 31 93,5%
Химиотерапия + анти-НЕЯ2- терапией 12 91,6% 8 100%
В группе НЕ112-сверхэкспресирующего РМЖ наибольшую эффективность
демонстрирует именно таксан-содержащая химиотерапия, где объективный ответ
наблюдался у 94,1% больных, в то время как при лечении антрациклин-содержащими схемами химиотерапии этот показатель равен лишь 71,3% (р 0.5)
4. Добавление цитотоксической химиотерапии к адьювантной гормонотерапии у больных люминальным А РМЖ не увеличивает показатели 5-летней общей выживаемости (97% и 98%, соответственно, р>0.5).
5. При люминальном-В (НЕЯ2- отрицательном) РМЖ с наличием регионарных метастазов (рШ-2) показатели 5-летней безрецидивной выживаемости выше при последовательном применении адъювантной химиотерапии, а затем многолетней эндокринотерапией в сравнении с одной эндокринотерапией (85% против 72%, соответственно, р=0.048).
6. У больных люминальным-В (НЕЯ2+) РМЖ комбинированное лечение (химиотерапия и последующая гормонотерапия) достоверно улучшает отдаленные результаты лечения по сравнению с одной химиотерапией или одной гормонотерапией (показатели 5-летней безрецидивной выживаемости 87,5% против 60% против 62%, соответственно, р по медицине, диссертация 2013 года, Пеньков, Константин Дмитриевич
ФГБУ «НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ОНКОЛОГИИИМЕНИ Н.Н. ПЕТРОВА» МИНЗДРАВА РОССИИ
ПЕНЬКОВ Константин Дмитриевич
ЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ РАЗЛИЧНЫХ БИОЛОГИЧЕСКИХ ПОДТИПОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Диссертация на соискание ученой степени кандидата медицинских наук
Научный руководитель: Заслуженный деятель науки РФ, член-корреспондент РАМН, доктор медицинских наук,
Глава 4. Обсуждение полученных результатов————————————79
Актуальность темы Рак молочной железы (РМЖ) относится к самым актуальным
проблемам современной онкологии. РМЖ является самой частой опухолью у
женщин, особенно старше 50 лет. Ежегодно в мире регистрируется около 1
млн. 200 тыс. новых случаев рака молочной железы, что составляет 22% от
всех злокачественных новообразований у женщин. (Мерабишвили В.М.,
2003; Семиглазов В.Ф., 2008; Семиглазов В.В., 2009; Гарин A.M., 2010)
До 1990х годов наблюдался неуклонный рост заболеваемости раком
молочной железы, что было связано с улучшением диагностики этой
патологии. В течение последних 10 лет отмечается более медленное
нарастание заболеваемости и снижение смертности от РМЖ, в развитых
странах, что обусловленовнедрением национальных программ скрининга и
широким применением системного адъювантного лечения. В настоящее
время в России ежегодно выявляется свыше 52 тысячи новых случаев РМЖ
(Мерабишвили, 2003, 2007; Аксель Е.М., 2006;Давыдов М.И., 2008; Чиссов,
Пятилетняя относительная выживаемость больных операбельными формами РМЖ в Санкт-Петербурге составляет 76,6% (Мерабишвили В.М., 2011).
Свыше 30 лет назад В.Ф. Семиглазов (1980), на основании изучения клинико-эпидемиологических признаков и анализа уровней продукции эстрогенов, прогестерона и других биохимических показателей, впервые в мире обосновал представление о патогенетическом многообразии РМЖ и существовании т.н. овариальной, надпочечниковой, инволютивной и других форм РМЖ, позже (через 10 лет) квалифицированного как открытие.
Прогресс молекулярной генетики, наблюдающийся в последние 5 лет и анализ «сигнатур» генной экспрессии позволил детализировать биологические характеристики этих опухолей и выделить ряд генетических подтипов: люминальный А и В, НЕЯ2-экспрессирующий, базально-подобный, нормо-подобный РМЖ.Однако, в клинической практике пока не
представляется реальным проведение такого анализа с рутинной целью. Для решения этой проблемы М. Cheang (2008) предложил «суррогатную» методику определения различных биологических подтипов, которая основана на иммуногистохимической оценке рецепторов эстрогенов (ЕЯ), рецепторов прогестерона (РИ.), НЕЯ2, Кл-67. По данной методике определены близкие по смыслу, но не аналогичные генетическому анализу ^епеехргеззюпаггау) «биологические подтипы»: Люминальный А, Люминальный В (НЕЯ2-негативный), Люминальный В (НЕ112-позитивный), ЕгЬ-В2 сверхэкспрессирующий, трижды-негативный. Важным аспектом является то, что определение уровня Кл-67 сложновоспроизводимая методика, которая выполняется не во всех лечебных учреждениях. Если надежная и достоверная оценка индекса Кь67 недоступна, как альтернатива оценке пролиферации может быть использована оценка гистологической степени злокачественности.
На основании ряда ретроспективных исследований и ИГХ пересмотра архивного патоморфологического материала (парафиновых блоков) высказано общее предположение о том, что прогноз заболевания и ответ на системную терапию и местное лечение может отличаться при различных биологических подтипах РМЖ.
Исходя из такого рода исследований, предполагается, что
химиотерапия целесообразна при высокой степени злокачественности,
высокой пролиферативной активности (К167>14%), отсутсвии ЕЯ и РЯ,
высокой экспрессии НЕЯ2. Остается неясным необходимость применения
химиотерапии при лечении «люминального-А» и «люминального-В» (НЕЯ2-
негативного) РМЖ. По мнению экспертов 12-й Международной
конференции по раку молочной железы в Сан-Галлене, «Люминальный А»
подтип скорее всего является наименее чувствительным к химиотерапии, а
при «Люминальном В» подтипе РМЖ в химиотерапевтические режимы
включаются антрациклины, однако, включение таксанов может быть
предпочтительным. Это относится и к «трижды-негативному» РМЖ
Судя по исследованиюТССТО№9831 (США), при «НЕЯ2-позитивном» РМЖ дополнительное использование трастузумаба и адъювантная цитотоксическая терапия увеличивает показатели выживаемости. Представляется предпочтительным одновременное применение трастузумаба и химиотерапии.
Таким образом, остается актуальным дальнейшее углубленное изучение особенностей клинического течения, прогноза и чувствительности к отдельным видам системного лечения различных биологических подтипов РМЖ.
В конечном итоге это позволит подойти ближе к индивидуализации (персонализации) планирования как местного (хирургического), так и, в особенности, адъювантного системного лечения РМЖ с целью улучшить показатели выживаемости этих пациентов и качество их жизни, отказавших в ряде случаев от заведомо неэффективной цитотоксической химиотерапии.
Индивидуализация лечения РМЖ, основанная на выделении биологических подтипов заболевания
1. На основании ИГХ анализа опухолей больных РМЖ и определения уровне экспрессии ЕЯ, РЯ и НЕЯ2 оценить удельный вес различных подтипов рака молочной железы, особенности их клинического течения, частоты и сроков местных рецидивов, отдаленных метастазов, показателей общей и безрецидивной выживаемости.
2. Определить прогностическое значение объема хирургического вмешательства при различных биологических подтипах РМЖ
3. Определить эффективность адъювантной химиотерапии при различных биологических подтипах РМЖ
4. Оценить эффективность адъювантной эндокринотерапии при Люминальном А и Люминальном В подтипах опухоли.
5. Изучить эффективность различных видов неоадъювантного системного лечения при различных биологических подтипах РМЖ.
На крупном массиве базы данных, включающем свыше 5 тысяч пациентов, усовершенствовано планирование лечения рака молочной железы на основе выделения биологических подтипов заболевания и оценки эффективности различных видов адъювантной системной терапии (химиотерапии, гормональной терапии, таргетной терапии) ранних (операбельных) форм РМЖ.
В работе в соответствии с задачами исследования проанализирована база данных из Ракового регистра отделения опухолей молочной железы НИИ онкологии им. Н.Н.Петрова и Городского клинического онкологического диспансера (Санкт-Петербург), располагающего сведениями об основных клинико-морфологических признаках, методах лечения, демографических данных, сроках и датах появления местных рецидивов, отдаленных метастазов, продолжительности жизни свыше 5000 больных РМЖ (2001-2011 г).
С учетом критериев включения, в анализ вошло 1188 больных (821 больная операбельными стадиями (I-IIb) и 369 больных Illa-IIIb стадиями). После ИГХ исследования уровней экспрессии HER2, рецепторов стероидных гормонов (ER/PR)6bmn определены основные биологические подтипы РМЖ. Люминальный А-461 больная (38,8%); Люминальный В (HER2- негативный) 277 больных (23.3%) Люминальный В (РПЖ2-позитивным) 134 больных (11.3%); НЕЯ2-экспрессирующий (3+) — 91 больная (7.6%о) Трижды-негативный — 225 больных (19%)
Кроме определения экспрессии HER2, ER, PR проводилась оценка степени гистологической злокачественности по Elston-Ellis.
Изучены отдаленные результаты лечения рака молочной железы различных биологических подтипов: частота и сроки появления местных рецидивов, отдаленных метастазов, общая и безрецидивная выживаемость.
Показатели выживаемости рассчитаны по методу Kaplan-Meier[Bland, 1998], позволяющим оценить показатели выживаемости при динамическом наблюдении для цензурируемых и нецензурируемых данных. Математическая обработка в каждой лечебной группе проведена с помощью актуриального (динамического) моментного метода Kaplan-Meier с использованием ряда пакетов современных статистических программ NCSS
(NamberCruncherStatisticalSistem, Version 5.5; PublishedbyDr. J.E.Hintze;
Keisville, Utah, 1988), Nepan (непараметрический анализ, разработанный в Ленинградском государственном политехническом институте в 1990 г. Яковлевым А.Ю., Кадыровой И.О.), STAT1STICA 6.0. (StatSoft, Inc. (2001). STAT1STICA (dataanalysissofitwaresystem), version 6. www.statsoft.com.), позволяющих провести как анализ общей и безрецидивной выживаемости с учетом влияния различных факторов, так и выявить существенность различий между сравниваемыми группами с помощью непараметрических статистических критериев: log-ranktest, Wilkokson, Колмогоров-Смирнов. Другим параметром оценки различных методов лечения является частота возникновения как местных рецидивов, так и отдаленных метастазов. В данных случаях статистическая достоверность различий изучена с использованием критериев ХИ-квадрата и Фишера (Двойрин В.В., 1985, Иванов O.A., 1997; Петрова, 2005). Для определения факторов прогноза применен метод регрессионного анализа, согласно полупараметрической модели пропорционального риска по Коксу. Корреляционный анализ проведен по KendallTau.
На основании точного определения показателей выживаемости в пределах каждого года наблюдения построены графические изображения -кривые выживаемости, удобные для наглядного представления информации (survivalcurves).
Индивидуализация (персонализация) планирования лечения, основанная на более точных сведениях о прогностических и предсказывающих признаков, позволяет улучшить отдаленные результаты лечения РМЖ, а также качество жизни этих больных.
Национальный Институт Рака США (NCI-USA) провозгласил 21 й век веком индивидуализированного лечения. Оно предполагает использование информации о генетической картине индивидуума, белках и окружающей среде для предотвращения, диагностики и лечения заболеваний[NCI, 2009]. Персонализированный подход к лечению рака молочной железы существует с 1980х годов, когда было обнаружено, что выгоду от лечения тамоксифеном получают только больные, в опухолях которых экспрессируются рецепторы эстрогенов (ER)[Fisher, 1989]. Последующее открытие амплификации генов erbB2/HER2 привело к началу нового витка персонализированной терапии -таргетной терапии. Первыми таргетными препаратами для лечения рака молочной железы стали трастузумаб и лапатиниб [Slamon, 2001; Geyer, 2006].
До недавнего времени, персонализированная терапия РМЖ, помимо возраста и стадии заболевания, была основана на оценке лишь двух предиктивных маркеров — ER и erbB2/HER2, являющихся одновременно и прогностическими. Развитие методов генетического профилирования привело к значительному изменению подходов к лечению этого заболевания.
РМЖ в настоящее время нельзя рассматривать как однородное заболевание, с различной морфологией. Исследования, направленные на генетическое профилирование опухолей молочной железы, позволили выделить ряд биологических подтипов, отличающихся по характеру течения, прогнозу и исходам заболевания.
Разделение опухолей на биологические подтипы дополняет информацию о стадии заболевания. Маленькие опухоли с признаками высокого риска рецидива нуждаются в агрессивной адъювантной терапии, в то время как опухоли более высоких стадий с благоприятными биологическими характеристиками могут не нуждаться в такой терапии.
К настоящему времени, всесторонне оценены и определены
подгруппы, отличающиеся по клиническому течению и ответу на лечение.
Эти подгруппы могут быть охарактеризованы с помощью высокотехнологичной молекулярной технологии, что обеспечивает углубленное проникновение в сущность генетических отличий различных подтипов РМЖ Дойной, 2009, 2011]. Несмотря на то, что ценность
данной молекулярной классификации ограничена ее тесным взаимодействием с традиционными методами определения НЕЯ2 и ЕЯ, выявление новых генетических аббераций, которые лежат в основе выделения биологических подтипов опухолей, позволило выявить новые терапевтические мишени, и изменило дизайн многих клинических исследований.
При анализе картины генной экспрессии выделяют следующие биологические подтипы РМЖ (рис.1): Люминальный А, Люминальный В, НЕЯ2-сверхэкспрессирующий, низкоклаудиновый и базально-подобный.
Биологические подтипы РМЖ и картина генной экспрессии
Люминальный А Люминальный В Низкоклаудиновый
Все опухоли делятся на две большие группы. В первую группу входят три подгруппы опухолей: НЕЯ2-сверхэкспрессирующий, низкоклаудиновый и
базально-подобный [Perouetal., 2000; Sorlieetal., 2003; Wirapatietal., 2008]. Данная группа характеризуется низким уровнем экспрессии или как правило отсутствием экспрессии рецепторов эстрогенов (ER) и прогестерона (PR), а так же наличием дополнительных факторов транскрипции, расположенных в люминaльнoм/ER+ кластере. Ко второй группе принадлежат Люминальный А и Люминальный В подтипы, отличительной особенностью которой является наличие pe^nTopoeER.
Базально-подобный подтип (рис.1 красный) характеризуется высокой экспрессией цитокератинов 5, 6 и 17(которые в типичном случае экспрессируются клетками базальной мембраны кожи и дыхательных путей), ламинина, а так же белка, связывающего жирные кислоты. В течение многих лет изучения данных опухолей были выявленные особенности данного подтипа, в числе которых высокая частота мутации гена р53. Данные опухоли обладают высокой пролиферативной активностью, которая отражается в значении индекса Ki-67, и экспрессии генов пролиферации. Высокий уровень пролиферативной активности является результатом дефицита протеиновой функции гена RB1, который служит одним из основных регуляторов клеточного цикла. В данных клетках имеется недостаточность RB и р53, что проявляется в быстром росте. Данные клетки так же ассоциируются с мутацией генов BRCA1. В случае, если у носителей BRCA1 возникает РМЖ, наиболее часто развивается именно базально-подобный РМЖ. Исследователи полагают, что утеря р53 (мутация гена р53), RB и мутация BRCA-1 приводят к значительному увеличению анеуплоидии, включая большое число хромосомных изменений, транслокаций и делеций [Sorlie и соавт., 2001].
Для HER2-CBepx3KcnpeccHpyioL4ero подтипа (рис.1 фиолетовый)
характерна высокая экспрессия ряда генов, расположенных в ERBB2
ампликоне, включая ERBB2 HER1 (erbBl), HER2/neu (erbB2), HER3 (erbB-
3),HER4 (erbB4). и GRB7. В физиологических условиях они регулируют
межклеточное и клеточно-стромальное взаимодействие посредством
сигнальных систем, контролируют клеточную выживаемость и пролиферацию, ангиогенез, а так же клеточную адгезию. Эти протеины состоят из трех доменов: внутренняя тирозинкиназа для трансдукции; короткая трансмембранная часть и внеклеточный рецепторный домен. Внеклеточный домен ЕОРЛ, НЕЯ-З и НЕ11-4 взаимодействуют со специфическими растворимыми лигандами. Специфические лиганды для НЕЯ2 не идентифицированы. Присоединение лигандов к ЕвРЯ, НЕЯЗ и НЕЯ4 приводит к образованию рецепторных комплексов, представляющих собой гомо- и гетеродимеры.ЕГЕК2 в данном случае выступает в качестве «корецептора», облегчая передачу сигнала. В случае развития РМЖ в некоторых опухолях наблюдается амплификация генов НЕЯ2/пеи и значительно возрастает количество данных рецепторов, которые начинают играть ключевую роль в канцерогенезе.
НЕЯ2-положительные опухоли составляют порядка 15-20% от общего числа опухолей. Среди этих опухолей около 30% являются ЕЯ-положительными, а большинство — ЕЯ-отрицательными.
При анализе карты экспрессии генов НЕЯ2 выявлено, что не все опухоли, относящиеся к НЕ112-сверхэкспрессирующему подтипу, являются НЕЯ2-положительными (имеют амплификацию гена НЕЯ2).Данная особенность НЕЯ2-сверхэкспрессирующих опухолей может быть объяснена наличием мутации в киназном домене НЕЯ2, однако, это лишь догадка. В настоящее время не идентифицирован данный активационный момент, однако, часть из НЕЯ2-содержащих опухолей фенотипически оказываются в трижды-негативной когорте.
Одним из основных вопросов является вопрос эффективности
таргетной анти-НЕЯ2 терапии у данного подтипа заболевания. В целом ряде
исследований [ПереводчиковаН.И., 2001;Р1ссаП-СеЬЬа11е1а1. 2005;
источник
По распространенности рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний. Он поражает ежегодно 1 млн. 600 тыс. женщин в мире и свыше 66 тыс. в Российской Федерации.
В ближайшие 20 лет во всех странах прогнозируется почти двукратное увеличение заболеваемости женщин раком груди, что объясняется увеличением продолжительности жизни и улучшением методов диагностики.
За последние годы, благодаря более раннему выявлению опухолей, смертность от рака груди у женщин снижается. В развитых странах, где применяется маммографический скрининг населения, этот показатель снизился на 30–50%.
Рак молочной железы – это не единообразное заболевание. При лечении клиницисты учитывают принадлежность опухоли к конкретному подтипу. Генетическое тестирование и иммуногистохимический метод, позволяют надежно определить биологические подтипы РМЖ. Эти подтипы сами по себе включают многие факторы риска и предсказывающие признаки, что позволяет выбрать наиболее эффективную терапию для больного.
Доказанное с помощью молекулярно-генетического анализа и иммуногистохимического исследования патогенетическое разнообразие РМЖ позволяет индивидуализировать лечение.
Увеличение выживаемости при раке молочной железы связано не только с широкомасштабным внедрением маммографического скрининга, но и адекватным использованием системных видов лечения.
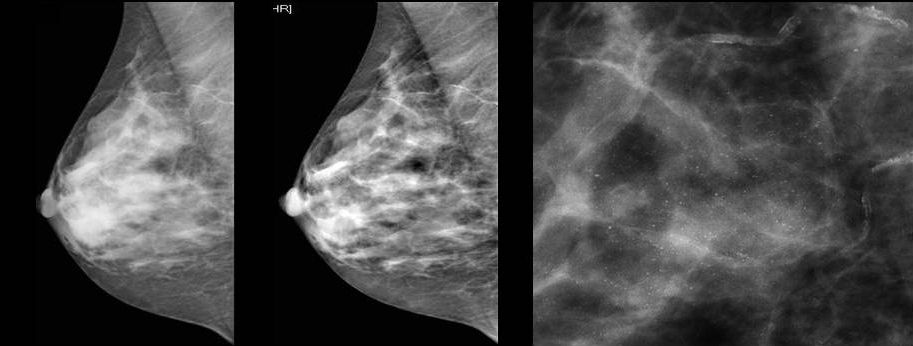
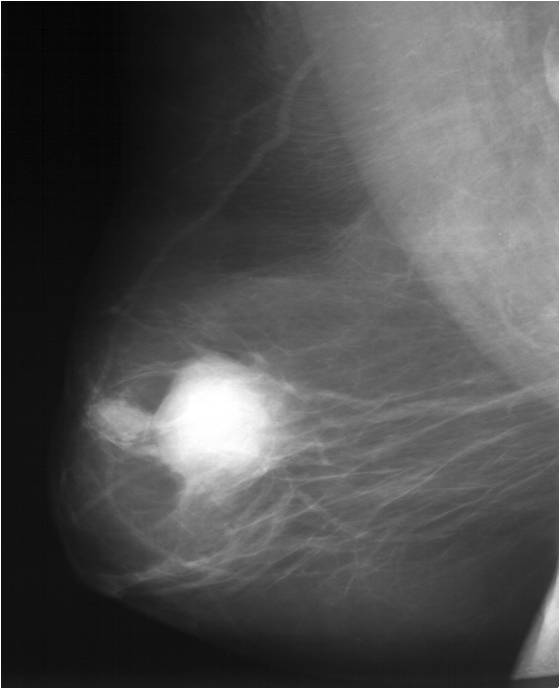
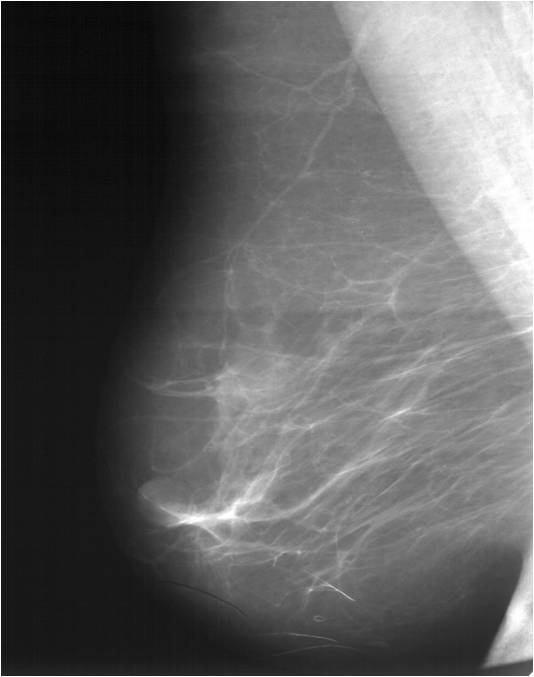
Для выявления злокачественных опухолей молочной железы существует определенный алгоритм диагностики, и его первичный элемент — маммографический скрининг. Чувствительность этого метода диагностики для опухолей от 2 мм до 5 мм составляет около 85%. Маммографическое исследование выполняют в двух проекциях.
Молодым женщинам с плотным строением молочной железы необходимо включение в программу наблюдения методов УЗИ и МРТ.
Поскольку традиционный маммографический скрининг у женщин до 40 лет малоэффективен, для скрининга может понадобиться альтернативная методика — МРТ. Современная контрастная магнитно-резонансная томография — высокочувствительный метод диагностики заболеваний молочной железы.
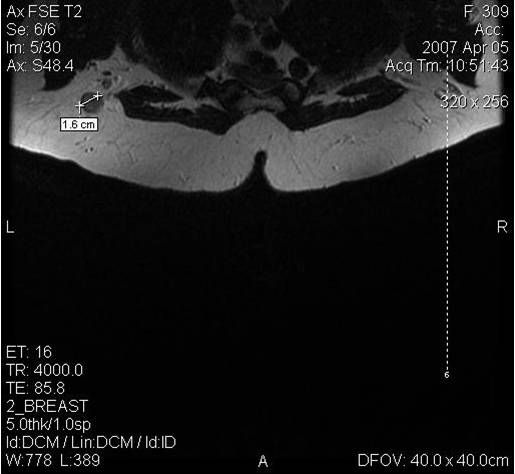
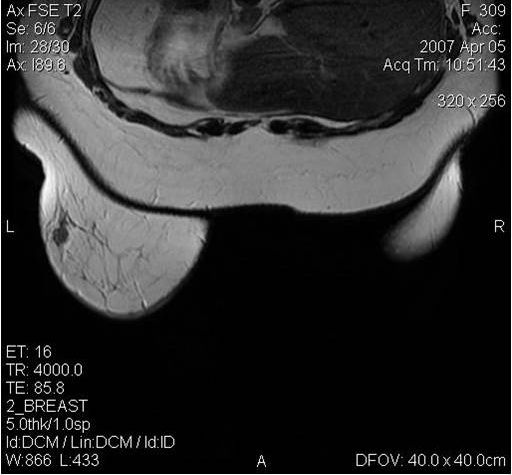
МРТ-диагностика рака молочной железы
У женщин с мутациями BRCA1 или BRCA2 при проведении МРТ возможно диагностировать рак молочной железы на самых ранних стадиях.
При ряде показаний женщинам назначается биопсия молочной железы под контролем УЗИ. Это исследование позволяет прицельно брать биологический материал для гистологического исследования, определения уровня экспрессии стероидных гормонов и статуса Her-2.
Известно множество факторов, повышающих риск возникновения рака молочной железы. На некоторые из них повлиять невозможно:
- семейная история по РМЖ,
- раннее менархе (начало месячных),
- позднее наступление менопаузы.
В то же время существуют и модифицируемые факторы, такие как:
- избыточный вес в постменопаузе,
- использование заместительной гормонотерапии,
- потребление алкоголя,
- курение
Стратегические шаги, направленные на снижение риска возникновения РМЖ включают контроль веса и борьбу с ожирением, регулярную физическую активность, уменьшение потребления алкоголя.
Большинство факторов риска рака молочной железы связано с действием гормонов на ткань молочной железы (раннее менархе, позднее наступление менопаузы, ожирение, применение гормональных препаратов). Считается, что именно женские половые гормоны, стимулируют процессы клеточного роста и повышают риски повреждения ДНК, что может привести к развитию злокачественного новообразования.
Только 5–10% случаев рака молочной железы обусловлены унаследованными мутантными генами BRCA. Но при этом, среди носителей мутаций риск возникновения заболевания может достигать 80%.
Чем младше возраст выявления первичного заболевания рака груди, тем выше вероятность заболеть контралатеральным раком, т.е. противоположной молочной железы.
Семейная история с наличием заболеваний раком молочной железы у кровных родственников, даже без ассоциации с мутациями BRCA, также повышает риск возникновения РМЖ.
Ожирение
Различными исследованиями доказано существование связи между заболеваемостью первичным РМЖ в постменопаузе и ожирением. Есть подтверждение связи между избыточным весом и низкой выживаемостью при всевозможных видах РМЖ.
Алкоголь
Алкоголь — также установленный фактор риска возникновения первичного РМЖ. Достоверность его отрицательного воздействия на пациентов, перенесших рак молочной железы, убедительна, так как он влияет на увеличение количества циркулирующих эстрогенов.
Только врач может оценить значимость различных симптомов. Однако каждой женщине необходимо знать, при каких симптомах надо обращаться к маммологу:
- «Образование», уплотнения, узел, инфильтрат, опухоль, «шарик» — что-то подобные этому вы обнаружили. Это еще не повод решить, что у вас РМЖ, но повод показаться специалисту.
- Деформация контура молочной железы, ареолы или соска (втяжение кожи или наоборот выбухание)
- Втяжение соска; особенно, если появилось недавно
- Выделение крови из соска
- Отек кожи всей молочной железы или ее локального участка
- Появление раздражения, мокнутые «ранки», язвочки, корочки на соске или ареоле
- Изъязвления (длительные, без видимой причины) на коже груди
- Дискомфорт в подмышечной области и обнаружение лимфоузлов ( «шариков» ) в подмышечной области
- Изменение цвета кожи молочной железы — покраснение, повышение температуры кожи в этой области.
Все эти симптомы могут быть проявлениями различных заболеваний (их насчитывается несколько десятков), возможно, не злокачественной природы. Однако, это может решить только специалист по заболеваниям молочной железы.
Признаки и симптомы рака молочной железы
0 стадия
Это стадия, когда не выявлена первичная опухоль, или она не может быть оценена, а также в случае неинвазивного рака молочной железы (что означает опухоль не выходит за границы своего появления, так называемый рак in situ).
1 стадия
Раковые клетки в этой стадии инвазируют или прорастают в соседние ткани. Опухолевый узел не более 2 см, лимфоузлы при этой стадии не поражены.
2 стадия
В этой стадии опухолевый узел превышает 2см и может достигать до 5см. При этой стадии могут быть поражены лимфоузлы, но поражение лимфоузлов носит одиночный характер, они не спаяны друг с другом и находятся на той же стороне, что и опухоль. В случае поражения лимфоузлов размер опухоли может быть и менее 2см.
3 стадия
Инвазивный рак, более 5 см или с явным и значительным поражением лимфатических узлов. При этом лимфоузлы могут быть спаяны между собой.
4 стадия
На этой стадии опухоль прорастает в кожу груди, грудную стенку либо во внутренние грудные лимфатические узлы. Она может быть любых размеров.
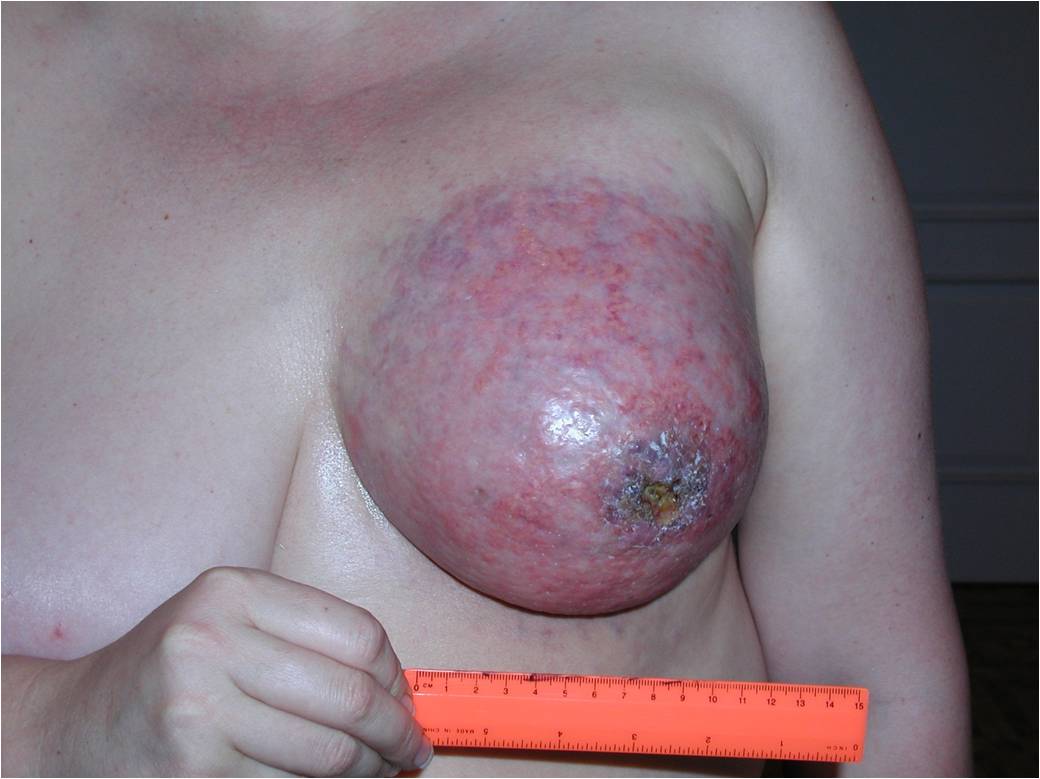
К 4 стадии рака молочной железы относится воспалительный рак, он встречается до 10 % всех случаев. Симптомы воспалительной формы рака груди это покраснение кожных покровов, железа становится теплой, отмечается увеличение и/или уплотнение части либо всей молочной железы. Кожа приобретает вид апельсиновой корки. Эту форму рака надо дифференцировать с воспалением молочной железы – маститом.
Также при 4 стадии опухоль может распространяться за пределы грудной клетки, в подмышечную область, внутренние грудные лимфатические узлы. Возможны метастазы в надключичные лимфатические узлы, а также в легкие, печень, кости или головной мозг.
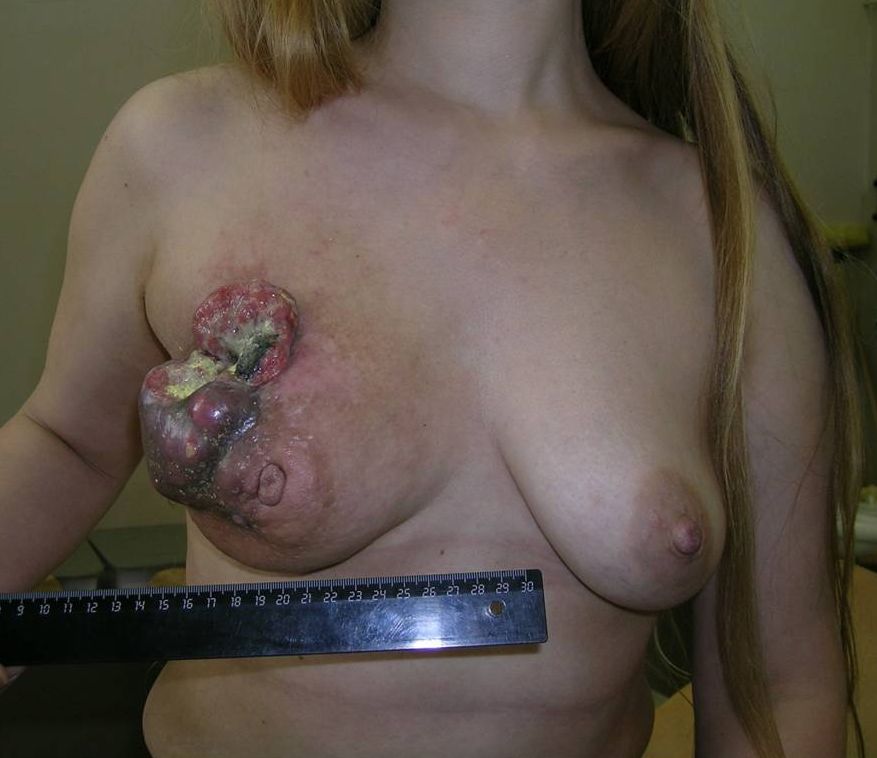
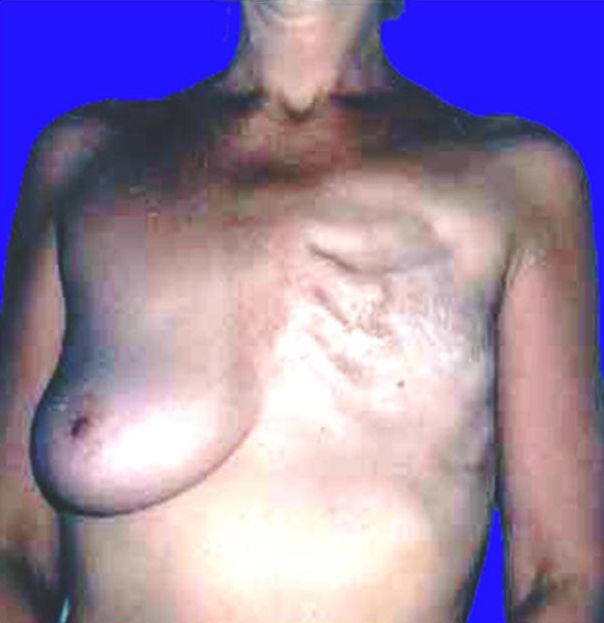
Как выглядит рак груди в разных стадиях:
Хирургическая операция — основной метод лечения при опухолях груди, и от качества его проведения во многом зависит исход заболевания. По данным некоторых штатов Индии, в которых по религиозным мотивам не проводится хирургическое лечение, показатели заболеваемости практически равняются показателям смертности. Обычно смертность от РМЖ в два — четыре раза уступает заболеваемости.
Однако, после хирургического лечения чаще всего следует лучевое. Местное лечение без послеоперационной лучевой терапии часто приводит к локально-регионарным рецидивам заболевания. Дело в том, что после завершения хирургической операции невозможно исключить существования скрытых отдаленных метастазов. Даже у больных с опухолями менее 1 см в диаметре в 10% случаев возможен рецидив заболевания.
Локализация отдаленных метастазов при РМЖ
Сейчас во всем мире наблюдается тенденция к сокращению объема хирургического вмешательства без потери эффективности. Хирургическое и лучевое лечение РМЖ развивается и совершенствуется в направлении органосохранения.
Благодаря внедрению маммографического скрининга, резко возросло число больных с ранней стадией заболевания, когда лимфоузлы не поражены метастазами. В этом случае «классическое» удаление всех уровней лимфоузлов было бы избыточной калечащей процедурой. На помощь хирургам пришел метод биопсии сигнальных (сторожевых) лимфатических узлов.
Поскольку, метастазы в подмышечных лимфоузлах появляются последовательно от первого ко второму, затем к третьему уровню, то достаточно определить наличие метастазов именно в первом лимфоузле. Его назвали «сигнальным»: если сигнальный лимфатический узел не содержит метастазов, то другие лимфоузлы также не метастатические.
Благодаря этому органосохраняющему методу, тысячи пациенток избежали избыточной полной хирургической диссекции, удаление раковой опухоли не привело к удалению груди.
Последние результаты клинических испытаний, в том числе и при участии НИИ онкологии им. Н.Н. Петрова, подтвердили безопасность отказа от полной подмышечной диссекции. Биопсия сигнальных (сторожевых) лимфатических узлов постепенно вытесняет подмышечную диссекцию как стандартную процедуру стадирования РМЖ.
Концепция биопсии сигнальных лимфатических узлов приобретает все большее признание и введена для многих локализаций опухолей в стандарты хирургического лечения Европейской Организацией по Изучению и Лечению Рака (EORTC).
Химиотерапия, наряду с хирургическим вмешательством, является одним из основных методов терапии рака. Послеоперационная химиотерапия улучшает результаты хирургического лечения, как и прогноз заболевания.
Ранее решение о назначении химиотерапии основывалось на двух факторах:
- стадия заболевания
- состояние регионарных лимфоузлов.
Благодаря многочисленным исследованиям ученых изменяются представления о биологии рака молочной железы, и выбор режимов химиотерапии значительно расширяется. И сегодня химиотерапевтическое лечение назначают даже при отсутствии метастазов в лимфоузлах, если небольшие по размеру опухоли обладают агрессивными биологическими характеристиками.
Люминальный А рак
При люминальном А раке избегают назначать проведение химиотерапии, особенно при негативных лимфоузлах, и применяют одну эндокринотерапию.
Люминальный В рак
Люминальные В опухоли характеризуются высокой агрессивностью. В этом случае чаще всего будет назначена химиотерапия, а выбор лечения основывается на оценке риска развития рецидива.
HER2-позитивный рак молочной железы
Лечение HER2-позитивного рака молочной железы основано на применении стандартных схем химиотерапии – трастузумаб и ХТ, основанная на антрациклинах и таксанах. Однако, только небольшой процент пациентов выигрывает от лечения, но все подвержены связанной с этим токсичностью.
Трижды негативный РМЖ
Трижды негативный рак молочной железы обычно ассоциируется с плохим прогнозом. Из-за редкой встречаемости особых типов РМЖ нет достаточных данных о роли адъювантной химиотерапии.
Химиотерапия при РМЖ у очень молодых женщин
Рак молочной железы в молодом возрасте обычно протекает агрессивно, часто встречаются гормонорезистеные и HER2-позитивные опухоли с иными свойствами, чем у более пожилых женщин. Для таких пациенток, моложе 35 лет, адъювантная полихимиотерапия почти всегда является необходимым методом лечения.
Химиотерапия пожилых пациенток
У пожилых пациенток (старше 65 лет) при решении вопроса о назначении адъювантной химиотерапии обязательно учитываются общее состояние организма и наличие сопутствующих хронических заболеваний.
В идеале пожилые пациенты должны подвергаться гериатрической оценке для определения их «пригодности» к адъювантому лечению. Потенциальный эффект лечения должен быть сбалансирован с теми рисками для организма, которые несет химиотерапия. Врач определяет наиболее эффективный и при этом наиболее безопасный специфический режим, основываясь на подтипе опухоли и индивидуальных характеристиках пациента.
Гормонотерапия
Молодые женщины с гормоноположительным раком молочной железы сохраняют риск рецидива заболевания на протяжении по крайней мере 15 лет после первичного заболевания. Онкологи должны определить, кто из пациентов нуждается в долгосрочной адъювантной терапии тамоксифеном или ингибиторами ароматазы.
Неоадъюватная (предоперационная) терапия
Неоадъюватная терапия занимает ведущую роль в лечении женщин с неоперабельным раком молочной железы, а также имеет важное значение при операбельных опухолях, когда выполняются органосохраняющие операции.
Эффект неоадъювантного лечения ДО (слева) и ПОСЛЕ (справа)
Лучевое лечение после проведенного хирургического вмешательства играет важную роль в терапии рака молочной железы и прогнозе заболевания. В НМИЦ онкологии им. Н.Н. Петрова было проведено исследование роли лучевой терапии после органосохраняющих операций (секторальная резекция с аксиллярной лимфоаденэктомией) у пациенток с минимальным РМЖ.
Анализ десятилетней безрецидивной выживаемости доказал более высокую эффективность лечения в группе больных, где применялась послеоперационная лучевая терапия.
Использование лекарственных препаратов для снижения риска заболевания называется химиопрофилактикой. На сегодняшний день одобренными препаратами для профилактики рака молочной железы являются тамоксифен и ралоксифен.
Тамоксифен может использоваться как пременопаузальными, так и постменопаузальными женщинами. Прием тамоксифена приводит к снижению риска РМЖ на 38% на более чем 10 летний период. Наиболее распространенными нежелательными явлениями на фоне приема препарата являются приливы.
В настоящее время клинические исследования изучают роль другого класса препаратов – ингибиторов ароматазы для оценки эффектов снижения риска РМЖ, которые сегодня используются только для лечения РМЖ. Предварительные результаты оказываются многообещающими. Ингибиторы ароматазы действуют только у женщин с нефункционирующими яичниками.
Профилактические хирургические операции по удалению молочных желез проводятся только в одном случае – если женщина является носителем мутаций в генах BRCA1 и BRCA2, известных как «синдром Анджелины Джоли». Мировой практикой доказано, что при удалении ткани обеих молочных желез риски РМЖ снижаются более чем на 90%. Такие операции выполняются в клиниках США и Израиля. В Европе подход к этому вопросу более консервативный.
В НМИЦ онкологии им. Н.Н. Петрова при проведении хирургического лечения женщинам с мутациями BRCA1 предлагается профилактическое удаление и реконструкция молочной железы.