Диагноз рака апокринных потовых желез устанавливается на основании результатов гистологического исследования. Основные трудности гистологической диагностики заключаются в различии между раком апокринных и раком ккринных потовых желез, при этом следует учитывать локализацию, гистологические и иммуногистохимические характеристики опухолей, особенности их течения, тип секреции и т.д. В то же время следует помнить, что некоторые новообразования потовых желез имеют промежуточные признаки или являются недифференцированными, что осложняет их четкое разделение на группы апокринного и эккринного происхождения. Примерами смешанных опухолей являются себокринная аденома, себоциома и поромаподобная аденома придатков кожи. Классификации отдельных опухолей помогают данные энзимной гистохимии, иммуногистохимии и электронной микроскопии. В частности, рак апокринных потовых желез часто содержит неопластические клетки с обильной зернистой эозинофильной цитоплазмой; почти в 30% случаев он позитивно окрашивается на железо. Эккринные раки никогда не окрашиваются положительно на железо, однако содержат ШИКположительные диастазорезистентные гранулы. Опухолевые клетки при эккринных раках, в отличие от рака апокринных потовых желез, имеют значительно меньшие размеры, они слабоэозинофильные, а клетки протоков — слабобазофильные .
Дифференциальный диагноз рака апокринных потовых желез также проводится с келоидом, гемангиомой, меланомой, эпидермоидной кистой, дерматофибромой, лимфомой, плоскоклеточным раком кожи, базалиомой, нейроэндокринным раком, саркомой Капоши, метастазами рака внутренних органов. Например, дуктальный рак потовой железы с локальной миоэпителиальной дифференцировкой может иметь сходство с раком носоглотки, а папиллярный рак потовой железы — с кожными метастазами рака яичников. Перстневидноклеточный рак гистологически сходен с метастазами рака молочной железы, желудка или кишечника. Дифференциальный диагноз во всех перечисленных случаях проводится с использованием иммуногистохимических и электронно-микроскопических исследований. Для дифференциальной диагностики с раком молочной железы, метастазировавшим в подмышечную область, используют маммографию и окрашивание биоптата на рецепторы к эстрогенам и прогестерону.
Течение апокринной аденокарциномы. Около 30-50% дуктопапиллярных раков апокриновых потовых желез метастазируют, в первую очередь лимфогенно, а в 48-50% случаев — гематогенно. Наиболее часто метастазируют дуктопапиллярные раки век, что обусловлено хорошей васкуляризацией этого региона. Метастазирование обычно происходит в региональные лимфатические узлы, а из них — во внутренние органы, в первую очередь в легкие, реже в печень, кости и мышцы.
Местные рецидивы после хирургического лечения рака апокринных потовых желез встречаются часто, в 80% случаев. Для снижения риска их развития необходим контроль операционного края.
Прогноз при раке апокринных потовых желез не анализировался отдельно от других раков потовых желез, при которых регионарные метастазы имели место в 85% случаев, отдаленные метастазы — в 31%. Десятилетняя продолжительность безрецидивного течения при отсутствии метастазов в лимфатические узлы составляла 56%, а при их наличии — только 9%. Риск метастазирования и летального исхода зависит от гистологических особенностей опухоли: 5-летняя выживаемость отмечена почти у 70% пациентов с высокодифференцированным раком и ни в одном случае — у пациентов с низко- и недифференцированным.
Лечение апокринной аденокарциномы — хирургическое удаление опухоли в широких пределах, нередко с последующей пластикой. При опухолях в области век, губ, носа, кончиков пальцев используют микрографическую операцию по Mohs. В профилактических целях показано удаление региональных лимфатических узлов. Химиотерапия (циклофосфамид, доксорубицин, флуороурацил, цисгшатин, блеомицин) недостаточно эффективна. Большинство опухолей радиорезистентно.
— Вернуться в оглавление раздела «Дерматология»
источник
БИФАЗНАЯ) КАРЦИНОМА
СМЕШАННАЯ ПРОТОКОВАЯ И ДОЛЬКОВАЯ
Такие карциномы характеризуются частично микроскопическими признаками инфильтрирующей дольковой карциномы, частично — инфильтрирующей протоковой. Она выявляется достаточно редко и ее необходимо отличать от случаев, когда две отдельные опухоли различного микроскопического строения существуют рядом в одной и той же молочной железе.
Иногда в опухолевом узле или в ткани молочной железы вне карциномы обнаруживаются структуры, по форме соответствующие долькам, альвеолы которых построены из атипических полиморфных раковых клеток. Такие формации не следует рассматривать как элементы долькового рака. Принято считать, что они не что иное, как результат интраканаликулярного распространения в альвеолы инфильтрирующего или неинфильтрирующего рака, и обозначаются как «канцеризация долек» (рис. 32).
Слизистый рак (муцинозный, коллоидный, желатинозный) обычно выявляется у женщин в менопаузальном периоде. Макроскопически опухолевый узел хорошо очерчен, крепитирует при пальпации. На разрезе имеет желеобразную консистенцию, тонкие фиброзные прослойки, часто видны мелкие очаги кровоизлияний. При микроскопическом исследовании видны обширные скопления слизи с «плавающими» в ней опухолевыми клетками (рис. 33). Последние, как правило, мономорфные, мелкие, формируют солидные или железистые структуры. Соотношение муцинозного и эпителиального компонентов может быть различным.
Иногда слизистый рак почти целиком состоит из муцина и тогда в препарате необходимо тщательно искать опухолевые, клетки. Слизь в таких случаях внеклеточная и представляет собой один из продуктов распада коллагеновых волокон.
Иногда в одном и том же опухолевом узле выявляются микроскопические структуры слизистого и обычного протокового инфильтрирующего рака. В этой связи выделяют, так называемые, «чистые» муцинозные карциномы и «нечистые», или «смешанные», слизистые раки, в которых сочетаются признаки того и другого микроскопических типов. Такое подразделение обусловлено различиями прогностического характера. «Чистые» слизистые раки отличаются более благоприятным прогнозом, чем протоковые инфильтрирующие карциномы. Это проявляется очень низкой частотой регионарного метастазирования «чистых» слизистых раков, которая при опухолях менее 5 см в диаметре не превышает 2-4%. В то же время необходимо помнить, что у части больных «чистым» слизистым раком отдаленные гематогенные метастазы могут быть обнаружены через 15 лет и более после начала лечения. Это свидетельствует о необходимости постоянного наблюдения за больными слизистым раком молочной железы. Больные «смешанным» слизистым раком имеют такой же прогноз, как и при инфильтрирующем протоковом раке.
Медуллярный рак обычно выявляется у женщин моложе 50 лет. При макроскопическом исследовании определяется четко очерченный опухолевой узел с ровными контурами, плотно связанный с окружающими тканями молочной железы. На разрезе узел серого цвета, часто с мелкими кровоизлияниями и очажками некроза. Консистенция опухоли мягкая, похожая на ткань мозга (старое название — «мозговик»). Микроскопическая структура опухоли представлена обширными полями крупных полиморфных клеток с большим количеством митозов. Опухоль практически не имеет соединительнотканных прослоек (рис. 34).
Постоянным микроскопическим компонентом является выраженная лимфоцитарная инфильтрация периферии опухоли. Иногда значительное количество лимфоцитов проникает вглубь опухоли, располагаясь между раковыми клетками.
Прогноз при медуллярной карциноме лучше, чем при обычном инвазивном раке. 10-летняя выживаемость при медуллярной карциноме составляет 84%, по сравнению с 63% при обычных протоковых раках. Метастазы в подмышечных лимфатических узлах выявляются часто, но обычно поражаются единичные лимфатические узлы и их локализация ограничена нижней аксиллярной группой. Прогноз особенно благоприятен при медуллярной карциноме менее 3 см в диаметре и сохраняется лучшим, чем для протоковой инфильтрирующей карциномы, даже когда имеются метастазы в регионарных лимфатических узлах.
Диагноз медуллярная карцинома должен ставиться лишь в тех случаях, когда имеются все признаки, ее характеризующие (ровные контуры опухолевого узла, массивные поля полиморфных опухолевых клеток, скудные соединительнотканные прослойки и выраженная лимфоплазмоцитарная инфильтрация). Опухоли, лишенные хотя бы одной из этих черт, следует расценивать как обычные инфильтрирующие протоковые карциномы высокой степени злокачественности.
Папиллярный инвазивный рак встречается очень редко, преимущественно у женщин в период менопаузы. При макроскопическом исследовании определяется четко очерченный деревянистой плотности серого цвета опухолевый узел, плотно спаянный с тканью молочной железы. Микроскопическое исследование показывает, что среди грубоволокнистой соединительной ткани располагаются неправильной формы и разной величины железистые полости, сформированные раковыми клетками. В просветы полостей выступают истинные сосочки, покрытые опухолевым эпителием.
Метастазирует папиллярная инвазивная карцинома редко и в метастазах в регионарные лимфатические узлы, обычно, сохраняет папиллярное строение. Прогноз инвазивного папиллярного рака значительно благоприятнее, чем при обычной протоковой инфильтрирующей карциноме. Иногда в одном и том же опухолевом узле выявляются стpyктуры инвазивного папиллярного рака и обычной протоковой карциномы (скиррозные, солидные и прочие структуры). Такие опухоли следует относить к инфильтративным протоковым раковым опухолям, так как прогноз в этих случаях не отличается от аналогичного показателя при банальной протоковой карциноме.
Редко инфильтрирующая папиллярная карцинома бывает представлена расположенными в строме железистыми полостями, имеющими правильную округлую или овальную форму и содержащими истинные сосочковые структуры, эпителий которых не имеет выраженного полиморфизма. Такие опухоли при микроскопическом исследовании бывает трудно отличить от папиллярного протокового рака in situ. Главным критерием в пользу инвазивного рака является наличие определяемого при макроскопическом исследовании плотного четко очерченного опухолевого узла.
Тубулярный рак — редкий гистологический вариант карциномы молочной железы, выявляющийся у женщин как в репродуктивном возрасте, так и менопаузальном периоде. Средний возраст таких больных около 50 лет.
Макроскопически новообразование представляет собой опухолевый узел твердой консистенции, неподвижный по отношению к окружающим тканям молочной железы. Нередко опухоль имеет звездчатую конфигурацию и похожа на протоковый инфильтрирующий рак скиррозного строения. Характерной особенностью опухолевого узла служат его небольшие размеры (1,5-2,5 см), что связано с медленным ростом карциномы.
Микроскопическая картина тубулярного рака представлена мелкими железами, расположенными на значительном расстоянии друг от друга в обильной строме. Железы не ветвятся и не анастомозируют друг с другом. Значительная часть желез имеет угловатую форму. Эпителий желез кубический или низкий цилиндрический, располагается в один ряд. Многие клетки на апикальной поверхности имеют реснички (апокриновый тип секреции). Клеточные элементы, формирующие железы, мономорфны, митотические фигуры не обнаруживаются.
Миоэпителиальные клетки не определяются; базальная мембрана отсутствует или обнаруживается в виде небольших ее фрагментов, что хорошо демонстрируется при использовании ШИК-реакции.
В просветах большинства желез не содержится продуктов секреции. В некоторых железистых структурах имеются клеточные мостики, соединяющие противоположные стенки железы (рис. 35).
В значительной части (более 2/3) тубулярных карцином в опухолевом узле или вне его определяются очаги внутридолькового или внутрипротокового рака, как правило, микропапиллярного или криброзного типа (рис. 36).
Строма опухоли обычно богата клеточными элементами. Микрокальцификаты выявляются, примерно, в половине случаев тубулярного рака. Количество их может быть разным, локализация — как в просветах железистых структур, так и в строме опухоли.
Метастазирует тубулярная карцинома редко. Метастазы, как правило, обнаруживаются лишь в подмышечных лимфатических узлах (рис. 37) и их частота не превышает 10% от числа всех оперированных по поводу этого варианта рака. При этом наличие регионарных метастазов не является фактором, отягощающим прогноз. Тубулярный рак молочной железы характеризуется достаточно благоприятным прогнозом. Частота рецидивирования и гематогенного метастазирования не превышает 4%. Иногда в тубулярном раке наблюдается сочетание со структурами обычной инфильтрирующей протоковой карциномы. Прогноз таких «смешанных» раков в значительной степени хуже, чем при чисто тубулярной карциноме. При этом преобладание тубулярного компонента делает прогноз лучше, чем при обычном, инвазивном протоковом раке.
Тубулярный рак иногда имитирует доброкачественное поражение молочной железы и, прежде всего, мелкожелезистый аденоз. Дифференциально-диагностические критерии этих процессов изложены в разделе, посвященном фиброкистозной болезни.
Аденокистозный рак (криброзный, цистаденоидный, цилиндрома) — редкая форма карциномы молочной железы, характеризующаяся очень благоприятным прогнозом. Макроскопически представляет собой опухолевый узел, не отличающийся от других форм инфильтрирующих опухолей. Как следует из названия, микроскопическое строение этой формы рака представлено кистозными формациями, заполненными криброзными («кружевными», солидными с круглыми отверстиями) разрастаниями из раковых клеток. Кисты, как правило, имеют неправильную форму. Они часто сочетаются с тубулярными структурами. Иногда кистозные формации имеют правильную округлую или овальную форму, а клетки, их образующие, мономорфны. Нередко на апикальных отделах клеток определяются реснички (рис. 38). В этом случае необходимо проводить дифференциальную диагностику между инвазивным аденокистозным раком и неинфильтрирующей протоковой карциномой криброзного строения. Наличие макроскопически определяемого плотного узла опухоли и микроскопические проявления инвазии в жировую клетчатку свидетельствуют в пользу аденокистозного рака.
Секреторный (ювенильный) рак — редкая форма карциномы молочной железы, встречающаяся, главным образом, у девочек. Крайне редко может возникать у взрослых женщин в репродуктивном периоде. При макроскопическом исследовании определяется четко очерченный опухолевый узел, обычно малых размеров. Микроскопическая картина достаточно характерна и представлена железистыми и солидными структурами, состоящими из крупных клеток с хорошо выраженной вакуолизированной цитоплазмой (рис. 39а). Значительная часть клеток имеет оптически пустую цитоплазму («гипернефроидного» вида). Просветы железистых структур заполнены эозинофильным ШИК-положительным секретом. Ядра, в основном, нормохромные с выраженными ядрышками. Нередко центральная часть узла опухоли представлена гиалинизированной стромой без раковых клеток.
Прогноз благоприятный. Регионарное и отдаленное метастазирование выявляется редко.
Апокринный рак — крайне редкая форма, образованная эпителием апокринового типа. Опухолевые клетки крупные, имеют хорошо выраженную обильную, ШИК-положительную цитоплазму, содержащую эозинофильную зернистость. Ядра светлые, с хорошо выраженными ядрышками. Опухолевые клетки формируют железисто-солидные или выстилают кистозные структуры. На апикальных концах раковых клеток нередко видны булавовидные выпячивания цитоплазмы (рис. 39б). Некоторые опухоли представляют собой пристеночный узел в пределах кисты, выстланной доброкачественным эпителием апокринового типа. В связи с редкостью наблюдений апокринного рака достоверных сведений о его прогнозе не имеется.
Рак с метаплазией представляет собой инфильтрирующий протоковый рак, при котором наблюдаются различные варианты метапластических изменений. К их числу относится эпидермоидная карцинома — исключительно редкая опухоль молочной железы, выявляемая у женщин пожилого возраста. Макроскопически не отличается от обычного протокового инфильтрирующего рака. В отдельных случаях в опухолевом узле можно увидеть центрально расположенную кисту, выполненную роговыми массами. Микроскопически опухоль представляет собой протоковый инфильтрирующий рак с очагами плоскоклеточного строения, величина которых может варьировать в широких пределах. Иногда наряду с очагами высокодифференцированного плоскоклеточного рака можно наблюдать веретеноклеточные плоскоклеточные участки, непосредственно переходящие друг в друга.
В редких случаях в низкодифференцированном протоковом раке выявляются очаги хондроидного, остеоидного и даже гигантоклеточного остеокластоподобного строения.
Судить о прогнозе метапластических карцином молочной железы не представляется возможным из-за малого количества наблюдений.
Липидсекретирующий рак также относится к числу редких гистологических вариантов карцином молочной железы. Он представлен солидными комплексами из крупных клеток с обильной вакуолизированной цитоплазмой, содержащей большое количество липидов (рис. 40), наличие которых следует подтвердить с помощью специальных методов окраски.
Описана, так называемая, карциноидная опухоль молочной железы (инвазивный протоковый рак с эндокринной дифференцировкой). Клиническая и макроскопическая картина при этой гистологической форме рака не отличается от таковой при обычных инфильтрирующих карциномах. Карциноидный синдром не отмечается даже при распространенных формах заболевания. При микроскопическом исследовании определяются солидные гнезда мелких мономорфных клеток, разделенные фиброзными прослойками, лентовидные и розеткоподобные структуры (рис. 41). Клетки этой формы рака содержат аргирофильные гранулы.
Воспалительный рак характеризуется клинической картиной мастита — болезненность, гиперемия, отек кожи молочной железы. При макроскопическом исследовании выявляется протоковый инфильтрирующий рак с выраженным распространенным карциноматозом дермальных лимфатических сосудов (рис. 42). В отдельных случаях клинически определяемая воспалительная карцинома не сопровождается проникновением опухолевых клеток в дермальные лимфатические сосуды. И, наоборот, при распространенном карциноматозе лимфатических сосудов может не быть клинических признаков воспалительной карциномы (так называемая скрытая, «оккультная» — воспалительная карцинома). Выявление комплексов раковых клеток в лимфатических сосудах дермы, вне зависимости от наличия или отсутствия воспалительной реакции, является признаком, значительно ухудшающим прогноз.
Болезнь Педжета соска наиболее часто выявляется у пожилых женшин. Средний возраст больных около 50 лет, т.е. такой же, как и при других формах рака молочной железы. Болезнь Педжета характеризуется экземоподобным поражением соска и протоковым раком молочной железы.
Первым клиническим проявлением болезни служат изменения кожи соска: отек, покраснение, мокнутие; могут появляться корочки или чешуйки, иногда поверхностное изъязвление. В дальнейшем эти изменения могут распространиться на ареолу и даже изредка на окружающую ее кожу. В отличие от экземы, которая протекает волнообразно, с обострениями и ремиссиями, при болезни Педжета ее проявления неуклонно прогрессируют и не реагируют на местное лечение.
При микроскопическом исследовании в эпидермисе соска или ареолы определяются крупные (значительно крупнее эпителия эпидермиса) клетки с выраженной эозинофильной светлой цитоплазмой (клетки Педжета). Ядра таких клеток полиморфны, иногда пикнотизированы. Эти клетки чаше располагаются в глубоких слоях эпидермиса, но могут лежать на разных его уровнях. Клетки Педжета могут лежать отдельно друг от друга, располагаться изолировано или в виде небольших скоплений (рис. 43). Они никогда не проникают в дерму. Такие клетки могут быть обнаружены в выводных протоках и придатках кожи. Иногда в цитоплазме клеток Педжета выявляются гранулы меланина — признак, который может привести к ошибочной диагностике меланомы. Вероятно, меланин перемешается в опухолевые клетки Педжета из близлежащих меланоцитов путем цитокринии.
Иммуногистохимически опухолевые клетки Педжета экспрессируют ЕМА, мембранный антиген глобул молочного жира, СЕА (при использовании поликлональных антител), кератин низкомолекулярной массы и инволюкрин.
В начальной стадии болезни эпидермис представляется мало дезорганизованным и сохраняет типичное подразделение на слои (стратификацию). В дальнейшем эпидермис расширяется, появляются акантотические тяжи. Часто возникают нарушения стратификации разной степени, вплоть до картины, соответствующей тяжелой дисплазии. Иногда появляется клеточный и ядерный полиморфизм, что в сочетании с выраженным нарушением стратификации напоминает карциному in situ.
Зависимости между количеством клеток Педжета и степенью дезорганизации эпидермиса не выявляется. Число клеток Педжета при нарастании дезорганизации эпидермиса в одних случаях может уменьшаться, в других увеличиваться.
Иногда в акантотических тяжах могут возникать полости, ограниченные одним слоем эпителиальных клеток (рис. 44), в результате чего возникают железистоподобные формации.
По мере развития болезни в дерме усиливается лимфоцитарная и плазмоклеточная инфильтрация.
Болезнь Педжета соска почти всегда сочетается с протоковым инфильтрирующим раком молочной железы.
Последний может локализоваться в любом квадранте молочной железы, исходить из средних и даже мелких протоков и не иметь видимой связи с соском или ареолой. Имеются сведения о малочисленных случаях возникновения долькового рака при болезни Педжета соска.
Столь частое сочетание болезни Педжета соска и рака молочной железы дает основание ряду авторов говорить о существовании болезни Педжета молочных желез. При этом выявляемые в эпидермисе клетки Педжета, не будучи раковыми, служат маркером расположенной в глубине ткани молочной железы карциномы. В связи с этим, при обнаружении в эпидермисе соска клеток Педжета необходима мастэктомия, даже если карцинома в молочной железе не выявляется при клиническом обследовании.
В описании макропрепарата и гистологическом заключении должна быть подробно охарактеризована карцинома молочной железы, что является основанием для дальнейшего выбора рационального метода комплексной и комбинированной терапии.
Дата добавления: 2015-05-09 ; Просмотров: 5576 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
FABP7 и HMGCS2 являются новыми маркерами белка для апокринной дифференциации, классифицирующей апокриновую рак груди
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: PG JAE JMAM IG. Выполняли эксперименты: PG JAE JMAM MLT IG. Проанализированы данные: PG JAE MLT NH NK IG. Используемые реагенты / материалы / инструменты анализа: MLT NH NK VTW. Написал статью: PG JAE NK VTW MLT JMAM IG.
Апокринная карцинома груди является отличительной злокачественностью с уникальными морфологическими и молекулярными особенностями, обычно характеризующимися тем, что они являются отрицательными для рецепторов эстрогена и прогестерона и поэтому не поддаются выбору для эндокринной терапии. Несмотря на то, что они морфологически отличаются от других поражений молочной железы, в настоящее время для их диагностики в настоящее время не существует стандартных молекулярных критериев. Используя протеомику на основе геля в сочетании с масс-спектрометрией и иммуногистохимией, мы идентифицировали два новых маркера HMGCS2 и FABP7, которые классифицируют весь спектр дифференцировки акрокорона молочной железы от доброкачественной метаплазии и кист до инвазивных стадий. Экспрессия HMGCS2 и FABP7 сильно связана с апокринной дифференцировкой; их экспрессия сохраняется у большинства инвазивных апокринных карцином (IAC), демонстрирующих положительную иммунореактивность в 100% и 78% апокринных карцином, соответственно, по сравнению с неакрокинными опухолями (16,7% и 6,8%). Показано, что ядерная локализация FABP7 в опухолевых клетках связана с более агрессивными стадиями апокринных карцином. Кроме того, при добавлении в панель апокринных биомаркеров, ранее сообщенных нашей группой: 15-PGDH, HMGCR и ACSM1, вместе они обеспечивают подпись, которая может представлять собой золотой молекулярный стандарт для определения апокринового фенотипа в груди. Более того, мы показываем, что сочетание HMGCS2 со стероидным профилем (рецептор HMGCS2 + / рецептор андрогенного рецептора (AR) + / эстрогена (ER) — / прогестерон (PR)) идентифицирует IAC с большей чувствительностью (79%) по сравнению со стероидным профилем (AR + / ER- / PR-) (54%). Мы также представили подробный иммуногистохимический анализ акопных повреждений молочной железы с помощью панели антител против белков, которые соответствуют 10 генам, выбранным из опубликованных транскриптомических сигнатур, которые в настоящее время характеризуют молекулярный апокриновый подтип и показали, что, кроме меланофилина, который сверхэкспрессируется при доброкачественных апокринных поражениях, эти белки не специфичны для морфологической апокриновой дифференцировки в молочной железе.
Авторы подтверждают, что все данные, лежащие в основе выводов, полностью доступны без ограничений. Все соответствующие данные можно найти в документе и его файлах вспомогательной информации.
Апокринная карцинома груди проявляет тот же характер гистологического роста, что и инвазивная протоковая карцинома особого типа, и в настоящее время диагностируется на основании наличия характерной морфологии эпителиальных клеток апокринного типа, наблюдаемой более чем в 90% от массы опухолевых клеток. Эти опухоли представляют собой относительно редкий подтип, составляющий менее 5% всех случаев рака молочной железы [1], [2]. Недавно Dellapasqua и соавторы сообщили о частоте апокриновой карциномы 0,8% после анализа когорты 6971 пациентов с раком молочной железы [3]. Это высокое несоответствие, скорее всего, связано с отсутствием консенсуса по стандартизованным воспроизводимым диагностическим критериям, поскольку существующая классификация злокачественных новообразований в крови в США дает неточное определение апирокральной карциномы молочной железы [4], что вызвало противоречивые и неоднородные выводы в научной литературы с точки зрения точного иммуногистохимического профиля и молекулярной классификации инвазивных апокринных карцином (IAC) [1], [5], [6], [7], [8], [9]. Более того, апокринная дифференциация обнаруживается в нескольких других подтипах опухоли молочной железы, включая папиллярную, микропапиллярную, трубчатую и лобулярную карциному [9]. В дополнение к характерным морфологическим признакам, как правило, IAC обычно имеют выраженный гормональный профиль, являющийся рецептором эстрогена (ER) и рецептором прогестерона (PR), но рецептор андрогенов (AR) положительный [10]. Опять же, следует отметить, что на протяжении многих лет IACs были отмечены как положительные ER в 3,8-60% случаев, PR положительные в 4,8% -40% и AR положительные в 56-100% [1], подчеркивая изменчивость в наблюдалось наблюдение за этими опухолями. Не так много данных относительно клинических исходов этих опухолей, и результаты не достаточно убедительны из-за ограниченного количества образцов, отобранных для анализа [9]. Всестороннее исследование, опубликованное недавно, показало значительно более низкую выживаемость без болезни для чистых IAC по сравнению с инвазивной протоковой карциномой (IDC) [3].
Несколько лет назад было проведено несколько транскриптомических исследований с целью классификации этих типов злокачественности молочной железы на молекулярном уровне. В исследовании профилирования генов, проведенном Перу и соавторами, IACs сгруппированы в базальноподобный подтип карциномы молочной железы [11]. После этого Фермер и его коллеги [12] идентифицировали подмножество опухолей молочной железы, характеризующихся повышенной передачей андрогенов и отличительным профилем экспрессии, который они назвали «молекулярным апокрином», поскольку эти поражения не проявили всех признаков гистопатологии, характерных для классических апокринных карцином. Молекулярно определенные апокринные карциномы включают опухоли, которые имеют некоторые общие характеристики экспрессии с группой HER2 + (ER- / PR- / HER2 +) в классификации Стэнфорда, а также с некоторыми поражениями, которые проявляют признаки базальноподобной / тройной отрицательной группы (высокий класс поражения ER- / PR- / HER2-). Было также показано, что с помощью данных микрочипов можно разделить опухоли молочной железы на 3 основные группы по статусу стероидного гормона: просвет (ER + / AR +), базальный (ER- / AR-) и молекулярный апокрин (ER- / AR +), с определенной ассоциацией между апокринной гистологией и молекулярным апокриновым типом [13]. Наконец, исследование метаанализа, проведенное Сангой и его коллегами [14], показало, что подгруппы, описанные Фермером и Доэном, очень похожи и оба предсказывают молекулярное апокриновое подмножество в других когортах. Однако на сегодняшний день связь между молекулярной апокриновой карциномой молочной железы и гистопатологически определенными апокриновыми опухолями остается сомнительной [15].
С целью разработки молекулярных критериев для воспроизводимости категоризации IAC на уровне белка мы провели систематический протеомический анализ четко определенного набора апокринных карцином, направленных на выявление биомаркеров, которые могут характеризовать и подтипы этих поражений более подробно, а также искать цели, которые могут привести к разработке новых целевых методов лечения и химиопрепаратов [2], [16], [17], [18], [19]. Соответственно, мы идентифицировали ряд маркеров апокриновых белков, которые включают 15-PGDH и ацил-CoA-синтетазу, семейство 1-й цепи семейства ацил-CoA-синтетазы (ACSM1), которые вместе с набором категоризирующих маркеров, которые преимущественно экспрессируются (AR , CD24) или не экспрессировали (bcl-2, GATA-3) с помощью апокринных метапластических поражений при доброкачественных поражениях молочной железы, оказались специфичными как для апокриновой протоковой карциномы in situ (ADCIS), так и для IAC [2], [16], [ 17], [19], [20]. Было показано, что эта апокринная подпись однозначно идентифицирует 13 из 14 ADCIS (92,9%) и 20 из 33 (60,6%) IAC в хорошо охарактеризованном наборе апокринных карцином [2], в котором выставлено более 90% опухолевых клеток цитологические особенности, характерные для апокринных клеток [21]. Здесь мы описываем два дополнительных маркера, связывающий жирные кислоты с жирной кислотой (FABP7) и гидроксиметилглутарил (HMG) -CoA-синтазу 2 (HMGCS2), который в сочетании с маркерами в сигнальной сигнатуре белка, описанной ранее [19], позволил идентифицировать ADCIS и IAC, которые не удались которые будут обнаружены в предыдущих исследованиях. Более того, наши результаты показывают, что HMGCS2, добавленный к сигнатуре рецептора стероидного гормона (ER- / PR- / AR +), идентифицирует апокринные опухоли других подтипов рака молочной железы с большей чувствительностью по сравнению с профилем стероидных рецепторов. Мы также представили подробный анализ иммуногистохимии (IHC) набора белков, соответствующих 10 генам, выбранным из транскриптомических сигнатур, которые в настоящее время характеризуют молекулярный апокриновый подтип [12], [13], [14], [22] для оценки комплементарности эти два подхода.
Чувствительность и специфичность антител являются критическими параметрами при разработке и разработке надежных анализов на основе ИГС для анализа и валидации потенциальных биомаркеров. Чтобы определить, являются ли антитела FABP7 и HMGCS2 достаточно специфичными с точки зрения окрашивания IHC для выявления доброкачественных и злокачественных апокринных поражений [2], [16], мы использовали трехструнную стратегию, разработанную в нашей лаборатории и подробно описанную в другом месте [23]: ( i) анализ потенциальной перекрестной реактивности 2D-вестерн-блоттингом (2D-WB), (ii) валидация масс-спектрометров соответствующих пятен белка, окрашенных серебром, наложенных на 2D-WB и (iii) эксперименты IHC с блокировкой антител с соответствующим белком / эпитоп. Этот подход сочетает в себе внутреннюю чувствительность и клеточное разрешение IHC, со спецификой идентификации 2D-WB и MS, а также общую способность анализа белка протеомики на основе геля [24].
В предыдущих исследованиях мы продемонстрировали сверхэкспрессию FABP7 и HMGCS2 апокриновыми клетками по сравнению с их обычными аналогами эпителиальных клеток груди [2]. Анализ 2D-PAGE / MS / 2D-WB проводили на тканевых лизатах, полученных от шести пациентов, и результаты для одной пары апокриновых кист / нормальных эпителиев показаны на рисунке 1. Как показано, антитело против HMGCS2 обнаружило несколько линий поезда белковые пятна аналогичного Mw (около 57 кДа) (фиг. 1A и C), совместимые с множественными посттрансляционными модификациями белка [25], [26]. Идентичность этих пятен как HMGCS2 была подтверждена MS-анализом (данные не показаны). Антитело, распознающее FABP7, обнаружило одно пятно с Mw ≅15 кДа (рис. 1А и D). Никакие белковые пятна, соответствующие положениям FABP7 и HMGCS2, не были обнаружены на двумерном геле нормальной ткани груди (рисунок 1B). Результаты показывают, что HMGCS2 и FABP7 распознаются соответствующими антителами, и, самое главное, перекрестная реактивность была обнаружена ни для HMGCS2, ни для FABP7 с любым из тысяч белков, разрешенных 2D PAGE, что демонстрирует высокую специфичность для этих антител. Кроме того, чтобы исключить возможность того, что анти-FABP7 может реагировать с некоторыми близкими гомологами из семейства белков FABP [27], мы провели 2D-WB с белковыми экстрактами из нескольких трехкратно отрицательных образцов рака молочной железы, в которых мы ранее наблюдали аберрантную экспрессию из трех других членов семейства белков FABP, а именно FABP3, FABP4 и FABP5 [23]. Как видно на рисунке S1, анти-FABP7 специально распознал только одно пятно, соответствующее FABP7, и перекрестная реактивность не была обнаружена с помощью FABP3, FABP4 или FABP5. Тождества всех белковых пятен определяли с помощью масс-спектрометрического анализа (данные не показаны). Высокая специфичность обоих антител была дополнительно подтверждена экспериментами IHC с блокировкой антител с соответствующим полноразмерным рекомбинантным белком (данные не показаны). Исходя из этих результатов, можно сделать вывод, что антитела против FABP7 и HMGCS2 распознают их родственные антигены с высокой специфичностью и, таким образом, могут быть включены в панель антител, используемых в экспериментах IHC, чтобы отличить тип клеток, которые экспрессируют интересующие белки в гетерогенном клинические образцы.
(А) 2-мерный серебристый гель белкового лизата из апокриновой микроцисты, вырезанной из биопсии опухоли пациента 95 (GrI; ER + / PR + / AR + / HER21 +). Позиции FABP7 и HMGCS2, идентифицированные методом масс-спектрометрии (MS), обозначены синими стрелками. Позиции апокринной дифференциации, маркеры, 15-PGDH и ACSM1, описанные в наших предыдущих исследованиях, обозначены черными стрелками для справки. (B) 2D серебристый окрашенный гель белкового лизата из дальнего нормального (примерно на 3-4 см от массы опухоли) повреждение молочной железы, вырезанное из мастэктомии пациента 121 (GrII; ER + / PR + / AR + / HER22 +). HMGCS2 и FABP7 были идентифицированы MS и обозначены синими стрелками. Показаны позиции HMGCS2, FABP7 (синяя стрелка) и 15-PGDH, и ACSM1 (черные стрелки). Позиции HMGCS2 и FABP7 на двумерном гелевом изображении (B) расположены путем сопоставления соответствующих изображений геля с помощью программного обеспечения PDQUEST. (C и D) 2D-вестерн-блотта лизата белка из той же апокриновой микроцисты, что и в (A), развивается либо с анти-HMGCS2, либо с антителами против FABP7.
Установив строгую специфичность антител, распознающих FABP7 и HMGCS2, мы исследовали их профили экспрессии IHC на последовательных участках поражений с различными формами доброкачественной апокриновой метаплазии. Таким образом, мы оценили процент положительности / отрицательности для HMGCS2 и FABP7 в 2 наборах образцов молочной железы, а именно: незлокачественная ткань молочной железы, рассеченная из областей, прилегающих к опухолям (28 пациентов с различными типами опухолей молочной железы, таблица S1) и 13 доброкачественных апокринных микроцист, полученных после операции (таблица S2). Экспрессия цитоплазматического FABP7 и HMGCS2, а также ядерного FABP7 считалась положительной, когда мы наблюдали более 60% цитоплазматической и более 1% ядерного окрашивания, соответственно. Репрезентативные образцы IHC показаны на рисунке 2. Ячейка и цитоплазматическое окрашивание FABP7 не оценивались независимо из-за ограниченного числа образцов, представленных в каждой группе. Как видно, нормальные концевые протоковые лобулярные единицы и нормальные протоки в областях груди, прилегающих к опухоли, показали положительность для обоих белков ни в просвете, ни в базальных / миоэпителиальных клетках (рис. 2A и B и рис. 2E и F). Однако области с морфологическими признаками апокринной дифференциации проявляли спорадически положительное окрашивание мозаикой (рис. 2C и G соответственно). Наиболее заметно, что апокринные кисты проявляют высокую иммунореактивность как для HMGCS2, так и для FABP7 (рис. 2D и H соответственно). Чтобы подтвердить эти наблюдения и обосновать внутриклеточную локализацию обоих белков, мы исследовали картину экспрессии HMGCS2 и FABP7 в апокринных кистах с помощью двойной иммунофлуоресценции (рис. 3). Как и ожидалось, нормальные эпителиальные клетки молочной железы почти не проявляли признаков окрашивания либо антителом (рис. 3, левая панель). Напротив, поражения с апокринной метаплазией (рис. 3, левая панель) и апокринные кисты (правая панель) были очень положительными для обоих белков. В совокупности эти эксперименты показали преимущественную экспрессию HMGCS2 и FABP7 при доброкачественных поражениях молочной железы, подвергающихся апокринной дифференциации. Кроме того, неапорические плоские кисты (тип II), которые были обнаружены в анализируемых поражениях, были полностью отрицательными как для HMGCS2, так и для FABP7 во всех случаях (данные не показаны).
Секции FFPE нормальных грудных и доброкачественных поражений груди с апокринной дифференциацией, смежными с опухолью, окрашивались антителами против FABP7 (верхняя панель) и HMGCS2 (нижняя панель). (A) и (E) показаны серийные участки нормальной ткани молочной железы. Люминальные и базальные / миоэпителиальные клетки обозначены соответственно красной и черной стрелками. (B) и (F) показаны участки больших нормальных протоков. (C) и (G) показывают серийные разделы повреждений молочной железы с доброкачественной апокриновой дифференцировкой (апокриновый аденоз). Положительные и отрицательные просветные клетки обозначены соответственно черными и зелеными стрелками. (D) и (H) показывают серийные участки повреждений с апокринными кистами. Апокринные кисты с апикальными мордами и нормальными маленькими протоками обозначены черными и зелеными стрелками соответственно. Увеличение: x10. Представительные области для каждого окрашивания показаны с более высоким увеличением (x20). Значения отсечки для FABP7 и HMGCS2 указаны в материалах и методах.
Косвенный двухклеточный иммунофлуоресцентный анализ нормального поражения молочной железы с апокриновой метаплазией (левая панель) и секциями апокринных кист (правая панель) реагировал с FABP7 (подпанели B и F) и HMGCS2 (подпанели C и G). Разделы контрастировали с ядерным пятном DAPI (синий канал). Слияние изображений отображается на подпанелях (D) и (H) соответственно.
На основании оценки IHC мы оценили процент положительности / отрицательности обоих белков в апокринных кистах по сравнению с неакрокинными поражениями и показали, что FABP7 был положительным в 12 из 13 образцов апокринных кист и отрицателен в 22 из 28 неапоринные образцы (92,3% и 78,6% соответственно, р
Чтобы определить, являются ли FABP7 и HMGCS2 исключительно экспрессией апокринной карциномы, мы проанализировали модели экспрессии этих предполагаемых биомаркеров в наборе из 205 неакрокинских опухолей молочной железы: 42 TNBC (21%), 103 Luminal A (50,2%), 17 Luminal B (8,3%) и 43 HER2 + (20,5%), содержащихся в трех коммерчески доступных тканевых микрочипах (BRC1501, 1502 и 1503, Pantomics Inc.) (Рисунок 6, Таблица S5). Частоты положительности для HMGCS2 и FABP7 по сравнению с IAC суммированы на рисунке 6B. В общей сложности положительные результаты FABP7 были обнаружены у 14 из 205 неакроцинных карцином груди (6,79%): 8 из 42 TNBC (19,04%); 1 из 103 подтипов Luminal A (0,97%); ни у одного из 17 Luminal B (0%) и в 5 из 43 HER2 + (11,62%). HMGCS2 был выражен в 1 из 42 TNBC (2,38%); 18 из 101 Luminal A (17,8%); 4 из 17 Luminal B (23,5%) и 11 из 43 HER2 + (25,5%), в общей сложности 34 из 203 неакрокинских карциномов молочной железы (16,7%) (рисунок 6B). Точный тест Фишера подтвердил статистически значимую разницу в частотах HMGCS2 и FABP7 между IAC и Luminal A, Luminal B, HER2 + и TNBC (p
Представительные изображения секций FFPE, иммунизированных антителом против MLPH. (A) нормальные протоки, (B) доброкачественные апокринные кисты (в основном, просвечивающая мембранная иммунореактивность), (C) склерозирующий аденоз с апокринной дифференцировкой, (D) IAC, показывающий положительное иммунное окрашивание в структурах с псевдожинами (цитоплазматическая и люминальная мембранная иммунореактивность) и (E ) IAC с отрицательным иммуноокрашиванием. Увеличение: x20.
Точный диагноз акопической карциномы молочной железы остается спорным, в основном из-за довольно субъективных гистопатологических критериев и отсутствия чувствительных и специфических биомаркеров, которые могут надежно классифицировать этот подтип карциномы молочной железы. Стратегия, которую мы использовали для создания маркеров белка для категоризации ИАК и потенциально используемого в качестве целей для терапии, основана на предположении, что эти поражения возникают из апокринных клеток, которые, в свою очередь, получены из нормальных молочных эпителиальных люминальных клеток, которые подверглись апокринам метаплазия [1], т. е. переход от эпителиальных клеток груди в апокриновый тип клеток пота-железа [2], [19], [28]. Здесь мы сообщаем об анализе экспрессии двух новых предполагаемых белковых биомаркеров, FABP7 и HMGCS2, при поражении молочной железы, подвергающихся апокринной дифференциации: от доброкачественной апокриновой метаплазии до инвазивной апокринической карциномы.
источник
Апокринный рак — редкое новообразование, которое состоит из клеток с обильной эозинофильной цитоплазмой, напоминающих метапластические апокринные элементы. Его часто неверно называют онкоцитарным раком или карциномой потовых желез. Эта форма составляет около 1 % всех злокачественных новообразований молочных желез. Макроскопически опухолевые узлы плотные, сероватые, с признаками инфильтративного роста. Под микроскопом апокринный рак имеет вид слизистого, долькового, тубулярного, медуллярного внутрипротокового рака, клетки которого обладают увеличенными и полиморфными ядрами с выраженными ядрышками, а также эозинофильной LUHK(PAS)- и альциан-положительной гомогенной или гранулярной цитоплазмой с вакуолизацией.
Рак с признаками эндокринного новообразования (син.: первичная карциноидная опухоль, апудома) — редкая опухоль, представленная одиночным четко отграниченным узлом диаметром 1—5 см. Иногда она имеет многоузловое строение. Под микроскопом большинство таких новообразований выглядят как инвазивный протоковый рак разной степени гистологической дифференцировки. Аргирофильные клетки находятся как внутри протоковых структур, так и в инвазивной части опухоли. Кроме того, паренхима опухоли может состоять из пластов тубулярного, слизистого, сосочкового, внутрипротокового, внутридолькового и инвазивного долькового рака. Ряд аргирофильных карцином молочных желез обладают эндокринным типом строения и напоминают карциноидные опухоли других органов.
В этом случае опухолевые клетки составляют гнезда и тяжи, разделенные полосками стромы, а также могут формировать ленты, сосочки и микрожелезы. Клетки паренхимы такого новообразования имеют мелкие размеры, нечеткие контуры, гиперхром ные округлые ялра. Они дают положительную аргирофильную реакцию по Гримелиусу и отрицательную — по Фонтана—Массону. При этом в аргирофильных клетках рака молочных желез не удается обнаружить полипептидные гормоны и биогенные амины. Поэтому опухоли с клетками, обладающими аргирофильными гранулами, не представляют собой отдельную нозологическую единицу и рассматриваются как рак с очагами эндокринной метаплазии.
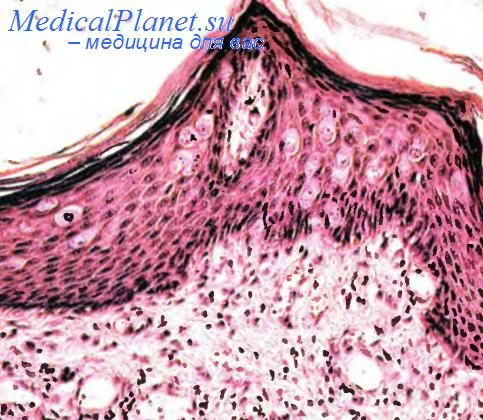
Крирозный рак расценивается как высокодифференцированный вариант инвазивного протокового рака. По частоте находок эта форма занимает около 6 % случаев инвазивного рака молочных желез. Если крнброзный компонент составляет менее половины объема паренхимы опухоли, то эта опухоль трактуется как смешанный инвазивный крнброзный рак. Как и в аналогичной карциноме другой локализации, паренхима криброзного рака гистологически напоминает решето, а весь опухолевый узел обладает развитой коллагеновой стромой. В паренхиме попадаются миоэпителиальные клетки и «дырчатые» структуры, которые могут сочетаться с тубулярным компонентом. Принято думать, что крнброзный рак в чистом виде прогностически более благоприятен, чем смешанный рак (с аденоид-кистозными структурами).
Болезнь Педжета — своеобразная и довольно редкая форма рака, представленная сочетанным поражением структур эпидермиса соска и крупных протоков молочных желез. По числу находок болезнь Педжета составляет 1 —2 % всех случаев рака молочных желез. Возраст больных 26— 88 лет. Пациенты жалуются на боли в пораженном органе, выделения из соска, иногда изъязвление на коже соска. Прогноз широко варьирует и определяется своевременностью начатого лечения и уровнем распространения процесса.
Под микроскопом при этом новообразовании в эпидермисе, преимущественно в нижних отделах сосков молочных желез, обнаруживаются крупные бледные клетки, иногда с оптически пустой цитоплазмой. Это клетки Педжета. Они располагаются поодиночке в поверхностных отделах эпидермиса с тенденцией к формированию пучков в базальных отделах. Их полиморфные крупные и часто светлые ядра содержат крупные ядрышки, а в цитоплазме может обнаруживаться небольшое количество пигмента или слизи. Изредка одиночные клетки Педжета располагаются в вакуолях. Все эти клетки дают положительные реакции на эпителиальный мембранный антиген, низкомолекулярные цитокератины и онкопротеин гена С-ERBB2 (HER2/neu). В подлежащей дерме и строме опухоли определяется лимфоидный инфильтрат. Болезнь Педжета может распространяться за пределы соска.
Почти всегда болезнь Педжета сочетается с вкутрипротоковым раком, реже с инвазивным раком молочных желез. Внутрипротоковый рак представлен комедокарцикомой, солидным раком, а инвазивный протоковый рак — низкодифференцированным солидным раком.
Болезнь Педжета следует дифференцировать от меланомы кожи и болезни Боуэна.
источник
При апокриновом раке более 90% опухолевой массы составляют клетки с признаками апокринизации.
Нужно отметить, что данная форма не имеет практического значения, а только теоретический интерес.
Апокриновый рак не имеет особенностей клинического течения и прогноза.
Частота выявления рака зависит от метода исследования. При использовании световой микроскопии колеблется в пределах 0,3-4%, при электронном микроскопическом исследовании — 0,4%. При использовании иммуногистохимического маркера анти-GCDFP-15 частота выявления составляет 12-72%.
Апокриновый рак может быть представлен двумя типами клеток: А и В. Клетки типа А — крупные, с выраженной монотонной эозинофильной цитоплазмой, их ядра крупные, светлые, похожие на клетки зернисто-клеточной опухоли.
Клетки типа В подобны клеткам гистиоцитарно-макрофагального происхождения и клеткам сального (sebaceous) рака. Отличие клеток от рака последнего типа заключается в отсутствии мелких светлых вакуолей липидов, цитоплазма апокринового рака монотонно светлая.
Представляет большой интерес иммунопрофиль апокринового рака. Позитивная реакция с антителом GCDFP-15 сочетается с отсутствием рецепторов эстрогена и прогестерона. Хотя ER мРНК в избытке содержится в ядрах опухолевых клеток, сам белок в большинстве случаев не продуцируется. Апокринный рак в 97% случаев имеет рецепторы андрогенов.
Под термином «метапластический рак» объединяют гетерогенную группу опухолей, для которых характерно наличие участков опухоли различного строения: аденокарциномы, плоскоклеточной карциномы, опухоли из веретеновидной клетки, участков мезенхимальной дифференцировки.
Метапластические карциномы составляют менее 1% всех инвазивных раков молочной железы (РМЖ). По имеющимся данным средний возраст больных 55 лет.
Клинические признаки данной опухоли не отличаются от инвазивной протоковой карциномы. В большинстве случаев отмечают хорошо отграниченную опухоль размером 3-4 см, однако существуют образования более 20 см, которые могут смещать сосок и изъязвлять кожу. На маммограмме большинство случаев рака метапластического типа выглядит в виде четко очерченного узла, иногда с микрокальцинатами.
Опухоль плотная на ощупь, хорошо отграничена от окружающей ткани. Зоны с плоскоклеточной или хондроидной дифференцировкой на поверхности разреза серого цвета, блестящие. В толще больших плоскоклеточных опухолей может находиться одна большая киста или несколько мелких (фото 80).
Фото 80. Внешний вид злокачественной листовидной опухоли, содержащей малигнизированный эпителиальный и стромальный компоненты
В зависимости от морфологического строения метаплacтические карциномы разделяют на подтипы: плоскоклеточный рак, аденокарпинома с веретеноклеточной метаплазией, аденосквамозная (железисто-плоскоклеточная) карцинома, смешанная эпителиально/мезенхимальная метапластическая карцинома, высокодифференцированная железисто-плоскоклеточная карцинома и другие.
Метапластическая плоскоклеточная карцинома молочной железы полностью построена из малигнизированного плоского эпителия с признаками ороговения или без них. Как и в других органах, плоскоклеточный рак может быть представлен веретенообразными клетками (фото 77, 78). Однако для установления диагноза необходимо исключить рак кожи или метастаз плоскоклеточного рака.
Фото 77. Метапластический рак. Видны очаги плоскоклеточной метаплазии с ороговением. Гематоксилин-эозин, х 100
Фото 78. Метапластический рак. Опухоль из веретенообразных клеток с очагами плоскоклеточной метаплазии. Гематоксилин-эозин, х 100
Плоскоклеточный рак молочной железы делят на фенотипы: крупноклеточный ороговевающий, неороговевающий, веретеноклеточный и акантотический. Возможны комбинации этих типов. Наиболее высокодифференцированные клетки часто ограничивают кистозные полости, в ходе распространения опухолевых клеток в окружающую строму эти клетки принимают всретеновидную форму и теряют черты, характерные для плоского эпителия.
В участках веретеноклеточной карциномы нередко отмечают пролиферацию стромальных клеточных элементов. Степень дифференцировки плоскоклеточной карциномы молочной железы зависит в основном от ядерной атипии.
При веретеноклеточном и акантотическом вариантах рака необходимо иммуногистохимическое подтверждение их эпителиальной природы. Эпителиальные опухолевые клетки дают позитивную реакцию с высокомолекулярными цитокератинами (СК5 и CK34betaE12), но негативную с маркерами сарком. Практически во всех метапластических карциномах молочной железы не выявляют рецепторов эстрогена и прогестерона (фото 77-79).
Аденокарцинома с веретеноклеточной метаплазией — это инвазивная карцинома с выраженной веретеноклеточной трансформацией (фото 79). Веретеновидныс клетки скорее всего образуются из железистого эпителия. Эту опухоль диагностируют главным образом у жен-шин в постменопаузальный период.
Фото 79. Метапластический рак. Опухоль из веретенообразных клеток. Гематоксилин-эозин, х 100
Опухоль состоит из тубулярных структур аденокарциномы, смешанных с опухолевыми веретеновидными клетками. Всретеновидные клетки имеют позитивную реакцию с эпителиальными маркерами, в том числе с цитокератином 7, но не с цитокератинами 5 и 6 или другими маркерами плоскоклеточной и миоэпителиальной дифференцировки.
Аденосквамозная (железисто-плоскоклеточная) карцинома — инвазивная карцинома с зонами хорошо развитых трубчато-железистых образований и широко распространенными солидными гнездами плоского эпителия.
Участки плоскоклеточной дифференцировки отмечали в 3,7% случаев инвазивной протоковой карциномы молочной железы, однако большая доля плоскоклеточной карциномы в опухолевой массе отмечается редко. Плоскоклеточный компонент, как правило, ороговевающий, однако зоны с выраженным ороговением могут соседствовать с участками неороговевающего рака.
Плоскоклеточный компонент дает отрицательную реакцию с антителами, выявляющими рецепторы эстрогена и прогестерона, в то время как протоковый компонент этих опухолей чаще позитивную.
Высокодифференцированная железисто-плоскоклеточная карцинома — это вариант метапластической карциномы, морфологическое строение которой похоже на аденосквамозную карциному кожи. Поэтому этот тип рака некоторые авторы классифицировали как сирингоматозную плоскоклеточную опухоль. Другие авторы обозначали ее как инфильтративную сирингоаденому с часто рецидивирующим после локального иссечения течением.
Возрастной диапазон заболевания широк. Опухоль, как правило, выявляют в виде небольшой пальпируемой массы размером от 5 до 80 мм.
Данный тип опухолей состоит из мелких железистых и солидных структур эпителиальных клеток, расположенных в веретеноклеточном стромальном компоненте. Соотношение всех этих компонентов отличается от случая к случаю. Солидные гнезда клеток могут содержать плоские клетки, роговые «жемчужины» или кистозные образования из плоских клеток.
Строма построена из бледных веретеновидных клеток. Стромальный компонент может содержать значительное количество коллагена, быть гиалинизированным, иметь клеточное строение, изредка выявляют фокусы хрящевой и костной ткани.
Высокодифференцированную железисто-плоскоклеточную карциному могут диагностировать в ассоциации с центральной склерозирующей пролиферацией (типа радиального рубца), склерозирующими папиллярными поражениями или склерозирующим аденозом.
Частота протоковой аденокарциномы in situ, ассоциированной с высокодифференцированной железисто-плоскоклеточной карциномой, вариабельна. Эти опухоли редко экспрессируют рецепторы эстрогена.
Аденосквамозный рак, как правило, имеет очень хороший прогноз, но в ряде случаев может давать рецидивы, что связано с неадекватностью локального иссечения. Метастатическое поражение лимфатических узлов отмечают редко.
Смешанные эпителиально-мезенхимальные метапластические карциномы (карцинома с остеоидной метаплазией, карцинома с хондроидной метаплазией, карциносаркома)
Это большая группа опухолей, для которых характерна смесь инфильтративной карциномы с гетерологическими мезенхимальными элементами в виде участков хрящеобразования, а также с костной мышечной, жировой, фиброзной дифференцировкой. Термин «карциносаркома» используют в случаях озлокачествления мезенхимального компонента. Определение степени злокачественности базируется на ядерных признаках и в меньшей степени на признаках цитоплазмы (фото 80-84).
Фото 81. Смешанная эпителиально-мезенхимальная опухоль с участком рабдоидной дифференцировки. Гематоксилин-эозин, х 100
Фото 82. Смешанная эпителиально-мезенхимальная опухоль, рабдоидная дифференцировка. Экспрессия Myogenina (клон F5D, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Отмечается позитивное окрашивание ядра опухолевых клеток, что характерно для РМЖ, х 200
Фото 83. Смешанная эпителиально-мезенхимальная опухоль, участок с остеогенной дифференцировкой. Гематоксилин-эозин, х 100
Фото 84. Карциносаркома молочной железы. Гематоксилин-эозин, х 100
Верстеноклеточные элементы часто экспрессируют цитокератины, хондроидные элементы белок S-100, однако могут отмечать коэкспрессию цитокератинов. Гладкомышечный актин в этих опухолях не выявляют. Как правило, рецепторы эстрогена и прогестерона как в участках аденокарциномы, так и мезенхимальной дифференцировки отсутствуют.
В случаях низкой дифференцировки карциносарком мезенхимальный компонент теряет любую иммунореактивность.
Дифференциальную диагностику между различными вариантами сарком и карциносаркомой проводят с помощью иммуногистохимических исследований.
Ангиосаркома по морфологическому строению похожа на веретеноклеточную плоскоклеточную карциному, однако наличие участков сквамозной дифференцировки облегчает диагностику. Наличие участков эпителиальной опухоли подтверждает негативная реакция с сосудистыми эндотелиальными маркерами (CD34, CD31) и позитивная — с цитокератинами.
Плоскоклеточную и железисто-плоскоклеточную карциному следует отличать от плеоморфной карциномы, для которой характерна смесь любого вида роста с большим количеством причудливых гигантских клеток; это важно, так как плеоморфная карцинома более агрессивна, чем любая разновидность плоскоклеточной или железисто-плоскоклеточной карциномы молочной железы.
Аденокарциному с хондроидной дифференцировкой нужно отличать от плеоморфной аденомы. Последняя неизменно имеет миоэпителиальный компонент (который иногда может доминировать), растущий вокруг пространств, ограниченных доброкачественными эпителиальными клетками. Миоэпителиальные клетки не определяют в аденокарциномах с хондроидной дифференцировкой.
Большинство известных метапластических карцином имели размер более 3-4 см. Метастазы в регионарных лимфатических узлах выявляли относительно редко. В подмышечные лимфатические узлы метастазируют приблизительно 10-15% опухоли с плоскоклеточной метаплазией, около 19-25% с костно-хрящевой. Отдаленные метастазы отмечены в 21 % случаев смешанной эпителиально-мезенхимальной метапластической карциномы.
Метапластические карциномы в лимфатических узлах сохраняют кроме участков рака и очаги метаплазии, как и в первичной опухоли.
Карциносаркомы очень агрессивные опухоли. При этом эпителиальный и мезенхимальный компоненты опухоли могут метастазировать как совместно, так и поодиночке.
5-летняя выживаемость больных карциносаркомами с костно-хряшевой дифференцировкой составляет 28-68%. Выживаемость больных с верстеноклеточной или плоскоклеточной карциномой составляет 5 лет в 63% случаев. Вовлечение лимфатических узлов в опухолевый процесс всегда связано с более агрессивным клиническим течением.
Среди плоскоклеточных карцином акантотический вариант является самым агрессивным.
На сегодня существует недостаточно информации об эффективности лечения метапластических карцином.
Л.М. Захарцева, М.В. Дятел, А.В. Григорук
источник







