Рак молочной железы (РМЖ) – онкологическое заболевание у женщин, которое диагностируется достаточно часто и ежегодно оно уносит жизни миллионов матерей, сестер, жен и дочерей. Наиболее сложным в лечении подтипом онкологии груди считается ТНРМЖ (трижды негативный рак молочной железы).
Попробуем разобраться, что такое тройной негативный рак молочной железы. Большинство злокачественных опухолей молочных желёз имеют определённые белковые структуры на поверхности клеток – так называемые, рецепторы. В настоящее время выделяют 3 вида клинически значимых рецепторов: рецепторы эстрогенов (ER), прогестерона (PgR) и HER 2/neu. Благодаря наличию этих рецепторов можно воздействовать на опухоль: например при избыточном наличии гормональных рецепторов, опухоль относится к гормонозависимой, и эффективно поддаётся лечению при помощи гормональной терапии. При наличии HER 2/neu рецепторов рационально назначение препаратов, относящихся к моноклональным антителам. А вот трижды негативный рак молочной железы не имеет в своей структуре этих молекул, а значит, и не имеет терапевтических мишеней для его лечения. Помимо вышеописанного, данный вид рака отличается чрезвычайно агрессивным течением и ранним метастазированием. Гистологически (то есть по строению тканей) ТНРМЖ чаще всего относится к базальноподобному и к низкодифференцированному протоковому раку.
Рак молочной железы с тройным негативным фенотипом встречается в 10-24% случаев от всех злокачественных опухолей данной локализации. Статистика по выживаемости у разных исследователей различная, но основная тенденция заключается в том, что прогноз у данной группы пациентов хуже, чем при других формах злокачественных опухолей грудной железы.
Трижды негативный рак молочной железы чаще всего развивается у молодой группы пациенток. Учитывая его высокую скорость роста и ранее метастазирование, симптомы протекают стремительно, и большинство женщин упускают тот ранний период развития, на котором ещё возможно излечение. Заболевания начинается, как правило, с образования небольшого уплотнения в молочной железе, на ощупь абсолютно безболезненного. За короткий промежуток времени, карцинома значительно увеличивается в размерах. Молочная железа становится плотной, напряжённой, малоподвижной. Кожа над опухолью воспалена, гиперемирована (интенсивно красного цвета). Могут определяться увеличенные подмышечные лимфоузлы. Чаще всего, именно на этом этапе женщина и обращается к врачу.
Нужно сказать, что эффективность маммологического скрининга для данной патологии чрезвычайно низкая, так как опухоль за 1 год между профилактическими исследованиями успевает перейти в экспансивную стадию развития.
Учитывая клиническую картину воспаления, даже врачами допускаются диагностические ошибки: часто назначается противовоспалительное лечение, антибиотикотерапия, что впоследствии затягивает время и ухудшает прогноз.
Диагностический поиск для данной молекулярно-генетической формы опухоли ничем не отличается от таковой для других типов и включает в себя следующие исследования: маммография, УЗИ, компьютерная томография, пункция с последующей биопсией; но основной акцент отдаётся иммуногистохимическому исследованию (ИГХ — исследование).
ИГХ – исследование это метод, который позволяет на молекулярном уровне выявить у опухоли те самые рецепторы, на которые и будет направлено терапевтическое воздействие. Материал для исследования берётся либо во время пункции, либо во время хирургического вмешательства.
Единственным методом, который может излечить пациентку с тройным негативным раком молочной железы является хирургическое вмешательство. Объём операции зависит от степени местного распространения (разрастания) опухоли, от наличия или отсутствия поражения регионарных лимфоузлов и наличия отдалённых метастазов. Но учитывая тот факт, что чаще всего данная форма рака диагностируется на достаточно поздней стадии – основной операцией является мастэктомия (удаление молочной железы).
В последующем хирургическое лечение дополняют химиотерапией (с включением антрациклинов и таксанов) и лучевой терапией.
Лечение больных ТНРМЖ при помощи гормонотерапии и анти-HER-2 терапии неэффективно.
В целом, если заболевание выявлено на ранней стадии, то прогноз – благоприятный. Необходимые профилактические мероприятия сводятся к регулярному проведению самообследования молочных желёз; и при наличии малейших отклонений – своевременное обращение к специалисту.
Кроме того медицина активно ищет новые пути лекарственного воздействия на опухоль: исследуются новые рецепторы на поверхности мембран клеток, на которые можно воздействовать, интенсивно апробируются современные препараты. Так, что в будущем, есть надежда излечивать пациенток даже на поздних стадиях.
источник

Трижды негативный рак молочной железы — весьма распространенное на территории нашей страны онкологическое заболевание. Подобная форма мутации клеток ткани встречается только у женщин. Анализируя медицинскую статистику, приводимую в ряде специализированных изданий, можно сделать вывод, что выживаемость пациенток в процентном соотношении несколько увеличилась, по сравнению с предыдущими годами. Количество женщин, переступивших пятилетний порог выживаемости при наличии локализованной формы заболевания, достигло 94%. А в случаях распространения метастаз – 26%. Такие высокие результаты обоснованы достижениями в области терапии рака, а именно – с применением индивидуального подхода к назначениям в каждом отдельном случае.
Говоря о подобном типе рака молочной железы, необходимо упомянуть, что он относится к гетерогенной группе новообразований. По молекулярно-генетической классификации онкологами выделяется всего четыре ключевых подтипа подобных опухолей. Каждый из которых характеризуется индивидуальными эпидо-физиологическими качествами, типичной картиной развития, прогнозированием, и выбором курса лечения. Люмиальный подтип А требует лечения гормональными препаратами, при гиперэкспрессивном her2/new – назначают лечение препаратами «Лапатиниб», «Пертузумаб» и «Трастузумаб».
Эффективность локализованного способа лечения ключевых, при опухолях грудных желез, мишеней, например: прогестероновых и эстрогенновых рецепторов или онкопротеинов по типу her2/new, обуславливает успехи, которые достигнуты в терапии этого заболевания.
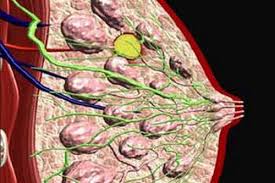
Но эти прогрессивные методы совершенно неприменимы, когда классическое лечение сталкивается с диагностикой базальноподобного рака. Это одно из самых прискорбных поражений в истории отечественной и современной онкологии. Базальноподобный и трижды негативный рак молочных желез по типу her2/new – это не совсем подобные опухоли, хотя в медицинской практике их довольно часто используют как термины-синонимы.
Примерно 73% базальноподобных форм характеризуются тройным негативным фенотипированием. И только в 27% случаев трипл-рак не будет базальноподобным. В эту категорию включены мало распространенные, гистологические подвиды рака молочных желез. А около 20% базальноподобных образований не подлежат фенотипированию по трижды негативному признаку.
На практике, чаще используются иммуногистохимические способы исследования этого рака, поскольку они дают более точные клинические результаты и доступнее, чем молекулярно-генетические.
Клинические характеристики трипл-рака молочной железы типа her2/new, его лечение и принципы метастазирования – давно постигнуты и каталогизированы. Он встречается в 22% от общего количества онкологических случаев, у женщин в возрасте до тридцати лет. Данный тип по агентам риска абсолютно противоположен люмиальному классу опухолей. Чаще всего her2/new выражается в виде образования протоковой карциномы с низкой дифференциации. Отличительная черта этого вида рака – высокая скорость роста, поэтому, когда назначается несвоевременное или неправильное лечение, выживаемость среди пациенток становится минимальной. После прохождения активной стадии мутации, рак становится агрессивен, провоцирует быстрое разрастание метастаз, и, впоследствии – дает неутешительный прогноз на излечение. По статистическим данным, при осложненной форме от момента диагностирования опухолевого процесса до летального исхода – проходит всего 10 месяцев. При обильном метастазировании трижды негативного рака молочной железы – выживаемость всего полгода. Для сравнения, при люмиальном А подтипе этот срок составляет более двух лет, а при люмиальном В подтипе – 1,7 года.
Сколько живут с раком груди? Одной из отличительных особенностей трижды отрицательного рака молочных желез, является комбинирование двух крайностей — плохой выживаемости и высокой степени чувствительности опухолевых клеток к воздействию цитостатиков. Особенно эту черту можно отметить, когда лечение проводится при помощи неоадъювантных химиопрепаратов.
У женщин с her2/new после проведения химиотерапевтического курса возрастает результативность значимой морфологической реакции, а так же, можно говорить о двух и даже трех летней выживаемости безрецидивного типа. Вопрос подбора оптимальной формы лечения данного типа рака до сих пор остается актуальным, хотя в государственных клиниках уже принята схема лечения таксанами и антрациклинами. Высокую эффективность показал терапевтический курс, состоящий из препаратов «Доксорубицин», «Доцетаксел» и « Циклофосфамид». При таком способе частота полноценной морфологической регрессии составляет 42%.
Отдельно нужно сказать об использовании в лечении платиносодержащих препаратов. После приема таких лекарств, в организме женщины нарушается синтез ДНК структур, путем появления дополнительных межнитиевых сшивок. К сожалению, лечение таким способом оправдано только при наличии у пациентки ассоциированных, наследственных трижды негативных видов рака молочных желез.
Говоря о выживаемости после адъювантной терапии, необходимо упомянуть о проведении нескольких сравнительных анализов, которые наглядно продемонстрировали эффективность различных методов лечения при разных подтипах трижды негативного рака. Оценивая их результаты, можно смело утверждать, что лечение адъювантной химиотерапией гораздо продуктивнее у женщин, которые еще не достигли возраста менопаузы. Отмечается повышение продолжительности жизни на 9% при оговариваемом сроке в 15 лет, с условием отсутствия рецидивов.
У женщинс эстрогеннегативным типом рака различия между общей и безрецидивной продолжительностью жизни выражены не так ярко. Поэтому, с учетом всего потенциала развития трипл-негативного рака грудных желез, самым перспективным для этого случая определен выбор усиленного режима химиотерапии и сокращение разрывов между лечебными подходами. После такого лечения отмечается значительное поднятие безрецидивного и общего порога длительности жизни.
В течение нескольких последних лет проводятся исследования, которые позволят выявить возможность применения антиогинезных угнетающих веществ в терапии трпл-рака молочных желез. Пациентки, которые вошли в центральную группу, в качестве дополнения к основному лечению антрациклинами, получают «Бевацизумаб» на протяжении всего курса химиотерапии. Заключительные результаты показали возросшие шансы на выживаемость в трех летний безрецидивной срок.
А значит, для эффективного повышения порога выживаемости при типл-раке молочной железы – наиболее оптимально подходит стратегия индивидуализации по максимальным клиническим показателям. Однако никаких типизированных специфических рекомендаций общего порядка не существует, и это онкологическое заболевание все еще характеризуется достаточно высоким процентом смертности.
источник
Медуллярный рак (карцинома) молочной железы встречается редко. Опухоль отличается злокачественным характером и быстрым ростом. Развитие медуллярного сопровождается симптомами, свойственным доброкачественным новообразованиями. Поэтому при подборе тактики лечения учитываются данные гистологического исследования проблемных тканей.
Медуллярный рак — это редкий вид злокачественных опухолей, поражающих молочные железы. Карцинома диагностируется в 5-7% случаях онкологических заболеваний груди. Развитие рака происходит по типу доброкачественных новообразований (фиброаденому).
Опухоль поражает преимущественно женщин в возрасте 45-55 лет. В 10% случаев медуллярный рак диагностируется у пациенток моложе 35 лет.
Медуллярный рак характеризуется быстрым ростом и поздним метастазированием. По мере развития новообразования опухолевый процесс затрагивает связочный аппарат молочной железы, вследствие чего на поверхности последней формируются крупные полосы.
В 5% случаев медуллярный рак поражает обе груди. На УЗИ-аппарате опухоль визуализируется как узел плотной консистенции, неотличимый от доброкачественного новообразования.
Медуллярный рак не содержит рецепторы, чувствительные к эстрогену и прогестерону. Поэтому в лечении опухоли не применяются гормональные препараты.
Важная особенность медуллярного рака заключается в том, что диагностировать карциному удается только на основании результатов гистологического исследования. Иные методы обследования при этом новообразовании не дают точных результатов.
Медуллярный рак молочных желез развивается под действием аналогичных факторов, что и другие злокачественные новообразования. У большинства пациенток опухоль возникает на фоне гормонального дисбаланса либо патологий репродуктивных органов.
Установлена взаимосвязь между мутацией генов BRCA 1 и BRCA 2.
Перерождение клеток молочной железы в раковые новообразования происходит преимущественно под воздействием эстрогена (опухоли типа ER). Также возможна трансформация из-за активности прогестерона (опухоли типа PR). Оба фактора объясняют, почему карциномы часто образуются на фоне гормонального дисбаланса.
В отдельную группу выделяют опухоли базальноподобного типа. Такие карциномы прорастают из базального слоя молочных желез. Базальноподобный рак плохо поддается терапии.
К числу возможных причин, провоцирующих развитие опухолевого процесса в груди, относят:
- воспалительные заболевания матки и яичников;
- ранняя менструация (до 11 лет);
- прерывание беременности (особенно опасны аборты при первой беременности);
- отсутствие лактации, ранний отказ от грудного вскармливания;
- отсутствие беременности;
- эндокринные заболевания;
- ожирение.
Спровоцировать опухолевый процесс способны ионизирующее излучение и контакт с канцерогенными веществами. В группу риска развития медуллярного рака входят курящие женщины.
Медуллярный рак характеризуется бессимптомным развитием. Первые признаки, указывающие на течение опухолевого процесса в молочных железах, возникают, когда новообразование достигает 2-3 см в диаметре.
При пальпации проблемной зоны выявляются плотные участки узловатой формы. По мере прогрессирования опухолевого процесса клиническая картина дополняется болевыми ощущениями в груди, увеличенными локальными лимфоузлами, нарушением дыхания. Новообразование оказывает токсическое воздействие на организм, из-за чего у пациентки отмечаются:
- побледнение кожи;
- резкое снижение веса;
- общая слабость;
- повышенная утомляемость и другие симптомы интоксикации.
Опухолевый процесс вызывает аномальные выделения из сосков. Из-за распространения раковых клеток нарушается целостность кожного покрова на груди. Со временем размер и число ран на поверхности молочных желез увеличивается.
В случае если опухоль локализуется возле ареолы, диагностируется синдром втяжения соска. Этот симптом становится более выраженным, когда пациентка заводит руки за голову.
Запущенный медуллярный рак прорастает в ткани связочного аппарата. Из-за этого на поверхности груди формируются тяжи.
Если опухоль дает метастазы, клиническая картина дополняется симптомами дисфункции тех органов, в которые проникли раковые клетки.
При уплотнениях в молочных железах назначаются УЗИ и маммография. Оба метода помогают визуализировать опухоль и определить локализацию карциномы. Чтобы определить структурные особенности новообразования, назначают МРТ и КТ.
Важным диагностическим мероприятием считается биопсия. Последняя назначается при подозрении на злокачественный характер опухоли.
При медуллярном раке указанные методы диагностики не способны определить тип новообразования. Для этого необходимо провести гистологическое исследование проблемных тканей. Забор последних иногда проводится через открытую полость, формируемую в молочной железе.
Медуллярный рак дифференцируется с другими новообразованиями на основании пяти признаков. Карцинома на 75% состоит из злокачественных клеток, объединенных в тяжи и разделенных соединительной тканью.
При гистологическом исследовании проблемной ткани не выявляются железистые и тубулярные структуры. Капсула у медуллярного рака диффузно-инфильтрированная.
Важной особенностью карциномы является наличие одного крупного и нескольких мелких ядер (ядерный полиморфизм) в составе клеток, большая часть которых заполнена цитоплазмой. Медуллярный рак обычно не прорастает за пределы первоначальной локализации. От здоровых клеток опухоль отделает выраженный слой фиброзной ткани.
При медуллярном раке показано комплексное лечение. Однако основным методом, применяемым в терапии этой опухоли, является хирургическое вмешательство.
Тактика лечения подбирается с учетом индивидуальных особенностей пациента и типа карциномы. Нередко хирургическое вмешательство предваряет химиотерапия, которая помогает уменьшить размеры рака.
При агрессивной форме опухоли показана радикальная мастэктомия. В ходе этой операции полностью удаляется пораженная молочная железа и ткани, вовлеченные в патологический процесс. После радикальной мастэктомии проводится курс лучевой или химиотерапии. Такое лечение помогает уничтожить оставшиеся раковые клетки, распространившиеся по другим отделам организма.
При небольших (до 4 см в диаметре) карциномах применяется лампэктомия. Метод предусматривает частичное иссечение молочной железы. В ходе лампэктомии удаляется опухоль. При этом функции молочной железы сохраняются.
После лампэктомии временно снижается чувствительность груди. Объясняется это тем, что во время операции повреждаются нервные волокна. По мере восстановления тканей возвращается чувствительность кожи.
В запущенных случаях, когда опухоль дала метастазы в отдаленные органы, применяются паллиативные методы лечения. Этот подход предусматривает удаление опухоли, а также проведение лучевой и химиотерапии.
После операции пациентке назначается прием обезболивающих и иных препаратов, которые купируют сопутствующие симптомы. Паллиативная терапия призвана облегчить состояние женщины, но не вылечить медуллярный рак.
При необходимости врач корректирует выбранную схему терапии. Это происходит после изучения гистологической структуры лимфатического узла, удаленного из подмышечной впадины. Если в тканях выявляются раковые клетки, проводится полное удаление молочной железы, после которого назначается курс лучевой либо химиотерапии.
Продолжительность реабилитационного периода после мастэктомии определяется индивидуальными особенностями пациента и степенью вмешательства. В среднем на восстановление организма уходит одна неделя. По завершении лечения пациенткам необходимо регулярно проходить обследование у маммолога, чтобы заранее выявить рецидив опухоли.
Химиотерапия как отдельный метод лечения применяется, если размеры злокачественного новообразования не превышают 2 см.
Медуллярный рак относится к числу наиболее «благоприятных» злокачественных новообразований, поражающих молочные железы. При условии своевременно проведенного лечения 10-летняя выживаемость наблюдается у 50-90% пациенток.
Этот показатель определяется в зависимости от характера границ карциномы, степени инфильтрации и наличия метастаз. Однако после обнаружения медуллярного рака все пациентки проживают первый год. Ситуация меняется позднее.
Если карцинома имеет четкие границы, то выживаемость среди пациентов в первые 3 года составляет 100%, 5 — 10 лет — 87%. При новообразованиях с неравномерными границами показатель меняется практически сразу. С третьего года жизни смертность среди пациенток достигает 8%, 5 лет — 24%, 7 лет — 34%, 10 лет — 76%.
Выживаемость пациенток с карциномой, клетки которой отличаются выраженной инфильтрацией (выявляется на основании гистологического исследования) составляет 88%. Этот показатель исчисляется с третьего года. Опухоли с умеренной инфильтрацией провоцируют смертельный исход в первые 5 лет после обнаружения новообразования у 48% пациентов, 7 лет — 80%.
Когда опухоль метастазирует, показатель выживаемости меняется незначительно в сравнении с приведенными данными. Смертность в первые 3 года жизни отмечается в 8% случаях. 5 лет проживают 68% пациентов. В течение последующих лет из-за метастазирующей карциномы погибают до 47% женщин.
Медуллярный рак в сравнении с другими опухолями молочных желез хорошо поддается лечению. Рецидив карциномы в течение первых 76 месяцев после удаления наблюдается у 13% пациенток.
Профилактика медуллярного рака и других опухолей молочных желез требует соблюдения нескольких правил. Женщинам рекомендуется избегать ожирения. Избыточная масса тела увеличивает вероятность появления карциномы на 40%.
Чтобы избежать образования раковой опухоли, следует отказаться от алкоголя. Последний стимулирует работу органов, ответственных за выработку половых гормонов. Регулярное потребление алкоголя увеличивает риск появления карциномы на 12%.
Для поддержания гормонального баланса следует уделять внимание физическим нагрузкам. Регулярные упражнения снижают уровень эстрогена в крови, считающегося одной из основных причин появления раковой опухоли. Физические упражнения снижают вероятность образования карцином на 30%.
Женщинам репродуктивного и пожилого возраста необходимо раз в месяц путем пальпации обследовать состояние молочных желез. Также рекомендуется каждые 6-12 месяцев обращаться к маммологу. Эти мероприятия помогают выявить опухоли на ранней стадии развития, когда лечение наиболее эффективно.
источник
Онкологические патологии молочной железы стоят на первом месте среди женских раковых заболеваний. Медики утверждают, что это обусловлено плохой экологией и распространением гормональной контрацепции во всем мире. Среди злокачественных опухолей груди трижды негативный рак молочной железы (тройной отрицательный) диагностируется в 25% случаев, от него умирает четвертая часть пациентов. Данную патологию удается определить с помощью иммуногистохимимческой диагностики, которая недавно была внедрена в онкологическую практику. Этот вид рака молочной железы достаточно агрессивный.
Трижды негативный рак молочной железы (ТНРМЖ) – одна из разновидностей онкологической патологии, что имеет большую злокачественность и стремительное развитие. Название данный вид заболевания получил по причине отсутствия на поверхности раковых клеток рецепторов эстрогена, прогестерона и мембранного белка HER-2. Из-за их отсутствия лечение патологии затруднено, так как таргетные препараты в данном случае неэффективны. Это значит, что для лечения рака груди не используют гормональную и таргетную терапию.
Очень часто тройной негативный рак развивается у молодых женщин, при обследовании врачи обнаруживают опухоли большого размера (более трех сантиметров) в груди, а также метастазы в лимфатических узлах. Развитие патологии медики связывают с мутацией в гене BRCA1, который в норме способствует предотвращению развития онкологических новообразований в организме человека.
Точные причины развития ТНРМЖ в онкологии неизвестны. Предполагается, что это зависит от гормональных нарушений в организме, которые проявляются в период менопаузы, раннего полового созревания. Чаще всего болеют пациентки с наследственной предрасположенностью, а также те, кто длительное время употребляет гормональную контрацепцию, имел поздние роды, аборты или отсутствие в анамнезе беременности. Рак может развиваться из-за травмы молочных желез, перенесенных ранее раковых заболеваний, раннего наступления менструации.
Обратите внимание! Наличие данных факторов не говорит об обязательном развитии патологии, но риск ее появления в этом случае достаточно высок.
Также заболевание может развиваться по причине наличия у женщины доброкачественных новообразований в груди: папилломы, мастопатии, фиброаденомы и так далее. Влияют на появление онкологического недуга и стрессы, неправильное питание, большая масса тела, регулярные переутомления и прочее.
Тройной негативный рак молочной железы – опасная злокачественная болезнь, которая развивается агрессивно и стремительно, рано распространяет метастазы. Главной причиной появления патологии, по мнению медиков, выступает гормональные нарушения и повышение плотности, зернистости молочной железы.
Разновидность патологии зависит от присутствия чуткости раковых клеток к определенным составляющим лечения. В онкологии принято выделять следующие формы трижды негативного рака молочной железы:
- Люминальный А – раковое новообразование появляется во время менопаузы и имеет зависимость от эстрогена, поэтому может лечиться при помощи терапии гормонами.
- Люминальный В – злокачественная опухоль, что имеет чуткость к эстрогену и мембранному белку HER-2. Гормональной терапии опухоль плохо поддается, прогнозы обычно плохие.
- HER-2-позитивный – опухоль груди, которая восприимчива к эстрогену и выступает агрессивной формой заболевания.
- Базальноподобный — трижды негативный рак молочной, он самый злокачественный, прогноз имеет неутешительный.
Обратите внимание! Базальноклеточный рак встречается у женщин в 70% случаев диагностирования ТНРМЖ.
Признаки опухоли груди зависят от причин ее развития и связаны с гистологическими характеристиками новообразования. Симптомы тройного негативного рака похожи на проявление опухолей иных типов и проявляются в виде втягивания соска, деформации кожного покрова, изменения формы груди, выделений из соска красного или желтого оттенка.
На начальных стадиях опухоль имеет незначительный размер, но она склонна стремительно расти и вызывать появление болевого синдрома. Карцинома разрушает ткани железы, что провоцирует развитие воспаления.
К основным признакам патологии относят:
- появление уплотнения в груди;
- выделения красного оттенка из соска;
- увеличение размеров лимфатических узлов;
- изменение и уплотнение кожного покрова.
Обратите внимание! Признаки заболевания схожи с симптомами мастопатии. На начальном этапе онкология не проявляет симптомов, возможно обнаружение подвижного уплотнения при пальпации.
Тройной негативный рак молочной железы имеет несколько стадий развития, которые зависят от размера новообразования, распространения метастаз по всему организму. В онкологии выделяют следующие степени злокачественности новообразования:
- Нулевая стадия характеризуется появлением небольшого новообразования, что не выходит за пределы структуры, не распространяет метастазы.
- Первая стадия обуславливается выходом раковых клеток за пределы структуры, ростом опухоли до двух сантиметров в диаметре. Метастазирование не происходит.
- Вторая степень злокачественности, при которой опухоль вырастает до пяти сантиметров, распространяет метастазы в лимфаузлы, расположенные на пораженной стороне. При этом опухоль не прорастает в ткани и органы.
- Третья стадия обуславливается ростом новообразования более пяти сантиметров, сильным увеличением лимфа узлов, которые тесно соединяются с органами.
- Четвертая стадия характеризуется наличием большого размера опухоли, которая прорастает в соседние ткани и органы, головной мозг. На этой стадии вылечить ТНРМЖ нельзя.
При несвоевременном лечении у онкобольного развивается раковая кахексия, накопление жидкости в плевральной полости, внутренние кровотечения, расстройства ЦНС. Нередко наблюдается развитие слепоты, печеночной недостаточности. После использования в качестве лечения химиотерапии и хирургической операции также могут развиться негативные последствия.
Трижды негативный рак молочной железы требует применения различных диагностических методов. Самым распространенным из них выступает маммография груди, что дает возможность определить любые изменения в органе, выявить уплотнения. Затем врач назначает биопсию, чтобы определить характер опухоли. Дуктография применяется для выявления внутрипротоковых папиллом, которые могут трансформироваться в раковую опухоль.
Если данные диагностические методики позволили определить онкологическое заболевание, проводят диагностику лимфаузлов методом УЗИ, рентгенографии, изотопного сканирования. Обязательным анализом является тест крови на онкомаркеры, а также на наличие рецепторов к гормонам прогестерон, HER-2 и эстроген. Всегда проводится цитологическое исследование выделяемого из соска.
Чтобы назначить правильное лечение, проводится дифференциальная диагностика. Врач дифференцирует патологию с такими заболеваниями, как гормональные нарушения, фиброаденома, ареолярный абсцесс, киста, внутрипротоковая папиллома.
Обратите внимание! По результатам комплексного обследования врач назначает необходимое лечение, которое подбирает индивидуально в каждом конкретном случае.
Негативный рак молочной железы лечится несколькими методами, главным из которых является хирургическое вмешательство. Врач может использовать различные методики в зависимости от степени распространенности патологического процесса, наличия метастаз и так далее. В незапущенных случаях используется удаление опухоли и окружающих тканей. Обычно такое лечение применяется при первой и второй стадии патологии, оно обязательно сочетается с лучевой терапией.
При распространении патологии производится квадрантэктомия – удаление новообразования с четвертой частью молочной железы. Нередко медики прибегают к полному удалению молочной железы. Если это сделано на ранней стадии заболевания, то прогноз будет хорошим.
В онкологии применяют и другие методы и технологии. Если новообразование неоперабельное, проводят лучевое облучение, радиотерапию.
Химиотерапия может оказаться эффективной при лечении рака, врач подбирает цитостатики, которые способны справиться с новообразованием. Если первый курс химиотерапии оказался неэффективным, медики меняют препараты, добавляют новые компоненты. Таргетная терапия не используется для лечения патологии, так как является в данном случае неэффективной.
Трижды негативный рак при беременности имеет несколько путей решения:
- Откладывание лечения до момента родов, при этом риск возникновения смертельного исхода женщины очень высок.
- Прерывание беременности и проведение полного лечения женщины.
Обратите внимание! Беременная женщина сама решает, какой путь лечения ей выбрать.
Показатель выживаемости при ТНРМЖ невысокий, что обусловлено часто возникающими рецидивами патологии через некоторое время после химиотерапии. Если заболевание было выявлено на третьей или четвертой стадии, лечение будет неэффективным, а прогноз – неблагоприятным. Поэтому ответ на вопрос о том, сколько живут с ТНРМЖ, будет зависеть от степени развития патологии, используемых химических препаратов и особенностей организма женщины. При эффективном лечении возможна трехлетняя выживаемость без появления рецидива.
Так как онкологи предполагают влияние генетической природы на заболевание, специальных методов его профилактики не существует. Женщины, которые входят в группу риска, должны два раза в год проходить обследование у маммолога.
источник
Трижды негативный рак молочной железы — агрессивный вариант злокачественной неоплазии груди, при котором опухолевые клетки не имеют рецепторов к эстрогену, прогестерону и эпидермальному фактору роста. Проявляется наличием плотного объемного образования, выделениями из соска, деформацией молочной железы, изменениями кожи, увеличением регионарных лимфоузлов. Диагностируется с помощью УЗИ, маммографии, цитологического и иммуногистохимического анализа. Лечение комбинированное с радикальной мастэктомией, лучевой терапией и назначением нескольких цитостатических препаратов.
Трижды негативный, или трипл-отрицательный (Triple negative) рак молочной железы встречается у 10-20% пациенток с диагностированным злокачественным новообразованием груди. В отличие от люминальных форм опухолевого процесса (гормонозависимого и HER2/Neu подтипов), ТНРМЖ поражает преимущественно женщин молодого возраста, имеет другие факторы риска и менее дифференцированную морфологическую структуру. Такие новообразования характеризуются высокой пролиферативной активностью, агрессивным течением с очень быстрым ростом и висцеральным метастазированием. Это обуславливает особое значение своевременного выявления патологии, поиска новых форм терапии, первичной и вторичной профилактики.
Единой теории возникновения этой формы злокачественных неоплазий пока не существует. С наибольшей вероятностью её развитие является результатом генетических аномалий. О наследственной природе неопроцесса свидетельствуют данные многолетних статистических наблюдений, проводимых специалистами в сфере онкологической маммологии, и исследования структуры ДНК:
- Наличие рака груди в роду. При трижды негативном раке молочной железы корреляция между заболеваемостью и сведениями о злокачественных неоплазиях грудных желез у родственников наиболее заметна. Эта форма рака принадлежит к категории так называемых семейных опухолей.
- Распространенность в отдельных этногруппах. Трипл-отрицательный рак груди чаще встречается у женщин негроидной расы, особенно афроамериканцев. Это может свидетельствовать об активности определенных наследуемых генов.
- BRCA мутации. У пациенток с трижды негативным новообразованием часто определяются мутации в BRCA-1 гене. Этот участок ДНК является онкосупрессорным и в норме отвечает за синтез защитных факторов, предотвращающих малигнизацию клеток.
- Активный онкоген FAM83B. По наблюдениям американских ученых, избыточная экспрессия этого гена изменяет поведение нормальных клеток, вызывая в них проявление опухолевой активности. Удаление гена позволяет подавить пролиферацию клеток неоплазии.
Из других факторов, повышающих риск развития трижды отрицательной опухоли молочной железы, онкомаммологи отмечают длительный неконтролируемый прием оральных контрацептивов, радиационные воздействия при лучевой терапии некоторых заболеваний, травмы грудной железы. Прямой зависимости между этой патологией и дисгормональными состояниями не выявлено.
Поскольку на поверхности раковых клеток при трижды отрицательных объёмных образованиях отсутствуют специфические рецепторы к женским половым гормонам и онкопротеину, механизм их роста отличается от патогенеза других форм рака, не связан с циклическими изменениями в женском организме. Вероятнее всего, развитие неоплазии обусловлено подавлением процессов апоптоза (запрограммированной гибели клеточных структур) и опухолевой супрессии. По данным исследований, у больных с трижды негативными новообразованиями инактиварован белок GDF11, обладающий супрессорным эффектом. По пока непонятным причинам созревание протеина в атипичных клетках останавливается, и он накапливается в неактивной форме. Это способствует быстрому неконтролируемому росту злокачественного образования с низкой дифференциацией клеток и их диссеминацией по организму. Самый частый вид ТНРМЖ — низкодифференцированная протоковая карцинома.
Систематизация форм трижды негативного рака молочных желез еще продолжается. Заболевание представлено несколькими подтипами, которые отличаются степенью агрессивности, но пока не выделены в самостоятельные клинические группы. Наиболее распространенной является классификация опухоли с учетом особенностей гистологического строения:
- Базальноподобный ТНРМЖ. В 70-75% случаев рак является базальноподобным. Но эти термины не синонимичны, поскольку до 20% неоплазий с такой гистологией не относятся к категории трижды негативных.
- Небазальноподобный ТНРМЖ. До 25% трижды отрицательных опухолей принадлежат к категории редких гистологических вариантов, таких как, например, плоскоклеточная и апокриновая карциномы.
Клинические проявления трижды негативной опухоли существенно не отличаются от симптоматики других разновидностей рака молочных желез, однако скорость развития опухолевого процесса является более высокой. Основной симптом неоплазии — наличие плотного малоэластичного объемного образования в тканях грудных желез, которое женщина может выявить случайно или во время самообследования. На начальных этапах уплотнение безболезненное, по мере роста, приводящего к сдавливанию и прорастанию окружающих тканей, может возникнуть боль, не связанная с фазами менструального цикла. Отличительная особенность трипл-негативного рака — быстрое увеличение размеров. Часто наблюдается втяжение сосков, увеличение объема молочной железы из-за ее отека, уплотнение кожи вследствие нарушения лимфоотока, изменения кожи над опухолью.
У большинства пациенток отмечаются выделения из сосков, обычно – жидкие желтоватые или кровянистые. В подмышечной области на стороне поражения рано начинают определяться увеличенные лимфатические узлы. По мере прогрессирования заболевания появляются признаки опухолевой интоксикации: слабость, быстрая утомляемость, отсутствие аппетита, резкое снижение веса, у ряда пациенток — зуд кожи и суставные боли. Метастазирование ТНРМЖ сопровождается нарушением функций пораженных органов и систем: желтушностью кожных покровов, кашлем, одышкой, потерей зрения, судорожными припадками и признаками органных нарушений.
Трижды негативный рак грудных желез — один из самых неблагоприятных видов злокачественных неоплазий. Его основным осложнением является быстрое метастазирование с развитием вторичных очагов в различных органах. Переход заболевания в терминальную стадию сопровождается раковой кахексией и, в зависимости от локализации метастазов, накоплением жидкости в плевральной полости, легочными кровотечениями, грубыми расстройствами со стороны ЦНС, печеночной недостаточностью, слепотой и др. Отдельную группу осложнений составляют последствия применяемых химиотерапевтических, лучевых и хирургических методов лечения.
Крайне агрессивный характер опухолевого процесса при ТНРМЖ обуславливает важность раннего выявления неоплазий. Задачами диагностического этапа являются оценка размеров и локализации новообразования, подтверждение его морфологических и иммуногистохимических особенностей, обнаружение регионарных и отдаленных метастатических очагов. Пациентке рекомендованы следующие исследования:
- УЗИ груди и маммография. Первичные методы диагностики позволяют определить в молочной железе объемное образование, получить данные о его размерах и расположении, обнаружить метастазы в аксиллярных лимфоузлах. Результаты, полученные с помощью сонографии и рентгенографии, неспецифичны и соответствуют признакам других злокачественных опухолей. ТНРМЖ можно заподозрить по большим размерам неоплазии (3-5 см и более).
- Цитологическая и иммуногистохимическая диагностика. Является вторым этапом обследования при подозрении на трижды негативный опухолевый процесс. Материал для исследования получают с помощью пункционной или трепан-биопсии. При микроскопии в препарате определяются преимущественно низкодифференцированные клетки. Иммуногистохимический анализ показывает, что на их мембранах отсутствуют эстрогенные, прогестероновые и HER-2-рецепторы.
После лабораторного подтверждения диагноза назначают инструментальные методы для выявления метастазов в других органах (МРТ, КТ, рентгенографию грудной клетки в двух проекциях и др.). С помощью общеклинических и биохимических методов оценивают функциональное состояние различных систем. Заболевание дифференцируют с доброкачественными опухолями молочных желез и другими формами рака груди. К постановке диагноза привлекают онколога, при необходимости — терапевта, гастроэнтеролога, пульмонолога, гематолога, невропатолога, окулиста, нейрохирурга, анестезиолога-реаниматолога.
Обнаружение у пациентки трижды негативной формы рака молочных желез требует быстрого подбора методов, направленных на уничтожение основной опухоли и метастатических очагов. Тактика ведения каждой больной определяется индивидуально, учитывается агрессивный рост и низкая чувствительность неоплазии к химиотерапевтическим препаратам. Терапевтическая схема назначается консилиумом специалистов и представляет комбинированный вариант радикального лечения, в который входят:
- Хирургическое удаление опухоли. Как правило, выполняют радикальную мастэктомию с полным удалением молочной железы и регионарных лимфатических узлов, обычно пораженных раковыми метастазами. Такая операция относится к разряду травматичных, но снижает вероятность рецидива.
- Лучевая терапия. Воздействие на ложе опухоли и региональные пути оттока лимфы радиационными лучами дает возможность уничтожить малигнизированные клетки, которые могли остаться после проведения операции. Участки облучения и терапевтические дозы определяет радиолог с учетом данных, полученных на диагностическом этапе.
- Химиотерапия. Из-за отсутствия рецепторов к эпидермальному онкопротеину и половым гормонам такой рак отличается низкой чувствительностью к традиционной гормональной и таргетной терапии. Для лечения пациенток обычно применяют полихимиотерапию. Проведение генопрофилирования позволяет более точно подбирать препараты.
Прогноз при трижды отрицательном раке молочных желез обычно хуже, чем при других вариантах злокачественных неоплазий. Правильный подбор полихимиотерапевтической схемы с назначением современных цитостатиков обеспечивает трехлетнюю выживаемость 65-68% пациенток с ТНРМЖ. По прошествии пятилетнего безрецидивного периода прогноз становится таким же, как при других видах рака груди. Результаты лечения во многом зависят от стадии, на которой обнаружена опухоль. С учетом предположительно генетической природы заболевания специфические методы первичной профилактики отсутствуют. Женщинам, имеющим родственниц с семейными формами рака, рекомендовано дважды в год, а при наличии показаний и чаще проходить обследование у маммолога и УЗИ- или маммографический скрининг.
источник
Базальноподобный рак молочной железы: молекулярные профили, клинические особенности и результаты выживания
Basal-like представляет собой важный молекулярный подтип рака молочной железы, характеризующийся агрессивным поведением и ограниченным терапией. Однако исход пациентов в этом подтипе расходится. У некоторых людей повышенный риск смерти в первые пять лет, а у других — длительное выживание более десяти лет после диагноза. В этом исследовании мы стремимся определить маркеры, связанные с выживанием базальноподобных пациентов и характеризующими подгруппы с отчетливым исходом заболевания.
Мы исследовали геномные и транскрипционные профили 351 базальноподобных образцов из наборов данных METABRIC и ROCK. Для определения генов / зондов, которые дифференциально экспрессируются в опухоли и контрольных образцах, были использованы два метода отбора, помеченные фильтрами дифференциала и выживания, и связаны с общей выживаемостью. Эти зонды были дополнительно использованы для определения молекулярных подгрупп, которые изменяются на уровне микроРНК и в количестве копии ДНК.
Мы идентифицировали сигнатуру экспрессии 80 зондов, которая различает две базальноподобные подгруппы с различными клиническими особенностями и результатами выживания. Гены, включенные в этот список, в основном связаны с иммунным ответом на рак, эпителиально-мезенхимным переходом и клеточным циклом. В частности, в Basal I были обнаружены высокие уровни CXCR6, HCST, C3AR1 и FPR3; тогда как HJURP, RRP12 и DNMT3B оказались чрезмерно выраженными в базале II. Эти гены проявили наивысшую межцентральную центральность и значения степени уступов и играют ключевую роль в дифференцировке рака молочной железы в базале. Дальнейший молекулярный анализ выявил 17 miRNAs, коррелированных с подгруппами, включая hsa-miR-342-5p, -150, -155, -200c и -17. Кроме того, на хромосомах 1q, 3q, 8q, 10p и 17q были обнаружены повышенные проценты коэффициентов усиления / усиления, а потери / делеции на 4q, 5q, 8p и X, связанные с уменьшением выживаемости.
Предложенная подпись поддерживает существование по меньшей мере двух подгрупп базально-подобных раков молочной железы с выраженным исходом заболевания. Идентификация пациентов с низким риском может повлиять на принятие клинических решений путем сокращения назначения высокодозной химиотерапии и, как следствие, предотвращения побочных эффектов. Признание других агрессивных признаков в этом подтипе может также иметь решающее значение для улучшения индивидуального ухода и для определения более эффективных методов лечения пациентов с высоким риском.
Онлайн-версия этой статьи (doi: 10.1186 / s12920-017-0250-9) содержит дополнительный материал, доступный для авторизованных пользователей.
Примерно 15% всех случаев рака молочной железы имеют базисный подтип, часто агрессивные и сильно рекуррентные поражения [1-3]. Базальноподобные раковые опухоли молочной железы (BLBC) определяются отсутствием экспрессии рецепторов гормональных рецепторов (ER) и прогестерона (PR) и рецептора-фактора человеческого эпидермального роста-2 (HER2) [4, 5]. Гистологически эти опухоли показывают высокосортные, высокие митотические показатели, наличие центральных некротических или фиброзных зон, толкающие границы инвазии, лимфоцитарный инфильтрат и атипичные медуллярные особенности [6]. Слой базальной клетки молочной железы также характеризуется высокой экспрессией цитокератинов (CK5 / 6, CK14 и CK17) и рецептора эпидермального фактора роста (EGFR) среди других маркеров [7-11]. Все эти особенности способствуют ограниченному терапевтическому ответу и, следовательно, влияют на в огнеупорной природе этих опухолей [12, 13]. Таким образом, пациенты с диагнозом BLBC имеют плохой прогноз и краткосрочную безболезненную и общую выживаемость [14]. Лучшее понимание патофизиологии и молекулярной основы базальноподобных опухолей необходимо для определения результатов лечения пациентов.
На молекулярном уровне базальноподобные опухоли считаются более гомогенными, чем иммуногистохимически определенные трехкратно отрицательные раковые опухоли молочной железы (TNBC), хотя терминология используется взаимозаменяемо [1, 15]. Несмотря на относительную молекулярную гомогенность, пациенты в этой группе по-прежнему демонстрируют расходящиеся результаты [12, 14, 16]: у некоторых пациентов высокая частота смертности и рецидивов в первые 3-5 лет, в отличие от других, которые выживают более 10 лет — с нет повторения — после диагноза [12, 14, 16]. Для последней группы прогноз лучше, чем прогноз подтипа опухоли молочной железы [8, 17]. Эти наблюдения показывают, что BLBC могут состоять по меньшей мере из двух клинически различных групп с плохой или превосходной выживаемостью [10]. Молекулярная характеристика этих базальноподобных опухолей представляет особый интерес для медицины, поскольку она может дать новые идеи для понимания и управления болезнями. Поэтому определение маркеров и механизмов, участвующих в дифференциации BLBC, является важным шагом вперед в этом направлении. Более того, это позволило бы разработать индивидуальные методы лечения с более эффективными индивидуальными ответами, что привело бы к более персонализированным и консервативным вмешательствам в отношении рака молочной железы [18].
Недавнее исследование TNBC указывало на существование собственных базальноподобных подтипов с различными молекулярными структурами [19-21]. Стратификация, проведенная и описанная Lehmann et al. (2011) [19] выявили участие обогащенного клеточного цикла и компонентов клеточного деления в базальноподобном 1 (BL1); передача сигналов фактора роста, гликолизис и глюконеогенез в базальноподобных 2 (BL2); и иммунных клеток в иммуномодуляторном (IM). Авторы также определили две другие группы, частично перекрывающие базисный подтип, определенный классификатором PAM50 [22]: Mesenchymal (M) и Mesenchymal stem-like (MSL). В качестве альтернативы, Burstein и его коллеги [20] определили подтипы базальноподобного иммуноподавляемого (BLIS) и базальноподобного иммуноактивированного (BLIA). Бывший тип опухоли характеризуется множественными факторами транскрипции семейства SOX, в то время как последний описан молекулами трансляции трансляции Stat и цитокинами. Совсем недавно, Jézéquel et al. (2015) [21] указывали на две другие группы: базальноподобные с низким иммунным ответом и высокие M2-подобные макрофаги и базально обогащенные высоким иммунным ответом и малыми макрофагами, подобными M2. Все описанные выше исследования сосредоточены на исследовании молекулярной гетерогенности TNBC, частично поддерживающих друг друга.
Многоэлементные модели также применялись для прогнозирования подтипа рака молочной железы [22, 23], рецидива [24] и выживаемости [25, 26]. Выбор генов во всех образцах обычно связан с уровнями гормональной экспрессии и модулями пролиферации. Поскольку BLBC и TNBC являются гормональными рецепторами (ER и PR) отрицательными и высокопролиферативными, сила прогнозирования маркеров для дальнейшего разделения пациентов, подверженных риску в этих группах, в современных моделях имеет ограниченное значение [27]. Клинические анализы, самостоятельно моделирующие тройные отрицательные образцы, выявили превосходные способности в прогнозировании результатов ранних опухолей стадии [28, 29]. Однако эти анализы и большинство подходов были сфокусированы на иммуногистохимически определенных TNBC [10, 30, 31]. Более надежный подход для характеристики результатов БЛБ еще не разработан. Соответственно, правильное исследование BLBC остается обязательным и определяющим для пациентов, диагностированных в этом подтипе [9].
Поскольку классификация TNBC не является идеальным суррогатом для определения субъектов BLBC, характеристика базальноподобных опухолей на геномном и транскриптомическом уровнях является насущной необходимостью. В этом вкладе мы нацелены на выявление маркеров, связанных с выживанием пациентов, с использованием более крупных когорт рака молочной железы из Молекулярной таксономии Международного консорциума рака молочной железы (METABRIC) [32] и Research Online Cancer Knowledge Base (ROCK) [33]. Благодаря определению этой подписи наша цель состоит в том, чтобы расслоить 351 опухоль на базальноподобные подгруппы с различными клиническими особенностями и результатами выживания и далее описать каждый из них. Соответственно, мы планируем исследовать данные микрочипов — включая значения экспрессии гена (мРНК) и микроРНК (miRNAs) и измерения аберрации числа копий (CNA) — для расширения молекулярной характеристики BLBC, что, насколько нам известно, еще не выполнено. Оценка более полных профилей BLBC имеет значение для определения групп риска в клинических условиях и, что более важно, для улучшения ответа на терапию.
МЕТАБРИЧЕСКИЕ геномные и транскриптомические данные были загружены из Европейского архива генома-феномена (EGA) (http://www.ebi.ac.uk/ega) под номерами доступа EGAS00000000083 и EGAS00000000122. Эти общедоступные коллекции содержат генотипирование (Affymetrix SNP 6.0), нормированную экспрессию гена log2 (Illumina_Human_WG-v3) и miRNA (массивы Agilent ncRNA 60k) для более 2000 опухолей молочной железы и 144 контрольных (неопухолевых) образцов груди [32]. Первоначальное исследование METABRIC было одобрено комиссиями по изучению этики в Великобритании и Канаде (больница Адденбрука, Кембридж, Соединенное Королевство, больница Гай, Лондон, Ноттингем, Ванкувер, Манитоба). Дальнейший анализ этих данных был одобрен Комитетом по этике исследований человека (HREC) в Университете Ньюкасла, Австралия (номер разрешения: H-2013-0277).
У кого-то из METABRIC есть подробное описание долгосрочных клинических и патологических результатов пациентов. Образцы опухолей были отнесены к подтипу рака молочной железы (просвет A, просвет B, обогащенный HER2, нормальный или базальный), используя метод обучения ансамбля [34], используя набор из 50 генов, определенный Parker et al. (2009) [22]. Ранее этот подход улучшал классификацию образцов и назначение подтипов в наборе данных METABRIC и выявил большую согласованность с точки зрения клинических особенностей и результатов выживания [34]. На основе этих меток для анализа в этом исследовании было отобрано подмножество из 250 базальноподобных опухолей. Для целей обучения и тестирования это подмножество было случайным образом разбито на два набора равного размера (125), чтобы избежать возможного смещения исходной когорты. Эти комплекты в дальнейшем называются наборами обучения и валидации.
Для дополнительной проверки на разных платформах мы использовали набор данных ROCK, полученный в Gene Expression Omnibus (GEO) (http://www.ncbi.nlm.nih.gov/geo/) под номером источника данных GSE47561 [33, 35]. Этот набор данных объединяет десять различных исследований (GSE2034, GSE11121, GSE20194, GSE1456, GSE2603, GSE6532, GSE20437, GSE7390, GSE5847 и E-TABM-185), выполненных по технологии Affymetrix HG-U133A. Скомпилированная матрица содержит log2 RMA перенормированные значения экспрессии гена для 1570 опухолевых образцов, 101 из которых имеют базисный подтип. Набор данных ROCK включает репрезентативную информацию для анализа выживаемости, однако в ней отсутствуют стандартные клинико-патологические данные, которые поэтому не были рассмотрены в этом исследовании.
Поскольку первая цель нашего исследования состоит в том, чтобы идентифицировать маркеры, обеспечивающие выживаемость среди базальноподобных пациентов, мы разработали метод фильтрации, чтобы выбрать репрезентативную сигнатуру зонда и уменьшить смещение, возникающее из-за большого количества зондов (48 803) и небольшого количества образцов ( 125) в учебном наборе. Мы определили два соответствующих критерия для выбора зондов, которые участвуют в инициировании опухоли и / или прогрессировании, а также коррелируют с выживанием, как подробно описано ниже.
Дифференциальный фильтр [36] использовался для отбора зондов с различными уровнями экспрессии между опухолями и контрольными группами. Основополагающее предположение состоит в том, что зонды, которые действительно коррелируют с раком молочной железы, связаны с геномными изменениями или изменениями от здоровой к раковой ткани. Мы применили Дифференциальный фильтр к каждому из зондов 48803 для проверки их разделительной способности между 125 опухолями и 144 элементами управления. Этот фильтр проверяет три возможных случая: уровни экспрессии в опухолях (a) ниже, чем (b) выше или (c) ниже и выше, чем в контрольных образцах. Последний случай относится к генам, которые регулируются в некоторых опухолях и понижаются в других, тогда как уровни экспрессии контроля лежат между этими двумя группами. Чтобы вычислить p-значение для этого случая, мы отразили все уровни экспрессии с одной стороны относительно среднего значения элементов управления. Мощность разделения каждого зонда определялась как минимальное значение p-значения Wilcoxon, рассчитанное для трех случаев. Чтобы определить количество зондов, проходящих через дифференциальный фильтр, мы построили упорядоченные log10-нормированные p-значения против соответствующих рангов зонда. Порог был установлен приблизительно в точке наивысшей кривизны этой функции. Этот порог основан на естественно возникающем системном поведении и не требует внешнего определения. Пробки, проходящие через этот фильтр, называются дифференциальным зондом.
Фильтр выживания [36] использовался для дальнейшей идентификации зондов, для которых уровни экспрессии связаны с выживанием пациентов. Этот фильтр использует оценку Каплана-Мейера для вычисления вероятностей выживаемости. Мощность стратификации каждого зонда рассчитывается с использованием теста рангового теста, применяемого к двум группам выборок, соответствующих квантилям с наименьшим и наивысшим значениями выражений, соответственно. Мы определили эти квантилиты, упорядочив все образцы по их значениям экспрессии зонда и выбранным образцам в первой и последней трети (квантиль от 0 до 33% в относительно слабо выраженном и от 67 до 100% в относительно чрезмерно выраженном группа). Этот анализ проводили в R, используя выживаемость пакета [37]. Поскольку информация о выживаемости не предоставляется для всех образцов, этот расчет был основан на 115 базальноподобных образцах опухоли (из общего числа 125) в наборе подготовки METABRIC. Чтобы определить количество проб, проходящих через фильтр Survival, мы использовали аналогичное определение порога, как для дифференциального подхода, то есть путем упорядочения log-нормированных p-значений, которые возникли из теста Log-rank. Эти зонды далее упоминаются как набор зондов для выживаемости.
Вторая цель нашего исследования — выявить и охарактеризовать базальноподобные подгруппы с различными исходами болезни. С этой целью мы выполнили иерархическую кластеризацию выборок на основе ранее заданного набора зонда выживания. Эта процедура использует предположение, что зонды, показывающие большинство вариаций в выражении и совместном выражении между собой, участвуют в подобных биологических механизмах и оказывают большое влияние на разграничение групп. Чтобы рассчитать несходство между 115 образцами из набора для обучения METABRIC, для которого предоставлена информация о выживании, мы использовали квадратный корень расхождения Йенсена-Шэннона [38-40]. Затем мы сгенерировали иерархическую кластеризацию с критерием Уорда, который минимизирует дисперсию в кластерах, используя статистику пакета R [41].
Далее мы исследовали, какие зонды из набора зонда выживания вносят наибольший вклад в разделение базальноподобных подгрупп с использованием теста Wilcoxon. Затем мы заказали нормированные log10 p-значения для определения зондов, которые существенно различают подгруппы, используя тот же пороговый критерий, что и для дифференциального фильтра. Целью этой процедуры является уточнение зондов, которые наилучшим образом разделяют базальноподобные подгруппы с различным заболеванием. Эти зонды далее упоминаются как сигнатура зонда и раскрывают поражающие гены и клеточные механизмы, участвующие в дифференциации подгрупп.
Базоподобные объекты сначала были сопоставлены с проверкой METABRIC, установленной с помощью центроидов, рассчитанных на основе ранее определенной сигнатуры зонда. Затем образцы в этом наборе данных были отнесены к подгруппе в соответствии с минимальным евклидовым расстоянием до центра тяжести.
Внешняя проверка была проведена в наборе данных ROCK, для которого центроиды были сопоставлены по технологиям — от Illumina до Affymetrix — с использованием пакетов аннотаций гена hgu133a.db и illuminaHumanv3.db [42] в R
Bioconductor. Поскольку измерение и нормализация уровня мРНК различаются между наборами данных METABRIC (Illumina) и ROCK (Affymetrix), мы стандартизировали рассчитанные значения центроида по отношению к средним уровням экспрессии, рассчитанным для всех базальноподобных образцов. Эта процедура изображена в уравнении 1, где s
i, j — значение выражения зонда j для образца i, а N — общее количество базальноподобных образцов (N равно 115 в наборе обучения METABRIC).
1 documentclass [12pt] минимальна
Usepackage
Usepackage
usepackage
Usepackage
Usepackage
usepackage
SetLength
begin
После нормализации центроидов было необходимо аналогичное преобразование значений экспрессии гена Affymetrix, чтобы обеспечить их непосредственное применение. Таким образом, мы применили ту же формулу (уравнение 1) к набору данных ROCK, где число N общих выборок равно 101. Назначение подгруппам было основано на минимальном евклидовом расстоянии до стандартизованного центра тяжести.
Чтобы идентифицировать ключевых игроков в сигнатуре зонда и их отношение друг к другу, мы сгенерировали и построили график сети с использованием минимального связующего дерева (MST) [43]. Расстояние d (x, y) между двумя зондами x и y определялось как d (x, y) = 1- | ρ
S (x, y) |, где ρ
S (x, y) — значение корреляции Спирмена между экспрессией зонда, вычисленной для 125 образцов опухоли из набора тренировок. Чтобы количественно оценить сетевой анализ, мы вычислили центральность междоузлия и степень узла каждого узла (зонда), используя пакетный igraph [44] в R.
Как правило, узлы с высокой степенью взаимности и значениями степени представляют потенциальные ключевые игроки в сети. Что касается значений центральности, наиболее представительные сущности очень связаны с остальной частью дерева; листовые узлы имеют значение центральности между 0, тогда как наиболее пересеченные узлы назначаются с наивысшими значениями (нормированными до 1). С другой стороны, степень узла указывает количество прямых соседей узла. Таким образом, зонды с высокими степенями также являются центральными (репрезентативными) для локальных групп с относительно сильным зондированием.
Чтобы раскрыть miRNAs, наиболее различающиеся между базальноподобными подгруппами, мы применили тест Wilcoxon к значениям экспрессии каждого из 853 зондов, доступных в наборе данных METABRIC. Мы рассматривали эти miRNAs с появляющимися p-значениями меньше 0,01 как в наборах обучения, так и в валидации, что важно для разделения между подгруппами. Оба набора данных использовались из-за ограниченного количества образцов (всего 146), для которых были представлены профили экспрессии miRNA. Пробы miRNA были дополнительно исследованы для возможных генов-мишеней в сигнальной сигнатуре зонда с использованием R
Bioconductor (RmiR.Hs.miRNA [45]) в пяти базах данных: miRBase, TarBase, PicTar, MirTarget2 и miRanda. Для аннотации miRNA и гена мы использовали пакеты hgug4112a.db [46] и illuminaHumanv3.db [42] соответственно.
Для квантования информации CNA мы использовали цитобанки, определенные в базе данных hg18, которая соответствует платформе METABRIC. Аберрации были разделены на две категории: потери (первоначально обозначаемые как гомозиготные и гетерозиготные делеции) и прибыли (прибыли и усиление). Для каждой базальноподобной подгруппы мы вычисляли частоту возникновения выигрышей и потерь на цитобанд и применяли Биномиальный тест для изучения гипотезы о том, что распределения CNA были одинаковыми среди подгрупп пациентов.
Далее мы подсчитали измененный процент генома (PGA) для каждой из базальноподобных подгрупп и применили тест Wilcoxon к этим показателям, чтобы получить значение значимости разницы между ними. Целью этого подхода является определение стабильных / неустойчивых профилей генома, связанных с подгруппами пациентов, определяемых нашей сигнатурой зонда, и статистическое описание того, являются ли они последовательно расходящимися.
С применением фильтров дифференциала и выживания в наборе подготовки METABRIC, как описано в «Методах», мы идентифицировали 15000 и 400 зондов, связанных с началом и / или прогрессированием рака, и выживанием пациентов соответственно. Соответствующие зонды в наборе дифференциальных зондов с четкими уровнями экспрессии между опухолями и контрольными показателями имели значительные значения р от 2,36 · 10-45 до 1,53 · 10-7. Уменьшенное количество зондов в наборе зонда выживаемости, связанное с индивидуальной выживаемостью, имело значимые значения р в диапазоне от 1,11 · 10-4 до 0,038. Эти зонды, в конечном счете, включают представительную подпись, приводящую к исходу базальноподобных пациентов в когорте рака молочной железы METABRIC.
Иерархическая кластеризация 115 базисных образцов, основанная на наборе зондов выживаемости, выявила две основные подгруппы: Basal I и Basal II (дополнительный файл 1: рисунок S1). Разделение на более чем две подгруппы — в следующем и последующих иерархических подразделениях в дендрограмме — не поддерживалось из-за высокого сходства подгрупп в терминах их молекулярного профиля и клинического исхода. Применение теста Wilcoxon определило сигнатуру зонда, содержащую 80 зондов со значительными p-значениями в диапазоне от 1,75 · 10-13 до 3,77 · 10-4, дифференцируя большинство между двумя базальноподобными группами на транскриптомическом ( мРНК). На рисунке 1 изображена карта тепла 80-зондовой сигнатуры для обучающего набора, где выборки упорядочены внутри каждой подгруппы по их евклидову расстоянию до соответствующих центроидов (дополнительный файл 2: таблицы S1, S2 и S3).
Рис. 1-яплотная карта подписи с 80 зонами в наборе для тренировки METABRIC. На этом рисунке показаны 80 зондов, связанных с выживанием, сгруппированных по их взаимной корреляции. Образцы в каждой базальноподобной подгруппе упорядочены по их общему рангу, а значения выражений нормируются между отдельными лицами. Подгруппы в наборе проверки METABRIC были определены с использованием центроидов, вычисленных в обучающем наборе. В наборе данных ROCK 55 зондов Affymetrix соответствовали сигналу 80 Illumina; образцы в этом наборе данных упорядочены по их общему рангу в каждой подгруппе
Чтобы охарактеризовать сигнатуру 80-зонда по отношению к их клеточной функции, мы объединили зонды по их взаимной корреляции в три группы (таблица 1) — G1, G2 и G3 — и аннотировали с использованием базы данных для аннотации, визуализации и интегрированного обнаружения (DAVID ) (Дополнительный файл 3: Таблицы S4, S5 и S6). Этот анализ показал, что зонды G1 сильно связаны с контролем клеточного цикла и делением клеток; они чрезмерно выражены в подгруппе Basal II. G2 показал связь с иммунной системой и воспалительным ответом. Примечательно, что уровни экспрессии зондов G2 в базале II аналогичны уровням, наблюдаемым в контроле, но значительно выше в базале I, что указывает на интрамутальную инфильтрацию лимфоцитами в этой подгруппе. В последней группе G3 зонды указывают на ассоциацию (несущественную) с процессами связывания металлов; они недопредставлены в базале II по сравнению с базальным I и контрольными образцами.
Таблица 1. Подпись на 80 зондов, относящаяся к выживанию
Подпись 80-зонда, связанная с выживанием (продолжение)
В этой таблице перечислены 80 аннотированных зондов Illumina, различающих базальноподобные подгруппы. Для каждой группы зондов (Gs) предусмотрены официальный символ гена (Gene), из браузера генома UCSC и идентификаторы зонда Illumina (идентификатор зонда), в том же порядке, что и на рисунке 1. Эта таблица также содержит центральность между центрами ( B) и значения степени узла (ND), рассчитанные для каждого зонда в базально-подобном учебном наборе
Центральность централизованности и анализ степени узла сигнатуры 80-зонда (рис.2) дополнительно обозначили важные гены, дифференцирующие подгруппы Basal I и Basal II (таблица 1). Гены с наивысшими значениями центральности (B ≥ 0,1) в G1 являются PSMG3, HJURP, BEND3, C10orf2, TPX2, RRP12 и DNMT3B; в G2, CXCR6, HCST, C3AR1, GBP4, LY96, ANKRD22, FPR3 и FCGR2A; и в G3, CTSK. В этом наборе гены HJURP, RRP12, DNMT3B, CXCR6, HCST, C3AR1, FPR3 и CTSK также демонстрировали высокие значения степени уступов (ND ≥ 4), являющиеся репрезентативными для совместной экспрессии зонда, подтверждающие их ключевую роль в дифференциации базальных подобные карциномы.
Рис. 2 Минимальное связующее дерево 80-зонной сигнатуры. График MST был сгенерирован для 80 зондов в обучающем наборе. Только датчики с высокими значениями корреляции между уровнями их выражений подключены к сети. Размер каждого узла пропорционален значению степени вычисляемого узла (количество подключений). Цвет каждого узла отражает значение центральности между центрами между низким (светло-розовым) и высоким (красным)
Качество сигнатуры 80-зонда оценивали с использованием центроидов, рассчитанных для набора тренировок, и применялись к наборам проверки METABRIC и ROCK. В ROCK 55 аннотированных зондов, отобранных от Illumina до Affymetrix, были проверены на платформах микрочипов. Соответствующие карты тепла на рис.1 показали наличие двух основных базальноподобных подгрупп Basal I и Basal II как в наборах METABRIC, так и в ROCK. Две подгруппы согласуются с размерами популяции и уровнями экспрессии мРНК (в G1, G2 и G3) и дополнительно поддерживают качество сигнатуры 80-зонда. Определение более чем двух подгрупп в иерархической кластеризации приведет к разделению объектов с очень похожими молекулярными профилями.
Анализ клинико-патологических маркеров выявил значительную корреляцию между базальноподобными подгруппами, определенными в этом исследовании, и гистологией опухолей (инвазивная дуктальная карцинома по сравнению с медуллярным типом), размером опухоли и статусом р53 (таблица 2). Согласно гистологической классификации, медуллярный тип чаще встречается у пациентов с базальным I. С другой стороны, базальная II подгруппа характеризуется более крупными опухолями (по размеру) и более высокой частотой мутации p53. Клинические особенности, такие как возраст, менопаузальный статус (MS), сорт, индекс прогностического ноттингема (NPI) и лимфатические узлы, не показали статистически значимых изменений по двум базальноподобным подгруппам.
Таблица 2Клиникопатологическая информация для пациентов в наборе данных METABRIC
Описанные клинико-патологические особенности: возраст в годах, менопаузальный статус (MS), размер опухоли в см, опухоль класса [1-3], индекс прогностических ноттингем Ноттингема (NPI), инвазия лимфатических узлов, гистопатологическая классификация (гистология) и p53, для Базальные I и II подгруппы в наборах обнаружения и проверки METABRIC. Во всех случаях p-значение указывает на значимость разницы между базальными I и II подгруппами. Для числовых переменных (возраст, размер, класс и NPI) он был рассчитан с использованием ANOVA по рангу; для категориального (MS, Lymph Node, Histology, p53) использовался биномиальный тест. Размеры населения для каждой группы указаны в последней строке. Гистология опухолей выглядит следующим образом: >
Анализ выживаемости выявил значительные различия в результатах пациентов между базальным I и базальным II. Basal I показал лучший прогноз по сравнению с Basal II во всех наборах данных (рис.3), с p-значениями критерия логарифмического ранжирования 0,0097, 0,017 и 0,043 для наборов данных METABRIC, валидации и ROCK соответственно.
Рис. Кривые выживания в наборах METABRIC и ROCK. Анализ выживаемости проводили с использованием оценки Каплана-Мейера. Серая линия показывает специфическую выживаемость всех базальноподобных образцов в наборах обучения и проверки, соответственно. Базальная подгруппа I показана в бирюзовых, а базальская II — в кораллах. Клещи представляют собой датчики пациентов, которые живы, а капли — смертельные случаи. Кривые выживания, основанные на последних 10 наблюдениях, построены в тире
Мы идентифицировали 17 miRNAs и 2 предполагаемых зонда, дифференциально выраженных между двумя базальноподобными подгруппами (таблица 3), причем значения p-значения Wilcoxon меньше 0,01 в обоих наборах данных METABRIC (дополнительный файл 4: таблицы S7, S8 и S9). Зонды hsa-miR-155, -342-5p и -150 показали наименьшие значения p и избыточную экспрессию в базале I по сравнению с базальным II и контрольными образцами. С другой стороны, транскрипты hsa-miR-19b-1 *, -17 * и -200c * были чрезмерно выражены в опухолях базального II по сравнению с базальным I и контрольной группой. Уровни экспрессии всех зондов изображены на рисунке 4. Кроме того, идентифицированные miRNAs были сопоставлены с сигналом 80-зонда, показывающим набор из 50 генных мишеней в пяти различных базах данных, как указано в таблице 4, и более подробно для Basal I и Basal II в дополнительном файле 4: Таблицы S7, S8 и S9. Среди генных мишеней C10orf2, HSD11B1, EGR2, FBXL5, CLEC7A, DNMT3B, FMO1, CTSK и PYHIN1 присутствовали, по крайней мере, в двух базах данных. Сравнение уровней экспрессии miRNA и гена среди подгрупп показало значительную корреляцию hsa-miR-142-5p и RASSF5, hsa-miR-142-5p и TIMP3, hsa-miR-150 и MIAT и hsa-miR-22 и TIMP3 как в Basal I, так и в Basal I.
Рис. 4. Полевая диаграмма miRNAs, дифференцирующаяся между базальными I и базальными II подгруппами. На изображении показаны уровни экспрессии 19 miRNAs по базальноподобным подгруппам и другим образцам в наборе данных METABRIC. Базаль I показан в бирюзовом, базальном II в кораллах, в сером и всем молочной железе, в желтом
МикроРНК дифференцируются между базальноподобными подгруппами рака молочной железы
MiRNAs, дифференциально выраженные в подгруппах Basal I и II, перечислены в этой таблице с соответствующим значением p в наборе обучения METABRIC. Зонды, расположенные над средней линией, указывают на чрезмерную экспрессию miRNA в базале I, тогда как те, которые ниже, выражены в базале II. Идентификаторы зондов соответствуют платформе Agilent
МикроРНК и соответствующие гены-мишени
В этой таблице перечислены дифференциально выраженные miRNAs и соответствующие гены-мишени в 80-зондовой сигнатуре. Соответствующие цели появились, по крайней мере, в одной из пяти баз данных: miRBase, TarBase, PicTar, MirTarget2 и miRanda. Целевые гены, присутствующие в по меньшей мере двух базах данных, подчеркнуты
Интегрированный анализ CNA выявил все большее число геномных изменений от Basal I до подгруппы Basal II (рис.5) и непокрытых цитобандов со значительными аберрациями (биномиальные тестовые p-значения ниже 0,15) как в наборах для обучения и валидации METABRIC (таблица 5 ). Соответственно, критические коэффициенты усиления / усиления были обнаружены на хромосомах 1q, 3q, 8q, 10p и 17q, а потери / делеции на 4q, 5q, 8p, Xp и Xq. Некоторые из этих аберраций ранее были связаны с первичными опухолями молочной железы и клеточными линиями в исследованиях BLBC и / или TNBC [20, 47-50].
Рисунок 5 Абсолютная ошибка числа кодов, определенная для базальноподобных подгрупп в наборе данных METABRIC. a Информация CNA нанесена на 23 хромосомы (включая Х-хромосому); процентная доля населения, показывающая усиление / усиление (Amp) или делецию / потерю (Del), рассчитывали для каждого цитобанда. b Коробки представляют собой PGA, рассчитанные для каждого набора данных METABRIC
Цитобанды, связанные со значительными приобретениями CNA
Хромосомные аберрации в цитобандах подразделяются на два основных типа: усиление / усиление и делеции / потери. P-значения были рассчитаны с использованием биномиального теста по глобальному распределению
Примечательно, что процент изменения генома в наборе тренировок для Basal I составлял 2,74% для прибыли и 0,23% для потерь; в базале II — 9,06 и 1,03% соответственно. Тест Wilcoxon показал значительную гетерогенность среди подгрупп для коэффициентов усиления (p-значение = 1,91 · 10-6) и для потерь (p-значение = 9,55 · 10-4). Такая же картина наблюдалась в наборе валидации для Basal I (3,58% для прибыли и 0,13%) и Basal II (10,46% для прибыли и 2,54%), также очень значительная (тест Wilcoxon: p-value = 1.11 · 10-6 для коэффициентов усиления и p-value = 5,37 · 10-6 для потерь). Возрастающая неустойчивость генома, представленная увеличением PGA, нанесенная на рисунке 5, происходила последовательно от Basal I до Basal II с уменьшением темпов выживания пациентов.
Базальноподобные подгруппы, определенные в этом исследовании, показывают различные закономерности с точки зрения молекулярных профилей опухолей, клинико-патологических особенностей и результатов выживания пациентов. Характеристика BLBC, учитывая два основных объекта Basal I и Basal II, подтверждается идентификацией сигнатуры 80 зондов, проверенной на платформах Illumina и Affymetrix в когортах METABRIC и ROCK. Важность этой сигнатуры, генов и семейств генов определяется их функциональностью для каждого набора: G1, G2 и G3. Аннотированные зонды выявили их связь с клеточным циклом и компонентами деления клеток, иммунной / воспалительной регуляцией и связыванием металлов, соответственно, и определяли подгруппы Basal I (Immune Active) и Basal II (High Proliferative). В Basal I избыточная экспрессия зондов G2 предполагает иммунную активацию и лимфоцитарную инфильтрацию, в частности, регулирование роста опухоли и выживания пациентов. Эта роль ранее ассоциировалась с лучшим прогнозом и ответным действием на терапию [51] и способна стратифицировать базально-подобные раковые заболевания молочной железы. С другой стороны, чрезмерная экспрессия генов, связанных с клеточным циклом G1, и недостаточная экспрессия генов, связывающих металл G3, в Basal II влияют на скорость пролиферации клеток и энергетический обмен. В этом случае клетки размножаются со скоростью, намного превышающей общие границы контролируемого клеточного цикла, одновременно с другими молекулярными изменениями метаболических процессов.
Гены G1 PSMG3, HJURP, BEND3, TPX2, RRP12 и DNMT3B демонстрировали наивысшие значения центральности и были чрезмерно выражены в подгруппе Basal II. Например, HJURP играет центральную роль в поддержании вновь реплицированных центромеров и митотической регуляции. Повышенные уровни этого гена в первичных опухолях и линиях клеток рака молочной железы были ранее связаны с уменьшением безрецидивной и общей выживаемости [52]. Также, участвующий в сборке митотического шпинделя, TPX2 при чрезмерном выражении ассоциировался с сетями пролиферации и улучшением метастазов, сохраняя прогностическую ценность для пациентов с раком молочной железы [53]. Кроме того, гиперактивность ферментов ДНК метилтрансферазы или избыточная экспрессия DNMT3B была дополнительно сообщена в BLBC и TNBC, где события гиперметилирования были более частыми, чем в других подтипах рака молочной железы [54]. Гиперметилированные опухоли также приводили к снижению уровней регуляторных miRNAs, включая hsa-miR-29a и -29b. В частности, недокалибровка hsa-miR-29c отмечена как характеристика BLBC, разделяющая их на два подмножества [55], что подтверждается нашими выводами. Однако для исследования биологической роли других репрезентативных генов, таких как PSMG3, BEND3 и RRP12 в G1, требуются дополнительные исследования.
Ряд генов G2 являются ключевыми регуляторами базальноподобного опухолевого генеза, такого как CXCR6, HCST, C3AR1, GBP4, LY96, ANKRD22, FPR3 и FCGR2A. Эти гены показывают наивысшую межцентральную центральность и степень узла среди опухолей и проявляются чрезмерно выраженными в базале I. В других отчетах чрезмерная экспрессия CXCR6 была связана с TNBC с разной ролью в аутоиммунитете и раке [56]. Совместная экспрессия CXCR6 и CXCL16, хемокинового лиганда и рецептора, была связана с воспалительным ответом и миграцией клеток [57, 58]. Кроме того, высокие уровни HCST [59, 60], C3AR1 [61], GBP4 [62], LY96 [63], ANKRD22 [64], FPR3 [65] и FCGR2A [66] также были связаны с иммунной активацией и / или воспалительный ответ в опухолях; однако их роль в базальноподобных злокачественных новообразованиях еще не раскрыта. В нашем исследовании повышенные уровни экспрессии этих зондов, в том числе генов в сигнатуре, привели к новым представлениям о базальноподобном происхождении и прогрессировании опухоли и дифференциации Basal I и Basal II.
Стандартные клинические показатели, такие как размер опухоли, гистология и статус р53, также подтверждаются наличием двух базальноподобных подгрупп. Базаль I показала самую высокую частоту медуллярного типа, тогда как базальев II показал наибольшее среднее значение размера опухоли и наибольшую частоту мутации р53. Интерпретация этих признаков на практике подтверждает лучший результат пациентов в подгруппе Basal I по сравнению с Basal II. С другой стороны, возраст пациентов, постменопаузальный статус, уровень опухоли, вторжение НПИ и лимфатических узлов имеют ограниченное значение для различения подгрупп. Большинство из этих переменных отражают общую агрессивность опухоли и плохой прогноз подтипа.
Эта работа является первым случаем охвата данных miRNA, что дает анализ базальноподобных подгрупп, которые включают пациентов с сопоставимыми геномными, транскриптомическими и долгосрочными данными о выживании [67]. MiRNAs показали важное значение для дифференциации базального I (15) и базального II (4). В Basal I hsa-miR-361-3p, -342-3p, -140-3p, -34a, -22, -142-5p, -142-3p, -155, -342-5p, -150, — 29c и -29a представлены увеличенное выражение относительно Basal II. В целом, hsa-miR-361-3p был обнаружен чрезмерно выраженным в TNBC по отношению к другим подтипам и здоровому контролю [68]; и используется для распознавания носителей мутаций BRCA1 / 2 и опухолей non-носителей [69]. Однако более высокие уровни этой miRNA были связаны с защитным значением в прогрессировании опухоли [70] и далее связаны с воспалительным ответом [71]. В соответствии с нашими результатами эти результаты содержат дополнительную информацию для лучшего понимания базальноподобных подгрупп. Кроме того, высокие уровни hsa-miR-342-5p [72, 73] и -34a [74, 75] коррелировали с раком молочной железы, уменьшали рецидив и увеличивали выживаемость; тогда как низкие уровни были связаны с ингибированием гибели клеток и сопротивлением терапии. Hsa-miR-22 [76, 77] и члены семейства hsa-miR-29 (-29a, -29b и -29c) [55, 78], ранее идентифицированные как опухолевые супрессоры, также участвовали в увеличении выживаемости [78] и указал на перспективные прогностические биомаркеры [77, 79].
В Basal II hsa-miR-19b-1, -17 и -200c представлены более высокие уровни экспрессии по сравнению с базальным I и контрольные образцы. Было показано, что опухолевые клетки с повышенной экспрессией hsa-miR-19 (-19a и -19b-1) вызывают эпителиально-мезенхимальный переход [80]. Примечательно, что члены семейства hsa-miR-200 были описаны как основные регуляторы этого биологического процесса. Высокие уровни hsa-miR-200c и -200b наблюдались в циркулирующих опухолевых клетках у пациентов с метастатическим раком молочной железы [81], что указывает на прогностическую значимость этого биологического маркера [82, 83]. В соответствии с этими наблюдениями наши результаты продемонстрировали повторяющуюся избыточную экспрессию hsa-miR-19b-1 и -200c в Basal II с худшим результатом заболевания среди двух базальноподобных подгрупп. В конечном счете, высокие уровни hsa-miR-17 обычно обнаруживаются в TNBCs [84], что связано с миграцией клеток in vitro и метастазами in vivo [85].
Вышеописанные miRNAs соответствовали 50 гена-мишеням из 80-зондовой сигнатуры. В нашем исследовании hsa-miR-200c * и -29c были связаны с уровнями экспрессии HJURP в G1, hsa-miR-19b-1 * с CXCR6 в G2 и hsa-miR-17 с CTSK в G3, которые среди самые важные гены в подписи. Однако ни одна из этих ассоциаций не была опубликована в литературе. С другой стороны, в исследованиях были продемонстрированы хиты генной регуляции между hsa-miR-142-5p и CD24 [86], hsa-miR-29 и DNMT3B [87, 88], hsa-miR-142-3p и EGR2 [ 89], hsa-miR-150 и EGR2 [90], hsa-miR-34a и IKZF3 [91], hsa-miR-150 и MIAT [92], hsa-miR-342-3p и PSMG3 [93, 94] , hsa-miR-17 и TIMP3 [95]. Наши результаты также показали важную корреляцию между miRNAS и значениями экспрессии генов как в Basal I, так и в Basal II, которые были идентифицированы в силиконом. Эти и другие корреляции, однако, очень сложны и не полностью поняты. Для подтверждения наших достижений необходим дополнительный анализ с использованием моделей in vitro и in vivo.
Базальноподобные и тройные отрицательные опухоли проявляют самые высокие частоты геномных приростов и потерь по сравнению с другими подтипами рака молочной железы [50]. Значительные аберрации, наблюдаемые в этом исследовании, подтвердили геномную нестабильность среди базальноподобных и далее дифференцировали две подгруппы. Наиболее распространенные аберрации, определяющие Basal II по отношению к базалу I, произошли на хромосомах 1, 3, 4, 5, 8, 10, 17 и X.
Прибыль в 1q, 3q, 8q, 10p и 17q была идентифицирована в нашем анализе и ранее сообщалась в тройных отрицательных опухолях [48-50]. В целом, рост на хромосоме 1q является наиболее частым CNA, обнаруженным при карциномах молочных желез и обычно является сложным и прерывистым [96, 97]. Также описаны ампликоны 1q, 8p и 10p. Эти ампликоны способствовали молекулярному пониманию этого заболевания и, особенно, базальноподобного внутреннего подтипа [98]. Например, амплификации в 8q21 были связаны с высоким уровнем опухоли, высоким уровнем Ki67 и другими маркерами пролиферации, включая MYC, MDM2 и CCND1 [99]. Усиления в 10p имели еще дифференцированные тройные отрицательные раковые заболевания [48], а в 17q25 выделяли BRCA1-мутированные опухоли [100].
Потери в 4q, 5q, 8p, Xp и Xq были определены как ключевые аберрации в базальноподобных опухолях в нашем анализе и среди других исследований рака молочной железы [20, 49]. Частые потери в 4q и 5q в BRCA1-мутированных опухолях отличают их от спорадических новообразований. В частности, потеря в 5q повлияла на экспрессию нескольких BRCA1-зависимых генов, участвующих в репарации ДНК, таких как RAD17 и RAD51 [101]. Высокие показатели заболеваемости в 5q14 также были связаны с плохим прогнозом в BLBC [102]. Другие данные свидетельствуют о том, что аберрации на Х-хромосоме являются общими для мутаций BRCA1 и спорадических опухолей [103].
В целом, эти аберрации дали дополнительную характеристику Basal I и Basal II. Возрастающая PGA или неустойчивость генома от одной подгруппы к другой дополняла сигнатуру 80 зонда с помощью транскриптомической оценки, которая по-прежнему считается более представительной для клеточных процессов в протеомическом масштабе [104]. Хотя идентифицированная CNA не показала прямую корреляцию с уровнями экспрессии 80 зондов, обычно это может привести к широким нарушениям, выходящим за рамки предлагаемой сигнатуры. В конечном счете, описанные выше приросты и потери в цитобанках, поддерживаемые рядом различных подходов в литературе, еще больше подтверждают дифференциацию базальноподобных подгрупп с различными клиническими признаками и результатами выживания.
В этом разделе мы также установили консенсус в отношении описания базальноподобных подгрупп (Basal I и Basal II) путем сопоставления наших результатов с другими достижениями в литературе [10, 19-21, 31] в соответствии с фокусом каждого изучение. Примечательно, что большинство из них были сосредоточены на классификации тройных отрицательных сущностей, более гетерогенной группы, чем базальноподобные. Например, среди шести собственных подтипов TNBC, определенных Lehmann et al. (2011) [19], три были учтены для дальнейших сравнений с предлагаемыми базальноподобными подгруппами: базальноподобными (BL1 и BL2) и иммуномодулирующими (IM). Группы были описаны на основе регуляции клеточного цикла, ответа на повреждение ДНК и иммуномодулирующих родственных генов соответственно. Эти гены намекают на участие подобных механизмов, дифференцирующих Basal I и Basal II, что указывает на то, что обе классификации связаны друг с другом. Гены (G1) с высокими значениями центральной доли в базале II, такие как HJURP и TPX2, были связаны с аберрантными сетями пролиферации, вторжением клеток и метастазами в рак молочной железы в соответствии с определением BL1 [19]. Кроме того, гены (G2), определяющие подгруппу Basal I, включая CXCR6, HCST, C3AR1, GBP4, LY96, ANKRD22, FPR3 и FCGR2A, имеют связь с иммунной активацией и воспалительным ответом, ближе к IM [19]. Основные положения, связанные с этими генами, подтверждают существование двух подгрупп, хотя пул образцов был значительно отличным, BLBC и TNBC.
В недавней классификации TNBC, проведенной Burstein et al. (2014) [20] были описаны две группы: базально-подобный иммуноактивированный (BLIA) и подтипы иммунного подавления (BLIS), соответствующие лучшему и худшему прогнозу соответственно. В BLIA опухоли проявляют избыточную экспрессию молекул трансляции трансляции Stat и цитокинов; в BLIS, высокие уровни иммунодепрессанной молекулы VTCN1. Механизмы, определяющие BLIA, следуют характеристикам Basal I, а BLIS — Basal II. Например, Basal I и BLIA [20] содержат общие гены и / или гены, принадлежащие к одному и тому же семейству, такие как CXCL9 / 10/11/13, GBP4 / 5 и CD2 / 24. Аналогично, Jézéquel et al. (2015) [21] выявили два соответствующих подтипа: базальноподобный с низким иммунным ответом и высокий M2-подобный макрофаг (C2) и обогащенный базами с высоким иммунным ответом и низким M2-подобным макрофагами (C3). Определенные базальноподобные и базально обогащенные группы поделились очевидным сходством с базальным II и базальным I, соответственно, и подтвердили наше исследование с точки зрения сигнатуры и функциональности зонда. Однако в отношении классификации TNBC Lehmann et al. (2011) [19], Burstein et al. (2014) [20] и Jézéquel et al. (2015) [21] частично поддерживают друг друга.
Альтернативный подход к дифференциации двух подгрупп базальноподобных — связанных либо с низким, либо с высоким риском рецидива заболевания — был проверен Hallett et al. (2012) [10] с использованием 14-генной сигнатуры. Среди генов в сигнатуре RPL3 и GPR27 были перечислены в качестве ключевых маркеров рецидива, тогда как RPL36AL и GPR65 появились как варианты в 80 исследованиях, связанных с выживанием. В том же направлении Sabatier et al. (2011) [31] определили сигнатуру метагена 28-киназ, связанную с безрецидивной выживаемостью и иммунным ответом, — для разделения ББК на две группы: «Иммунный максимум» и «Иммунный низ». Этот подход выявил ключевые гены, включая IL2RG / B, GBP2, CCR5 / 7, CXCR3 / 5/6 и CXCL9 / 13, связанные с членами их семей в нашей сигнатуре, такие как IL2RA, GBP4, CCR1, CXCR6 и CXCL11. Эти гены оказались чрезмерно выраженными в «Immune High» [31] и в подгруппе Basal I по сравнению с «Immune Low» [31] и Basal II.
Интегрируя эти наблюдения, существует четкий консенсус относительно сегрегации базально-подобных молочных желез в по меньшей мере две подгруппы. Basal I (Immune Active) показывают молекулярные перекрытия и фенотипические сходства с BLIA [20], IM [19] и C3 [21]; Basal II (высокий пролиферативный), сопоставляемый с BLIS [20] и C2 [21]. Полноценная геномная и транскриптомическая характеристика двух подгрупп, представленных в этом исследовании, приведет к лучшему пониманию механизмов, участвующих в базальноподобных опухолях, и к идентификации групп пациентов с отчетливым результатом заболевания, поддерживаемых дополнительными характеристиками выживания [ 10, 31]. Последнее имеет решающее значение для улучшения принятия клинических решений и для оказания помощи в индивидуальном лечении, которое сосредоточено на манипуляциях с иммунной системой и вмешательстве в клеточный цикл. В целом, опухоли с активированным иммунным ответом показали благоприятный прогноз [15] и, вероятно, будут реагировать на химиотерапию [31], тогда как высоко пролиферативные выявили повышенный риск метастазов и рецидивов [18]. В этом контексте пациенты с низким риском должны следовать более консервативным методам лечения, а люди с высоким риском должны получать более эффективные препараты для улучшения индивидуального ответа, к более персонализированной медицине.
Исследования показали, что гетерогенность BLBC выходит за рамки классической иммуногистохимии. Несмотря на то, что для выявления пациентов с низким и высоким риском были использованы несколько клинико-патологических признаков, выявление новых биомаркеров с прогностической ценностью остается неотложной задачей для улучшения управления раком молочной железы. Подписанная в этом исследовании подпись 80-зонда, связанная с различными результатами выживания, содержит предполагаемые маркеры прогрессирования заболевания и представляет собой многообещающий актив для клинических применений. Интегрированная оценка экспрессии miRNA и информации CNA, в конечном счете, способствует определению более полных профилей базальноподобных опухолей. Важность определения групп, подверженных риску БЛБ, отражается на влиянии связанных с выживаемостью признаков в клинических условиях и, что более важно, на терапию.
Дополнительный файл 1Настроить S1. Тепловая карта 400 зондов в наборе подготовки METABRIC. Эта карта тепла показывает иерархическую кластеризацию 115 базисных образцов на основе значений выражения зонда. Существуют два основных кластера: базаль-I (бирюзовый) и базаль-II (коралл). 80 зондов, которые наилучшим образом различают две группы, обозначаются оранжевым цветом. Красные и синие цвета представляют собой относительное над- и недовыражение, соответственно. Значения выражений нормируются по выборкам. (JPG 9635,84 kb)
Дополнительный файл 2Basal-подобные образцы классифицируются в Basal I и Basal II, а центроиды определяют их. Таблицы S1 и S2 перечисляют идентификаторы образцов для каждой базальноподобной подгруппы Basal I и Basal II; центроиды также представлены в таблице S3. (XLSX 27 kb)
Дополнительный файл 3Функциональная аннотация зондов G1, G2 и G3. Эти таблицы содержат все зонды, определенные для G1 (таблица S4), G2 (таблица S5) и G3 (таблица S6). Аннотация основана на базе данных для аннотации, визуализации и интегрированного обнаружения (DAVID). (XLSX 37 kb)
Дополнительный файл 4 Таблицы S7, S8 и S9. МикроРНК дифференцируются между базальным I и базальным II и соответствующими генными мишенями. В таблице S7 показаны miRNAs, дифференциально выраженные в подгруппах Basal I и II, с соответствующим p-значением в наборах для обучения и валидации METABRIC. Таблицы S8 и S9 перечисляют miRNAs и все генные мишени для Basal I и Basal II, соответственно. (XLSX 69 kb)
Базальноподобный рак молочной железы
Копировать аберрацию номера
База данных для аннотации, визуализации и комплексного обнаружения
источник