Каждый организм представляет собой сплоченную, гармоничную систему клеток, где каждая из них на своем месте выполняет свою строго определенную функцию. Рак возникает, когда организм теряет строгий контроль над ростом, величиной и подвижностью своих клеток, это приводитк безудержному их размножению и проникновению в соседние ткани. В результате, эти клетки рано или поздно попадают в лимфатическое либо кровяное русло, что приводит к их распространению – метастазированию – иобразованию дочерних опухолей.
У человека встречается более сотни видов опухолей и каждая отличаетсяот другой, к примеру относительным средним возрастом опухоли, который отражает скорость роста и склонность к образованию дочерних опухолей. Сегодня уже достоверно известно великое множество факторов, приводящих кразвитию рака и еще большее количество факторов изучается. Однако вряд ли когда-нибудь удастся установить основную причину возникновения этой болезни, хотя общие механизмы ее развития, уже открыты.
Решающим фактором в развитии рака является иммунная система.
Иммунная система – это система защиты организма не только от вредоносных микроорганизмов (бактерии, простейшие, грибы и вирусы), но иот собственных вырождающихся клеток, которые бесконтрольно делятся. Каждый день жизни в человеческом организме зарождается около 8 злокачественных опухолей! И при этом средняя частота развития опухолевойболезни — 1 раз в 200 лет (клеточных делений)! Это отражает работу иммунной системы человека по распознанию и уничтожению измененных клетокорганизма, из которых в последствие может развиваться рак.
И все-таки иногда иммунная система не распознает такие клетки. В своюочередь, опухоль во время своего роста продуцирует вещества, угнетающиеиммунную систему. Как следствие у большинства людей, страдающих раковойболезнью, иммунная система ослаблена. Это служит причиной назначения врачами комплексного медикаментозного лечения (витамины, микроэлементы ит.д.) для стимуляции иммунной системы к борьбе против рака.
В последнее время благодаря интенсивным исследованиям в области иммунологии открыты новые факторы и типы клеток, посредством которых реализуется иммунный ответ. Количество этих исследований постоянно растет и сегодня мы понимаем иммунные процессы намного, чем 10 лет тому глубже назад. И совершенно ясно, что дендритные клетки в этих процессах играют особо важную роль.
С помощью специальных методов из крови больного выделяются клетки-предшественники, из которых впоследствии выращивают дендритные клетки. В присутствие определенных веществ их высаживают на лабораторные чашки, чтобы клетки не утратили способности к дальнейшему развитию.
Во время фазы созревания в культуру клеток добавляют структуры опухолевых клеток, полученные путем генной инженерии, либо «обломки» опухоли самого пациента.
Незрелая клетка-предшественник способна захватывать эти структуры.
Захваченный «обломок» претерпевает определенные структурные изменения, чтобы позднее характерный признак этой опухоли мог быть лучше распознан другими иммунными клетками.
В результате этих процессов клетка- предшественник превращается в дендритную клетку, которая на своей поверхности несет признак опухоли с особой сигнальной последовательностью. Именно эту последовательность и распознает иммунная клетка как чужеродную.
Теперь созревшие дендритные клетки вводятся под кожу, откуда они активно перемещаются в лимфоузлы, активируют различные типы клеток – исполнителей (цитотоксические Т-лимфоциты), которые при контакте с опухолевой клеткой уничтожают ее.
Активные клетки-исполнители «ознакомлены» с чужеродным признаком, с током крови они распространяются по всему организму и «ищут» в разных тканях носителей именно этого признака.
При встрече со своей целью (в данном случае с опухолевой клеткой), клетка-исполнитель повреждает ее и вырабатывает вещества, оповещающие другие иммунные клетки.
Лечение рака посредством собственной иммунной системы – давняя мечта человечества. И в 90-х годах мы подошли вплотную к ее реализации, научившись выращивать дендритные клетки. Это клетки осуществляющие патрулирование и обнаружение чужеродных структур в тканях организма. Этиструктуры захватываются дендритными клетками, разлагаются на более мелкие, которые потом «выносятся на показ» на поверхность клетки. В таком виде дендритные клетки мигрируют из тканей в лимфоузлы. Там чужеродные структуры будут представлены клеткам-исполнителям (цитотоксическим Т-лимфоцитам), которые таким образом активируются, покидают лимфоузлы, выходят в ткани, атакуют и уничтожают структуры, обладающие представленным им признаком.
В дальнейшем дендритные клетки могут также активировать другие иммунные клетки – так называемые Т-хелперы. Активные Т-хелперы с током крови попадают на «место событий», и там вырабатывают вещества, поддерживающие активность клеток-исполнителей.
В результате взаимодействия дендритных клеток и Т- хелперов также стимулируются к росту и выработке специфических антител антителпродуцирующие В-клетки.
На сегодняшний день доказана эффективность лечения дендритными клетками больных раком кожи, почки, молочной железы, предстательной железы, а также раком толстой кишки и яичника.
Для большинства видов рака уже существуют стандарты лечения, которые создавались десятилетиями. Иммунотерапия (вакцинация дендритными клетками) сегодня рекомендуется как поддерживающая, в комплексе с химиотерапией и лучевой терапией. Известно, что иммунные клетки более эффективно борются с клетками опухоли, которая ранее уже подверглась разрушительному действию «химии или радиации».
Вакцинация дендритными клетками также часто применяется, когда рутинная терапия не приносит желаемого эффекта. Примером для этого можетслужить лечение рака почки и меланомы кожи.
Наибольший эффект при вакцинации проявляется на ранних стадиях болезни, когда в организме еще не так много раковых клеток. В этой ситуации иммунные клетки зачастую намного эффективнее чем у больных с большей опухолевой массой. Поэтому перед лечением дендритными клетками всегда показано специальное лабораторное исследование крови, позволяющееопределить реактивность иммунной системы. Как при стандартном лечении рака, так и при лечении дендритными клетками, терапия будет тем эффективнее, чем раньше она начнется.
Для выделения предшественников дендритных клеток у пациента берут 150 мл крови. Чтобы кровь не сворачивалась, в нее добавляют противосвертывающее средство – Гепарин. Эту кровь в охлажденном виде немедленно доставляют в нашу лабораторию для последующей обработки.
Для выделения предшественников дендритных клеток у пациента берут 150 мл крови. Чтобы кровь не сворачивалась, в нее добавляют противосвертывающее средство – Гепарин. Эту кровь в охлажденном виде немедленно доставляют в нашу лабораторию для последующей обработки.
В специальных сосудах кровь центрифугируется и разделяется на фракции. Целью фракционирования является отделение белых кровяных клеток от красных кровяных клеток и клеток неспецифического иммунного ответа – гранулоцитов.
Фракция красных кровяных клеток и гранулоцитов (см. Рис) осаждается на дно пробирки и в дальнейшем не используется. Во фракции лимфоцитов ( на рисунке — белесая полоса между светлым и желтым слоями в пробирке) находятся те клетки, из которых в последствие могут развиться дендритные клетки.
После нескольких После нескольких ступеней очистки клетки помещаются в специальные чашки с питательным раствором. Здесь клетки, в том числе и клетки-предшественники,постепенно оседают на дно пластиковой чашки и фиксируются там. И после завершающей фазы очистки в питательный раствор добавляются факторы роста.
Затем клетки помещаются в специальный инкубационный шкаф, в котором поддерживается постоянная температура, а также обеспечиваются и контролируются необходимые условия среды для роста и созревания культуры клеток. Здесь проходит фаза роста.
Для запуска процесса созревания в культуру клеток необходимо добавить белковые субстанции, которые находились на поверхности опухолевых клеток этого пациента. Опухолевые клетки предоставляет патолог. Клетки берутся из хирургически удаленной опухоли или из материала биопсии. Этой белковой субстанцией может также выступать и т.н. опухолевый маркер, который ранее определялся в крови пациента в повышенной концентрации.
В общей сложности В общей сложности дендритные клетки выращиваются в условиях инкубационного шкафа 7 дней. Зрелость дендритных клеток можно определить методом микроскопии – форма у всех клеток разная, неправильная. Обращают на себя внимание множественные тонкие волосоподобные выросты, окаймляющие клетку.
Перед тем, как «собирать урожай» клетки проходят еще один тест на зрелость в так называемом проточном цитометре. В нем определяется наличие специфических структур, их количество и взаимоотношение на поверхности дендритных клеток.
После проверки зрелости, культура дендритных клеток собирается и снова подвергается многократной тщательной очистке. Потом половина клеток собирается для первой инъекции в маленький шприц, который передается лечащему врачу. Врач вводит вакцину пациенту в подкожную клетчатку живота в область паховых лимфоузлов и, через 15 минут пациент может покинуть клинику.
Вторая часть клеток собирается для последующей инъекции и хранится в специальном растворе при температуре -196°С. Эти клетки будут разморожены непосредственно перед второй инъекцией и, подобно первой, набраны в шприц и переданы лечащему врачу.
После первой инъекции необходимо регулярно проходить исследования крови, чтобы следить за реакцией иммунной системы. Концентрация иммунныхклеток, уничтожающих опухоль значительно повышается. Снижение этой концентрации является показанием для второй инъекции.
При лечении дендритными клетками могут наблюдаться определенные побочные эффекты. Они могут возникать как следствие общего иммунного ответа организма, что приведет к высвобождению веществ, участвующих в инфекционных воспалительных реакциях. Субъективно это может проявиться умеренным повышением температуры тела и слабостью. Реакция на инъекцию может также выражаться увеличением лимфоузлов. Иногда наблюдается покраснение кожи на месте инъекции.
В отличие от химио- или радиотерапии, когда организм подвергается воздействию чужеродных веществ или облучения, при лечении дендритными клетками с опухолью борется собственная иммунная система организма. В сравнении с другими видами лечения, терапия дендритными клетками очень редко сопровождается побочными реакциями, которые слабо выражены и обладают кратковременным характером, что едва ли отражается на общем самочувствии и работоспособности пациента. Кроме того, эта терапия проводится амбулаторно и не требует пребывания в клинике.
Таким образом, терапия дендритными клетками может проводится в дополнение рутинного лечения (химиотерапии), которое угнетает иммунную систему. И по этой причине должно быть разделено с последним во времени.Результаты последних обширных исследований свидетельствуют об эффективности данного метода, что дает возможность поставить его в один ряд с общепризнанными методами. Однако, не смотря на это, терапия дендритными клетками по-прежнему рассматривается как дополнение к уже существующим методам.
Лечение дендритными клетками является молодым видом лечения. Однако, несмотря на это, уже достаточно широко известно в научных кругах благодаря своей эффективности в лечении рака. Некоторые немецкие страховые компании и больничные кассы уже покрывают расходы на это лечение как на необходимую поддерживающую терапию при раке. По Вашей просьбе может быть предоставлена более подробная информация о методе, включая последние публикации.
источник
Метод аутогемотерапии на основе аутологичных антиген-активированных дендритных клеток в лечении больных раком молочной железы.
Решающим фактором в развитии рака является иммунная система. Иммунная система – это система защиты организма не только от вредоносных микроорганизмов (бактерии, простейшие, грибы и вирусы), но и от собственных аномально развивающихся клеток, бесконтрольное деление которых приводит к развитию опухоли. Иногда под воздействием ряда факторов иммунная система не распознает такие клетки, что способствует распространению опухолевого очага. В свою очередь, опухоль во время своего роста продуцирует вещества, угнетающие иммунную систему. Как следствие у большинства людей, имеющих опухолевое заболевание, иммунная система ослаблена.
В последнее время благодаря интенсивным исследованиям открыты новые факторы и типы клеток, посредством которых реализуется иммунный ответ. Были открыты и изучены клетки иммунной системы, которые играют главную роль в противоопухолевой защите организма. Эти клетки называются дендритные клетки (ДК). Дендритная клетка выступает единственным посредником для других клеток иммунной системы, которые непосредственно выполняют функцию иммунной защиты – обнаруживают и уничтожают аномальную клетку или возбудителя.
Основные методы лечения при РМЖ:
Попытки стимуляции иммунной системы для лечения при раке предпринимались давно и неоднократно. Однако лишь в последнее время на основе результатов изучения основных противоопухолевых реакций, механизмов их формирования и регуляции, возможных причин неэффективности иммунного ответа, идентификации опухоль-ассоциированных антигенов (ОАА) удалось добиться определенных положительных результатов применения иммунотропных препаратов различной природы.
Иммунотерапия дендритными клетками также часто применяется, когда рутинная терапия не приносит желаемого эффекта. Наибольший эффект при этом проявляется на ранних стадиях болезни, когда в организме еще не так много раковых клеток. В этой ситуации иммунные клетки зачастую намного эффективнее, чем у больных с большей опухолевой массой. Поэтому перед лечением дендритными клетками всегда показано специальное лабораторное исследование крови, позволяющее определить реактивность иммунной системы. Как при стандартном лечении рака, так и при лечении дендритными клетками, терапия будет тем эффективнее, чем раньше она начнется.
Все процедуры, связанные с введением препарата на основе дендритных клеток будут проводиться на базе Клиники иммунопатологии НИИФКИ.
В настоящее время в клинике используют методику активации собственных клеток иммунной системы вне организма с последующей реинфузией больному.
Этапы лечения:
- Этап клинического обследования.
На данном этапе проводится анализ результатов обследований, с которыми пациент поступает: ультразвуковое исследование (УЗИ), компьютерная томография (КТ), рентгенологическое, а так же клинико-лабораторные тесты (общий анализ крови (ОАК) с лейкоцитарной формулой, общий анализ мочи (ОАМ), биохимический анализ крови, онкомаркеры CA-15-3 (при наличии)). За этот период специалистами выполняется: подтверждение диагноза, выявление органных дисфункций и оценка возможности лечения.
- Этап получения биологического материала.
Забор 100 мл крови для получения аутологичных антиген-активированных дендритных клеток и активированных лимфоцитов. Забор крови осуществляется перед проведением операции в стерильную одноразовую емкость с антикоагулянтом (гепарин).
- Изъятие образца злокачественной опухоли.
Забор образца опухолевой ткани размером 1-3 см 3 производится специалистом в зависимости от стадии болезни и выбранного этапа диагностики или лечения.
- Лабораторный этап приготовления препарата для аутогемотерапии.
На данном этапе проводится получение клеточного материала для аутогемотерапии.
- Этап иммунотерапии.
В зависимости от стратегии основного лечения возможно несколько режимов введения аутологичных иммунных клеток.
Количество инъекций зависит от количества клеток, полученных из крови пациента. Оптимальное количество инъекций от 3 до 5.
Через 6 месяцев после окончания полного курса аутогемотерапии производят повторный забор крови для оценки иммунологических показателей.
Пациентам с данным диагнозом проводятся бесплатные консультации по предварительной записи.
Запись по тел. регистратуры: (383) 228-22-11, 228-24-60
источник
Основа биовакцины – это материал опухолевого образования. Важно понимать, что использование вакцины на основе дендритных клеток является лишь частью комплексной терапии в лечении рака.
Дендритные клетки т.е. вакцину на их основе изготавливают после хирургического лечения с применением полученного в процессе вмешательства опухолевого материала, а также клеток, выделенных из крови больного.
После этого пациент продолжает основной курс терапии (химиотерапию или другое) и после его окончания несколько раз получает дендритную вакцину, при помощи которой удается закрепить полученный результат терапии. Это обеспечивает профилактику рецидива и развития метастазов.
До настоящего момента в мире было проведено более 1000 клинических испытаний биовакцин где применялись дендритные клетки. В этих испытаниях принимали участие больные с распространенными стадиями рака, и в результате был сделан вывод, что использование биовакцин должно быть направлено не только на борьбу с опухолью, но и на профилактику рецидивов и образования метастазов.
Роль дендритной вакцины в лечении рака сложно переоценить, ведь большинство летальных исходов при онкологических опухолях возникает в результате прогрессирования патологии и развития метастазов.
На сегодняшний день нами получены результаты клинических исследований, а изготовление дендритной вакцины проводится усовершенствованным методом, не имеющим аналогов во всем мире.
Дендритные клетки являются важным звеном в формировании приобретенного иммунитета. Согласно данным медицинских исследований, количество дендритных клеток в организме пациента со злокачественными опухолями существенно снижено, а сами они функционируют неполноценно.
Считается, что снижение количества дендритных клеток и потеря эффективности их работы является одной из основных причин отсутствия полноценной иммунологической защиты организма на развивающийся раковый процесс.
Из этого можно сделать вывод, что даже при введении антигенов непосредственно в патологический очаг не наблюдается активизации иммунитета в нужном объеме. При культивировании дендритных клеток в условиях in vitro часто удается избежать отрицательного действия иммунносупрессивных факторов и обеспечить полноценное созревание этих клеток.
Дендритные клетки культивируют в среде, которая содержит материал опухоли. Для изготовления вакцины материал, взятый из опухоли, обрабатывается специальным образом, что позволяет повысить иммуногенность опухолевых антигенов.
Биовакцины, изготовленные индивидуально для каждого отдельного пациента, на сегодняшний день являются самыми безопасными и высокоэффективными в лечении онкологических заболеваний. Благодаря проведенным исследованиям было установлено, что использование вакцин на основе дендритных клеток в составе комплексного лечения рака позволило существенно повысить продолжительность и качество жизни пациентов.
После введения вакцины в организм дендритные клетки перемещаются в лимфоидную ткань, где участвуют в обучении Т-лимфоцитов и инициируют их пролиферацию. Терапевтический эффект вакцины заключается в активизации цитотоксических Т-лимфоцитов, активность которых у онкологических больных существенно снижена.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
источник
Раковая опухоль выживает в организме только потому, что научилась ускользать от внимания иммунной системы, в норме распознающей и уничтожающей любые патологические клетки. Поэтому сейчас в онкологии активно разрабатываются методы иммунотерапии, когда иммунные клетки, выделенные из крови больного, «обучают» бороться с опухолью, размножают и вводят обратно. Общая схема подобной иммунотерапии известна давно, но у этого подхода есть свои проблемы, главная из которых – неустойчивость достигнутой ремиссии из-за сохранения микроскопических метастазов. И попытки усовершенствовать методику не останавливаются…
Чтобы понять суть метода иммунотерапии рака, сначала немного ликбеза. Главными клетками иммунной системы являются лимфоциты, которые вырабатывают белки-антитела против антигенов («чужеродных» молекул, в том числе на клеточных мембранах), обеспечивают контактное взаимодействие с патологическими клетками и вообще «мастера на все руки». Центральными «игроками» противоопухолевого иммунитета являются цитотоксические Т-лимфоциты, которые недаром называют еще Т-киллерами, а также особые дендритные клетки, которые «показывают» чужеродный антиген Т-лимфоцитам и таким образом активируют и направляют их деятельность.
Первые попытки использовать Т-лимфоциты как инструмент противораковой терапии начались еще в 1980-х гг., когда эти клетки научились культивировать вне организма. Т-лимфоциты, инфильтрирующие опухоль, выделяли из опухолевой ткани, размножали и вводили обратно пациенту. Таким образом удавалось добиться серьезных улучшений у больных меланомой. Однако в силу трудоемкости метода и побочных эффектов, связанных с сопутствующим введением высоких доз ростовых факторов, этот метод применялся лишь в случае, когда иных способов лечения не существовало (например, при метастатической меланоме – наиболее агрессивной стадии рака кожи).
Современные методики позволяют избирательно нацеливать Т-лимфоциты на опухолевые клетки благодаря генной модификации их поверхностных рецепторов. Однако до сих пор считалось, что такая терапия эффективна лишь в случае эпителиальных опухолей с высоким уровнем соматических мутаций (при меланоме, раке легких и мочевого пузыря), но не слишком результативна в отношении других распространенных видов рака эпителия, характеризующихся более низкой скоростью мутирования (рака желудочно-кишечного тракта, яичников, молочной железы).
Недавно в США были проведены клинические испытания иммунотерапевтического подхода к лечению рака молочной железы на 49-летней больной, которая фактически умирала, – опухоль оказалась устойчива сразу к нескольким видам химиотерапии. Ученые выделили из опухолевой ткани пациентки наследственный материал (ДНК и РНК), в котором было выявлено несколько десятков новых мутаций.
Параллельно из опухоли выделили инфильтрирующие ее Т-лимфоциты и другие иммунокомпетентные клетки, способные специфически взаимодействовать с антигенами, включая антиген-презентирующие дендритные клетки. Внутрь этих клеток поместили фрагменты матричной РНК, содержащие мутации, характерные для опухоли. Модифицированные дендритные клетки активировали цитотоксические Т-лимфоциты, среди которых были отобраны те, что наиболее активно реагировали на мутантные версии белков, кодируемых генами SLC3A2, KIAA0368, CADPS2 и CTSB. Эти лимфоциты, размноженные в большом количестве, были введены пациентке.
Через 1,5 месяца после введения «обученных» Т-клеток размер опухоли уменьшился наполовину, а спустя 22 месяца наблюдалась видимая полная регрессия не только опухоли, но и метастазов. Этот вдохновляющий результат показывает, что максимально персонализированная терапия, при которой иммунные клетки-киллеры прицельно «направлены» на опухоль с конкретным мутантным «профилем», может привести к долговременной ремиссии даже в безнадежном случае.
источник
Недавно мы писали новость о первом успешном излечении рака молочной железы на терминальной стадии. Пациентку из США успешно вылечили с помощью перспективного метода лечения опухолевых заболеваний – иммунотерапии. В качестве противоопухолевых агентов были выбраны специфические иммунные тельца самой пациентки – дендритные клетки, о которых мы и поговорим.
Сложность и коварность злокачественных опухолей в том, что они невидимы для иммунной системы. Если в норме все атипичные клетки подлежат уничтожению, то при сбоях иммунной системы этого не происходит. Клетка, которая «неправильно» себя ведет, начинает размножаться и приобретать все признаки злокачественной. Так формируется опухоль, которая незаметна для иммунной системы, и в конечном итоге, приводящая к гибели больного, если вовремя не предпринять никаких мер.
Существенная проблема в лечении раковых заболеваний состоит в том, что существующие методы терапии приводят к серьезным побочным эффектам. Раковая клетка хоть и отличается от здоровой, но во многом обладает тем же набором признаков и функций. И если химиотерапия сильно бьет по раковым клеткам, то страдают и здоровые клетки тоже.
Долгое время ученые искали прицельные методы борьбы с раком, позволяющие им точно уничтожать раковые клетки, не поражая при этом здоровых. И, похоже, такой метод найден. Иммунотерапия – термин, который внедрился в онкологическую практику еще несколько десятков лет назад, однако сегодня к этому методу лечения приковано все медицинское и научное сообщество, ведь оно показывает феноменальные результаты.
Для проведения иммунотерапии в организм вводят специальные вещества – опухолевые антигены, которые в организме способствуют продукции специфических иммунных клеток, поражающих злокачественные клетки.
Преимуществом иммунотерапии является тот факт, что она высокоспецифична и работает только в отношении злокачественных клеток, не затрагивая здоровых.
Каким же образом происходит иммунный ответ на чужеродные агенты в организме, в том числе и раковые клетки? Среди множества клеток, принимающих участие в иммунном ответе, отдельно следует сказать о дендритных клетках. Это популяция особых клеток, имеющих отросчатые участки по периметру, которые задействованы в презентации чужеродных антигенов другим клеткам иммунной системы. Другими словами, дендритные клетки активируют адаптивный иммунитет.
Впервые дендритные клетки были открыты в 1868 году немецким ученым Паулем Лангергансом. Из-за специфической морфологии ученый ошибочно принял эти клетки за нервные окончания. И только в 1973 году ученому Ральфу Стайнману удалось установить принадлежность этих клеток именно к иммунной системе. В 2011 году ученого з это эпохальное открытие наградили Нобелевской премией, но посмертно. Как известно, Нобелевская премия посмертно не вручается, а Ральф Стайнман стал третьим ученым, которому Премию вручили уже после смерти.
Дендритные клетки являются антигенпрезентирующими клетками. Главным образом, располагаются они в крови и тканях, которые непосредственно контактируют с внешней средой. Уникальность этих клеток в том, что они обладают инструментарием, который позволяет им распознавать чужеродных агентов. Они способны поглощать чужеродных агентов, при этом они расщепляют антигены на отдельные части пептидов, которые затем связываются с молекулами главного комплекса гистосовместимости (MHC – Major Histocompatibility Complex). Таким образом, происходит вызревание дендритной клетки, после чего она презентует при помощи МНС вражеский антиген иным клеткам иммунитета. Это, например, Т-клетки, которые ранее еще не сталкивались с антигенов. После такой встречи Т-клетки начинают активно делиться и специализироваться в клетки-уничтожители чужеродных клеток или в эффекторные Т-клетки. Также имеются CD4+ T-клетки, которых называют Т-хелперами. Эти клетки стимулируют В-лимфоциты, производящие антитела. В свою очередь антитела, обладая высокой специфичностью к антигену, устремляются на его поражение.
Как уже упоминалось выше, опухолевые клетки умеют обходить иммунологический надзор. В этой связи для прицельного их уничтожения иммунной системе крайне важно распознать антигены, находящиеся на поверхности опухолевых клеток. И в этом случае возникает закономерная задача – максимально эффективно уничтожить раковую опухоль с помощью клеток собственной иммунной системы.
Уже показано на животных, что дендритные клетки могут захватывать антигены опухолевых клеток и презентовать их Т-клеткам иммунной системы. Так возникает активация опухолеспецифических Т-лимфоцитов, что приводит к настоящей войне с раковой опухолью.
Отметим, что в нашем организме имеются и другие антигенпрезентирующие клетки, например, макрофаги. Однако дендритные клетки эту работу выполняют намного эффективнее, поэтому они и используются в настоящее время в иммунотерапии рака. Именно благодаря своим уникальным свойствам дендритные клетки были выбраны для экспериментальной терапии рака молочной железы терминальной стадии, которая закончилась успешно. Уже 2,5 года пациентка полностью здорова и рецидивов не наблюдается.
Однако не все так просто, как нам бы того хотелось. Дендритные клетки обнаруживаются в большинстве опухолей. Они буквально пожирают части злокачественных клеток, пытаясь предоставить иммунной системе антигены. Однако опухоли в свою очередь умело этому препятствуют. Например, опухоли активно продуцируют раково-эмбриональный антиген и муцин-1, которые не позволяют дендритным клеткам презентовать опухолевые антигены Т-клеткам.
Кроме того, опухолевые клетки мешают нормальному созреванию дендритных клеток. Опухоли продуцируют специфический белок IL-10, в присутствии которого невозможна антигенспецифическая реакция. Также опухолевые клетки высвобождают коктейль веществ, которые способствуют образование других дендритных клеток, обладающих не противоопухолевыми свойствами, а наоборот – проопухолевыми! Одна из задач иммунотерапии – «перевоспитать» проопухолевые дендритные клетки в противоопухолевые, и сегодня для этого имеются соответствующие инструменты.
Вакцины против рака создаются для каждого пациента в индивидуальном порядке из его собственных дендритных клеток. Для начала секвенируется геном опухолевых клеток, то есть читается ДНК опухоли. Затем определяются мутации, и сегодня это не проблема в любой лаборатории, где имеются специальное оборудование. А далее, чтобы понять, какие именно из этих мутаций могут привести к образованию новых антигенов, создается библиотека соответствующих мутантных пептидов. Затем каждый из пептидов презентуется дендритным клеткам, отобранным заранее у пациента. Те дендритные клетки, которые реагируют на новые антигены, отбирают и размножают в лабораторных условиях, ведь именно они будут уничтожать опухолевые клетки (но в организме этого не происходит, поскольку таких клеток слишком мало).
Затем в течение определенного периода (как правило, 1-2 недель) пациенту вводят новые клетки, а после чего – следят за его состоянием здоровья. К слову, у пациентки, которой удалось полностью вылечить рак молочной железы, биопсия не показала наличия опухолевых клеток уже через 42 недели после инъекции 90 миллиардов переобученных лимфоцитов. То есть этим клеткам понадобилось меньше года для того, чтобы уничтожить не только первичную опухоль, но и метастазы в организме больного. Примечательно, что пациентке давали всего 2-3 месяца, но спустя 2,5 года все анализы «чистые».
источник
Изобретение относится к иммунологии и биотехнологии, конкретно — к созданию клеточных препаратов, обеспечивающих противоопухолевую активность в организме больного раком молочной железы и их применению в медицине при послеоперационном и поддерживающем лечении для профилактики или терапии отдаленных метастазов.
Опухоль может быть представлена широким спектром антигенов. Некоторые антигены представлены у всех опухолей определенного типа, а некоторые антигены могут быть обнаружены только у данного пациента. Дендритные клетки (ДК) способны представлять антигены, полученные из различных источников, что позволяет им эффективно стимулировать опухоль-специфичные эффекторные Т-клетки.
В данном процессе, первым шагом является обеспечение ДК опухоль-специфичными антигенами [Markiewicz M.A., Kast W.M. Progress in the development of immunotherapy of cancer using ex vivo-generated dendritic cells expressing multiple tumor antigen epitopes. // Cancer Invest. — 2004. — Vol. 22. — p.417-434]. Использование опухолевого лизата как источника опухолевых иммуногенов, обладает потенциальным преимуществом в стимуляции ответа против различных известных и неизвестных опухоль-ассоциированных антигенов (ОАА).
Данный метод позволяет вызвать поликлональный иммунный ответ, стимулируя как CD4+, так и цитотоксический CD8+ тип иммунного ответа, тем самым снижая возможность опухоли избежать иммунного ответа. Данный метод уменьшает время и усилия, направленные на выявление и синтез отдельных иммунодоминантных пептидных эпитопов, позволяя ДК естественно процессировать опухолевые антигены.
Недостатком данного метода является ограниченный объем опухолевого материала, использующийся для изготовления лизата, а также ограниченная пригодность опухолевых клеток, полученных от пациентов [Liu L.N., Shivakumar R., Allen С, Fratantoni J.С. Delivery of whole tumor lysate into dendritic cells for cancer vaccination. // Electroporation Protocols // Edited by Li S. // Methods Mol Biol. — 2008. — Vol. 423. — p. 139-153]. Эффективность вакцины будет зависеть от концентрации иммуногенных и иммуносупрессивных АГ в материале опухоли [Dong Н., Dai G., Xu L, Zhang Y., et al. Tumor cell lysate induces the immunosuppression and apoptosis of mouse immunocytes. Molecular Medicine Reports. — 2014. — Vol. 10. — p. 2827-2834].
Известен способ стимуляции цитотоксического иммунного ответа против клеток опухолевой линии аденокарциномы молочной железы, экспрессирующих специфические антигены, с помощью дендритных клеток, трансфецированных полиэпитопной ДНК-конструкцией (RU 2520091, C12N 5/084, 2014). Данный способ стимуляции специфического противоопухолевого иммунного ответа против клеток рака молочной железы осуществляют с помощью дендритных клеток, трансфецированных полиэпитопной ДНК-конструкцией. Полученные из периферической крови условно-здоровых доноров, трансфецированные полиэпитопной конструкцией, дендритные клетки культивируются с неприлипшей фракцией мононуклеарных клеток.
Недостатком способа является ограничения в применении способа в клинической практике. Введение ДНК-конструкций в клетку пациента осуществляется методами химической трансфекции или электропорации. Реагенты для химической трансфекции являются токсичными, а электропорация резко снижает количество жизнеспособных клеток и требует несертифицированных расходных материалов.
Известен способ получения противоопухолевой вакцины, включающий выделение мононуклеарных лимфоцитов, инкубацию выделенных мононуклеарных лимфоцитов с ростовыми факторами для получения из мононуклеарных лимфоцитов незрелых дендритных клеток, получение полилизата опухолей, обработку полученных незрелых дендритных клеток полилизатом опухолей, индукцию созревания незрелых дендритных клеток, обработанных полилизатом опухолей, в зрелые дендритные клетки, нагруженные полилизатом опухолей. Полилизат выбран из группы включающей рак яичников, рак кишечника, рак пищевода, рак желудка, рак молочной железы, меланому, рак почки, рак легкого. По мнению авторов описанная вакцина может применяться для изготовления лекарственного средства для профилактики злокачественного новообразования (RU 2008102736, C12N 5/08, 2009).
Недостатком способа является применение к пациенту смеси антигенов, полученных из аллогенных источников. Это может привести к развитию тяжелых иммунологических нарушений.
Известен способ послеоперационной терапии рака почки с использованием совместной культуры ДК и цитокин-активированных клеток. ДК получали из мононуклеарных клеток (МНК) периферической крови больных раком почки путем культивирования МНК, обогащенных фракцией моноцитов, в течение 4 дней в присутствии IL-4 (500 ед/мл) и GM-CSF (1000 ед/мл). Затем в культуру полученных дендритных клеток (ДК) добавляли лизат опухолевой ткани пациента и оставляли на 24 часа, а затем вносили TNF-α (1000 ед/мл) для созревания в течение последующих двух суток. Неприлипающую фракцию клеток для получения цитокин-индуцированных киллеров культивировали в среде RPMI 1640, содержащей 1000 ед/мл rhIL-2 и 10% инактивированной теплом сыворотки IV группы в количестве (3-5)×10 6 /мл, во флаконе 25-см 2 , поверхность которого покрыта иммобилизованными anti-CD3 моноклональными антителами (20 мкг/мл). Сокультивирование ДК и цитокин-индуцированных киллеров проводилось в течение 7 дней без добавления дополнительных факторов. Введение пациенту совместной культуры производилось через 4 недели после операции внутривенно в количестве 3*10 8 клеток капельно в 100 мл раствора Рингера с лактатом через периферический внутривенный капельный катетер. Была отмечена хорошая переносимость метода, а побочные эффекты — гриппоподобные состояния, такие как лихорадка и усталость, — самостоятельно проходили в течение 2-3 часов. Ни у одного из пациентов не отмечалось эффектов, соответствующих III классу цитотоксичности или аутоиммунным реакциям (Zhan HL, Gao X, Pu XY, Li W, Li ZJ, Zhou XF, Qiu JG. A randomized controlled trial of postoperative tumor lysate-pulsed dendritic cells and cytokine-induced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma. Chin Med J (Engl). 2012 Nov; 125(21): 3771-7).
Недостатком способа является стимуляция только неспецифической активации цитокин-индуцированных клеток, преимущественно киллеров, без прямой активации Т-клеточного ответа.
Известен способ послеоперационной терапии рака желудка и колоректального рака с использованием ДК и цитокин-активированных клеток. ДК получали из мононуклеарных клеток (МНК) периферической крови больных раком желудка и колоректальным раком путем культивирования МНК, обогащенных фракцией моноцитов, в течение 6 дней в присутствии IL-4 (20 нг/мл) и GM-CSF (50 нг/мл). Затем в культуру полученных дендритных клеток (ДК) добавляли лизат опухолевых клеток линий AGS (для рака желудка) или LS-174-T (колоректальный рак) на 2 суток. Неприлипающую фракцию клеток для получения цитокин-индуцированных киллеров культивировали в среде RPMI 1640, содержащей 10% фетальной сыворотки теленка, 1000 ед/мл rhIL-2, 300 ед/мл IFN-gamma, anti-CD3 моноклональными антителами (20 нг/мл). Инфузию ДК и цитокин-индуцированных киллеров начинали через 2-3 дня после химиотерапии. ДК вводили двумя частями. Одна часть смешивалась с цитокин-индуцированными киллерами с добавлением IL-2 и вводилась внутривенно. Другая часть вводилась подкожно в район лимфоузлов, соответствующих области поражения. Была отмечена хорошая переносимость метода, а побочные эффекты, такие как лихорадка и повышение температуры до 37-40°C проходили самостоятельно или под действием жаропонижающих препаратов (Gao D, Li С, Xie X, Zhao Р, Wei X, Sun W, Liu HC, Alexandrou AT, Jones J, Zhao R, Li JJ. Autologous tumor lysate-pulsed dendritic cell immunotherapy with cytokine-induced killer cells improves survival in gastric and colorectal cancer patients. PLoS One. 2014 Apr 3;9(4):e93886. doi: 10.1371/journal.pone.0093886. eCollection 2014).
Недостатком способа является отсутствие этапа созревания дендритных клеток, что может привести к развитию не только желаемого цитотоксического ответа, но и способствовать формированию толерантности к опухолевым антигенам. Отсутствие этапа совместного культивирования дендритных клеток с цитокин-индуцированными клетками не позволит в полной мере сформировать антиген-специфический противоопухолевый ответ.
Наиболее близким к предложенному является способ генерации антиген-специфических цитотоксических клеток с противоопухолевой активностью при раке молочной железы, включающий выделение мононуклеарных клеток (МНК) из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции МНК ростовых факторов, нагрузку незрелых дендритных клеток антигенами опухолевого лизата in vitro, стимуляцию созревания дендритных клеток. При этом к полученным незрелым ДК добавляют лизат аутологичных опухолевых клеток в дозе 100 мкг/мл, а еще через 48 часов в течение последующих 24 часов вносят рчФНО-альфа в дозе 25 нг/мл. Затем проводят совместное культивирование зрелых активированных лизатом дендритных клеток и неприлипающей фракции МНК в соотношении 1:10 в присутствии рекомбинантного человеческого интерлейкина-12 в дозе 10 нг/мл и рекомбинантного человеческого интерлейкина-18 в дозе 100 нг/мл. После добавления ростовых факторов к прилипающей фракции МНК производят культивирование в течение 48 часов для получения незрелых дендритных клеток (RU 2521506, C12N 5/0783, 2014).
Недостатком способа является то, что при 48 часах культивирования клетки прилипающей фракции моноцитов недостаточно полно дифференцируются в дендритные клетки, что приводит к меньшему содержанию зрелых дендритных клеток в составе клеточной фракции, предназначенной для совместного культивирования с мононуклеарными клетками. Следует отметить, что полученный данным способом препарат не может быть применен непосредственно для иммунотерапии, т.к. клетки с течением времени подвергаются апоптозу, из-за отсутствия реализации полученных эффекторных функций.
Задачей изобретения является повышение эффективности способа иммунотерапии рака молочной железы.
Техническим результатом изобретения является создание клеточного препарата, который в организме пациента обеспечивает защиту от формирования отдаленных метастазов и стимулирует специфический цитотоксический ответ против существующих.
Поставленная задача достигается тем, что в способе иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток, включающем выделение мононуклеарных клеток из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции мононуклеарных клеток ростовых факторов, нагрузка незрелых ДК антигенами лизата аутологичных опухолевых клеток рака молочной железы in vitro, стимуляцию созревания ДК, совместное культивирование ДК с лимфоцитами неприлипающей фракции в соотношении 1:10 с добавлением IL-12 и IL-18, добавление к прилипающей фракции мононуклеарных клеток ростовых факторов осуществляют в течение 72 часов, нагрузку ДК антигенами опухолевого лизата проводят в течение 24 часов, стимуляцию созревания ДК осуществляют в течение 48 часов, затем производят оценку экспрессии маркеров на поверхности зрелых дендритных клеток, а препарат, полученный при совместном культивировании в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток, замораживают с последующей разморозкой и фракционированием, причем фракционирование размороженных клеток и их культивирование осуществляют в течение 2-4 часов непосредственно перед инъекцией, в результате чего клетки разделяются на прилипающую и неприлипающую фракции, а затем обогащенную ДК прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов.
Изобретение, на наш взгляд, является новым и соответствует критерию «изобретательский уровень».
Добавление к прилипающей фракции мононуклеарных клеток ростовых факторов в течение 72 часов, нагрузка ДК антигенами опухолевого лизата — в течение 24 часов, осуществление стимуляции созревания ДК в течение 48 часов, повышают эффективность иммунотерапии за счет получения морфологически и фенотипически зрелых дендритных клеток в составе применяемого препарата, что подтверждается оценкой экспрессии маркеров на поверхности зрелых дендритных клеток.
Совместное культивирование в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток способствует приобретению эффекторных функций Т-клетками, в частности цитотоксической активности, что повышает эффективность иммунотерапии в целом.
Замораживание полученного препарата с его последующей разморозкой и фракционированием, и культивированием клеток в течение 2-4 часов непосредственно перед введением препарата пациенту позволяют разделить клетки на прилипающую и неприлипающую фракции, что повышает эффективность иммунотерапии за счет использования нескольких путей миграции иммуногенных клеток в составе препарата к очагу поражения и исключает возможную пирогенную реакцию организма пациента.
Обогащенную ДК прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов, что повышает эффективность иммунотерапии за счет активации цитотоксических механизмов, направленных на лизис единичных клеток, потенциально способных формировать отдаленные метастазы и стимулировать специфический цитотоксический ответ против существующих метастазов.
Изобретение осуществляется следующим образом.
Выделенные из периферической крови больных раком молочной железы клетки прилипающей фракции мононуклеарных клеток культивируются в концентрации 1 млн/мл в полной среде, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глютамина, 10 мМ HEPES, 5×10 -5 мМ 2-меркаптоэтанола, 80 мкг/мл гентамицина, 100 мкг/мл ампициллина в атмосфере 5% СО2 при 37°C с добавлением рчГМ-КСФ (100 нг/мл) и рчИЛ-4 (50 нг/мл). Через 72 часа культивирования к полученным незрелым ДК добавляется лизат опухолевой ткани в дозе 100 мкг/мл. Еще через 24 часа культивирования добавляется для созревания рчФНО-α в дозе 25 нг/мл в течение последующих 48 часов. По окончании этого этапа проводят оценку экспрессии маркеров зрелых дендритных клеток.
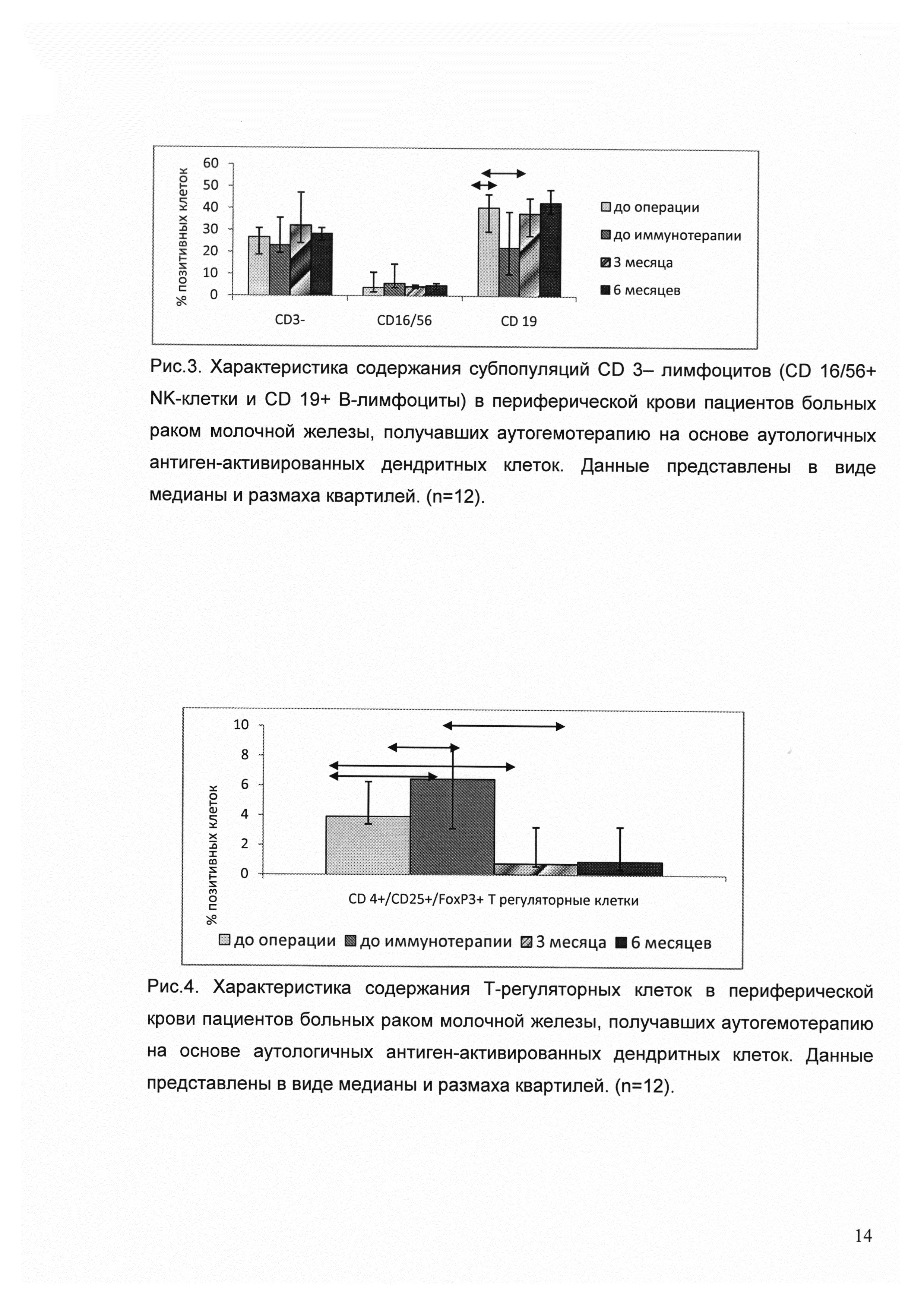
Для характеристики полученных ДК использовали несколько параметров. Результаты представлены на рисунке 1.
— Оценка экспрессии маркера CD 123 (плазмацитоидные ДК) на поверхности зрелых дендритных клеток. Для этого в популяции CD 45-позитивных клеток выделяли линейно-негативные HLA-DR-позитивные клетки, в которых определяли содержание CD 123-плазмацитоидных дендритных клеток. Содержание плазмоцитоидных дендритных клеток составило 2,35% [UQ; LQ: 4,45; 1,25].
— Оценка экспрессии маркера CD 11 с (миелоидные ДК) на поверхности зрелых дендритных клеток. Для этого в популяции CD 45-позитивных клеток выделяли линейно-негативные HLA-DR-позитивные клетки, в которых определяли содержание CD 11с-миелоидных ДК. Содержание миелоидных дендритных клеток составило 51,75% [UQ; LQ: 64,35; 23,925].
— Оценка экспрессии маркеров CD 83+/CD 86+ на поверхности зрелых дендритных клеток. Для этого в популяции больших гранулярных лимфоцитов выделяли популяцию CD 11c+HLA-DR + клеток и в них определяли содержание CD 83+CD86+ дубль-позитивных дендритных клеток, которое составляло 97,65% [UQ; LQ: 94,925; 99,3].
— Оценка экспрессии маркеров CD 205+/CD 209+ на поверхности зрелых дендритных клеток. Для этого в популяции больших гранулярных лимфоцитов выделяли популяцию CD 11c+HLA-DR + клеток и в них определяли содержание CD 205+CD209 + дубль-позитивных дендритных клеток, которое составляло 97,5% [UQ; LO: 99,1; 92,9].
После анализа поверхностного фенотипа зрелых дендритных клеток осуществляли совместное культивирование дендритных клеток и неприлипшей фракции мононуклеарных клеток в соотношении 1:10 с добавлением IL-12 (8 нг/мл) и IL-18 (80 нг/мл) еще в течение 96 часов.
Полученную культуру клеток замораживают для длительного хранения. Курс лечения включал 3-4-кратное введение вакцины. Утром, в день инъекции, производилась разморозка замороженной аликвоты клеток. Размороженные клетки культивировались в течение 3 часов. Прилипшая фракция механически с помощью скрепера снимается с поверхности культурального флакона и готовится для подкожного введения. Неприлипшая фракция готовится для внутривенного введения. Обе клеточные фракции трехкратно отмываются физиологическим раствором. Для подкожного введения клетки (2-3 млн) ресуспендируются в объеме 800-1000 мкл и вводятся подкожно, в три точки в подлопаточную область. Для внутривенного введения клетки (20-30 млн) ресуспендируются в 100 мл физиологического раствора с добавлением 2 мл 10% альбумина. Введение клеток осуществляется на фоне премедикации дексаметазоном (8 мг). Введение клеток в адъювантном режиме производится на фоне химиотерапии (1 раз в три недели, между курсами) или же после окончания курса химиотерапии (1 раз в неделю). Введение клеток в неоадъювантном (самостоятельном) режиме производится 1 раз в неделю.
Непосредственных осложнений при введении препарата не отмечалось. У пациенток с наличием отдаленных изменений наблюдалось повышение температуры до 37,2°C и 37,5°C в среднем через 2 суток после инъекции. Купировались симптоматически (прием НПВС).
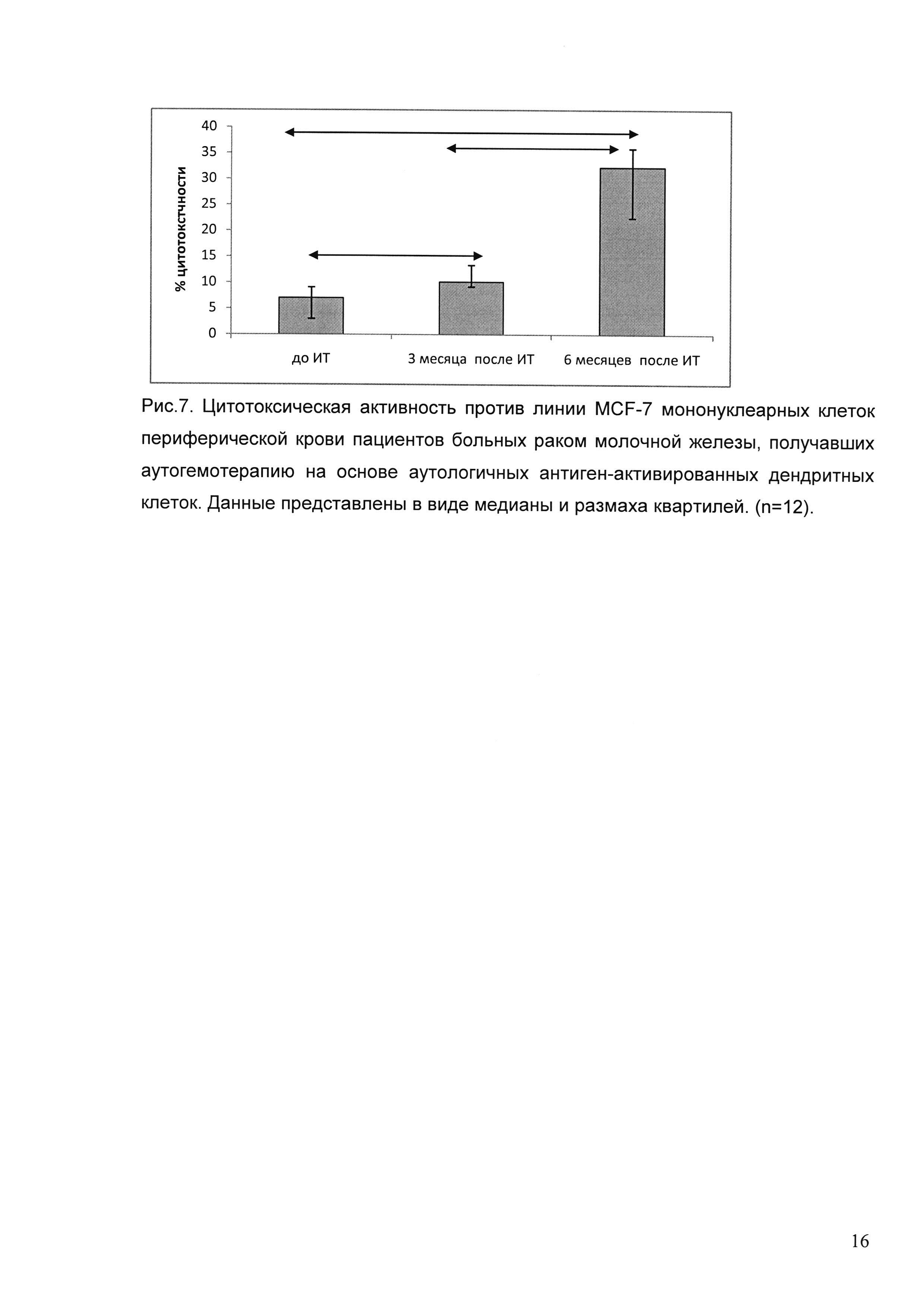
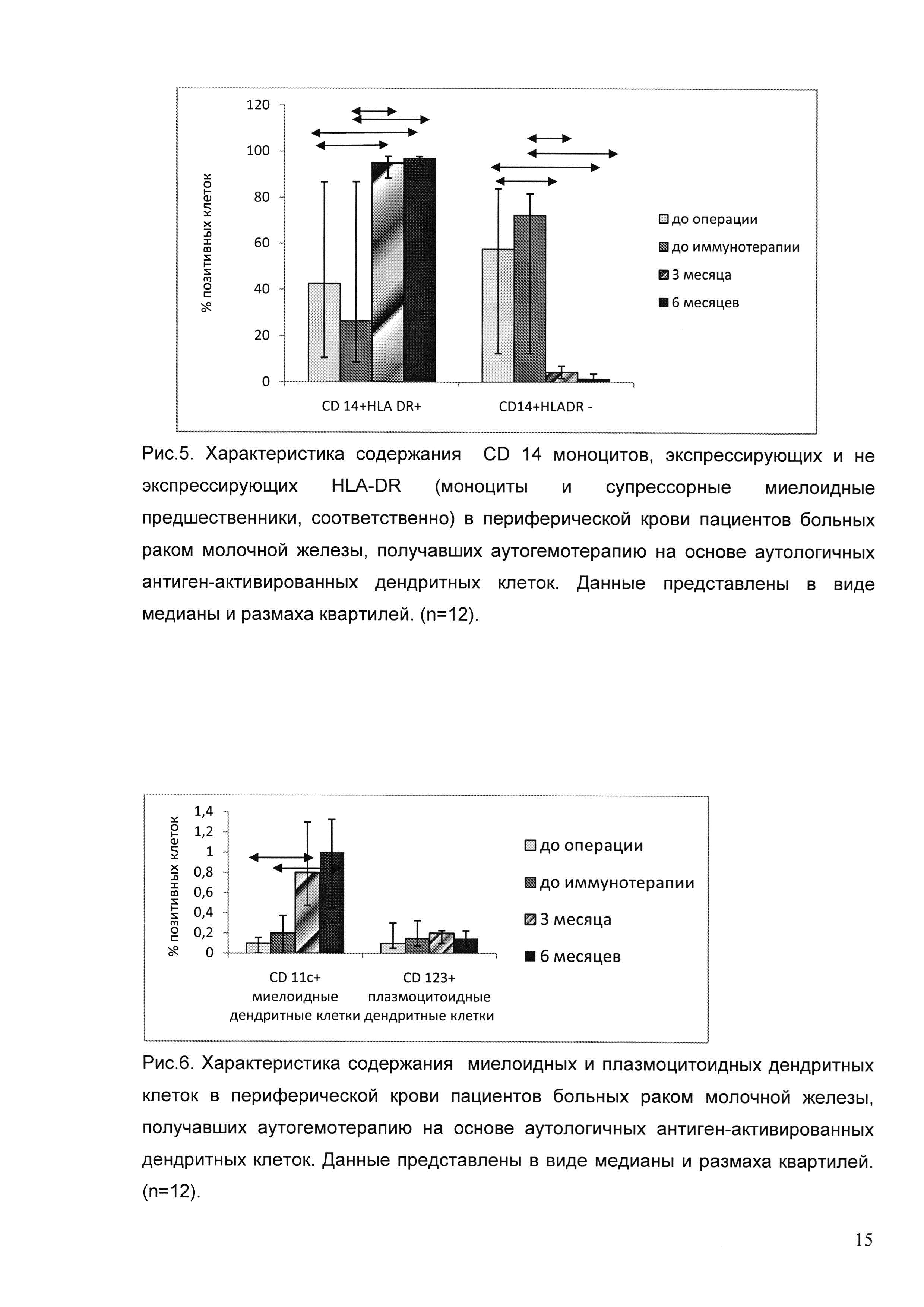
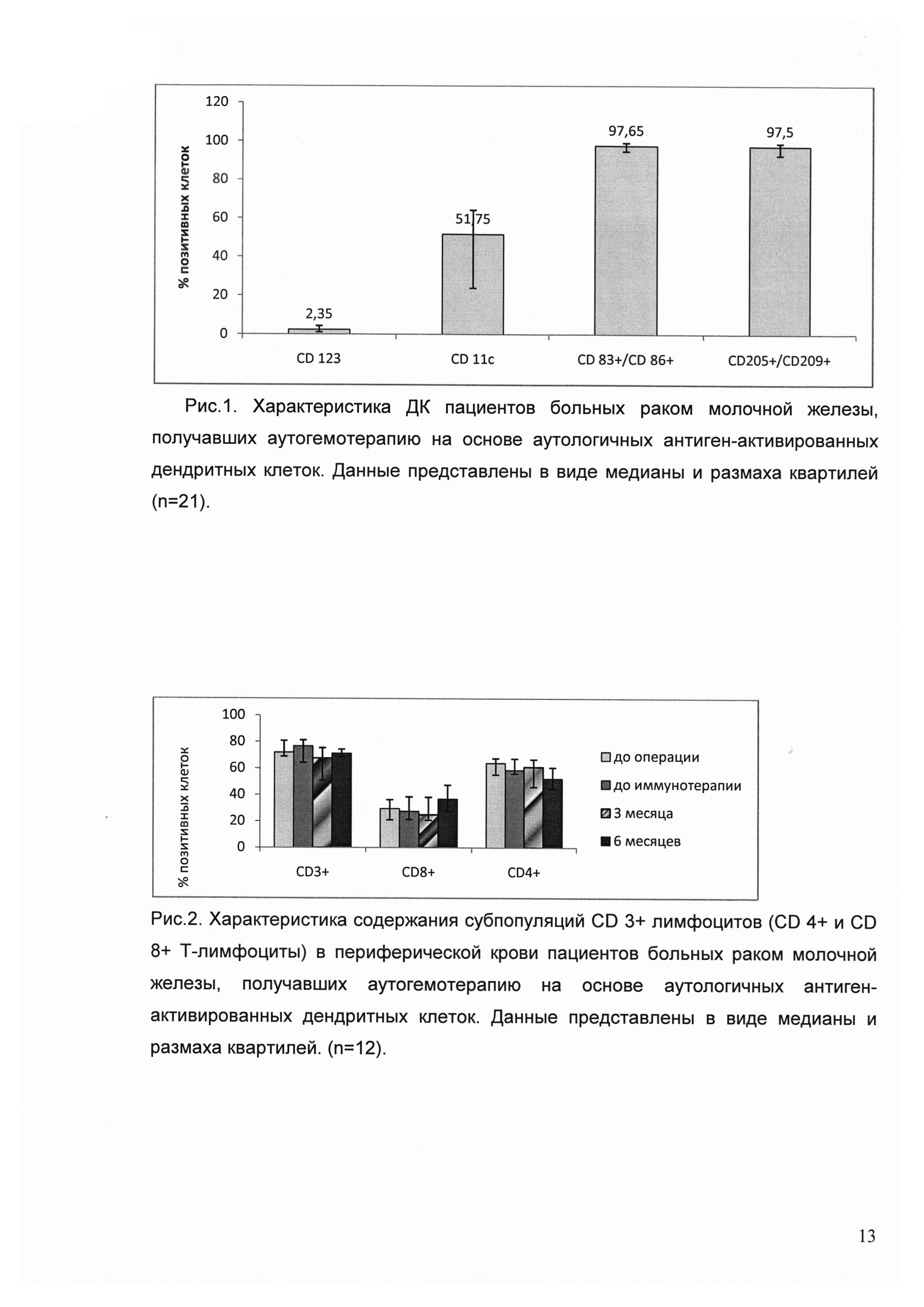
Для иммунологической оценки эффективности проводимой терапии мы оценивали иммунный статус пациентов и цитотоксическую активность циркулирующих мононуклеарных клеток. Нами исследовано содержание популяций CD 3+ клеток — CD 4 и CD 8, CD 3- CD 16/56 и CD 19, CD 14 моноцитов, экспрессирующих и не экспрессирующих HLA-DR (моноциты и супрессорные миелоидные предшественники соответственно), Т-регуляторных клеток, миелоидных и плазмоцитоидных ДК до операции, до начала иммунотерапии, через 3 и 6 месяцев после окончания иммунотерапии. Данные получены для 12 пациентов, получавших терапию в адъювантном режиме.
Для оценки содержания субпопуляций лимфоцитов была использована схема гейтирования, предложенная производителем набора. Среди CD 45+ лейкоцитов выделяли CD 3+ и CD 3-субпопуляции. Среди CD 3+ клеток определяли CD 4 и CD 8 Т-лимфоциты, из CD 3- клеток — CD 16/56 NK-клетки и CD 19 В-лимфоциты. Результаты представлены на рисунках 2 и 3. Таким образом, статистически значимые изменения отмечены только для CD 19 В-лимфоцитов — достоверное снижение к началу иммунотерапии по сравнению с состоянием до операции и повышение через 3 месяца после иммунотерапии.
Для оценки содержания Т-регуляторных клеток среди CD 45+ лейкоцитов выделяли популяцию CD4+CD25+ лимфоцитов и определяли содержание клеток, несущих маркер FoxP3. Результаты представлены на рисунке 4. Таким образом, через 3 месяца после проведения иммунотерапии наблюдается достоверное снижение уровня Т-регуляторных (CD 4+CD25+FoxP3) клеток, которое сохраняется и через 6 месяцев после иммунотерапии.
Для оценки содержания CD 14 моноцитов, экспрессирующих и не экспрессирующих HLA DR (моноциты и супрессорные миелоидные предшественники, соответственно) среди CD 45+ лейкоцитов выделяли CD14+ моноциты и оценивали на них экспрессию HLA DR. Результаты представлены на рисунке 5. Таким образом, через 3 месяца после проведения иммунотерапии достоверно увеличивается содержание CD 14+HLA DR+ моноцитов, и достоверно снижается содержание миелоидных супрессоров CD 14+HLA DR-, которое сохраняется и через 6 месяцев после иммунотерапии.
Оценка экспрессии маркеров CD 11с (миелоидные ДК) и CD 123 (плазмацитоидные ДК) и на поверхности зрелых дендритных клеток. Для этого в популяции CD 45-позитивных клеток выделяли линейно-негативные HLA DR-позитивные клетки, в которых определяли содержание CD 11с миелоидных ДК и CD 123 плазмацитоидных. Результаты представлены на рисунке 6. Данные представлены как процент позитивных клеток от CD 45-позитивных клеток. На фоне иммунотерапии происходит прирост миелоидных дендритных клеток, а содержание плазмоцитоидных дендритных клеток практически не изменяется.
При исследовании цитотоксической активности мононуклеарных клеток против опухолевой линии аденокарциномы молочной железы MCF-7 было показано постепенное усиление цитотоксической активности через 3 и 6 месяцев после иммунотерапии по сравнению с исходным уровнем (до иммунотерапии — ИТ). Результаты представлены на рисунке 7. На рисунках 3-7 стрелками показаны достоверные различия.
В настоящее время для пациенток, прошедших иммунотерапию в адъювантном режиме, прошло около 2 лет наблюдения за 6 пациентками; 1 год наблюдения за 4 пациентками; менее 1 года за 6 пациентками; менее 6 месяцев наблюдения за 5 пациентками. За этот период пациенты не обращались в онкодиспансер по поводу прогрессирования или рецидивирования заболевания. У одной пациентки была отмечена гиперплазия надключичного лимфоузла, однако дальнейшего роста не наблюдалось. У другой пациентки прошедшей курс иммунотерапии в ноябре 2015 г., выявлен метастаз в головной мозг (оперативное пособие в условиях НИИТО, гистологически — аденокарцинома).
Для пациентов, получавших иммунотерапию в неоадъювантном (самостоятельном) режиме.
Пациентка М., 31 год. Через 6 месяцев после курса иммунотерапии при контрольном МСКТ было зафиксировано снижение количества метастазов в легких на 35-40%, уменьшение гидроторакса, улучшение состояния кожи железы. Пациентка Е., 50 лет. При введении вакцины пациентом было отмечено облегчение выраженности болевого синдрома в пораженной железе. Однако у данного пациента была очень агрессивная и химиорезистентная опухоль (на момент включения в исследование проводилась третья линия терапии, включающая капецитабин и тамоксифен) и в январе 2016 г. пациентка умерла. Пациентка Н., 63 года, взята в исследование ввиду интересного клинического диагноза T×N×M1, при котором первичная опухоль не выявлена, а происхождение опухоли было определено только после иссечения и исследования мягкотканого метастаза. На момент включения в исследование пациентка принимала золедроновую кислоту и тамоксифен. Через 2 недели после курса иммунотерапии пациентом было отмечено исчезновение метастаза в затылочной области, уменьшение отека правой руки. По результатам МСКТ отмечена положительная динамика по состоянию костей скелета.
Предложенное изобретение позволяет повысить эффективность способа иммунотерапии рака молочной железы.
Техническим результатом изобретения является создание клеточного препарата, который в организме пациента обеспечивает защиту от формирования отдаленных метастазов и стимулирует специфический цитотоксический ответ против существующих.
Предлагаемое изобретение является эффективным компонентом в комплексном лечении рака молочной железы, не оказывает значимых побочных эффектов и способствует достижению признаков стабилизации болезни.
Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток, включающий выделение мононуклеарных клеток из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции МНК ростовых факторов, нагрузка незрелых дендритных клеток антигенами лизата аутологичных опухолевых клеток рака молочной железы in vitro, стимуляцию созревания дендритных клеток, совместное культивирование дендритных клеток с лимфоцитами неприлипающей фракции в соотношении 1:10 с добавлением IL-12 и IL-18, отличающийся тем, что добавление к прилипающей фракции мононуклеарных клеток ростовых факторов осуществляют в течение 72 часов, нагрузку дендритных клеток антигенами опухолевого лизата проводят в течение 24 часов, стимуляцию созревания дендритных клеток осуществляют в течение 48 часов, затем производят оценку экспрессии маркеров на поверхности зрелых дендритных клеток, а препарат, полученный при совместном культивировании в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток, замораживают с последующей разморозкой и фракционированием, причем фракционирование размороженных клеток и их культивирование осуществляют в течение 2-4 часов непосредственно перед инъекцией, в результате чего клетки разделяются на прилипающую и неприлипающую фракции, а затем обогащенную дендритными клетками прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов.
источник
Современные клиники за рубежом располагают огромным арсеналом средств для успешного лечения рака груди. В большинстве случаев рак успешно лечится, но у некоторых пациенток случаются рецидивы. Чтобы их предотвратить, ученые разработали специальную противораковую вакцину.
Специалисты, работающие в области онкологии, отмечают, что лечение рака молочной железы проводится с помощью разных методик. Применяются традиционные и новые способы лечения, используются все доступные медикаменты. Но даже при успешном завершении лечебного курса, женщины рискуют столкнуться с рецидивирующей онкологией груди. С помощью системной терапии, которая сейчас практикуется в онкологии, сложно предотвратить рецидив, поэтому и ведется работа над созданием специальной профилактической вакцины, которая станет частью адъювантной терапии.
В настоящее время борьба с рецидивами рака груди ведется с помощью адъювантной терапии, которая подбирается в персональном порядке. Это может быть радиотерапия, назначенная после органосохраняющей операции. Также может быть назначена иммунотерапия или гормональная терапия.
В будущем планируется применение вакцин, препятствующих рецидивам рака груди. Причем они не будут замещать профилактические, уже существующие, мероприятия. Вакцина от рака груди станет дополнительным способом щадящего адъювантного лечения, предназначенного для тех пациенток, которые хотят свести к минимуму риски возникновения онкологического рецидива.
В основе действия вакцины против рака заложено стимулирование иммунной системы онкологических больных на выявление и разрушение раковых клеток. Такой препарат состоит из опухолевого антигена. Когда его вводят в организм пациенток, их иммунная система начинает реагировать.
Для изготовления опухолевых антигенов берутся белые клетки крови больного, после чего они вводятся в организм с помощью вакцин разных типов:
- дендритно-клеточных;
- вирусно-векторных;
- цельноклеточных.
В настоящее время Управление по контролю продуктов питания и лекарств США одобрило лишь одну вакцину от рака. Это дендритно-клеточная вакцина сипулейцел. С ее помощью лечат рак предстательной железы с метастазами, который невозможно вылечить гормонотерапией.
Онкологи центра имени Андерсона в США используют пептидные вакцины. Для их изготовления из опухолевого антигена, в основном HER2 (онкопротеина), извлекаются цепочки молекул пептидов. Затем к ним добавляется иммуноадъюванты, провоцирующие иммунную реакцию. В онкоцентре им. М.Д. Андерсона проходят клинические испытания с применением гранулоцит-макрофаг колониестимулирующего фактора (GM-CSF). Этот иммуноадъювант уже используется в медицине для терапии нейропении, которая возникает у пациентов после трансплантации. Когда вышеуказанный препарат попадает в организм, то в месте введения вакцины активизируются дендритные клетки, при этом улучшается работа иммунной системы.
Сейчас специалисты онкоцентра им. М.Д. Андерсона проводят испытания вакцин на основе пептидов, изготовленных из онкопротеина (HER2). Такая вакцина против рака груди показывает отличные результаты у пациенток с нормальным количеством HER2 и негативной раковой опухолью, а также со средним содержанием HER2 и отсутствием карциномы молочной железы.
Испытания данной вакцины проходят третью фазу. В состав используемого пептида входит девять видов аминокислот. Когда молекулы комплекса гистосовместимости 1-го класса взаимодействуют с ними, происходит стимуляция CD-8 положительных клеток (Т-клеток). Такие Т-клетки находят раковые клетки среди здоровых и начинают их атаковать, при этом вырабатываются цитотоксические ферменты, развращающие клетки рака. Стоит отметить, что активировать Т-клетки способны только клетки HLA-A2 или HLA-A3. Поэтому вакцина на основе пептида Е75 назначается пациенткам, у которых клетки положительные к антигену указанных типов лейкоцитов.
По состоянию на май 2012 года специалисты хирургического отделения онкологии центра им. М.Д. Андерсона озвучили результаты первых двух фаз испытания вакцины на основе пептида Е75. После этого планируется приступить в третьей фазе испытаний, которые должны доказать эффективность вакцины Е75 в профилактике развития рецидива узлового рака груди у пациенток со средним и низким содержанием онкопротеина HER2.
Для проведения плацебо-контролируемого испытания выбран двойной слепой метод. Участвовать в испытании будут семь сотен пациенток, прошедших стандартное лечение рака молочной железы. Обязательное условие — рак HER2 1+ или HER2 2+, а также положительность HLA-A2- или HLA-A3.
Сначала женщины будут получать вакцину в течение полугода один раз в месяц. Затем инъекции будут продолжены на регулярной основе — в течение трех лет с периодичностью каждые полгода. Созданная вакцина должна улучшить показатели трехлетней выживаемости пациенток, прошедших лечение рака груди. Проводимые исследования позволят убедиться в эффективности такой прививки. Если препарат оправдает ожидания, то в будущем он будет входить в стандартную программу терапии рака груди.
По структуре и принципу воздействия вакцина GP2 аналогична вакцине Е75. Пептид АЕ37 отличается от перечисленных препаратов более длинной цепочкой, способностью связываться с молекулами комплекса гистосовместимости 2-го класса. Данная вакцина активизирует CD4-положительные клетки, при этом иммунная система выражена более ярко. Пептид АЕ37 можно представить клетками большинства типов HLA, кроме того данный пептид взаимодействует с li-Key белком, улучшая работу иммунной системы.
Вакцины АЕ37 и GP2 переходят на 3 этап испытания, который покажет, насколько препараты результативны для профилактики рецидива злокачественной опухоли груди (негативно-узлового и позитивно-узлового), связанного с высоким риском рецидивирования. Пациентки одной группы, которые участвуют в исследовании, делятся еще на несколько групп с учетом типа HLA, после чего проводится вакцинация соответствующим препаратом. Другая группа пациенток получает инъекции иммунадъювантов.
Для уточнения результатов испытаний специалисты провели дополнительный анализ, показавший, что применение пептида АЕ37 и GM-CSF позволило на 43% снизить показатель рецидивов.
Противораковые вакцины, которые исследуют специалисты американского онкоцентра, характеризуются ценовой доступностью и возможностью приобретения в свободной продаже. Они дешевле дендритно-клеточных вакцины, которые изготавливаются персонально для каждой пациентки.
Пациенты из Америки и других стран с радостью принимали участие в испытании. После его окончания женщины отметили, что вакцины оказались результативными, при этом они практически не вызвали побочных эффектов. Среди последствий вакцинации стоит отметить появление покраснения в месте введения инъекции. Также некоторые женщины столкнулись с легкими проявлениями гриппа, которые присутствовали после вакцинации на протяжении шести часов. Пациентки с легкостью перенесли эти проявления, ведь ранее им уже пришлось проходить лечение рака в Израиле химиотерапией, которая сопровождается серьезными проблемами с ЖКТ, выпадением волос и т.п.
При многочисленных плюсах новые вакцины применимы не для всех пациенток. Клинические исследования показали, что вакцинация не дает должного результата, если рак развился до поздней стадии, и сопровождается обширным метастазированием.
В будущем планируется разработка новых вакцин против рака на основе белка и циклина Е, которые содержатся в фолатах. Ведется активная разработка новых иммуноадъювантов, которые будут еще сильнее активизировать иммунную систему. Исследуются возможности эффективного сочетания вакцины с другими препаратами.
Кроме того, вакцины вполне могут стать результативным способом борьбы с раком ранних стадий, которую можно начинать, как только пациентке ставится окончательный диагноз. При таком подходе результативность терапии рака груди значительно улучшится.
источник