Возможно, что хоть раз в своей практике каждый практикующий гинеколог наблюдал беременных пациенток, у которых во время беременности было диагностировано онкологическое заболеваний. Первым желанием любого врача будет рекомендация избавиться от беременности и заняться самым безолагательным лечением злокачественного заболевания. Но все меняется, в том числе и подходы к наблюдению и ведению таких пациенток.
РМЖ и беременность
Вопрос — влияет ли беременность на рост опухоли молочной железы и способствует ли ее распространению — волнует каждого гинеколога. Еще в 1880 г. С. Гросс высказал мнение, что РМЖ, развивающийся на фоне беременности и лактации, отличается быстрым ростом и более выраженным злокачественным течением. С годов прошлого века в литературе начинают появляться более оптимистичные прогнозы относительно течения и отдаленных исходов заболевания у больных данной группы.
По данным зарубежным материалов, на 3000 беременностей приходится 1 случай РМЖ. По данным Т. White, основанным на наблюдении 45 881 женщин, РМЖ развивается на фоне беременности или вскоре после родов у 2,8% обследованных. По другим данным до 7,3% женщин моложе 45 лет, страдающих РМЖ, являются беременными или кормящими.
25% случаев заболевания встречается в возрасте до 45 лет, в активный репродуктивный период, а около 70% случаев РМЖ, связанных с беременностью и лактацией, отмечается в молодом возрасте (данные American Cancer Society).
На сегодняшний день научных и клинических доказательств возникновения опухоли во время беременности de novo нет. Поэтому с большей долей вероятности можно предположить, что онкологический процесс, диагностированный во время беременности, — следствие уже имеющегося скрытого опухолевого процесса в молочной железе, просто ранее не обнаруженного.
Но угроза прогрессирования заболевания во время наступления беременности всегда будет существовать. Многие гинекологи знают, что пациентки, заметившие в начале беременности лишь небольшую по размерам опухоль, через 9 месяцев при отсутствии лечения обращаются к онкологу на поздней стадии. Возможно, подъем уровня половых гормонов во время беременности стимулирует рост уже имеющейся опухоли, которая связана с естественным повышением уровня эстрогенов и прогестерона. Помимо этого, обильное кровоснабжение молочной железы стимулирует развитие опухоли.
25–35% женщин, обнаруживших узел в молочной железе, к врачу не обращаются, списывая это образование на специфические изменения молочных желез при беременности. Следствие этого — поздняя диагностика опухоли.
По частоте встречаемости во время беременности встречаются:
- Рак молочной железы — 50% всех опухолей и опухолевидных образований, выявляемых во время беременности
- Галактоцеле
- Хронический лактационный мастит
Особенностями РМЖ при беременности является быстрая инвазия в окружающие ткани, что ведет к возникновению острых и форм рака, быстрая диссеминация опухолевого процесса, метастатическое поражение лимфатических коллекторов разного уровня, вплоть до надключичных.
Гистологические варианты РМЖ, наблюдаемые у молодых женщин, не зависят от того, беременны они или нет. Наиболее часто у этих женщин наблюдается инвазивный протоковый тип (75–90% наблюдений) [5]. формы встречаются чрезвычайно редко: 1,5–4% наблюдений. Более высокая частота лимфогенных метастазов характерна для РМЖ у молодых женщин, а не для рака в сочетании с беременностью
К моменту установления диагноза средние размеры опухоли колеблются от 5–6 до 15 см, частота распространенных форм — от 72 до 85%, при этом в 20% случаев выявляются метастазы во внутренние органы.
В РОНЦ им. проблемой РМЖ у беременных занимаются с 1972 года. По данным этого учреждения из числа наблюдавшихся беременных и лактирующих женщин 21% к моменту диагностики рака признаны . В 88% процесс оказался местнораспространенным и лишь в 12% — локальным. Наиболее частыми у обследованных в этот период наблюдения оказались маститоподобная, и формы рака. К настоящему времени Центр располагает данными более чем о 200 случаях сочетания РМЖ, ассоциированного с беременностью.
Диагностика РМЖ во время беременности
- Резкое увеличение массы молочной железы во время беременности и лактации. Увеличивающаяся во время беременности молочная железа, изменение ее плотности, могут маскировать опухолевый процесс, и часто ни врач, ни сама женщина не могут представить о таком сочетании беременности и рака.
- Методом обследования женщины при обнаружении узлового образования в молочной железе является УЗИ молочной железы. В 85% случаев оно способно помочь правильно поставить диагноз и своевременно направить женщины к онкологу.
- Маммография может применяться при адекватном экранировании и защите плода в исключительных случаях, а именно если по УЗИ выявляется подозрительный на рак участок, который сливается с гипертрофированными тканями, при отсутствии возможности четко дифференцировать злокачественную опухоль.
- «Соr»-биопсии или эксцизионная биопсия, проводимая под местной анестезией.
- Выявление метастазов — МРТ.
Лечение и ведение пациенток. Необходимость прерывания беременности
Повышение количества эстрогенов в начале беременности, как и увеличение уровня гормонов желтого тела и плаценты во ее половине, стимулируют рост опухоли в молочной железе. Но, несмотря на чувствительность опухолевой ткани к гормональной стимуляции в период беременности и лактации, при сравнении сопоставимых по возрасту и стадии процесса групп больных выживаемость среди беременных и небеременных женщин оказалась одинаковой.
Прерывание беременности с последующим проведением стандартной химиотерапии не улучшает прогноз заболевания. Даже при распространенных формах болезни выборочное прерывание беременности с последующим выключением функции яичников не позволяет существенно улучшить выживаемость. Таким образом, прерывание беременности у женщины, страдающей РМЖ, не является эффективной и адекватной мерой борьбы с заболеванием.
Если же пациентка принимает решение о прерывании беременности, то планирование лечения РМЖ в дальнейшем не отличается от такового у небеременных женщин. Наличие бывшей беременности может учитываться в таком случае как один из факторов неблагоприятного прогноза.
Алгоритм ведения пациентки:
- Совместное решение врачей, пациентки и ее семьи — сохранение или прерывание беременности.
- При решении прервать беременность — лечение начинается немедленно в полном объеме после прерывания беременности.
- При решении сохранения беременности — лечение откладывается до родов. Прогноз неблагоприятный.
В настоящее время есть методики, позволяющие проводить лечение беременных женщин с минимальным влиянием на плод.
1 этап — радикальная мастэктомия. Операция и анестезиологическое пособие во всех триместрах беременности безопасны для матери и для ребенка, не приводят к преждевременным родам, самопроизвольному аборту.
2 этап — химиотерапия и лучевая терапия
Лечение РМЖ в зависимости от триместра беременности
1 триместр — высокий риск развития врожденных уродств плода (10–20%) и самопроизвольных абортов.
2 и 3 триместры — увеличивается частота преждевременных родов, миелосупрессии у матери и плода, кровотечений и инфекций, задержки роста плода, рождения мертвого плода.
Andercen Cancer Center (США) опубликовал свои данные по наблюдению за 54 пациентками с беременностью и РМЖ. Средний срок беременности составлял 22,8 недель (от 10 до 34 недель).
23 (43%) из них получали неоадъювантную ХТ и 85% пациенток амбулаторно получали ХТ по схеме PAC во 2 и 3 триместрах беременности с последующим оперативным лечением.
Оперативное лечение выполнено 56% пациенток на любом сроке беременности.
Лучевая терапия проводилась после родов.
Роды происходили в среднем на 37 неделе.
Состояние детей: Масса тела рожденных детей составляла 2964 г. в среднем.
У 1 ребенка — субарахноидальное кровоизлияние, 1 ребенок — синдром Дауна.
На момент публикации исследования (2005 год) были живы 76% пациенток.
Выводы проведенного исследования:
Оперативное лечение безопасно на любом сроке беременности, проведение химиотерапии целесообразно на 2 и 3 сроках беременности. Лучевая терапия проводится после родов.
- Доксорубицин — менее токсичен по сравнению с другими препаратами в 1 триместре беременности, и относительно безопасен в других сроках беременности. Описано много наблюдений применения доксорубицина во 2 и 3 триместрах без отрицательного влияния на плод.
- Циклофосфан — стоит вторым в ряду после доксорубицина по токсичности, наряду с которым является препаратом выбора для лечения беременных с РМЖ.
- Метотрексат и — наиболее токсичные препараты, но последний все же применяется в схеме PAC.
- Таксаны — мало доступной информации по их применению у беременных.
У беременных ЛТ не применяется ее тератогенных свойств. Пороговой повреждающей дозой для плода в I и II триместрах считается 0,1 Гр; доза от 0,1 до 0,15 Гр приводит к дефектам развития, нарушениям ЦНС, доза 0,5- 1 Гр — к задержке развития, а доза 1–2,5 Гр — к уродствам. В III триместре плод менее чувствителен к лучевым воздействиям, но, тем не менее, от лучевой терапии воздерживаются на протяжении всей беременности.
Поля облучения можно сконцентрировать на МЖ, грудной клетке, подмышечных лимфатических узлах. На протяжении первых 2х недель беременности лучевая терапия может привести к спонтанному аборту. Между 2 и 8 неделями беременности повышается риск пороков развития плода. Лучевая терапия после 8 недель беременности приводит к задержке психосоматического развития новорожденных; на протяжении жизни у них повышается риск развития онкологических заболеваний
Результаты двух рандомизированных исследований показывают, что химиотерапия и лучевая терапия будут эффективными, если проводятся в течение 7 месяцев после хирургического лечения. Если интервал более длительный, адьювантная терапия неэффективна.
Споры о целесообразности проведения профилактической кастрации у пациенток, перенесших РМЖ на фоне беременности, все еще продолжаются. Пока нет достаточных оснований утверждать, что кастрация удлиняет срок безрецидивного течения и предупреждает метастазирование. Есть также мнение, что отдаленные результаты лечения у больных РМЖ, забеременевших впоследствии, лучше, чем у больных, перенесших овариэктомию. Объяснить это можно тем, что только при длительном безрецидивном течении болезни после операции женщина может решиться на новую беременность.
Выбора метода лечения в зависимости от стадии заболевания
- При начальных стадиях (Т1abN0М0) рекомендуется модифицированная радикальная мастэктомия с сохранением обеих грудных мышц с отсроченной реконструкцией. Органосохраняющие операции, требующие послеоперационной лучевой терапии, противопоказаны в I триместре беременности. Лучевая терапия может быть отложена до послеродового периода. Адъювантная химиотерапия при раннем раке (Т1abN0М0) и благоприятных прогностических факторах не рекомендуется, поскольку выживаемость в таких случаях достигает 100%, а рецидивы опухоли не возникают.
- При неблагоприятных факторах прогноза (недифференцированные, анапластические опухоли, отрицательные гормональные рецепторы опухоли) в начальных стадиях рекомендуется (после родов) адъювантная химиотерапия. При положительных рецепторах после химиотерапии назначают антиэстрогены.
- При IIа (Т1N1М0, Т1N1М0, Т2N0М0) — IIb (Т2N1М0, Т3N0М0) стадиях — модифицированная радикальная мастэктомия с отсроченной пластикой является операцией выбора в течение всего срока беременности. При решении пациентки прервать беременность химиотерапию назначают сразу после операции. Секторальная резекция с подмышечной лимфаденэктомией и последующей лучевой терапией предусматривает необходимость прерывания беременности в I триместре. Если беременность сохраняется и на ее фоне выполняется органосохраняющая операция, лучевую терапию следует отложить до послеродового периода.
- Если пациентка информирована о возможном риске для плода и отказывается от лекарственного лечения, после операции дополнительная терапия может быть отсрочена до момента раннего родоразрешения. Тамоксифен при эстрогенположительных рецепторах назначают после завершения беременности и проведения адъювантной химиотерапии.
- При РМЖ в стадии IIIa (М0; ), IIIb (), IIIc (любая TN3M0) и при формах РМЖ, рекомендовано прерывание беременности в качестве этапа лечения. Если же пациентка обратилась к врачу в III триместре беременности и считает (как и ее семья) приоритетом здоровье плода (будущего ребенка), в этом случае лечение начинается после раннего родоразрешения.
В случае полной информированности больной обо всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах предлагается неоадъювантная терапия по схеме АС (адриамицин, циклофосфан). После окончания химиотерапии и выполнения модифицированной радикальной мастэктомии при эстрогенположительных рецепторах назначают гормонотерапию (после родов).
Если у беременной диагностируется распространенный РМЖ с (множественными) отдаленными метастазами, после беседы с родственниками пациентки приоритетной целью становится здоровье плода/ребенка. Выбор метода лечения следует определять индивидуально и предпочтительно консилиумом (хирург, химиотерапевт, специалист по лучевой терапии, психолог) с учетом распространенности опухоли и сроков беременности.
Отсутствуют отдаленные данные о судьбах и здоровье детей, родившихся от матерей с РМЖ во время беременности.
Беременность после лечения РМЖ
Вопрос о повторной беременности после перенесенного РМЖ широко обсуждается в онкологических кругах. Некоторые ученые считают, что требуется категорически запретить последующие беременности, другие считают, что минимальный интервал между лечением и последующей беременностью составляет от 6 месяцев до 5 лет.
Прогноз заболевания
Многочисленные современные исследования свидетельствуют, что в случае одинакового возраста пациенток и одинаковой стадии развития заболевания прогноз не зависит от наличия или отсутствия беременности. По данным французских авторов, разница в продолжительности жизни у пациенток с одинаковой стадией на момент установления диагноза достоверно не отличается от наличия и отсутствия беременности, а также при стадии опухоли N+ и N-. В то же время существует много работ о том, что у беременных женщин рак выявляется впервые в более запущенной стадии, чем вне беременности. Именно запоздалая диагностика объясняет, почему продолжительность жизни без метастазов и показатели пятилетней выживаемости больных хуже при сочетании РМЖ и беременности.
В литературе не описано отрицательного влияния РМЖ на состояние плода. Неизвестны также случаи передачи заболевания плоду. Описано 60 случаев метастазов РМЖ в плаценту без поражения плода. Если на протяжении первого триместра беременности пациенткам не назначалась химиотерапия, частота пороков развития плода идентична таковой в общей популяции и составляет 2–3%.
Проблема РМЖ и беременности является комплексной. Она требует коллективного участия врачей различных специальностей (рентгенологов, генетиков, , онкологов), а также разработки единой программы поэтапного обследования беременных для выявления болезни на максимально ранних сроках.
Целесообразно для решения этой проблемы включить молочных желез в план наблюдения беременной женщины (либо на этапе планирования беременности, либо в I триместре беременности).
Материал подготовила ,
Научный редактор «Академии Амбулаторной Гинекологии»
Журнал «Маммология», №1, 2005.
Газета «Новости медицины и фармации» Маммология (298), 2009
источник

Итак, к дополнительным факторам риска по развитию рака груди при беременности (и вне ее тоже), относятся также явления мастопатии, доброкачественные образования в молочных железах, разного рода новообразования в молочной железе различного характера – фиброзные, кистозные, аденоматозные. Риск при таком состоянии повышен примерно в два-три раза. Также рискуют чаще получить рак женщины с перенесенными травмами груди или без операции пролеченные явления маститов во время лактации, особенно с полостями или гноем. Также сильнее рискуют те, кто переносили в более раннем возрасте другие онкологические заболевания по гинекологии, а также при наличии у родных рака эндометрия или рака яичников, это повышает в два с лишним раза риски рака МЖ.
Есть также и группа факторов риска со стороны внешней среды и питания женщин, влияющих на развитие рака молочной железы. К таковым относят курение с подросткового возраста, что повышает риски онкологии для женщины в любой ее локализации. Также сильно влияет и употребление алкоголя в достаточно большом количестве, особенно если это пиво, предположительно повышающее уровни эстрогенов в организме женщины до более высоких цифр. Сильно влияет на развитие РМЖ наличие избыточного веса тела и преобладание в организме жиров.
Так, были проведены исследования, доказавшие снижение риска РМЖ примерно на 40% у женщин, которые занимаются спортом или хотя бы ежедневно прогуливаются не менее одного часа. Одним из сильно действующих факторов риска для женщин возрастом до тридцати лет, особенно в период полового созревания и формирования груди, являются воздействия ионизирующего излучения. Поэтому, сегодня для детей и подростков, а также молодых женщин предпочтительными методами исследования груди является ультразвук, а не рентгеновское исследование. Также проводятся до сих пор исследования влияния на развитие РМЖ контрацептивных препаратов, и многие специалисты высказывают достаточно обоснованные идеи их негативного влияния на грудь. Но одних факторов риска не достаточно для того, чтобы развился однозначно рак. Почему точно он начинает развиваться, пока не знает никто из медиков и ученых.
Что делать, если есть подозрения на опухоль?
Таким вопросом может задаваться любая женщина, даже не будучи беременной, обнаружив в своей груди какое-либо образование или уплотнение, дефекты кожи или что-либо другое. Если (вне беременности. ) выявлено увеличение размера груди, потемнение сосков или ареолы, ярко видимая венозная сеть на груди или же возникновение растяжек (стрии) в области кожи, а также ощущение небольшой болезненности или же даже боли – это повод побеспокоиться, и вспомнить, когда в последний раз вы были на осмотре у маммолога или гинеколога из женской консультации. Проводили ли вам УЗИ молочной железы или маммографию (в возрасте старше сорока лет). Если вы затруднились с ответом, тогда стоит вам сделать следующие мероприятия.
Прежде всего, стоит провести самообследование груди. Важно осмотреть ваше нижнее белье в местах соприкосновения ее с сосками груди, и убедиться в том, что отсутствуют какие-либо выделения или темные пятна. Но стоит помнить, что выделения из груди при беременности вполне нормальны и закономерны – это развитие груди и ее подготовка к лактации и данный признак для беременных не будет актуальным. Особенно часто выделения молозива из сосков возникают во втором триместре, примерно после срока в 26-30 недель. Но до беременности и после окончания периода грудного вскармливания никаких выделений из груди быть не должно. При этом цвет нормальных выделений из груди при беременности является молочно-желтым, если это зеленоватые, бурые или кровянистые выделения, назвать их нормальными нельзя. С такими выделениями или с сомнениями по поводу выделений из груди и отличий молозива от других патологических выделений стоит обратиться к доктору.
Затем стоит внимательно осмотреть соски и ареолу груди, при беременности они потемнеют и слегка увеличатся в размерах, могут отчетливее проступать особые железы Монтгомери вокруг соска. Но при всем этом на соске и на ареоле не должно быть шелушений, каких-либо втяжений кожи, красноты или высыпаний, и тем более кровоточивости, эрозий и язвочек, других нетипичных изменений. Нужно далее встать перед зеркалом и поднять руки вверх, заложить их за голову, и внимательно осмотреть форму и размер груди. Важно сравнить форму обеих грудей и отметить, нет ли их изменения или деформации. Также стоит тщательно смотреть каждую грудь на предмет выпуклостей или втяжения, деформированных участков ткани, отечности кожи или ее изменения. В случае, если возникает отек тканей, кожа может приобретать вид апельсиновой корочки.
Следующим важным этапом в осмотре и самообследовании груди является ее тщательное прощупывание (пальпация), такой метод очень эффективен и несет важную информацию о том, в каком состоянии находится молочная железа в ранние сроки беременности. Разного рода грубые и объемные изменения в области молочной железы можно определить вполне самостоятельно при прощупывании в любом сроке беерменности, более мелкие и глубоки определить можно далеко не всегда. Стоит взять за правило ощупывание молочных желез легкими круговыми движениями по направлению движения спирали или прощупывая ее по сегментам от области сока к области периферии, и определяя плотность различных участков груди, выделяя отдельно участки с меньшей и большей плотностью. После прощупывания груди нужно также прощупать область подмышек и подмышечную впадину, нет ли там мелких шишечек в вид увеличенных лимфоузлов (они прощупываются под кожей и в тканях как горошинки или фасолинки). Но стоит помнить, что во время беременности возможно небольшое увеличение лимфоузлов, но оно обычно двустороннее и незначительное. Если вы отметили у себя какое-либо изменение в молочной железе, не тяните с обследованием, тем более во время беременности, отправляйтесь к своему наблюдающему врачу.
Что нужно сделать на приеме у гинеколога
К большому сожалению, далеко не все врачи-гинекологи на участках хорошо знакомы с данной патологией, так как около 10% врачей могли встречать в своей практике подобные проблемы в здоровье, тем более у беременных женщин. При обследовании и опросе женщины высоко квалифицированный доктор будет ориентироваться для исключения всех других заболеваний молочных желез только на свой клинический опыт и на врачебные знания. Но сегодня ко всем этим знаниям добавляются и многочисленные методы объективного обследования и диагностики. Самыми доступными и самыми безопасными для беременных будут анализы и проведение ультразвукового обследования. Если в женской консультации имеется собственный аппарат УЗИ, а они сегодня есть почти во всех клиниках, стоит пройти обследование там. Если же аппарата УЗИ нет, нужно обратиться в любую частную или государственную клинику, онкологический стационар или больницу.
На первичном этапе диагностики по УЗИ специалист поможет определить, имеется ли на самом деле патология в молочных железах или это просто изменения, связанные непосредственно с самой беременностью, а также поможет диагностировать опухоли или кисты, аденомы и прочие образования. Обычно на этом этапе, при обнаружении подозрительных новообразований или уплотнений в груди, проводится консультация специалистов, в том числе и онколога, и женщина направляется на более детальное и углубленное исследование груди уже в онкологическом стационаре.
При направлении к врачу-онкологу
Не стоит сразу же паниковать и бояться врача онколога при направлении в онкологический стационар. Большинство из обнаруженных образований в груди являются доброкачественными, и поддаются лечению, либо проходят после рождения ребенка и кормления грудью. Кроме того, современная медицина сегодня дает женщинам возможности консультирования у врачей, имеющих большой опыт в лечении таких же пациенток и которые помогут женщине благополучно и выносить беременность, и сохранить здоровье груди. Онкологические стационары на сегодня располагают целым набором достаточно точных и эффективных методов исследования, при этом они никаким образом не повредят здоровью развивающегося в утробе плода и позволят поставить диагноз максимально рано и точно. Естественно, что при беременности спектр обследований будет существенно уменьшен, но при этом их вполне достаточно для того, чтобы определить и тип рака, и его стадию и выбрать необходимое для женщины лечение. Завтра продолжим эту тему.
источник
В современной литературе рак молочной жележы (РМЖ), возникший на фоне беременности, лактации либо в течение первого года после завершения беременности, обозначают термином «РМЖ, ассоциированный с беременностью».
Carcinoma mamma.
КОД ПО МКБ-10
C50 Злокачественное новообразование молочной железы.
В зависимости от анатомической локализации опухоли заболеванию присваивают статистический шифр.
· C50.0 Соска и ареолы.
· C50.1 Центральной части молочной железы.
· C50.2 Верхневнутреннего квадранта молочной железы.
· C50.3 Нижневнутреннего квадранта молочной железы.
· C50.4 Верхненаружного квадранта молочной железы.
· C50.5 Нижненаружного квадранта молочной железы.
· C50.6 Подмышечной задней части молочной железы.
Ежегодно в мире выявляют более 1 млн новых случаев РМЖ, прогнозируя рост числа заболевших к 2010 г. до 1,5 млн.
В России РМЖ занимает первое место по частоте среди всех злокачественных новообразований у женщин. Ежегодно регистрируют более 46 тыс. новых случаев РМЖ. Примерно 1 из 10 женщин на протяжении жизни заболевает РМЖ.
Смертность равна половине заболеваемости РМЖ. В 2002 г. в России от РМЖ умерли 22,1 тыс. женщин, что составило 16,7% среди злокачественных новообразований. Среди всех злокачественных новообразований, выявляемых при беременности, РМЖ занимает второе место по частоте после РШМ. На 3000 беременностей приходится 1 случай РМЖ. Около 3% всех наблюдений РМЖ диагностируют во время беременности. До 7,3% женщин моложе 45 лет, страдающих этим заболеванием, — беременные или кормящие.
Классификация РМЖ, ассоциированного с беременностью, не отличается от таковой у небеременных и основана на клинических проявлениях заболевания. В её основу положены восемь признаков: анатомическая локализация и размер опухоли, объём метастатического поражения лимфатических узлов, наличие отдалённых метастазов, стадия развития опухоли (как вариант комбинации её размера и объёма метастатического поражения), а также клеточный тип, гистопатологический уровень дифференцировки и тип экспрессируемых рецепторов клеток опухоли.
Клиническая классификация первичной опухоли и регионарных лимфатических узлов (Международный противораковый союз, 6-е издание. Перевод и редакция проф. Н.Н. Блинова).
Оценка размеров первичной опухоли (T):
·T0 — нет признаков первичной опухоли;
·TX — оценка первичной опухоли невозможна;
·Tis — карцинома in situ; внутрипротоковая карцинома, дольковая карцинома in situ или поражение соска (болезнь Педжета);
·T1 — опухоль 2 cм или менее в наибольшем измерении;
·T1mic — микроинвазия; опухоль 0,1 см или менее 1 см в наибольшем измерении;
·T1а — опухоль более 0,1 см, но менее 0,5 см в наибольшем измерении;
·T1b — опухоль более 0,5 см, но менее 1 см в наибольшем измерении;
·T1c — опухоль более 1 см, но менее 2 см в наибольшем измерении;
·T2 — опухоль более 2 см, но менее 5 см в наибольшем измерении;
·T3 — опухоль более 5 см в наибольшем измерении;
·T4 — опухоль любого размера, прорастающая грудную стенку и кожу;
·T4а — прорастание грудной стенки;
·T4b — отёк (включая симптом «лимонной» корки) или изъязвление кожи молочной железы;
·T4с — сочетание T4а и T4b;
·T4d — воспалительный РМЖ.
Поражение регионарных лимфатических узлов (N): NX (если лимфатические узлы нельзя исследовать по какойлибо причине), N0 (регионарные лимфатические узлы не пальпируются), N1 (метастазы в ипсилатеральные подмышечные лимфатические узлы, при этом последние подвижны), N2 (метастазы в ипсилатеральные подмышечные лимфатические узлы, которые неподвижно фиксированы друг с другом или с окружающими тканями), N3 (метастазы в надключичные и подключичные лимфатические узлы на стороне поражения, метастазы в окологрудинные лимфатические узлы на стороне поражения).
Отдалённые метастазы (М): MX (наличие отдалённых метастазов оценить невозможно), M0 (отсутствие метастазов), М1 (есть отдалённые метастазы; уточнение их локализации в конкретном органе — лёгком, костях, печени, мозге и т.д.).
Стадии РМЖ:
· 0 (ТisN0M0);
· I (Т1N0M0);
· IIA (T1N1M0,T2N0M0);
· IIB (T2N1M0,T3N0M0);
· IIIA (T1N2M0,T2N2M0,T3N1M0,T3N2M0);
· IIIB (T4N0M0,T4N1M0,T4N2M0);
· IIIC (любая Т N3M0);
· IV (любая Т любая N M1).
На заболеваемость РМЖ оказывает влияние ряд факторов.
· Факторы риска развития РМЖ, связанные с репродуктивной функцией.
— Раннее менархе, поздняя менопауза.
— Нерегулярный менструальный цикл.
— Отсутствие беременностей и родов (риск рака снижается на 7% с каждыми родами).
— Поздняя первая беременность и поздние первые роды. У женщин, имевших поздние первые роды (в возрасте старше 30 лет) или не имевших родов вообще, риск заболеть РМЖ в 2–3 раза выше, чем у родивших до 20 лет.
Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска развития РМЖ. Риск возникновения РМЖ в возрасте до 40 лет в 5,3 раза выше у женщин, родивших в возрасте старше 30 лет по сравнению с родившими до 20 лет.
— Продолжительность лактации менее 1 мес. Отсутствие лактации сопровождается увеличением риска возникновения РМЖ в 1,5 раза. Прослеживается обратная зависимость между общей длительностью лактаций и риском развития РМЖ.
· Наследственные факторы. В 5–10% наблюдений РМЖ связан с мутацией генов BRCA1 и BRCA2, что объясняет семейные случаи заболевания. Риск развития РМЖ у женщин-носителей мутантных генов чрезвычайно высок и составляет 80–95% на протяжении всей жизни. Рожавшие женщиныносители данных мутаций существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем нерожавшие. Ранний возраст первых родов в этой группе не снижает риск развития рака.
·Факторы риска, связанные с заболеваниями молочных желёз и других органов.
— Наличие пролиферативной формы фиброзно-кистозной болезни и различных доброкачественных опухолей молочных желёз (риск возникновения рака увеличивается в 2,3 раза).
— Травмы молочной железы, неоперированные лактационные маститы.
· Генитальные факторы риска.
— Рак эндометрия, рак яичников повышают риск развития РМЖ в 2 раза.
— Некомпенсированное влияние эстрогенов также повышает риск РМЖ. Для женщин, у которых естественная менопауза наступила в возрасте до 45 лет, риск развития РМЖ снижается вдвое по сравнению с теми, у кого менструации продолжаются после 54 лет. Показано достоверное снижение риска возникновения рака у женщин с хирургической кастрацией до 40 лет на 47% по сравнению с группой женщин с естественной менопаузой в 45–54 года, причём наименьшее число опухолей обнаружено при искусственной менопаузе до 35 лет.
— Приём синтетических прогестинов повышают риск развития РМЖ.
· Факторы внешней среды.
— Факторы риска внешней среды и питания (курение, алкоголь, избыточный вес).
— Ионизирующая радиация. В качестве фактора риска имеет наибольшую опасность в возрасте до 30 лет (в период от пременархе до 18 лет). Это одна из причин предпочтительного использования УЗИ, а не рентгенологического метода исследования молочных желёз у молодых женщин.
Этиологические факторы, влияющие на возникновение РМЖ на фоне сущест-вующей беременности, предположительно, не отличаются от таковых в группе небеременных пациенток.
Регуляция нормального функционирования молочной железы происходит под влиянием комплексного взаимодействия между различными гормонами.
Гормональное влияние на развитие РМЖ хорошо известно. Эстрогены и прогестерон могут выполнять роль стимуляторов роста опухоли во время беременности, если злокачественная трансформация уже произошла. Это осуществляется в результате индукции синтеза факторов роста, которые стимулируют пролиферацию эпителиальных клеток молочной железы и тормозят апоптоз (транскрипция фактора роста эндотелия сосудов индуцируется эстрогенами, что может привести к патологической неоваскуляризации); стимуляции клеточного роста за счёт отрицательной обратной связи, согласно которой эстрогены нивелируют эффекты ингибирующих факторов роста.
Известен эффект эстрогенов, вызывающих ускорение роста числа микрометастазов, — стимуляция так называемых спящих метастазов. Прогестерон также поддерживает циклическую пролиферацию молочных желёз в течение беременности, стимулируя рост эпителия. В зависимости от продолжительности воздействия прогестерон может потенциально видоизменять ответ как нормальных, так и раковых клеток молочной железы на различных уровнях.
Гипертрофия, набухание молочных желёз, изменение консистенции, усиленная васкуляризация, а также ряд возможных осложнений (мастит, галактоцеле) затрудняют осмотр и маскируют развивающуюся опухоль во время беременности и лактации.
Наиболее характерной жалобой у 95% больных бывает определение болезненных неоформленных опухолевидных масс в ткани молочной железы, часто сопровождающихся дискомфортом в области соска (болезненность, покалывание, отёчность); изменение состояния всей молочной железы в виде асимметричного набухания и уплотнения; одностороннее увеличение лимфатических узлов. Втяжение соска, наличие кожных симптомов (например, «симптом площадки»), как правило, не отмечают.
Нередко в анамнезе у заболевших раком на фоне беременности есть пролиферативная форма фиброзно-кистозной болезни, а также различные доброкачественные опухоли молочных желёз. В 45–50% случаев пациентки, ранее имевшие беременность, перенесли лечение по поводу лактационного мастита. Нередко пациентки отмечают случаи РМЖ в своей семье. При сборе анамнеза женщины указывают на длительный период наблюдения опухоли. В 82% случаев пациентки самостоятельно выявляют опухоль в I триместре. Треть заболевших на фоне беременности при первом выявлении опухоли не обращаются за врачебной помощью, а при подозрении на злокачественный процесс в 25% случаев отказываются от диагностических мероприятий. С момента появления первых симптомов до
установления диагноза врачом у беременной женщины проходит гораздо больше времени, чем в обычной ситуации (15 и 4 мес соответственно). Поздняя диагностика РМЖ в период беременности приводит к отсрочке начала лечения в среднем на 2–3,5 мес. Установлено, что 1 мес задержки в лечении увеличивает риск метастазирования в подмышечные лимфатические узлы на 0,9%, а задержка в лечении на 6 мес — на 5,1%. По этой причине к моменту установления правильного диагноза заболевание нередко находится в неоперабельной стадии.
Физиологическая гипертрофия (средний вес молочных желёз, равный приблизительно 200 г, удваивается во время беременности до 400 г), изменение консистенции, отёк, усиленная васкуляризация затрудняют осмотр. Стандартное пальпаторное исследование малоэффективно и в большинстве случаев, особенно на поздних сроках гестации, не позволяет дифференцировать опухоль.
Клинический и биохимический анализы крови больных с РМЖ, ассоциированном с беременностью, не отличаются от таковых у здоровых беременных. Изменение биохимических показателей крови, косвенно указывающих на возможное метастазирование РМЖ в кости или в печень, при беременности не характерно. Так, активность ЩФ при беременности физиологически может увеличиваться от 2 до 4 раз; АЛТ, АСТ, лактатдегидрогеназа обычно находятся на уровне, соответствующем сроку беременности. Уровень половых гормонов и пролактина у больных с РМЖ также соответствует срокам беременности.
Рентгенологическое исследование (маммография) ассоциируется с негативным влиянием на плод. Тем не менее, при адекватном экранировании и защите плода в ряде случаев этот метод диагностики можно проводить. Так, рентгенография в передней и боковой проекции воздействует на плод в дозе только 0,4–0,5 мрад (0,004–0,005 Гр) при доказанной повреждающей дозе, равной 0,05–0,1 Гр. Однако маммография при беременности существенного диагностического значения не имеет и в 25% случаев даёт ложноотрицательную картину — тень опухоли сливается с гипертрофированной железистой тканью (рис. 50-1, см. цв. вклейку). Если удалось визуализировать участок уплотнения (симптом затемнения) в двух проекциях, можно говорить об объёмном процессе. Высокоинтенсивное затемнение неправильной формы, нечёткость контура, наличие микрокальцинатов не позволяют исключить злокачественный процесс. Однако в большинстве случаев чётко определить размеры и структуру опухоли весьма затруднительно.
Рис. 50-1. Рентгенограмма молочной железы в прямой проекции. Рак молочной железы. Беременность 24 нед.
Опухоль чётко не определяется.
УЗИ (ультрасонография) — метод, наиболее рекомендуемый для диагностики рака у беременных и кормящих женщин. С помощью стандартного УЗИ возможно выполнить цветовую и энергетическую допплерографию, количественную оценку скорости кровотока в визуализируемых сосудах. В 97% случаев метод УЗИ позволяет провести дифференциальную диагностику кистозных образований с солидными (рис. 50-2, см. цв. вклейку). При сонографии РМЖ представляет собой гипоэхогенное образование (тёмносерые оттенки на экране), неправильной формы без чётких контуров, неоднородной структуры, с гиперваскуляризацией
Рис. 50-2. Сонограмма молочной железы. Пациентка, 23 года. Беременность 11 нед. Фиброаденома.
МРТ можно применять во время беременности, так как данный метод не несёт радиоактивного компонента. Тем не менее, контрастный препарат гадобутрол не рекомендуется использовать при беременности за исключением случаев крайней необходимости. В настоящее время в России МРТ молочных желёз исследуют и используют в диагностике случаев, неоднозначно интерпретируемых при маммографии и УЗИ. Оценка количественной характеристики динамического накопления контрастного вещества (интенсивное), а также качественные характеристики выявленного патологического процесса (нечёткие, тяжистые контуры) позволяют дифференцировать злокачественный процесс.
Цитологическое и гистологическое исследования пунктатов и биоптатов молочной железы — наиболее достоверные методы диагностики. Результат цитологического исследования у беременных во многом зависит от опыта работы цитолога с аналогичными случаями.
Эксцизионную биопсию, выполняемую под местной анестезией, считают «золотым стандартом» при любой неясной патологии в молочной железе. При завершённой беременности для снижения риска развития лактационного свища рекомендуют прекратить лактацию приблизительно за неделю до проведения манипуляции (каберголин). После выполнения биопсии назначают холодовое воздействие на молочные железы и их тугое бинтование. Техника «Cor- биопсии» образований в молочной железе высокоспецифична и высокочувствительна (рис. 50-3, см. цв. вклейку)
Морфологу, выполняющему исследование удалённого препарата, необходимо сообщить о наличии беременности у пациентки. «Сor-биопсия» позволяет не только получить достаточное количество материала для верификации диагноза, но и выполнить целый набор иммуногистохимических исследований для определения прогноза и тактики лечения пациентки (рецепторный статус опухоли, экспрессия гена Her2-neu, Ki-67 и т.д.). РМЖ у беременных имеет то же гистологическое строение, что и в группе небеременных. От 70 до 90% опухолей соответствует инфильтративному протоковому РМЖ. У беременных чаще наблюдают опухоль больших размеров с выраженным внутрипротоковым компонентом, метастатически изменённые регионарные лимфатические узлы, распространение раковых эмболов по лимфатическим щелям. Как правило у беременных, больных РМЖ, определяют эстроген и прогестеронотрицательные опухоли.
Рис.50-3. Аппарат-игла для проведения «Cor-биопсии».
Выявление отдаленных метастазов в печени без риска для плода может быть произведено с помощью УЗИ и МРТ.
Радиоизотопное исследование костей скелета для выявления метастазов выполняют чрезвычайно редко, поскольку данный метод исследования несёт 0,00194 Гр лучевой нагрузки на плод.
Программа скрининга подразумевает маммографическое и физикальное исследования, а также самообследование женщиной молочных желёз. У беременных наиболее рациональными, доступными и информативными методами скрининга считают самообследование молочных желёз и УЗИ. Схема ультразвукового скрининга при беременности, регламентированная приказом №457 МЗ РФ «О совершенствовании пренатальной диагностики в профилактике наследственных и врождённых заболеваний у детей» включает три обязательных исследования в 10–14, 20–24 и 32– 34 нед беременности, позволяющие своевременно диагностировать ВПР. Считают рациональным одномоментно выполнять и контрольные УЗИ молочных желёз.
Дифференциальную диагностику РМЖ у беременных и кормящих женщин следует проводить с маститом, фиброаденомой, листовидной опухолью молочной железы, галактоцеле, липомой, лимфомой, гамартомой, саркомой, туберкулёзом. Постановка диагноза «лактационный мастит» при наличии злокачественной опухоли в молочной железе — типичная ошибка в клинической практике. Кроме совпадения сроков проявления истинного лактационного мастита и РМЖ не редкостью бывает и совпадение клинической картины (рис. 50-4, 50-5, см. цв. вклейку).
Рис. 50-4. Пациентка, 21 год. Беременность 16 нед. Рак молочной железы (отёчно-инфильтративная форма).
Рис. 50-5. Пациентка, 25 лет. Беременность 24 нед. Мастит.
В последние годы всё чаще наблюдают стёртые формы воспалительных поражений молочной железы, характеризующиеся, если не полным отсутствием, то, по крайней мере, слабой выраженностью типичных клинических проявлений. Так, гнойный мастит может протекать с нормальной или субфебрильной температурой, без озноба, без выраженных изменений картины крови, при вялой воспалительной реакции. В клинике возрастает число случаев необоснованного и неадекватного применения лечебных физиотерапевтических процедур, которые стимулируют диссеминацию злокачественного процесса и приводят к быстрой инвазии в окружающие ткани, образуя так называемые острые, или диффузно-инфильтративные, формы рака.
При обнаружении опухоли и при её цитологической верификации необходимо коллегиальное обсуждение полученных диагностических данных с участием онколога и акушера. В крупных медицинских центрах на этапе постановки диагноза возможно привлечение медицинского генетика.
В диагнозе указывают локализацию опухоли (правая/левая молочная железа) и соответствие стадии по классификации ТNM. Необходимо указать наличие беременности и срок гестации в неделях.
Рак правой молочной железы T2N0M0 (IIА стадия). Беременность 23–24 нед.
Целью лечения больного с онкологическим заболеванием считают не только достижение максимально выраженного клинического эффекта, но и увеличение продолжительности и улучшение качества жизни. Определение лечебной тактики зависит прежде всего от стадии заболевания, а не от срока беременности. В том случае, когда больная отказывается от медицинской помощи и приоритетом для неё и её семьи представляется защита плода, лечение откладывают до момента родов. Как правило, прогноз у больных, выбравших этот вариант, крайне неблагоприятен.
Второй вариант подразумевает немедленное завершение беременности и проведение лечения в объёме, адекватном стадии опухолевого процесса. Дальнейшее лечение не отличается от такового у небеременных.
Третий вариант, который всё чаще применяют в мировой практике последние 20 лет — проведение лечения без прерывания беременности. При этом можно проводить как оперативные вмешательства, так и лекарственную терапию.
Лечение РМЖ подразумевает комплексный подход, включающий оперативное вмешательство, лекарственное лечение и лучевую терапию. Несмотря на то что лучевую терапию достаточно часто применяют в обычной онкологической практике, для беременных она противопоказана. Тератогенные свойства лучевой терапии, а также угроза развития онкологической патологии у ребёнка, в том числе лейкоза, заставляют воздерживаться от её применения на протяжении всей беременности. При проведении стандартного курса в суммарной дозе, равной 5000 рад (50 Гр), плод получает лучевую нагрузку в пределах от 3,9–15 рад (0,039–0,15 Гр) в I триместре и 200 рад (2 Гр) — к концу беременности. Пороговой повреждающей дозой для плода в I и II триместрах беременности считают 10 рад (0,1 Гр). Доза от 10–15 рад приводит к дефектам развития, нарушениям ЦНС, доза 50–200 рад — к задержке развития, а доза от 100–250 рад — к уродствам.
Спорными вопросами бывают безопасность и возможные побочные эффекты противоопухолевых препаратов в период беременности. Наибольший риск развития уродств у плода возникает при проведении химиотерапии в I триместре беременности — частота ВПР составляет 10–20%, возрастает частота спонтанных абортов.
Химиотерапия, проводимая во II и III триместрах беременности, также может приводить к преждевременным родам и таким осложнениям, как миелосупрессия у матери и плода, кровотечение и инфекционные заболевания, задержка роста, малая масса тела плода, рождение его мёртвым. Отдалённые результаты проведения химиотерапии во время беременности неизвестны. Решение о проведении химиотерапии возможно лишь после разъяснительной беседы с беременной и её семьёй.
В случае полной информированности больной о всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах беременности возможно назначение неоадъювантной полихимиотерапии (доксорубицин, циклофосфамид).
На современном этапе нет отдалённых данных о судьбе и здоровье детей, родившихся у женщин, подвергшихся специфическому лекарственному лечению.
Одним из наиболее действенных методов терапии РМЖ считают гормональное лечение. Однако антиэстрогенное средство тамоксифен оказывает тератогенное действие и противопоказан при беременности.
Оперативное лечение считают основным методом при РМЖ. На начальных стадиях заболевания возможно выполнение оперативного вмешательства в качестве первого этапа лечения. Радикальная мастэктомия или органосохраняющая операция, а также сопровождающее анестезиологическое пособие, не опасны для плода и, как правило, не приводят к самопроизвольному аборту. Радикальная маст-эктомия с сохранением обеих грудных мышц — наиболее рациональный хирургический объём при начальных (I, II) стадиях РМЖ в I триместре, когда больная хочет сохранить беременность. Больные, перенёсшие мастэктомию, не нуждаются в лучевой терапии. Органосохраняющие операции при сохранении беременности нежелательны, так как требуют дополнительной лучевой терапии, а её можно проводить только после завершения беременности. Необходимость выполнения аксиллярной диссекции во всех случаях определяется высокой частотой метастазов в регионарные лимфатические узлы.
При отказе больной от полного удаления молочной железы, при начальных сроках беременности органосохраняющая операция может быть дополнена полихимиотерапией, начиная со II триместра, и лучевой терапией после раннего родоразрешения.
Если диагноз поставлен в конце II триместра или позже, вариантом выбора считают радикальную резекцию с последующей дистанционной лучевой терапией после завершения беременности.
Метод лечения у больных РМЖ, ассоциированным с беременностью, определяют индивидуально с учётом срока беременности и данных о распространённости опухоли предпочтительно консилиумом с привлечением хирурга, акушера, химиотерапевта, радиолога, психолога.
Госпитализация в онкологический стационар показана в случае согласия больной на тот или иной вид лечения. При госпитализации необходимо заключение акушера о сроке беременности, объективная инструментальная оценка жизнеспособности плода, наличия или отсутствия его патологии. Акушер предоставляет заключение о противопоказании к тому или иному виду планируемого лечения.
Оценка эффективности лечения. Лечебный эффект от неоадъювантной химиотерапии определяется на основании сравнения размеров опухоли до лечения и после, наличия отека, гиперемии. Если контроль осуществляется на фоне существующей беременности, необходимо подобрать безопасные для плода методы. После окончания лечения контрольное исследование, включающее, осмотр, маммографию, рентген легких, УЗИ органов брюшной полости, радиоизотопное исследование костей, проводится через 6 месяцев. Последующее обследование — через 1 год.
При местнораспространённом РМЖ (стадии IIIA, IIIB, IIIC), при отёчноинфильтративных формах рака и при IV стадии рака, если необходимо проведение химиотерапии и больная согласна на прерывание беременности, в качестве первого этапа лечения рекомендуют прерывание беременности, причём на любом сроке (с 22–27 недель — «очень ранние» преждевременные роды). При постановке диагноза в III триместре и при решении пролонгировать беременность возможны ранние преждевременные роды в сроке 34 недель.
Профилактика основана на программах формирования здорового образа жизни и устранении факторов риска развития рака. Помимо повышения информированности женщин репродуктивного возраста о возможной злокачественной патологии молочных желёз на фоне беременности необходимо внедрять методы самообследования, а главное — инструментальное исследование молочных желёз в рамках прегравидарной подготовки. Основные профилактические меры должны быть направлены на выявление болезни на максимально ранних сроках.
Необходимо включить УЗИ молочных желёз в план наблюдения беременной либо на этапе планирования, либо в I триместре беременности.
Необходимо информировать женщин о том, что опухолевые клетки не метастазируют в ткани плода; женщина, болеющая раком, должна прекратить лактацию, что связано с необходимостью немедленно начать лечение и принимать различные лекарственные препараты. Ошибочно предположение, что будущий ребёнок женского пола непременно заболеет РМЖ, если у болеющей матери обнаружены мутации генов BRCA1 и BRCA2.
Следует объяснить, что последующая беременность не ухудшает прогноз у больных с ранней стадией РМЖ. Вопрос о беременности после проведённого лечения при сохранённой репродуктивной функции следует решать с осторожностью. Необходимо учитывать стадию заболевания, наличие или отсутствие неблагоприятных факторов прогноза. Минимальным интервалом от момента завершения лечения до планирования последующей беременности считают интервал 2–3 года.
После окончания лечения женщина должна находиться под длительным наблюдением онколога. Срок первого контрольного осмотра — через 6 мес от момента проведения лечения. Затем рекомендована явка через год.
При сравнении в рамках одинаковых стадий и возрастных групп выживаемость беременных, больных РМЖ, ассоциированным с беременностью, не отличается от таковой в группе небеременных. Тем не менее, РМЖ, ассоциированный с беременностью, имеет худший прогноз, чем в целом РМЖ, что обусловлено большей распространённостью болезни на момент постановки диагноза.
Примерные сроки нетрудоспособности
Ориентировочные сроки временной нетрудоспособности при злокачественных новообразованиях молочной железы (класс II по МКБ-10) I стадии составляют 50–75 дней, II–III стадии — 80–115 дней. Вопрос об установлении инвалидности решают после завершения оплачиваемого отпуска по беременности и родам.
источник
По крайней мере 10 % женщин, больных раком молочной железы (РМЖ) и моложе 40 лет, на момент диагностирования заболевания могут быть беременны. Как правило, у беременных злокачественные новообразования молочной железы представлены безболезненной опухолью или уплотнением.
В некоторых случаях могут иметь место выделения из соска. Во время кормления грудью ребенок может отказываться от молока. Нормальная масса молочной железы во время беременности составляет 200—400 г, ее упругость и плотность повышаются. Постановка диагноза по результатам маммографии у беременных затруднена.
У многих беременных диагностирование рака молочной железы (РМЖ) происходит с задержкой на 1—2,5 мес, а во время лактации — даже до 6 мес. Согласно исследованию, проведенному в 1991 г. в Memorial Sloan-Kettering Cancer Centre (Нью-Йорк), у 44 из 56 больных поставить диагноз РМЖ смогли только после родов. Обзор литературы, выполненный Puekridge и соавт., показал, что задержка в диагностировании рака молочной железы (РМЖ) у беременных составляет 2—15 мес. и более.
Поскольку время удвоения размера опухоли составляет 130 дней, отсрочка лечения на 1 мес. увеличивает риск метастазирования в подмышечные лимфоузлы на 0,9 %, а на 6 мее. — на 5,1 %. Отчаети по этой причине рак молочной железы (РМЖ) у беременных — это грозный диагноз. Однако выживаемость в зависимости от возраста и стадии заболевания у беременных идентична таковым у небеременных больных. Беременность не относится к объективным факторам риска.
На рисунке ниже представлен возможный алгоритм тактики ведения беременных с раком молочной железы. Чем раньше диагностируется заболевание, тем больше продолжительность жизни. В диагностике используют пункционную биопсию и тонкоигольную аспирацию. Во время беременности при экранировании живота можно проводить маммографию, но накопление грудного молока и лактация увеличивают плотность ткани, что может препятствовать выявлению патологических изменений.
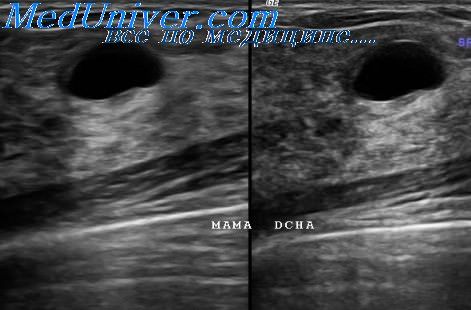
УЗИ дает достаточно достоверную информацию и не оказывает отрицательного влияния на плод. Результаты тонкоигольной аспирации трудно интерпретировать цитологически при вторичных клеточных изменениях, которые происходят во время беременности и лактации, что повышает риск ложноотрицательных результатов. «Золотым стандартом» остается пункционная биопсия.
При необходимости выполняют эксплоративную операцию. Для того чтобы заранее снизить риск образования фистулы млечных протоков, лактацию останавливают прикладыванием пакетов со льдом, перевязыванием молочных желез или применением бромокриптина (2,5 мг 3 раза в сутки в течение недели). До проведения биопсии молочные железы необходимо избавить от молока. Давящая повязка снижает риск гематомы, которая может развиться вследствие гиперваскуляризации.
Приблизительно 75—90 % злокачественных новообразований молочной железы у беременных представлены раком протоков, что служит зеркальным отражением ситуации в популяции небеременных женщин. Ранее предполагали, что во время беременности часто развивается воспалительный рак молочной железы (РМЖ). Современные исследования показали, что на самом деле частота их возникновения составляет 1,5—4,2 % каку беременных, так и небеременных. Некоторые исследования выявили неблагоприятные патоморфологические данные РМЖ у беременных.
У большинства беременных опухоли не имеют ЭР и ПР, что приводит к увеличению риска ложноотрицательных результатов лигандсвязывающей пробы для определения этих рецепторов, т. к. повышение уровня эстрогенов и прогестерона регулируется рецепторами по механизму обратной связи. Иммуногистохимическое исследование не способно определить различия в ряде гормонозависимых опухолей у беременных и небеременных женщин одного возраста. При раке молочных протоков наблюдают сверхэкспрессию c-ERBB-2 и мутации р53, но такие изменения не обнаруживаются в опухолях беременных.
У беременных высока частота злокачественных новообразований, позитивных по HER-2/neu, по сравнению с небеременными. Интересно, что HER-2/neu (продукт онкогена р105) обладает сверхэкспрессией не только в злокачественных новообразованиях протоков, но и в эпителии плода и плаценте, так что к концу III триместра его уровень превышает норму.
Эпидемиологические исследования показали, что риск злокачественных новообразований молочной железы повышен в отдельных семьях. Риск увеличивается в 5—10 раз, если это заболевание диагностировали у матери или сестры. Женщины, генетически предрасположенные к злокачественным новообразованиям молочной железы, доминируют в группе беременных с раком молочной железы (РМЖ)) (в 3 раза больше, чем среди небеременных). По сравнению со спорадическими случаями РМЖ у беременных со злокачественными новообразованиями молочной железы, в семье у которых были случаи заболевания, высокий уровень аллельных мутаций BRCA2. В Швеции проводилось исследование, в котором приняли участие 292 женщины с РМЖ в возрасте до 40 лет.
Исследование показало, что во время беременности повышается вероятность развития заболевания при наличии определенных мутаций BRCA1 и BRCA2.
В клинике Haagensen используется классификация РМЖ, обращающая большее внимание на факторы неблагоприятного прогноза в течении заболевания. Во время беременности при экранировании можно проводить латеральную и заднепереднюю рентгенографию грудной клетки. Теоретическая доза, получаемая эмбрионом в этом случае, не превышает 0,0006 Гр.
Если катетер позволяет быстро выводить радиоактивное вещество из мочевого пузыря, разрешается проводить сцинтиграфию костей с низкой дозой 99m Тс, при этом плод получает 0,0008 Гр вместо стандартных 0,0019 Гр. Более высокая лучевая нагрузка на плод исключает использование КТ для выявления метастазов, но при исследовании грудной клетки, абдоминальной полости и скелета можно применять МРТ. Исследование печени предпочтительнее проводить с помощью МРТ, а не УЗИ. МРТ служит также самым безопасным и чувствительным методом при исследовании головного мозга.
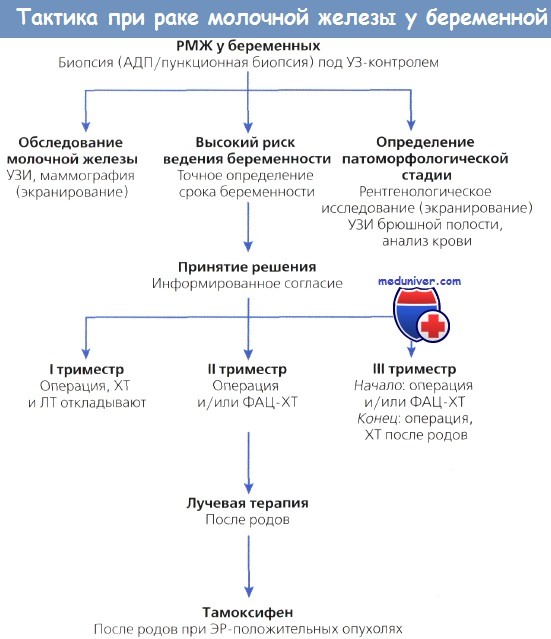
• ФАЦ-терапию рекомендуется проводить во II и III триместрах беременности.
• При локально распространенном РМЖ хирургическое вмешательство (радикальная мастэктомия) проводят после неоадъювантной XT.
• ЭР — эстрогеновые рецепторы;
• ФАЦ — 5-фторурацил, доксорубицин (Адриамицин) и циклофосфамид;
• АДП — аспирационная диагностическая пункция.
источник
Рак молочной железы у беременных — это злокачественная неоплазия груди, выявленная на фоне гестации, лактации или в течение 12 месяцев после родов. Проявляется узловым или диффузным уплотнением грудных желез, их тяжестью и болезненностью, дискомфортом, болью в области ареолы, выделениями из соска, локальными изменениями кожи, увеличением аксиллярных лимфоузлов. Диагностируется при помощи УЗИ, трепанобиопсии, МРТ молочных желез. В период гестации используются хирургические методы лечения (обычно модифицированные варианты радикальной мастэктомии), химиотерапия по схеме AC. После родов терапию дополняют гормональными препаратами и лучевыми методиками.
Злокачественные опухоли молочных желез — второй по распространенности вид неоплазий, диагностируемых у беременных. Их встречаемость составляет 1:3 000 — 1:10 000 гестаций. Средний возраст женщин, у которых диагностирован рак грудной железы, ассоциированный с беременностью, — составляет 33 года. До 82% пациенток выявляют новообразование самостоятельно в I триместре, при этом практически в 3/4 случаев диагностируются поздние стадии неоплазии с размерами опухоли от 6 до 15 см, а у каждой пятой беременной обнаруживаются метастазы во внутренних органах. Из-за несвоевременной диагностики заболевания задержка начала лечения в среднем составляет 2-3,5 месяца.
Этиология злокачественных неоплазий при гестации является такой же, как у небеременных женщин. В 5-10% случаев развитие рака обусловлено наследуемой мутацией генов BRCA1/BRCA2. У остальных пациенток новообразование возникает на фоне дисгормональных состояний, воздействий неблагоприятных факторов окружающей среды (мутагенных химических веществ, радиации и пр.), недостаточности иммунитета. Как правило, опухоли, выявляемые в грудных железах беременных, возникают до зачатия, однако их рост может ускориться на фоне физиологических гестационных изменений. По мнению специалистов в сфере онкологии и акушерства, специфическими провоцирующими факторами быстрого онкогенеза при беременности являются:
- Гормональная перестройка. Более чем в 70% случаев рак груди у беременных является эстроген-зависимым (ER+). При гестации уровень эстрогенов в крови возрастает почти в 30 раз. Под влиянием гормонов происходит подготовка молочных желез к лактации: грудь набухает, в ней увеличивается количество альвеол, молочных протоков. Гиперэстрогенная стимуляция может способствовать более быстрому развитию раковых клеток.
- Снижение иммунитета. Поскольку генетически плод чужероден материнскому организму, физиологические изменения в иммунной системе беременных направлены на снижение общей реактивности. За счет увеличение числа Т-супрессоров, уменьшения уровня Т-хелперов, появления блокирующих антител подавляется эффекторное звено иммунитета. В результате иммунная система хуже выявляет и уничтожает собственные перерождающиеся клетки.
Вероятный механизм развития рака молочной железы у беременных основан на стимуляции роста трансформированных клеток эстрогенами и прогестероном. Усиленное эстрогенное воздействие индуцирует синтез факторов роста, под влиянием которого пролиферируют эпителиальные клетки грудных желез, в том числе злокачественной опухоли. Одновременно тормозится клеточный апоптоз, за счет индуцированной транскрипции фактора роста сосудистого эндотелия начинается патологическая неоваскуляризация.
Поскольку эстрогены способны нивелировать действие ингибирующих факторов роста, включается отрицательная обратная связь, стимулирующая клеточную гиперплазию. Одним из эстрогенных эффектов является быстрое увеличение числа микрометастазов, вызванное стимуляцией так называемых спящих метастатических образований. Роль прогестерона в онкогенезе неоплазий молочных желез еще уточняется. Его эффекты могут быть связаны с поддержанием циклической пролиферации железистых клеток при гестации и стимуляции роста с потенциальным видоизменением ответа нормального и перерожденного железистого эпителия.
Систематизация форм рака груди во время беременности основана на тех же критериях, что и вне гестационного периода, — анатомическом расположении неоплазии, ее размерах, особенностях метастазирования в лимфатические узлы и отдаленные органы, гистологическом строении, уровне клеточной дифференцировки, типе экспрессируемых рецепторов малигнизированных клеток. Наиболее значимую роль в разработке оптимальной тактики сопровождения беременности играет классификация опухоли по стадиям развития. Онкомаммологи различают:
- Неинвазивный рак (карциномаinsitu). Неоплазия локализована в молочном протоке или дольке. Лимфоузлы интактны. Клиника отсутствует. Рак становится случайной находкой при плановом обследовании. Наиболее благоприятная форма. Возможно продолжение гестации после оперативного лечения.
- РакIстадии. Максимальный поперечник новообразования не превышает 2 см. Неоплазия прорастает в окружающие ткани груди, но не метастазирует. Может определяться клинически в виде узлового уплотнения. Проведение хирургического вмешательства позволяет сохранить беременность.
- РакIIстадии. При IIA стадии опухоль имеет размеры до 2 см с метастазированием в аксиллярные лимфоузлы на стороне поражения или до 5 см без метастазов. При раке IIB стадии размеры неоплазии составляют 2-5 см при наличии метастазов в лимфоузлы или от 5 см и более — при их отсутствии. Для сохранения гестации показана радикальная мастэктомия.
- РакIIIстадии. Опухоль разрастается до 5 и более сантиметров либо отмечаются конгломераты спаянных подмышечных лимфатических узлов, прорастание рака в кожу молочной железы, ткани грудной клетки, поражение подключичных и надключичных лимфоузлов. Возможны отдаленные метастазы.
- РакIVстадии. Отмечается массивное поражение молочной железы с прорастанием окружающих тканей, диссеминацией в кожу, изъязвлениями. Возможно вовлечение в процесс второй груди, подмышечных лимфоузлов на противоположной стороне. Характерны множественные отдаленные метастазы.
При III-IV стадиях онкопроцесса по желанию пациентки и ее родственников допустимо сохранение гестации с досрочным родоразрешением в сроки достаточной жизнеспособности ребенка. В таких случаях выполнение радикального оперативного вмешательства позволяет приостановить распространение опухоли и начать активную терапию в послеродовом периоде. Назначение некоторых химиопрепаратов возможно с 15-й недели гестации.
Хотя гестационные физиологические изменения тканей усложняют выявление злокачественного объемного образования, существуют маркерные признаки, повышающие онконастороженность. О развитии рака может свидетельствовать появление в одной из молочных желез узла или неоформленного уплотнения, болезненности и тяжести. У некоторых пациенток на фоне общего нагрубания асимметрично изменяется форма пораженной грудной железы, на коже возникают неровности, участки втяжений или локальной отечности.
Часто отмечается покалывание, боли в сосково-ареолярной области, может втягиваться сосок, появляются сукровичные выделения. При наличии регионарных метастазов в подмышке на пораженной стороне определяются увеличенные лимфатические узлы, в более тяжелых случаях лимфоузлы прощупываются над и под ключицей, в противоположной аксиллярной впадине. Признаки общей интоксикации в виде потери аппетита, снижения веса, нарастающей слабости и быстрой утомляемости характерны только для терминальных стадий болезни.
Рак грудных желез, возникающий у беременных, может быстро прогрессировать и осложняться метастазированием. Распространенные формы заболевания выявляются у 72-85% пациенток, у 20% женщин внутренние органы поражены метастазами. В некоторых случаях развивается воспаление тканей, окружающих опухоль. По мнению большинства акушеров-гинекологов, рак груди не оказывает негативного воздействия на ребенка, однако на поздних стадиях заболевания при наличии опухолевой интоксикации возможна гипоксия плода. Применение во II-III триместрах химиотерапевтических препаратов способно спровоцировать преждевременные роды, миелосупрессию у женщины и ребенка, задержку развития плода, мертворождение, массивные послеродовые кровотечения, инфекционные осложнения (эндометрит, хориоамнионит и др.).
Поскольку беременные женщины часто расценивают начальные признаки опухоли как специфические изменения молочных желез перед лактацией, рак груди при гестации обычно диагностируется на более поздних стадиях. Диагностически значимые радиологические методы исследования при беременности применяются ограниченно из-за возможного негативного влияния на плод, однако другие современные методики позволяют выявить опухоль и правильно оценить стадию онкопроцесса. Наиболее информативными при обнаружении злокачественной неоплазии груди являются:
- Маммосонография. УЗИ молочных желез — оптимальный метод скрининговой диагностики злокачественных опухолей у беременных и лактирующих женщин. Информативность ультрасонографии, дополненной цветовой и энергетической допплерографией, достигает 97%. Обычно на УЗИ рак выглядит как гиперваскуляризированное гипоэхогенное образование неправильной формы и неоднородной структуры. С помощью ультразвука удобно исследовать регионарные лимфоузлы.
- Трепанобиопсия молочной железы. Материал, полученный с помощью биопсийного пистолета, используют для определения морфологической структуры новообразования и его иммуногистохимического профиля (рецепторного статуса, амплификации гена Her2-neu, пролиферативного индекса Ki-67 и др.). Трепанобиопсия обладает большей информативностью, чем пункционная биопсия, позволяет верифицировать диагноз в 99,0-99,8% случаев.
- Томография. МРТ молочных желез проводят при получении неоднозначных результатов сонографии. Послойная визуализация дает возможность максимально точно оценить размеры и распространенность неоплазии. МРТ всего тела рекомендована для выявления метастазов. В I триместре сканирование осуществляют с осторожностью из-за возможной кавитации и перегревания эмбриона. Контрастирование допускается в исключительных случаях.
Маммографию беременным с подозрением на рак груди назначают редко, что связано с возможным повреждающим воздействием на плод и получением в 25% случаев ложноотрицательных результатов. В качестве дополнительных методов обследования рекомендовано определение онкомаркера CA 15-3, цитология мазка, полученного из соска пораженной молочной железы, оценка риска развития BRCA-ассоциированного рака, дуктоскопия, радиотермометрия груди, электроимпедансная маммография. Заболевание дифференцируют с маститом, доброкачественными неоплазиями (кистами, аденомами, фиброаденомами, липомами, листовидными опухолями), галактоцеле, гамартомами, лимфомами, саркомами, туберкулезом. Кроме онкомаммолога пациентку по показаниям консультирует онколог, химиотерапевт, хирург, фтизиатр, инфекционист.
Если ранее выявление злокачественного новообразования груди служило достаточным основанием для прерывания беременности, в последние десятилетия применяют стратегии, предполагающие раннее начало терапии и сохранение гестации. Выбор врачебной тактики в каждом конкретном случае рака выполняется индивидуально с учетом стадии процесса, гестационного срока и решения беременной. В 1-м триместре при выявлении инвазивных форм опухоли беременность рекомендуется прервать медицинским абортом, во 2-3-м — при желании пациентки продлить до минимально возможного срока рождения жизнеспособного плода. После искусственного прерывания гестации лечение производится по стандартным протоколам онкологической помощи. При решении сохранить ребенка могут использоваться следующие варианты:
- Хирургическое лечение. Наиболее оправданным вмешательством при ранних стадиях рака является радикальная мастэктомия, при необходимости дополненная аксиллярной диссекцией без последующей лучевой терапии. Лампэктомия, квадрантэктомия, секторальная резекция груди выполняются реже. Онкопластические операции не рекомендованы. Объем и срок проведения вмешательства при поздних стадиях болезни определяются индивидуально.
- Назначение химиопрепаратов. Антинеопластические средства могут применяться после 14 недели гестационного срока. Чем позже начато медикаментозное лечение, тем меньше вероятность возникновения уродств у плода. Препаратами выбора являются алкилирующие цитостатики и антрациклиновые антибиотики. При распространенных формах рака используется неоадъювантная полихимиотерапия как подготовительный этап перед радикальной операцией.
Гормонотерапия, наиболее эффективная при рецепторо-позитивных формах рака, беременным не проводится из-за тератогенного влияния антагонистов эстрогенов. Назначение лучевой терапии возможно только после завершения гестации. Рекомендованным способом родоразрешения являются естественные роды. Кесарево сечение осуществляется только при наличии акушерских показаний или тяжелой экстрагенитальной патологии, несовместимой с родовыми нагрузками.
Показатели выживаемости пациенток, у которых в период беременности было диагностировано злокачественное новообразование молочной железы, не отличаются от данных по группам небеременных женщин. Прерывание гестации не влияет на исход заболевания. Однако в целом прогноз является более серьезным, поскольку у беременных зачастую выявляются распространенные формы рака. Минимальный безопасный интервал от момента завершения лечения до следующей беременности, по данным разных авторов, составляет от 6 месяцев до 5 лет. Основная задача профилактики рака грудных желез — обнаружение опухоли на ранних стадиях при помощи скрининговых методов (УЗИ, маммографии).
источник

