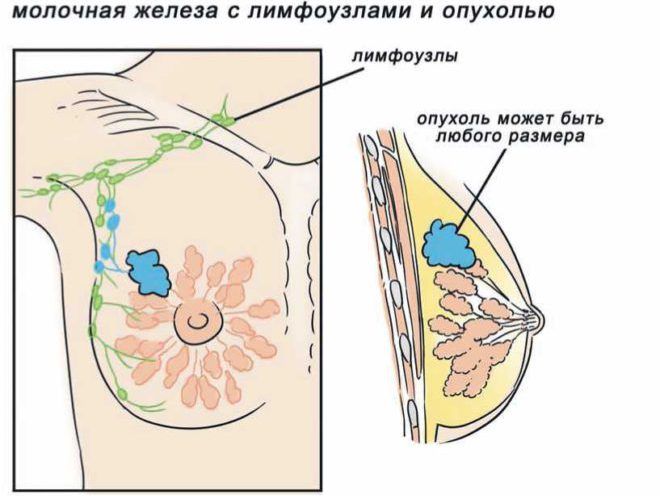
Часть опухолей молочной железы состоит из клеток, для которых характерно присутствие рецепторов эстрогенов и других стероидных гормонов, включая прогестоген. Эти рецепторы находятся как в ядре, так и в цитоплазме клеток. Они обнаружены в 65% опухолей, возникающих в период постменопаузы. В то же время лишь 30% опухолей, развивающихся в пременопаузе и связанных с геном BRCA1, обычно не содержат рецепторов эстрогенов и прогестерона (PR).
Однако эти рецепторы присутствуют в опухолях, связанных с геном BRCA2. Гормональная зависимость некоторых опухолей подтверждается клиническими наблюдениями при изменении в организме гормонального фона. В настоящее время показано, что наличие рецепторов эстрогенов (ER) в опухолевых клетках коррелирует с чувствительностью индивидуальной опухоли к гормонам. Это позволяет прогнозировать ее чувствительность к гормональным препаратам, что имеет важное клиническое значение.
Например, пациенткам, у которых обнаружена ER-отрицательная опухоль, можно не удалять яичники. Не совсем ясно, отражает ли статус ER фундаментальные различия между «отрицательным» и «положительным» раком молочной железы, или существует непрерывный переход от опухолей с резко положительной характеристикой ER к опухолям, в которых уровень ER практически не определяется. Современные данные свидетельствуют в пользу второго предположения.
При этом к положительным обычно относят опухоли, значение ER для которых находится выше определенного уровня, обычно составляющего 5 фмоль/мг цитоплазматического белка, или 25 фмоль/мг ядерной ДНК.
Наличие эстрогеновых рецепторов характерно для хорошо дифференцированных опухолей (особенно трубчатого, дольчатого, лобулярного или сосочкового типа), а также для опухолей с микроскопическими признаками эластоза. Согласно клиническим наблюдениям, медленно растущие опухоли в основном являются ER-положительными. Первичная опухоль и ее метастазы обладают близкими значениями ER, хотя от положительных опухолей иногда наблюдаются ER-отрицательные метастазы. Обратная картина встречается редко.
Насколько успешно измерения ER позволяют прогнозировать чувствительность опухолей к гормонам? Лишь 5-7% ER-отрицательных опухолей проявляют чувствительность к гормонам. Напротив, гормональной чувствительностью характеризуются 55% ER-положительных опухолей. Хотя больных с такими опухолями можно лечить гормональными препаратами, уровень ER нельзя считать достаточно надежным показателем.
Однако существует клиническая закономерность, выявленная эмпирически: опухоли с высоким значением ER в 90% случаев являются гормонально зависимыми. Наряду с этим показано, что опухоли с высокими значениями PR, более чем в 80% случаев также чувствительны к гормонам.
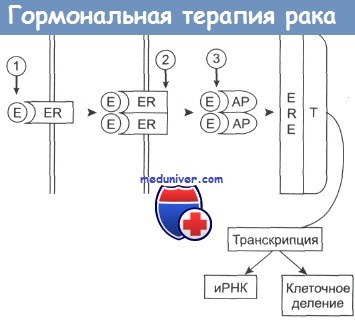
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.
источник
Молочная железа у женщин является гормонозависимым органом. Основными гормонами, которые влияют на ее работу, считаются прогестерон, эстроген и пролактин. В норме эти вещества всегда присутствуют в организме. Когда развивается РМЖ (рак молочных желез), метод лечения определяет то, сохранились ли в груди рецепторы к гормонам. Если да, то действовать на опухоль, угнетая ее рост, можно соответствующими препаратами.
Гормоны – это биологически активные вещества, которые отвечают за деление клеток, нормализацию других жизненно важных процессов. Практически все процессы жизнедеятельности зависят от нормальной выработки этих веществ.
На поверхности всех клеток организма находятся специальные белки, которые получают «сигналы», они называются рецепторами. Если в крови появляется вещество, которое может вступить во взаимодействие с этими белками на поверхности, начинается их соединение. Такие специальные белки считаются самыми чувствительными частицами в организме.
Значение рецепторов эстрогена, прогестерона и НЕR-2 белка в клетках рака молочной железы, и методы их определения
В кровотоке женского организма все время присутствуют:
- Эстрогены – 3 вида
- Прогестероны – 5 видов
Сколько их содержится в данный момент, зависит от того, какой сейчас период менструального цикла. Эти гормоны взаимодействуют со специальными структурами на поверхности клеток молочных желез.
Развитие онкологии подразумевает рост опухоли, клетки которой мутировали – изменились. Некоторые из них полностью преобразовались, в других же остались рецепторы гормонов. Когда к таким клеткам попадает эстроген и прогестерон, они делятся особенно интенсивно, затем проникают в кровь и лимфу. При онкологии это означает появление метастазов.
Рецепторы прогестерона при раке молочной железы, как и эстрогена, являются основанием для назначения гормональной терапии. Цель этого метода лечения – максимально уменьшить действие гормонов на опухоль, тем самым остановив ее рост и деление патогенных клеток.
Чаще всего гормональная терапия назначается после проведения операции по удалению раковой опухоли. Ее цель заключается в перестраховке, чтобы предотвратить губительное действие раковых клеток, которые могли остаться в организме.
Располагаются эти чувствительные частицы во многих частях тела – жировой ткани, лимфоузлах, молочных железах. Все эти ткани имеют подходящую для жизнедеятельности гормонов структуру. Основными функциями эстрогена и прогестерона являются:
- поддержание гормонального баланса в организме
- нормальная работа репродуктивной системы
- регулирование менструального цикла
- поддерживание в нормальном состоянии кожи, волос (их называют «гормонами красоты»)
- поддержание работы центральной нервной системы
- другие
В таблице ниже приведены допустимые показатели нормы прогестерона и эстрогена в разные периоды менструального цикла женщины:
Чтобы определить количество прогестерона и эстрогена, назначается анализ крови. А чтобы определить наличие рецепторов эстрогена и прогестерона при раке молочной железы, требуется иммуногистохимическое исследование. Для его проведения берут кусочек опухоли, заливают в парафин. Затем в лаборатории происходит изучение взятого материала.
Если иммуногистохимическое исследование подтвердило наличие рецепторов половых гормонов на участке груди, пораженном злокачественными процессами, это означает, что необходимо выбирать средства гормонотерапии. В противном случае рост ракового образования будет увеличиваться, появятся метастазы, затрагивающие другие органы.
Однако положительные данные исследования являются не единственным основанием для прогноза на выздоровление. Если стадия рака вторая и выше, появились метастазы, поражены лимфоузлы, успех терапии уменьшается.
Эстроген-рецепторы относятся к группе ядерных, делятся на две формы: α и β. Рецепторы к нему, как и к прогестерону, играют важную роль в формировании злокачественной опухоли. Они представляют собой белковые структуры, которые размещаются по поверхности новообразования.
При естественном выделении новых половых гормонов происходит их соединение и взаимодействием с рецепторами, которые расположены возле раковой опухоли. Последствием становится интенсивное развитие и прогрессирование роста онкологии. По статистике, рецепторы к половым гормонам встречаются в такой частоте:
- 75% — эстроген-позитивные
- 65% — эстроген-позитивные, восприимчивы также к прогестерону
- 10% — эстроген-позитивные, но абсолютно прогестерон-негативные (эстрогенозависимые)
- 5% — прогестерон-позитивные, но абсолютно эстроген-негативные (прогестеронзависимые)
- 25% — не содержат рецепторы, восприимчивые к гормонам
Две формы эстроген-рецептора α и β исследованы по-разному. Функция эстрогена типа β научно полностью не определена. Тип α исследован подробно, относится к группе лиганд-активированных ядерных структур. Принцип действия эстрогена такой:
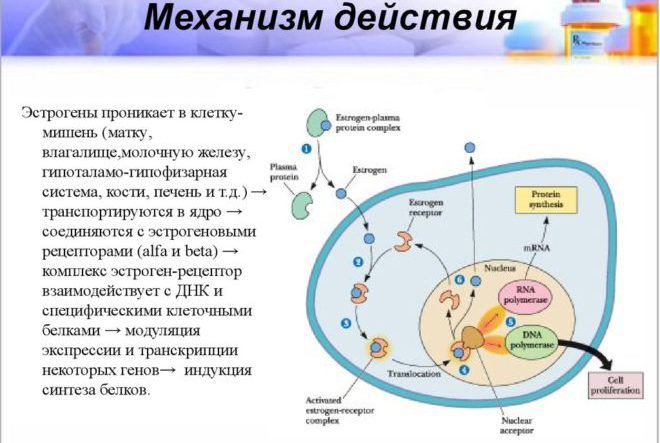
- проникает в молочную железу и другие ткани
- транспортируется в ядро
- соединяется с эстрогеновыми рецепторами
- взаимодействует с ДНК и клеточными белками
- осуществляет синтез белков
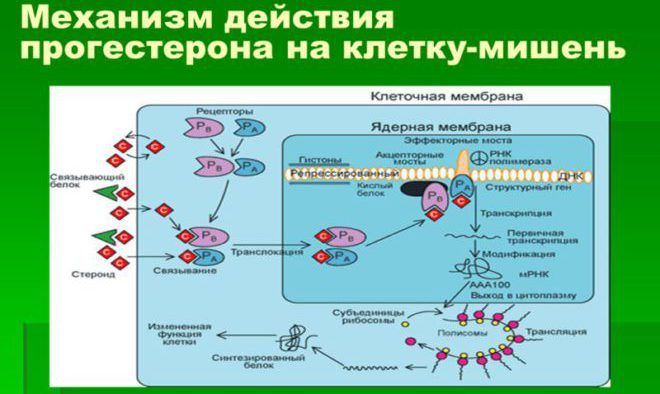
Промотор гена прогестерона содержит в составе частицы, зависимые от эстрогена, поэтому считается, что роль последнего при формировании злокачественных опухолей больше. В связи с этим эстрогенозависимый рак молочной железы встречается чаще, чем прогестеронозависимый. Принцип действия прогестерон-рецепторов аналогичен эстрогеновым. Соединяясь с гормоном, они взаимодействуют, результатом чего оказывается модуляция экспрессии и синтез белков.
Результаты исследований применяются лечащим врачом-онкологом для подбора терапии рака. В основном прогноз на выздоровление положительный, если опухоль оказалась гормонозависимой, определена на ранней стадии, метастазов нет.
Если принимается решение о назначении гормональной терапии, на основании показателей количества рецепторов, определяется ее вид. Выделяют такие основные виды:
- адъювантная – ее продолжительность составляет 5-10 лет, иногда назначается пожизненно
- неоадъювантная – длится 3-6 месяцев, чаще всего применяется перед хирургическим вмешательством
- лечебная – назначается на ранних стадиях онкологии, вместо операции
Чтобы остановить выработку эстрогена и прогестерона и прекратить их соединение с соответствующими рецепторами, назначаются препараты, которые:
- снижают уровень эстрогена
- останавливают взаимодействие с уже имеющимися в организме гормонами
Основными группами таких лекарственных средств являются:
- Модуляторы рецепторов. Изначально применялся Тамоксифен – лекарственный препарат, компоненты которого привязывались к эстрогену, блокируя проникновение к ним самого гормона. Сегодня применяются такие аналоги Тамиксифена, как Ралоксифен, Торемифен.
- Блокаторы рецепторов. Эта группа препаратов направляет свое действие на разрушение рецепторов опухоли. В результате в них не просто не проникает гормон, а они вовсе перестают функционировать. Эффективное средство этой группы – Фаслодекс.
- Ингибиторы ароматазы. Признаны наиболее эффективной группой средств гормонотерапии, которые способствуют не только угнетению рецепторов, но и разрушению раковой опухоли. Одним из наиболее эффективным ингибиторов ароматазы признан Летрозол.
- Прогестины. Обычно назначаются, если препараты предыдущих групп оказались неэффективными. Оказывают мощное действие на выработку гормонов, блокируют рецепторы, но вызывают ряд побочных действий.
Таким образом, определение рецепторов прогестерона и эстрогена является основанием для назначения гормонотерапии. Рак молочной железы – опасное для жизни женщины заболевание, поэтому затягивать с выбором лечения нельзя. После проведения специальных исследований, лечащий врач решает, как будет применяться гормонотерапия – вместо операции или в дополнение к ней.
источник
Одним их характерных признаков злокачественных опухолей является их «умение» стимулировать свой рост самостоятельно. Они выделяют факторы роста, которые связываются с рецепторами (белковыми молекулами расположенными в опухоли) после чего происходит стимуляция роста. Стимулирующими факторами могут быть и вещества, находящиеся в организме человека. Так, в случае рака молочной железы такими веществами могут выступать эстрогены — женские половые гормоны.
Более ста лет назад было показано, что удаление яичников, являющихся основным источником эстрогенов у женщин в пременопаузе, оказывает противоопухолевый эффект у больных с распространенным РМЖ.
Остановка функции яичников у женщины (хирургическая, лучевая, гормональная) приводит к снижению уровня эстрогенов крови с 1000-100 до 100-10 ммоль/л, т. е. в 10 раз. Остаточный уровень эстрогенов обеспечивается превращением андростендиона, вырабатываемого корой надпочечников, в эстрогены за счет реакции ароматизации, протекающей в жировой и некоторых других тканях.
В постменопаузе главным путем образования эстрогенов является ароматизация андрогенов, продуцируемых надпочечниками. Таким образом, блокада яичников не обеспечивает полной остановки образования этих гормонов, и требуется дополнительное воздействие, чтобы прервать стимуляцию опухоли.
Спросите вашего врача: Какое значение имеет определение рецепторов к эстрогенам и прогестерону в лечении рака молочной железы?
Определение рецепторов к эстрогену и прогестерону в опухоли молочной железы является на сегодняшний день стандартным мероприятием, позволяющим планировать объем лечение, определять в нем роль гормонотерапии, а также определять риск возникновения рецидива заболевания.
Определение рецепторов к эстрогенам и прогестерону проводится с помощью иммуногистохимического исследования. Материалом для исследования обычно являются блоки препарата (кусочек опухоли, специально обработанный и залитый в парафин). Исследование проводится в специальных лабораториях.
Значительный прогресс в лечении рака молочной железы внесли исследования по выявлению и количественному определению в опухолевых клетках стероидных рецепторов к эстрагену и прогестерону. Пациентки, опухоли которых содержали рецепторы к эстрогену и прогестерону, в 50-65% случаев оказались чувствительными к гормональной терапии. В то же время, если опухоль содержала один тип рецептора, чувствительность к гормональной терапии значительно снижалась. В случае если опухолевые клетки не содержали рецепторов, то эффективность гормонотерапии не превышала 10%.
В настоящее время общепринято, что если более 10% опухолевых клеток содержат рецепторы к эстрогену или прогестерону, то опухоль следует считать гормоночувствительной. В Израиле гормональные препараты применяются на различных этапах комбинированного и комплексного методов лечения операбельных форм рака молочной железы, а также в случаях генерализации опухолевого процесса.
Следует признать, что первичная опухоль молочной железы состоит из биологически различных популяций клеток. Они различаются по многим параметрам, в частности по скорости роста, кариотипу, наличию или отсутствию гормональных рецепторов, продукции опухоль-ассоциированных белков, иммуногенности, чувствительности к гормоно- и химиотерапии.
Эффективной последующей антиэстрогенной стратегией явилась блокада рецепторов этих гормонов. С этой целью были синтезированы селективные модуляторы рецепторов к эстрогенам (SERM) тамоксифен и торимефен. Назначение тамоксифена в течение пяти лет у пациенток с рецептор-позитивными опухолями в менопаузе позволило сократить частоту рецидивов и возникновения рака контралатеральной молочной железы на 50%, уменьшить смертность на 28%.
Помимо этих препаратов есть и новые, не упомянутые в статье, созданные по тому же принципу — блокировке рецепторов опухоли к гормонам женщины или же подавлению функции яичников. Спросите у нашего консультирующего врача о новых направлениях лечения гормоно-зависимых опухолей груди и какие успехт уже достигнуты в лечении не чувствительных к гормонам опухолей. Мы можем помочь вам — не тяните время, оно не ждет.
источник
Эндокринотерапия (гормонотерапия) – разновидность противоопухолевого лечения, при котором применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. В основу разработки этого метода легло открытие факта, что клетки некоторых злокачественных новообразований не способны расти независимо от внешних условий. Процессы их роста зависят от наличия в крови или окружающих тканях гормонально активных веществ (гормоны). Ярким примером, служит рак молочной железы, во многих случаях которого для роста клеток необходимо наличие в крови эстрогенов и/или прогестерона. Соответственно, лишив опухолевые клетки «подпитки» этими гормонами, можно остановить их рост и даже добиться полного или частичного исчезновения опухоли.
Гормоны — биологически активные вещества, оказывающие регулирующее влияния на процессы обмена веществ, а также физиологических функций организма, включая процессы деления клеток. К гормонам относятся очень различающиеся друг от друга по структуре вещества. Они регулируют практически все процессы в организме, включая обмен веществ, рост, взросление и старение, половое созревание и т.д. Вопреки широко распространенному заблуждению, применение не всех гормонов вызывает увеличение массы тела и быстрый набор веса. Таким побочным эффектом характеризуются только глюкокортикостероиды и их производные (например, дексаметазон, преднизолон, метилпреднизолон и т.д.). Вещества, которые используются для лечения онкологических заболеваний, как правило, не вызывают увеличения веса.
Главное преимущество эндокринотерапии — её избирательное воздействие на ткани, которые зависимы от наличия «целевого» гормона, а также низкая токсичность проводимого лечения. Недостатки этого метода являются следствием его преимуществ — не все опухоли зависимы от наличия каких-либо гормонов, соответственно в случае такой зависимости назначение гормонотерапии будет неэффективно. Кроме того, возможно развитие симптомов снижения концентрации определенных гормонов, например симптомы менопаузы у женщин, получающих некоторые виды эндокринотерапии по поводу рака молочной железы. К гормонозависимым опухолям относят рак предстательной железы, некоторые виды рак молочной железы, рака тела матки и яичников. В данном разделе рассказывается о гормонотерапии на примере опухолей, чек рост может зависить от наличия рецепторов эстрогена и прогестерона.
На поверхности практически всех клеток организма содержатся специальные белки, которые позволяют клеткам улавливать сигналы из окружающей среды. Эти белки являются своеобразными «глазами и ушами» клеток и играют роль детекторов: они получают «сигналы» от определенных веществ в крови и передают их клеткам. Такие белки получили название «рецепторы». Эти сигналы способны заставлять клетки активно делиться, в этом случае рецепторы выпускают в качестве «спускового крючка» в процессе деления клеток. В случае, если в крови появляется вещество, которое может взаимодействовать с рецептором (т.е. вещество, подходящее к рецептору как «ключ к замку»), запускается механизм деления клеток. Таким образом регулируется процесс деления многих нормальных клеток в организме, но опухолевые клетки способы активно использовать сигналы от рецепторов для своего роста.
Как было сказано выше, рецепторы есть на поверхности всех клеток в организме. При проведени гормонотерапии имеет значение один из видов рецепторов – гормональные рецепторы эстрогена и прогестерона. Эстроген и прогестерон часто называют «женскими гормонами», они выполняют важную роль в формировании женского организма в процессе полового созревания, а также в регуляции менструального цикла, беременности и процессе деторождении. Наиболее активно эти гормоны вырабатываются в женском организме во время менструального периода (т.е. с момента первой менструации до их окончания). Однако, даже после менопаузы в женском организме продолжают вырабатываться эти гормоны, хотя и в гораздо меньшем количестве. Примечательно, что у мужчин также они также образутся, но в значительно меньшем количестве, чем у женщин. При соединении с гормональными рецепторами эстроген и/или прогестерон стимулируют рост клеток молочной железы, а также играют важную роль в процессе обновления эндометрия (ткань, выстилающая внутреннюю полость матки).
Так как на опухолевых клетках тоже могут содержаться рецепторы гормонов, их рост может зависить от влияния эстрогена и прогестерона. Выработка (экспрессия) этих рецепторов отмечается на в клетках рака молочной железы в большинстве случаев развития этого заболевания. В случае наличия экспрессии рецепторов гормонов раковые клетки реагируют на сигналы, поступающие от этих гормонов, и используют их для выживания и размножения. В случаях, когда выживание раковой клетки зависит от влияния гормонов, если убрать эти гормоны или заблокировать их действия, у раковых клеток становится меньше шансов на выживание и размножение. Именно этот принцип и лег в основу гормонотерапии опухолей.
Как было сказано выше, гормонотерапия действует только на те опухолевые клетки, чье выживание зависит от наличия на них рецепторов гормонов. До начала лечения важно знать, имеют ли клетки рака эти рецепторы. В настоящее время разработаны методы, которые позволяют «увидеть» рецепторы различных гормонов. Во многих лабораториях используется метод окрашивания, при котором гормональные рецепторы становятся видны в образце ткани рака. Этот тест называется «иммуногистохимическое исследование» или иммуногистохимия (ИГХ) (подробнее про этот вид исследований и другие виды исследований опухолевой ткани). Врач-патологоанатом (или патоморфолог) произведет анализ кусочка опухолевой ткани и оценит наличие в ней экспрессии рецепторов. В случае если они есть – с большой долей вероятности пациентка получит преимущество от проведения гормонотерапии, если их нет – её назначение нецелесообразно, так как нет «точки приложения» лечения.
После проведения исследования врач-патологоанатом составит письменное заключение, отражающее его результаты. В случае рака молочной железы наиболее часто проводится одновременное определение наличия в опухолевой ткани рецепторов эстрогена, прогестерона, гиперэкспрессии (повышения выработки) белка HER2-neu, а также оценка скорости деления опухолевых клеток (индекс Ki-67). Не все лаборатории одинаковым образом анализируют результаты исследования, и они не обязаны выдавать результаты единым образом. Так что вы можете столкнуться с любыми из перечисленных результатов: Июнь 2019
источник
Рецепторами эстрогена и прогестерона называют внутриклеточные структуры, которые способны воспринимать стероидные гормоны. Они присутствуют во многих частях организмах – в тканях-мишенях. Их наличие в молочных железах, матке обеспечивает определенный гормональный эффект. Данные структуры берут участие в механизме индукции синтеза матричной РНК, в процессе выделения цитокинов и факторов роста.
Рецепторы к эстрогену и прогестерону играют немаловажную роль при образовании и прогрессировании злокачественных процессов. В этом случае они представляют собой белковые структуры, которые размещаются на поверхности опухоли. При выделении прогестерона или эстрогенов организмом женщины, что считается нормальным процессом, происходит их соединение с рецепторами, которые находятся около злокачественного образования. В результате происходит интенсивное прогрессирование злокачественных процессов.
Экспрессия рецепторов или их восприимчивость лежит в основе обследований, которые проводятся при выявлении рака молочной железы. При помощи такой диагностики не составит труда определить характер заболевания, выявить гормонозависимость или опровергнуть это. По результатам приведенных анализов можно назначить лучшее лечение, которое позволит человеку выздороветь и предупредить дальнейшие рецидивы онкологических процессов. При помощи данной диагностики делается прогноз течения заболевания.
Также проведя анализ на наличие рецепторов к данным гормонам можно говорить о возможности развития других патологических состояний в организме женщины. К таким негативным процессам относят:
- бесплодие;
- нарушение репродуктивной функции;
- гиперплазия эндометрия;
- онкологические заболевания тела матки и другие.
Рак молочной железы является самым распространенным онкологическим заболеванием у женщин, которое может проявиться в любом возрасте (как в подростковом, так и пожилом). Большое количество образований в груди являются гормонозависимыми. Наличие в организме женщины эстрогена и прогестерона провоцирует их активный рост и метастазирование.
Согласно последним исследованиям частота встречаемости рецепторов к данным гормонам при раке молочной железы следующая:
- почти 75% всех злокачественных образований в груди являются эстроген позитивными. Обозначаются как ЭР+;
- 65% эстроген позитивные опухоли характеризуются дополнительным присутствием восприимчивых структур к прогестерону. Обозначаются как ЭР+/ПР+;
- около 25% злокачественных образований не содержат восприимчивые структуры к гормонам. Их обозначают как ЭР-/ПР-;
- только 10% раковых опухолей являются эстрогеново позитивными, но прогестероново негативными. Обозначение – ЭР+/ПР-;
- 5% онкологических образований являются прогестероново активными, но эстрогеново негативными. Обозначаются – ЭР-/ПР+.
Обследование на определение экспрессии к рецепторам гормонов проводится для всех больных, у которых выявлен рак молочной железы. Опухоли, характеризующиеся наличием и высоким содержанием данных структур, обычно хорошо дифференцированные. Они редко отличаются агрессивным течением, отлично поддаются гормональной терапии. Применяются разнообразные препараты, которые относятся к группе антиэстрогеннов – Тамоксифен, Фарестон. Они непосредственно ограждают рецепторы от восприятия гормонов. Также используются другие группы препаратов – блокаторы ароматазы (Аримидекс). Они не позволяют организму вырабатывать эстрогены. Под воздействием такой гормональной терапии опухоли исчезают со временем, поскольку их рост останавливается.
Образования с ЭР+ поддаются медикаментозному лечению в 50% случаев, а ЭР+/ПР+ – в 75%. Если злокачественные процессы характеризуется параметром ЭР-/ПР-, гормональная терапия будет неэффективна. При показателе ЭР-/ПР+ положительный эффект от применения специальных медикаментозных средств возможен у 10% больных.
Определение данного показателя проводится при помощи специального иммуногистохимического исследования. Для этого необходимо получить специально подготовленные кусочки опухоли, которые обрабатываются определенным образом и заливаются в парафин. Такое исследование может проводиться исключительно в патоморфологических лабораториях.
Иммуногистохимическая диагностика позволяет получить большое количество информации, которая поможет назначить правильное лечение для достижения лучшего результата при наличии злокачественных образований разной локализации. Данное исследование выявляет различные внутри- и внеклеточные маркеры. При помощи обычных способов диагностики определить данные параметры невозможно.
Другие причины проведения иммуногистохимической диагностики. Иммуногистохимическое исследование проводится не только при наличии рака молочной железы.
Определение параметров данного типа при помощи иммуногистохимической диагностики позволяет определить способность эндометрия к имплантации яйцеклетки. Его стероидная рецепция при наличии диагноза бесплодие значительно изменяется. Последние исследования в данной области позволили получить информацию, что в таком состоянии значительно снижается количество прогестерон-позитивных клеток, повышается экспрессия альфаэстрогенов.
Также определение состояния эндометрия при помощи иммуногистохимического исследования, которое заключается в оценке восприимчивости к гормоносодержащим веществам, очень важно перед процедурой ЭКО. Любые отклонения могут снизить эффективность применяемых препаратов или привести к непредвиденным негативным последствиям.
Уровень экспрессии при обычной гиперплазии никоим образом не зависит от возраста женщины или наличия других гинекологических заболеваний доброкачественного характера. Поэтому женщину, которая пребывает в постменопаузном состоянии, следует лечить консервативно.
Также применение иммуногистохимической диагностики показано при раке тела матки. Оно позволяет определить биологическое поведение опухоли.
- Интенсивная терапия. Анестезиология. Реаниматология. Маневич А.З. 2007г. М. «Медиздат».
- Акушерский риск. Максимум информации — минимум опасности для матери и младенца Радзинский В.Е., Князев С.А., Костин И.Н. 2009 г. Издательство: Эксмо.
- Сахарный диабет у беременных. Макаров О.В, Ордынский Москва 2010г С.127.
- Акушерство. Национальное руководство. Гриф УМО по медицинскому образованию. Айламазян Э.К., Радзинский В.Е., Кулаков В.И., Савельева Г.М. 2009 г. Издательство: Гэотар-Медиа.
- Инфекции в акушерстве и гинекологии. Макарова О.В., Алешкина В.А., Савченко Т.Н. Москва., Медпресс-информ, 2007, 462 с.
- Анатомически и клинически узкий таз. Чернуха Е.А., Пучко Т.К., Волобуев А.И. 2005 г. Издательство: Триада-Х.
- Неотложные состояния в акушерств. Сухих В.Н., Г.Т.Сухих, И.И.Баранов и др., Издательство: Гэотар-Медиа, 2011.
Акушер-гинеколог, к.м.н., ДонНМУ им. М. Горького. Автор многочисленных публикаций на 6 сайтах медицинской тематики.
источник
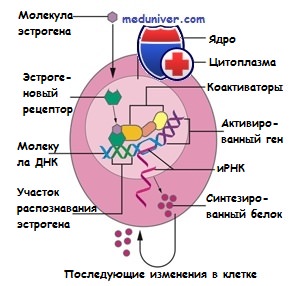
В настоящее время известны 2 типа рецепторов эстрогена (РЭ): α и β. Хотя экспрессия рецепторов типа β проводится опухолевыми клетками рака молочной железы, его функции в нормальных и опухолевых тканях еще не определена точно. И, наоборот, рецептор типа α исследован более подробно, и служит в качестве прогностических маркеров для гормональной терапии. Он принадлежит к группе лиганд-активированных ядерных рецепторов.
После входа в клетки эстроген связывается с РЭ, тот отделяется от шапероновых белков, к которым присоединен, пространственно изменяется, фосфорилирует и димеризуется. Впоследствии, связывается с фрагментами генов, которые в области своих промотор содержат часть, зависимую от эстрогенов (ERE – estrogen response element). Это приводит к транскрипции генов. Этот метод транслитерации называется классическим.
Комплекс эстрадиола и РЭ может регулировать экспрессию генов без прямого взаимодействия с ДНК, с помощью других факторов транскрипции, таких, как комплекс активированного протеина Fos/Jun и АР-1. Этот метод транслитерации называется неклассическим.
Опухолями с положительными стероидными рецепторами считаются все опухоли, имеющие положительные рецепторы эстрогенов и/или прогестеронов (PgR, РП). Принимая во внимание тот факт, что промотор гена к РП содержит часть, зависимую от эстрогена, экспрессия РП должна также служить маркером эндокринной зависимости.
Кроме того, доклинические исследования показали, что блокада РП в клетках может вызвать ингибирование пролиферации и индукцию апоптоза. На основании этих данных были разработаны ингибиторы РП для использования в клинической практике. Два из них, онапристон и мифепристон, были протестированы в клинических исследованиях II фазы (следующий этап клинических испытаний не проводился из-за потери коммерческой поддержки). Основным механизмом действия онапристона считается индукция конечной дифференцировки, что приводит к гибели клеток.
Эстроген-рецепторы принадлежат к семейству ядерных рецепторов. Как уже было сказано, существуют 2 различные формы: α и β. Лишь недавно идентифицированная форма β, гомологичная форме α, происходит в тимусе, селезенке, яичниках и семенных клетках, и имеет сильное сходство с фитоэстрогенами. РЭ-α представляет собой протеин, имеющий молекулярную массу около 65 кДа (595 аминокислот), с ними связывается эстрадиол с высоким сродством. РЭ-β состоит из 485 аминокислот.
С большой вероятностью, РЭ-β являются наиболее предпочтительной мишенью для гормональной терапии.
Молекула РЭ состоит из 6 областей. В основном важны 2 области:
- С-концевой домен для связывания лиганды;
- ДНК-связывающий домен.
Связывание эстрадиола опосредовано через лиганд-связывающий домен, содержащий гидрофобную область. Место связывания с ДНК и гормонами расположены на протеине РЭ так, что не являются связанными и, следовательно, они в какой-то степени независимы.
Ген РЭ-α локализован на коротком плече хромосомы 6, состоит из 8 экзонов. Ген РЭ-β расположен на хромосоме 14, и также имеет 8 экзонов. Обе формы РЭ в естественных условиях имеют собственные сигнальные пути, которые соединены между собой.
Определение РЭ (без разбора α и β компонентов) и РП выполняется как иммуногистохимическими методами, так и количественным ELISA-анализом или анализом лиганд-насыщения. Между указанными выше способами можно предположить некоторые отличия, но все они основаны на иммунохимическом обнаружении протеина или связывания лиганды.
Рецепторы прогестерона относятся к дополнительным параметрам для проверки гормонального статуса больных с раком молочной железы. Действие РЭ, как фактора транскрипции, приводит к регуляции транскрипции генов-мишеней, в т. ч. гена белка РП. Таким образом, по-прежнему является сомнительным отрицательное значение РЭ и одновременное проявление положительности РП.
Очевидно то, что, например, антиэстроген Тамоксифен, вводимый пациентам с онкологией РЭ-положительной и РП-отрицательной, является нежелательным агонистом, стимулирующим пролиферацию опухоли.
В случае первичной опухоли существуют определенные границы РЭ, выше которых ткань считается положительной. Позитивность определяется по-разному при иммуногистохимической характеристике (как процент положительных клеток) и при количественном определении в цитозоле тканей первичной опухоли (cut-off, как правило, находится на уровне 15 пмоль/г белка в цитозоле ткани).
Рецепторы к эстрогену и прогестерону и их определение является очень важным исследованием в диагностике рака молочной железы, играет ключевую роль в выборе метода лечения. В соответствии с размером первичной опухоли, поражением лимфатических узлов результат этого исследования важен для оценки прогноза.
Определение рецепторов эстрогена и прогестерона при первичной опухоли является важным показателем критерия гормональной терапии. Способ применения отдельных видов гормональной терапии (эстрогены, ингибиторы ароматазы или гестагены) зависит не только от стадии опухоли, но также и от состояния менопаузы пациентки.
На антигормональную терапию, однако, реагирует только 60-70% пациенток с положительностью РЭ. В отдаленных метастазах показатели эстроген- и прогестерон-рецепторов уменьшаются, их содержание в первичной опухоли снижается с возрастом.
Положительность рецепторов прогестерона и эстрогена указывает на лучший прогноз заболевания как в отношении бессимптомного интервала, так и общей выживаемости.
Данные последних исследований указывают на целесообразность определения обеих форм РЭ, к тому же как в цитозоле, так и в ядерных фракциях. Важность недавно определенных вариантов РЭ-α и исходящую из этого молекулярную гетерогенность клеток рака молочной железы, еще предстоит доказать. Этот фактор может объяснить отсутствие однородности ответа на гормональную терапию.
Тесты для определения присутствия рецепторов прогестерона и эстрогена должны выполняться у всех вновь диагностированных случаев рака молочной железы и при всех рецидивах. Исследования на наличие рецепторов прогестерона и эстрогена также используются в качестве индикатора прогноза и определения лечения пациентов с первичным или рецидивирующим раком молочной железы.
У больных с наличием РЭ-позитивных и РП-позитивных опухолей, как правило, имеется лучший прогноз, чем у пациентов с наличием РЭ-отрицательных и РП-отрицательных опухолей (как в отношении общей выживаемости, так и бессимптомного интервала). Эти пациенты также лучше отвечают на эндокринную терапию (гормональная терапия, например, с применением Тамоксифена).
Если рак молочной железы является РЭ-положительным и РП-положительным, то пациентка имеет прогноз лучше среднего, и опухоль может реагировать на эндокринную/гормональную терапию. Чем больше число опухолевых клеток, содержащих РЭ/РП, тем более благоприятного ответа на лечение можно ожидать.
Если рак РЭ-отрицательный, но РП-положительный или РЭ-положительный, но РП-отрицательный, выгода из эндокринного лечения может быть извлечена, но эффект такой терапии может быть снижен.
Если рак молочной железы РЭ-отрицательный и РП-отрицательный, то пациентка, скорее всего, не покажет ответа на гормональную терапию.
Влияние эндокринной терапии у отдельных пациентов зависит от многих факторов, но ожидаемый эффект лечения заключается в следующем:
- РЭ-положительный, РП-положительный: эффект терапии у 75-80% больных;
- РЭ-положительный, РП-отрицательный: 40-50%;
- РЭ-отрицательный, РП-положительный: 25-30%;
- РЭ-отрицательный, РП-отрицательный: 10% пациентов или менее.
Тестирование на наличие рецепторов прогестерона и эстрогена (РЭ/РП) проводится в специализированных лабораториях, а результаты доступны в течение нескольких дней после проведения исследования.
источник
Морфологическая диагностика рака молочной железы — ангиогенез, плотность микрососудов, рецепторы экстрогена
Благодаря исследованиям последних 25 лет создана стройная теория опухолевого ангиогенеза.
Зависимость роста опухоли от развития сосудистой сети в ней на сегодня установленный факт.
Ангиогенез необходим для снабжения опухоли кислородом, питательными веществами, факторами роста, гормонами, ферментами и гемостатическими факторами, регулирующими процессы коагуляции и активность фибринолитической системы.
Показано, что динамика роста новообразований и их потенция к диссеминации зависит от степени развития и количества кровеносных сосудов. Выделены в химически чистом виде факторы ангиогенеза новообразований, продуцируемые клетками опухоли и клетками фонового воспалительного инфильтрата. Также синтезированы ингибиторы ангиогенеза, действие которых через редукцию капиллярной сети опухоли приводит к ее регрессу.
В условиях отсутствия достаточного кровоснабжения опухоль получает кислород и питательные вещества путем диффузи и и обычно не вырастает более 1-2 мм в диаметре. В бессосудистых опухолях темпы клеточного роста равны темпам их гибели, поэтому новообразование не растет до тех пор, пока в ней не начнется рост кровеносных сосудов из близлежащих капилляров.
Этот процесс принято называть ангиогенезом. Начало ангиогенеза ведет к формированию новой сети капилляров. Новообразованные капилляры в опухоли отличаются своим строением. Они имеют фрагментированную базальную мембрану, что создает условия для легкого проникновения опухолевых клеток в кровяное русло.
Доказано, что не только опухолевые клетки, но и макрофаги, лимфоциты, тучные клетки передают сигналы о необходимости начала ангиогенеза путем секреции ростовых факторов.
Ангиогенез — сложный динамический процесс, который регулируется рядом проангиогенных и антиангиогенных факторов. Ангиогенное переключение характеризуется дисбалансом между проангиогенными и антиангиогенными факторами и ведет к стимуляции образования кровеносных сосудов.
Повышение васкуляризации опухоли и экспрессия опухолью проангиогенных факторов ассоциируется с распространенной стадией опухоли и неблагоприятным прогнозом многих злокачественных новообразований.
Формирование новых сосудов происходит из уже существующих путем пролиферации, миграции, инвазии эндотелиальных клеток и формирования из них тубулярных структур.
Ангиогенные факторы выявляют в сыворотке крови и в моче больных онкологического профиля. Выраженное ангиогенное действие оказывают фактор роста эндотелия сосудов (VEGF), основной и кислый фактор роста фибробластов (FGF), инсулиноподобный фактор роста I, фактор роста гепатоцитов (HGF), ангиопоэтин, плацентарный фактор роста (PGF), связываемый гепарином эпидермальный фактор роста (EGF), фактор роста тромбоцитов, трансформирующий фактор роста в (TGF-в).
Наиболее изучены факторы семейства VEGF, к которому относят 6 гликопротеинов: VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E, фактор роста плаценты (PIGF)-1 и 2. VEGF-A идентифицировали как фактор, индуцирующий проницаемость сосудов. VEGF-A является гомодимерным гликопротеином с молекулярной массой 45 кДа.
Выявлены 4 изоформы, каждый мономер которых состоит из 121, 165, 189, 206 а.о. VEGF-A121 свободно сскретируется, в то время как наиболее крупные изоформы (VEGF-A145, VEGF-A206) депонируются во внеклеточном матриксе. Для их активации необходимо расщепление протеазами.
Наиболее распространенная изоформа — VEGF-A165, представленный в растворимой и связанной формах. В ряде солидных опухолей отмечают его гиперэкпрессию. Доказано, что структура экспрессии опре деленных изоформ VEGF тканеспецифична. VEGF-A играет важную роль в развитии эмбриона, участвуя в формировании васкулогенеза и сердечно-сосудистой системы.
В постнатальный период имеет большое значение при заживлении ран, овуляции, менструации, поддержании уровня артериального давления, беременности. Повышая ангиогенез, VEGF-A принимает участие в формировании патологических состояний при артрите, псориазе, диабетической ретинопатии. VEGF-C и VEGF-D принимают участие в эмбриональном и постнатальном лимфоангиогенезе. Их значение в ангиогенезе опухоли не установлено. VEGF-E не относится к непосредственному гомологу VEGF, а является вирусным протеином, который кодируется парапокевирусом Orf.
Лиганды VEGF осуществляют ангиогенные эффекты посредством нескольких рецепторов/Активация рецепторов VEGF запускает процесс передачи множества сигналов, регулирующих выживание эндотелиальных клеток, их миграцию, инвазию, пролиферацию и дифференцировку, а также мобилизацию клеток — предшественниц эндотелиальных клеток из костного мозга в кровяное русло.
VEGF повышает проницаемость стенок сосудов, что приводит к отложению белков в интерстилиальной ткани и способствует ангиогенезу. VEGF также индуцирует экспрессию генов, связанных с обеспечением процесса свертывания крови и фибринолиза.
Два рецептора первоначально определяли на эндотелиальных клетках, которые характеризуются как специфические рецепторы тирозинкипазы VEGF-1, VEGF-2.
Доказано, что рецепторы экпрессирутотся на гемопоэтических клетках разных клеточных поколений у взрослых. Эти рецепторы состоят из 7 внеклеточных иммуноглобулиновых областей, единичного трансмембранного домена и домена тирозинкиназы. Недавно открыли еще один рецептор тирозинкиназы VEGF-3, принимающий участие в лимфоангиогенезе.
Все изоформы VEGF-A связываются с рецепторами VEGF-1 и VEGF-2, в то время как плацентарный фактор роста (PIGF)-1 и PIGF-2, VEGF-B связываются только с рецептором VEGF-1, VEGF-E — с рецептором VEGF-2, VEGF-C и VEGF-D — с рецепторами VEGF-2 и VEGF-3.
Гиперэкспрессия VEGF ассоциируется с опухолевой прогрессией и неблагоприятным клиническим исходом при многих карциномах, в том числе рак молочной железы (РМЖ).
VEGF обладает разнообразной биологической активностью посредством стимуляции соответствующих рецепторов, расположенных на эндотелиальных клетках.
Во-первых, он является одним из ключевых индукторов сосудистой проницаемости, которая в 50 тыс. раз мощнее гистамина. VEGF участвует в образовании выпота в брюшной и плевральных полостях при канцероматозе плевры и брюшины.
Точный механизм повышения проницаемости сосудов не определен. Одни исследователи считают, что проникновение макромолекул происходит через эндотелий посредством трансэндотелиальных каналов клеток, вовлекающих вези коваскулярные органеллы, индуцированные VEGF.
Другие считают, что VEGF индуцирует фенестрацию эндотелия, что приводит к формированию дополнительного трансклеточного пути, Есть мнение, что VEGF стимулирует путь внутри эндотелиальных клеток путем открытия синапсов между прилегающими эндотелиальными клетками.
Во-вторых, VEGF приводит к изменению морфологии эндотелиальных клеток, стимулирует их миграцию и рост. Он повышает экспрессию разнообразных генов эндотелиоцитов, включает прокоагулянтный тканевой фактор, фибринолитические белки, металлопротеазы матрикса, интегрины и митогены. VEGF является митогеном эндотелиальных клеток. Пролиферация эндотелия происходит с вовлечением VEGF-2, активации внеклеточных киназ Erkl/2 и JN K/SAPK.
В-третьих, VEGF угнетает апоптоз путем активации PI3K-Akt пути, антиапоптотических белков и тем самым способствует повышению выживаемости клеток.
В-четвертых, VEGF индуцирует ряд ферментов и белков, участвующих в процессе деградации базальной мембраны. Это способствует миграции эндотелиальных клеток.
VEGF также играет важную роль в эмбриональном кроветворении и васкулогенезе. Костный мозг содержит многочисленные чувствительные к VEGF клетки, среди которых эндотелиальиые клетки, стволовые клетки гемопоэза, остеобласты и остеокласты.
Роль клеток — предшественников эндотелиоцитов в васкуляризации опухоли окончательно не установлена. Однако известно, что клетки — предшественники эндотелиоцитов привлекаются в места ангиогенеза опухоли с помощью VEGF.
В настоящее время существуют коммерческие антитела щя определения различных рецепторов VEGF, а также разработаны иммуногистохимические методы как на замороженных срезах, так и на парафиновых.
Учение об апгиогенезе в опухолях практически применяют в онкоморфологии. По степени развития кровеносных сосудов в резецированной опухоли оказалось возможным определить риск развития рецидива и метастазов.
Следует отметить, что ангиогенез играет важную роль в активации дремлющих микрометастазов. Колонии опухолевых клеток, циркулируя в кровяном русле, попадают в органы и длительное время могут находиться в латентном состоянии.
Многие такие микроскопические скопления метастатических клеток погибают путем апоптоза. Однако после активации ангиогенеза происходит васкуляризация микрометастазов, которые начинают быстро расти.
Учитывая важное значение ангиогенеза для развития опухолевого процесса, подавление его путем блокады VEGF довольно перспективный метод лечения. Понимание системы VEGF рецептор — лиганд и ее биологии обусловило разработку различных терапевтических подходов, специфически нацеленных на эту систему. Данный подход к лечению является новым и чрезвычайно важным методом терапевтического вмешательства в онкологии.
S. Brem и соавторы были первыми, предположившими, что количество микрососудов в опухоли может коррелировать с гистологическим вариантом рака и его агрессивностью. A. Srivastova и соавторы получили подтверждение этому, изучая количество кровеносных сосудов в 20 случаях меланомы кожи.
Тканевые срезы опухоли окрашивали специальными красителями, выявляющими сосуды, и визуально изучали их с помощью микроскопа. Затем считали плотность сосудов в опухоли. В 10 случаях меланомы с развитием метастазов в дальнейшем плотность сосудов в два раза выше по сравнению с клинически благоприятно протекающими случаями.
В 90-х годах прошлого столетия проведен ряд исследований по изучению микрососудов РМЖ. Доказано, что их высокий удельный вес отмечают в опухолях с агрессивным течением. Удельный вес (индекс) микрососудов в РМЖ — это количество микрососудов в поле зрения площадью 0,75 мм2.
Для выявления сосудов не существует идеального маркера. Чаще изучают эндотелиальные клетки сосудов, используя антитела к VIIT фактору свертываемости крови (фактор Виллебранда), CD31 и CD34 (фото 94).
Антитела к VIII фактору свертываемости крови (фактор Виллебранда) не выявляют все сосуды. Более чувствитеюн CD31, но это антитело окрашивает плазматические клетки, поэтому в опухолях с воспалительной инфильтрацией его использовать нецелесообразно. CD34 — более информативный для выявления кровеносных и лимфатических сосудов, таккак окрашивает эндотелиальные клетки всех сосудов.
Этот маркер основной во многих патологоанатомических лабораториях. Его недостаток — выявление перевезикулярных стромальных элементов.
Учитывая гетерогенность опухоли, в начале исследования необходимо отобрать участки с наиболее выраженным ангиогенезом. Для этого нужно просмотреть большое количество тонких срезов множественных участков опухоли, окрашенных гематоксилин-эозином.
N. Weidner и соавторы изучали плотность сосудов с помощью иммуногистохимического метода окрашивания эндотелия, используя антитела к VIII фактору свертываемости крови (фактор Виллебранда). При этом участки склероза, некроза, ткани нормального строения в исследовании не учитывали, а для анализа отбирали участки опухоли, содержащие наибольшее количество сосудов.
Эти участки могут быть в глубине, но чаще их определяли по краю опухоли. Любую группу или цепочку позитивно окрашенных клеток, не относящихся к опухоли и строме, рассматривали в качестве микрососуда.
Результатом считали самый высокий показатель плотности микрососудов после просмотра 200 полей зрения при увеличении 20×10 окуляр, площадь поля зрения микроскопа — 0,74 мм2. Среднее арифметическое не вычисляли. В агрессивных типах рака молочной железы определялии индекс микрососудов 101 и выше, в опухолях с благоприятным клиническим течением — в среднем 45 (р=0,003).
Таким образом в агрессивных типах РМЖ плотность микрососудов выше на 33%. У всех пациенток с РМЖ с индексом микрососудов 100 и более выявляли метастазы в течение 33 мес, в то время как в группе больных раком молочной железы с индексом микрососудов менее 33 только у 5%.
Риск метастазирования возрастает на 100% для пациентов с РМЖ с индексом микрососудов более 100. Показатель плотности микрососудов является важным прогностическим фактором общей и безрецидивной выживаемости пациентов.
Некоторые исследователи считают, что в случаях рака с высокой внутриопухолевой плотностью сосудов более эффективна внутриартериальная полихимиотерапия и лучевая терапия.
Во многих патологоанатомических лабораториях применяют подсчет плотности микрососудов в опухолях, однако данная методика, как и подсчет митозов, требует навыков и поэтому результаты различных лабораторий не всегда сопоставимы. М.К. Brawеrеt и соавторы попытались автоматизировать процесс подсчета сосудов. По его мнению автоматизированный подсчет дает более объективные данные, тесно коррелирующие с общей выживаемостью пациентов (р
План лечения составляют с учётом стадии опухолевого процесса, морфологической структуры опухоли, возраста больной, сопутствующих заболеваний, общего состояния пациентки. Применяют следующие методы лечения: хирургический, комбинированный (сочетание операции с лучевой или лекарственной терапией) и ком.
По данным многочисленных публикаций, этиология и патогенез РМЖ сложны и определяются сочетанием многих факторов. Гормональная регуляция функции молочных желез значительно сложнее, чем эндометрия. Помимо эстрогенов и прогесторона, развитие молочных желез в пубертатном периоде, их функция во время бер.
источник
Здравствуйте!
По результатам ИГХ анализа РМЖ:
инвазивная карцинома неспецифического типа (протоковая),
Grade 1,
рецепторы эстрогена 80% ядер,
рецепторы прогестерона 50% ядер,
ki-67 до 15%,
экспрессия белка her-2/neu на уровне — 1(+).
Статус: женщина 58 лет, менопауза с 55 лет.
Мои вопросы:
1) Что значит неспецифического типа из ИГХ?
2) Нужно ли при таком результате her-2/neu делать дополнительные исследования? Я слышала о fish тесте.
3) Можно ли рассматривать овариэктомию как гормональное лечение при таком статусе?
Что такое рецепторы к эстрогену и прогестерону?
Одним их характерных признаков злокачественных опухолей является их «умение» стимулировать свой рост самостоятельно. Они выделяют факторы роста, которые связываются с рецепторами (белковыми молекулами расположенными в опухоли) после чего происходит стимуляция роста. Стимулирующими факторами могут быть и вещества, находящиейся в организме человека. Так, в случае рака молочной железы такими веществами могут выступать эстрогены — женские половые гормоны.
Рецепторы к эстрогену и прогестерону представляют собой белковые молекулы, расположенные в злокачественных клетках. Эстрогены соединяются с ними и образуют комплексы, обладающие стимулирующим действием. Разрушение этого механизма лежит в основе гормонотерапии. Так, антиэстрогены (тамоксифен, фарестон) блокируют рецепторы непосредственно, блокаторы ароматазы (Аримидекс и др.) блокируют выработку эстрогенов, тем самым снижая их уровень в организме.
Рецепторы к эстрогену и прогестерону (ER, PR) находятся не в каждой опухоли.
Какое значение имеет определение рецепторов к эстрогенам и прогестерону в лечении рака молочной железы?
Определение рецепторов к эстрогену и прогестерону в опухоли молочной железы является на сегодняшний день стандартным мероприятием, позволяющим планировать объем лечение, определять в нем роль гормонотерапии, а также определять риск возникновения рецидива заболевания.
Как проводится определение рецепторов?
Определение рецепторов к эстрогенам и прогестерону проводится с помощью иммуногистохимического исследования. Материалом для исследования обычно являются блоки препарата (кусочек опухоли, специально обработанный и залитый в парафин). Исследование проводится в специальных лабораториях.До последнего времени наличие рецепторов HER-2/neu у больных раком молочной железы определяли гистохимически после пункции опухоли. Эти рецепторы обнаруживают только у 20-30% женщин с раком молочной железы. Основной целью гистохимического исследования является определение показаний для лечения трастузумабом (антитела к рецепторам HER-2/neu), которое показано при обнаружении более 10% позитивных клеток (2+ или 3+). В дальнейшем выяснилось, что значительная часть больных раком молочной железы положительно реагируют на лечение трастузумабом при отрицательном результате гистохимического исследования.
В настоящее время получены тест-системы для количественного определения HER-2/neu в сыворотке крови, который хорошо коррелирует с данными гистохимического исследования. Повышение концентрации HER-2/neu в сыворотке крови наблюдают у женщин с раком молочной железы, особенно при наличии метастазов. В качестве точки разделения используют величину 15 нг/мл. Значения выше этого уровня свидетельствуют о HER-2/neu-позитивном раке молочной железы. Повышенный уровень HER-2/neu сильно коррелирует с плохим прогнозом, низкой выживаемостью и агрессивным течением заболевания (такие опухоли обладают высокой пролиферативной и метастатической активностью). Эффективная специфическая (трастузумаб), гормональная и химиотерапия сопровождаются снижением уровня HER-2/neu в сыворотке крови. Принятие решения о таком методе гормонального лечения, как воздействие на яичники – очень важный и ответственный момент в лечении рака молочной железы. Это особенно относится к тем пациенткам, у которых еще нет детей. Однако, если Вас уже за сорок, и менструальный цикл у Вас все еще не угас, но при этом имеются пораженные раком лимфоузлы, врач может порекомендовать Вам несколько методов для того, чтобы снизить уровень эстрогенов в крови. Это может быть и подавление функции яичников, их удаление и назначение ингибиторов ароматазы.
Выбор методов будет зависеть от риска рецидива рака.
источник
Иммуногистохимические выявления экспрессии рецепторов к стероидным гормонам при патологических процессах
Биологический эффект гормонов начинается с их связывания со специфическими рецепторами. Все рецепторы, будь то рецепторы стероидов или полипептидов, имеют по два функционально разных домена (участка): первый домен (домен узнавания) связывает гормон, а второй генерирует сигнал, который сопрягает узнавание гормона с определенным внутриклеточным процессом.
Рецепторы к эстрогенам (ЭР) и прогестерону (ПР) относятся к внутриклеточным рецепторам стероидных гормонов. Они присутствуют в различных тканях-мишенях, прежде всего в молочных железах и матке, где участвуют в механизмах гормональной регуляции жизнедеятельности и функциональной активности специализированных клеток. Нарушение рецепторной чувствительности тканей приводит к развитию дисфункциональных нарушений репродуктивной сферы, бесплодию, гиперплазии эндометрия, злокачественным и доброкачественным опухолям матки и молочных желез и др. Поэтому исследование ЭР и ПР используют в диагностике и прогнозе развития данных патологических состояний.
 |  |
| Схема влияния стероидных гормонов на структурную перестройку эндометрия | Экспрессия ЭР в клетках стромы и эпителии желез эндометрия. |
Эндометрий – многокомпонентная сложная система, клеточные элементы которой находятся в сложной динамической взаимосвязи. Циклическая структурно-функциональная перестройка эндометрия обеспечивается главным образом взаимодействием с половыми гормонами, рецепторы которых располагаются в ядре и цитозоли эпителия желез и стромы.
Концентрация рецепторов к эстрогенам и прогестерону постепенно нарастает к преовуляторному периоду. До середины лютеиновой фазы сохраняется максимальное содержание рецепторов к прогестерону, тогда как суммарных рецепторов к эстрогенам в этом периоде цикла значительно уменьшается. К концу цикла существенное снижение концентрации цитозольных рецепторов к прогестерону нивелирует возникшую разницу уровней стероидных рецепторов.
Нарушение рецепторной чувствительности эндометрия может быть следствием воздействия различных этиологических факторов. Наиболее частой причиной, по мнению ряда авторов, является хронический эндометрит , при котором основной проблемой становится снижение экспрессии рецепторов за счет нарушения кровоснабжения, ишемии ткани, склероза и фиброза в стромальном компоненте. При этом дисфункция стероидо-рецепторных систем эндометрия является одним из механизмов нарушения процессов пролиферации и секреторной трансформации слизистой оболочки матки.
Одной из возможных причин неудач в программе экстракорпорального оплодотворения и переноса эмбриона (ЭКО и ПЭ) является нарушение процессов имплантации (прикрепления эмбриона к эндометрию). Для обеспечения успешной имплантации и развития эмбриона огромное значение имеет структура эндометрия, в частности содержание в нем прогестероновых и эстрогеновых рецепторов, а также пиноподий — выростов на поверхности эндометрия, к которым непосредственно прикрепляется эмбрион. В настоящее время доказано, что решающую роль в процессе имплантации играют не столько абсолютное содержание стероидных гормонов и морфологическая структура эндометрия, сколько его рецептивность, т.е количество функционально полноценных рецепторов ткани эндометрия к соответствующим стероидным гормонам.
При нарушении содержания рецепторов в эндометрии и низком количестве пиноподий, даже при нормальных уровнях гормонов в крови, не происходит достаточного развития эндометрия и эмбрион не может прикрепится к матке.
В настоящее время в программе подготовки к ВРТ рекомендован метод диагностики состояния эндометрия, позволяющий определить полноценность его развития и способность обеспечить адекватное развитие эмбриона в полости матки.
Данный метод основан на комплексном изучении эндометрия, включающем:
- определение гормонального статуса;
- гистологическое исследование;
- определение содержания прогестероновых и эстрогеновых рецепторов;
- подсчет количества пиноподий.
Не менее важна оценка состояния эндометрия перед назначением высоких доз гормональных препаратов в программах ЭКО. С одной стороны, гормональные препараты оказывают существенное влияние на систему рецепторов, с другой – нарушения в рецепторном аппарате могут привести к недостаточной восприимчивости эндометрия к экзогенному гормональному воздействию.
Нарушение экспрессии рецепторов половых гормонов является одним из ведущих механизмов формирования гиперплазии эндометрия и определяет форму и тяжесть гиперпластического процесса. Рядом авторов было показано, что при простой железистой гиперплазии без атипии наблюдается повышение рецепторов ЭР и ПР в эпителии желез и стромальных элементах с одновременно высокими показателями экспрессии маркера пролиферации Ki-67. При рецедивирующих формах ЖГЭ наблюдается мозаичность картины рецепторной чувствительности эндометрия. Зоны с обедненностью рецепторов к эстроген и прогестерону или полным их отсутствием в эпителии желез могут служить субстратом для развития автономной ткани (Бабиченко И.И., Фролова И.И., 2006).
 |  |
Результаты исследований (Толибова Г.Х, Траль Т.Г. и соавт, (НИИ АГиР им Д.О. Отта) показали, что оптимальный день для проведения ИГХ-исследования рецепторной чувствительности эндометрия к эстрогену и прогесетрону является:
- С 19 по 22 день менструального цикла при 28-дневном цикле для диагностики эндометриальной дисфункции (оценка экспрессии рецепторов эстрогена и прогестерона, маркеров воспаления)
- С 23 по 26 день менструального цикла при 35 –дневном цикле
- С 19 по 22 день при индуцированном цикле
- Через 4-6 месяцев после неудачной попытки ЭКО
Рак молочной железы является самым распространенным злокачественным образованием у женщин и находится на втором месте среди причин смерти от опухолевых заболеваний. Раннее выявление данного заболевания и применение адекватных методов лечения могут приводить к существенному увеличению выживаемости.
Благодаря успехам молекулярной биологии в настоящее время в арсенале исследователей и клиницистов имеется очень много молекулярно-биологических показателей, которые могут помочь в прогнозе раннего рака и выборе адьювантной терапии при распространенном процессе.
Основные группы клеточных/тканевых
маркеров, используемых при РМЖ
источник