Рак молочной железы является основной причиной смертности от злокачественных опухолей среди женского населения. Подход к оперативному лечению рака молочной железы за всю историю развития онкологии претерпело немало изменений – от классической радикальной мастэктомии, которая была разработана под конец ХІХ века Холстедом, до органосохраняющих операций. Эти изменения связаны с разработкой и внедрением новых методов комбинированного и комплексного лечения.
Применение неоадъювантных методов лечения рака молочной железы в виде химиотерапии и лучевой терапии, проведенных перед операцией, снижает биологическую активность опухоли и снижает или предотвращает лимфогенную диссеминацию. Но эти методы способны отодвигать сроки выполнения радикальной операции, так как возможны появления лучевых эпителиитов и лейкопении.
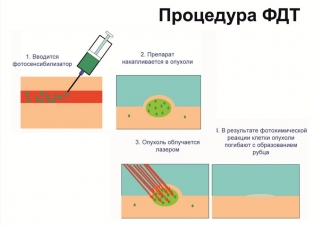
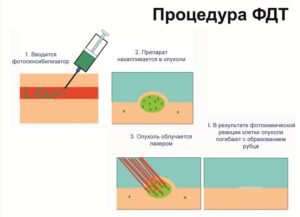
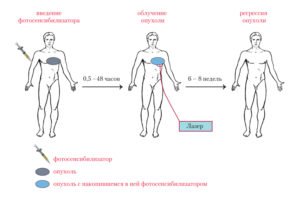
Фотодинамическая терапия является органосохраняющим способом лечения рака молочной железы из-за накопления веществ фотосенсибилизатора в клетках злокачественных новообразований. Основой этого метода является фотохимическая деструкция фотосенсибилизатора с выделением большого количества «синглетного кислорода».
Это происходит под действием светового излучения определенной мощности и длины волны. Эти волны вместе с другими радикалами провоцируют процесс разрушения в клетке и приводят к некробиозу и некрозу клеточных структур, базальных мембран сосудов опухоли и эндотелия.
Помимо этого, фотодинамическая терапия (ФДТ) приводит в активность систему комплемента и иммунологически активные клетки крови, которые находятся в опухоли.
Самым важным в действии фотодинамической терапии является запуск апоптоза клеток. Это гораздо сильнее снижает биологическую активность клеток новообразования и риск метастазирования. Поэтому изучена возможность комбинации фотодинамической терапии с хирургическим методом. ФДТ применяется при лечении образований злокачественного характера, которые доступные лазерному воздействию.
Положительный эффект фотодинамической терапии разных онкологических процессов составляет от 70% до 92%.
Во многих случаях раннего выявления рака молочной железы пациентки отказываются от оперативного вмешательства. Поэтому возникают вопрос о возможности применения фотодинамической терапии в виде самостоятельного вида лечения.
В связи с этим были проведены исследования, целью которых была разработка методики интерстициальной фотодинамической терапии рака молочной железы и оценка эффективности данного метода с препаратом Фотосенс, который является фотосенсибилизатором второго поколения.
В исследовании принимали участие 14 больных возрастом от 40 до 65 лет, которые добровольно согласились пройти ФДТ.
Больным, которым был поставлен диагноз рак молочной железы (T1-2NхM), моноузловая форма, которые имели диаметр опухоли не более 3 см, ФДТ применялась в виде предоперационной терапии.
В исследовании лечения рака молочных желез методом ФДТ использовался фотосенсибилизатор Фотосенс (ФС). Данный препарат вводился внутривенно капельно на протяжении 30 минут в дозировке 0,5 мг/кг за 1-1,5 часа перед облучением с предварительным разведением в физиологическом растворе.
С целью обнаружения и определения концентрации вещества в опухоли применялась установка LESA-6 с лазером, который работает на длине волны 630 нм. При этом плотность энергии, которая им создавалась, ни разу не спровоцировала фотодинамического повреждения исследуемой ткани.
Для фотодинамической терапии в лечении рака молочных желез применялся диодный лазер ЛД680-2000, который имеет мощность 1,5Вт и лазерное излучение с длиной волны 670 нм. Для подведения света лазера использовался металлизированный световод, который имеет диаметр до 1 мм. При этом мощность облучения лазером на выходе кварцевого световода составляла 300 мВт/см 2 . Плотность энергии при интерстициальном облучении составляла 100-500 Дж/см 3 с одной позиции.
Фотодинамическая терапия проводилась за 7-10 дней до мастэктомии радикальным методом.
Женщинам для лечения рака молочных желез проводился сеанс интерстициального облучения. При превышении узла опухоли более 2,5 см (в 6 случаях) световод подводился к новообразованию из 4 точек. У остальных 8 пациенток свет подводился из одной точки, которая располагалась в центре опухоли. Это подтверждало ультразвуковую коррекцию ориентации.
С целью снижения фоточувствительности кожи женщины после введения фотосенсибилизаторов избегали попадания прямых солнечных лучей на протяжении 4- 6 недель. Пациентки принимали антигистаминные и антиоксидантные препараты на протяжении месяца, также использовали солнцезащитные кремы и очки.
В процессе проведения спектрометрии в удаленном препарате концентрация ФС в ткани новообразования составила в 3,35- 4,1 раза больше, нежели в калибровочном образце. Это является необходимым условием для ФДТ. Но в коже и в окружающей ткани груди она не превышала 1,8 ед.
При гистологическом исследовании удаленных тканей молочной железы абсолютно во всех случаях наблюдался процесс некроза опухолевого узла.
В 11 случаях из 14 этот некроз после фотодинамической терапии имел тотальный характер, и структура опухоли не определялась. У 3 человек некроз был частичным.
Это говорит о недостатках в технике фотодинамической терапии при больших размерах опухолей, которые требуют многофокусного подведения световой энергии.
Итоги и выводы о целесообразности применения фотодинамической терапии в лечении рака молочной железы:
- Фотодинамическая терапия позволяет получить полный некроз опухоли с заменой ее ткани на рубцовую.
- Во всех случаях лечения рака груди ФС значительно накапливался, что позволяло проводить ФДТ с хорошим местным эффектом.
- В случаях отказа от оперативного лечения рака молочной железы метод можно применять в сочетании с рентгено- и химиотерапией.
- Ни в одном случае не наблюдалось побочных реакций после введения Фотосенса в рекомендованных дозах.
- Возможно проведение повторных сеансов без введения препарата из-за длительной задержки фотосенсибилизатора в тканях.
- С применением рекомендованных режимов мощностей фотодинамическая терапия протекает с болевыми ощущениями, что требует предварительного введения анальгетиков.
Из негативных моментов применения фотодинамической терапии стоит выделить болезненность в области приложения энергии самой большой плотности, а также повышение фоточувствительности кожи. Боль, возникавшая при сеансах, купировалась ненаркотическими обезболивающими средствами.
Кожа была фоточувствительна на протяжении 2-3 месяцев, что говорило о значительном содержании в ней ФС. Местная фототоксическая реакция на кистях рук и на открытых участках кожи в виде зуда и гиперемии отмечалась у 3 пациенток. У 8 больных после первого дня наблюдался отек молочной железы, у 3 был подъем температуры до субфебрильных цифр.
В целом фотодинамическая терапия является одним из нескольких эффективных способом лечения рака молочной железы, которые применяются на сегодняшний день.
источник
Совсем недавно одним из методов лечения рака молочной железы стала фотодинамическая терапия.
Для разрушения раковых клеток она использует лазер и другие источники света в сочетании с лекарством – фото-чувствительным агентом. Тип лекарства соответствует предпочтениям раковых клеток, и когда его активизирует свет, оно их разрушает. Необходимо, чтобы свет достигал раковых клеток. Изначально фотодинамическая терапия использовалась для лечения рака кожи, а также разновидностей рака, расположенных на слизистой внутренних органов или вблизи нее – например, рак слизистой рта или слизистой мочевого пузыря, которых легко достичь лазером или световым зондом. Сейчас для лечения плотных опухолей молочной железы используется оптиковолоконный кабель. Если рак возник в молочной железе, целью терапии является его излечение, но при развитом метастатическом раке молочной железы или яичников цель обычно связана с ослаблением симптомов через уменьшение опухолей, до которых свет сможет добраться. Фотодинамическая терапия проводится в больнице, хотя чаще ее предоставляют в однодневном стационаре.
На первой стадии лечения в организм вводится лекарство: это может быть инъекция, напиток или таблетка. На второй стадии раковую опухоль облучают светом. Это может быть лазерный или нелазерный луч, проходящий по гибкому шнуру, который подбирается как можно ближе к опухоли. Интервал между этими стадиями, позволяющий лекарству собраться в раковых клетках, зависит от типа лекарства и может варьироваться от 90 минут до четырех дней. Восстановление после ФТ вызывает меньше рубцевания, чем хирургическая операция; время излечения зависит от того, насколько глубоко проник свет, и может достигать нескольких недель. Метод дает особую надежду в случае рака молочной железы из-за важности груди для самовосприятия женщины. Благодаря простоте и низкой стоимости он способен помочь пациентам в бедных странах.
Результаты лечения рака молочной железы с помощью ФТ говорят о том, что метод играет важную роль в контроле возвращающегося рака молочной железы, с которым не справилась традиционная терапия 70 . Частичное облучение молочной железы с последующей лампэктомией – хороший выбор на ранней стадии. То, что ФТ успешно используется при лечении рецидивов в грудной стенке с гистопатологическими характеристиками, схожими с первичными опухолями, дает возможность в ряде случаев заменить радиотерапию фотодинамической терапией после лампэктомии. Свет необходимо направлять на место опухоли диаметром 1–2 см. Использование неионизирующего излучения исключает долговременные осложнения, в том числе вероятность возникновения рака из-за облучения. Свет к месту воздействия доставляет баллонный катетер, а само место определяется путем ультразвукового сканирования, чтобы катетер подошел точно к опухоли. В отличие от многочисленных сеансов радиотерапии, ФТ требует всего лишь одного сеанса. Основной риск – инфицирование места входа катетера.
Сейчас исследуется оптимальное сочетание лекарства и дозы светового излучения. Некоторые эксперименты показывают возможность великолепного контроля опухоли и хорошего восстановления нормальной ткани, но другие демонстрируют разрушение нормальной ткани, поэтому на данной стадии развития процедуры важно, чтобы она проходила только в высококвалифицированных медицинских центрах.
В литературе, посвященной использованию ФТ для лечения таких поверхностных типов рака молочной железы, как болезнь Педжета, говорится, что фотодинамическая терапия может быть весьма эффективным методом 71 .
Побочные эффекты
К побочным эффектам фотодинамической терапии относятся повреждения кожи и глаз в отсутствие достаточных мер предосторожности, а также другие, обычно незначительные и временные неудобства, в зависимости от места лечения.
Ожог и повреждение глаз. Побочные эффекты ФТ зависят от состояния здоровья конкретного человека. Кроме того, они отражают тип фоточувствительного лекарства и время между его введением и применением облучения. Хотя лекарства аккумулируются в основном в раковых клетках, они могут проникать и в здоровые клетки кожи, в том числе вокруг глаз, которые крайне чувствительны к свету. Тем, кто проходит ФТ, советуют защищать себя не только от солнечного света, но и от яркого электрического освещения на период до нескольких недель, в зависимости от лекарства. Пациенты могут носить на улице панамы, рубашки с длинными рукавами, перчатки и темные очки. Солнцезащитные кремы не помогают. Можно сильно обгореть даже в тусклый зимний день или у окна, если солнце яркое. В помещении необходим приглушенный свет, максимум 60 W Визиты к офтальмологу следует отменить. Старайтесь, чтобы в глаза не бил яркий свет. Врач или медсестра должны объяснить вам, как постепенно привыкать к нормальному свету и когда он станет для вас безопасен.
Боль. Лечение ФТ может вызвать боль в месте опухоли. Принимайте болеутоляющие.
Опухание. При использовании некоторых лекарств может появляться опухание. Обычно оно временное, и, чтобы снизить воспаление, его можно лечить стероидами.
В зависимости от местоположения опухоли возникают и другие побочные эффекты: запор, с которым можно справиться естественным питанием с высоким содержанием волокон, или тошнота, которую можно вылечить акупунктурой или имбирным чаем.
Дальнейшие исследования
Продолжаются клинические исследования по увеличению эффективности фотодинамической терапии и снижению ее побочных эффектов. Исследуются различные фоточувствительные агенты, которые могут быть зелеными (основанными на хлорофилле) или красными (полученными из крови), а также воздействие лазерного и нелазерного луча, доставляемого по оптоволокну. Врач даст заключение, подходит ли вам фотодинамическая терапия.
Предупреждение и советы
Поскольку фотодинамическая терапия относительно проста, не слишком опасна для пациентов и крайне выгодна, некоторые частные клиники предлагают ФТ в качестве лечения развитого рака молочной железы или рака яичников. К сожалению, они могут использовать ФТ так, что она не поможет. Некоторых пациентов, с которыми я разговаривала, после принятия фоточувствительного лекарства просто клали под красную лампу, освещавшую все их тело. Это называется «цитолюминисцентная терапия» и не имеет отношения к ФТ. Непонятно, как в этом случае свет достигает опухоли, и я не обнаружила свидетельств успешных результатов ЦТ у людей с глубокими плотными опухолями яичников и молочной железы. Некоторые частные клиники даже рекомендуют ЦТ вместо химиотерапии. Когда пациенты приходят ко мне после цитолюминисцентной терапии (которую неверно называют фотодинамической), их симптомы обычно ухудшаются, и иногда довольно серьезно. Некоторые чувствовали себя хорошо, пока лечились в государственных учреждениях и следовали моей программе. Возможно, лекарство, которое всасывается раковыми клетками, может их стимулировать, если его не активирует свет. У меня нет прямых доказательств – это лишь инстинкт ученого. Я советую обсуждать с вашим терапевтом и онкологом любое предлагаемое лечение, чтобы убедиться, что рекомендуемое лекарство и способ доставки света будут безопасными и эффективными.
источник
На долю рака молочной железы 3-4 стадии приходится 30% случаев первичного обращения к варчу. У части пациенток наблюдается распад опухоли, они страдают от боли, кровотечений и воспаления, но и получают психологическую травму, так как сам вид распадающейся опухоли и ее запах невольно изолирует таких женщин от окружающих. Ввиду распространенности опухоли очень часто таким пациенткам проводят только симптоматическое лечение.
Мировой опыт применения в онкологии фотодинамической терапии показал ее эффективность как при радикальном, так и при паллиативном лечении раковых опухолей разной локализации. В некоторых ситуациях, например, при отказе женщины от операции или при противопоказаниях к операции, фотодинамическая терапия есть единственным методом влияния на опухоль.
В основе фотодинамической терапии лежит биологический эффект, который заключается в реакциях фотоокисления. Сравнительно быстрая реакция опухоли на фотодинамическую терапию является результатом одновременного повреждения злокачественных клеток и их сосудов.
Первые признаки нарушения кровообращения наблюдаются через 2-3 часа после фотодинамического воздействия с развитием полной закупорки сосудов через 12 часов и некроза опухоли через 24 часа. Лазерное излучение, падающее на опухоль, приводит к местному повышению температуры, которое воздействует на опухоль аналогично гипертермии. Имеются сообщения о бактерицидном действии фотодинамической терапии.
Фотодинамическая терапия проводится больным раком молочной железы с 3-4 стадиями. У них может быть кровотечение различной интенсивности из распадающейся опухоли, метастазы в легких, в позвоночнике, анемия.
У всех больных с распадающимися опухолями молочной железы после первого сеанса достигается остановка кровотечения. Иногда у пациенток с большими по объему опухолями для полного облучения всей поверхности требуется несколько сеансов. В этом случае сначала облучают наиболее кровоточащие участки.
Кроме этого наблюдается очищение опухоли от некротических масс, что приводит к исчезновению зловонного запаха распадающейся опухоли и формированию плотного струпа к 7-8 суткам после начала лечения. Исчезает воспалительный отек молочной железы, практически переставает беспокоить боль.
У всех больных во время сеансов фотодинамической терапии наблюдается усиление боли в области опухоли. Иногда даже может потребоваться назначение наркотических анальгетиков, у остальных боли снимаются обычными анальгетиками.
Через 1-2 месяца после фотодинамической терапии опухоль молочной железы или уменьшается, или не отмечается прогрессирования роста. Рецидив кровотечения при раке молочной железе может наблюдаться через несколько месяцев после проведения фотодинамической терапии.
Эти положительные результаты показывают, что применение фотодинамической терапии при раке молочной железы с паллиативной целью является эффективным для воздействия на распадающиеся опухоли молочной железы. При этом достигается остановка кровотечения, наблюдается очищение опухоли от некротических масс, что приводит к уменьшению зловонного запаха и боли. Все это улучшает не только состояние пациенток, но и качество их жизни.
Если у вас есть вопросы к врачам онкологам вы можете задать у нас на сайте в разделе консультации
Диагностка и лечение онкологии в медицинских центрах Израиля подробная информация
Подпишитесь на рассылку Новости онкологии и будьте в курсе всех событий и новостей в мира онкологии.
источник
Самая современная терапия по лечению рака — фотодинамическая, основанная на сочетании фотосенсибилизаторов и лазерного излучения с нужной длиной волны.
Фотосенсибилизаторы преобразуют энергию лазера, вызывая тем самым синглетный кислород и свободные радикальные реакции, которые приводят к гибели злокачественных клеток. Фотодинамическая волна уничтожает клетки опухоли избирательно, ведь фотосенсибилизаторы находятся в пораженной ткани дольше, чем в здоровой. Таким образом, опухоль отмирает и происходит ее замещение здоровыми тканями.
ФДТ заметно выгодна, по сравнению с хирургическим лечением, лучевым, химиотерапией тем, что отсутствуют тяжелые осложнения.
При первых стадиях онкологического заболевания радикальность ФТД не уступает ни одному традиционному комплексу лечения, а в случае рецидива, возможно, провести повторный курс, так как к данному методу не формируется устойчивость лечение лазером рака, рецидивы рака молочной железы.
Фотодинамическую терапию применяют тогда, когда общепринятые способы лечения пациенту противопоказаны, либо оказались для него неэффективными. Лечить ФТД можно не только начальные стадии рака, но и уже сильно развитые и далеко зашедшие (рак мочевого пузыря, гинекологические раки, опухоли бронхов, трахеи, восстановления просвета в пищеводе, рецидивы рака грудной стенки и молочной железы). Очень эффективно применение ФТД при лечении внутриполостных онкологий с применением эндоскопов, которые позволяют провести лазерное лечение рака даже в труднодоступных зонах, таких как желчный проток и панкреатодуоденальная зона.
Механизм действия заключается в том, что фотосенсибилизатор вводится внутривенно и концентрируется в раковой области, за счет которого и повышается светочувствительность тканей. Лазерное излучение является низкоэнергетическим и возбуждает фотосенсибилизатор, в результате чего происходит фотохимическая реакция, которая продуцирует синглетный кислород и свободные радикалы, которые высокоактивны и токсичны для раковых клеток. Опухоль начинает рассасываться и постепенно замещаться здоровой соединительной тканью, что приводит к выздоровлению.
1.Применяется тогда, когда хирургическое вмешательство не возможно, так как возникнут тяжелые сопутствующие заболевания или из-за распространенности опухоли. ФТД разрушает только пораженные клетки, не повреждая здоровые ткани и коллагеновые волокна, которые являются каркасными в тканях и органах. Благодаря лазерной терапии, проводимой при помощи фотосенсибилизаторов после разрушения опухоли, освободившийся каркас заполняют здоровые клетки.
2.Фотосенсибилизатор носит избирательный характер и поэтому накапливается только в опухоли при этом, не задерживаясь в нормальных тканях, окружающих ее. Благодаря чему в процессе облучения селективно повреждается злокачественная опухоль, а не окружающие ткани
3. Фотодинамическая терапия не воздействует на весь организм, как при химиотерапии, лечение происходит локально, то есть только там, куда направляется луч.
4. Низкая стоимость терапии. Для большинства онкозаболевших нет возможности ездить на лечение в дорогие зарубежные клиники, поэтому для них этот метод самый приемлемый и к тому же щадящий локальный и малоинвазивный.
На фоне всех этих достоинств есть один недостаток ФТД — это повышение чувствительности кожи к яркому солнечному свету. Таких проявлений можно избежать, но для этого требуется соблюдать определенный световой режим. Отечественные ученые уже разработали фотосенсибилизаторы, у которых не будет такого побочного действия.
Фотодинамическая терапия является новым и перспективным методом в лечении раковых опухолей и к тому же успешно используется в России.
Заведующий отделением гипертермии и фотодинамической терапии
Кандидат медицинских наук, первая квалификационная категория
Первая квалификационная категория
Кандидат медицинских наук, высшая квалификационная категория
Отделение гипертермии и фотодинамической терапии является структурным подразделением и клинической базой лаборатории фотодинамической терапии и гипертермии с группой химиотерапии РНПЦ ОМР им. Н. Н. Александрова.
Отделение сотрудничает с другими клиническими подразделениями и ведет совместную научную деятельность с ведущими специалистами нашего Центра.
Разработанные и применяемые в лаборатории/отделении методы общей и локальной гипертермии при лечении далеко зашедших форм злокачественных новообразований; фотодинамической терапии предраковых заболеваний женской половой сферы являются уникальными, Не имеют аналогов в странах СНГ и в мире.
Отделение оснащено современной аппаратурой для проведения сеансов общей управляемой и локальной гипертермии, фотодинамической терапии и флуоресцентной диагностики.
Сформирован коллектив сотрудников, обладающих высокими профессиональными качествами и большим трудовым стажем работы в области гипертермической онкологии и фотодинамической терапии, в том числе, 2 кандидата медицинских наук, врача высшей квалификационной категории.
Медицинская помощь гражданам Республики Беларусь осуществляется бесплатно (кроме предопухолевой патологии и доброкачественных новообразований), гражданам стран СНГ и дальнего зарубежья – на платной основе.
Дополнительную информацию можно получить в кабинете платных услуг по телефонам:
Гипертермия общая высокочастотная электромагнитная управляемая гипертермия (с искусственной гипергликемией и полихимиотерапией) при метастатическом раке почки, меланоме кожи, раке яичников, забрюшинных саркомах и других новообразованиях, резистентных к стандартным схемам химиотерапии и химиолучевой терапии; локальная гипертермия при злокачественных новообразованиях III–IV стадий (нерезектабельный местно–распространенный рак шейки матки, опухоли органов малого таза и др.).
Установка для общей высокочастотной электромагнитной управляемой гипертермии «Птичь М» (Республика Беларусь)
фотодинамическая терапия базально– и плоскоклеточного рака кожи; фотодинамическая терапия подкожных метастазов рака молочной железы; фотодинамическая терапия подкожных метастазов меланомы; фотодинамическая терапия рака мочевого пузыря; фотодинамическая терапия дисплазии шейки матки; фотодинамическая терапия лейкоплакии слизистых оболочек полости рта; фотодинамическая терапия дистрофических заболеваний вульвы; интраоперационная соно–фотодинамическая терапия злокачественных опухолей головного мозга grade III–IV; фотодинамическая терапия меланомы хориоидеи больших размеров; внутривенное лазерное облучение крови; системная фотодинамическая терапия.
Лазерный аппарат для фотодинамической терапии «ФДТ–ЛАЗЕР» (λ=660±5 нм; «БелОМО», Республика Беларусь); лазерный аппарат для фотодинамической терапии «УПЛ ФДТ» (λ=665±5 нм; НТЦ «ЛЭМТ», Республика Беларусь); аппарат лазерный терапевтический «Люзар–МП» (λ1=670±2 нм; λ2=810±6 нм; Республика Беларусь).
Гипертермия в онкологии. Возможности и перспективы. (Ссылка на скачивание) Фотодинамическая терапия. Дисплазия шейки матки. (Ссылка на скачивание) Фотодинамическая терапия. Лейкоплакия слизистой оболочки полости рта. (Ссылка на скачивание) Фотодинамическая терапия. Рак кожи. (Ссылка на скачивание)
На сегодняшний день основные направления клинических исследований – это использование общей гипертермии в комбинированном лечении химио — и радиорезистентных форм злокачественных новообразований, фотодинамическая терапия и флуоресцентная диагностика злокачественных опухолей и предраковых заболеваний.
«Разработать и внедрить метод лечения больных рецидивными и рефрактерными злокачественными лимфомами с применением общей гипертермии» (2009–2013 гг.). «Разработать метод мультимодального лечения больных нерезектабельным раком шейки матки» (2010–2014 гг.) «Разработать методики фотодинамической (флуоресцентной) диагностики и терапии злокачественных опухолей слизистой полости рта и ротоглотки» (2010–2012 гг.). «Разработать и внедрить органосохраняющие методы лечения больных поверхностным и инвазивным раком мочевого пузыря с использованием фотодинамической терапии» (2011–2015 гг.). «Разработать и внедрить в медицинскую практику органосохраняющий метод лечения больных меланомой хориоидеи больших размеров» (2010–2014 гг.).
комплекс для общей электромагнитной гипертемии «Птичь» (РНПЦ ОМР им. Н. Н. Александрова); оптоволоконный лазерный флуоресцентный спектроанализатор «ЛЭСА–6» (Биоспек); устройство визуализации флуоресценции «КАМИН–ВИДЕО» (Биоспек); спектрофлуориметр лабораторный «SOLAR SM–2203» (SOLAR); кольпоскоп с возможностью визуализации флуоресценции «ЭКС–1» (Экомп); лазеры для фотодинамической терапии с длиной волны излучения 660 нм (ЛЭМТ, ИФ НАН РБ); лазеры для фотодинамической терапии с длиной волны излучения 670 нм (Биоспек); лазеры для низкоинтенсивной терапии с длиной волны излучения 670 нм и 810 нм (Люзар).
В отделе оказывается помощь больным с далеко зашедшими формами диссеминированной форма меланомы кожи, рака молочной железы, почки, яичников, сарком мягких тканей и костей, в том числе детям в возрасте от 7 лет.
Гипертермия – это научно обоснованный современный метод лечения онкологических заболеваний, основанный на совместном воздействии высокой температуры и специальных противоопухолевых агентов, обладает высокой повреждающей способностью в отношении злокачественных опухолей.
Гипертермия значительно повышает эффективность лучевой терапии и химиотерапии при комбинированном применении. Сама по себе гипертермия безопасна, не имеет побочных эффектов и не дает осложнений.
Процедура гипертермии полностью безболезненна. Гипертермия – не панацея, но практически при любой локализации и при любой стадии заболевания включение гипертермии в комплексное лечение существенно улучшает его результаты, увеличивает продолжительность и повышает качество жизни.
- При первично операбельных опухолях применение гипертермии позволяет уменьшить объем резекции, улучшает ближайшие и отдаленные результаты хирургического метода лечения. Адъювантное применение гипертермии в послеоперационном периоде позволяет значительно снизить частоту местных рецидивов опухоли и появление отдалённых метастазов. При первично нерезектабельных опухолях применение гипертермии способствует переводу опухоли резектабельное состояние. Гипертермия значительно повышает эффективность лучевой и химиотерапии. В поздних стадиях заболевания включение гипертермии в лечебные программы способствует стабилизировать течение заболевания, достигнуть клинической ремиссии.
Сеансы общей гипертемии проводят на уникальной установке «Птичь», разработанной в РНПЦ ОМР им. Н. Н. Александрова.
Используемая нами методика гипертермии с искусственной гипергликемией не имеет аналогов в странах СНГ и мире.
В нашем отделе была разработана уникальная методика органосохраняющего лечения больных цервикальной интраэпителиальной неоплазией II и III степени (или, как их еще нередко называют, с дисплазиями шейки матки) методом фотодинамической терапии.
Опасность цервикальной интраэпителиальной неоплазии заключается в том, что при отсутствии лечения высока вероятность ее трансформации в рак шейки матки. Общепринятое хирургическое лечение дисплазий нередко сопровождается осложнениями, одним из которых является развитие в последующем бесплодия.
Разработанный нами метод фотодинамической терапии дисплазий шейки матки обладает высокой эффективностью (до 96 % излеченных по результатам обследования через год после лечения), не нарушает анатомическую целостность шейки матки и позволяет сохранить детородную функцию.
Метод фотодинамической терапии основан на способности некоторых веществ, так называемых фотосенсибилизаторов, избирательно разрушать патологические ткани при облучении лазером с определенной длиной волны.
При проведении сеанса фотодинамической терапии пациентке вводят препарат (как правило, утром), затем через 2–3 часа проводят сеанс облучения шейки матки лазером. Сам сеанс длится 1–2 часа и не требует анестезии. В подавляющем большинстве случаев достаточно проведения одного сеанса фотодинамической терапии. В случае рецидива заболевания возможно проведение повторных сеансов, без каких либо побочных эффектов. Как правило, пациентки могут вести обычный образ жизни уже на следующий день после процедуры. Таким образом, сама процедура лечения дисплазии занимает всего один день.
В своей практике мы используем высокоэффективный фотосенсибилизатор «Фотолон» белорусского производства (российские аналоги — «Фотодитазин», «Радахлорин»).
Сегодня базальноклеточный рак кожи, как правило, успешно лечится хирургическим методом, либо методом близкофокусной лучевой терапии. Однако при некоторых локализациях опухолей, например, на крыле носа, ушной раковине, веке или в носогубной складке, применение перечисленных методов может привести к нежелательным косметическим дефектам. В таком случае показана фотодинамическая терапия, применение которой сводит риск такого рода нежелательных осложнений к минимуму.
Внутривенная фотодинамическая терапия воздействует на иммунную систему пациента, повышает противоопухолевый иммунитет и препятствует гематогенному метастазированию опухоли. Применение системной фотодинамической терапии позволит улучшить результаты лечения и качество жизни больных со злокачественными новообразованиями.
Вся медицинская помощь гражданам Республики Беларусь оказывается бесплатно. Жителям стран ближнего и дальнего зарубежья возможно проведение лечения на платной основе.
Дополнительную информацию, касающуюся медицинских аспектов лечения в нашем отделе, можно получить по телефону +375 (17) 287–95–36 (Истомин Юрий Петрович), а информацию о расценках можно получить в кабинете платных услуг.
На базе отделения гипертермии и фотодинамической терапии организована стажировка «на рабочем месте» использованию в онкологической практике лечебных методик гипертермии и фотодинамической терапии.
Средства массовой информации о нас:
«Фотадынамічная тэрапія дапамагае вылечыць рак скуры ў 85–90 % выпадкаў». Газета «Звязда» № 5 (241) ад 03 лютага 2011 года. (21.by). «Белорусские онкологи освоили новую технологию лечения патологии у женщин». Новости ОНТ 15.09.2010 года. (TUT. by). «Злокачественные образования: фотодинамическая терапия». Сообщение Интерфакс от 01.02.2011 года. «С широко открытыми зрачками». Газета «7 дней» № 26 от 30 июня 2011 года. Пресс–конференция: «Вопросы развития новых методов и перспективы использования современных лазерных технологий в практической медицине при лечении онкологических и других заболеваний». Белпрессцентр, 31 января 2011 года. Смотреть видео «Новый лазерный аппарат для лечения онкологических заболеваний разработали в Беларуси». БелТА, 16 июня 2009 года. «Лазер против опухолей». Газета «7 дней» № 25 от 18 июня 2009 года.
Задайте вопрос специалисту из личного кабинета и получите ответ в максимально короткие сроки.
источник
Поначалу фотосенсибилизирующие препараты не использовались в массах вследствие своей высокой токсичности и появлением целого ряда нежелательных последствий для организма, однако усилиями российских и западных ученых удалось вывести лекарство II поколения – фотодитазин на основе хлорофилла водоросли, которое стало отличаться низким уровнем токсичности и может применяться по несколько раз. Фактически эта методика лечения стала результатом скрещения фотобиологии, квантовой физики и фотохимии.
Итак, что это такое, фотодинамическая терапия? В основе этого метода лежит применение фотосенсибилизаторов (специальный ряд медикаментов) способных увеличивать восприимчивость тканей к излучению света под воздействием которого разрушаются именно опухолевые клетки. Данный вид терапии в онкологии осуществляется поэтапно:
- Препарат вводится внутривенно, либо наносится на поврежденный кожный покров или перорально;
- Аккумулирование лекарственного средства в месте поражения в период с 24 до 48 часов, а иногда и до нескольких дней.
- Получение лазерного луча. При более глубоком расположении опухоли используются трубки, заряженные светодиодом. Сочетание лазерного света и фотосенсибилизаторов порождает токсины убивающие раковые клетки. При этом чтобы «отключить» аномальное образование от питания, вынужденной мерой является удаление мелких кровеносных сосудов. В силу своего точечного воздействия на раковые клетки, позволяющего минимизировать пагубное влияние на здоровые ткани, вызываемое обычно лучевой и химиотерапией, такой способ лечения идеально подходит для людей с ослабленным иммунитетом и тяжелых больных.
- Гибель раковых элементов в течение многих месяцев, после чего место опухоли начинают заполнять здоровые клетки.
Фотодинамика наиболее широко применяется при лечении болезнях онкологии, позволяя устранять образования первичного, вторичного и метастатического характера. Особенно данный вид терапии применяется при таких разновидностях онкологических заболеваний как:
- Рак кожи (меланома), век, губ, ушных раковин, полости рта (лор органы);
- Опухоль легких, трахеи и бронхов;
- Рак шейки матки, молочной железы, желудка, пищевода и мочевого пузыря, а также эндометриоз;
При этом назначение такого лечения противопоказано людям, имеющим следующие проблемы:
- Болезнь сердца и нарушение работы сосудов;
- Почечная и печеночная недостаточность;
- Состояние беременности и период лактации;
- Непереносимость препаратов фотосенсибилизаторов.
Весьма распространенным данный метод стал в области стоматологии – при лечении зубных заболеваний и пародонтоза. В частности, фотодинамическая процедура помогает в санации:
- Кариеса;
- Воспаления десен (гингивит).
- Воспаления стрежневой конструкции зубов (пародонтит);
- Заражения лунки десны (альвеолит);
- Изменения окраса (потемнение, пожелтение) зубов (дисколорит).
С помощью использования лазерного луча осуществляется всесторонняя дезинфекция, которая успешно замещает антибиотикотерапию.
Использование этой процедуры знакомо также косметологам (сегодня, довольно широкое распространение находит фотодинамическое омоложение кожи как альтернатива безоперационного обновления тела и лица с использованием возможностей световых волн) и дерматологам, применяющим фотодинамическую терапию при лечении:
- Болезни сальных желез, при которой волосяные фолликулы забиваются и воспаляются, вызывая сильную угревую сыпь (акне);
- Хронического заболевания кожи неинфекционного генеза (чешуйчатый лишай или псориаз);
- Заболевания витилиго, при котором утрачивается пигментация естественного происхождения вследствие разрушения меланина в некоторых местах кожи;
- Купероза (расширение сосудов кожи);
- Хронического заболевания поверхности лица, проявляющемся в виде яркого покраснения и образования отеков (розацеа);
- Микоза (болезнь людей и животных, вызываемая грибками-паразитами и оказывающая крайне плохое воздействие на поверхность кожи и внутренние органы;
- Кератомы (возрастные изменения эпителия доброкачественного характера);
- Гиперпигментации;
Также фотодинамическую терапию можно с уверенностью назвать достойной и эффективной заменой лазерной хирургии в офтальмологии – благодаря этому способу значительно сужается возможность для роста аномальных кровеносных сосудов, что предупреждает развитие дегенерации сетчатки глаза.
Задаваясь вопросом, почему именно этот вид терапии является действенным и востребованным, необходимо обратится к его преимуществам, среди которых считаются:
- Целевое воздействие на проблемную зону;
- Хорошая переносимость данной процедуры любой возрастной категорией;
- Относительная безопасность для соседних с опухолью органов, а также для пораженных раковым образованием тканей;
- При диагнозе «рак кожи» рассматриваемый способ обеспечивает 100% положительный эффект;
- Воздействие в труднодоступных местах (поджелудочная и предстательная железа, язык, бронхи, желчный проток, ушная раковина);
- Высокая вероятность сохранения репродуктивных функций у женщин;
- Отсутствие следов лазерного облучения.
Фотодинамическая процедура может осуществляться в несколько этапов, но обычно достаточно одного сеанса для достижения желаемого результата. Время выведения препарата из организма составляет двое суток, он практически не вызывает аллергии. Применение такой терапии допускается на ранних стадиях рака как самостоятельный метод санации, особенно если радикальная операция становится невозможной в силу определённых факторов.
При этом кратно повышается эффективность при сочетании фотодинамической терапии с параллельными методами лечения рака, а лазерный луч в преддверие хирургического вмешательства существенно снижает частоту рецидивов образования аномальных клеток.
Несмотря на наличие множества плюсов, в подобном способе лечения есть и свои недостатки, такие как:
- Ограничение доступа света – лечение проводится только в той части, которая находится непосредственно под кожным покровом. По этой причине не допускается использовать метод для уничтожения раковых образований локализованных по разным тканям и органам.
- Как побочный эффект после приема терапии наблюдается временная чувствительность к свету;
- Отеки в месте терапии;
- Головная боль, икота, рвота, тошнота (при лечении в области пищевода);
- Одышка, воспаление бронхов и легких.
- Сенсибилизаторы I поколения;
- Фотосенсибилизаторы II поколения;
При этом в онкологии преимущественно применяется лекарство «Фотофрин», которое активируется путем красного цвета. Особенно он показан при:
- Осложнении гастроэзофагеальной рефлюксной болезни, характеризующейся забросом желчи в пищевод (пищевод Барретта); Препарат выступает в качестве профилактики предотвращения развития онкологического заболевания;
- Опухоли гортани. Проведение процедуры значительно облегчает состояние больного, особенно когда образование становится большого размера и перекрывает гортань, а терапия лазером оказывается бесполезной.
- Раке легких;
* Получив данные о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
Однако, важно помнить, что для терапии с введением «Фотофрина» существуют и противопоказания в случае:
- Наличия шунта между бронхами и пищеводом;
- Реакции на препарат;
- Язвы желудка или расширении вен;
- Раковых образований, распространяющихся по крупным сосудам.
В свою очередь при старческом кератозе часто используется аминоливулиновую кислоту, которая наносится наружно исключительно на кожу лица и головы.
Побочные эффекты от фотодинамического лечения можно минимизировать, если соблюдать необходимые меры, предшествующие ей и последующие после нее. К числу рекомендаций относятся следующие:
- Перед проведением терапии, нужно обеспечить недоступность солнечного света в комнаты дома;
- Приобрести солнцезащитные очки, взять с собой головной убор прикрывающий лицо, а также надеть одежду с длинными рукавами;
- В период до тридцати дней нежелательно находится на улице в дневное время суток, а в случае выхода пользоваться солнцезащитным кремом;
- В вечернее время обеспечить непопадание света от лампы на глазную часть;
- Не сушить волосы феном, так как нагретый воздух способен привести в действие сохранившийся в клетках препарат и стать причиной покраснения кожи.
Фотодинамический эффект весьма различен по своему характеру, так как все зависит от индивидуальных особенностей организма пациента и от природы заболевания с которым он столкнулся. Однако, в целом, оценивая его применение в онкологии, следует обозначить данный способ как наиболее безболезненный, безопасный и действенный. Отклики больных сводятся к тому, что после использования такой процедуры состояние становится значительно лучше, особенно если это рак кожи и другие болезни, связанные с кожными покровами.
В настоящее время, на постсоветском пространстве, лечение онкологии описанным способом успешно осуществляется в клиниках России (г.Москва, г.Самара, г.Новосибирск, г.Краснодар, г.Воронеж), Казахстана (г.Алматы), Украины и Беларуси (г.Минск) и, если выявить эту патологию на самых ранних стадиях, то при содействии фотодинамического лечения, есть все шансы на ее устранение. При этом диапазон цен за проведение такой терапии в России варьируется от 8000 рублей до 50 000 рублей за одну процедуру.
источник
Автореферат и диссертация по медицине (14.00.14) на тему: Методика интерстициальной фотодинамической терапии меланомы и рака молочной железы
Автореферат диссертации по медицине на тему Методика интерстициальной фотодинамической терапии меланомы и рака молочной железы
Филинов Владимир Леонидович
Методика интерстициальной фотодинамической терапии меланомы и рака молочной железы
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в Государственном учреждении Московском научно-исследовательском онкологическом институте им. П.А. Герцена МЗ РФ (директор -академик РАМН, профессор В.И. Чиссов) и Государственном учреждении здравоохранения онкологическом клиническом диспансере № 1 Департамента здравоохранения города Москвы (главный врач — профессор А.М. Сдвижков).
доктор медицинских наук, профессор Виктор Викторович Соколов. Научный консультант:
доктор медицинских наук, профессор Александр Михайлович Сдвижков. Официальные оппоненты:
доктор биологических наук, профессор Раиса Ивановна Якубовская, доктор медицинских наук, профессор Стаханов Михаил Леонидович.
Ведущее учреждение: Российский научный центр рентгенорадиологии МЗ РФ.
Защита диссертации состоится 21 декабря 2004г. в. часов на заседании
диссертационного совета Д 208.047.01 при Московском научно-исследовательском онкологическом институте им. П.А. Герцена МЗ РФ.
Адрес: 125284, Москва, 2-ой Боткинский проезд, д.З.
С диссертацией можно ознакомиться библиотеке ГУ МНИОИ им. П.А. Герцена.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор И.А. Максимов
В настоящее время как в России, так и во всем мире онкологическая патология приобретает все большее медико-социальное значение. Обеспокоенность ростом заболеваемости и смертности от злокачественных новообразований заставляет клиницистов большинства специальностей искать новые пути оптимизации лечебной тактики при опухолевых процессах с учетом возможных осложнений.
В структуре онкологической заболеваемости населения Российской Федерации особое место занимает рак молочной железы (РМЖ). В нашей стране РМЖ — самая распространенная злокачественная опухоль у женщин (18,42 % всей женской онкопатологии) [Чиссов В.И., Дарьялова С.Л. и соавт., 2000]. В половине случаев РМЖ выявляется в распространенной стадии процесса, на долю III и IV стадии при первичном обращении больных приходится до 40 % [Гарин А.М., 2001; Чиссов В.И., Дарьялова С.Л. и соавт., 2000]. Рецидивы заболевания в течение 5 лет после радикального лечения возникают в среднем в 28 % случаев [Freedman G.M., Fowble B.L. et all., 2000; Newman L.A., Hunt K.K. et all, 2000]. Вероятность рецидива РМЖ зависит от исходной стадии заболевания. При Т 1-2 рецидив заболевания выявляется в 6 — 10 %, при ТЗ-4- в25-50% случаев [Rivadeneira D.E., Simmons R.M., et all., 2000; Solin L.J., Fourquet A, et all., 2001]. Вероятность рецидива РМЖ возрастает при наличии до начала лечения метастазов в регионарных лимфоузлах.
Одной из актуальных проблем в лечении больных РМЖ являются послеоперационные внутрикожные и подкожные регионарные метастазы. Лечение больных с метастазами РМЖ требует значительно большего арсенала методов и средств, чем лечение больных первичным РМЖ. Поскольку метастатическая опухоль размером от 0,5 см и более уже является источником дальнейшего метастазирования. Эффективное лечение выявленных метастазов рака молочной железы имеет не менее важное прогностическое значение, чем лечение первичной опухоли. Хирургическое удаление метастазов рака молочной железы не всегда возможно в связи с множественным характером поражения или же большой распространенностью процесса. Кроме того, соматическое состояние больных, перенесших комбинированное лечение и полихимиотерапию (ПХТ), порой не позволяет осуществлять хирургическое вмешательство в оптимальном объеме. Результативность консервативной терапии метастазов рака молочной железы во многом зависит от чувствительности опухоли к лучевому, лекарственному и гормональному лечению. Множественный характер внутрикожного метастазирования в ряде случаев ограничивает возможности лучевого лечения. Основным традиционным методом лечения больных с метастазами рака молочной железы остается химиогормонотерапия с многократным повторением курсов лечения [Моисеенко В.М., Семиглазов В.Ф. и соавт | .1007; Unrm-n R Д^рьячпия С.Л. и соавт.,
2000]. Положительный эффект ПХТ с применением стандартных схем лечения (полная или частичная регрессия) при метастазах рака молочной железы в кожу и мягкие ткани достигается в 22 — 27 % случаев со сроком ремиссии 2-3 месяца [Моисеенко В.М., Орлова Р.В. и соавт., 2000]. Продление сроков ремиссии требует многокурсовой ПХТ. Неудовлетворенность результатами терапии больных РМЖ заставляет клиницистов искать новые методы и совершенствовать схемы комплексного и комбинированного лечения.
На долю меланомы приходится 10 % всех злокачественных опухолей кожи. Заболеваемость меланомой кожи в России неуклонно растет, ежегодный прирост заболеваемости составляет 5 % [Чиссов В.И., Дарьялова С.Л. и соавт., 2000]. Клинические данные указывают на прямую зависимость выживаемости больных от уровня инвазии меланомы кожи. Медиана выживаемости пациентов с 4 стадией заболевания составляет около 6 — 7,5 мес, 5-летняя выживаемость — приблизительно 6 % [Bajetta E., Del Vecchio M., et all., 2002]
Основной метод лечения первичной меланомы — хирургический. Удаление первичной меланомы кожи не исключает развитие местных рецидивов и транзиторных метастазов, которые обычно выявляются в период от 6 до 20 месяцев после операции и составляют 7 — 11 %. Удаление солитарных метастазов в ряде случаев способно улучшить прогноз, однако при наличии множественных метастазов в кожу и мягкие ткани хирургическое лечение не всегда выполнимо. Применение послеоперационного облучения направлено на уменьшение риска рецидива заболевания, однако адьювантная лучевая терапия далеко не всегда оказывается эффективной из-за низкой чувствительности меланомы к ионизирующему излучению [Барчук А.С., 2001]. У 8-20 % больных с метастазами меланомы монохимиотерапия позволяет добиться объективного эффекта со сроком ремиссии 4-6 месяцев. Менее 2 % больных переживают 5-летний рубеж. ПХТ стандартными схемами с применением DTIC и CCNU при метастазах меланомы приводит к полной или частичной регрессии в 22-50 % случаев [Bajetta E., Del Vecchio M., et all., 2002]. Многократные курсы ПХТ существенно не изменяют результатов лечения, не улучшают безрецидивный период и общую выживаемость больных [Барчук А.С., 2001]. Иммунотерапия эффективна у 1517% больных с метастазами меланомы. При сочетании ПХТ и иммунотерапии объективный эффект при внутрикожных метастазах меланомы достигает 25 -50 % [Coates A.S., 1992; Bajetta E., Del Vecchio M., et all, 2002]. Таким образом лечение метастазов мелано-мы в кожу и мягкие ткани представляет не менее трудную проблему, чем лечение первичной опухоли.
Фотодинамическая терапия (ФДТ) является принципиально новым методом в лечении больных, основанном на способности фотосенсибилизаторов (ФС) накапливаться в
клетках злокачественных опухолей и при избирательном воздействии лазерного излучения определенной длины волны вызывать повреждение опухоли. Клинические испытания метода ФДТ с препаратами фотогем и фотосенс проводимые в России с 1992 года (МНОЙ им. П.А. Герцена, ГНЦ Лазерной Медицины, ОНЦ РАМН им. Блохина, ММА им. ИМ. Сеченова и др.) показали высокую эффективность данного метода в лечении больных злокачественными опухолями различной локализации и морфологической структуры. В настоящее время наиболее изучена и широко применяется методика дистанционной ФДТ. Возможности дистанционной ФДТ значительно ограничены в случае узловых опухолей и опухолей расположенных подкожно и в мягких тканях [Karrer S., Szeimies R.M., 2002]. Для реализации фотодинамического эффекта в данном случае необходимо интерстици-альное лазерное облучения опухоли. Основной потенциальной группой пациентов для применения методики ИФДТ являются больные с множественными узловыми формами внутрикожных и подкожных метастазов РМЖ и меланомы.
Основной целью данной работы явилась разработка методики интерстициальной фотодинамической терапии с препаратом фотосенс у больных меланомой кожи и раком молочной железы.
1. Разработка методов расчета световой дозы при узловых формах злокачественных опухолей кожи и мягких тканей при контактном неинвазивном интерстициальном способе облучения (670 нм).
2. Разработка схемы распределения источников лазерного излучения при инвазивной интерстициальной фотодинамической терапии (ИФДТ) в узловой опухоли, при первичном и метастатическом РМЖ, в зависимости от ее размеров.
3. Разработка схем сочетанного контактного и интерстициального лазерного облучения внутрикожных и подкожных метастазов РМЖ и меланомы.
4. Определение сроков реализации и критериев оценки противоопухолевого эффекта ИФДТ узловых метастазов РМЖ и меланомы.
5. Разработка показаний и противопоказаний для ИФДТ узловых метастазов РМЖ и меланомы с препаратом фотосенс.
В данной работе впервые на клиническом материале представлены показания к проведению ИФДТ РМЖ и меланомы с отечественным фотосенсибилизатором фотосенс,
изучена терапевтическая ценность фотосенса при проведении ИФДТ подкожных и внут-рикожных узловых опухолей данных нозологических форм; даны рекомендации по методике доставки лазерного излучения к опухоли в зависимости от ее объема, локализации, с использованием отечественной медицинской лазерной аппаратуры; разработаны схемы установки лазерных излучателей, разработана методика расчета световой дозы при контактных и инвазивных интерстициальных способах лазерного облучения опухоли; определены оптимальные световые дозы, разработана эффективная методика лечения больных с метастазами РМЖ и меланомы; определены критерии и сроки реализации противоопухолевой эффективности ИФДТ с препаратом фотосенс в данной группе больных; представлены наиболее характерные осложнения ИФДГ при использовании фотосенса у больных РМЖ и меланомы, определены меры профилактики и лечения осложнений.
Разработанная методика ИФДТ с препаратом фотосенс позволяют расширить диапазон применения ФДТ у больным РМЖ и меланомы, в первую очередь при узловых формах внутрикожных и подкожных метастазов, у лиц с отягощенным соматическим статусом и резистентностью к химио-лучевому лечению. Методика ИФДТ рекомендована для внедрения в практику онкологических институтов, онкологических центров, краевых и областных и городских онкологических диспансеров России.
Результаты работы — методика ИФДГ рака молочной железы и меланомы с использованием препарата фотосенс и лазерной установки отечественного производства «ЛД-2000» внедрены в клиническую практику кабинета ФДТ Онкологического клинического диспансера №1 Департамента здравоохранения города Москвы.
По материалам диссертации опубликовано 5 печатных работ. Оформлена заявка на изобретение №. от. //. 2004 г. «Способ проведения фотодинамической терапии злокачественных опухолей»
Диссертация изложена на 112 страницах печатного текста, состоит из введения, 4 глав, заключения, вывода и списка литературы. В работе содержится 26 таблиц, 9 рисунков и 24 фотографии. Список литературы включает работы 63-х отечественных и 200 зарубежных авторов.
Работа апробирована на межотделенческой научной конференции ГУ МНИОИ им. ПА Герцена 26.06.2004 г.
Материалы и методы исследования.
Работа основана на анализе непосредственных результатов проведения ФДГ 69 больным за период с 1999 по 2003 гг. Методика интерстициальной фотодинамической терапии (ИФДТ) применена 45 больным РМЖ и 24 больным меланомой кожи. Исследование проведено на базе Онкологического клинического диспансера №1 Департамента здравоохранения города Москвы.
В зависимости от цели и задач исследования все больные были разделены на три группы. В первую группу вошло 13 больных (все женского пола) в возрасте от 43 до 76 лет с диагнозом первичного рака молочной железы. ИФДТ в данной группе проводилась как компонент сочетанного лечения на предоперационном этапе. Во вторую группу вошло 32 больных (все женского пола) в возрасте от 46 до 79 лет с диагнозом РМЖ после комплексного или комбинированного лечения. ИФДТ в данной группе проводилась по поводу внутрикожных и подкожных узловых метастазов РМЖ. Третью группу составили 24 пациента (9 мужчин и 15 женщин) в возрасте от 44 до 78 лет с диагнозом меланомы кожи после радикального хирургического лечения. ИФДТ в данной группе проводилась по поводу внутрикожных и подкожных узловых метастазов меланомы.
По данным УЗИ и рентгенологического исследования до начала проведения ИФДТ у всех больных I клинической группы имелись одиночные узловые опухоли размером от 0,7 до 3 см в диаметре, без прорастания кожи и поражения регионарных лимфоузлов (Т1-2А,М),М0) (Таблица 1).
Таб. № 1. Распределение больныхРМЖпо размеру первичной опухоли.
Размер опухоли Абсолютное количество больных %
От 2 до 3 см (Т2. А.МШ0) 5 38,5
Опухоли в молочной железе были расположены: в верхне — наружном квадранте у 9 больных (69,2 %), верхне — внутреннем — у 3 больных (23,1 %) и в нижне — внутреннем -у 1 больной (7,7 %). Цитологическое исследование пунктата опухоли с целью верификации процесса до начала ИФДТ во всех 13 случаях показало наличие железистого рака. По
данным послеоперационного исследования удаленные опухоли имели морфологическую структуру, представленную в таблице № 2
Таб. № 2. Морфологическая структура первичного РМЖ.
Морфологическая структура Абсолютное количество больных %
Инфильтративно — протоковый рак 4 30,8
Инфильтративно — дольковый рак 6 46,1
Внутрипротоковый рак 2 15,4
Рак молочной железы без уточнения 1 7,7
Сопутствующая патология в данной группе больных хроническая ИБС — у 10 пациенток (76,9 %), гипертоническая болезнь — у 9 (69,2 %), пневмосклероз — у 8 (61,5 %), не являлась противопоказанием к проведению ИФДТ и последующему радикальному хирургическому лечению ИФДТ как предоперационный этап проводилась с целью деструкции опухоли, повышения абластики, снижения вероятности местного рецидивирования и им-плантационного метастазирования, в первую очередь при выполнении органосохраняю-щих операций
В группе больных (II группа) после комплексного или комбинированного лечения по поводу первичного рака молочной железы (Т1-4М0-2М0) были выявлены множественные метастатические узловые опухоли общим числом 121 (от 2 до 12 у каждой пациентки), размером от 0,5 до 5 см, в т ч 16 метастазов в лимфатические узлы размером от 1 до 3 см (Таблица 3)
Таб. № 3. Размеры метастатических опухолей РМЖ.
Размер опухоли Абсолютное количество опухолей %
У 25 больных (78,1 %) имелись узловые метастатические опухоли в кожу и мягкие ткани грудной стенки в области послеоперационного рубца, у 7 (21,9 %) имелись отдаленные метастазы в кожу и мягкие ткани головы и шеи, грудной и брюшной стенки, у 5
больных (16,1 %) имелись метастазы в лимфатические узлы. Опухоли имели различную локализацию по отношению к кожным покровам: интрадермальные, субдермальные, расположенные в мягких тканях и не связанные с кожей (Таблица 4).
Таб. № 4. ЛокализацияметастазовРМЖпо отношению к коже.
Расположение опухоли Абсолютное количество опухолей %
В связи с выявленными метастазами в кожу и мягкие ткани всем больным проводилась многокурсовая ПХТ и гормональное лечение. В большинстве случаев применялись стандартные схемы лечения: CAF и CMF. ИФДТ проводилась в связи с недостаточной эффективностью химиогормонотерапии метастазов РМЖ (остаточные опухоли, прогрес-сирование).
С целью верификации метастатического процесса перед проведением ИФДТ проводился забор материала с последующим цитологическим исследованием.
Сопутствующая патология в данной группе больных: хроническая ИБС — у 25 пациенток (80,1 %), постинфарктный кардиосклероз — у 6 (19,4 %), гипертоническая болезнь — у 24 (77,4 %), пневмосклероз — у 20 (64,5 %), сахарный диабет — у 3 (9,7 %), остаточные явления ОНМК — у 2 (6,5 %), не явилась противопоказанием к проведению ИФДТ. На момент начала проведения лечения состояние больных расценивалось как удовлетворительное.
Все 24 пациента с метастазами меланомы (III группа) ранее получили радикальное хирургическое лечение с удалением первичной опухоли, в 15 случаях (62,5 %), по показаниям, дополнительно производилась регионарная лимфаденэктомия. По данным морфологического исследования удаленной первичной опухоли во всех случаях имела место пигментная меланома.
У 24 больных меланомой кожи имелись множественные узловые метастатические опухоли в коже и мягких тканях общим числом 297. Опухоли располагались в следующих регионарных зонах по отношению к первичному очагу: в области верхних и нижних конечностей — 16 больных (66,7 %), грудной и брюшной стенки — 5 (20,8 %), головы и шеи -3 (12,5 %). У 4 больных (16,7 %) имелись метастазы в регионарные лимфатические узлы -общим числом 15. Размеры метастатических опухолей были от 0,8 до 3 см (Таблица 5).
Таб. № S. Размеры метастатических опухолей меланомы.
Размер опухоли Абсолютное количество опухолей %
Опухоли имели различную локализацию по отношению к кожным покровам: ин-традермальные, субдермальные, расположенные в мягких тканях и в лимфатических узлах
Таб. № 6. Локализация метастазов меланомы по отношению к коже.
Расположение опухоли Абсолютное количество опухолей %
В связи с выявленными метастазами меланомы в кожу и мягкие ткани 16 больных (66,7 %) получали иммунохимиотерапию, 8 больных (33,3 %) получали только иммунотерапию в связи с противопоказаниями к ПХТ по соматическому статусу. Иммунотерапия проводилась с использованием иммуномодуляторов: интерлейкин, интерферон. Химиотерапия проводилась, в основном, стандартными схемами с использованием БТ1С и ССМИ. ИФДТ применена в связи с недостаточной эффективностью иммунохимиотерапии (остаточные опухоли, продолженный рост).
Цитологическое исследование, предшествовавшее проведению ИФДТ, во всех случаях показало наличие метастазов меланомы.
Сопутствующая патология в данной группе больных: хроническая ИБС — у 19 пациентов (79,2 %), постинфарктный кардиосклероз — у 5 (20,8 %), гипертоническая болезнь — у 23 (95,8 %), пневмосклероз — у 19 (79,2 %), сахарный диабет — у 4 (16,7 %), ХПН — у 3 (12,5 %), остаточные явления ОНМК — у 2 (8,3 %), не явилась противопоказанием к проведению ИФДТ. На момент начала проведения лечения состояние больных расценивалось как удовлетворительное.
Обследование больных перед проведением ИФДТ разделялось на четыре основные этапа:
• общеклиническое обследование до начала ИФДТ,
• общеклиническое обследование по окончании ИФДТ,
• обследование с целью оценки эффективности ИФДТ.
Уточняющая диагностика включала следующие методики: маммографию; УЗИ молочных желез и зон возможного метастатического поражения, в т.ч. регионарных лимфатических узлов (при РМЖ и меланоме); цитологическое исследование пунктата опухоли. По данным уточняющего обследования определялась стадия процесса, морфология опухоли (в I клинической группе), морфология метастатических опухолей, размер опухолевых узлов, локализация в коже и мягких тканях (во II и Ш группах).
Обследование после окончания ИФДГ у больных I клинической группы проводилось перед радикальным хирургическим лечением для оценки эффективности предоперационной терапии (контроль динамических изменений опухоли). Сразу после радикального хирургического вмешательства производилась флуоресцентная диагностика (ФД) удаленных тканей (опухоль, молочная железа, регионарные лимфатические узлы) для определения уровня накопления препарата Фотосенс в тканях. Морфологическое исследование удаленной опухоли проводилось для определения степени лечебного патоморфоза, объема некротических изменений в опухоли и реакции окружающих тканей на фотодинамическое воздействие.
Оценка эффективности проведенной терапии у пациенток П и III клинических групп проводилась через 1 и 2 месяца после окончания ИФДТ (цель — контроль динамических изменений метастатических очагов и регионарных лимфатических узлов). В процессе наблюдения проводилось цитологическое исследование пунктатов и морфологическое исследование препаратов отдельных опухолей с целью определения степени лечебного патоморфоза и ответа окружающих тканей на фотодинамическое воздействие.
Фотосенс — синтетический ФС второго поколения. После внутривенного введения в дозе 0,5 мг/кг препарат достаточно быстро распределяется в крови и тканях. Концентрация препарата в опухолевой ткани выше, чем в окружающих здоровых тканях в среднем в 1,5-2 раза. При введении в дозе 0,5 мг\кг уровень фотосенса в опухоли и коже достигает максимальных значений в течение первых 1 — 2 суток, а затем медленно уменьшается, продолжая определяться вплоть до 3 — 4 месяцев после лечения. Проведение дистанционной ФДГ с фотосенсом вызывает болевые ощущения различной степени выраженности в зоне облучения, что требует применения анальгетиков. Болевой синдром
в зоне лазерного воздействия может сохраняться от нескольких часов до 1 суток после проведения ФДТ. Основным побочным эффектом ФДТ является повышенная кожная фоточувствительность, обусловленная длительным удерживанием фотосенса в коже и требующая соблюдения светового режима
Различие уровня накопления ФС в опухоли и здоровой ткани (селективность) может являться признаком наличия злокачественного процесса. Спектральный анализ тканей in vivo является неинвазивным и позволяет получать информацию о состоянии тканей не влияя на динамику различных биологических процессов. Флуоресцентная диагностика (ФД) тканей дает возможность обработки данных в реальном масштабе времени и позволяет корректировать параметры светового воздействия при проведении ФДТ в соответствии с полученной информацией. В представленной работе ФД проводилась с использованием лазерного спектрального анализатора LESA-7. В качестве источника излучения, возбуждающего флуоресценцию фотосенсибилизатора в биологических тканях, использовался He-Ne лазер с длиной волны 633 нм и средней мощностью излучения 2 мВт.
ИФДТ проводилась с использованием лазерной диодной установки ЛД-2000 фирмы «БИОСПЕК». Длина волны излучения 670 нм оптимальна при проведении ФДТ с использованием препарата фотосенс. Максимальная мощность излучения лазерной установки составляет 2 Вт на выходе оптического разъема. Установка позволяет контролировать мощность излучения, задавать требуемое время облучения Для доставки лазерного излучения к опухоли использовались кварцевые световоды диаметром 600 мкм с цилиндрическим диффузором, а также торцевой световод с микролинзой Для измерения мощности излучения на дистальном конце световода использовался интегральный измеритель мощности и энергии лазерного излучения ИИМ-Ш отечественного производства.
Для реализации повреждающего эффекта ФДТ в опухоли необходимы условия для проникновения света во все ее участки и определенную перитуморальную область. Для этого требуется подведение света ко всей массе опухоли в той световой дозе, которая реализует реакцию ФДТ с повреждением опухоли в необходимом объеме, с сохранением окружающей здоровой ткани Данная проблема решается методом ИФДТ.
При проведении предоперационной ИФДТ у больных с первичным РМЖ препарат фотосенс в дозе 0,5 мг/кг вводился однократно внутривенно на физиологическом растворе в разведении 1/4 в течение 30 минут. Облучение начиналось через 2 часа после введения фотосенсибилизатора. При размерах опухоли до 1,5 см в паренхиму опухоли посредством пункции иглой устанавливался один диффузор, при размерах 1,5 — 2 см — устанавливались два диффузора параллельно, при размерах 2 — 3 см — три диффузора.
Интратуморальное облучение: А. Установлен один диффузор. Б. Установлены два диффузора. В. Установлены три диффузора. 1) кожа; 2) опухоль; 3) зона воздействия; 4) световод с диффузором на рабочей части.
Облучение проводилось однократно, последовательно с каждого диффузора. Световая доза с каждого сантиметра длины диффузора достигала 500 Дж. (Таблица 7).
Таб. № 7. Основные параметры интратуморальной ИФДТпервичногоРМЖ.
Диаметр опухоли Длина дифф-ра Суммарная световая энергия 1 позиции облучения (Дж) Суммарная световая энергия на курс лечения (Дж) Мощность излучения (мВт)
Перитуморальная ИФДТ проводилась через сутки после интратуморального облучения Одноразовые кварцевые световоды с диффузором той же длины вводились пери-туморально посредством пункции иглой в трех точках. Облучение проводилось последовательно с каждого диффузора Световая доза с каждого сантиметра длины диффузора достигала 200 Дж (Таблица 8).
Перитуморальное облучение: 1) кожа; 2) опухоль; 3) зона воздействия, 4) световод с диффузором на рабочей части.
В случае проведения ИФДТ метастатических опухолей кожи и мягких тканей (РМЖ, меланома) препарат фотосенс вводился в дозе 0,5 мг/кг внутривенно однократно
на физиологическом растворе в разведении 1/4 в течение 30 минут. Первый сеанс ИФДТ проводился через 24 часа после введения ФС. Последующие сеансы проводились с интервалом в 24 часа. Лазерное облучение узловых внутрикожных и подкожных опухолей, размером до 2 см проводилось неинвазивно, посредством микролинзы в контакте с опухолью и давлением излучателя света на зону воздействия. Световая энергия одной позиции лазерного облучения — 200 Дж. Опухоли, размером от 0,5 до 1 см облучались с одной — двух точек. Опухоли размером от 1,5 до 2 см облучались с 2-х точек (Таблица 9).
Таблицам 8. Основные параметры перитуморальной ИФДТпервичного РМЖ.
Диаметр Длина Суммарная све- Количество Суммарная све- Мощность
опухоли Диффу- товая энергия позиций диф- товая энергия излучения
зора 1 позиции (Дж) фузора на курс лечения (мВт)
2 см 2,5 см 500 3 1500 200
3 см 3,5 см 700 3 2100 200
Таб.Ле 9. Основные параметры ИФДТ внутрикожных и подкожных метастазов
РМЖ(меланомы) с микролинзой.
Размер опухоли Мощность лазерного излучения (мВт) Суммарная энергия одного сеанса облучения (Дж) Количество сеансов на курс лечения Суммарная световая доза на курс лечения (Дж)
0,8 см 300 200 (РМЖ) 400 (меланома) 3-4 600 — 800 (РМЖ) 1200 (меланома)
1,5 см 300 400 3-4 1200-1600
Лазерное облучение метастазов в лимфатические узлы проводилось посредством микролинзы в контакте с опухолью с давлением излучателя света на зону воздействия. Световая энергия одной позиции лазерного облучения — 200 Дж. Опухоли, размером до 1см облучались с одной точки. Опухоли размером от 1 до 2см облучались с 2-х точек. При ИФДТ метастатически пораженных лимфатических узлов инвазивный метод не использовался.
Лазерное облучение узловых метастатических опухолей РМЖ размером более 2 см проводилось с использованием световода диаметром 600 мкм с пластиковым диффузором на рабочей части. При воздействии на опухоли размером 1,5 до 2 см устанавли-
вался один диффузор, посредством пункции иглой, в центр опухоли. При размерах опухоли от 2 до 5 см в паренхиму опухоли параллельно устанавливались два диффузора. Облучение проводилось последовательно с каждого диффузора. Световая доза с 1 сантиметра длины диффузора — 200 Дж. (Таблица 10).
Таб. М10. Основные параметры интратуморалъной ИФДТметастазов РМЖ.
Размер опухоли • Длина диффузора Средняя мощность облучения (мВт) Световая энергия 1се-анса (Дж) Количество сеансов облучения Суммарная доза световой энергии на курс (Дж)
1,5 см 2 см 200 400 3 1200
3 см 3,5 см 200 1400 3 4200
4 см 4,5 см 200 1800 3 5400
При наличии узловых метастазов меланомы в кожу и мягкие ткани дополнительно к неинвазивному проводилось перитуморальное облучение с использованием световода диаметром 600 мкм с диффузором на рабочей части. Через пункционную иглу перитумо-рально под метастатическую опухоль устанавливался диффузор, соответствующий размерам опухоли (на 0,5 см более ее диаметра). Облучение через диффузор проводилось последовательно после облучения опухоли микролинзой. Световая доза с 1 сантиметра длины диффузора — 200 Дж (Таблица 11).
Таб. № 11. Основные параметры перитуморального облучения метастатической
Размер опухоли Длина диффузора Мощность облучения (мВт) Световая энергия одного сеанса (Дж) Количество сеансов на курс лечения Суммарная световая доза на курс лечения (Дж)
2 см 2,5 см 200 500 3 1500
Схема проведения ИФДТ на метастаз меланомы в мягкие ткани: 1) микролинза; 2) опухоль; 3) зона воздействия; 4) световод с диффузором на рабочей части.
Предоперационная ИФДТ проведена у 13 больных первичным РМЖ. Все больные -женщины. ИФДГ, как предоперационный этап, проводилась с целью: деструкции опухоли, повышения абластики, снижения вероятности местного рецидивирования и импланта-ционного метастазирования, в первую очередь при выполнении органосохраняющих операций
Предоперационная ИФДТ первичного РМЖ оценивалась по данным УЗИ рентгенологического обследования и по результатам морфологического исследования операционных препаратов.
Эффективность лечения оценивалась по принятой классификации: ПР — полная регрессия опухоли, подтвержденная морфологическим исследованием; ЧР — частичная регрессия — уменьшение размеров опухолей на 50 % и более; ОР — ограниченная регрессия — уменьшение размеров опухолей менее, чем на 50 %.
Больные получили от 1 до 3 сеансов предоперационной ИФДТ (Таблица 12) Облучение сопровождалось умеренным болевым синдромом, который купировался применением ненаркотических анальгетиков. По окончании ИФДТ наблюдался локальный отек ткани молочной железы в зоне лазерного воздействия и легкая болезненность при пальпации
Таб. Ms 12. Количество сеансов ИФДТ, полученных больными.
Количество сеансов Количество больных Процентное соотношение
Контрольное УЗИ и маммографическое исследование через 10 дней после окончания предоперационной ИФДТ выявило у больных размытость контуров и уменьшение интенсивности тени опухоли.
Через 10 дней после окончания ИФДТ больным проведено радикальное хирургическое лечение. Радикальная мастэктомия произведена 10 больным, радикальная резекция молочной железы — 3 пациенткам.
Операционные препараты гистологически исследованы на степень лечебного пато-морфоза (Таблица 13).
Таб. № 13. Степени лечебного патоморфоза удаленных опухолей.
Степень лечебного патомор- Количество больных Процентное соотноше-
Таким образом в большинстве случаев через 10 дней после ИФДТ в имелась 2-4 степень лечебного патоморфоза опухоли.
Морфологическое исследование удаленных опухолей показало ряд характерных особенностей повреждения тканей после проведенной ИФДТ. В 79,92 % исследованных опухолей (10 больных) имели место очаги некроза, занимающие более 50% центральной части стромы (ЧР) Во всех исследуемых случаях имел место тромбоз мелких и средних сосудов, некроз их стенки как в опухоли, так и по периферии ее, стаз эритроцитов, мелкие кровоизлияния и разной степени выраженности лимфоидная инфильтрация. В ткани молочной железы вокруг опухоли — фибринозное набухание. Морфологическое исследование регионарных лимфоузлов выявило гистиоцитоз синусов, лимфостаз центральных отделов, полнокровие мелких сосудов.
В двух случаях (15,38 %) имелась ОР опухолей с наличием патоморфоза 1 степени В одном случае (7,70 %) предоперационная ИФДТ привела к ПР опухоли.
Таким образом по данным морфологического исследования в сопоставлением данных УЗИ и маммографии непосредственный терапевтический эффект в результате предоперационной ИФДТ первичного РМЖ получен во всех случаях, из них: ПР — 7,70 %, ЧР -76,92%, ОР-15,38%.
Флуоресцентное исследование (ex vivo) Непосредственно после радикального хирургического лечения удаленные препараты исследовались спектроскопически Проводилось флуоресцентное исследование опухоли, окружающих тканей и регионарных лимфатических узлов для определения селективности накопления препарата фотосенс «нормальная ткань /опухоль». В лимфатических узлах наблюдалось достаточно высокое накопление препарата, по сравнению с опухолью молочной железы, предварительно подвергнутой ИФДТ (Таблица 14).
Таб. Лв 14. Селективность накопления Фотосенса в опухоли и лимфоузлах.
Зона исследования Средние показатели селективности норма/опухоль
Здоровая ткань / опухоль 1/1,15
Окружающая ткань / лимфоузлы 1 / 2,27
ИФДТ проведена 32 больным с узловыми метастатическими опухолями РМЖ в коже и мягких тканях, ранее получавшим комплексное или комбинированное лечение по поводу первичного РМЖ. ИФДТ проведена в связи с недостаточной эффективностью хи-миогормонотерагош метастазов в кожу и мягкие ткани.
Флуоресцентное исследование. Через 24 часа после введения фотосенсибилизатора, перед началом ИФДТ проводилось флуоресцентное исследование внутрикожных метастатических опухолей. По данным ФД определяется уровень накопления препарата в опухоли, селективность накопления
В большинстве случаев селективность накопления препарата «здоровая ткань/опухоль» имела значения 1/2 — 1/3, что предполагало селективность ИФДТ при воздействии на метастатические очаги РМЖ (Таблица 15).
Таб. № 15. Результаты ФД внутрикожных метастазов РМЖ.
Зона диагностики Средний уровень накопления препарата Селективность
Метастатическая опухоль 130,2 1/2,6
ИФДТ проведена на 121 метастатическую узловую опухоль РМЖ размером от 0,5 до 5 см, расположенную интрадермально, субдермально, в мягких тканях и лимфатических узлах. Лазерное облучение узловых метастатических опухолей проводилось неинва-зивно и инвазивно.
Результаты ИФДТ метастазов РМЖ оценивались по данным УЗИ, рентгенологического обследования. Проводилось цитологическое исследование зон расположения опухолей (скарификат, пунктат). Через 2-3 месяца после ИФДТ в 43,75 % случаев произведена операция — иссечение тканей в зонах расположения опухолей с последующим морфологическим исследованием операционных препаратов. Эффективность проведения ИФДТ оценивалась по принятой классификации: ПР — полная регрессия опухоли, ЧР — частичная регрессия ОР — ограниченная регрессия.
Таб. № 16. Эффективность ИФДТ в зависимости от размера метастазов РМЖ.
Размер Полная резорбция Частичная резорбция Всего
опухоли Количество опухолей % Количество опухолей % опух.
От 0,5 до 1 см 40 83,33 7 16,67 48
От 1 до 2 см 29 63,04 18 36,96 46
От 2 до 3 см 8 50,00 8 50,00 16
От 3 до 5 см 2 18,18 9 81,82 11
Наибольший эффект ИФДТ метастазов РМЖ был достигнут при размерах опухолей от 0,5 до 2 см. Эффективность воздействия снижалась с увеличением размеров метастатических опухолей (Таблица 16).
Имелось различие в эффективности ИФДТ в зависимости от локализации метастатических опухолей (Таблица 17).
Таб. № 17. Эффективность ИФДТ в зависимости от локализации метастазов РМЖ.
Расположение опухолей ПР ЧР Всего опухолей
Интрадермальное 34 (80,95 %) 8(19,05%) 42
Субдермальное 24 (64,86 %) 13(35,14%) 37
В мягких тканях 11(42,31%) 15(57,69%) 26
В лимфатических узлах 10(62,50%) 6 (37,50 %) 16
Таким образом, наибольший терапевтический эффект при проведении ИФДТ получен при интрадермальном и субдермальном расположении метастазов РМЖ. Высока эффективность ИФДГ метастазов РМЖ в лимфатические узлы.
ИФДТ проведена 24 больным с метастазами меланомы в кожу и мягкие ткани после радикального хирургического лечения по поводу первичной пигментной меланомы кожи. ИФДТ проведена в связи с недостаточной эффективностью иммунохимиотерапии метастазов в кожу и мягкие ткани
Флуоресцентное исследование. Через 24 часа после введения фотосенсибилизатора, перед началом ИФДТ проводилось флуоресцентное исследование внутрикожных метастатических опухолей. По данным ФД определяется уровень накопления препарата в опухоли, селективность (Таблица 18)
Таб. №18. Результаты флуоресцентной диагностики внутрикожных
Зона диагностики Средний уровень накопления препарата Селективность
Метастатическая опухоль 66,3 1/1,49
В основном селективность накопления фотосенса не превышала соотношения здоровая ткань/опухоль — 1/1,49.
Лазерное облучение узловых метастатических опухолей проводилось неинвазивно с использованием микролинзы и инвазивно с использованием стерильных диффузоров, расположенных в мягких тканях, перитуморально.
ИФДТ проведена на 297 узловых метастатических опухолей.
Непосредственные результаты оценивалась по данным рентгенорафии, УЗИ, гистологического и цитологического исследования Через 2-3 месяца после ИФДГ в 12,79 % случаев произведена операция — иссечение тканей в зонах расположения опухолей с последующим морфологическим исследованием операционных препаратов.
Эффективность проведения ИФДТ оценивалась по принятой классификации: ПР -полная регрессия опухоли, ЧР — частичная регрессия, ОР — ограниченная регрессия.
Таб. № 29. Эффективность ИФДТв зависимости от размера метастазов меланомы.
Размер опухоли Полная регрессия Частичная регрессия Всего опух.
Количество опухолей % Количество опухолей %
От 0,8 до 1 см 178 83,96 34 16,04 212
От 1 до 2 см 19 26,03 54 73,96 73
От 2 до 3 см 0 0,00 12 100,00 12
При проведении ИФДТ на метастазы меланомы непосредственный эффект получен в 100 % случаев. Эффективность лечения зависит от размеров опухоли (Таблица 19). Наибольший эффект ИФДТ метастазов меланомы достигнут при размерах опухолей от 0,8 до 2 см. При размерах опухолей от 2 до 3 см получена только ЧР. Имелось различие в эффективности ИФДТ в связи с локализацией метастатических опухолей (Таблица 20).
Таб. № 20. Эффективность ИФДТ в зависимости от локализации метастазов
Расположение опухолей ПР ЧР Всего опухолей
Интрадермальное 160(82,90%) 33 (17,10 %) 193
Субдермальное 35 (49,30 %) 36 (50,70 %) 71
В мягких тканях 0 (0 %) 18(100%) 18
В лимфоузлах 2(13,33%) 13 (86,67 %) 15
Таким образом, наибольший терапевтический эффект при проведении ИФДТ получен при интрадермальном и субдермальном расположении метастазов РМЖ. Эффективность ИФДТ метастазов меланомы в лимфатические узлы недостаточно высока.
Клинически, в процессе проведения ИФДТ, на 2 — 4 сутки отмечалось размягчение опухолевых узлов. В зоне лазерного воздействия в процессе проведения ИФДТ и в последующие 3—4 суток наблюдался незначительный отек тканей. При внутрикожных метастатических опухолях под воздействием ИФДТ имел место поверхностный некроз с последующим рубцеванием. Болевой синдром в процессе лечения был незначительный.
Возможные осложнения и мепы та профилактики.
В процессе проведения ИФДТ у больных не наблюдалось обострения сопутствующей патологии Не отмечалось ухудшение состояния больных как в процессе лечения, так и при последующем наблюдении В большинстве случаев больные отмечали улучшение общего состояния в процессе ИФДТ и по окончании ее
Аллергических реакций на введение фотосенсибилизатора Фотосенс не зафиксировано ни в одном случае Наличие болевого синдрома в момент проведения ИФДТ не было противопоказанием к проведению лечения данным методом Проведение ИФДТ как посредством диффузора, так и с микролинзой в контакте не вызывало выраженного болевого синдрома Боли купировались применением таблетированных и инъекционных ненаркотических анальгетиков Отек, возникающий в зоне лазерного воздействия был умеренным и не требовал медикаментозного вмешательства Изменений в клинических и биохимических показателях крови у больных по окончании ИФДГ по сравнению с исходными данными не отмечено
В весенне — летний период у большинства больных имелись проявления кожной фототоксичности после введения фотосенса и выражались в наличии умеренной пигментации открытых участков кожи У 24 % больных зафиксированы солнечные ожоги открытых участков кожи 1 степени в виде гиперемии и умеренного отека Данные проявления были связаны с нарушением больными рекомендуемого светового режима В последующем наблюдалась пигментация данных участков кожи Пигментация сохранялась в течение 4-6 месяцев, постепенно уменьшаясь
Комплекс лечебных и профилактических мероприятий применялся с учетом специфических механизмов ФДТ Для профилактики кожных фототоксических реакций, особенно в весенне летний период, рекомендовались антиоксидантные эмульсии и мази, содержащие витамин Е и В-каротин
Прием антиоксидантныч препаратов в течение 1 месяца, включающих витамин А (суточная доза 30 000 ME), витамин С (суточная доза 600 мг), витамин Е (суточная доза 300 мг) рекомендовался всем пациентам с первых суток после окончания ИФДТ с целью профилактики проявлений кожной фототоксичности Проявления кожной фототоксичности, возникшие у больных в следствие нарушения больными светового режима, не потребовали медикаментозного лечения
Всего у 69 больных обследованных групп имелась 431 узловая опухоль ИФДГ проводилась с использованием разработанных в ОКД №1 методик, в сроки не ранее 1-2 месяцев после предшествующего противоопухолевого лечения традиционными методами При анализе результатов лечения оценивались переносимость препарата фотосенс и
ИФДТ, терапевтическая активность фотосенса в дозе 0,5 мг/кг, а также зависимость результатов лечения от размеров, локализации и морфологической структуры опухолей. Результат лечения оценивали на основании предложенных схем динамического рентгеновского УЗИ и морфологического контроля по принятой классификации: ПР, ЧР, ОР. фотосенс вводился внутривенно калельно.
Анализ непосредственных результатов лечения показал, что в указанной дозе фотосенс обладает высокой терапевтической активностью в лечении больных с узловыми метастатическими опухолями РМЖ и меланомы.
Предложенный алгоритм обследования перед проведением ИФДГ позволяет наиболее эффективно воздействовать на опухоли, а алгоритм контроля по окончании лечения позволяет оценивать результаты и безопасность проведения ИФДТ злокачественных опухолей данных локализаций.
Предложенная методика ИФДТ позволяет повысить эффективность лечения больных раком молочной железы и меланомой кожи. Определяющим фактором при решении вопроса о проведении ИФДГ может явиться недостаточная эффективность ранее проводимого лечения традиционными методами.
Подводя итоги собственного исследования и учитывая данные литературы, можно заключить, что метод ИФДТ метастазов РМЖ и меланомы в кожу и мягкие ткани с использованием отечественного препарата фотосенс является эффективным в лечении больных со злокачественными опухолями данной локализации и может быть рекомендован в ЛПУ онкологического профиля
1. Таким образом проведенный анализ непосредственных и ближайших результатов ИФДТ с применением разработанной методики позволяет сделать вывод об эффективности метода в лечении больных с узловыми метастазами РМЖ и меланомы в кожу и мягкие ткани и является методом выбора при неэффективности традиционных методов.
2. Оптимальная терапевтическая доза фотосенса, при внутривенном введении, для ИФДТ РМЖ и меланомы составляет 0,5 мг/кг веса тела больного.
3. Оптимальная световая доза при проведении ИФДТ узловых опухолей РМЖ и меланомы составляет 500 — 600 Дж на 1 смЗ опухоли на курс лечения и определяется индивидуально в каждом конкретном случае в соответствии с размерами метастатического узла.
4. При проведении ИФДТ полная регрессия узловых метастазов РМЖ достигнута в 73,42%, а узловых метастазов меланомы в 66,33% случаев.
5. ПР и ЧР при предоперационной ИФДТ первичного рака молочной железы получена в 84,62 % случаев и с учетом морфологических данных исследования удаленных опухолей говорит о перспективности этого направления и требует продолжения работы над данной проблемой, особенно в случае экономных хирургических вмешательств.
5. Полная реализация эффекта при ИФДТ указанных локализаций регистрируется как правило к концу 4-6 недели после светового воздействия. Для оценки эффективности ИФДТ необходимо проведение комплексного обследования, включающего УЗИ, рентгенологическое исследование с обязательным морфологическим контролем.
6. Нецелесообразно проведение ИФДТ на узловые метастатические опухоли РМЖ, размером более 3 см, и на узловые метастатические опухоли меланомы, размером более 2 см в связи с низкой эффективностью метода.
10. ИФДТ рака молочной железы и меланомы является методом выбора при лечении больных с выраженной сопутствующей патологией,’ функциональной нерезектабель-ностью опухолей при множественном поражении и при ранних рецидивах опухолей после хирургического, комбинированного и других видов противоопухолевого лечения.
1. ИФДТ показана при узловых метастазах рака молочной железы и меланомы в кожу и мягкие ткани размером от 0,5 до 3 см.
2. Перед проведением лечения необходимо комплексное обследование, включающее обязательное морфологическое подтверждение процесса, определение размеров и локализации опухолей.
3. Обязательно информирование пациента о предполагаемом лечении, соблюдении светового режима с письменным согласием на данное вмешательство.
4. Проведение инвазивной ИФДТ рекомендуется осуществлять следующим образом:
-введение фотосенса в дозе 0,5 мг/кг внутривенно капельно на физиологическом растворе, однократное за 24 часа до проведения лечения,
-установка диффузора (двух, трех) под контролем УЗИ посредством пункционной иглы интратум орально при метастазах РМЖ, с фиксацией к кожным покровам, через 24 часа после введения ФС, облучение: мощность 200 — 300 мВт на выходе световода, световая энергия одной позиции — 200- 300 Дж с 1 см длины рабочей части диффузора,
-установка диффузора (двух, трех) под контролем УЗИ посредством пункционной иглы перитуморально, с фиксацией к кожным покровам, через 24 часа после интратумо-
ральной ФДТ, облучение: мощность 200 мВт на выходе световода, световая энергия одной позиции 200 Дж с 1 см длины рабочей части диффузора,
5. Проведение неинвазивной ИФДТ:
-введение фотосенса в дозе 0,5 мг/кг внутривенно капельно на физиологическом растворе, однократное за 24 часа до проведения лечения,
-установка микролинзы в контакте с опухолью и давлением на данную зону силой 0,1-0,5 кг/см2 через 24 часа после введения ФС,
-облучение: мощность 200 — 300 мВт на выходе световода, световая энергия одной позиции лазерного облучения 100-300 Дж,
-количество позиций лазерного облучения и количество сеансов облучения зависит от размера опухоли: оптимальная курсовая доза на 1 смЗ опухоли равна 500 — 600 Дж.
6. Оценка эффективности проведенной ИФДТ осуществляется через 1-2 месяца после лечения по данным УЗИ, рентгенографии, цитологического исследования.
Список работ по теме диссертации-
Материалы диссертации доложены:
1. «Клиническая эффективность фотодинамической терапии при некоторых злокачественных опухолях». А.М.Сдвижков, В.Л.Филинов, В.И.Борисов. Доклад на Второй научно-практической конференции с международным участием «Отечественные противоопухолевые препараты». Москва. Март- 2003.
2. «Эффективность фотодинамической терапии при некоторых злокачественных опухолях». В.Л.Филинов, А.М.Сдвижков, В.И.Борисов. Доклад на международном семинаре «ФДТ в лечении больных онкологической патологией». ММА им. И.М.Сеченова. Москва. 6.10.04.
1. «Фотодинамическая терапия и флуоресцентная диагностика метастазов рака молочной железы» — тезисы. Е.Вакуловская, В.Шенталь, В.Летягин, В.Соколов, Л.Умнова, Г.Ворожцов, Е.Лукьянец, В.Филинов, Е.Странадко и др. XI Международный конгресс по противоопухолевому лечению. Париж, Франция, февраль-2001.
2. «Фотодинамическая терапия злокачественных опухолей у больных в преклонном возрасте по материалам ОКД №1 КЗ Москвы» — тезисы. А.М.Сдвижков, В.В.Соколов, В.И.Борисов, В.Л.Филинов, НВ.Филинова. V Международный конгресс «Паллиативная помощь в онкологии» Анталия, Турция, апрель-2001.
3. «Фотодинамическая терапия и флуоресцентная диагностика метастазов рака мо-
лочной железы с фотосенсом и аласенсом». Е.Вакуловская, В.Шенталь, В.Летягин, Л.Умнова, Г.Ворожцов, В.Филинов, Е.Странадко. Международный конгресс «BIOS -2002» Сан-Хосе, США, январь-2002.
4. Photodynamic therapy and fluorescent diagnostics of breast cancer. Elena G. Vaku-lovskaya M.D., Victor P. Letyagin, Loubov V. Umnova, Georgiu N. Vorozhcsov, Vladimir L. Philinov Proc. SP1E Vol. 5315, p. 152-156, Optical Methods for Tumor Treatment and Detection: Mechanisms and Techniques in Photodynamic Therapy XIII, David Kessel; Ed. Jun 2004
5. «Фотодинамическая терапия метастазов рака молочной железы и меланомы» В.Л.Филинов, А.М.Сдвижков, В.И.Борисов, В.В. Соколов. «Паллиативная медицина» № 3. Октябрь 2004 г. Москва.
12. Оформлена заявка на изобретение №.. ____
«Способ проведения фото динамической терапии злокачественных опухолей».
Принято к исполнению 15/11/2004 Исполнено 16/11/2004
ООО «11-й ФОРМАТ» ИНН 7726330900 Москва, Балаклавский пр-т, 20-2-93 (095) 747-64-70 (095) 318-40-68 www.autoreferat.ru
1.1. История развития метода фотодинамической терапии (ФДТ).
1.2. Клинический опыт исследования метода ФДТ.
1.3. ФДТ больных раком молочной железы и меланомой.
1.4. Механизмы действия ФДТ.
Глава II. Материалы и методы исследования.
2.1. Общая характеристика больных.
2.2. Инструментальные, клинические и лабораторные методы исследования.
2.3. Фотосенсибилизатор фотосенс.
2.4. Аппаратура для проведения ИФДТ.
2.5. Методики ИФДТ больных раком молочной железы и меланомой.
Глава III. Результаты собственных исследований.
3.1. Распространение лазерного излучения в биологической ткани при проведении ИФДТ.
3.2. Непосредственные результаты ИФДТ больных первичным раком молочной железы.
3.3. Непосредственные результаты ИФДТ больных с метастазами рака молочной железы.
3.4. Непосредственные результаты ИФДТ больных с метастазами меланомы.
3.5. Осложнения и меры профилактики.
Глава IV. Обсуждение полученных результатов.
Во всем мире отмечается тенденция к росту заболеваемости злокачественными новообразованиями и смертности от них. В Российской Федерации абсолютное число больных с впервые в жизни установленным диагнозом злокачественной опухоли, поставленных на учет в течение года, за последние 10 лет увеличилось на 20%. Ежегодно выявляется более 400 тысяч больных со злокачественными новообразованиями различных локализаций (58). В нашей стране активно проводятся научные исследования, направленные на улучшение результатов лечения онкологических больных. Накопленный опыт отечественных онкологов по применению усовершенствованных подходов к хирургическому, комбинированному и комплексному лечению позволяет улучшать, их результаты, включая и показатели 5-летней выживаемости пациентов (58). Вместе с тем традиционные методы лечения далеко не всегда эффективны. Это связано с тем, что большинство из выявляемых онкологических больных имеют 3 и 4 стадию заболевания. Вторая не менее важная причина неудовлетворенности результатами лечения — невысокая чувствительность ряда опухолей к лучевому и лекарственному противоопухолевому лечению. Хирургическое лечение не всегда удается осуществить, что часто связано с тяжестью общего состояния больного, выраженной сопутствующей патологией, функциональной неоперабельностью или распространенностью опухолевого процесса.
В структуре онкологической заболеваемости населения Российской Федерации значительное место занимает рак молочной железы (РМЖ) — 9%. В России, среди онкологических заболеваний у женщин, РМЖ стоит на первом месте и в 1997 году составил 18,42% (58). В половине случаев РМЖ выявляется в распространенной стадии процесса, на долю 3 и 4 стадии при первичном обращении больных приходится 40% (11, 58). Результатом применения современных методов комплексного и комбинированного лечения — 5-летняя выживаемость при 1 стадии рака составляет 96%, при 2А — 90%, 2В -80%, ЗА — 87%, ЗВ -67% (58). Рецидивы заболевания в течение 5 лет после радикального лечения возникают в среднем в 28% случаев (114, 194, 240, 222). Вероятность рецидива РМЖ зависит от исходной стадии заболевания. При Т 1 -2 рецидив заболевания выявляется в 6 — 10%, при Т 3 -4 — в 25 — 50% случаев (169, 211, 222, 240, 253). Вероятность рецидива РМЖ возрастает при наличии до начала лечения метастазов в регионарных лимфоузлах. При поражении 20% и более регионарных лимфоузлов рецидив заболевания в срок до 8 лет выявляются в 40% случаев (210). Лечение больных с метастазами РМЖ требует значительно большего арсенала методов и средств, чем лечение больных первичным РМЖ. Поскольку метастатическая опухоль размером более 0,5 см уже является источником дальнейшего метастазирования — эффективное лечение больных с выявленными метастазами РМЖ имеет не менее важное прогностическое значение, чем лечение больных с первичной опухолью (33).
Хирургическое удаление метастазов рака молочной железы не всегда возможно в связи с множественным характером поражения, большой распространенностью процесса. Соматическое состояние больных, перенесших комбинированное лечение и полихимиотерапию (ПХТ), порой не позволяет осуществлять хирургическое вмешательство в оптимальном объеме. Результативность консервативной терапии больных с метастазами РМЖ во многом зависит от чувствительности опухоли к лучевому, лекарственному и гормональному лечению. Множественный характер внутрикожного метастазирования в ряде случаев ограничивает возможности лучевого лечения. Основным традиционным методом лечения больных с метастазами РМЖ остается химиогормонотерапия с многократным повторением курсов лечения (33, 58, 248). Положительный эффект ПХТ (полная или частичная регрессия) при метастазах РМЖ в кожу и мягкие ткани, с применением стандартных схем лечения, достигается в 22 — 27% случаев со сроком ремиссии 2-3 месяца (185). Продление сроков ремиссии требует многокурсовой ПХТ (41, 42). Неудовлетворенность результатами терапии больных РМЖ заставляют клиницистов искать новые методы и совершенствовать схемы комплексного и комбинированного лечения.
Фотодинамическая терапия (ФДТ) является принципиально новым методом в лечении больных, основанном на способности фотосенсибилизираторов (ФС) накапливаться в злокачественных опухолях и при избирательном воздействии лазерного излучения определенной длины волны вызывать повреждение опухоли. Тромбоз сосудов опухоли, стимуляция локального противоопухолевого иммунитета так же способствуют гибели опухолевых клеток (55). Высокая избирательность поражения опухолей, отсутствие выраженных побочных реакций, возможность повторных курсов лечения и сочетание в одной процедуре диагностики и лечения качественно отличает метод ФДТ от традиционных методов лечения онкологических больных (56). Клинические испытания метода ФДТ с препаратами фотогем и фотосенс проводимые в России с 1992 года ( МНИОИ им.П.А.Герцена, ГНЦ Лазерной Медицины, ОНЦ РАМН им.Блохина, ММА им. И.М.Сеченова и др.) показали высокую эффективность данного метода в лечении больных злокачественными опухолями различной локализации и морфологической структуры (9, 10,55,56).
В настоящее время наиболее изучена и широко применяется методика дистанционной ФДТ. Распространение лазерного света, при этом виде облучения, в глубину ткани ограничено и зависит от оптических свойств опухоли, выбранной длины волны, а так же от отражающей способности поверхности ткани (30). Возможности дистанционной ФДТ значительно ограничены в случае узловых опухолей и опухолей расположенных подкожно и в мягких тканях (152). Для реализации фотодинамического эффекта в данном случае необходимо интерстициальное лазерное облучение опухоли. Для эффективного использования интерстициальной ФДТ (ИФДТ) в лечении больных необходима разработка методики расчета оптимальной световой дозы, определение позиций световодов с целью максимального повреждения опухоли и минимального повреждения окружающей здоровой ткани.
Клинические испытания препарата фотосенс показали достаточно высокую эффективность дистанционной ФДТ при внутри кожных метастазах РМЖ, размером не более 0,5 — 0,8 см (9,10). Основной потенциальной группой пациентов для применения методики ИФДТ являются больные с множественными узловыми формами внутрикожных и подкожных метастазов РМЖ, размером от 0,8 см и более, в случае, когда традиционные методы лечения неэффективны или малоэффективны. Методика ИФДТ так же может быть эффективна в лечении больных с узловым внутрикожными и подкожными метастазами меланомы.
Меланома — составляет 10% всех злокачественных опухолей кожи, ежегодный прирост заболеваемости составляет 5% (58). Медиана выживаемости пациентов с 4 стадией заболевания составляет около 6-7,5 месяцев, 5-летняя выживаемость — около 6% (106). Заболеваемость меланомой кожи в России неуклонно растет: в 1985 году составила 2,0, а в 1997 году 3,9 на 100000 населения (58).
Основной метод лечения больных первичной меланомой кожи хирургический — широкое иссечение опухоли в пределах здоровых тканей. Объем иссекаемых тканей при удалении меланомы зависит от толщины опухоли, классифицируемый по Breslow (или от уровня инвазии опухоли по Clark) (77, 197, 217, 245, 254). Клинические данные указывают на прямую зависимость выживаемости больных от уровня инвазии кожи. Так 5-летняя выживаемость при 1-ом уровне инвазии составляет 98 — 100%, при 2-ом — 9098%, при 3-ем — 80 — 90%, при 4-ом — 60-70%, при 5-ом уровне инвазии -3040% (58, 198, 245). По данным МНИОИ им.П.А.Герцена при исследовании удаленных, клинически неизмененных, регионарных лимфатических узлов у 30% больных выявляются метастазы меланомы (58).
Хирургическое удаление первичной опухоли не исключает развитие местных рецидивов и транзиторных метастазов, которые обычно выявляются в период от 6 до 20 месяцев после операции и составляют 7-11% (64, 234, 245). Послеоперационная лучевая терапия направлена на уменьшение риска рецидива заболевания и применяется в основном при меланоме толщиной 4 мм и при морфологически подтвержденных метастазах в регионарные лимфоузлы (79,218, 235, 236). Однако адьювантная лучевая терапия далеко не всегда оказывается эффективной из-за низкой чувствительности меланомы к ионизирующему излучению (5).
Таким образом лечение больных с метастазами меланомы в кожу и мягкие ткани представляет не менее трудную проблему, чем лечение больных с первичной опухолью. Хирургическое удаление солитарных метастазов, в ряде случаев, увеличивает продолжительность жизни пациентов в среднем на 25 месяцев (15, 245). При наличии множественных метастазов в кожу и мягкие ткани хирургическое лечение не всегда выполнимо (149, 150, 246, 247).
У 8 — 20% больных с метастазами меланомы монохимиотерапия позволяет добиться объективного эффекта со сроком ремиссии 4-6 месяцев. Менее 2% больных переживают 5-летний рубеж (106). ПХТ стандартными схемами с применением DTIC и CCNU при метастазах меланомы приводит к полной или частичной регрессии опухолей в 22-40% случаев (106). Многократные курсы ПХТ существенно не изменяют результатов лечения, не улучшают* безрецидивный период и общую выживаемость больных (5, 88). Иммунотерапия эффективна у 15-17% больных с метастазами меланомы (256). Сочетанием ПХТ и иммунотерапии объективный эффект при внутрикожных метастазах меланомы достигается в 25-40% (88, 106, 130, 206). В последние годы большое внимание уделяется разработке методов антиангиогенной терапии. Предполагается, что применение антиангиогенных препаратов будет способствовать замедлению роста метастатических опухолей и стабилизации заболевания (106). Таким образом, используемые в настоящее время методы лечения подкожных и внутрикожных метастазов меланомы не обеспечивают удовлетворительных непосредственных и отдаленных результатов.
Клинические испытания метода ФДТ с препаратом Фотосенс (МНИОИ им.П.А.Герцена, ГНЦ Лазерной медицины, ОНЦ РАМН им.Блохина, ММА им. И.М.Сеченова, ОКД № 1 и др.) показали, что метастазы меланомы накапливают препарат в достаточной мере для эффективного воздействия методом ФДТ. При узловых формах метастазов меланомы, содержащих большое количество светопоглощающего пигмента, размером от 0,5 см и более перспективным направлением совершенствования метода ФДТ является неинвазивное интерстициальное лазерное облучение с применением микролинзы в контакте с опухолью.
Как за рубежом, так и в России в последние годы проводятся работы по совершенствованию метода ФДТ с фотометрией, определением оптимальной курсовой дозы световой энергии, по поиску режимов лазерного облучения опухолей (264,265,266,267). Интерстициальная фотодинамическая терапия (ИФДТ) может явиться эффективным дополнительным методом лечения больных с внутрикожными и подкожными метастазами РМЖ и меланомы.
Разработка методики интерстициальной фотодинамической терапии с препаратом фотосенс у больных меланомой кожи и раком молочной железы.
1. Разработка методов расчета световой дозы при узловых формах злокачественных опухолей кожи и мягких тканей при контактном неинвазивном интерстициальном способе облучения (670 нм).
2. Разработка схемы распределения источников лазерного излучения при инвазивной интерстициальной фотодинамической терапии в узловой опухоли, в зависимости от ее размеров, при первичном и метастатическом раке молочной железы.
3. Разработка схем сочетанного контактного и интерстициального лазерного облучения внутрикожных и подкожных метастазов рака молочной железы и меланомы.
4. Определение сроков реализации и критериев оценки противоопухолевого эффекта интерстициальной фотодинамической терапии узловых форм метастазов рака молочной железы и меланомы.
5. Разработка показаний и противопоказаний для интерстициальной фотодинамической терапии узловых форм метастазов рака молочной железы и меланомы с препаратом фотосенс.
Научная новизна исследования.
В данной работе впервые на клиническом материале представлены показания к проведению ИФДТ больных РМЖ и меланомой с фотосенсибилизатором фотосенс, изучена терапевтическая ценность фотосенса при проведении ИФДТ подкожных и внутрикожных узловых опухолей данных нозологических форм; даны рекомендации по методике доставки лазерного излучения к опухоли в зависимости от ее объема, локализации, с использованием отечественной медицинской лазерной аппаратуры; разработаны схемы установки лазерных излучателей; разработана методика расчета световой дозы при контактных и инвазивных интерстициальных способах лазерного облучения опухоли; определены оптимальные световые дозы, разработана эффективная методика лечения больных с метастазами РМЖ и меланомы; определены критерии и сроки реализации противоопухолевого эффекта ИФДТ с препаратом фотосенс в данной группе больных; представлены возможные характерные осложнения ИФДТ при использовании фотосенса у больных РМЖ и меланомой, определены меры профилактики и лечения осложнений.
Практическая значимость работы.
Разработанная методика ИФДТ с препаратом фотосенс позволяют расширить диапазон применения ФДТ у больным раком молочной железы и меланомой, в первую очередь при узловых формах внутрикожных и подкожных метастазов, у лиц с отягощенным соматическим статусом и резистентностью опухолей к ПХТ и лучевой терапии. Методика ИФДТ рекомендована для внедрения в практику онкологических институтов, онкологических центров, краевых и областных и городских онкологических диспансеров России.
Основное положение работы — методика ИФДТ рака молочной железы и меланомы с использованием препарата фотосенс и лазерной установки отечественного производства «ЛД-2000» внедрены в клиническую практику кабинета ФДТ Онкологического клинического диспансера №1 Департамента здравоохранения города Москвы.
Опубликовано 8 печатных работ по ФДТ больных злокачественными опухолями в России и за рубежом, в том числе по материалам диссертации опубликовано 5 печатных работ. Сделаны 3 доклада на Российских и международных конференциях и семинарах. Оформлена заявка на изобретение №2004133704 от 19.11.04.
Апробация работы состоялась 24.06.04 в ГУ МНИОИ им. П.А.Герцена МЗ и CP РФ.
Диссертация изложена на 108 страницах печатного текста, состоит из введения, 4 глав, заключения, выводов, методических рекомендаций, списка публикаций и списка литературы. В работе содержится 26 таблиц, 9 рисунков и 24 фотографии. Список литературы включает 63 работы опубликованные в России и 204 работы опубликованные за рубежом.
источник