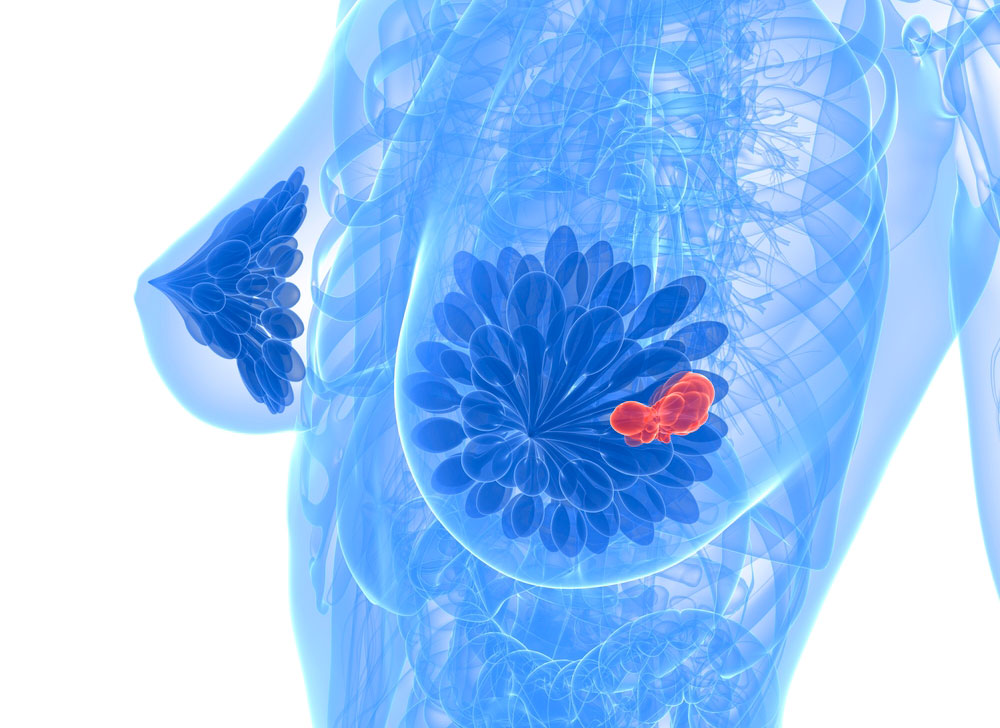
Приблизительно 10% заболеваний раком молочной железы имеют наследственный характер и связаны с определенными генами. Гены BRCA 1 и BRCA2 отвечают за предотвращение роста раковых клеток в молочной железе и яичниках. В каждом организме есть две копии генов BRCA1 и BRCA2 – по одному от каждого из родителей. Мутация генов BRCA1 и BRCA2 является одной из причин возникновения рака молочной железы и значительно повышает риск возникновения болезни. Приблизительно 60% женщин с мутацией гена заболевают раком. При этом если один из генов сломан, а второй функционирует в обычном режиме, генная защита организма продолжит предотвращение роста раковых клеток, то есть не каждая женщина с мутацией одного из генов заболеет раком.
Обнаружение мутации в генах BRCA1 и BRCA2 позволяет правильно определять тактику лечения для пациенток, у которых опухоль уже обнаружена, так как существуют таргетные препараты, эффективно воздействующие на BRCA-ассоциированные опухоли. Также информация о генотипе по этим генам поможет планировать профилактические мероприятия и наблюдение для людей, у которых симптомов заболевания еще нет.
Причины для тестирования
У большинства пациенток рак молочной железы не является унаследованным заболеванием. Но если в вашей семейной истории существуют случаи болезни, особенно не единичные, то проверка на мутацию генов BRCA1 и BRCA2 будет крайне полезным диагностическим исследованием. Заподозрить семейную форму рака можно в следующих случаях:
• При наличии двух или более родственниц, имеющих рак молочной железы;
• При выявлении рака молочной железы в возрасте до 35 лет;
• При наличии двустороннего или мультифокального рака молочной железы;
• При раке яичников;
• При наличии даже одного родственника с раком яичников или раком молочной железы, который был диагностирован до 40-летнего возраста;
• При раке грудной железы у родственника-мужчины;
• При раке молочной железы у матери, сестры или дочери;
• Если у многих поколений в семье был рак молочной железы или яичников;
• При наличии родственницы, страдающей раком молочной железы в относительно молодом возрасте (моложе 50 лет);
• При наличии родственницы, страдающей раком обеих молочных желез.
Важно понимать, следующую информацию о генетической наследственности:
• наличие мутации гена у одного из членов семьи не обязательно повлечет за собой передачу данного гена следующему поколению.
• Наличие мутации гена помещает вас в категорию повышенного риска, но не подтверждает наличие болезни. Вы можете почувствовать тревогу и опасения, но не стоит давать переживаниям завладеть вами. Ознакомьтесь со статьей «Действия при наличии генетической мутации» и возможными дальнейшими действиями.
• Отсутствие мутации гена не гарантирует полную безопасность от заболевания. Даже если генетический тест отрицательный, все равно существует риск заболевания, но его вероятность приравнена к среднестатистическому уровню.
• В семьях с многократными случаями заболевания раком молочной железы или яичников, пациентке с уже диагностированной болезнью и отрицательным результатом теста на поломку генов BRCA1 и BRCA2 стоит предположить, что причина заболевания кроется в других генетических изменениях, и рассмотреть возможность широкой генетической диагностики.
Где проводить генетическое исследование
Тест на выявление генетических аномалий BRCA1 и BRCA2 проводится путем забора венозной крови и не требует дополнительной подготовки. Срок получения результатов анализа составляет от 5 дней до нескольких недель. Тест не включен в программу ОМС и проводится на платной основе во многих профильных онкологических центрах и платных медицинских лабораториях.
Мутация генов BRCA1 и BRCA2: статистика и прогноз
Мутация гена BRCA1 случается чаще, чем мутация BRCA2. Положительный результат на мутацию генов BRCA1 и BRCA2 значительно повышает риск развития заболевания. Среднестатистический риск развития рака молочной железы составляет 12%, а при мутации гена риск колеблется от 40% до 85%, то есть в 3-7 раз больше. Риск развития рака яичников также увеличивается с 2% до 16-44%. Вероятность наследственной передачи одного из мутировавших генов от родителя к ребенку составляет 50%. В случае поломки обоих генов, риск наследственной передачи составляет 50% для каждого из генов.
Результаты научных исследований:
• мутации генов BRCA1 и BRCA2 влекут за собой развитие опухолей, не зависимых от эстрогена, что означает что лечение данных опухолей гормоном будет не эффективно, в отличие от химиотерапии.
• Такие опухоли будут иметь высокую степень роста клеток
• мутации генов BRCA1 и BRCA2 влекут за собой развитие опухолей, показывающих отрицательный результат при тестировании на Her2/Neu. Данная генетическая аномалия не является наследственной, но развивается в организме с течением времени. Большинство опухолей, приобретенных в ходе мутации BRCA1 и BRCA2, не поддаются лечению Герцептином, так как являются Her2/neu негативными.
• Риск развития болезни во второй груди никак не коррелирует с наличием мутации генов BRCA1 и BRCA2.
Что делать при наличии генетической мутации
Генетические анализы позволят вашему врачу выбрать наиболее эффективную форму лечения. Так, например, в случае мутации BRCA1, вероятнее всего гормональная терапия будет не эффективной. В случае мутации BRCA2, ситуация обратная, и лечение гормонами может дать нужный результат. Если ваши результаты генетического тестирования оказались положительными, вы можете воспользоваться данной информацией для понижения риска заболевания:
• Рассмотрите возможность превентивной мастэктомии – такая операция понижает риск заболевания на 90%. В случае положительного генетического результата и после приобретения заболевания в одной из молочных желез, риск возникновения заболевания во второй железе составляет около 3% в год. При отсутствии генетической мутации, данный риск равен 1%.
• Рассмотрите возможность проведения превентивной овариэктомии – удаления обоих яичников и маточных труб. Данная операция понижает риск возникновения заболевания на 50%, если операция была проведена до наступления менопаузы, так как она отнимет у организма основной источник эстрогена. Возраст для проведения операции зависит от результатов генетического тестирования: в случае положительного генетического результата на BRCA1, предпочтительный возраст для овариэктомии – 35-40 лет. При положительном BRCA2, предпочтительный возраст для операции – 40-45 лет.
• По согласованию с врачом принимайте лекарственные препараты, которые способны снизить риск рака яичников.
• Если вы не готовы к радикальным действиям по проведению мастэктомии или овариэктомии, вы можете рассмотреть вариант более тщательных и частых обследований (скринингов). В то время как скрининги не предотвращают развитие болезни, они могут позволить выявить ее на более ранних стадиях и оптимизировать процесс лечения.
• Начните делать МРТ грудной клетки с 25 летнего возраста. Данное исследование можно делать и в более раннем возрасте, если в семейной истории были случаи заболевания до 30-летнего возраста.
• Делайте детальное гинекологическое обследование, включая УЗИ органов малого таза, начиная с 25-летнего возраста. Сдавайте анализ на онкомаркер СА125.
• Посещайте маммолога каждые 6 месяцев и проводите самостоятельный осмотр груди каждый месяц.
• Рассмотрите возможность участия в клинических исследованиях по превентивным стратегиям.
Тестирование на другие генетические отклонения
Помимо генов BRCA1 и BRCA2, существует ряд других мутаций, которые способны повлечь за собой рак молочной железы. К ним относятся CHEK2, PALB2, ATM, BRIP1, TP53, PTEN, STK11, CDH1, NBN, BARD1, MLH1, MRE11, MSH2, MSH6, MUTYH, PMS1, PMS2, RAD50, RAD51C.
Большинство умеренно- и низкопенетрантных генов напрямую взаимодействует с BRCA1 (например, BARD1, ABRAXAS, BRIP1, BABAM1), следовательно, их поломки мешают ему нормально выполнять свою работу.
• Ген CHEK2 кодирует белок под названием «чекпоинт-киназа 2», который может взаимодействовать с p53 и BRCA1. CHEK2 не дает клетке делиться дальше, если ее геном поврежден, — клеточный цикл останавливается на стадии G1.
• Белок, кодируемый геном ATM, выполняет множество функций, связанных с ответом на повреждение и с репарацией ДНК, в том числе в сигнальных путях, включающих TP53, BRCA1 и CHEK2. RAD51 и его паралоги (т.е. гены, появившиеся в результате дупликаций RAD51 внутри генома) — это ключевые медиаторы гомологической рекомбинации.
• Самые важные с «онкологической» точки зрения — это RAD51C и RAD51D, которые взаимодействуют с BRCA2.
Если результаты на мутацию данных генов окажутся положительными, вам могут предложить такие профилактические меры, как частые проверки, гормональная терапия, или в некоторых случаях оперативное вмешательство. Решение о мерах, подходящих вам, необходимо принимать вместе с генетиком и онкологом.
источник
Заболеваемость
Частота наследственной предрасположенности к раку молочной железы составляет около 25% всех случаев рака молочной железы. Приблизительно 5-10% случаев рака молочной железы и яичников вызваны мутациями генов BRCA1, BRCA2, CHEK2, TP53 и PTEN. Гены BRCA1 и BRCA2 высоко чувствительны при раке молочной железы, в то время как мутации в CHEK2, ATM, BRIP1 и PALB2 характерны для промежуточного риска возникновения рака молочной железы. Объединенные исследования идентифицировали другие общие варианты, связанные с низким риском возникновения рака молочной железы. Тем не менее, более 70% генетической предрасположенности к раку молочной железы остаются необъяснимыми.
Распространенность носителей мутации гена BRCA, в общем, по популяции составляет от 1/800 до 1/1000. Это обуславливает повышение риска развития рака молочной железы на 15%-20%. Распространенность мутаций генов BRCA1 или BRCA2 значительно различается у этнических групп в географических регионах. Специфические мутации и рецидивы мутаций в зависимости от популяции были описаны в Исландии, Нидерландах, Швеции, Норвегии, Германии, Франции, Испании, Канаде, странах Центральной и Восточной Европы и среди потомков евреев, выходцев из Германии.
Частота мутаций BRCA1 и BRCA2 у больных раком молочной железы и яичников, изначально не дифференцированных по признаку наследственности либо возраста, в общей массе мала: 25 лет, после получения генетической консультации и информированного согласия. Пациентов с выявленными генетическими мутациями следует поддерживать в вопросах получения генетической консультации для близких членов семьи.
Большинство клинически опасных мутаций — это мутации, связанные с усечением белка, малое количество это бессмысленные мутации. Некоторые мутации определяются технически, но прямое ДНК секвенирование «золотой» стандарт. Геномный ДНК, извлеченный из крови используется как трафарет, кодирующий экзоны с фланкирующим интронным секвенированием. В дополнении у 2-12% семей с высоким риском могут наблюдаться большие геномные изменения, рекомендуются специальные методы для обнаружения дупликаций или делеций одного или более экзонов такие как мультиплексная ПЦР [III, B].
Снижение рисков: нехирургические превентивные меры
Наблюдение с точки зрения возникновения рака груди у носителей BRCA включает ежемесячные самопроверки, клиническое обследование груди раз или два в год, а также раз в год маммографию и магнитно-резонансную томографию (МРТ) молочной железы, начиная с 25-30 лет [IIa, B]. Пока еще нет доступных данных, чтобы определить, что более эффективно в молодом возрасте – поочередно маммография и МРТ каждые 6 месяцев либо оба обследования раз в год, учитывая высокую степень появления рака в промежутках между обследованиями.
Профилактическая химиотерапия
Адъювантный тамоксифен сокращает риск контралатерального рака груди у носителей мутаций гена BRCA [III, B], тогда как преимущества тамоксифена для предотвращения первичного рака молочной железы не были доказаны [Ib, A].
Снижение рисков: профилактические хирургические методы
Профилактическая двусторонняя мастэктомия — наиболее эффективная из известных на сегодня стратегий по сокращению риска развития рака груди у носителей мутации гена [III, B], хотя не отмечены преимущества в выживании, и многие женщины не считают эту стратегию приемлемой по косметическим соображениям. Контралатеральная профилактическая мастэктомия — вариант к рассмотрению для носителей мутации BRCA с раком груди в раннем возрасте и односторонней мастэктомией [IV, C].
Типы профилактической мастэктомии могут быть от тотальной мастэктомии до кожесохраняющей и сосковосохраняющей мастэктомии. Различные варианты реконструкции молочной железы должны быть обсуждены с пациентом и включая преимущество и риски для каждого.
На сегодняшний день недостаточно доказательств для рутинного выполнения биопсии сторожевого лимфатического узла у пациентов, подвергшихся профилактической мастэктомии.
Профилактическая двусторонняя сальпингоовариэктомия
Операция связана со снижением риска рака молочной железы у носителей мутации гена BRCA в пременопаузе, риска снижения рецидива ипсилатерального рака молочной железы после органосохранной операции и лучевой терапии, риска снижения рака яичников и гинекологических опухолей, а также имеются доказательства снижения общей смертности.[III, B]. Двусторонняя сальпингоовариэктомия рекомендована после 35 лет и в тех случаях, когда беременность больше не планируется [IV, C].
Кратковременная гормонозаместительная терапия после двусторонней сальпингоовариэктомии, по-видимому, не снижает общих преимуществ данной стратегии для уменьшения риска заболевания раком молочной железы [III, B].
Модификаторы риска
Риск BRCA-ассоциированного рака молочной железы может быть изменен внешними факторами. Гормональные и репродуктивные факторы, такие как беременность (количество беременностей и возраст в первую беременность), грудное вскармливание и оральные противозачаточные средства связаны с риском модификации у носителей мутации BRCA. Количество родов в анамнезе, кажется, снижает риск развития рака молочной железы у женщин с мутациями BRCA в общей популяции. [III, B].
Органосохранная операция и лучевая терапия у носителей BRCA мутаций, которые подверглись профилактической овариэктомии, ассоциирована с подобной формой развития рецидивного рака молочной железы по сравнению с контролем в течение 10 лет. Риск развития контралатерального рака молочной железы у носителей BRCA выше по сравнению со спорадическим контролем, независимо от гормонального вмешательства.
Решение о хирургическом лечении рака молочной железы у носителей мутации BRCA должно основываться на тех же параметрах, как и при спорадических случаях диагностики рака, при этом принимая во внимание более высокую степень риска двустороннего рака молочной железы, и ипсилатерального рецидива если за органосохранным оперативным лечением следует лучевая терапия без выполнения овариэктомии [III, B].
Системное лечение
Согласно последним данным, общий прогноз рака молочной железы у носителей BRCA мутаций такой же, как и при спорадическом раке молочной железы, а отсутствие мутации BRCA1/2, считается прогнозирующим фактором химиочувствительности опухоли [III, B].
Продолжается II фаза рандомизированного клинического исследования по изучению чувствительности к платино-содержащей химиотерапии при BRCA ассоциированных метастатических опухолях по сравнению с таксан-содержащими режимами.
Ингибиторы PARP используются как единственные терапевтические агенты для пациентов с BRCA ассоциированным раком молочной железы и яичников. Эти препараты ингибируют путь репарации однонитевого разрыва ДНК и приводят к апоптозу в BRCA дефицитных опухолевых клетках, которые уже имеют дефицит в гомологичной рекомбинантной репарации. Некоторые клинические исследования II фазы изучают недостаток специфической репарации ДНК в BRCA ассоциированных опухолях с использованием ингибиторов PARP при метастатическом процессе.
Два клинических исследования II фазы с применением орального ингибитора PARP — олапариба при местно распространенном раке молочной железы и раке яичников с BRCA мутацией недавно показали поддерживающий клинический эффект при применении 400мг препарата непрерывно (процент ответивших: 41% и 33%, и безрецидивная выживаемость составила 5.7 и 5.8 месяцев, соответственно).
До сих пор не имеется окончательных выводов о лучших режимах химиотерапии для пациентов с BRCA ассоциированным раком молочной железы [III, B]. В настоящее время при выборе адъювантного лечения для больных раком молочной железы с наличием BRCA мутации должны использоваться стандартные прогностические факторы.
источник
Наследственный рак молочной железы – онкологическое заболевание, обусловленное генетической мутацией и проявляющееся повышенным риском развития злокачественных опухолей молочной железы у кровных родственников. Отличается от спорадических неоплазий более ранним началом, большим количеством двухсторонних поражений и частыми сочетаниями с новообразованиями других органов. Диагностируется с учетом семейной истории, данных молекулярно-генетического анализа и инструментальных исследований. При наличии предрасположенности проводятся регулярные осмотры, по показаниям осуществляется профилактическая мастэктомия. Лечение – операции, химиотерапия, радиотерапия.
Наследственный рак молочной железы – заболевание, сопровождающееся повышением вероятности возникновения злокачественных новообразований молочной железы вследствие генетической мутации, передающейся из поколения в поколение. Является одной из наиболее распространенных наследственных форм рака. Составляет от 5 до 10% от общего количества неоплазий молочной железы. Характеризуется частым ранним началом (в возрасте до 50 лет). Распространенность двухсторонних поражений при разных мутациях колеблется от 5-20 до 60%.
При наследственном раке молочной железы существует высокая вероятность развития других опухолей, в том числе – рака яичников, эндометрия, толстого кишечника, желудка, поджелудочной железы и мочевого пузыря, а также меланомы кожи. При наличии одной близкой родственницы, страдавшей данным заболеванием, риск неоплазии увеличивается в два раза, при двух случаях рака молочной железы в семье – в пять раз. Вероятность развития новообразования еще больше возрастает, если у одной или более родственницы симптомы болезни появились в возрасте младше 50 лет. Лечение проводят специалисты в сфере онкологии и маммологии.
Специалистам известен целый ряд генетических мутаций, увеличивающих вероятность возникновения рака молочной железы. В литературе чаще всего упоминаются мутации генов-супрессоров BRCA1 и BRCA2. Связь этих генов с опухолями данного органа была достоверно установлена в 1994 году. Проведенные исследования позволили повысить уровень ранней диагностики наследственного рака молочной железы и стали основой для последующих изысканий в этой области. В последующем ученым удалось обнаружить, что перечисленные гены выявляются всего у 20-30% больных с семейными случаями рака молочной железы и рака яичников.
У остальных пациенток заболевание провоцируется другими мутациями, при этом в разных регионах планеты преобладают различные генетические аномалии. Наряду с повышенной вероятностью развития наследственного рака молочной железы дефектные гены могут увеличивать риск возникновения других злокачественных новообразований, чаще всего – уже упомянутого выше рака яичников. Несколько реже у пациенток возникают опухоли эндометрия, еще реже – неоплазии органов, не являющихся частью женской репродуктивной системы.
Существует ряд факторов риска, провоцирующих наследственный рак молочной железы у носительниц дефектного гена. В числе таких факторов – раннее менархе (частое явление при данной патологии), позднее начало климакса, отсутствие беременностей и родов, длительный прием гормональных препаратов, сахарный диабет, ожирение, гипертоническая болезнь, курение, злоупотребление алкоголем, наличие доброкачественных пролиферативных изменений ткани молочной железы и некоторых заболеваний женских половых органов.
На ранних стадиях наследственный рак молочной железы протекает бессимптомно. Иногда первыми признаками становятся болезненность в молочных железах (при наличии мастопатии) и интенсивные боли во время менструаций. Как правило, опухоль обнаруживают до возникновения развернутой клинической картины. Возможно как самостоятельное выявление узла (случайное или в процессе самоосмотра), так и возникновение подозрений на онкологическое заболевание при проведении очередного обследования.
При прогрессировании наследственного рака молочной железы появляются выделения из соска. Увеличиваются подмышечные лимфоузлы на стороне поражения. Кожа над опухолью становится морщинистой, выявляются умбиликация и положительный «симптом площадки». В последующем наблюдаются прогрессирующая деформация органа и симптом «лимонной корки». Возможно изъязвление. На поздних стадиях наследственного рака молочной железы к проявлениям первичной неоплазии присоединяются нарушения функций различных органов, обусловленные отдаленным метастазированием, и общие симптомы онкологического заболевания: расстройства аппетита, потеря веса, гипертермия.
Отмечаются различия в течении наследственного рака молочной железы, вызываемого разными генетическими мутациями. Новообразования, выявляемые у женщин-носительниц гена BRCA1, характеризуются высокой степенью злокачественности. Рак, ассоциированный с мутациями BRCA2, протекает более благоприятно по сравнению со спорадическими случаями заболевания. Отличительной особенностью всех форм наследственного рака молочной железы является высокая вероятность возникновения контрлатеральных поражений и рецидивов опухоли в той же молочной железе после проведения органосохраняющих операций. Для сравнения: средняя частота местных рецидивных неоплазий при спорадическом раке составляет 1-1,5% в течение года. При наследственном раке молочной железы контрлатеральные новообразования выявляются у 42%, ипсилатеральные – у 49% больных.
Диагноз устанавливается с учетом семейного анамнеза, результатов молекулярно-генетических исследований и данных дополнительного обследования. Генетический анализ выполняют после выявления семейно-анамнестических признаков наследственного рака молочной железы (наличия заболевания у близких родственников, раннего начала, высокой частоты двухсторонних поражений). При положительном результате анализа регулярно назначают маммографию. При образовании узла осуществляют УЗИ молочной железы, дуктографию, МРТ и другие диагностические процедуры. При подозрении на наличие отдаленных метастазов проводят рентгенографию грудной клетки, сцинтиграфию всего скелета, УЗИ печени, МРТ головного мозга и другие исследования.
Традиционно при наследственном раке молочной железы применяли стандартные схемы, составленные с учетом более высокой вероятности рецидивирования. Однако в последние годы в литературе все чаще встречаются указания на необходимость использования специальных лечебных программ, составленных с учетом чувствительности наследственного рака молочной железы, ассоциированного с различными генетическими аномалиями. Так, пациенткам с дефектом BRCA1 из-за низкой эффективности не рекомендуют назначать средства из группы таксанов. При наследственном раке молочной железы с мутацией BRCA2 успешно применяют цисплатин – препарат, не входящий в стандартную схему лечения рака молочной железы, но успешно используемый при лечении опухолей других локализаций. Для снижения частоты рецидивов даже на начальных стадиях выполняют радикальную мастэктомию, а не органосохраняющие операции.
Меры по предотвращению и своевременному выявлению наследственного рака молочной железы включают в себя отказ от вредных привычек, регулярные самоосмотры и осмотры специалиста. Основной инструментальной методикой, используемой при проведении профилактических обследований, является маммография, однако в последние годы при наличии возможностей ее все чаще заменяют ЯМР, исключающим облучение пациентки. При высоком риске развития наследственного рака молочной железы (более 25%) осуществляют профилактическую двухстороннюю мастэктомию, иногда – в сочетании с оофорэктомией.
источник
АЮРВЕДА — ОМОЛОЖЕНИЕ И ДОЛГОЛЕТИЕ
Прием глюкозамина для суставов равна как плацебо эффект
Согласно мировой статистике, около 70% женщин с диагнозом рака молочной железы не имеют каких-либо определенных факторов риска. Однако рак у ближайшего родственника (родители, брат, сестра, ребенок) увеличивает шансы заболеть в 2 раза.
Примерно 80% образований в груди — доброкачественные.
Но, каждый год примерно 55-60 тысяч российских женщин слышат «рак молочной железы» как страшный диагноз.
На протяжении десятилетий показатели заболевания раком молочной железы в богатых странах росли быстрее, чем в бедных странах.
После заявления Анджелины Джоли во всех онкологических институтах ждут наплыва женщин, желающих удалить здоровую грудь — на всякий случай.
Стоит ли в этом деле спешить?
И хотя было доказано, что мутации генов BRCA1 и BRCA2 резко усиливают опасность заболевания раком молочной железы в течение жизни женщины, менее 10% случаев заболевания, как считается, обнаруживается у женщин с такими наследственными мутациями.
Приблизительно 5-10% случаев рака молочной железы и яичников вызваны мутациями генов BRCA1, BRCA2, CHEK2, TP53 и PTEN. Гены BRCA1 и BRCA2 высоко чувствительны при раке молочной железы, в то время как мутации в CHEK2, ATM, BRIP1 и PALB2 характерны для промежуточного риска возникновения рака молочной железы . Объединенные исследования идентифицировали другие общие варианты, связанные с низким риском возникновения рака молочной железы.
В большинстве случаев раком молочной железы заболевают женщины, у которых нет известных унаследованных факторов риска!
Тем не менее, более 70% генетической предрасположенности к раку молочной железы остаются необъяснимыми.
BRCA1 и BRCA2 (BRCA означает BReast CAncer) являются «супрессоров опухолей» гены, то есть они помогают предотвратить неконтролируемый рост клеток. В организме человека эти гены отвечают за противоопухолевую защиту: восстанавливают целостность поврежденных молекул ДНК, нормализуют баланс эстрогенов, тормозят деление пораженных клеток, препятствуют метастазированию раковых клеток молочной железы.
ДНК каждого человека состоит из двух копий каждого из генов. У людей с мутацией, одна из этих копий «ломается», оставляя тело более восприимчивым к росту опухоли.
Мутации передаются из поколения в поколение, от одного из родителей к своим детям. Каждый человек имеет по две копии каждого гена, одна копия – от отца, другая – от матери. Если ваша мать или отец являются носителями мутаций в гене, то в процессе наследования генетического материала Вы имеете 50% шанс на наследование мутированного гена и 50% шанс на наследование неизмененного гена. Если вы не наследуйте ее, риск заболевания раком будет таким же, как в общей популяции. Если Вы наследуете дефектный ген, то появляется риск 50:50 передачи этого гена вашим детям.
Если дефектный ген Вами не унаследован, то риск передачи его детям отсутствует.
Наследуется ли рак молочной железы? Что делать, если в роду были рак молочной железы? У меня тоже должен быть, верно?
Нет, нет и нет. Если у кого-то из родственников были мутантные гены, приводящие к раку груди, это еще не значит, что вы в группе риска. BRCA мутации находятся в примерно 0,1 до 0,2 процента от общей численности населения, а это означает, что они чрезвычайно редки. Большинство женщин с семейной историей рака молочной железы или яичников – даже с серьезной семейной историей – не имеют изменений гена BRCA. И большинство источников считают, что всего 5-10 процентов случаев рака молочной железы обусловлены мутациями BRCA.
Другими словами, 90-95 процентов случаев рака молочной железы не связаны с BRCA мутаций.
В 90-95% случаев рака молочной железы (РМЖ) – заболевание, зависящее от внешних факторов (экологии, условий работы, питания). Однако 5-10% – это наследственные формы рака.
Прежде всего, не пугаться, не впадать в панику, не терять присутствия духа. Это может быть и не связано с наследственностью. К тому же наследственное предрасположение вовсе не обязательно приведет к заболеванию. Главное понять, что в любой жизненной коллизии выигрывает тот, кто настраивает себя на лучшее.
Популяционная частота этих мутаций не более 1 %. Но у женщин с наличием мутации гена BRCA1 риск развития рака молочной железы на протяжении жизни составляет 40-80%, развития рака во второй молочной железе — 40-60%, рак яицников — 15-45%. Женщины с мутацией гена BRCA2 имеют риск развития рака молочной железы на протяжении жизни 50-85%, и рак яицников — 10-20%. Мужчины с мутациями BRCA имеют повышенный риск развития рака простаты, молочной железы и рака поджелудочной железы.
Широко применяемые критерии для направления на генетическое исследование включают в себя:
а) три или более случая рака молочной железы и/или яичников, среди близких родственников, при этом по крайней мере один в возрасте менее 50 лет;
b) два случая рака молочной железы в возрасте моложе 40 лет;
с) рак груди у мужчины и рак молочной железы у женщины, изначально диагностированный в молодом возрасте
Взвешенное решение
Используйте эту анкету, чтобы помочь себе принять решение. После ее заполнения у вас должно сложиться более ясное представление о том, что вы думаете о сдаче генетического анализа на рак молочной железы и яичников. Обсудите результаты с вашим врачом.
Обведите ответ, который лучше всего вам подходит.
У меня есть родственник, у которого положительный анализ на изменение в генах BRCA
У меня отягощенная семейная история рака молочной железы
Я еврейка, и в моей семье были случаи заболевания раком молочной железы или яичников
Я бы не принимала лекарственные препараты и не делала бы операцию, даже если бы результат анализа был положительный
Для меня важно знать, унаследовала ли я генетический дефект BRCA
Я знаю, что наличие генетического изменения не означает, что я обязательно заболею раком.
Я не могу себе позволить генетическое обследование.
Я очень боюсь, что у меня может быть рак молочной железы, и я готова сделать операцию или принимать медицинские препараты, если результат анализа будет положительный.
Я скорее предпочту рискнуть, чем точно знать, являюсь ли я носителем гена BRCA.
Каково ваше общее впечатление?
Ваши ответы призваны дать вам общее представление о том, какое решение принять. У вас может быть один главный довод в пользу того, сдавать или не сдавать анализ на ген BRCA.
Нет в человеческом организме органов, которые не нужны.
Рак груди на ранних стадиях заболевания вполне излечим. На протяжении десятилетий показатели заболевания раком молочной железы в богатых странах росли быстрее, чем в бедных странах. Что в образе жизни женщин в развитых странах настолько увеличивает вероятность развития у них этой болезни по сравнению с женщинами в отдельных частях Юго-Восточной Азии и Африки, где частотность заболевания, как правило, в пять раз ниже?
Может быть, это связано с избыточным весом и потреблением алкоголя. В крови женщин с избыточным весом более высокое содержание эстрогена, поскольку жировые клетки вырабатывают эстроген, который стимулирует рост большинства видов раковых опухолей молочной железы. Алкоголь также ассоциируется с повышенным уровнем гормонов в крови, что вполне может быть тем механизмом, из-за которого повышается риск рака молочной железы у женщин.
Доказано также, что факторами риска в отношении рака молочной железы является заместительная гормональная терапия и оральные контрацептивы, которые являются источниками эстрогена.
Еще, е сть больше доказательств того, что фактором появления рака молочной железы является сменная работа, связанная с нарушением суточного режима!
Конечно, хочется найти лекарство от рака молочной железы, но лучше предотвратить рак молочной железы в тех случаях, когда это возможно.
Количество смертей в России от рака молочной железы превышает 23,5 тыс. в год. Каждый день 47 детей в России остаются без мам, жизни которых уносит это страшное заболевание.
Берегите себя и будьте здоровы!
- Наследственный фактор. Так, среди главных причин развития рака молочной железы, 20-25% составляет наследственная предрасположенность. Если в Вашей семье были случаи заболевания раком, Вы попадаете в группу-риска.
- Ряд заболеваний, а именно: гинекологические, связанные с нарушением работы яичников, заболевание щитовидной железы, надпочечников, сахарный диабет, мастопатия. Неправильное лечение такого рода заболеваний может спровоцировать рак груди.
- Повышенный уровень женских половых гормонов (гиперэстрогения) и пониженный уровень мужских, которые являются некоей страховкой от возникновения рака молочной железы.
- Поздняя беременность. Безопасный возраст для рождения ребенка — до 35 лет. Также, обратите особое внимание, что длительное кормление ребенка грудью снижает риск заболевания.
- Травма молочной железы. Так, 25% женщин, у которых диагностировали рак, говорили о предшествующей травме груди.
- В зоне риска женщины после 50 лет.
- Ранние месячные — до 12 лет, поздний климакс — после 53 лет.
- Вредные привычки. Так, курящие женщина на 30% чаще страдают раком молочной железы.
- Постоянный стресс и переутомляемость.
- Также фактором риска становится отсутствие родов. Сейчас многие семьи ограничиваются одним ребёнком или женщины рожают после 35 лет. Такие поздние первые роды увеличивают риск развития рака молочной железы в 5–7 раз.
Помните, что 80% женщин самостоятельно диагностировали опухоль молочной железы на ранних стадиях. И при своевременном обращении к специалисту, смогли уберечь и не потерять грудь. Поэтому, так важно уделять особое внимание самообследованию организма.
Существует ошибочное мнение, что раку молочной железы чаще подвержены женщины старше 50 лет. Но все чаще в онкологических клиниках можно встретить пациенток, возраст которых едва перевалил за 30.
На начальной стадии заболевания внешние симптомы рака молочной железы отсутствуют. Зачастую женщина даже не подозревает о нависшей над здоровьем угрозе. Первые симптомы рака груди можно заметить, когда механизм болезни уже запущен.
Симптомы рака молочной железы
- изменение формы, размера или контура груди
- Уплотнения в молочной железе
- деформация и выделения из сосков
- увеличение лимфатических узлов
На Украине у каждой четвертой женщины, приходящей на первичное обследование к маммологу, выявляется запущенная форма рака молочной железы. Об этом сообщил главный онколог министерства здравоохранения страны Игорь Cедаков.
«Сегодня на Украине зарегистрировано 336 маммографов. Делается более 730 тыс. маммограмм ежегодно. Однако показатели запущенности — начиная с 2В стадии и до 4-й стадии — колеблются в пределах 25%», — сказал он на презентации проекта «Мужчины против рака груди».
Седаков также отметил, что растет число молодых женщин, умирающих из-за этого заболевания. По его словам, своевременное обследование украинок среди прочего помогло бы сэкономить значительные средства.
Ссылаясь на официальные данные американских экспертов, он отметил, что на лечение одной пациентки с начальной формой рака молочной железы в среднем требуется от 3 до 30 тысяч долларов. «Для лечения 3-й и 4-й стадий расходуется до полумиллиона долларов в год», — добавил Седаков.
Почему химиотерапия не только ухудшает качество жизни, но во многих случаях малоэффективна прилечении рака?
Когда вы поймете, что токсичные препараты, которые используются для химиотерапии, на деле являются одной из причин рака, абсурдно думать, что мы все еще используем их для лечения людей с онкологическими заболеваниями. Реальные исследования доказали, что химиотерапия не только ухудшает качество жизни, но во многих случаях малоэффективна при лечении рака.
Химиотерапия и удаление зараженных частей тела устраняют лишь симптомы рака, но не его причины. Именно поэтому по статистике у большинства больных раком, которые прошли химиотерапию, случаются рецидивы. Или, поскольку химиотерапия и лучевая терапия только ослабляют и разрушают иммунную систему, больные становятся более восприимчивыми к другим заболеваниям, угрожающих иммунной системе. Банальная простуда или грипп могут перерасти в пневмонию, которая может оказаться смертельной.
Статистика выздоровления после рака учитывает только случаи, когда после химиотерапии и облучения человек живет дольше пяти лет. Многие люди, которые якобы «излечились» от рака, умирают в течение шести или семи лет. Химиотерапия – это не панацея. Мы используем причину рака (токсичные препараты) для его лечения.
Фармацевтическая промышленность стремится лишь к тому, чтобы получить прибыль. Некоторые курсы химиотерапии могут стоить более 100000 долларов.
Одна из основных проблем в том, что, когда люди слышат этот диагноз, они паникуют. Многие люди на самом деле считают, что это смертный приговор. Они буквально одержимы страхом. А когда люди боятся, они будут прибегать к любым средствам, в том числе химиотерапии и лучевой терапии и другим дорогостоящим и малоэффективным методам лечения.
Заболевание раком молочной железы известно еще с древних времен, так как женщина всегда относилась к этой части своего тела не только как к атрибуту женской привлекательности, но и как к органу, дающему питание ее детям. Самым распространенным провокатором возникновения такой болезни является курение, на втором месте после которого идет злоупотребление загаром.
Женщины всегда чутки к состоянии груди, поэтому при обнаружений изменений в органе они сразу обращаются к врачу, что и позволило выявить эту болезнь достаточно давно. Как правило, пациентки не отказываются от хирургического вмешательства по поводу удаления опухоли, тем более что современная пластическая хирургия дает возможность исправить внешний вид оперированной груди. Но бывают случаи, когда пациентка отказывается полностью от какого-либо лечения, не желая лишать себя части органа рак молочной железы 2 степени, онкология груди .
Онкология молочной железы поражает не только одну из желез, зачастую поражение происходит в обеих молочных железах.
Как упоминалось выше, в зону риска, в первую очередь, попадают курильщицы и любительницы загара, но помимо этого есть еще ряд причин, которые влияют на возникновение болезни: генетическая наследственность, поздняя менопауза, наступающая после 55 лет, рано начавшиеся менструации, то есть ранее 12 лет, радиоактивное облучение, ожирение и некоторые другие.
Определен ряд симптомов, указывающих на поражение организма раком молочной железы:
-выделения из соска;
-появление уплотнения в груди;
-молочная железа изменилась в контурах, либо цвете;
-появились увеличенные лимфоузлы в области подмышки.
Как правило, врачи при диагностике проводят ряд процедур для выявления заболевания, в которые обязательно входит пальпация, маммография, рентгенография, биопсия и УЗИ молочных желез.
Лечение может быть назначено в различных сочетаниях всех методов, применяемых для излечения раковых заболеваний. Все зависит от размеров опухоли, поражения раковым процессом расположенных рядом органов, наличия метастазов и поражения лимфоузлов.
Онкология молочной железы классифицируется по различным показателям, первым из которых является степень инвазивности процесса. Исходя из признака, рак подразделяется на инвазивный и неинвазивный.
Неинвазивный рак больше поддается лечению и выживаемость при таком распространении весьма высока. Характеризуется он локализацией только внутри органа, причем чаще всего раковые клетки не выходят за пределы протоков молочной железы.
Инвазивные формы рака более опасны, так как они не ограничиваются пределами протоков и поражают рядом расположенные здоровые ткани и органы. Инвазивный рак имеет 4 степени, из которых вторая имеет еще и подвиды.
Подвид 2А характеризуется небольшими размерами опухоли, которые не достигают 2 сантиметров. Распространяется такая болезнь в подмышечные лимфоузлы в количестве от 1 до 3-х. К этой подстадии так же относят злокачественные новообразования размерами 2-5 сантиметров, не без распространения на лимфатические узлы подмышечной области.
Подвид 2В характеризуется новообразованиями с диаметром, не превышающим 5 сантиметров, опять же с распространением на 1-3 лимфатических узла подмышечной области со стороны опухоли. Так же сюда относят и большие по размеру опухоли, но без распространения на подмышечные лимфатические узлы.
Если лечение подобрано и проведено правильно, то десятилетняя выживаемость пациентов при 2 степени рака молочной железы может достигать 90%.
Лечение второй стадии, как правило, включает в себя мастэктомию, радио и химиотерапию.
Рак вообще имеет тесную связь с нервной системой, а рак груди (поскольку тут и гормональная, и имунная системы задействованы) вдвойне обусловлен психосоматическими факторами. Этот вид рака возникает от затяжного стресса, сопровождающегося накоплением обид и злости. Причем рак груди чаще связан с обидой на. мать или полового партнера, поскольку эти люди ассоциируются с зоной груди и мозг подсознательно проецирует негативные переживания именно на эту часть тела.
Результаты анализа, проведенного специалистами Оксфордского университета, ставят под сомнение эффективность программ массового скрининга на рак молочной железы. Сравнив уровень смертности от этого вида онкологии и степень охваченности маммографическим исследованием женского населения Великобритании в течение почти сорока лет, ученые не нашли свидетельств положительного влияния скрининга на этот показатель. Работа опубликована в журнале Journal of the Royal Society of Medicine.
Авторы изучили статистические данные о смертности в регионе Оксфорда с 1979 по 2009 год, а также данные о смертности от рака груди по всей Великобритании во всех возрастных группах с 1971 по 2009 год. Регион Оксфорда был выбран потому, что только в нем, в отличие от остальной страны, в свидетельстве о смерти указываются все возможные причины смерти. Изучалось положение со смертностью от рака молочной железы до и после 1988 года, когда Национальной службой здравоохранения Великобритании (NHS) была введена программа по выявлению рака груди на ранней стадии у женского населения в возрасте от 50 до 64 лет.
Однако, вопреки ожиданиям, наибольшие снижение показателей смертности от рака груди было выявлено не в этой возрастной группе, а среди женщин моложе 40 лет, которые не проходят регулярное обследование на этот вид онкологии. Так, в период с 1988 по 2001 в этой возрастной группе было отмечено снижение уровня смертности на два процента, а в период с 2001 по 2009 год — на пять процентов. А вот на смертность женщин в возрасте 50 — 64 лет, как отмечают авторы, рутинное тестирование на рак груди, в сравнении с более молодой группой, практически не повлияло — в первый из временных периодов их показатель упал лишь на 1,2 процента, а во второй — на три процента.
Статистика свидетельствует о том, делают вывод авторы, что на популяционном уровне эффекта от массового скрининга на рак молочной железы в Великобритании, который, как ожидалось, должен был значительно снизить смертность от этого заболевания, не наблюдается.
Новое исследование показывает, что женщины с определенными мутациями генов находятся в зоне риска развития рака молочной железы, если они подвергались воздействию излучения рентгенографии грудной клетки и маммографии возрасте до 30 лет, по сравнению с теми, кто имеет эти же генные мутации и не подвергались излучению.
В исследовании участвовало около 2000 женщин в возрасте от 18 лет и старше, проживающих в Нидерландах, Франции и Великобритании. Все женщины имели мутацию в генах BRCA1 или BRCA2, которые ассоциируются с повышенным риском рака груди или рака яичников.
48 % женщин сообщили, что подвергались рентгенографии и 33 % — маммографии, по данным доклада в BMJ. Средний возраст женщин, когда они сделали первую маммографию, составлял 29 лет.
В период между 2006 и 2009 годах у 43 % женщин был диагностирован рак молочной железы. История любого воздействия радиации от рентгена грудой клетки или маммографии в возрасте между 20 и 29 годами увеличивает риск развития рака молочной железы на 43%, и любое воздействие до 20 лет – на 62%. Также отмечено, что воздействие между 30 и 39 годам не оказывает никакого влияния.
На каждые 100 женщин в возрасте 30 лет с мутациями в генах BRCA1/BRCA2 , девять заболеет раком молочной железы к 40 годам, и риск заболевания у этих женщин увеличится на 5 %, если они пройдут процедуру маммографии до 30 лет согласно вычислениям Анука Пижпа и его коллег из Онкологического института в Нидерландах.
«Воздействие радиации — установленный фактор риска для рака молочной железы среди всех женщин», — указывают авторы исследования. Некоторые страны рекомендуют избегать женщинам в возрасте до 30 лет проходить обследования с использованием маммографии. Пижп и его коллеги рекомендуют женщинам до 30 лет, имеющих мутации в BRCA1/BRCA2 генах, проходить неионизирующие методы диагностики, такие, как МРТ.
« Необходимо похвалить авторов, которые выполнили сложное исследование», — говорит доктор Ай Мой Ту Ма, директор хирургии на груди в больнице Рузвельта Святого Луки в Нью-Йорке. Он также соглашается с тем, что для женщин несущих генные мутации, до 30 лет необходимо проходить неионизирующие методы диагностики.
Другой специалист по раку молочной железы предполагает, что к таким пациентам необходим индивидуальный подход.
«Женщины с мутациями BRCA должны придерживаться программы диагностирования, разработанной специально для них на основе личных и семейных факторов в дополнение к учету генной мутации для того, чтобы свести к минимуму потенциальный риск», — докладывает доктор Ева Халас, начальник службы клинического рака в Больнице Университета Уинтроп, в Майнеоле, Нью-Йорк.
Растение катчхур (вид Fagonia cretica), известная еще как «плащ Девы Марии», вырастает в Пакистане и используется для приготовления травяного чая. Также известно, что в сельских районах Пакистана напиток из этого растения давали женщинам, которые страдают от рака груди.. Нужно отметить, что до сих пор традиционной медициной этот метод лечения рассматривался как часть фольклора, хотя онкопациентки, которые принимали экстракт катчхура, отмечали улучшение состояния и утверждали, что при этом никаких серьезных побочных эффектов, характерных при раковой терапии (потеря волос, диарея, ухудшение анализов крови), у них не возникало.
Исследователи из Астонского университета (Бирмингем) и больницы Рассела Холла, что в Дадли, Великобритания, провели тесты с использованием Fagonia cretica и установили, что действительно, в лабораторных условиях экстракт убивает раковые клетки, не повреждая здоровых клеток организма.
Теперь специалисты намерены выяснить, какой элемент или элементы растения ответственные за уничтожение раковых клеток. А чтобы узнать, будут ли лекарства сохранять такую же эффективность внутри организма, как в лабораторных условиях, вероятно, будут организованы испытания экстракта катчхура на людях со злокачественными опухолями.
Работа в ночные смены на протяжении 30 и более лет удваивает риск рака груди
Неприятную взаимосвязь между работой в ночную смену и онкологическими заболеваниями выявили канадские ученые, обследовав более двух тысяч здоровых женщин и пациенток с диагнозом рак груди, проживающих в городах Ванкувер и Кингстон (Канада). Труд ученых обнародован в British Medical Journal
В своей работе исследователи оценивали связь ночных смен с развитием онкологического заболевания у 1134 женщин с раком груди и 1179 женщин без этого заболевания. Все участницы одного возраста, жительницы двух городов Канады — Ванкувера и Кингстона.
У женщин спрашивали, приходилось ли им работать по сменам в течение своей трудовой деятельности. Примерно каждая третья женщина из обеих групп работала в ночные смены. Если ученые не выявили зависимости между раком груди и работой в ночные смены на протяжении 14 лет или 15-29 лет, то для тех, кто работал 30 лет или больше, риск удваивался.
Эта взаимосвязь была общей, как для представительниц профессий в сфере здравоохранения, например, медсестер, так и для представительниц других профессий.
Авторы отмечают, что ночное время очень важно для женщины, так как именно тогда образуется гормон мелатонин, нарушение выработки которого может увеличивать производство другого гормона — эстрогена, чрезмерные уровни которого ведут к развитию опухолей. Роль может играть также нехватка витамина D в организме и нарушение биоритмов.
Но, возможно, рак груди может преследовать любую трудолюбивую женщину, совсем не обязательно ведущую ночной образ жизни. Например, 14 мая 2013 года на страницах The New York Times знаменитая американская актриса Анджелина Джоли призналась, что в конце апреля 2013 года перенесла хирургическую операцию — двустороннюю профилактическую мастэктомию. После операции на груди заявила о намерении удалить себе яичники с целью снижения риска заболеть раком.
Найден новый эпигенетический маркер рака молочной железы. Ученые проанализировали 450 тысяч участков метилирования по всему геному 36 пар однояйцевых близнецов с дискордантностью по данному заболеванию.
Ни для кого не секрет, что огромную роль в развитии тех или иных форм онкологических заболеваний играют генетические мутации. Описаны многие из этих мутаций и степени риска развития неоплазий, связанных с ними. Однако, несмотря на всю критическую важность «генетической основы», не менее существенную роль в развитии этих патологий могут играть эпигенетические процессы.
Эпигенетические изменения не нарушают последовательности нуклеотидов в ДНК и не передаются по наследству, но за счет химической модификации определенных хромосомных локусов и связанных с ними генов критически изменяют их доступность для транскрипционного аппарата клетки. (Примеры эпигенетических изменений – ацетилирование и метилирование гистонов, метилирование ДНК.) Такое эпигенетическое «включение/выключение» генов, в частности, лежит в основе дифференцировки – приобретения необходимого фенотипа – всех типов соматических клеток. И наоборот, изменение характерной «эпигенетической маркировки» клетки того или иного типа приводит к де-дифференцировке или смене фенотипа (транс-дифференцировке) в другой клеточный тип, например, из эпителия в мезенхиму. Учитывая такие масштабы эффектов эпигенетической регуляции, нетрудно понять, что нарушения этого процесса могут приводить к развитию патологий, таких как канцерогенез.
Метилирование ДНК, как один из важнейших механизмов эпигенетической регуляции, был открыт на рубеже восьмидесятых годов прошлого столетия. Суть этого процесса заключается в конверсии цитозинового нуклеотидного остатка в 5-метилцитозин. Долгое время считалось, что единственным функциональным следствием метилирования является транскрипционная репрессия генов, поскольку «островки» метилирования, чаще всего обнаруживаемые в промоторных последовательностях генов, конформационно препятствуют взаимодействию этого участка ДНК с белковыми транскрипционными факторами, необходимыми для экспрессии данного гена. Однако затем выяснилось, что в ряде случаев этот процесс может опосредовать и активацию экспрессии генов. Но, так или иначе, правильный паттерн метилирования критически необходим для нормальной клеточной дифференцировки и развития организма.
В ходе же неопластического перерождения картина эпигенетической модификации, как правило, меняется таким образом, что общий уровень метилирования генома существенно снижается, в то время как регуляторные участки существенно меньшей части генов (чаще всего, генов-онкосупрессоров), наоборот, гиперметилируются и подавляются. Соответственно, если изменение нормального метилирования в каком-либо из генов играет важную роль в развитии определенной формы рака, то установление такого феномена будет способствовать не только лучшему пониманию патогенеза этого заболевания, но и может оказаться своего рода эпигенетическим маркером данного заболевания.
Один из таких ранее неизвестных специфических эпигенетических маркеров рака молочной железы, а именно гиперметилирование промоторного участка гена DOK7, удалось обнаружить международной группе ученых, недавно опубликовавшей результаты своей работы в журнале Carcinogenesis.
Рак молочной железы (РМЖ) – наиболее распространенная форма неоплазии у женщин (примерно, один случай на девять женщин). При этом только в 30% случаев он передается по наследству. Иными словами, в абсолютно большей части случаев причиной этого заболевания становятся спорадические мутации и эпигенетические изменения. Среди последних чаще всего отмечается гиперметилирование и, как следствие, «глушение» генов BRCA1 и BRCA2, известных онкосупрессоров, участвующих в гомологичной рекомбинации при репарации повреждений ДНК. Открытие этих эпигенетических маркеров позволило, в свое время, установить, что их носители гораздо лучше отвечают на лечение такими химиотерапевтическими агентами, как PARP-ингибиторы и цисплатин, чем остальные пациентки с диагнозом РМЖ. Соответственно, установление эпигенетических маркеров, встречающихся при данном заболевании с меньшей частотой, также могло бы помочь в разработке других персонализированных методов лечения.
Для этой цели авторы применили недавно разработанный метод сравнения паттернов метилирования у однояйцевых близнецов, успешно примененный в аналогичных исследованиях сахарного диабета первого типа и системной красной волчанки.
Однояйцевые близнецы генетически идентичны, но в ходе эмбриогенеза и последующего постнатального развития между ними возникает ряд фенотипических различий, явление, известное как «дискордантность однояйцевых близнецов». Одним из проявлений дискордантности, по большей части определяемой, как раз, эпигенетическими изменениями, может быть развитие какого-либо заболевания у одного из близнецов при отсутствии этого заболевания у другого. В таком случае, сравнение эпигенетических карт двух близнецов может обнаружить эпигенетические маркеры данного заболевания.
В своем исследовании авторы использовали клетки периферической крови и сравнили 450 тысяч участков метилирования по всему геному 36 пар однояйцевых близнецов с дискордантностью по раку молочной железы. Всего было обнаружено 403 участка генома с различным метилированием. Как и ожидалось, подавляющее большинство из них было связано с гипометилированием генома, характерным для раковых заболеваний. Из оставшейся части большее внимание было уделено гиперметилированным участкам регуляторных последовательностей 14 генов, показавших наибольшие различия в метилировании. Большинство этих генов оказались уже известными участниками патогенеза РМЖ и других раковых заболеваний. Однако канцерогенные функции одного из них, DOK7 (а точнее, одной из его изоформ, транскрибируемых с альтернативного промотора), показавшего как раз наиболее значимые различия в метилировании, оказались практически неизвестными.
Дальнейшая проверка возможности использования DOK7 в качестве эпигенетического маркера рака молочной железы, проведенная на послеоперационных образцах РМЖ и культуральных линиях клеток РМЖ, полностью подтвердила обнаруженную корреляцию. Более того, анализ показал, что DOK7, как маркер, обладает уникальными прогностическими характеристиками. А именно: гиперметилирование одного из его промоторов в клетках периферической крови можно обнаружить за несколько лет до постановки самого диагноза РМЖ.
Дальнейшие исследования в этой области, по словам ученых, будут связаны с выяснением точных функций DOK7, а именно, той его изоформы, которая синтезируется с гиперметилированного при РМЖ промотора в норме и при канцерогенезе.
Источник: Holger Heyn, F. Javier Carmona, Antonio Gomez, Humberto J. Ferreira, Jordana T. Bell, Sergi Sayols, Kirsten Ward, Olafur A. Stefansson, Sebastian Moran, Juan Sandoval, Jorunn E. Eyfjord, Tim D. Spector, and Manel Esteller. DNA methylation profiling in breast cancer discordant identical twins identifies DOK7 as novel epigenetic biomarker. Carcinogenesis (2012) doi: 10.1093/carcin/bgs321 First published online: October 10, 2012.
На фото:
1. Октябрь – всемирный месяц борьбы с раком молочной железы. Розовая ленточка – эмблема, разработанная Всемирной организацией здравоохранения.
2. Дифференциально метилированные участки CpG в парах однояйцовых близнецов, дискордантных по раку молочной железы. (E) bcDMP отличаются эпигенетически, несмотря на идентичный генетический фон близнецов. Красная точка – «здоровая зона» в раковых кластерах. Уровень метилирования ДНК bcDMP маркирован цветом: желтый – образец с низким уровнем метилирования; красный – образец с высоким уровнем метилирования. (F) Иерархический кластерный анализ форм bcDMP в шести основных парах близнецов, дискордантных по РМЖ.
3. Гены, ассоциированные с bcDMP, участвуют в возникновении других форм рака (рака поджелудочной железы, хронической миелоидной лейкемии, колоректального рака, мелкоклеточного рака легких). Сетевой анализ.
4. Гиперметилирование DOK7 при раке молочной железы. Анализ образцов ДНК (из крови) здоровых и заболевших РМЖ женщин-близнецов.
Каждый из нас рождается голым, но потом мы смотрим на одежду так, будто уже в ней появились на свет. Одежда изменяет внешний вид, говорит о социальном положении, роде занятий, моде и сексуальности.
Но она же становится нашей раковиной, которая заставляет нас приспосабливаться, а мягкие ткани тела принимать её размер и форму.
Как правило, женщины предпочитают эффектные кружевные бюстгальтеры на косточках из синтетических материалов, которые хорошо поддерживают и моделируют форму груди. При этом удобству и комфорту они отводят последнее место, совершенно не заботясь о том, что грудь деформируется, приспосабливаясь под форму лифчика.
«Бюстгальтер — это упругий предмет одежды, предназначенный для изменения формы груди путём постоянного давления и сжатия мягких тканей груди, в том числе и лимфатических сосудов. Свидетельством этого являются красные следы и углубления в коже, которые остаются после ношения бюстгальтера» (С. Сингер, 1995).
После тестирования здоровых и заболевших женщин Американские учёные пришли к выводу, что женщины с раком молочной железы носили бюстгальтер дольше, чем здоровые женщины, а постоянное ношение бюстгальтеров повышает риск заболеть раком молочной железы в 21 раз.
Исследования 5000 женщин в США, показали, что 96 % женщин из заболевших носили бюстгальтер более 12 часов в день, а 18% даже спали в них. Эти исследования также обнаружили, что связь между бюстгальтером и раком груди в три раза больше, чем связь между курением и раком легких!
Таким образом, существует прямая зависимость между ношением бюстгальтеров и возникновением рака груди — чем больше часов в день женщины носят бюстгальтер, тем у них выше риск рака молочной железы. Такая же зависимость от ношения бюстгальтера существует относительно кистозно-фиброзной мастопатии, которая часто предшествует раку.
Всё дело в том, что бюстгальтер, сдавливая грудную клетку, сдавливает и лимфатические сосуды, по которым из ткани молочной железы выводятся отмершие и повреждённые клетки, отработанные продукты жизнедеятельности тканей и различные токсины. Многие из этих токсинов являются канцерогенами, которые накапливаются преимущественно в жировых тканях организма, в том числе груди. Бюстгальтер способствует задержке этих веществ в молочной железе, затрудняя лимфатический дренаж.
Многие говорят, что роль бюстгальтеров в возникновении рака молочной железы это всего лишь миф.
Действительно, бюстгальтеры не вызывают рак груди сами по себе! Рак запускается в отдельной клетке как результат мутации. А затем, если лимфатическая и иммунная система не очищает организм от нетипичных или раковых клеток, может начаться формирование опухоли. Если же лимфатические сосуды пережаты, токсины и «чужеродные клетки» не могут быть выведены из тканей и разрушены.
Значит ли это, что стоит вовсе отказаться от бюстгальтеров?
Вовсе нет. Не надо впадать в крайности, т.к. этот предмет туалета действительно иногда просто необходим. Но, учитывая печальную статистику, нужно придерживаться некоторых условий:
1. Бюстгальтер нужно носить только тогда, когда это необходимо и, конечно, не более 12 часов в день. А, главное, никогда не спать в нём.
2. Бюстгальтер всегда следует надевать при занятиях спортом или танцами, особенно женщинам с большой грудью.
3. Правильно выбирать бюстгальтер:
- Он не должен быть слишком тугой! Ведь иногда, идя по улице, можно заметить даже через одежду как у некоторых женщин бюстгальтер сжимает грудную клетку, оставляя «вмятины» по бокам груди.
- При выборе бюстгальтера следует точно подбирать его размер и учитывать свои анатомические особенности. Нельзя, чтобы лифчик изменял собственную форму груди или придавал ей неестественное положение.
- Желательно как можно реже носить бюстгальтер на косточках, который сдавливает грудь, блокируя дренаж лимфатической жидкости из её нижней части.
- Рекомендуется носить бюстгальтеры с чашечками без швов.
- Отдавать предпочтение хлопчатобумажной ткани, которая может впитывать пот и кожный жир, а также пропускать воздух — грудь дышит, а не перегревается.
- Опасными являются и модели пуш-ап, которые приподнимают грудь, а не просто поддерживают её.
- По оценкам ученых наиболее опасен бюстгальтер без бретелек, т.к. вес груди приходится на боковые стороны, а это прямое давление на лимфатические узлы.
- Не желательно носить бюстгальтер ярких или тёмных цветов летом в жару. Если его качество окажется невысоким, он может полинять из-за интенсивного потоотделения, а краска впитается в кожу.
Хотя мужчины намного реже женщин сталкиваются с раком груди, скорее всего, данная встреча будет фатальной, делают вывод специалисты. Эксперты сравнили 13000 мужчин и 1440000, занесенных в Национальную американскую раковую базу данных в 1998-2007 годах, рассказывает The Toronto Sun.
В целом показатель выживаемости для женщин составил 83%, а для мужчин — 74%. Мужчины жили в среднем около восьми лет после постановки диагноза, женщины же жили в течение более десяти лет.
По словам руководителя изыскания доктора Джона Грейфа, частично за статистическим различием стоит тот факт, что люди больше осведомлены о раке груди у женщин. Соответственно состояние женщин проверяют чаще.
Значит, у пациенток больше шансов выявить рак на ранней стадии, тем самым, облегчив работу онкологам. У мужчин рак находят позже, когда опухоли уже выросшие, более развитые и готовы распространиться в лимфатические узлы.
Что касается факторов риска, для мужчин, как и для женщин, в их число входят: генетическая предрасположенность и наличие раковых больных в семье, влияние радиации, курение, лишний вес, отсутствие физической активности. Также особо стоит опасаться мужчинам с повышенным уровнем эстрогена или болезнями, влияющими на гормональный фон.
Снизить риск развития онкологического заболевания на 5% поможет употребления одной-двух порций жирной рыбы в неделю, считают специалисты
Полиненасыщенные жирные кислоты, содержащиеся в рыбе, могут снизить риск развития рака груди, уверены китайские ученые.
Об этом сообщает РИА Новости со ссылкой на научный труд, опубликованный в журнале British Medical Journal. Одна из наиболее часто возникающих злокачественных опухолей – рак молочной железы, примерно 23% всех случаев онкологических заболеваний. При употреблении одной-двух порций тунца, лосося или сардины в неделю, риск развития этого страшного заболевания можно снизить на 5%, уверены авторы исследования.
Дело в том, что полиненасыщенные жирные кислоты омега-3, содержание которых особенно велико в жирной рыбе, орехах и злаках, помогают регулировать работу кровеносных сосудов, и участвуют в мозговой деятельности.
Ученые провели анализ данных 26 исследований по проблеме питания и рака, проведенных в США, Европе и Азии, в которых участвовали более 800 тысяч человек. Когда жирные полиненасыщенные кислоты поступают в организм через употребление морской рыбы, риск рака груди снижался на 14% у тех, кто употреблял такую пищу в большом количестве.
Наименее подвержены раку груди уроженки Азии. По всей видимости, уровень употребления рыбы в азиатских странах намного выше, чем в Европе, предполагают авторы исследования.
На 5% сокращается риск развития рака молочной железы при употреблении в день 0,1 грамма жирных кислот, содержащихся в морской рыбе, что равно одной – двум порциям рыбы еженедельно.
Для выяснения механизма защитного воздействия содержащихся в рыбе жирных кислот, ученым необходимы исследования, с участием добровольцев-людей.
Известная американская актриса, обладательница двух премий «Оскар» Анджелина Джоли призналась, что недавно сделала мастэктомию (хирургическое удаление грудной железы) из-за высокого риска у нее развития рака. Об этом Джоли написала в своей колонке, опубликованной в газете The New York Times с заголовкой «Мой медицинский выбор».
«Правда в том, что я ношу «дефектный» ген, BRCA1 [ген-супрессор, ответственный за развитие злокачественной опухоли молочной железы], который резко повышает риск развития рака молочной железы или яичников. Мои доктора оценили риск развития у меня рака молочной железы в 87%, а рака яичников — в 50%, хотя этот риск индивидуален для каждой женщины», — пишет Джоли.
По словам актрисы, осознав реальность, она решила действовать на опережение и по возможности максимально снизить угрозу развития опухоли. «27 апреля я закончила трехмесячный курс медицинских процедур в рамках мастэктомии», — отметила Джоли. Она призналась, что ее молочные железы были удалены и заменены имплантантами.
«Я хотела написать это, чтобы сказать другим женщинам, что решение сделать мастэктомии далось мне нелегко. Но я очень рада, что сделала это. Вероятность развития рака молочной железы у меня снизилась с 87% до 5%. Я могу сказать своим детям, что они не должны бояться потерять меня из-за рака», — пишет Анджелина Джоли.
Актриса также признает, что ей повезло иметь рядом любящего партнера (Джоли много лет живет в гражданском браке с актером Брэдом Питтом, пара вместе воспитывает троих приемных и троих родных детей). «Брэд находился в Pink Lotus Breast Center, где я лечилась, во время операций. Нам удавалось найти моменты, чтобы вместе посмеяться. Мы знали, что это правильно, что это необходимо для нашей семьи и что это сблизит нас. Так и произошло», — рассказал она.
Мать Анджелины Джоли Маршелин Бертран скончалась в 2007 году в возрасте 56 лет от рака.
источник