Гормональная терапия является эффективным методом лечения гормональнозависимых опухолей молочной железы. Иногда ее называют антиэстрогеновой терапией, так как она направлена на предотвращение воздействия эстрогена на онкологические клетки.
В Москве на онкологических болезнях (в том числе и на раке молочной железы) специализируются врачи Юсуповской больницы. Это одно из лучших учреждений по оснащенности, высококвалифицированным врачам, ценовой политике, качеству оказываемых услуг и сервису, в котором процент положительного исхода лечения один из самых высоких в стране.
В большинстве случаев гормональная терапия оказывает эффективное действие, так как 75% всех опухолей, расположенных в молочных железах, имеют гормонзависимую природу. В зависимости от общего состояния пациентки, стадии заболевания, характера течения, распространенности, менопаузального статуса доктор подбирает оптимальную схему лечения. Ее нужно строго придерживаться, ведь только так можно достичь положительного результата.
Показаниями к назначению гормональной терапии являются:
- снижение вероятности возникновения рака у женщин, которые не страдают этим заболеванием, но находятся в зоне высокого риска;
- снижение риска рецидивов при неинвазивном раке;
- снижение вероятности рецидива или появления новых опухолей после оперативного вмешательства, химиотерапии и лучевой терапии;
- уменьшение размеров опухоли при инвазивном раке;
- метастатический рак.
Гормонотерапию часто называют «страховкой» после применения других методов лечения рака, так как операция, лучевая терапия и химиотерапия не могут дать 100% гарантию, что пациентка не заболеет вновь. Препараты гормонотерапии оказывают влияние на весь организм, подавляя действие эстрогена, и назначаются только в случаях гормонозависимых опухолей.
В Юсуповской больнице применяется только лучшее диагностическое оборудование от производителей с мировым именем, полный перечень лекарственных препаратов (антибиотики, химиопрепараты, гормональные таблетки и инъекции).
- адъювантная (профилактическая);
- неоадъювантная;
- лечебная.
Применяется как дополнительная терапия после оперативного вмешательства, химического облучения и лучевой терапии с целью профилактики рецидивов. Обычно такая терапия длится от 5 до 10 лет, при этом доктор назначает препараты ингибиторов ароматазы или тамоксифен.
Неоадъювантная терапия представляет собой комплексное лечение перед проведением оперативного вмешательства или лучевой терапией. Она применяется в следующих случаях:
- для уменьшения размеров опухоли и ее метастазов;
- для уменьшения объема хирургического вмешательства;
- для увеличения безрецидивной и общей выживаемости;
- для определения чувствительности опухоли к цитостатикам;
- для оценки новых способов лечения.
Такая терапия длится от 3 до 6 месяцев, хотя при положительном результате лечение продлевается.
Назначается пациенткам с неоперабельным раком и при генерализации. Также лечебную терапию назначают молодым женщинам с метастазами в печень или легкие, а также в период ремиссии.
Выбор лечения рака молочной железы зависит от многих факторов, среди которых:
- гормональный статус обнаруженной опухоли;
- менопаузальный статус женщины;
- стадия заболевания;
- применяемые ранее способы лечения;
- наличие сопутствующих соматических болезней;
- риск развития рецидива.
После применения неоадъювантной терапии у 80% пациенток опухоль уменьшается в размерах, а у 15% — отмечена полная морфологическая ремиссия.
Все виды терапии применяются в Юсуповской больнице. Врач, учитывая состояние пациентки, природу опухоли и стадию заболевания, подберет оптимальную схему лечения, которая поможет в эффективном лечении.
Гормонотерапию при раке молочной железы подбирают в зависимости от того, сохранен ли у женщины менструальный цикл. Так, пациенткам в пременопаузе (менструальный цикл постоянный) назначают:
- тамоксифен сроком на 5 лет (на ранних стадиях заболевания);
- операцию по удалению яичников;
- после удаления яичников или подавления их функции с помощью медикаментов назначают ингибиторы ароматазы.
Женщинам в период менопаузы (пациентка находится в климактерическом или постклимактерическом состоянии):
- назначают ингибиторы ароматазы после хирургического вмешательства, химической и лучевой терапии;
- если пациентка до менопаузы принимала тамоксифен, то его заменяют ингибиторами ароматазы;
- если женщина принимала тамоксифен на протяжении последних 5 лет, то его заменяют фемарой;
- если при лечении тамоксифеном была выявлена новая опухоль или рецидив, то вместо него назначают ингибиторы ароматазы;
- если в период приема ингибитора ароматазы выявлен рецидив, то его заменяют на тамоксифен, фаслодекс или назначают другой ингибитор ароматазы.
Опухоли по своей природе могут быть доброкачественными и злокачественными. Если опухоль доброкачественная, при этом существует риск ее перехода в рак, то единственным препаратом, который назначается таким пациенткам, является тамоксифен. Также он применяется при обнаружении протоковой карциномы in situ.
Женщинам с HER2-позитивным раком предпочтительнее назначать ингибиторы ароматазы. Также они назначаются, если тамоксифен оказался нерезультативным.
Относится к группе антиэстрогенов и препятствует соединению эстрогенов с раковыми клетками, что, соответственно, не дает последним увеличиваться. Его назначают женщинам на ранних стадиях заболевания и в период предменопаузы.
Одно из торговых названий этого препарата – Тамоксифен-Нолвадекс (в таблетках). У некоторых пациенток при их приеме отмечается сухость влагалища или, наоборот, чрезмерные выделения, усиленное потоотделение, покраснение кожи, увеличение веса.
Эти препараты блокируют выработку эстрогенов в организме женщины и назначаются пациенткам уже после наступления менопаузы. Как показывает практика, многим женщинам удалось преодолеть рак молочной железы благодаря приему одного из этой группы препаратов (аримидекс, фемара, аромазин). Каждый препарат назначается в определенных случаях:
- аримидекс – на ранних стадиях заболевания сразу после удаления опухоли;
- аромазин – на ранних стадиях рака тем женщинам, которые ранее несколько лет принимали тамоксифен;
- фемара – на ранних стадиях болезни после оперативного вмешательства пациенткам, которые принимали тамоксифен 5 и более лет.
У большинства женщин прием этих препаратов не вызывает никаких негативных симптомов, но некоторые отмечают тошноту, сухость во влагалище и боль в суставах. Также длительный прием ингибиторов ароматазы может стать причиной хрупкости костей, поэтому вместе с данными препаратами параллельно назначают кальций и витамин Д.
Этот препарат является аналогом природного ЛГРГ и применяется для подавления работы гипофиза. Он снижает количество гормонов, которые вырабатывают эстрогены, но при прекращении его приема гипофиз начинает работать в усиленном режиме. Поэтому врачи после нескольких месяцев приема золадекса рекомендуют операцию по удалению яичников (овариоэктомию) хирургическим способом или путем облучения.
Побочное действие препарата заключается в снижении полового влечения, покраснении, сильном потоотделении, головных болях, перепадах настроения. Золадекс вводят внутримышечно в нижнюю часть брюшной стенки 1 раз в месяц.
Несмотря не огромную пользу, гормонотерапия имеет ряд негативных последствий. Примерно половина женщин, которым назначается гормонотерапия при раке молочной железы, отмечают:
- увеличение массы тела;
- потливость;
- отечность;
- сухость влагалища;
- преждевременное наступление менопаузы;
- перепады настроения, депрессия.
Широко используемый препарат тамоксифен может стать причиной образования тромбов, рака матки и бесплодия. Препараты, которые направлены на снижение уровня эстрогенов (ингибиторы ароматазы), в некоторых случаях приводят к остеопорозу, повышению холестерина, заболеваниям ЖКТ. При появлении вышеперечисленных симптомов следует немедленно обратиться к доктору. Он сможет подобрать другие оптимальные лекарства.
С момента обнаружения опухоли в молочной железе женщине нужно пересмотреть свой рацион. Правильно подобранная диета позволит значительно улучшить общее самочувствие и снизить риск дальнейшего развития заболевания.
Питание при раке должно быть максимально сбалансированным, с большим количеством витаминов и микроэлементов. Кушать необходимо часто, но маленькими порциями, при этом придерживаться принципа раздельного питания.
Врачи Юсуповской больницы считают, что питание при гормонотерапии рака молочной железы должно быть именно таким:
- употреблять много ярко окрашенных овощей и фруктов (морковь, тыква, томаты, капуста, клюква, чеснок) и злаков (коричневый рис, пророщенная пшеница, отруби);
- калорийность рациона должна зависеть от веса пациентки: женщинам с лишним весом с помощью диеты нужно попытаться избавиться от лишних килограммов;
- уменьшить количество животных жиров в рационе и увеличить количество растительных;
- употреблять пищу, богатую кальцием и витамином Д;
- отказаться от продуктов, в состав которых входят фитоэстрогены;
- полностью исключить копченую, жареную, соленую, острую пищу и продукты с консервантами;
- ограничить количество сахара (в том числе и напитков с его содержанием);
- полностью отказаться от алкоголя, курения и наркотических средств;
- как можно меньше кушать красное мясо;
- обязательно добавить в рацион морскую рыбу, морепродукты, морскую капусту;
- ежедневно употреблять 1-2 порции молочных продуктов;
- пить как можно больше сырой воды (не менее 2-2,5 л в день), зеленого чая и отваров из травяных сборов.
В Юсуповской больнице есть все необходимое оборудование для диагностики и лечения заболевания, а при выявлении образования в молочной железе в лаборатории можно сделать анализ на определение его природы.
Важно заметить, что каждая женщина в возрасте после 35 лет должна раз в год посещать маммолога чтобы исключить вероятность патологических образований в груди. Это можно сделать в Юсуповской больнице, которая находится по адресу: 117186, г. Москва, ул. Нагорная, д.17, корп.6, предварительно записавшись на прием.
источник
Процессы роста и размножения всех клеток в организме находятся под жестким регулирующим контролем генов, которые способных запускать или останавливать их. В норме в организме поддерживается баланс между появлением новых клеток и гибелью старых. В опухолевых клетках процессы размножения клеток выходят из под контроля. Зачастую это происходит по причине возникновения «сбоев» в работе определенных генов, играющих наиболее важную роль в контроле над делением клеток.
HER2 (аббревиатура от английского human epidermal growth factor receptor 2 – рецептор фактора роста эпидермиса) является одним из таких генов. Этот ген может также обозначаться как «HER2-neu» или «ERBB2», эти названия являются синонимами. Его неправильная работа обнаруживается во многих случаях развития рака молочной железы и приводит к активной выработке в клетках одноименного белка (HER2), что заставляет клетки быстро делиться. Когда в клетке образуется избыточное количество белка HER2, говорят об амплификации этого гена. Амплификация HER2 обнаруживается примерно у 25% пациенток с диагнозом рака молочной железы. Её наличие приводит к повышению агрессивности опухолевых клеток. Вследствие высокой важности знания HER2-статуса опухоли, определение наличия амплификации HER2 является или избыточной выработки белка HER2 является одним из стандартных методов обследования, и проводится у всех пациенток с диагнозом рака молочной железы. Кроме того, в ряде исследований была продемонстрирована клиническая значимость выработки HER2 при раке желудка, по этой причине препараты, подавляющие активность этого белка также применяются для лечения рака желудка.
Изначально HER2-позитивный рак молочной железы был одним из наиболее агрессивных разновидностей этого заболевания, который характеризовался очень быстрым темпом роста опухоли, высоким риском развития рецидива болезни и появления отдаленных метастазов. Тем не менее, в настоящее время разработано множество препаратов, подавляющих активность этого белка (см. ниже). Они продемонстрировали высокую эффективность в лечении HER2-положительного рака молочной железы, превратив этот подтип рака в один из относительно благоприятных вариантов заболевания. Проведение целенаправленной («таргетной») терапии, блокирующей активность HER2, позволяет значительно повысить эффективность лечения и резко снизить риск развития рецидива рака молочной железы или добиться длительного контроля над болезнью в случае лечения её поздних стадий.
Необходимо отметить, что применение препаратов, блокирующих активность HER2, целесообразно только в том случае, если в опухоли есть повышенная выработка этого белка вследствие наличия амплификации гена HER2. Если она отсутствует, раковые клетки не вырабатывают этот белок, следовательно, назначение препаратов, блокирующих активность этого белка не приведет к желаемому результату. По этой причине перед началом лечения всем пациенткам с диагнозом рака молочной железы перед началом лечения проводится специальное обследование, направленное на определение повышенной выработки HER2. Эта информация критически важна для правильного лечения рака молочной железы.
В процессе диагностики рака молочной железы небольшой кусочек опухолевой ткани путем биопсии забирается для проведения иммуногистохимического исследования. Как правило, одновременно проводится определение наличия экспрессии (выработки) опухолевыми клетками рецепторов женских половых гормонов, HER2-статуса опухолевых клеток, а также темпов её роста (индекс Ki-67). При проведении этого исследования на опухолевые клетки наносятся специальные «красители», которые окрашивают HER2 в случаях, когда он содержится в клетках в большом количестве. Иммуногистохимическое исследование оценивает наличие гиперпродукции белка HER2 опухолевыми клетками.
По результатам иммуногистохимического определения HER2 статуса опухоли может быть получен один из следующих результатов:
0 баллов – в опухоли не отмечено признаков экспрессии HER2 (результат исследования отрицательный, назначение анти-HER2 препаратов нецелесообразно);
1+ — в опухолевых клетках обнаружена незначительная экспрессия HER2 (результат исследования отрицательный);
2+ — в опухолевых клетках обнаружена умеренная экспрессия HER2 (результат сомнительный, требуется проведение дополнительного исследования, см. ниже);
3+ — в опухолевых клетках обнаружена повышенная экспрессия HER2 (результат положительный, назначение анти-HER2 препаратов целесообразно).
Если по результатам иммуногистохимического исследования была выявлена выраженная экспрессия HER2 (3+), пациентке показано назначение препаратов, блокирующих активность этого белка, так как опухолевые клетки активно вырабатывают этот белок и процессы их роста зависят от его функционирования. Если результат исследования отрицательный (0 или 1+) назначение такого лечения не приведет к желаемому результату.
Получение сомнительного результата (2+) означает, что по результатам иммуногистохимического исследования достоверно определить наличие экспрессии HER2 не удалось и необходимо проведение дополнительных методов исследования, например, т.н. «флюоресцентной гибридизации in situ» (FISH) или схожего с ней метода CISH. Эти методы позволяют напрямую оценить наличие амплификации HER2. По результатам проведения этих тестов может быть получен положительный или отрицательный ответ. Положительный ответ означает, что была выявлена амплификации HER2 и целесообразно назначение анти-HER2 терапии.
На данный момент разработано и внедрено в клиническую практику 4 препарата, подавляющих активность HER2. Они несколько различаются по структуре и механизму действия, а также по показаниям к применению, эти лекарства могут назначаться как в комбинации с другими препаратами, например химиотерапевтическими агентами, так и самостоятельно (в монотерапии). В этом разделе представлено краткое описание этих препаратов.
Трастузумаб – лекарственный препарат, который представляет собой белок (моноклональное антитело), сконструированный таким образом, чтобы избирательно связываться с HER2 и «закрывать» его, не давая ему возможности нормально функционировать и провоцировать процессы роста и деления опухолевых клеток. Трастузумаб является препаратом, который наиболее часто назначается пациенткам с HER2-положительным раком молочной железы. Он применяется в сочетании с химиотерапией в качестве пред- или послеоперационной терапии данного заболевания, а также для первоначального лечения поздних его поздних стадий. Препарат выпускается как в виде раствора для внутривенных капельных введений, так и в виде раствора для подкожных введений. Трастузумаб-эмтанзин (T-DM1) – комбинированный препарат, который содержит молекулы трастузумаба, соединенные с противоопухолевым препаратом эмтанзином, который оказывает губительное действие на клетки. Препарат сконструирован таким образом, что молекулы трастузумаба связываются со своей мишенью на поверхности опухолевых клеток, после чего эмтанзин проникает в них и вызывает гибель раковых клеток. Помимо лечения рака молочной железы трастузумаб также применяется для лечения рака желудка в случае выявления в опухоли гиперэкспрессии HER2. Препарат вводится внутривенно капельно.
Пертузумаб – также как и трастузумаб, пертузумаб представляет собой моноклональное антитело к HER2, однако в отличие от трастузумаба он связывается с другим участком этого белка. Препарат назначается в комбинации с трастузумабом и позволяет повысить эффективность лечения. Препарат вводится внутривенно капельно.
Лапатиниб – препарат, блокирующий сигнальный путь, который проводит сигналы от HER2. Препарат применяется для лечения пациенток, у которых было отмечено прогрессирование на фоне применения режимов лечения с использованием трастузумаба, а также для лечения HER2-положительного гормонозависимого рака молочной железы, в этом случае лапатиниб применяется в комбинации с гормонотерапией. Препарат выпускается в виде таблеток и принимается внутрь.
Указанные препараты назначаются только пациенткам с HER2-положительными опухолями (экспрессия HER2 3+ при проведении иммуногистохимического исследования или выявленная амплификация гена при проведении FISH или схожего метода исследования).
Необходимо отметить, что HER2 статус опухоли может меняться в процессе проведения лечения как результат изменений, происходящих в раковых клетках. Клетки опухоли ищут способ выжить на фоне проводимой терапии и постоянно изменяются. Например, в случае, если произошел рецидив исходно HER2-положительной опухоли, во вновь выявленных опухолевых очагах может отмечаться исчезновение выработки этого белка и утрата зависимости опухолевых клеток от влияния этого гена. Возможно и обратное – появление гиперэкспрессии HER2 в опухолях, которые исходно не вырабатывали этот белок. По этой причине в случае развития рецидивов или появления метастазов врач может рекомендовать повторное проведение биопсии и проведение нового тестирования для определения HER2 статуса опухоли.
источник
Герцептин — первый таргетный препарат, разработанный для лечения больных раком молочной железы (РМЖ) более 10 лет назад.
Процесс производства герцептина начинается с иммунизации мышей фрагментом HER-2-белка, отбора антителопродуцирующих В-лимфоцитов мышей и слияния последних с бессмертными клетками миеломы.
В результате образуются клеточные гибриды, которые могут бесконечно пассироваться в условиях лаборатории и служить неограниченным, хорошо воспроизводимым источником выработки антител.
При введении человеку такие моноклональные антитела (МКАт) вызывают реакцию иммунного отторжения. Для предотвращения иммунологической реакции методом генной инженерии наиболее активную часть мышиного антитела «вырезают» и встраивают в каркас человеческого антитела, в результате получается химерный гибрид с содержанием специфического мышиного фрагмента не более 5%, что позволяет исключить реакцию отторжения (рис. 5).
Рис. 5. Строение гуманизированного МКАт к HER-2 — герцептина.
В результате введения герцептина блокируется путь HER-зависимого сигнального каскада, приводящего к инициации клеточного деления, поддержанию жизнеспособности клеток, инвазии, метастазированию и клеточному делению. Кроме того, препарат обладает антиангиогенной активностью, ингибирует синтез TGF-p, ангиопоэтина-1, ингибитора активатора плазминогена-1 (PAI-1) и, возможно, VEGF. Кроме того, описана индукция герцептином синтеза тромбоспондина-1 (ингибитор ангиогенеза).
В 1998 г. герцептин был зарегистрирован в качестве противоопухолевого препарата для лечения HER-позитивного метастатического РМЖ, сначала во 2-3-й линии лечения метастатического рака молочной железы, затем как компонент 1-й линии терапии в комбинации с паклитакселом (исследования HO648g и HO649g).
Следующим важным этапом стала регистрация в 2006 г. герцептина в качестве первого таргетного прапарата, одобренного для использования в адъювантном режиме у больных РМЖ. В основу регистрации препарата легли результаты исследования HERA (с включением 5081 больного) и исследований NSABP B-31 и NCCTG N9831 (3500 пациенток).
В исследование HERA, проводившееся c декабря 2001 по март 2005 г. в различных центрах мира, была включена 5081 пациентка с ранними стадиями рака молочной железы и гиперэкспрессией HER-2; все пациентки до начала исследования полностью завершили стандартное неоадъювантное или адъювантное лечение: операция ± лучевая терапия; как минимум 4 курса химиотерапии: антрациклины (максимальная кумулятивная доза не более 360 мг/м2 для доксорубицина или не более 720 мг/м2 для эпирубицина) и/или таксаны или CMF.
При наличии положительного рецепторного статуса больным назначали эндокринотерапию в течение 5 лет. Больные были рандомизированы на 3 группы: 1694 пациентки получали герцептин в течение 1 года, 1694 — герцептин в течение 2 лет и 1693 пациентки составили группу контроля (рис. 6).
Рис. 6. Дизайн исследования HERA.
Средний возраст пациенток 49 лет, 2/3 больных имели метастазы в подмышечных лимфатических узлах, у 48% женщин обнаружены негативные в отношении гормональных рецепторов опухоли. Обязательным условием включения больных в исследование HERA было сохранение фракции выброса левого желудочка на уровне 45% и более (по данным эхокардиографии или MUGA).
В группе терапии герцептином было зафиксировано 127 неблагоприятных исходов против 220 в группе наблюдения (табл. 7).
Таблица 7. Исследование HERA: частота неблагоприятных исходов
| Первый рецидив РМЖ, число больных (%) | Конкурирующие события, число больных (%) | |||||
| локальный | регионарный | отдаленный | летальный исход не вследствие прогрессирования | |||
| Л (1546 больных) | 12 (0,77) | 7 (0,45) | 112 (7,2) | 18 (1,6) | 64 (4,1) | 35 (2,3) |
| Т->Л (1548 больных) | 14 (0,9) | 2 (0,12) | 130 (8,4) | 19 (1,2) | 65 (4,2) | 25 (1,6) |
| Л->Т (1540 больных) | 17 (1,1) | 6 (0,39) | 105 (6,8) | 16 (1,0) | 59 (3,8) | 33 (2,1) |
Примечание: Л — летрозол, Т — тамоксифен.
В рамках проведенного анализа было выявлено преимущество летрозола по сравнению с терапией тамоксифеном в снижении доли ранних рецидивов (в течение 2 лет после рандомизации): 2,5% против 4,1%, причем разница в доле ранних рецидивов более выражена у больных с N(+)-статусом лимфатических узлов.
Преимущества в терапии летрозолом имеют пациентки с крупными опухолями и наличием сосудистой инвазии. Согласно данным BIG 1-98, результаты последовательного режима летрозол — тамоксифен соответствовали результатам монотерапии летрозолом, что может быть объяснено переносимой пользой первоначальной терапии препаратом.
Этот факт указывает на возможность переключения на тамоксифен после 2 лет адъювантной терапии летрозолом в случае необходимости с целью завершения 5-летней эндокринной терапии.
Исследование BIG 1-98 показало, что профиль токсичности тамоксифена, летрозола и их комбинированных режимов различен: при приеме тамоксифена чаще отмечены тромбоэмболические осложнения, вагинальные кровотечения, приливы и ночное потоотделение, в то время как при применении летрозола преобладали гиперхолестеринемия, артралгия, миалгия и переломы костей.
В целом во всех группах лечения отсутствовали какие-либо непредвиденные угрожающие жизни нежелательные явления, что делает проведение эндокринной терапии у больных РМЖ в постменопаузе многообещающим.
Таким образом, многочисленные исследования по адъювантной эндокринной терапии гормоночувствительного рака молочной железы показали, что тамоксифен остается эффективным препаратом, снижающим риск рецидива болезни и риск смерти от ее прогрессирования. Применение ИА существенно расширяет возможности адъювантной эндокринотерапии.
Оптимальной стратегией является переход на прием ингибиторов ароматазы после 2-3 лет приема тамоксифена. В качестве ранней адъювантной гормонотерапии ИА могут иметь преимущество перед тамоксифеном у пациенток с высоким риском рецидива, а также при противопоказаниях к приему тамоксифена (гиперпластические процессы в эндометрии, гиперкоагуляция, тромбоэмболии и тромбофлебит в анамнезе и др.).
Необходимо отметить, что даже через 5 лет после адъювантной эндокринной терапии у женщин с ранними стадиями РЭ- и ПЭ-положительного рака молочной железы продолжают развиваться рецидивы болезни. Очевидно, дальнейшие исследования (SOLE; NCT00553410) определят оптимальный срок эндокринной терапии, обеспечивающий максимальный срок жизни больных без признаков заболевания.
И.В. Поддубная, Д.В. Комов, И.В. Колядина
источник
Рак молочной железы относят к гормонозависимым опухолям, поэтому очень действенным считается проведение гормонотерапии при раке молочной железы.
Гормонотерапия это один из способов терапии онкологии молочной железы, среди которых химиотерапия, радиотерапия и хирургический способ лечения. Гормонотерапия преследует своей целью уменьшить воздействие гормона эстрогена на раковое новообразование.
Метод лечения гормонами составляет специалист, он учитывает стадию заболевания, статус менопаузы женщины, риск рецидивного возникновения раковой опухоли. Очень важно сочетать лечение онкологии груди с другими заболеваниями, так их присутствие может усилить побочные эффекты.
При лечении такого вида рака применяются различные виды лечения, в постменопаузе отличный результат выдают лекарственные препараты, которые понижают выработку гормона эстрогена, а в репродуктивном возрасте применяют релизинг-гормоны.
Назначение гормональной терапии показано, если биопсия показала, что рак является гормонозависимым и это делает лечение в 70% случаев успешным.
Гормонозависимая опухоль груди появляется, если повышается гормон эстроген, а его повышение возможно при использовании его при лечении:
- поликистоза яичников;
- нарушений месячных;
- миомы матки.
К группе риска можно отнести женщин, которые:
- имеют сбои в работе яичников;
- сделали аборт;
- имели угрозу выкидыша;
- перенесли замершую беременность.
Симптомами гормонозависимой опухоли груди считаются:
- увеличение лимфоузлов;
- боли в месте новообразований;
- появление уплотнений.
Показателями для рекомендации лечения гормонотерапией при гормонозависимых опухолях являются:
- наследственный фактор;
- внушительные размеры опухоли;
- рак на последней стадии;
- метастатический рак;
- для предотвращения рецидива после лечения карциномы;
- возникновение метастаз.
Уменьшение уровня эстрогенов и прогестерона в крови проявляет, в общем, положительное воздействие на здоровье женщины, это снижает вероятность рецидива гормонозависимого заболевания.
Гормонотерапию целесообразнее проводить в сочетании с прочими способами лечения. Назначение лечения гормональными препаратами проводят при:
- Вероятности появления метастазов;
- Различных уплотнениях после проведения операции;
- Раке, не поддающегося химиотерапии;
- Росте новообразования в отсутствии роста онкоклеток.
Запомните! Терапия рака молочной железы при помощи гормонотерапии разрешает одновременно несколько проблем, каждая из которых требует использование определенного препарата.
Выбор метода воздействия зависит от некоторых факторов:
- Предыдущих способов лечения;
- Гормонального статуса раковой опухоли;
- Стадии онкологического заболевания;
- Непереносимости препаратов;
- Сопутствующих диагнозов (некоторые болезни ухудшают прогнозы основного заболевания);
- Периода жизни пациента – пре- и постменопауза.
Так же при назначении лечения требуется знать, присутствуют ли в опухоли рецепторы к гормонам, и к которым именно. От гормонального статуса заболевания зависит и назначение лечения. Наиболее благоприятный прогноз, когда есть рецепторы одновременно к прогестерону и эстрогену, также бывают случаи:
- Негативности ко всем гормонам;
- Неизвестного гормонального статуса;
- Чувствительности только к эстрогену (прогестерону), когда рецептор эстрогена (прогестерона) позитивный.
Гормонотерапия рака молочной железы (РМЖ) подразделяется на три вида:
- Адъювантная гормонотерапия может длиться около 5-10 лет, она выполняется для уменьшения риска рецидива карциномы;
- Неоадъювантная гормонотерапия проводится в промежутке 3-6 месяцев, ее назначают перед операцией, когда опухоль более 2 см и в процесс втянуты лимфоузлы;
- Лечебная гормонотерапия применяется при неоперабельных опухолях или для уменьшения и устранения раковых очагов (больше 2 стадии (2а)).
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
Можно выделить несколько ведущих видов гормонального лечения, любой из которых имеет отдельный механизм воздействия: понижение уровня эстрогена в крови, прекращение его выработки или ее уменьшение:
- Ингибиторы ароматазы. Они оказывают влияние на концентрацию эстрогенов, блокируя рецепторы и не давая клеткам размножаться и делиться. Такие ингибиторы прописываются больным после наступления менопаузы. Можно выделить 3 вида ингибиторов ароматазы при онкологии груди: Фемара, Аримидекс, Аромазин. Но эти препараты могут привести к повышению хрупкости костей. При приеме подобных препаратов назначается кальций с витамином D, для предотвращения остеопороза;
- Блокираторы эстрогеновых рецепторов, при эстрогенозависимых опухолях. Эти препараты предотвращают воздействие на клетки раковой опухоли. К таким препаратам можно отнести: Фулвестрант, Фазлодекс;
- Модуляторы рецепторов к эстрогенам, которые останавливают выработку эстрогенов. Это антиэстрогенные препараты в таблетках: Кломифен, Тамоксифен;
- Прогестины, которые уменьшают выработку определенных гормонов гипофиза, которые ответственны за появление андрогенов и эстрогенов;
- Воздействие на яичники — еще один способ гормонотерапии. Таких способов три: медикаментозный (инъекции Золадексом или Люпроном), хирургический (удаление яичников — овариэктомия), радиационное облучение.
При лечении возможны побочные эффекты, появление которых зависит от множества факторов: стадии онкологического заболевания молочной железы, когда было получено лечение, возрастной категории пациентки, общего состояния здоровья, схемы назначенного лечения. Самыми частыми побочными эффектами являются:
- Преждевременный климакс и сопутствующие ему симптомы – приливы, увеличение веса и т.д.;
- Отечность ног;
- Проблемы со сном;
- Нарушение пищеварения (запоры или поносы);
- Боли в деснах;
- Сухость влагалища;
- Тошнота или рвота;
- Алопеция;
- Усиленная потливость;
- Депрессия;
- Ухудшение памяти.
В основном, эти симптомы через непродолжительное время проходят (спустя несколько недель по завершению лечения гормонами), иногда может продолжаться до 2 месяцев.
Ингибиторы ароматазы могут спровоцировать возникновения остеопороза, повышают холестерин в крови, могут вызвать проблемы с ЖКТ и приводят к алопеции.
Тамоксифен повышает риск тромбообразования, гепатита, является фактором риска для возникновения рака матки и проблем бесплодия.
Золадекс и Люпрон вызывают скачки давления, артралгию, депрессию.
После хирургического удаления яичников может нарушаться водно-солевой обмен, может развиться алкалоз, поднятие уровня сахара в крови, также может диагностироваться синдром Кушинга и язвенные поражения органов ЖКТ.
При приеме прогестинов возможно прибавление веса, выпадение волос, тромбоэмболические осложнения.
Диета при лечении гормонотерапией может понизить вероятность появления рецидива заболевания. В питании предпочтение надо отдавать отварным или тушеным блюдам, исключив полностью жареное. Также ограничения касаются употребления сахара, солений, жиров животного происхождения. Полностью исключить требуется:
- Консерванты;
- Кофе;
- Сою;
- Фастфуд;
- Продукты с пищевыми добавками;
- Алкоголь.
Из мясных блюд желательно употреблять нежирные сорта мяса, рекомендуется добавлять в пищу лук и чеснок. Пить побольше жидкости, простой воды. В рационе должны присутствовать следующие продукты:
- Морепродукты;
- Крупы;
- Фрукты;
- Растительные жиры;
- Жирная морская рыба;
- Морская капуста;
- Яйца;
- Овощи;
- Молочные продукты.
Эффективность гормонотерапии при онкологии молочной железы зависит от размера опухоли, также играет немаловажную роль наличие сопутствующих заболеваний и иммунитет пациентки.
Эффективность лечения гормонотерапией довольно высока, но требуется соблюдение всех рекомендаций врача, в том числе относительно питания.
Прогнозы гормонотерапии довольно оптимистичны, особенно, если гормонозависимая опухоль имеет рецепторы, и прогестерона, и эстрогена, тогда эффективность лечения составляет – 70 % случаев, при нахождении в опухоли, хотя бы одного из гормонов – эффективность составляет 30%. При прочих видах карциномы груди эффективность терапии составляет всего лишь 10%. При опухоли, которая считается негормонозависимой, такой тип лечения применять нецелесообразно.
Нужна ли гормонотерапия после мастэктомии?
Для предотвращения появления метастаз гормонотерапию могут назначить после хирургического вмешательства.
источник
Женские гормоны – эстроген и прогестерон — влияют на злокачественные опухоли молочной железы. Врачи описывают эти виды рака груди как эстроген-рецептор положительный или прогестерон-рецептор положительный рак груди.
Соответственно, гормонотерапия при раке груди предотвращает попадание гормонов к злокачественным клеткам молочной железы.
Препараты гормонотерапии при раке молочной железы блокируют либо ферменты, участвующие в синтезе эстрогенов, либо блокируют связь рецептора, находящегося на поверхности клетки опухоли, и эстрогенов. Поэтому для гормональной терапии при раке молочной железы применяются разные лекарственные препараты.
- Блокирует рецепторы к эстрогенам и прогестерону
Когда эстроген связывается с рецепторами, он стимулирует рост и деление клеток опухоли. Препараты данного класса (например, Тамоксифен) блокирует рецепторы на поверхности клеток, тем самым не позволяя эстрогену связаться с ними. - Снижает уровень эстрогенов, образующихся в яичниках
Ингибиторы блокируют фермент ароматаза, не допуская трансформации андрогенов в эстрогены. Препараты ингибиторов ароматазы в гормонотерапии рака молочной железы – это анастрозол (Аримидекс), экземестан (Aromasin), летрозол (Фемара). - Подавляет функцию гипофиза
Также за количество гормонов, которые вырабатываются яичниками, отвечает гипофиз. Женщинам, которые не достигли менопаузы, назначают блокаторы, которые предупреждают выработку яичниками эстрогена или прогестерона, то есть подавляют сигнал, передаваемый от гипофиза к яичникам. Единственный лекарственный препарат этого класса, который используется при раке молочной железы – гозерелин (Золадекс).
Решение о проведении гормонотерапии у пациенток с раком молочной железы применяется после определения гормонального статуса опухоли. Для этого в обязательном порядке выполняется иммуногистохимическое исследование.
Это зависит от стадии распространения опухоли. Профилактическая или адъювантная гормонотерапия проводится после хирургического вмешательства, она направлена на предупреждение развития рецидива заболевания после проведенного радикального лечения. А лечебная гормонотерапия назначается при метастатическом раке молочной железы, то есть при распространенной стадии заболевания.
В настоящее время под термином «овариоэктомия» нередко подразумевается «выключение функции яичников», которое может быть осуществлено не только хирургическим вмешательством (удалением яичников), но и лекарственным методом (препарат гозерелин — Золадекс).
В отличие от лекарственного метода удаление яичников является необратимой мерой, в то время как при использовании гормонотерапии яичники могут восстанавливать свою функцию. Особенно, если речь идет о женщинах до 45 лет.
В государственных учреждениях применяют хирургическое вмешательство, то есть двухстороннее удаление яичников, так как это – экономически выгоднее. Однако овариоэктомия провоцирует быструю, резко возникающую нехватку эстрогенов, что чревато значительным количеством побочных эффектов:
- Среди негативных последствий овариоэктомии следует выделить усталость, апатию, увеличение массы тела, проблемы с памятью, перепады настроения и депрессию, образование тромбов, а также нарушения в костях (остеопороз).
- Осложнения овариоэктомии носят отсроченный, но ярко выраженный характер. Так как нехватка эстрогенов возникает внезапно, то организм отвечает бурно, и все вышеперечисленные осложнения носят ярко выраженный характер, что значительно ухудшает качество жизни молодой женщины.
- В отличие от хирургического вмешательства, при гормонотерапии отсутствует резкая смена гормонального статуса организма, поэтому все побочные эффекты проявляются минимально.
Именно из-за выраженности побочных эффектов при проведении хирургических методов гормонотерапии мы рекомендует отдавать предпочтение лекарственным методам гормональной терапии при раке груди, успешно применяемым на протяжении долгого времени в нашей клинике. Они характеризуются минимальными побочными эффектами и максимальным лечебным воздействием.
Для подбора гормонотерапии при раке молочной железы запишитесь на консультацию онколога, и мы назначим вам оптимальную тактику лечения, учитывая все необходимые факторы.
Сотрудники медицинской школы Уорикского университета (Warwick Medical School, University of Warwick) в Великобритании пришли к выводу о том, что при проведении гистерэктомии у женщин в период пременопаузы желательно не проводить удаление обоих яичников. Несмотря на то, что выполнение двусторонней овариоэктомии связано с уменьшением риска развития рака яичников, в то же время повышается смертность от ишемической болезни сердца (ИБС) и любых видов рака. Всего в исследование были включены данные более 113 тыс. женщин.
источник
Рецептор HER 2 — это белковая молекула или так называемый белок HER 2, который необходим для нормального развития клеток. Через рецепторы НЕR 2 организм осуществляет контроль процесса роста, деления, а также самовосстановления здоровых клеток молочной железы. Однако раковые клетки груди имеют повышенное количество рецепторов HER 2, стимуляция которых способствует ускорению роста клеток. В итоге, примерно у 25% пациентов с раком молочной железы клетки после получения ошибочной команды начинают усиленно делиться и бесконтрольно разрастаться.
Рак молочной железы с показателем нормального, не повышенного содержания гена HER2 и рецептора HER2 имеет название HER 2 — негативный. Данный вид рака определяется у 75% пациентов с заболеванием рак молочной железы.
Рак молочной железы с показателем повышенного содержания (амплификацией) гена HER 2 или ускоренной выработкой (оверэкспрессией) рецептора HER2 имеет название HER 2-позитивный. Он признан особо агрессивным. Его диагностируют только в 25% случаях рака молочной железы. Рост HER 2-позитивных злокачественных опухолей намного быстрее, чем HER 2-негативных. Однако, HER 2 -позитивный рак молочной железы поддается лечению специальными препаратами Герцептин и Лапатиниб, которые не имеют эффекта при лечении HER2-негативного рака.
Кроме того, стоит помнить, что в 30% случаев HER 2-позитивный рак молочной железы со временем превращается в HER2 -негативный.
Проведенное исследование доказало эффективность Герцептина для снижения риска рецидива заболевания у женщин с ранним раком груди. Не так давно для предотвращения рецидива применялась химическая терапия и гормональная терапия, однако не всегда успешно. После того, как вместе с химической терапией стали применять Герцептин, риск возникновения рецидива сократился вдвое.
Лицензирование Герцептина состоялось в 2006 году в Великобритании. Данный препарат зарекомендовал себя как возможный вариант лечения после проведения хирургического вмешательства и дополнительно химио-радиотерапии.
Применение гормонотерапии способствует замедлению или блокировке роста злокачественных клеток молочной железы. Эффект гормональной терапии достигается за счет изменения уровня женских гормонов, производимых собственным организмом, и предотвращения уничтожения гормонов злокачественными клетками опухоли.
Гормональная терапия применима в тех случаях, когда у раковых клеток присутствуют эстроген- или прогестерон-позитивные рецепторы. Кроме того, для определения эффективности гормонотерапии необходимо определить статус HER 2, показатель которого также является значимым при выборе метода лечения.
Для определения HER2 статуса рака молочной железы, а именно для выявления повышенного уровня гена HER 2 в опухолевых клетках применяются специальные тесты из ткани опухоли, взятого при биопсии. Тесты могут проводиться и одновременно с начальным этапом хирургического вмешательства.
Варианты тестов:
1. Иммуногистохимическое исследование (ИГХ) является недорогим, но и сравнительно точным методом определения HER 2 статуса. Данное исследование позволяет по гистологическому материалу определить показатель HER 2 протеина в опухолевых клетках молочной железы с использованием специальной окраски. Чем выше показатель количества HER2 рецепторов, тем ярче окраска. Результат зависит от показателя интенсивности окраски и полноты окрашивания клеточной мембраны и определяется по шкале от 0 до 3+ . Окрашивание, полностью окружающее контур клеточной мембраны, определяется как 2+ или 3+. Частичное, неполное — как 1+. При показателе 0 амплификация (накопление) гена HER 2 отсутствует. При показателях 1+ и 2+, рекомендовано FISH-исследование для уточнения HER2 статуса.
2. тест FISH (флуоресцентная гибридизация) FISH — наиболее точное исследование для выявления повышенного уровня гена HER 2 в опухолевых клетках молочной железы.
Показатели FISH теста разделяют рак молочной железы на:
HER2 — позитивный рак (при наличии амплификации гена HER2);
HER2 — негативный (при отсутствии амплификации гена HER2).
3. тест SPOT-LIGHT HER 2 CISH
Тест под названием SPoT-Light HER2 CISH также выявляет повышенное содержание (амплификацию) гена HER2 в опухолевых клетках молочной железы. Тест введен в практику с 2008 года и используется до настоящего времени.
Показатели проведенного SPoT-Light HER 2 CISH теста делятся на:
HER2 — позитивный рак молочной железы (при наличии амплификации гена HER2)
HER2 — негативный рак молочной железы (при отсутствии амплификации гена HER2)
4. тест INFORM HER 2 DUAL ISH
Новейший тест Inform HER2 Dual ISH, одобренный в США, используется с июня 2011 года.
Показатели результатов теста SPoT-Light HER2 Inform HER2 Dual ISH аналогичны вышеуказанным тестам и также подразделяются на позитивный и негативный рак молочной железы. Для получения дополнительной информации обратитесь к разделу Часто задаваемые вопросы
• инновационная терапия;
• как получить квоту в онкоцентр;
• участие в экспериментальной терапии;
• помощь в срочной госпитализации.
Отправьте копии мед.документов и
чека оплаты 1500 рублей
(реквизиты)
источник
Гормонотерапия рака молочной железы (или антигормональная терапия) назначается химиотерапевтом на основании данных иммуногистохимического (ИГХ) исследования опухоли (наличие эстроеновых и/или прогестиновых рецепторов — ER и/или PR, Her2/Neu, Ki 67), и гистологического исследования (размер опухоли и признаки поражения лимфатических узлов метастазами).
Чувствительность опухоли к гормонам в анализе обозначается либо в баллах (от 0 до 10) или числом (от 0 до 300) или качественно: слабо, умеренно, сильно-чувствительная опухоль. Прогностически наличие у опухоли чувствительности к гормонам — хороший признак: есть ещё один способ на неё воздействовать (кроме химиотерапии). При такой опухоли гормональная терапия помогает сдерживать её рост. Выживаемость в группе пациентов с гормон-позитивной опухолью — выше, чем при гормон-негативной опухоли.
В теории, даже если до операции у Вас не были выявлены метастазы опухоли (в костях, лёгких и печени) — гарантировать этого на 100% невозможно. Там могли быть единичные опухолевые клетки, которые просто не видны при УЗИ, рентгенографии, ОСГ, КТ, МРТ, ПЭТ этих органов. Для того, чтобы они не развивались назначается гормонотерапия.
| Подробнее о принципах лечения рака молочной железы можно посмотреть ЗДЕСЬ (для специалистов). |
Зарубежные коллеги для назначения лечения применяют систему Adjuvantonline, тесты Oncotype DX и MammaPrint. В нашей стране использование данных тестов не оплачивается страховыми компаниями, а потому их выполнение может быть организовать только за счёт пациентов (стоимость аналогична той, как если бы Вы оплачивали её за рубежом). Смысл этих тестов в том, что в ряде случаев (когда по стандартам рутинно назначается химиотерапия и гормонотерапия) по результатам генетических тестов лечение может быть изменено за счёт отказа от химиотерапии только в пользу гормонотерапии или наоборот. Так бывает в 1/4 — 1/3 случаев. Подробнее о тестах Oncotype DX и MammaPrint Вы можете прочитать ЗДЕСЬ.
Результаты всех этих тестов позволяют в 1/3 — 1/4 случаев отказаться от традиционно запланированной гормонотерапии в пользу химиотерапии и наоборот.
Недавно в Санкт-Петербурге появилась компания, предлагающая выполнение аналогичного, но более дешёвого аналога анализа Онкотайп-Д-Икс или Мамма-Принт: Genext. Принцип теста аналогичен. Анализы выполняются в Мюнхене. Стоимость — 140 т.р. Для анализа необходимо передать сотруднику компании парафиновый блок опухоли и заключить договор. Тел. 8(965)080-72-77, Андрей Вдовин.
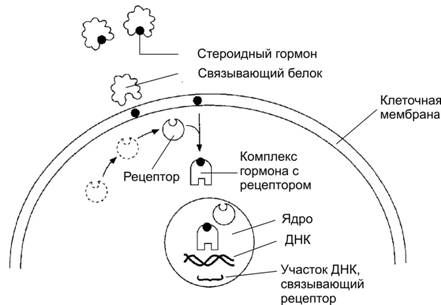
Механизм эффективности гормонотерапии следующий: на оболочках некоторых раковых клеток имеются специальные белки — рецепторы. Они могут соединяться с женскими половыми гормонами (циркулирующими в кровотоке эстрогенами или прогестинами). Такое соединение стимулирует опухолевые клетки к делению.
Эстрогеновые рецепторы обозначаются ER, прогестиновые — PR.
Раковые опухоли, возникшие у женщин до наступления менопаузы, на своих оболочках чаще не имеют таких рецепторов (не чувствительны к гормонотерапии: ER-, PR- или 0 баллов), тогда как раковые клетки у женщин в постменопаузе — чаще их имеют (чувствительны к гормонотерапии, например: ER+,PR+ или 8 баллов, 280 или 300). Женские половые гормоны синтезируются не только яичниками женщины, но и надпочечниками, жировой тканью, иногда – самой опухолью. Поэтому женские половые гормоны присутствуют в организме женщины и после прекращения у неё менструальной функции.
Некоторые препараты для гормонотерапии (Тамоксифен, Торемифен, Флувестрант) соединяются с рецепторами на оболочках опухолевых клеток, опережая их аналогичное соединение с гормонами. Другие препараты (Летрозол, Фемара, Анастрозол, Экземестан, Гозерелин) нарушают синтез женских половых гормонов в организме женщины. В любом случае, не получая гормональную стимуляцию, опухолевая клетка доживает до своей старости и погибает без деления. Поэтому назначение препаратов для гормонотерапии — длительное, а регулярный их приём — обязателен.
Тамоксифен доказал свою эффективность у женщин с сохранённой менструальной функцией. Другие препараты — эффективны только при наступившей менопаузе (подтверждается не отсутствием месячных, а анализом крови на гормоны — тест на менопаузу). Если же менопауза не наступила, назначение других препаратов (кроме Тамоксифена) возможно только вместе с «выключением» яичников препаратом Гозерелин или их удалением.
Удаление яичников при раке молочной железы (аднексэктомия) оправдано при прогрессии онкологического заболевания (показания определяет химиотерапевт). При отсутствии прогрессии, как элемент гормонотерапии, аднексэктомию предлагают в странах, неспособных обеспечить своим гражданам надлежащий уровень современного лекарственного обеспечения: часто это бывает при невозможности предоставить пациенту Гозерелин (Золадекс) на весь курс лечения.
В случаях, когда у пациентки с раком молочной железы имеется сопутствующая гинекологическая патология (гиперплазия эндометрия, миома матки или патология яичников) — иногда, действительно, разумнее выполнить гинекологическую операцию или только аднексэктомию (по согласованию с гинекологом).
Гормонотерапию не проводят одновременно с химиотерапией. Дело в том, что и химиотерапия, и лучевая терапия воздействуют только на делящуюся опухолевую клетку, а гормонотерапия делает её неделящейся. Исходя из этого (для того, чтобы достичь максимальной эффективности химиотерапии и лучевой терапии) — гормонотерапию лучше начинать после завершения этих методов лечения.
| Где купить препараты для гормонотерапии смотрите ЗДЕСЬ. |
Никто не собирается гормонотерапией делать из женщины мужчину. Борода и усы у Вас не вырастут, голос не изменится.
Гормонотерапия по сравнению с химиотерапией переносится совершенно иначе. Неприятные ощущения могут возникать в период адаптации в начале лечения (1 мес), но совсем не обязательно. При гормонотерапии нет проявлений токсичности (тошнота, рвота, кишечные расстройства). Она не требует контроля анализов крови.
За изобретение Тамоксифена была присуждена Нобелевская премия. Не стоит отказываться от его приёма, изучив инструкцию — просто этот препарат наиболее изучен.
Побочное действие Тамоксифена и других препаратов для гормонотерапии для лечения рака молочной железы (груди)
При приёме Тамоксифена некоторые пациенты отмечали головокружение днём при его утреннем приёме. Однако, при переносе времени приёма на вечер — дневные головокружения исчезали.
Следующая проблема, иногда (а не всегда) сопутствующая приёму Тамоксифена — гиперплазия эндометрия и маточные кровотечения. Но эти кровотечения могут возникать и без Тамоксифена! В конце концов, даже 3 выскабливания при гиперплазии эндометрия и кровотечении, или даже удаление матки, но без отказа от приёма Тамоксифена — принесёт куда больше пользы в уменьшении риска возврата вашей болезни.
К сожалению, опухоль со временем может привыкнуть к назначенному Вам препарату для гормонотерапии и болезнь может вернуться. Если в арсенале у Вас будут ещё другие лекарства — вам назначат их. Если Вы уже всё попробовали — в резерве останется только химиотерапия. Не отказывайтесь самостоятельно от Тамоксифена. Оставьте это в компетенции Вашего врача.
Тамоксифен противопоказан при глаукоме. Обязательно скажите своему врачу, если она у Вас есть.
Анастрозол иногда провоцирует обострения ревматоидного артрита. Смена его на Фемару (Летрозол) нивелирует этот побочный эффект. Оба эти препарата провоцируют остеопороз и требуют параллельного назначения препаратов кальция и витамина Д (например, КальцийД3 компании Никомед), равно как и ежегодной контрольной остеосцинтиграфии.
Аналог Летрозола — Лорета (2.5 мг/1 раз в сутки), испанского производства, но гораздо дешевле.
Тамоксифен не желателен при имевших место тромбофлебитах. Если у Вас варикозная болезнь ног — рассмотрите лучше вариант операции (флебэктомия или склерозирование). В конце концов, если сегодня такую операцию Вы перенесёте, то не факт, что вы перенесёте её через несколько лет (а такая необходимость может возникнуть).
При сопутствующей сердечной патологии частота и степень её усугубления на фоне приёма Тамоксифена была ниже, чем на фоне приёма ингибиторов ароматазы.
При Her2/neu позитивных (Her2/neu3+) и гормонопозитивных (ER+ и PR+) опухолях Тамоксифен не показал должной эффективности, по сравнению с ингибиторами ароматазы.
Иногда гормонотерапия назначается в неоадьювантном режиме при неудалённой опухоли. На фоне такого лечения положительная динамика — уменьшение опухоли — не должна обольщать пациента в пользу отказа от операции. Эффект гормонотерапии может быть нестойким, и сегодняшние оптимальные условия для операции — завтра могут быть упущены: опухоль может адаптироваться и начать расти на фоне приёма препаратов, а усугубившаяся сопутствующая патология (например — сердца) — уже не позволит выполнить операцию.
Назначение гормонотерапии — не самая простая задача. Главное — не назначайте её себе сами и не выбирайте сами себе препараты. Грамотный химиотерапевт всё равно разбирается в этом лучше чем Вы. Вы должны просто информировать его о всех своих сопутствующих проблемах и довериться его решению.
Для проведения гормонотерапии есть оригинальные препараты и дженерики. Стоимость оригинальных препаратов не всегда неподъёмна. Информация об аптеках, легально продающих препараты для гормонотерапии находится ЗДЕСЬ.
Я был свидетелем фактов, когда в одном онкологическом учреждении Санкт-Петербурга назначение гормонотерапии и перевод пациентов с одного препарата на другой (это называется смена линии гормонотерапии) определялось не медицинскими показаниями (прогрессия заболевания на фоне лечения), а истечением срока годности лекарств, купленных руководителем учреждения без учёта потребности в них (вероятно, мотивированного на покупку другими причинами). Иными словами — пациентам давали только те препараты (бесплатно, по полису ОМС), у которых выходит срок годности (нарушая онкологические правила назначения гормонотерапии). В этом же учреждении (когда руководитель не обеспечил закупку препаратов в должном количестве и когда лекарства для гормонотерапии закончились уже в ноябре) — пациентам в декабре (при выявленных метастазах в кости) не назначали лечение, а рекомендовали пройти дополнительные контрольные обследования через 3 месяца (когда препараты уже появятся по закупкам нового года).
| Мы стараемся обеспечить всем нашим пациентам консультацию грамотного химиотерапевта, мотивированного при назначении гормонотерапии только потребностями пациента, а не другими причинами. |
Дополнительно о гормонотерапии Вы можете прочитать ЗДЕСЬ.
Автор: Чиж Игорь Александрович
заведующий, кмн, онколог высшей квалификационной категории,
хирург высшей квалификационной категории, пластический хирург
Если информация нашего сайта была Вам полезна — пожалуйста, оставьте свои отзывы о нём и рекомендации в интернете для других пациентов.
источник