Опубликовано в журнале
Терра Медика Нова »» № 1 ’98
Онкология В.Ф. Семиглазов, профессор
НИИ онкологии им. проф. Н.Н. Петрова МЗ РФ, Санкт-Петербург
Эстрогенная зависимость некоторых форм рака молочной железы (РМЖ) предопределила применение антиэстрогенов в терапии этого заболевания. Среди них препарат «Тамоксифен» занимает ведущее место в лечении как распространенных, так и ранних стадий РМЖ. Обзор 86 наиболее крупных исследований показал, что общий объективный ответ на применение тамоксифена у больных распространенным РМЖ достигает 34%. У женщин старше 70 лет этот показатель увеличивается до 43% [Cuzick J., 1996]. Наиболее высокая частота ремиссий достигнута при наличии положительных рецепторов эстрогенов и/или прогестерона (ЭР + , ПР + ). Средняя длительность ответа на тамоксифен варьирует от 2 до 24 мес. При прогрессировании опухоли в режиме обычных доз (20-40 мг ежедневно) увеличение дозы до 90 мг в день вновь приводит к ремиссии, особенно у пожилых с ЭР + -опухолями [EBCTCG — (Early Breast Cancer Trialists’ Collaborative Group), 1988]. Адъювантное применение тамоксифена у больных ранними формами РМЖ приводит к сокращению смертности на 18-20% в первые 5 лет наблюдения среди женщин старше 50 лет [EBCTCG, 1990].
Клинически наиболее важный вопрос, касающийся тамоксифена: как долго больные РМЖ должны принимать препарат? В результате 10-летних клинических испытаний, проведенных в НИИ онкологии им. Н. Н. Петрова с 1985 по 1995 гг., доказано, что даже относительно непродолжительное (около 1 года) профилактическое лечение тамоксифеном почти 1000 больных (подбор осуществлялся на рандомизированной, то есть случайной основе) улучшает показатели безрецидивности выживаемости и сокращает смертность на 8-10%: 2-летнее адъювантное лечение эффективнее однолетнего (сокращение смертности на 12-15%) [1; Baum M., et al., 1996]; 5-летнее (20 мг ежедневно) представляется еще более эффективным по промежуточным расчетам (однако сроки наблюдения пока недостаточны для достижения статистически достоверных отличий).
В 1996-1997 гг. опубликованы предварительные результаты 6 исследований [2; Baum М., et аl., 1996, Delozier Т., et аl., 1997: Rutqvist L.E., et al., 1996: Stewart H., et al., 1996: Tormey D., et al., 1996), в которых рандомизированно подобранные больные РМЖ получали адъювантную терапию тамоксифеном на протяжении различных временных периодов: 2 года против 5 лет, 5 лет против 10 лет. В одном из последних сообщений проекта NSABP В-14 содержатся доказательства преимущества 5-летнего адъювантного приема тамоксифена в сравнении с группой пациентов, вообще не получавших адъювантного лечения, а также выявлено достоверное отодвигание сроков наступления рецидива заболевания как среди женщин моложе 50 лет (в основном репродуктивного возраста), так и в более старших возрастных группах [2].
Первоначальные испытания адъювантного применения тамоксифена в сравнении с контролем, начатые в 1970 г., вскоре показали, что сроки проявления как местных рецидивов, так и отдаленных метастазов могут быть существенно отодвинуты благодаря тамоксифену [4-5]. В 1985 г. метаанализ всех рандомизированных клинических испытаний, проведенных в Оксфордском университете группой EBCTCG, включая и российских исследователей, четко показал, что 5-летняя выживаемость больных РМЖ при адъювантном применении тамоксифена может быть улучшена [EBCTCG, 1988]. В 1985 г., однако, анализ коснулся лишь 28 центров с недостаточными сроками наблюдения в некоторых из них. Но ко времени второго общего обзора EBCTCG в 1990 г. с большим числом испытаний и более длительными сроками наблюдения стало очевидным, что абсолютная выживаемость оказалась более значительной через 10 лет по сравнению с первыми 5 годами приема препарата, и этот благоприятный эффект увеличивался с увеличением длительности применения тамоксифена [EBCTCG, 1990].
В пределах этого временного ранга более продолжительное лечение оказалось более эффективным в предотвращении или отсрочке рецидива заболевания и улучшении показателей 10-летней выживаемости. Поэтому при адъювантной терапии на ранних стадиях РМЖ многие доктора рекомендуют применять тамоксифен не менее 2 лет или около 5 лет [Rouesse J., et al., 1996], и существует мнение, что для некоторых пациентов лечение должно продолжаться до 10 лет или даже неопределенно долго [Baum М. et al., 1996].
Однако применение тамоксифена сопровождается рядом побочных неблагоприятных эффектов, частота и тяжесть которых могут усилиться при более длительном приеме препарата. Пожалуй, наиболее важным из них является увеличение частоты рака эндометрия [Fisher В., et al., 1994, Fornander Т., et al., 1989; Rutqvist L.E., et al., 1995]. Известно, что при лечении тамоксифеном в течение нескольких лет (от 2 до 5) регистрируется одна дополнительная смерть от рака эндометрия на 1000 женщин, принимавших тамоксифен [4]. Вероятность таких событий по частоте в 40 раз уступает величине сокращения заболеваемости раком противоположной молочной железы.
Несмотря на то, что с точки зрения отдаленной перспективы, то есть выживаемости леченных больных, польза тамоксифена намного перевешивает опасность, продолжаются оживленные дебаты об оптимальных сроках лечения. Часть исследователей полагает, что и 2-летнего приема тамоксифена вполне достаточно [Fornander Т., et al., 1989: Rouesse J.,et al., 1996], в то время как другие доктора склоняются к тому, что 10-летний срок адъювантного лечения является предпочтительным [6].
Чрезвычайно трудно дать прямой ответ, так как наблюдается существенный благоприятный «пережитковый» («carry over»), по R. Peto, эффект, продолжающийся и после окончания лечения тамоксифеном. Таким образом, даже несколько лет адъювантной терапии тамоксифеном сопровождаются сокращением ежегодной частоты рецидивирования и смертности не только в период лечения, но также в течение нескольких лет после окончания лечения [2, EBCTCG, 1988]. Этот устойчивый благоприятный эффект был полезен в испытаниях с 1-2 — летним приемом тамоксифена в сравнении с контролем (без тамоксифена), так как увеличивал отличия даже 10-летней выживаемости между лечебной и контрольной группами.
Однако в испытаниях, сравнивающих прекращение приема тамоксифена после нескольких лет (от 2 до 5 лет) с группой больных, продолжающих его прием еще несколько лет, этот «пережитковый» эффект может вначале оказаться помехой для правильной оценки, так как устойчивый благоприятный эффект в контроле (с более коротким периодом лечения тамоксифеном) возможно означает, что в первые несколько лет дополнительного лечения может наблюдаться лишь небольшая выгода.
Таким образом, с точки зрения биостатистики [4], клинические испытания, в которых сравниваются 2-летнийприем тамоксифена с 5-летним, должны сопровождаться не 5-, а 10-летним периодом наблюдения, а испытания, в которых сравнивается 5-летний прием тамоксифена с 10-летним, должны основываться на 15-летнем периоде наблюдения после установления первичного диагноза.
Более того, даже испытания, сравнивающие несколько лет адъювантного лечения тамоксифеном с более продолжительными сроками лечения и с последующим длительным сроком наблюдения за больными, включающие в совокупности несколько десятков тысяч пациентов, нуждаются в широком международном сотрудничестве с точной интерпретацией полученных «общих» данных. Тем не менее, ранние результаты 6 недавно опубликованных испытаний представляют существенный интерес (таблица).
Таблица.
Сводные результаты шести наиболее крупных клинических испытаний значения продолжительности лечения тамоксифеном
| Количество больных | Шведское испытние | CRC, Британия | Название программы и длительность назначения тамоксифена, лет | |||||||||
| FNCLCC, Франция | Шотландское испытние | NSABR B-14, США | ECOG, США | |||||||||
| 2 года | 5 лет | 2 года | 5 лет | 2 года | > 2 лет до рецидива заболевания | 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | 10 лет | |
| Рандомизированные больные РМЖ | 1744 | 1801 | 1470 | 1467 | 1882 | 1911 | 169 | 173 | 570 | 583 | 93 | 100 |
| Рецидивы и отдаленные метастазы | 279 15,9% | 288 12,6% | 190 12,9% | 145 9,8% | 318 16,8% | 258 13,5% | 34 20% | 44 25,4% | 19 3,3% | 34 5,8% | 23 24,7% | 15% |
| Смерть от РМЖ | 162 9,2% | 132 7,3% | 110 7,4% | 94 6,4% | 130 6,9% | 59 3,0% | 25 14,7% | 32 18,4% | 9 1,5% | 16 2,7% | 8 8,6% | 8 8% |
| Другие причины смерти | 92 5,2% | 78 4,3% | 14 0,95% | 18 1,2% | 134 7,1% | 228 11,9% | 15 8,8% | 16 9,2% | 5 0,87% | 9 1,5% | 2 2,15% | 6 6% |
| Все случаи смерти | 254 14,5% | 210 11,6% | 124 8,4% | 112 7,6% | 264 14% | 287 15,0% | 40 23,6% | 48 27,7% | 14 2,45% | 25 4,28% | 10 10,7% | 14 14% |
Шведская кооперативная группа по изучению РМЖ сравнивала эффективность 2-летнего применения тамоксифена с 5-летним у больных на ранних стадиях РМЖ с ЭР + -опухолями. Группа пришла к заключению, что больные, которые в результате рандомизации получали препарат 5 лет, характеризовались более продолжительной общей и безрецидивной выживаемостью по сравнению с теми, кто получал тамоксифен только 2 года [Rutqvist L.E., et аl., 1996].
В другое исследование (NSABPB-14), начатое в 1982 г., спланированное на первом этапе как «адъювантный тамоксифен против плацебо», а далее — как «тамоксифен в течение 5 лет в сравнении с более продолжительным приемом», включались больные РМЖ без метастазов в регионарные лимфатические узлы, то есть на самых ранних стадиях рака [2]. Промежуточный анализ результатов этого исследования дал основание Национальному Онкологическому Институту США выступить с заявленияем о том, что применение тамоксифена свыше 5 лет не приносит существенной пользы, так как число больных с рецидивом заболевания увеличилось с 3,3% до 5,8%.
В декабре 1996 г. были опубликованы результаты исследования по программе CRC (Cancer Research Campaign) в Лондоне. В испытание включались больные в возрасте 50 лет и старше, безотносительно к содержанию рецепторов эстрогенов. Подобно Шведскому исследованию в программе CRC было обнаружено, что пациенты, получавшие тамоксифен 5 лет, характеризовались более продолжительным периодом до рецидива заболевания, то есть более высокой безрецидивной выживаемостью. Однако в отличие от Шведского испытания не было получено достоверных преимуществ общей выживаемости при большей продолжительности терапии тамоксифеном.
В исследовании, проведенном во Франции группой FNCLCC [DeloizerT., et аl., 1997], больные РМЖ были рандомизированы на получающих тамоксифен в течение 2-3 лет по сравнению с более продолжительным, до развития рецидива заболевания, приемом препарата. Показатели 5-летней безрецидивной выживаемости у больных с более длительным приемом тамоксифена достоверно (р = 0,0025) выше, чем в контроле (82% против 76%). Однако показатели общей выживаемости в сравниваемых группах не отличались (85 и 86%).
Шестое опубликованное исследование [Tormey D., et аl., 1996] проведено Восточной Кооперативной Онкологической Группой (ECOG). Это рандомизированное испытание для сравнения эффективности 5-летнего лечения тамоксифеном с более чем 5-летним у больных РМЖ с метастазами в регионарных лимфатических узлах. В этом исследовании не было обнаружено отличий в показателях общей выживаемости при различных лечебных стратегиях. Однако в группе больных с ЭР + заметна тенденция к более высокой выживаемости при более продолжительном лечении тамоксифеном, хотя отличия при этом сроке наблюдения пока статистически недостоверны.
Как при метаанализе всех испытаний адъювантного применения тамоксифена в сравнении с контролем [EBCTCG, 1992], так и в этих шести испытаниях различной продолжительности применения тамоксифена не обнаружено убедительных доказательств того, что какие-либо другие причины смерти, кроме РМЖ и рака эндометрия, имеют связь с приемом тамоксифена. На последней встрече в 1995 г. в Оксфорде группа EBCTCG [EBCTCG, 1996] пришла к заключению, что испытания, в ходе которых сопоставляется различная продолжительность приема тамоксифена, еще не могут быть всесторонне проанализированы, и такой анализ предполагается выполнить в 2000 году. Поэтому может оказаться преждевременным заявление Национального Института Рака (США) о том, что результаты испытания NSABP В-14 и Шотландского испытания [2, Stewart Н., et аl., 1996] дают основания заключить определенно, что 5-летнее лечение тамоксифеном является достаточным.
Профессор М. Baunn из Лондона, один из авторов проекта CRC, заявил, что он не согласен с заключением NSABP о том, что 5-летний период лечения тамоксифеном оптимален. Он агитирует онкологов включать как можно больше пациентов в исследования по определению оптимальных сроков и продолжительности адъювантного применения тамоксифена. Профессор считает заключение, сделанное на основании промежуточных результатов программы NSABP, «интеллектуальным мошенничеством». Скорее всего к 2000 году, а, может быть, еще и позже, клиницисты будут располагать достаточным числом пациентов и сроками наблюдения за ними, чтобы решить, является ли 5-летнее лечение тамоксифеном достаточным. Многие полагают, что упускается 2-3% дополнительной выгоды от более длительной терапии тамоксифеном. Исследования на животных и другие экспериментальные данные свидетельствуют о том, что тамоксифен — цитостатик и своего рода супрессор опухоли, но он не убивает опухолевые клетки: когда лечение тамоксифеном прекращается, опухоль рецидивирует, поэтому более продолжительное применение тамоксифена представляется более предпочтительным и благоприятным для судьбы больных РМЖ [3; Howell A., et аl., 1996]. С целью получения надежной оценки эффективности и безопасности длительного (более 5 лет) адъювантного применения тамоксифена организована международная научная программа ATLAS (Adjuvant Tarnoxifen-Longer Against Shorter) с штаб-квартирой в Оксфордском университете.
В мире около 1 млн. женщин принимают тамоксифен в качестве профилактики рецидива заболевания после хирургического лечения РМЖ. Даже если небольшая часть их положительно реагирует на тамоксифен, большинству все же он спасает жизнь, а это тысячи спасенных.
Перспективным представляется использование для адъювантной терапии рака молочной железы антиэстрогенов II поколения, в частности торемифена («Фарестон»), который не повышает частоту рака эндометрия. Однако этот вопрос требует дополнительного освещения.
1. Семиглазов ВФ. Проблемы рака молочной железы на пороге XXI века. Актовая речь, посвященная 70-летию НИИ онкологии им. Н.Н. Петрова. СПб. 1997. 17 сс.
2. Fisher В, Dignam I, Bryant J, et аl. Five versus more than five years of tarnoxifen therapy for breast cancer patients with negative lymph nodes and estrogen receptor-positive tumours. J Nati Cancer Inst 1996; 88 (21): 1529-42.
3. Jordan VC. Tamoxifen. A guide for clinicians and patients. Huntington, NY, USA: Oncology news Intern, 1996. 216 pp.
4. Peto R. Five years of tamoxifen — or more? (editorial). J Nati Cancer Inst 1996; 88: 1791-3.
5. Piccart MJ, DileoA, Roy J, et аl. Breast cancer: is there a new standard in adjuvant treatment? 21st ESMO Congress Educational Book. Vienna, Austria, November 1-5, 1996: 15-27.
6. Swain S. Tamoxifen: the Long and Short of it (editorial). J Nati Cancer Inst 1996; 88: 1510-3.
источник
В последние годы целый ряд новых гормональных агентов для лечения рака молочной железы (чистые антиэстрогены, ингибиторы ароматазы и агонисты гонадотропин-рилизинг-гормонов) интенсивно изучаются у женщин с гормонозависимыми опухолями. Эти препараты сравниваются с «золотым» стандартом тамоксифеном, а также друг с другом в больших клинических исследованиях.
Тамоксифен vs Анастрозол при диссеминированном раке молочной железы.
Сравнение эффективности ингибитора ароматазы анастрозола с тамоксифеном в качестве гормонотерапии первой линии проведено в двух больших мультицентровых исследованиях, имевших сходный дизайн: Европейском и Северо-Американском. [1,2]. Эти исследования продемонстрировали небольшое повышение эффективности анастрозола по сравнению с тамоксифеном, а также увеличение времени до прогрессирования, особенно у больных с положительными рецепторами к эстрогену.
Аналогичные результаты получены также в исследовании испанских авторов, в котором анастрозол сравнивался с тамоксифеном при проведении гормонотерапии первой линии у больных с положительными рецепторами к эстрогену [3] (табл.4).
Таблица 4.
Анастрозол vs Тамоксифен: Барселонское исследование.
| Тамоксифен | Анастрозол | р | |
|---|---|---|---|
| Кол-во больных | 117 | 121 | |
| Суточная доза | 40 мг | 1 мг | |
| Эффективность | 23% | 34% | Нет данных |
| Среднее время до прогр. | Там > анастрозол | Анастрозол > Там | |
| Кол-во больных | 74 | 85 | |
| Эффективность | 8% | 9% | |
| Стабилизация >24 нед. | 52% | 41% |
Полученные данные свидетельствуют о существенной активности анастрозола у больных с прогрессированием на фоне приема тамоксифена и наоборот. Это несомненно является обнадеживающим для больных с гормоночувствительными опухолями молочной железы. Однако, проведение перекреста не позволяет сделать вывод о том, какой же из двух препаратов обеспечил улучшение выживаемости в этих исследованиях.
При среднем сроке наблюдения 2 года никаких существенных изменений содержания холестерина, липопротеидов низкой и высокой плотности, а также триглицеридов не было отмечено ни среди больных, принимавших тамоксифен, ни в группе пациенток, принимавших анастрозол [5].
Летрозол в сравнении с Тамоксифеном при лечении распространенного и раннего рака молочной железы.
Второй ингибитор ароматазы летрозол также является объектом пристального внимания исследователей. Результаты двух больших исследований представлены компанией Новартис. В первом (двойном слепом, перекрестном) сравнивалась эффективность летрозола и тамоксифена при проведении гормонотерапии первой линии у больных в менопаузе с положительными или неизвестными рецепторами [6]. Полученные результаты представлены в табл. 6.
Таблица 6.
Летрозол в сравнении с тамоксифеном при распространенном раке молочной железы.
| Летрозол | Тамоксифен | Р | |
|---|---|---|---|
| Суточная доза | 2,5 мг | 20 мг | |
| Кол-во больных | 453 | 454 | |
| Средний возраст | 65 лет | 64 года | |
| РЭ+ и/или РП+ | 66% | 67% | |
| РЭ/РП неизвестны | 34% | 33% | |
| Предшествующая терапия тамоксифеном | 20% | 18% | |
| Ср. время до прогрессирования | 9,4 мес. | 6,0 мес. | 0,0001 |
| Эффективность | 30% | 20% | 0,0006 |
| Длительность эффектов | 23 мес. | 23 мес. | >0,05 |
| Ощущение приливов | 18% | 15% |
В этом исследовании летрозол обеспечивал лучшую непосредственную эффективность и более продолжительное время до прогрессирования по сравнению с тамоксифеном. Данные относительно выживаемости отсутствуют. Оба вида лечения переносились больными сравнительно хорошо. Летрозол оценен в сравнении с тамоксифеном также у больных в менопаузе с ранним раком молочной железы [7]. В исследование включались больные, которым планировалось органосохраняющее лечение, с гормонозависимыми опухолями. Продолжительность неоадъювантной гормонотерапии составляла 4 мес., после чего больные подвергались хирургическому лечению. Полученные результаты представлены в табл. 7.
Таблица 7.
Летрозол в сравнении с тамоксифеном в качестве предоперационной гормонотерапии рака молочной железы.
| Летрозол | Тамоксифен | Р | ||||
|---|---|---|---|---|---|---|
| Суточная доза | 2,5 мг | 20 мг | ||||
| Кол-во больных | 154 | 170 | ||||
| РЭ+ | 88% | 87% | ||||
| РП+ | 66% | 60% | ||||
| HER2+ | 12% | 16% | ||||
| Эффективность | 55% | 36% | Европейское исследование 0020 | Северо-Американское исследование 0021 | ||
| Ре жим | Фулвестрант | Анастрозол | р | Фулвестрант | Анастрозол | р |
| Доза | 250 мг | 1 мг | 250 мг | 1 мг | ||
| Кол-во б-ных | 222 | 229 | 206 | 194 | ||
| РЭ+ | 73% | 80% | 87% | 87% | ||
| Предш. адъюв. гормонотерапия | 55% | 52% | 59% | 60% | ||
| Предшеств. гормонотерапия 1 линии | 57% | 56% | 53% | 50% | ||
| Время до прогр. | 5,5 мес. | 5,1 мес. | 0,84 | 5,4 мес. | 3,6 мес. | 0,43 |
| Эффективность | 21% | 16% | 0,20 | 17% | 17% | NS |
| Стаб.>24 нед. | 24% | 29% | 25% | 19% | ||
| Длит. эффекта | 14,3 мес. | 14,0 мес. | 19,3 мес. | 10,5 мес. | ||
| Приливы | 18% | 17% | 24% | 24% |
В целом не было выявлено каких-либо существенных различий в частоте объективных эффектов или времени до прогрессирования между фулвестрантом и анастрозолом. Небольшое различие в длительности эффекта было отмечено в Северо-Американском исследовании.
Экземестан в сравнении с Тамоксифеном в качестве первой линии терапии диссеминированного рака молочной железы.
Экземестан в отличие от анастрозола и летрозола имеет стероидную структуру и необратимо блокирует ароматазу. Сравнение эффективности экземестана и тамоксифена проведено в рамках рандомизированного исследования, в котором приняли участие больные диссеминированным раком молочной железы в менопаузе с положительными РЭ и/или РП [10]. Основные результаты исследования приведены в табл. 9.
Таблица 9.
Экземестан vs Тамоксифен при диссеминированном раке молочной железы.
В этом исследовании экземестан продемонстрировал лучшие непосредственные результаты лечения по сравнению с тамоксифеном.
Экземестан в неоадъювантной терапии местно-распространенного рака молочной железы. Роль экземестана в предоперационной терапии рака молочной железы оценена в небольшом исследовании II фазы [11], в которое включены 13 больных постменопаузального возраста с РЭ+. Участницы исследования получали экземестан в суточной дозе 25 мг в течение 3 месяцев перед хирургическим лечением. В среднем отмечено уменьшение опухолевой массы на 85%, и 83% больных ответили на лечение. В результате изучения биоптатов молочных желез было показано, что экземестан снижает циркуляцию периферических и синтез внутриопухолевых эстрогенов.
Итак, несколько рандомизированных исследований были посвящены сравнению тамоксифена и ингибиторов ароматазы в первой линии гормонотерапии диссеминированного рака молочной железы у больных в менопаузе. В целом, ингибиторы ароматазы отличались более благоприятным спектром токсичности по сравнению с тамоксифеном. В большинстве исследований ингибиторы ароматазы продемонстрировали сравнимую с тамоксифеном, а иногда и превосходящую его эффективность. Полученные результаты свидетельствуют о том, что ингибиторы ароматазы могут рассматриваться, наряду с тамоксифеном, как препараты выбора для лечения больных постменопаузального возраста с РЭ+, правда пока нет четких данных об улучшении выживаемости при использовании ингибиторов ароматазы. Нерешенным остается и вопрос об оптимальной последовательности назначения ингибиторов ароматазы и тамоксифена.
Выключение функции яичников или химиотерапия в качестве адъювантного лечения.
Возрождается интерес к проблеме аменореи/овариоэктомии у женщин пременопаузального возраста с гормонозависимой болезнью. Полагают, что эффект адъювантной химиотерапии частично реализуется через индуцируемую аменорею; исследования по изучению этой проблемы признаны сегодня приоритетными [12]. В частности, в исследовании ZEBRA с участием пациенток пременопаузального ( Время наблюдения
Из представленных данных видно, что выключение функции яичников с помощью гозерелина приводит к более выраженному по сравнению с CMF снижению костной плотности. Однако, ожидается, что в случае восстановления функции яичников по окончании приема гозерелина деминерализация будет менее выраженной.
К сожалению в исследовании ZEBRA не был использован тамоксифен, являющийся стандартом адъювантной терапии раннего гормонозависимого рака молочной железы. По этой причине представляется чрезвычайно сложным использовать полученные результаты в повседневной практике. Тем не менее, в этой работе был наглядно продемонстрирован тот факт, что выключение функции яичников у женщин в пременопаузе с гормонозависимыми опухолями может быть равноэффектиным назначению адъювантной химиотерапии CMF. В дальнейшем предстоит оценить, имеет ли преимущества сочетание кастрации с химиотерапией и назначением тамоксифена по сравнению с каждым из этих методов в отдельности.
1. Bonneterre J. Thurlimann B, Robertson JFR, et al. Anastrozole versus tamxoifen as first-line therapy for advanced breast cancer in 668 postmenopausal women: results of the tamoxifen or arimidex randomized group efficacy and tolerability study. J Clin Oncol. 2000;18:3748-3757.
2. Nabholtz JM, Buzdar A, Pollak M, et al. Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. J Clin Oncol. 2000;18:3758-3767.
3. Milla-Santos A, Milla L, Rallo L, Solana V. Anastrozole vs. tamoxifen in hormone dependent advanced breast cancer: a phase II randomized trial. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 173. Breast Cancer Res Treat. 2000;64:54.
4. Thurlimann B, Roberston JFR, Bonneterre J, et al. Efficacy of tamoxifen following anastrozole (Arimidex) as first-line treatment for advanced breast cancer in postmenopausal women. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 162. Breast Cancer Res Treat. 2000;64:51.
5. Dewar J, Nabholtz JM, Bonneterre J, et al. The effect of anastrozole (Armidex) on plasma lipids — data from a randomized comparison of anastrozole versus tamoxifen in postmenopausal women with advanced breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 164. Breast Cancer Res Treat. 2000;64:51.
6. Smith R, Sun Y, Garin A, et al. Femara (letrozole) showed significant improvement in efficacy over tamoxifen as first-line treatment in postmenopausal women with advanced breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 7. Breast Cancer Res Treat. 2000;64:27.
7. Ellis MJ, Jaenicke F, Llombart-Cussac A, et al. A randomized double-blind multicenter study of pre-operative tamoxifen versus femara (letrozole) for postmenopausal women with ER and/or PgR positive breast cancer ineligible for breast conserving surgery. Correlation of clinical response with tumor gene expression and proliferation. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 14. Breast Cancer Res Treat. 2000;64:29.
8. Osborne CK, Pipper J, Jones SE, et al. Faslodex (ICI 182,780) shows longer duration of response compared with Arimidex (anastrozole) in post-menopausal (PM) women with advanced breast cancer (ABC). Preliminary results of a phase III North American Trial. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 7. Breast Cancer Res Treat. 2000;64:27.
9. Howell A, Roberston JFR, Quaresma Albano J, et al. Comparison of efficacy and tolerability of fulvestrant (Faslodex) with anastrozole (Arimidex) in post-menopausal women with advanced breast cancer (ABC) — preliminary results. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 6. Breast Cancer Res Treat. 2000;64:27.
10. Paridaens R, Dirix L, Lohrisch C, et al. Activity and safety of exemestane (E) as first-line hormonal therapy (HT) in metastatic breast cancer (MBC) patients (PTS): final results of an EORTC randomized phase II trial. Program and abstracts of The 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 167. Breast Cancer Res Treat. 2000;64:52.
11. Dixon JM, Grattage L, Renshaw L, et al. Exemestane as neoadjuvant treatment for locally advanced breast cancer: endocrinologic and clinical endpoints. Program and abstracts of The 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 170. Breast Cancer Res Treat. 2000;64:53.
12. Jonat W, on behalf of the ZEBRA (Zoladex Early Breast Cancer Research Association) Trialist’s Group. Zoladex (goserelin) vs. CMF as adjuvant therapy in pre/perimenopausal early (node positive) breast cancer: preliminary efficacy, QOL, and BMD results from the ZEBRA study. Program and abstracts of The 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 13. Breast Cancer Res Treat. 2000;64:29.
источник
Гормональная терапия является эффективным методом лечения гормональнозависимых опухолей молочной железы. Иногда ее называют антиэстрогеновой терапией, так как она направлена на предотвращение воздействия эстрогена на онкологические клетки.
В Москве на онкологических болезнях (в том числе и на раке молочной железы) специализируются врачи Юсуповской больницы. Это одно из лучших учреждений по оснащенности, высококвалифицированным врачам, ценовой политике, качеству оказываемых услуг и сервису, в котором процент положительного исхода лечения один из самых высоких в стране.
В большинстве случаев гормональная терапия оказывает эффективное действие, так как 75% всех опухолей, расположенных в молочных железах, имеют гормонзависимую природу. В зависимости от общего состояния пациентки, стадии заболевания, характера течения, распространенности, менопаузального статуса доктор подбирает оптимальную схему лечения. Ее нужно строго придерживаться, ведь только так можно достичь положительного результата.
Показаниями к назначению гормональной терапии являются:
- снижение вероятности возникновения рака у женщин, которые не страдают этим заболеванием, но находятся в зоне высокого риска;
- снижение риска рецидивов при неинвазивном раке;
- снижение вероятности рецидива или появления новых опухолей после оперативного вмешательства, химиотерапии и лучевой терапии;
- уменьшение размеров опухоли при инвазивном раке;
- метастатический рак.
Гормонотерапию часто называют «страховкой» после применения других методов лечения рака, так как операция, лучевая терапия и химиотерапия не могут дать 100% гарантию, что пациентка не заболеет вновь. Препараты гормонотерапии оказывают влияние на весь организм, подавляя действие эстрогена, и назначаются только в случаях гормонозависимых опухолей.
В Юсуповской больнице применяется только лучшее диагностическое оборудование от производителей с мировым именем, полный перечень лекарственных препаратов (антибиотики, химиопрепараты, гормональные таблетки и инъекции).
- адъювантная (профилактическая);
- неоадъювантная;
- лечебная.
Применяется как дополнительная терапия после оперативного вмешательства, химического облучения и лучевой терапии с целью профилактики рецидивов. Обычно такая терапия длится от 5 до 10 лет, при этом доктор назначает препараты ингибиторов ароматазы или тамоксифен.
Неоадъювантная терапия представляет собой комплексное лечение перед проведением оперативного вмешательства или лучевой терапией. Она применяется в следующих случаях:
- для уменьшения размеров опухоли и ее метастазов;
- для уменьшения объема хирургического вмешательства;
- для увеличения безрецидивной и общей выживаемости;
- для определения чувствительности опухоли к цитостатикам;
- для оценки новых способов лечения.
Такая терапия длится от 3 до 6 месяцев, хотя при положительном результате лечение продлевается.
Назначается пациенткам с неоперабельным раком и при генерализации. Также лечебную терапию назначают молодым женщинам с метастазами в печень или легкие, а также в период ремиссии.
Выбор лечения рака молочной железы зависит от многих факторов, среди которых:
- гормональный статус обнаруженной опухоли;
- менопаузальный статус женщины;
- стадия заболевания;
- применяемые ранее способы лечения;
- наличие сопутствующих соматических болезней;
- риск развития рецидива.
После применения неоадъювантной терапии у 80% пациенток опухоль уменьшается в размерах, а у 15% — отмечена полная морфологическая ремиссия.
Все виды терапии применяются в Юсуповской больнице. Врач, учитывая состояние пациентки, природу опухоли и стадию заболевания, подберет оптимальную схему лечения, которая поможет в эффективном лечении.
Гормонотерапию при раке молочной железы подбирают в зависимости от того, сохранен ли у женщины менструальный цикл. Так, пациенткам в пременопаузе (менструальный цикл постоянный) назначают:
- тамоксифен сроком на 5 лет (на ранних стадиях заболевания);
- операцию по удалению яичников;
- после удаления яичников или подавления их функции с помощью медикаментов назначают ингибиторы ароматазы.
Женщинам в период менопаузы (пациентка находится в климактерическом или постклимактерическом состоянии):
- назначают ингибиторы ароматазы после хирургического вмешательства, химической и лучевой терапии;
- если пациентка до менопаузы принимала тамоксифен, то его заменяют ингибиторами ароматазы;
- если женщина принимала тамоксифен на протяжении последних 5 лет, то его заменяют фемарой;
- если при лечении тамоксифеном была выявлена новая опухоль или рецидив, то вместо него назначают ингибиторы ароматазы;
- если в период приема ингибитора ароматазы выявлен рецидив, то его заменяют на тамоксифен, фаслодекс или назначают другой ингибитор ароматазы.
Опухоли по своей природе могут быть доброкачественными и злокачественными. Если опухоль доброкачественная, при этом существует риск ее перехода в рак, то единственным препаратом, который назначается таким пациенткам, является тамоксифен. Также он применяется при обнаружении протоковой карциномы in situ.
Женщинам с HER2-позитивным раком предпочтительнее назначать ингибиторы ароматазы. Также они назначаются, если тамоксифен оказался нерезультативным.
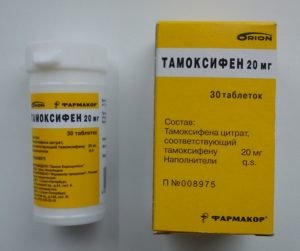
Относится к группе антиэстрогенов и препятствует соединению эстрогенов с раковыми клетками, что, соответственно, не дает последним увеличиваться. Его назначают женщинам на ранних стадиях заболевания и в период предменопаузы.
Одно из торговых названий этого препарата – Тамоксифен-Нолвадекс (в таблетках). У некоторых пациенток при их приеме отмечается сухость влагалища или, наоборот, чрезмерные выделения, усиленное потоотделение, покраснение кожи, увеличение веса.
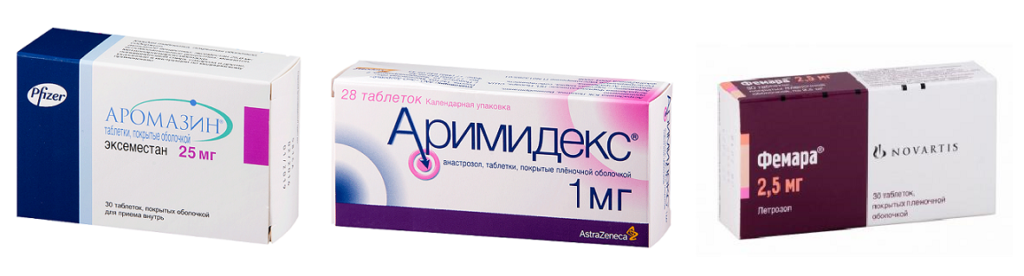
Эти препараты блокируют выработку эстрогенов в организме женщины и назначаются пациенткам уже после наступления менопаузы. Как показывает практика, многим женщинам удалось преодолеть рак молочной железы благодаря приему одного из этой группы препаратов (аримидекс, фемара, аромазин). Каждый препарат назначается в определенных случаях:
- аримидекс – на ранних стадиях заболевания сразу после удаления опухоли;
- аромазин – на ранних стадиях рака тем женщинам, которые ранее несколько лет принимали тамоксифен;
- фемара – на ранних стадиях болезни после оперативного вмешательства пациенткам, которые принимали тамоксифен 5 и более лет.
У большинства женщин прием этих препаратов не вызывает никаких негативных симптомов, но некоторые отмечают тошноту, сухость во влагалище и боль в суставах. Также длительный прием ингибиторов ароматазы может стать причиной хрупкости костей, поэтому вместе с данными препаратами параллельно назначают кальций и витамин Д.
Этот препарат является аналогом природного ЛГРГ и применяется для подавления работы гипофиза. Он снижает количество гормонов, которые вырабатывают эстрогены, но при прекращении его приема гипофиз начинает работать в усиленном режиме. Поэтому врачи после нескольких месяцев приема золадекса рекомендуют операцию по удалению яичников (овариоэктомию) хирургическим способом или путем облучения.
Побочное действие препарата заключается в снижении полового влечения, покраснении, сильном потоотделении, головных болях, перепадах настроения. Золадекс вводят внутримышечно в нижнюю часть брюшной стенки 1 раз в месяц.
Несмотря не огромную пользу, гормонотерапия имеет ряд негативных последствий. Примерно половина женщин, которым назначается гормонотерапия при раке молочной железы, отмечают:
- увеличение массы тела;
- потливость;
- отечность;
- сухость влагалища;
- преждевременное наступление менопаузы;
- перепады настроения, депрессия.
Широко используемый препарат тамоксифен может стать причиной образования тромбов, рака матки и бесплодия. Препараты, которые направлены на снижение уровня эстрогенов (ингибиторы ароматазы), в некоторых случаях приводят к остеопорозу, повышению холестерина, заболеваниям ЖКТ. При появлении вышеперечисленных симптомов следует немедленно обратиться к доктору. Он сможет подобрать другие оптимальные лекарства.
С момента обнаружения опухоли в молочной железе женщине нужно пересмотреть свой рацион. Правильно подобранная диета позволит значительно улучшить общее самочувствие и снизить риск дальнейшего развития заболевания.
Питание при раке должно быть максимально сбалансированным, с большим количеством витаминов и микроэлементов. Кушать необходимо часто, но маленькими порциями, при этом придерживаться принципа раздельного питания.
Врачи Юсуповской больницы считают, что питание при гормонотерапии рака молочной железы должно быть именно таким:
- употреблять много ярко окрашенных овощей и фруктов (морковь, тыква, томаты, капуста, клюква, чеснок) и злаков (коричневый рис, пророщенная пшеница, отруби);
- калорийность рациона должна зависеть от веса пациентки: женщинам с лишним весом с помощью диеты нужно попытаться избавиться от лишних килограммов;
- уменьшить количество животных жиров в рационе и увеличить количество растительных;
- употреблять пищу, богатую кальцием и витамином Д;
- отказаться от продуктов, в состав которых входят фитоэстрогены;
- полностью исключить копченую, жареную, соленую, острую пищу и продукты с консервантами;
- ограничить количество сахара (в том числе и напитков с его содержанием);
- полностью отказаться от алкоголя, курения и наркотических средств;
- как можно меньше кушать красное мясо;
- обязательно добавить в рацион морскую рыбу, морепродукты, морскую капусту;
- ежедневно употреблять 1-2 порции молочных продуктов;
- пить как можно больше сырой воды (не менее 2-2,5 л в день), зеленого чая и отваров из травяных сборов.
В Юсуповской больнице есть все необходимое оборудование для диагностики и лечения заболевания, а при выявлении образования в молочной железе в лаборатории можно сделать анализ на определение его природы.
Важно заметить, что каждая женщина в возрасте после 35 лет должна раз в год посещать маммолога чтобы исключить вероятность патологических образований в груди. Это можно сделать в Юсуповской больнице, которая находится по адресу: 117186, г. Москва, ул. Нагорная, д.17, корп.6, предварительно записавшись на прием.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Гормонотерапию для лечения раковых опухолей молочной железы применяют уже более века. Еще в конце XIX века были опубликованы первые результаты лечения пациентов с раком молочной железы методом овариэктомии (удаление яичников), которые показали хорошую эффективность.
После онкологи предложили различные методы гормонотерапии: лучевую кастрацию, прием андрогенов, удаление надпочечников, хирургическое разрушение гипофиза, прием антиэстрогенов, антипрогестинов, ингибиторов ароматазы.
Со временем были разработаны эффективные методы гормонотерапии – лучевой, хирургической, лекарственной.
На сегодняшний день гормонотерапия является неотъемлемой частью комплексной терапии на любой стадии рака груди.
Выделяют два направления данного вида лечения рака груди: прекращение (торможение) выработки эстрогенов и прием антиэстрогенных препаратов.
Лечение выбирает специалист, с учетом различных факторов – возраст и состояние пациентки, стадия заболевания, сопутствующие болезни. Операция по удалению яичников назначается только женщинам с сохраненной менструальной функцией или при ранней менопаузе, в постменопаузе эффективны препараты снижающие уровень эстрогена, в репродуктивном возрасте используют релизинг-гормоны
Опухоли молочной железы относят к гормонозависимым, но только у примерно 40% пациентов наблюдается положительный эффект от гормонотерапии,.
Стоит отметить, что некоторые препараты могут заменить оперативное лечение, к примеру, прием ингибиторов ароматазы позволяет избежать удаления надпочечников, релизинг-гормоны – удаление яичников.

Как и любое другое лечение, гормонотерапия рака молочной железы имеет последствия, среди которых можно выделить увеличение веса, отечности, ранняя менопауза, повышенная потливость, сухость влагалища.
Кроме того, некоторые пациентки отмечают на фоне лечения угнетение настроения, развитие депрессии.
Некоторые препараты, обладают тяжелыми побочными эффектами, например, широко используемый тамоксифен увеличивает риск образования тромбов, может привести к раку матки, бесплодию.
Препараты, снижающие выработку эстрогенов (ингибиторы ароматазы), которые назначаются в период постменопаузы, провоцируют остеопороз, увеличивают риск образования тромбов, болезней ЖКТ, повышают уровень холестерина.
Эффективность лечения при гормонозависимых опухолях довольно высокая. Если в раковых клетках выявлены и прогестероновые и эстрогеновые рецепторы, то гормонотерапия будет эффективна на 70%, если выявлен только один тип рецепторов – на 33%.
При других типах опухоли эффективность гормонотерапии при раке груди достигает всего 10%.
Гормонотерапия рака молочной железы достаточно эффективный метод терапии гормонозависимых опухолей груди. Такой метод также называют антиэстрогеновым и основной целью такого лечения является предотвращение воздействия женского гормона на раковые клетки.
Гормонотерапия при раке молочной железы показана женщинам при неинвазивных формах рака (для предупреждения повторного развития заболевания либо перехода в инвазивный раковый процесс), после операции, лучевой или химиотерапии для уменьшения вероятности рецидива, при больших опухолях (перед оперативным лечением терапия позволяет уменьшить новообразование и помогает хирургу выявить патологические ткани), при метастазах (гормонотерапия позволяет остановить дальнейшее метастазирование), а также при генетической предрасположенности.
Гормонотерапия при раке молочной железы сегодня происходит по двум направлениям: лечение с учетом менструального цикла и вне зависимости от него.
При универсальных методах гормонотерапии не зависящих от менструального цикла используют антиэстрогены и прогестины.
Самым распространенным и исследованным, уже длительное время применяемом онкологами, является антиэстрогеновое средство – тамоксифен. При длительном приеме препарат может увеличить уровень эстрогена в крови, повышает риск развития гормонозависимой опухоли в других органах, также клинически доказана вероятность развития тромбоэмболических осложнений и токсическое действие на печень.
Сегодня в большинстве случаев тамоксифен назначается не дольше, чем на 5 лет.
Не менее популярными препаратами из этой группы являются торемифен, ралоксифен.
Отдельно сказать стоит о фулвестранте, которому современная гормонотерапия рака груди отводит особое место. Препарат разрушает эстрогеновые рецепторы опухоли, поэтому ряд специалистов относят его к «истинным антагонистам».
Стандартно онкологи назначают гормонотерапию по одной из трех основных схем, которые отличаются принципом действия – уменьшение в крови уровня эстрогена, блокировка эстрогеновых рецепторов, снижение синтеза эстрогена.
После обследования может быть назначено следующее лечение:
- избирательные модуляторы эстрогеновых рецепторов – терапия направлена на отключение эстрогеновых рецепторов (химические вещества оказывают избирательное действие на клетки, оказывая подобное эстрогенам действие), основным препаратом этого направления является тамоксифен.
- препараты, ингибирующие аромотазу – используют в период постменопаузы, снижают производство эстрогена. В практике онкологов используется летрозол, анасторозол, экземестан.
- блокировка и разрушение эстрогеновых рецепторов (Фулвестрант, Фаслодекс).
Эстрогеновые рецепторы находятся на раковых клетках и притягивают эстрогены, которые способствуют дальнейшему росту опухоли. В зависимости от их уровня лаборатория делает заключение о гормонозависимости опухоли, после этого, врач определяет схему лечения выбрать.
Противоопухолевый препарат Тамоксифен оказывает антиэстрогеновое действие. После приема тамоксифен связывается с эстрогенными рецепторами в органах, подверженных развитию гормонозависимых опухолей и тормозит рост раковых клеток (в случае если развитие опухоли вызвано ß- 17- эстрогенами).
Назначается мужчинам и женщинам (преимущественно в период менопаузы) с раком груди, при раке яичников, эндометрия, почек, предстательной железы, после операций для корректировки гормонального фона.
Дозировка устанавливается индивидуально, с учетом состояния пациента.
При раковой опухоли молочной железы обычно назначается по 10мг 1-2 раза в сутки. При необходимости специалист может повысить дозировку до 30 – 40 мг в сутки.
Тамоксифен необходимо принимать длительно (от 2 месяцев до 3 лет) под наблюдением врача. Курс лечения определяется индивидуально (обычно препарат прекращают принимать через 1-2 месяца после регрессии).
Повторный курс проводят после 2-х месячного перерыва.
После удаления молочной железы для коррекции уровня гормонов назначают 20мг в сутки.
Прием препарата может вызвать тошноту, рвоту, расстройство пищеварения, отсутствие аппетита, в отдельных случаях приводит к чрезмерному накоплению жира в печени, гепатиту. Возможны депрессии, головные боли, отечность, аллергические реакции, боли в костях, повышение температуры. Длительный прием может спровоцировать поражение сетчатки, катаракту, патологии роговицы.
У женщин может вызвать разрастание эндометрия, кровотечения, подавление менструаций, у мужчин – импотенцию.
Торемифен по принципу действия близок к тамоксифену, препарат препятствует выработке эстрогена в организме. Назначается в период постменопаузы, от 60 до 240 мг каждый день в течение нескольких лет.
На фоне лечения могут возникнуть негативные реакции организма, в частности, головокружение, повышение внутриглазного давления и развитие катаракты, инфаркт миокарда, острую закупорку кровеносных сосудов, снижение уровня тромбоцитов, аллергические реакции, увеличение ткани эндометрия, тромбоз, чувство жара, повышенная потливость.
Торемифен оказывает токсическое действие на печень.
Одновременный прием с препаратами, снижающими выведение кальция с мочой, повышает риск гиперкальцемии.
Нельзя одновременно принимать Торемифен с препаратами, удлиняющими интервал QT.
Во время приема рифампицина, фенобарбитала, дексаметазона, фенитоина и других индукторов CYP3A4 может потребоваться увеличение дозировки Торемифена.
Лечение должно проводиться под контролем врача.
Ралоксифен избирательный модулятор эстрогеновых рецепторов. Назначается при раковых опухолях молочной железы в период менопаузы для предупреждения развития остеопороза (снижение плотности и нарушение структуры костей).
Препарат нормализует уровень кальция, снижая его выведение из организма почками.
Ралоксифен необходимо принимать длительное время (по 60мг в сутки), обычно в пожилом возрасте дозировка не корректируется.
На фоне лечения могут появиться судороги икроножных мышц, тромбоэмболия, отеки, ощущение жара в теле. При возникновении маточного кровотечения необходимо обратиться к лечащему врачу и пройти дополнительное обследование.
Во время лечения необходимо принимать кальций.
Противораковый препарат Фулвестрант также подавляет эстрогенные рецепторы. Препарат блокирует действие эстрогенов, при этом эстрогеноподобная активность не наблюдается.
Данных о возможном влиянии на эндометрий, эндотелий в период постменопаузы, костную ткань нет.
В онкологии используется для лечения раковых опухолей груди в виде инъекций, рекомендуемая доза 250мг 1р в месяц.
Во время лечения могут появиться тошнота, расстройство стула, потеря аппетита, тромбоэмболия, аллергические реакции, отечность, боли в спине, выделения из сосков, повышается риск развития инфекций мочевыводящих путей, кровотечений.
Фаслодекс включает то же действующее вещество, что Фулвестрант, обладает антиэстрогеновым действием.
Назначается при распространенном раке груди в период постменопаузы.
Используют препарат в виде инъекций (внутримышечно) раз в месяц по 250мг.
При средневыраженных нарушениях функции печени корректировки дозы не требуется.
Безопасность препарата при нарушении работы почек не проверялась.
Летрозол подавляет синтез эстрогенов, обладает антиэстрогеновым действием, избирательно ингибирует аромотазу.
Стандартно назначается 2,5мг в сутки в течение 5 лет. Препарат нужно принимать ежедневно, независимо от приема пищи.
Летрозол нужно прекратить в случае, если проявляются первые симптомы прогрессирования заболевания.
На последних стадиях, при метастазировании прием препарат показан пока наблюдается рост опухоли.
При печеночной недостаточности и пожилым пациентам корректировка дозы не требуется.
Данные об одновременном приеме с другими противораковыми препаратами отсутствуют.
Следует с осторожностью назначать Летрозол с препаратами, которые метаболизируются изоферментами CYP2A6 и CYP2C19.
Анастрозол относится к антагонистам эстрогенов, избирательно подавляет ароматазу.
Показан для лечения начальных стадий гормонозависимых опухолей молочной железы в постменопаузе, а также после лечения тамоксифеном.
Препарат нужно принимать за 1ч до приема пищи (или через 2-3 часа после).
Обычна назначается по 1 мг в сутки, длительность лечения определяется индивидуально с учетом тяжести и формы заболевания.
Нельзя принимать одновременно с Анастрозолом препараты, содержащие гормоны.
На фоне лечения снижается плотность костей.
Данных об эффективности комплексного лечения (Анастрозол + химиотерапия) нет.
Прием препарата может спровоцировать сильные головокружения, продолжающиеся головные боли, сонливость, депрессии, отсутствие аппетита, рвоту, сухость во рту, аллергию, бронхит, ринит, фарингит, боли в груди, спине, повышенное потоотделение, снижение подвижности суставов, отечность, облысение, увеличение веса.
Одновременный прием томоксифена и анастрозола противопоказан.
Экзместан показан для лечения и профилактики рака или злокачественных образований в молочной железе, относится к антагонистам эстрогенов.
Принимают Экзместан после еды по 25мг в день, длительность приема – до повторного прогрессирования опухоли.
Не рекомендуется назначать препарат женщинам в пременопаузным эндокринным статусом, поскольку нет данных об эффективности и безопасности лечения у этой группы пациентов. При нарушениях работы печени корректировка дозы не требуется.
Назначают Экзместан после определения постменопаузного статуса пациентки.
На фоне лечения может появиться быстрая утомляемость, головокружения, головные боли, нарушение сна, депрессии, рвота, отсутствие аппетита, расстройства стула, аллергии, повышенная потливость, облысение, отечность.
Препараты, содержащие эстрогены подавляют терапевтическое действие Экзместана.
источник
Рак молочной железы относят к гормонозависимым опухолям, поэтому очень действенным считается проведение гормонотерапии при раке молочной железы.
Гормонотерапия это один из способов терапии онкологии молочной железы, среди которых химиотерапия, радиотерапия и хирургический способ лечения. Гормонотерапия преследует своей целью уменьшить воздействие гормона эстрогена на раковое новообразование.
Метод лечения гормонами составляет специалист, он учитывает стадию заболевания, статус менопаузы женщины, риск рецидивного возникновения раковой опухоли. Очень важно сочетать лечение онкологии груди с другими заболеваниями, так их присутствие может усилить побочные эффекты.
При лечении такого вида рака применяются различные виды лечения, в постменопаузе отличный результат выдают лекарственные препараты, которые понижают выработку гормона эстрогена, а в репродуктивном возрасте применяют релизинг-гормоны.
Назначение гормональной терапии показано, если биопсия показала, что рак является гормонозависимым и это делает лечение в 70% случаев успешным.
Гормонозависимая опухоль груди появляется, если повышается гормон эстроген, а его повышение возможно при использовании его при лечении:
- поликистоза яичников;
- нарушений месячных;
- миомы матки.
К группе риска можно отнести женщин, которые:
- имеют сбои в работе яичников;
- сделали аборт;
- имели угрозу выкидыша;
- перенесли замершую беременность.
Симптомами гормонозависимой опухоли груди считаются:
- увеличение лимфоузлов;
- боли в месте новообразований;
- появление уплотнений.
Показателями для рекомендации лечения гормонотерапией при гормонозависимых опухолях являются:
- наследственный фактор;
- внушительные размеры опухоли;
- рак на последней стадии;
- метастатический рак;
- для предотвращения рецидива после лечения карциномы;
- возникновение метастаз.
Уменьшение уровня эстрогенов и прогестерона в крови проявляет, в общем, положительное воздействие на здоровье женщины, это снижает вероятность рецидива гормонозависимого заболевания.
Гормонотерапию целесообразнее проводить в сочетании с прочими способами лечения. Назначение лечения гормональными препаратами проводят при:
- Вероятности появления метастазов;
- Различных уплотнениях после проведения операции;
- Раке, не поддающегося химиотерапии;
- Росте новообразования в отсутствии роста онкоклеток.
Запомните! Терапия рака молочной железы при помощи гормонотерапии разрешает одновременно несколько проблем, каждая из которых требует использование определенного препарата.
Выбор метода воздействия зависит от некоторых факторов:
- Предыдущих способов лечения;
- Гормонального статуса раковой опухоли;
- Стадии онкологического заболевания;
- Непереносимости препаратов;
- Сопутствующих диагнозов (некоторые болезни ухудшают прогнозы основного заболевания);
- Периода жизни пациента – пре- и постменопауза.
Так же при назначении лечения требуется знать, присутствуют ли в опухоли рецепторы к гормонам, и к которым именно. От гормонального статуса заболевания зависит и назначение лечения. Наиболее благоприятный прогноз, когда есть рецепторы одновременно к прогестерону и эстрогену, также бывают случаи:
- Негативности ко всем гормонам;
- Неизвестного гормонального статуса;
- Чувствительности только к эстрогену (прогестерону), когда рецептор эстрогена (прогестерона) позитивный.
Гормонотерапия рака молочной железы (РМЖ) подразделяется на три вида:
- Адъювантная гормонотерапия может длиться около 5-10 лет, она выполняется для уменьшения риска рецидива карциномы;
- Неоадъювантная гормонотерапия проводится в промежутке 3-6 месяцев, ее назначают перед операцией, когда опухоль более 2 см и в процесс втянуты лимфоузлы;
- Лечебная гормонотерапия применяется при неоперабельных опухолях или для уменьшения и устранения раковых очагов (больше 2 стадии (2а)).
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
Можно выделить несколько ведущих видов гормонального лечения, любой из которых имеет отдельный механизм воздействия: понижение уровня эстрогена в крови, прекращение его выработки или ее уменьшение:
- Ингибиторы ароматазы. Они оказывают влияние на концентрацию эстрогенов, блокируя рецепторы и не давая клеткам размножаться и делиться. Такие ингибиторы прописываются больным после наступления менопаузы. Можно выделить 3 вида ингибиторов ароматазы при онкологии груди: Фемара, Аримидекс, Аромазин. Но эти препараты могут привести к повышению хрупкости костей. При приеме подобных препаратов назначается кальций с витамином D, для предотвращения остеопороза;
- Блокираторы эстрогеновых рецепторов, при эстрогенозависимых опухолях. Эти препараты предотвращают воздействие на клетки раковой опухоли. К таким препаратам можно отнести: Фулвестрант, Фазлодекс;
- Модуляторы рецепторов к эстрогенам, которые останавливают выработку эстрогенов. Это антиэстрогенные препараты в таблетках: Кломифен, Тамоксифен;
- Прогестины, которые уменьшают выработку определенных гормонов гипофиза, которые ответственны за появление андрогенов и эстрогенов;
- Воздействие на яичники — еще один способ гормонотерапии. Таких способов три: медикаментозный (инъекции Золадексом или Люпроном), хирургический (удаление яичников — овариэктомия), радиационное облучение.
При лечении возможны побочные эффекты, появление которых зависит от множества факторов: стадии онкологического заболевания молочной железы, когда было получено лечение, возрастной категории пациентки, общего состояния здоровья, схемы назначенного лечения. Самыми частыми побочными эффектами являются:
- Преждевременный климакс и сопутствующие ему симптомы – приливы, увеличение веса и т.д.;
- Отечность ног;
- Проблемы со сном;
- Нарушение пищеварения (запоры или поносы);
- Боли в деснах;
- Сухость влагалища;
- Тошнота или рвота;
- Алопеция;
- Усиленная потливость;
- Депрессия;
- Ухудшение памяти.
В основном, эти симптомы через непродолжительное время проходят (спустя несколько недель по завершению лечения гормонами), иногда может продолжаться до 2 месяцев.
Ингибиторы ароматазы могут спровоцировать возникновения остеопороза, повышают холестерин в крови, могут вызвать проблемы с ЖКТ и приводят к алопеции.
Тамоксифен повышает риск тромбообразования, гепатита, является фактором риска для возникновения рака матки и проблем бесплодия.
Золадекс и Люпрон вызывают скачки давления, артралгию, депрессию.
После хирургического удаления яичников может нарушаться водно-солевой обмен, может развиться алкалоз, поднятие уровня сахара в крови, также может диагностироваться синдром Кушинга и язвенные поражения органов ЖКТ.
При приеме прогестинов возможно прибавление веса, выпадение волос, тромбоэмболические осложнения.
Диета при лечении гормонотерапией может понизить вероятность появления рецидива заболевания. В питании предпочтение надо отдавать отварным или тушеным блюдам, исключив полностью жареное. Также ограничения касаются употребления сахара, солений, жиров животного происхождения. Полностью исключить требуется:
- Консерванты;
- Кофе;
- Сою;
- Фастфуд;
- Продукты с пищевыми добавками;
- Алкоголь.
Из мясных блюд желательно употреблять нежирные сорта мяса, рекомендуется добавлять в пищу лук и чеснок. Пить побольше жидкости, простой воды. В рационе должны присутствовать следующие продукты:
- Морепродукты;
- Крупы;
- Фрукты;
- Растительные жиры;
- Жирная морская рыба;
- Морская капуста;
- Яйца;
- Овощи;
- Молочные продукты.
Эффективность гормонотерапии при онкологии молочной железы зависит от размера опухоли, также играет немаловажную роль наличие сопутствующих заболеваний и иммунитет пациентки.
Эффективность лечения гормонотерапией довольно высока, но требуется соблюдение всех рекомендаций врача, в том числе относительно питания.
Прогнозы гормонотерапии довольно оптимистичны, особенно, если гормонозависимая опухоль имеет рецепторы, и прогестерона, и эстрогена, тогда эффективность лечения составляет – 70 % случаев, при нахождении в опухоли, хотя бы одного из гормонов – эффективность составляет 30%. При прочих видах карциномы груди эффективность терапии составляет всего лишь 10%. При опухоли, которая считается негормонозависимой, такой тип лечения применять нецелесообразно.
Нужна ли гормонотерапия после мастэктомии?
Для предотвращения появления метастаз гормонотерапию могут назначить после хирургического вмешательства.
источник