В большинстве случаев обследования больных с локализованными опухолями врач приходит к выводу, что болезнь носит преимущественно системный характер, и метастазы разовьются позже. Обнаружение многочисленных метастазов, часто спустя годы после проведения мастэктомии, а также в течение многолетнего наблюдения за больными подтверждает этот вывод.
По данным классических исследований Бринкли и Хейбитл, общая выживаемость больных раком молочной железы через 25 лет после лечения составляет только 20%. Даже среди пациенток, которым мастэктомия была сделана своевременно («ранние» операбельные случаи), выживаемость составляет лишь 30%.
Обычно появление метастазов приводит к смертельному исходу в пределах трех лет, хотя в случаях, когда лечение оказывается эффективным, пациентки могут жить дольше. Вероятность метастазирования опухоли сильно зависит от степени вовлечения подмышечных лимфатических узлов в патологический процесс, что определяется при гистологическом анализе образцов, взятых во время операции.
Существует взаимосвязь между количеством пораженных подмышечных лимфатических узлов и вероятностью распространения метастазов.
Со времени проведения первой операции терапевтической овариэктомии, проведенной Битсоном в 1896 г., стало очевидно, что при изменении гормонального статуса организма в случаях распространенного опухолевого процесса, по крайней мере для одной трети пациенток достигается симптоматический эффект.
Использовались различные методы: удаление яичников или их облучение (иногда называемое «создание искусственной менопаузы»), лечение эстрогенами, антиэстрогенами и антагонистами гонадотропин-рилизинг-гормона (например, гозерелином). Этот гормон регулирует секрецию лютеинизирующего гормона (LHRH).
Также применяли анаболические стероиды, глюкокортикоиды и прогестерон, проводили удаление надпочечников или гипофиза и назначали ингибиторы ароматазы (анастрозол или летрозол).
Стандартный подход основан на менструальном статусе пациентки. Для большинства больных с метастазирующими опухолями в пременопаузе и перименопаузе используется хирургическое удаление яичников или их облучение. Однако с появлением антагонистов гонадотропин-рилизинг-гормона эти процедуры стали применять реже.
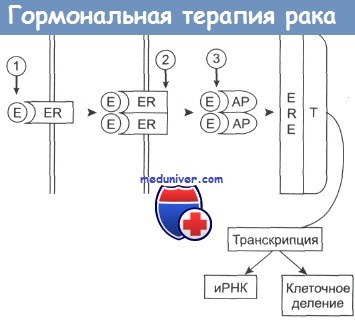
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.
Антагонисты обеспечивают стойкое снижение уровня эстрогенов и вызывают у пациентки состояние менопаузы, которое длится в продолжении примерно двух месяцев с начала применения гозерелина. Препарат назначается ежемесячно в виде внутримышечных инъекций. Вместе с тем в качестве альтернативы снова стал популярным такой хирургический метод, как лапароскопическое удаление яичников.
Это достаточно безопасная и несложная операция, после которой пациентка на одну ночь остается в стационаре. Следует отметить, что перед операцией больные проходят тщательный отбор по критерию гормональной чувствительности опухоли, и тем, для кого не предполагается проявление лечебного эффекта, операция не проводится.
Для пациенток с опухолью в постменопаузе широко применяется тамоксифен, поскольку он практически не проявляет побочных эффектов. Препарат действует как антиэстроген, но, вероятно, оказывает и прямой цитотоксический эффект. В течение почти 20 лет тамоксифен использовался в качестве стандартного препарата адъювантной терапии.
Тамоксифен назначается перорально в ежедневной стандартной дозе 20 мг. Он обладает медленным кумулятивным действием. Побочные эффекты редки, однако могут наблюдаться приливы, тошнота, гиперкальциемия, тромбоцитопения, удержание жидкости и расстройство менструального цикла. После приема препарата большинство пациенток прибавляют 1-2 фунта в весе и некоторые отмечают ухудшение состояния кожи, волос и ногтей.
Гораздо более существенный эффект получен при назначении гормонотерапии пациенткам с гормонально зависимыми опухолями, в то время как при лечении гормонально независимых опухолей благоприятный эффект наблюдался лишь в редких случаях. Прогноз в случаях гормонально зависимых и независимых опухолей отличается. Для больных с гормонально-зависимыми опухолями характерен более длительный безрецидивный период и большая выживаемость.
Совместное определение показателей ER и PR обеспечивает более точный прогноз в отношении чувствительности опухоли к гормонотерапии, чем это оказывается возможным при оперировании только показателем ER. Больные с PR-положительными опухолями также характеризуются более длительным безболезненным периодом.
На эффективность гормонотерапии сильно влияет характер распространения метастазов. Костные метастазы проявляют некоторую чувствительность к гормонам, хотя после лечения пациентки живут в среднем около 12-15 месяцев. Тем не менее некоторые больные с гормоночувствительными опухолями и с костными метастазами живут дольше, иногда несколько лет.
В большинстве случаев, при рецидиве опухоли, развившейся в пременопаузе, применяется гозерин (или его аналоги) или лапароскопическая овариэктомия (или облучение яичников). Эти меры эффективны для гормонально чувствительных опухолей. При опухолях в периоде постменопаузы обычно назначают тамоксифен, если пациентки раньше не получали этот препарат в качестве средства адъювантной терапии.
В любом случае можно ожидать, что выживаемость больных составит по крайней мере 30%. Экзогенные гормоны назначают до тех пор, пока не наступит эффект. В дальнейшем гормональную терапию продолжают только тем пациенткам, у которых проявился эффект первичного лечения. Предложены новые противоопухолевые препараты, относящиеся к группе ингибиторов ароматазы.
К числу их относится анастрозол, который блокирует биосинтез предшественников эстрогенов и их последующие превращения в тканях. Анастрозол действует при пероральном применении. Он хорошо переносится больными, так же как и другие родственные соединения, благодаря чему эти препараты быстро заняли место тамоксифена, который оказался неэффективным в лечении пациенток с гормонозависимыми опухолями, развивающимися в период постменопаузы. Рекомендуемая ежедневная доза препарата составляет 1 мг.
Если после первичного лечения возникает рецидив, то назначают другие препараты, например анаболические стероиды, прогестогены и глюкокортикоиды. Анаболические стероиды более эффективны у пациенток с опухолями, развившимися в постменопаузе, и, по-видимому, их особенно необходимо применять в случаях обнаружения костных метастазов.
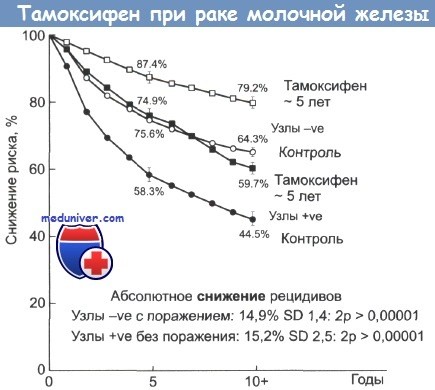
Светлые значки — пациентки без признаков поражения лимфатических узлов; затемненные значки — пациентки с признаками поражения лимфоузлов.
Благоприятный эффект достигается примерно у 20% пациенток, однако недостатком применения стероидов является вирилизация. Удобным для применения является нандролон деканоат (Deca-Durabolin), который назначается в виде внутримышечных инъекций в дозе 50-100 мг каждые 3-4 недели. Если гормонотерапия раньше давала положительные результаты, то можно применять прогестогены. Наиболее часто используется ацетат медроксипрогестерона (МРА, Provera), который обычно назначают перорально в дозе 100 мг три раза в день.
Однако его применение ограничено из-за развития побочного эффекта — прибавления в весе. Такой же эффективностью обладает другое производное прогестерона — мегестрол-ацетат (Megace).
Широко обсуждается вопрос выбора метода лечения первого рецидива опухоли. Следует в этом случае использовать гормональный метод или же химиотерапию с использованием цитотостатиков? Если принимать во внимание количественные показатели, то выбирать надо между гормонотерапией (эффективна в 30% случаев) и комбинационной химиотерапией (эффективность которой в два раза выше). Однако это упрощенное решение вопроса, ответить на который на самом деле сложно.
Реакция опухоли на гормоны обычно носит более продолжительный характер, и у пациентки наблюдаются минимальные токсические проявления. При химиотерапии развивается более кратковременный эффект, который сопровождается токсическими и психологическими осложнениями. Большинство клиницистов в Великобритании в качестве средства первичного лечения предпочитают использовать гормональную терапию. Выбор облегчается все более широким применением метода анализа состояния рецепторов эстрогенов: гормональная терапия должна проводиться только среди пациенток с ER-положительными опухолями. Недавно предложен препарат фульвестрант (Faslodex), подавляющий функции рецепторов эстрогенов. Он может применяться у пациенток с гормоноустойчивыми опухолями, которые развились в постменопаузе. Одним из основных преимуществ этого препарата, по сравнению с агонистом эстрогенов, тамоксифеном, является отсутствие побочных эффектов. Он также не опустошает пул эстрогенов в женском организме, что происходит при применении ингибиторов ароматазы.
источник

Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Адъювантная гормональная терапия существенно изменила прогноз больных раком молочной железы с наличием рецепторов эстрогенов и прогестерона в опухоли. При назначении тамоксифена отмечается снижение на 50% частоты рецидива на фоне приема препарата и на 30% в следующие 5 лет после прекращения его приема. Это сопровождается снижением смертности на 30% в течение 15 лет с начала приема тамоксифена. Ингибиторы ароматазы в течение 5 лет обладают еще большим эффектом в сравнении с тамоксифеном, уменьшая риск прогрессирования на 30% за период приема и на 15% риск смерти в первые 10 лет. Однако накопленный опыт показывает, что после прекращения 5-летнего приема тамоксифена или ингибиторов ароматазы у больных сохраняется риск отсроченного прогрессирования. Это послужило основанием для проведения исследований по увеличению сроков адъювантной гормонотерапии.
Увеличение продолжительности приема тамоксифена было изучено в двух опубликованных на сегодняшний день исследованиях (таблица 1). В исследовании NSABP-14 увеличение продолжительности приема до 10 лет не привело к улучшению отдаленных результатов. В это исследование включались больные с N0, а значит с низким риском прогрессирования, что не позволило выявить потенциально возможную пользу длительного приема тамоксифена. В исследовании ATLAS увеличение продолжительности приема тамоксифена с 5 до 10 лет привело к достоверному снижению риска прогрессирования и смерти. При этом польза от длительного приема тамоксифена становится достоверной отсроченно, только после прекращения 10-летнего приема препарата. Причиной улучшения результатов лечения является уменьшение частоты локальных рецидивов заболевания, возникновения контрлатерального рака молочной железы (профилактический эффект) и незначительное снижение частоты отдаленных метастазов. В обоих исследованиях отмечено снижение частоты и выраженности ишемической болезни сердца, отсутствие увеличения частоты инсультов и тромбоэмболий и увеличение в 2 раза (с 2-3% до 4-5%) частоты возникновения рака эндометрия.
Таблица 1. Результаты рандомизированных исследований
по сравнению продленной и стандартной адъювантной гормонотерапии.
| Исследование | Число больных | Лечение | Срок наблюдения после рандомизации | БРВ | OВ |
|---|---|---|---|---|---|
| NSABP B-14 [1] | 1172 | Тамоксифен 5 лет Плацебо 5 лет | 7 лет | 78% 82% | 91% 94% |
| ATLAS [2] | 6846 | Тамоксифен 5 лет Плацебо 5 лет | 10 лет | 78,6%* 74,9% | 87,8%* 85% |
| MA.17 [3] | 1918 | Летрозол 5 лет Плацебо 5 лет | 5 лет | 95%* 91% | 93% 94% |
| NSABP B-42 [4] | 3966 | Летрозол 5 лет Плацебо 5 лет | 7 лет | 84,7% 81,3% | Н.Д. |
| IDEAL [5] | 1824 | Летрозол 5 лет Летрозол 2,5 года | 6,6 года | 82% 85,4% | Н.Д. |
| ABCSG-16 [6] | 3482 | Анастрозол 5 лет Анастрозол 2 года | 5 лет | 78% 78% | Н.Д. |
* – статистически достоверная разница;
Н.Д. – нет данных.
Ингибиторы ароматазы продемонстрировали большую эффективность в сравнении с тамоксифеном при проведении адъювантной гормонотерапии больным раком молочной железы с наличием рецепторов стероидных гормонов в опухоли. В связи с этим стало актуальным изучить клиническую эффективность увеличения продолжительности приема ингибиторов ароматазы по сравнению со стандартным 5-летним приемом. В таблице 1 приведены результаты исследования по изучению продленной терапии ингибиторами ароматазы. Следует отметить, что только одно исследование MA.17 опубликовано в полном виде, для всех остальных исследований известна только безрецидивная выживаемость и токсичность терапии. В исследовании MA.17 прием летрозола в течение 5 лет после окончания 5-летней терапии тамоксифеном (79% больных) или ингибиторами ароматазы (21%) привел к достоверному снижению безрецидивной выживаемости, не оказав влияния на общую. Отмечено, что основной причиной снижения безрецидивной выживаемости стало уменьшение частоты контрлатерального рака. В исследования NSABP B-42 10-летний прием летрозола не повлиял на частоту прогрессирования заболевания по сравнению с 5-летним приемом тамоксифена или ингибиторов ароматазы. Анализ токсичности демонстрирует увеличение риска развития сердечно-сосудистых заболеваний и костных переломов на фоне длительного приема препаратов. Риск развития переломов повышается после 7 лет приема ингибиторов ароматазы.
Два исследования посвящены определению оптимальной продолжительности проведения адъювантной гормонотерапии. Дополнительные 5 лет приема были выбраны эмпирически, и остается актуальным сокращение сроков проведения адъювантной терапии для удобства пациентов и уменьшения риска развития побочных эффектов. В исследовании IDEAL сравнивается дополнительное назначение летрозола в течение 2,5 и 5 лет после ранее проведенной стандартной 5-летней адъювантной терапии. При медиане наблюдения 6,6 года после рандомизации не отмечено разницы в показателях безрецидивной и общей выживаемости. Длительный прием летрозола сочетался со снижением частоты контрлатерального рака.
В исследовании ABCSG-16 больным раком молочной железы с наличием рецепторов стероидных гормонов в опухоли и отсутствием амплификации HER2, получавшим адъювантную терапию тамоксифеном или ингибиторами ароматазы в течение 5 лет, назначали дополнительный прием анастрозола в течение 2 или 5 лет. В исследование были включены 3484 больные без признаков болезни на момент рандомизации после 5 лет адъювантной терапии. Стратификация проводилась в зависимости от проводимой гормонотерапии в первые 5 лет (тамоксифен или ингибиторы ароматазы). Предварительные результаты, доложенные на прошедшем симпозиуме по раку молочной железы в Сан-Антонио (США) в декабре 2017 года, свидетельствуют, что частота развития прогрессирования заболевания была одинаковой в обеих группах, безрецидивная выживаемость составила 78% и не зависела от вида гормонотерапии в первые 5 лет. Не отмечено разницы в развитии контрлатерального рака молочной железы. В группе длительного приема анастрозола отмечается повышение частоты костных переломов после 3-го года приема. Авторы делают вывод, что увеличение продолжительности адъювантной терапии на 2 года (всего 7 лет) эффективно предотвращает прогрессирование рака молочной железы и предохраняет от развития побочных эффектов, обусловленных длительным приемом ингибиторов ароматазы. Добавление ингибиторов ароматазы в течение 5 лет не дает выигрыша в улучшении отдаленных результатов и сопровождается увеличением побочных эффектов.
Приведенные исследования показывают, что назначение тамоксифена или ингибиторов ароматазы в течение 7-10 лет может приводить к выигрышу в безрецидивной и общей выживаемости по сравнению с 5-летним их назначением. Очевидно, что выигрыш этот отмечается лишь у меньшинства пациенток, в то время как большинство напрасно получают потенциально токсичную терапию со снижением качества жизни. Поэтому важно при обсуждении увеличения продолжительности гормонотерапии оценивать риск дальнейшего прогрессирования после 5 лет адъювантной гормонотерапии у каждой конкретной больной. Этому было посвящено исследование Оксфордской группы EBCTCG (Early Breast Cancer Trialists Collaborative Group) [7].
Были обобщены 88 исследований по 5-летнему назначению адъювантной гормонотерапии и оценен риск прогрессирования и смерти в течение 15 (5-20) лет после прекращения приема в зависимости от различных прогностических факторов.
Результаты наблюдения за больными в последующие 15 лет после 5-летнего прекращения гормонотерапии демонстрируют увеличение кумулятивного риска прогрессирования и смерти от рака молочной железы. Риск прогрессирования и последующей смерти от рака молочной железы напрямую связан с наличием метастазов и их числом в подмышечных лимфоузлах (см. таблицу 2). В первые 5 лет приема гормональных препаратов наблюдается существенное отставание риска смерти от частоты развития прогрессирования заболевания. Однако при наблюдении в течение 20 лет частота смерти от рака молочной железы догоняет частоту рецидивирования и составляет в зависимости от метастатического поражения подмышечных лимфоузлов 15%, 28% и 49%.
Таблица 2. Риск прогрессирования и смерти при проведении гормонотерапии в течение 5 лет.
| Частота рецидивов | Частота смерти | |||
|---|---|---|---|---|
| 5-летняя | 20-летняя | 5-летняя | 20-летняя | |
| N0 | 6% | 22% | 3% | 15% |
| N1-3 | 10% | 31% | 5% | 28% |
| N4-9 | 22% | 52% | 12% | 49% |
Авторы изучили, какие клинические факторы в наибольшей степени определяют риск прогрессирования после прекращения приема гормонов за период 5-20 лет. Оказалось, что, несмотря на то, что на период 5 лет все больные не имели признаков прогрессирования заболевания, размер первичной опухоли и состояние подмышечных лимфоузлов в момент постановки диагноза в наибольшей степени предсказывали риск прогрессирования в последующие после прекращения приема гормональных препаратов годы. Минимальный ежегодный риск прогрессирования менее 1% и кумулятивный в 13% на период 20 лет отмечается у больных с T1N0. С увеличением размера первичной опухоли и числа метастазов в подмышечные лимфоузлы растет как ежегодный, так и кумулятивный риск прогрессирования, достигая максимальных значений 2,8% и 41% при T2N4-9. У больных с T1N0 на частоту прогрессирования оказывала влияние степень дифференцировки, увеличивая его с 10% при высокой степени до 17% при низкой.
Таким образом, проведенное исследование подтвердило, что после прекращения приема гормональных препаратов в течение 5 лет в последующие годы происходит увеличение риска прогрессирования, степень которого зависит от размера первичной опухоли, наличия и числа метастазов в подмышечных лимфоузлах. Все это оправдывает и объясняет целесообразность увеличения продолжительности приема тамоксифена или ингибиторов ароматазы у больных с высоким риском прогрессирования. При обсуждении необходимости продолжения гормонотерапии после 5 лет приема исследование EBCTCG помогает оценить риск прогрессирования и принять правильное решение.
Можно ли с большей точностью определить популяцию больных, которым показано проведение продленной адъювантной гормонотерапии? Возможно, использование генетических тестов (например, Oncotype DX или MammaPrint) с лучшей точностью в сравнении со стадией болезни позволит выявить пациентов с высоким риском прогрессирования после 5 лет адъювантной терапии. Но пока отсутствуют результаты таких исследований, практический интерес представляет исследование по изучению циркулирующих опухолевых клеток у больных после 5 лет адъювантной гормонотерапии [8]. В исследование, которое было представлено на конференции по раку молочной железы в Сан-Антонио в 2017 году, включались больные раком молочной железы II-III стадий с отсутствием экспрессии HER2, которым проводилась адъювантная химиотерапия с добавлением и без бевацизумаба (исследование E5103). Затем больным с наличием рецепторов стероидных гормонов назначали адъювантную гормонотерапию. У 546 больных без признаков прогрессирования выполняли определение наличия циркулирующих опухолевых клеток в крови методом CELLSEARCH CTC assay в период 4,5-7 лет с момента постановки диагноза.
Оказалось, что циркулирующие опухолевые клетки определяются у 4,8% больных: у больных с наличием рецепторов стероидных гормонов – 5,1%, при отрицательных рецепторах – 4,3%. При медиане наблюдения 1,6 года после выполнения теста наличие циркулирующих опухолевых клеток увеличивает риск прогрессирования в 20 раз у больных с положительными рецепторами и не влияет на частоту прогрессирования при отрицательных рецепторах. Было показано, что риск прогрессирования в ближайшие 2 года у больных с положительными рецепторами и наличием циркулирующих опухолевых клеток и без них составляет 35% и 2% соответственно. Авторы посчитали полученные результаты неожиданными. Первой неожиданностью было обнаружение циркулирующих опухолевых клеток у больных без признаков болезни после 5 лет интенсивной адъювантной химиогормонотерапии. Второй неожиданностью была высокая предсказывающая способность прогрессирования заболевания в случае обнаружения циркулирующих опухолевых клеток только у больных с наличием рецепторов стероидных гормонов в опухоли. И третья неожиданность – это быстрое прогрессирование болезни в этой группе больных после окончания адъювантной гормонотерапии.
Авторы делают вывод, что обнаружение циркулирующих опухолевых клеток у больных с наличием рецепторов стероидных гормонов в момент окончания 5-летнего приема адъювантной гормонотерапии является четким биомаркером быстрого прогрессирования заболевания в ближайшие годы после ее окончания. Можно предположить, что определение опухолевой ДНК в плазме крови больных после 5-летнего приема гормональной адъювантной терапии также может служить индикатором присутствия микрометастазов и высокого риска прогрессирования. Возможно, именно эти больные выигрывают от увеличения продолжительности адъювантной гормонотерапии, а тест на определение циркулирующих опухолевых клеток или опухолевой ДНК будет обязательным для определения оптимальной продолжительности гормонотерапии. Можно думать, что в группе больных с высоким риском прогрессирования будут найдены более эффективные методы лечения в сравнении с увеличением только продолжительности приема гормональных препаратов. Добавление ингибиторов циклинзависимых киназ приведет не только к повышению эффективности адъювантной гормонотерапии, но и к возможному сокращению сроков ее проведения. Интересным представляется назначение ингибиторов контрольных точек иммунного ответа у больных с микрометастазами рака молочной железы после проведения начального этапа гормонотерапии.
Исходя из полученных данных, можно сделать следующие выводы:
- Увеличение продолжительности адъювантной гормонотерапии обладает недостаточной эффективностью, улучшая показатели 10-летней безрецидивной выживаемости на 3-4%. Это обусловлено как резистентностью опухолевых клеток к проводимой более 5 лет гормонотерапии, так и отсутствием селекции больных, которые выигрывают в наибольшей степени от увеличения ее продолжительности.
- У больных с негативными факторами риска (в первую очередь по распространенности опухолевого процесса) можно рекомендовать следующие варианты продленной гормонотерапии:
- при первоначальном приеме тамоксифена 5 лет продление можно осуществить за счет дополнительного назначения тамоксифена еще на 5 лет или ингибиторов ароматазы на 2 года;
- при назначении ингибиторов ароматазы в качестве адъювантной гормонотерапии ее продолжительность должна составлять 5 лет. Проведенные исследования свидетельствуют о возможной пользе увеличения этого срока до 7 лет, что требует подтверждения в дополнительных исследованиях;
- при первоначальном приеме тамоксифена в течение 2-3 лет с последующим переходом на ингибиторы ароматазы в течение еще 2-3-лет можно рекомендовать продление приема ингибиторов до суммарной продолжительности их приема в течение 5 лет.
- Актуальным является поиск биомаркеров, предсказывающих высокий риск прогрессирования после 5 лет гормонотерапии. Именно в популяции больных с высоким риском прогрессирования следует определить как оптимальную продолжительность адъювантной терапии, так и препараты для ее проведения.
Ключевые слова: рак молочной железы, адъювантная гормонотерапия.
- Fisher B, Dignam J, Bryant J, et al. Five versus more than 5 years of tamoxifen for lymph node negative breast cancer: Updated findings from the National Surgical Adjuvant Breast and Bowel Project B-14 randomized trial. J. Natl. Cancer Inst. 2001; 93: 684-690.
- Davies C, Pan H, Godwin J, et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen.receptor-positive breast cancer: ATLAS, a randomised trial. Lancet. 2013; 381: 805-816.
- Goss P, Ingle J, Pritchard K, et al. Extending aromatase-inhibitor adjuvant therapy to 10 years. N. Engl. J. Med. 2016; 375: 209-219.
- Mamounas P, Bandos H, Lembersky C, et al. A randomized, double blinded, placebo-controlled clinical trial of extended adjuvant endocrine therapy with letrozole in postmenopausal women with hormone-receptor breast cancer who have completed previous adjuvant therapy with an aromatase inhibitor: results from NRG Oncology/NSABP B-42. 2016 San Antonio Breast Cancer Symposium. Abstract S1-05.
- Blok E, Kroep J, Meershoek-Klein E, et al. Optimal duration of extended adjuvant endocrine therapy for early breast cancer; results of the >Узнать больше о лечении рака молочной железы можно на
Большой конференции RUSSCO «Рак молочной железы»
(25-26 января 2018, Лотте Отель Москва)
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
источник
В последние годы целый ряд новых гормональных агентов для лечения рака молочной железы (чистые антиэстрогены, ингибиторы ароматазы и агонисты гонадотропин-рилизинг-гормонов) интенсивно изучаются у женщин с гормонозависимыми опухолями. Эти препараты сравниваются с «золотым» стандартом тамоксифеном, а также друг с другом в больших клинических исследованиях.
Тамоксифен vs Анастрозол при диссеминированном раке молочной железы.
Сравнение эффективности ингибитора ароматазы анастрозола с тамоксифеном в качестве гормонотерапии первой линии проведено в двух больших мультицентровых исследованиях, имевших сходный дизайн: Европейском и Северо-Американском. [1,2]. Эти исследования продемонстрировали небольшое повышение эффективности анастрозола по сравнению с тамоксифеном, а также увеличение времени до прогрессирования, особенно у больных с положительными рецепторами к эстрогену.
Аналогичные результаты получены также в исследовании испанских авторов, в котором анастрозол сравнивался с тамоксифеном при проведении гормонотерапии первой линии у больных с положительными рецепторами к эстрогену [3] (табл.4).
Таблица 4.
Анастрозол vs Тамоксифен: Барселонское исследование.
| Тамоксифен | Анастрозол | р | |
|---|---|---|---|
| Кол-во больных | 117 | 121 | |
| Суточная доза | 40 мг | 1 мг | |
| Эффективность | 23% | 34% | Нет данных |
| Среднее время до прогр. | Там > анастрозол | Анастрозол > Там | |
| Кол-во больных | 74 | 85 | |
| Эффективность | 8% | 9% | |
| Стабилизация >24 нед. | 52% | 41% |
Полученные данные свидетельствуют о существенной активности анастрозола у больных с прогрессированием на фоне приема тамоксифена и наоборот. Это несомненно является обнадеживающим для больных с гормоночувствительными опухолями молочной железы. Однако, проведение перекреста не позволяет сделать вывод о том, какой же из двух препаратов обеспечил улучшение выживаемости в этих исследованиях.
При среднем сроке наблюдения 2 года никаких существенных изменений содержания холестерина, липопротеидов низкой и высокой плотности, а также триглицеридов не было отмечено ни среди больных, принимавших тамоксифен, ни в группе пациенток, принимавших анастрозол [5].
Летрозол в сравнении с Тамоксифеном при лечении распространенного и раннего рака молочной железы.
Второй ингибитор ароматазы летрозол также является объектом пристального внимания исследователей. Результаты двух больших исследований представлены компанией Новартис. В первом (двойном слепом, перекрестном) сравнивалась эффективность летрозола и тамоксифена при проведении гормонотерапии первой линии у больных в менопаузе с положительными или неизвестными рецепторами [6]. Полученные результаты представлены в табл. 6.
Таблица 6.
Летрозол в сравнении с тамоксифеном при распространенном раке молочной железы.
| Летрозол | Тамоксифен | Р | |
|---|---|---|---|
| Суточная доза | 2,5 мг | 20 мг | |
| Кол-во больных | 453 | 454 | |
| Средний возраст | 65 лет | 64 года | |
| РЭ+ и/или РП+ | 66% | 67% | |
| РЭ/РП неизвестны | 34% | 33% | |
| Предшествующая терапия тамоксифеном | 20% | 18% | |
| Ср. время до прогрессирования | 9,4 мес. | 6,0 мес. | 0,0001 |
| Эффективность | 30% | 20% | 0,0006 |
| Длительность эффектов | 23 мес. | 23 мес. | >0,05 |
| Ощущение приливов | 18% | 15% |
В этом исследовании летрозол обеспечивал лучшую непосредственную эффективность и более продолжительное время до прогрессирования по сравнению с тамоксифеном. Данные относительно выживаемости отсутствуют. Оба вида лечения переносились больными сравнительно хорошо. Летрозол оценен в сравнении с тамоксифеном также у больных в менопаузе с ранним раком молочной железы [7]. В исследование включались больные, которым планировалось органосохраняющее лечение, с гормонозависимыми опухолями. Продолжительность неоадъювантной гормонотерапии составляла 4 мес., после чего больные подвергались хирургическому лечению. Полученные результаты представлены в табл. 7.
Таблица 7.
Летрозол в сравнении с тамоксифеном в качестве предоперационной гормонотерапии рака молочной железы.
| Летрозол | Тамоксифен | Р | ||||
|---|---|---|---|---|---|---|
| Суточная доза | 2,5 мг | 20 мг | ||||
| Кол-во больных | 154 | 170 | ||||
| РЭ+ | 88% | 87% | ||||
| РП+ | 66% | 60% | ||||
| HER2+ | 12% | 16% | ||||
| Эффективность | 55% | 36% | Европейское исследование 0020 | Северо-Американское исследование 0021 | ||
| Ре жим | Фулвестрант | Анастрозол | р | Фулвестрант | Анастрозол | р |
| Доза | 250 мг | 1 мг | 250 мг | 1 мг | ||
| Кол-во б-ных | 222 | 229 | 206 | 194 | ||
| РЭ+ | 73% | 80% | 87% | 87% | ||
| Предш. адъюв. гормонотерапия | 55% | 52% | 59% | 60% | ||
| Предшеств. гормонотерапия 1 линии | 57% | 56% | 53% | 50% | ||
| Время до прогр. | 5,5 мес. | 5,1 мес. | 0,84 | 5,4 мес. | 3,6 мес. | 0,43 |
| Эффективность | 21% | 16% | 0,20 | 17% | 17% | NS |
| Стаб.>24 нед. | 24% | 29% | 25% | 19% | ||
| Длит. эффекта | 14,3 мес. | 14,0 мес. | 19,3 мес. | 10,5 мес. | ||
| Приливы | 18% | 17% | 24% | 24% |
В целом не было выявлено каких-либо существенных различий в частоте объективных эффектов или времени до прогрессирования между фулвестрантом и анастрозолом. Небольшое различие в длительности эффекта было отмечено в Северо-Американском исследовании.
Экземестан в сравнении с Тамоксифеном в качестве первой линии терапии диссеминированного рака молочной железы.
Экземестан в отличие от анастрозола и летрозола имеет стероидную структуру и необратимо блокирует ароматазу. Сравнение эффективности экземестана и тамоксифена проведено в рамках рандомизированного исследования, в котором приняли участие больные диссеминированным раком молочной железы в менопаузе с положительными РЭ и/или РП [10]. Основные результаты исследования приведены в табл. 9.
Таблица 9.
Экземестан vs Тамоксифен при диссеминированном раке молочной железы.
В этом исследовании экземестан продемонстрировал лучшие непосредственные результаты лечения по сравнению с тамоксифеном.
Экземестан в неоадъювантной терапии местно-распространенного рака молочной железы. Роль экземестана в предоперационной терапии рака молочной железы оценена в небольшом исследовании II фазы [11], в которое включены 13 больных постменопаузального возраста с РЭ+. Участницы исследования получали экземестан в суточной дозе 25 мг в течение 3 месяцев перед хирургическим лечением. В среднем отмечено уменьшение опухолевой массы на 85%, и 83% больных ответили на лечение. В результате изучения биоптатов молочных желез было показано, что экземестан снижает циркуляцию периферических и синтез внутриопухолевых эстрогенов.
Итак, несколько рандомизированных исследований были посвящены сравнению тамоксифена и ингибиторов ароматазы в первой линии гормонотерапии диссеминированного рака молочной железы у больных в менопаузе. В целом, ингибиторы ароматазы отличались более благоприятным спектром токсичности по сравнению с тамоксифеном. В большинстве исследований ингибиторы ароматазы продемонстрировали сравнимую с тамоксифеном, а иногда и превосходящую его эффективность. Полученные результаты свидетельствуют о том, что ингибиторы ароматазы могут рассматриваться, наряду с тамоксифеном, как препараты выбора для лечения больных постменопаузального возраста с РЭ+, правда пока нет четких данных об улучшении выживаемости при использовании ингибиторов ароматазы. Нерешенным остается и вопрос об оптимальной последовательности назначения ингибиторов ароматазы и тамоксифена.
Выключение функции яичников или химиотерапия в качестве адъювантного лечения.
Возрождается интерес к проблеме аменореи/овариоэктомии у женщин пременопаузального возраста с гормонозависимой болезнью. Полагают, что эффект адъювантной химиотерапии частично реализуется через индуцируемую аменорею; исследования по изучению этой проблемы признаны сегодня приоритетными [12]. В частности, в исследовании ZEBRA с участием пациенток пременопаузального ( Время наблюдения
Из представленных данных видно, что выключение функции яичников с помощью гозерелина приводит к более выраженному по сравнению с CMF снижению костной плотности. Однако, ожидается, что в случае восстановления функции яичников по окончании приема гозерелина деминерализация будет менее выраженной.
К сожалению в исследовании ZEBRA не был использован тамоксифен, являющийся стандартом адъювантной терапии раннего гормонозависимого рака молочной железы. По этой причине представляется чрезвычайно сложным использовать полученные результаты в повседневной практике. Тем не менее, в этой работе был наглядно продемонстрирован тот факт, что выключение функции яичников у женщин в пременопаузе с гормонозависимыми опухолями может быть равноэффектиным назначению адъювантной химиотерапии CMF. В дальнейшем предстоит оценить, имеет ли преимущества сочетание кастрации с химиотерапией и назначением тамоксифена по сравнению с каждым из этих методов в отдельности.
1. Bonneterre J. Thurlimann B, Robertson JFR, et al. Anastrozole versus tamxoifen as first-line therapy for advanced breast cancer in 668 postmenopausal women: results of the tamoxifen or arimidex randomized group efficacy and tolerability study. J Clin Oncol. 2000;18:3748-3757.
2. Nabholtz JM, Buzdar A, Pollak M, et al. Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. J Clin Oncol. 2000;18:3758-3767.
3. Milla-Santos A, Milla L, Rallo L, Solana V. Anastrozole vs. tamoxifen in hormone dependent advanced breast cancer: a phase II randomized trial. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 173. Breast Cancer Res Treat. 2000;64:54.
4. Thurlimann B, Roberston JFR, Bonneterre J, et al. Efficacy of tamoxifen following anastrozole (Arimidex) as first-line treatment for advanced breast cancer in postmenopausal women. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 162. Breast Cancer Res Treat. 2000;64:51.
5. Dewar J, Nabholtz JM, Bonneterre J, et al. The effect of anastrozole (Armidex) on plasma lipids — data from a randomized comparison of anastrozole versus tamoxifen in postmenopausal women with advanced breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 164. Breast Cancer Res Treat. 2000;64:51.
6. Smith R, Sun Y, Garin A, et al. Femara (letrozole) showed significant improvement in efficacy over tamoxifen as first-line treatment in postmenopausal women with advanced breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 7. Breast Cancer Res Treat. 2000;64:27.
7. Ellis MJ, Jaenicke F, Llombart-Cussac A, et al. A randomized double-blind multicenter study of pre-operative tamoxifen versus femara (letrozole) for postmenopausal women with ER and/or PgR positive breast cancer ineligible for breast conserving surgery. Correlation of clinical response with tumor gene expression and proliferation. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 14. Breast Cancer Res Treat. 2000;64:29.
8. Osborne CK, Pipper J, Jones SE, et al. Faslodex (ICI 182,780) shows longer duration of response compared with Arimidex (anastrozole) in post-menopausal (PM) women with advanced breast cancer (ABC). Preliminary results of a phase III North American Trial. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 7. Breast Cancer Res Treat. 2000;64:27.
9. Howell A, Roberston JFR, Quaresma Albano J, et al. Comparison of efficacy and tolerability of fulvestrant (Faslodex) with anastrozole (Arimidex) in post-menopausal women with advanced breast cancer (ABC) — preliminary results. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 6. Breast Cancer Res Treat. 2000;64:27.
10. Paridaens R, Dirix L, Lohrisch C, et al. Activity and safety of exemestane (E) as first-line hormonal therapy (HT) in metastatic breast cancer (MBC) patients (PTS): final results of an EORTC randomized phase II trial. Program and abstracts of The 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 167. Breast Cancer Res Treat. 2000;64:52.
11. Dixon JM, Grattage L, Renshaw L, et al. Exemestane as neoadjuvant treatment for locally advanced breast cancer: endocrinologic and clinical endpoints. Program and abstracts of The 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 170. Breast Cancer Res Treat. 2000;64:53.
12. Jonat W, on behalf of the ZEBRA (Zoladex Early Breast Cancer Research Association) Trialist’s Group. Zoladex (goserelin) vs. CMF as adjuvant therapy in pre/perimenopausal early (node positive) breast cancer: preliminary efficacy, QOL, and BMD results from the ZEBRA study. Program and abstracts of The 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 13. Breast Cancer Res Treat. 2000;64:29.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Гормонотерапию для лечения раковых опухолей молочной железы применяют уже более века. Еще в конце XIX века были опубликованы первые результаты лечения пациентов с раком молочной железы методом овариэктомии (удаление яичников), которые показали хорошую эффективность.
После онкологи предложили различные методы гормонотерапии: лучевую кастрацию, прием андрогенов, удаление надпочечников, хирургическое разрушение гипофиза, прием антиэстрогенов, антипрогестинов, ингибиторов ароматазы.
Со временем были разработаны эффективные методы гормонотерапии – лучевой, хирургической, лекарственной.
На сегодняшний день гормонотерапия является неотъемлемой частью комплексной терапии на любой стадии рака груди.
Выделяют два направления данного вида лечения рака груди: прекращение (торможение) выработки эстрогенов и прием антиэстрогенных препаратов.
Лечение выбирает специалист, с учетом различных факторов – возраст и состояние пациентки, стадия заболевания, сопутствующие болезни. Операция по удалению яичников назначается только женщинам с сохраненной менструальной функцией или при ранней менопаузе, в постменопаузе эффективны препараты снижающие уровень эстрогена, в репродуктивном возрасте используют релизинг-гормоны
Опухоли молочной железы относят к гормонозависимым, но только у примерно 40% пациентов наблюдается положительный эффект от гормонотерапии,.
Стоит отметить, что некоторые препараты могут заменить оперативное лечение, к примеру, прием ингибиторов ароматазы позволяет избежать удаления надпочечников, релизинг-гормоны – удаление яичников.

Как и любое другое лечение, гормонотерапия рака молочной железы имеет последствия, среди которых можно выделить увеличение веса, отечности, ранняя менопауза, повышенная потливость, сухость влагалища.
Кроме того, некоторые пациентки отмечают на фоне лечения угнетение настроения, развитие депрессии.
Некоторые препараты, обладают тяжелыми побочными эффектами, например, широко используемый тамоксифен увеличивает риск образования тромбов, может привести к раку матки, бесплодию.
Препараты, снижающие выработку эстрогенов (ингибиторы ароматазы), которые назначаются в период постменопаузы, провоцируют остеопороз, увеличивают риск образования тромбов, болезней ЖКТ, повышают уровень холестерина.
Эффективность лечения при гормонозависимых опухолях довольно высокая. Если в раковых клетках выявлены и прогестероновые и эстрогеновые рецепторы, то гормонотерапия будет эффективна на 70%, если выявлен только один тип рецепторов – на 33%.
При других типах опухоли эффективность гормонотерапии при раке груди достигает всего 10%.
Гормонотерапия рака молочной железы достаточно эффективный метод терапии гормонозависимых опухолей груди. Такой метод также называют антиэстрогеновым и основной целью такого лечения является предотвращение воздействия женского гормона на раковые клетки.
Гормонотерапия при раке молочной железы показана женщинам при неинвазивных формах рака (для предупреждения повторного развития заболевания либо перехода в инвазивный раковый процесс), после операции, лучевой или химиотерапии для уменьшения вероятности рецидива, при больших опухолях (перед оперативным лечением терапия позволяет уменьшить новообразование и помогает хирургу выявить патологические ткани), при метастазах (гормонотерапия позволяет остановить дальнейшее метастазирование), а также при генетической предрасположенности.
Гормонотерапия при раке молочной железы сегодня происходит по двум направлениям: лечение с учетом менструального цикла и вне зависимости от него.
При универсальных методах гормонотерапии не зависящих от менструального цикла используют антиэстрогены и прогестины.
Самым распространенным и исследованным, уже длительное время применяемом онкологами, является антиэстрогеновое средство – тамоксифен. При длительном приеме препарат может увеличить уровень эстрогена в крови, повышает риск развития гормонозависимой опухоли в других органах, также клинически доказана вероятность развития тромбоэмболических осложнений и токсическое действие на печень.
Сегодня в большинстве случаев тамоксифен назначается не дольше, чем на 5 лет.
Не менее популярными препаратами из этой группы являются торемифен, ралоксифен.
Отдельно сказать стоит о фулвестранте, которому современная гормонотерапия рака груди отводит особое место. Препарат разрушает эстрогеновые рецепторы опухоли, поэтому ряд специалистов относят его к «истинным антагонистам».
Стандартно онкологи назначают гормонотерапию по одной из трех основных схем, которые отличаются принципом действия – уменьшение в крови уровня эстрогена, блокировка эстрогеновых рецепторов, снижение синтеза эстрогена.
После обследования может быть назначено следующее лечение:
- избирательные модуляторы эстрогеновых рецепторов – терапия направлена на отключение эстрогеновых рецепторов (химические вещества оказывают избирательное действие на клетки, оказывая подобное эстрогенам действие), основным препаратом этого направления является тамоксифен.
- препараты, ингибирующие аромотазу – используют в период постменопаузы, снижают производство эстрогена. В практике онкологов используется летрозол, анасторозол, экземестан.
- блокировка и разрушение эстрогеновых рецепторов (Фулвестрант, Фаслодекс).
Эстрогеновые рецепторы находятся на раковых клетках и притягивают эстрогены, которые способствуют дальнейшему росту опухоли. В зависимости от их уровня лаборатория делает заключение о гормонозависимости опухоли, после этого, врач определяет схему лечения выбрать.
Противоопухолевый препарат Тамоксифен оказывает антиэстрогеновое действие. После приема тамоксифен связывается с эстрогенными рецепторами в органах, подверженных развитию гормонозависимых опухолей и тормозит рост раковых клеток (в случае если развитие опухоли вызвано ß- 17- эстрогенами).
Назначается мужчинам и женщинам (преимущественно в период менопаузы) с раком груди, при раке яичников, эндометрия, почек, предстательной железы, после операций для корректировки гормонального фона.
Дозировка устанавливается индивидуально, с учетом состояния пациента.
При раковой опухоли молочной железы обычно назначается по 10мг 1-2 раза в сутки. При необходимости специалист может повысить дозировку до 30 – 40 мг в сутки.
Тамоксифен необходимо принимать длительно (от 2 месяцев до 3 лет) под наблюдением врача. Курс лечения определяется индивидуально (обычно препарат прекращают принимать через 1-2 месяца после регрессии).
Повторный курс проводят после 2-х месячного перерыва.
После удаления молочной железы для коррекции уровня гормонов назначают 20мг в сутки.
Прием препарата может вызвать тошноту, рвоту, расстройство пищеварения, отсутствие аппетита, в отдельных случаях приводит к чрезмерному накоплению жира в печени, гепатиту. Возможны депрессии, головные боли, отечность, аллергические реакции, боли в костях, повышение температуры. Длительный прием может спровоцировать поражение сетчатки, катаракту, патологии роговицы.
У женщин может вызвать разрастание эндометрия, кровотечения, подавление менструаций, у мужчин – импотенцию.
Торемифен по принципу действия близок к тамоксифену, препарат препятствует выработке эстрогена в организме. Назначается в период постменопаузы, от 60 до 240 мг каждый день в течение нескольких лет.
На фоне лечения могут возникнуть негативные реакции организма, в частности, головокружение, повышение внутриглазного давления и развитие катаракты, инфаркт миокарда, острую закупорку кровеносных сосудов, снижение уровня тромбоцитов, аллергические реакции, увеличение ткани эндометрия, тромбоз, чувство жара, повышенная потливость.
Торемифен оказывает токсическое действие на печень.
Одновременный прием с препаратами, снижающими выведение кальция с мочой, повышает риск гиперкальцемии.
Нельзя одновременно принимать Торемифен с препаратами, удлиняющими интервал QT.
Во время приема рифампицина, фенобарбитала, дексаметазона, фенитоина и других индукторов CYP3A4 может потребоваться увеличение дозировки Торемифена.
Лечение должно проводиться под контролем врача.
Ралоксифен избирательный модулятор эстрогеновых рецепторов. Назначается при раковых опухолях молочной железы в период менопаузы для предупреждения развития остеопороза (снижение плотности и нарушение структуры костей).
Препарат нормализует уровень кальция, снижая его выведение из организма почками.
Ралоксифен необходимо принимать длительное время (по 60мг в сутки), обычно в пожилом возрасте дозировка не корректируется.
На фоне лечения могут появиться судороги икроножных мышц, тромбоэмболия, отеки, ощущение жара в теле. При возникновении маточного кровотечения необходимо обратиться к лечащему врачу и пройти дополнительное обследование.
Во время лечения необходимо принимать кальций.
Противораковый препарат Фулвестрант также подавляет эстрогенные рецепторы. Препарат блокирует действие эстрогенов, при этом эстрогеноподобная активность не наблюдается.
Данных о возможном влиянии на эндометрий, эндотелий в период постменопаузы, костную ткань нет.
В онкологии используется для лечения раковых опухолей груди в виде инъекций, рекомендуемая доза 250мг 1р в месяц.
Во время лечения могут появиться тошнота, расстройство стула, потеря аппетита, тромбоэмболия, аллергические реакции, отечность, боли в спине, выделения из сосков, повышается риск развития инфекций мочевыводящих путей, кровотечений.
Фаслодекс включает то же действующее вещество, что Фулвестрант, обладает антиэстрогеновым действием.
Назначается при распространенном раке груди в период постменопаузы.
Используют препарат в виде инъекций (внутримышечно) раз в месяц по 250мг.
При средневыраженных нарушениях функции печени корректировки дозы не требуется.
Безопасность препарата при нарушении работы почек не проверялась.
Летрозол подавляет синтез эстрогенов, обладает антиэстрогеновым действием, избирательно ингибирует аромотазу.
Стандартно назначается 2,5мг в сутки в течение 5 лет. Препарат нужно принимать ежедневно, независимо от приема пищи.
Летрозол нужно прекратить в случае, если проявляются первые симптомы прогрессирования заболевания.
На последних стадиях, при метастазировании прием препарат показан пока наблюдается рост опухоли.
При печеночной недостаточности и пожилым пациентам корректировка дозы не требуется.
Данные об одновременном приеме с другими противораковыми препаратами отсутствуют.
Следует с осторожностью назначать Летрозол с препаратами, которые метаболизируются изоферментами CYP2A6 и CYP2C19.
Анастрозол относится к антагонистам эстрогенов, избирательно подавляет ароматазу.
Показан для лечения начальных стадий гормонозависимых опухолей молочной железы в постменопаузе, а также после лечения тамоксифеном.
Препарат нужно принимать за 1ч до приема пищи (или через 2-3 часа после).
Обычна назначается по 1 мг в сутки, длительность лечения определяется индивидуально с учетом тяжести и формы заболевания.
Нельзя принимать одновременно с Анастрозолом препараты, содержащие гормоны.
На фоне лечения снижается плотность костей.
Данных об эффективности комплексного лечения (Анастрозол + химиотерапия) нет.
Прием препарата может спровоцировать сильные головокружения, продолжающиеся головные боли, сонливость, депрессии, отсутствие аппетита, рвоту, сухость во рту, аллергию, бронхит, ринит, фарингит, боли в груди, спине, повышенное потоотделение, снижение подвижности суставов, отечность, облысение, увеличение веса.
Одновременный прием томоксифена и анастрозола противопоказан.
Экзместан показан для лечения и профилактики рака или злокачественных образований в молочной железе, относится к антагонистам эстрогенов.
Принимают Экзместан после еды по 25мг в день, длительность приема – до повторного прогрессирования опухоли.
Не рекомендуется назначать препарат женщинам в пременопаузным эндокринным статусом, поскольку нет данных об эффективности и безопасности лечения у этой группы пациентов. При нарушениях работы печени корректировка дозы не требуется.
Назначают Экзместан после определения постменопаузного статуса пациентки.
На фоне лечения может появиться быстрая утомляемость, головокружения, головные боли, нарушение сна, депрессии, рвота, отсутствие аппетита, расстройства стула, аллергии, повышенная потливость, облысение, отечность.
Препараты, содержащие эстрогены подавляют терапевтическое действие Экзместана.
источник
Анастрозол (аримидекс) — это препарат ингибиторов ароматазы и уже многие годы используется в лечении распространенного гормонально-позитивного рака молочных желез у пациенток в постменопаузе.
В октябре 2005 года управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) одобрило применение анастрозола в качестве адъювантной терапии у пациенток с ранними стадиями рака молочной железы.
Исследование, которое называлось АТАС (Arimidex or Tamoxifen Alone or in Combination – сравнение аримидекса и тамоксифена по отдельности и в сочетании), началось в 1999 году и предположительно закончится в 2011 году.
Целью проводимого исследования является выяснение эффективности отдельного и сочетанного применения анастрозола и тамоксифена у пациенток с ранними стадиями гормонально-позитивного рака молочной железы.
В исследовании участвовало 9300 пациенток в постменопаузе с ранними стадиями гормонально-позитивного рака молочной железы, которые только что прошли первый этап лечения (операцию с или без химио- и радиотерапии).
Пациенткам назначался либо анастрозол, либо тамоксифен, либо оба препарата сразу. Исследователи наблюдали за пациентками в течение 5 лет. Они отмечали, какие побочные эффекты встречались в каждой группе пациенток и как часто наблюдался рецидив рака, метастазирование или летальный исход.
Исследователи продолжат наблюдать за этими пациентками еще 5 лет. Представим полученные результаты данного исследования.
При отдельном применении анастрозол оказался намного эффективнее, чем тамоксифен:
В снижении риска рецидива рака,
В снижении риска распространения рака (метастазирования),
В снижении риска развития нового рака в другой молочной железе.
В снижении риска летального исхода от рака.
Анастрозол при отдельном применении оказался намного эффективнее, чем сочетание аримидекса с тамоксифеном.
Улучшения отмечались у пациенток с различными типами гормонально-позитивного рака: эстроген-позитивного, прогестерон-позитивного и их сочетании. У пациенток, принимавших аримидекс, отмечалось меньше проявлений менопаузы и меньше случаев рака матки, тромбозов и инсультов. Однако при приеме аримидекса отмечалось большее число болей в суставах и переломов костей.
Так как проблемы с суставами и костной системой при применении анастрозола встречаются чаще, чем при приеме тамоксифена, рекомендуется проконсультироваться с врачом в плане исследования состояния костной ткани до начала лечения либо назначения препаратов, укрепляющих костную ткань.
Если у Вас постменопаузальный период и у Вас гормонально-позитивный рак молочной железы, Вы вполне можете принимать анастрозол. Однако, прежде всего, проконсультируйтесь с Вашим лечащим врачом.
Длительность приема анастразола — принимайте анастрозола до тех пор, пока Ваш врач не скажет Вам о прекращении необходимости его принимать. В исследовании АТАС, которое продолжается и сейчас, было показано преимущество анастрозола над тамоксифеном в снижении риска рецидива рака молочной железы у женщин в постменопаузе в течение 5 лет.
Анастрозол представляет собой таблетированный препарат и принимают его по одной таблетке в день. Рекомендуется принимать аримидекс в одно и то же время. Если Вы забыли принять таблетку, то примите ее сразу, как Вы вспомнили об этом, либо просто примите следующую дозу как обычно, но не пытайтесь принять две таблетки за один раз.
Побочные эффекты анастрозола
В клинических исследованиях было выявлено, что наиболее частыми побочными эффектами анастрозола были:
повышенное артериальное давление,
Кроме того, при приеме анастрозола чаще отмечались патологические переломы костей, чем при приеме тамоксифена (10 % и 7 % соответственно).
Анастрозол не следует применять в следующих ситуациях:
При аллергических реакциях на анастрозол и другие компоненты анастрозола.
При грудном вскармливании.
При беременности, либо если Вы возможно беременны или планируете беременность.
источник