Широко известен тот факт, что после полной резекции опухоли у немалого процента пациенток, рак молочной железы вновь возвращается через несколько месяцев или лет.
Возвращение болезни и появление опухоли может проявиться в молочной железе, и тогда лечением будет удаление всего органа. Рецидив может проявляться, также, в других органах — развитие вторичных очагов, метастаз.
Чтобы предотвратить или уменьшить риск рецидива, во многих случаях, предлагается дополнительная терапия. Сущность дополнительного лечения заключается в том, что, несмотря на отсутствие видимых признаков распространения болезни, проводится основное лечение (операция) и дополнительное вспомогательное лечение, уничтожающее микроскопические раковые клетки для предотвращения возврата болезни в будущем.
Нет возможности дать точный прогноз дальнейшего развития заболевания. Поэтому решение о дополнительном лечении принимается для каждой пациентки индивидуально на основе статистических данных, собранных ранее при лечении тысяч больных.
Лучевая терапия — это дополнительная послеоперационная терапия, которая предлагается в настоящее время почти каждой пациентке страдающей раком молочной железы. Эта процедура является очень эффективной профилактикой возвращения опухоли с прежней локализацией.
В большинстве случаях облучению подвергается молочная железа, но иногда лучевая терапия показана и в области подмышечных лимфатических узлов. Лечение проводится ежедневно, в течение 7 недель. Основные продвижения в области лучевой терапии, максимально сокращают побочные эффекты, включая боль в груди, возможные повреждения сердца и легких.
Побочные эффекты, как правило, незначительны: небольшое покраснение на коже, ощущение слабости или усталости. Обычно во время лечения не наблюдается выпадения волос, тошноты, рвоты или ожогов на коже. Это высокоэффективное лечение — риск возвращения болезни сокращается на одну треть.
Следует отметить, что риск возврата болезни после лампэктомии и облучения выше, чем после мастэктомии.
Развитие большей части заболеваний рака молочной железы зависит от влияния женских половых гормонов. В этих случаях показано медикаментозное лечение, которое блокирует активность гормонов и таким образом, снижает риск появления опухоли.
Стандартным лечением является препарат Тамоксифен, который принимают один раз в день в течение 5 лет. В случае, если у пациентки обнаруживают признаки рака молочной железы, в период постменопаузы, то лечение будет несколько иным.
В таких ситуациях после двух-трёх лет приёма препарата Тамоксифен , проводится дополнительная лекарственная терапия при помощи препаратов Фемара (летрозол) , Аримидекс (анастрозол) , Аромазин (экземестан) .
Гормональная терапия может вызвать побочные эффекты: вспышки жара, развитие остеопороза, изменения в настроении, но большинство из них легко преодолимы. Гормональная терапия является очень эффективным лечением, а также снижает риск рецидива почти в два раза.
В случаях, когда риск возврата опухоли очень высок, как правило, будет рекомендована химиотерапия. По сравнению с гормональной и лучевой терапией, химиотерапия, как правило, даёт больше побочных эффектов.
Побочные эффекты всех видов химиотерапии достаточно известны,- это тошнота, рвота, выпадение волос, снижение функции иммунной системы, утомляемость и слабость.
Современная израильская фармакология предлагает большое количество средств по лечению рака и предотвращению побочных эффектов химиотерапии, нашедшие широкое применение в онкологическом центре имени Хаима Шиба.
Как известно, химиотерапия может привести к нарушениям детородной функции у пациенток. В онкологическом центре имени Хаима Шиба существуют несколько надёжных методов сохранения фертильности.
Важным аспектом в принятии решения о начале лечения методом химиотерапии является оценка риска возвращения заболевания. Планирование основывается на определённых критериях, оценив которые можно определить степень риска возвращения заболевания.
- наличие раковых клеток в лимфатических узлах
- размер опухоли молочной железы
- возраст пациентки (чем моложе, тем более высокий риск повторения)
- характер опухоли и её рост (GRADE и STAGE)
- наличие рецепторов эстрогена и прогестерона
- наличие специфического гена HER2
Оценка обычно делается лечащим онкологом и базируется как на его личном опыте, так и на опыте, накопленном в институте рака молочной железы.
В отделении рака молочной железы в больнице имени Хаима Шиба история болезни каждой вновь поступившей пациентки представляется на общем консилиуме всех специалистов отделения под руководством доктора Кауфман.
Главной целью этих консилиумов является оценка риска рецидива, а также принятие решения по поводу выбора метода химиотерапии, соответствующего определённой патологии.
Рецептор эстрогена (ER) — белок, обнаруженный на клетках злокачественной опухоли, к которому могут присоединяться молекулы гормона эстрогена. Этот белок известен также под названием HER 2. Понятие «ER-положительный» означает, что раковые клетки женщины чувствительны к гормону эстрогену, и этот гормон оказывает влияние на развитие болезни.
Проверка на гормональные рецепторы — серия лабораторных анализов, определяющих зависимость развития раковой опухоли молочной железы от влияния женских гормонов, эстрогена и прогестерона.
Герцептин Когда в раковой опухоли в значительной степени выражены протеины, называемые HER — 2, то химиотерапия проводится в сочетании с препаратом Герцептин, в состав которого входят антитела, непосредственно действующие на раковые клетки и блокирующие протеины HER — 2.
Лечение проводится внутривенно и длится в течение года по индивидуально выстроенной программе для каждой пациентки.
Биологическая терапия — Лапатиниб (Тайкерб) Для лечения рака молочной железы с положительным тестом на HER — 2 существует ряд новых лекарственных препаратов. Недавно произведён и успешно прошёл испытания новый препарат из семейства ингибиторов — лапатиниб тирозинкиназы. Это препарат, который подавляет функцию двух рецепторов – HER-2 и HER-1.
Отделение рака молочной железы медицинского центра Хаима Шиба является ведущим в мире по клиническим испытаниям новых препаратов. Данные одного из важных исследований за последнее время опубликованы в английском медицинском журнале New England journal of Medicine (декабрь 2006).
В этом исследовании проверялась эффективность комбинации препарата Лапатиниб со стандартной химиотерапией по сравнению с методом лечения посредством только стандартной химиотерапией среди женщин с раком молочной железы, давшем метастазы на фоне положительного HER2 и проходящих лечение препаратом Герцептин.
И действительно, результаты оказались революционными. Метод химиотерапии в сочетании с препаратом Лапатиниб в случаях рака молочной железы, давшем метастазы значительно тормозит развитие болезни.
Отзыв после лечения рака молочной железы в больнице Шиба :
Хочу сказать большое спасибо всему международному отделу за хорошую и четкую организацию моего лечения в клинике Шиба.
Особенно хочется поблагодарить моего координатора — Наташеньку Батюк ! Всегда пунктуальна и приветлива. Очень грамотно и незамедлительно решала все вопросы, связанные с моей операцией и дальнейшим лечением. Наташенька поддерживала со мной связь, высылала необходимые мне документы и держала в курсе всех дел.
Спасибо старшему координатору Лене Колесник, которая очень подробно и терпеливо отвечала на любые вопросы.
В рамках отделения ведётся передовое исследование, особенно агрессивного типа опухоли — воспалительного рака молочной железы. Результатом исследования стала разработка инновационного метода лечения, способного значительно изменить течение заболевания.
Химиотерапия, как правило, назначается в послеоперационный период. Лучевая терапия проводится после химиотерапии или после операции в случае, если химиотерапия не входит в программу лечения. Гормональная терапия применяться после завершения химиотерапии и лучевой терапией.
Как упоминалось выше, иногда назначается вспомогательное лечение — химиотерапия перед операцией по удалению опухоли, то есть неоадъювантное лечение. Целью назначения этого лечения является уменьшение размеров опухоли перед операцией, что увеличивает шансы итога операции.
Химиотерапия до операции также позволяет осуществлять мониторинг ответной реакции опухоли на лечение, что дает возможность оценить эффективность лечения.
Задача проверки называемой онкотейп состоит в том, чтобы рассмотреть взятые из опухоли образцы на молекулярном уровне. Разработанный тест дает эффективную оценку риска развития рецидива.
источник
Трастузумаб или лапатиниб со стандартной химиотерапией для HER2-положительного рака молочной железы: результаты исследования GEICAM / 2006-14
Добавление трастузумаба (T) и лапатиниба (L) к неоадъювантной химиотерапии увеличивает частоту патологического полного ответа (pCR) у пациентов с рецептором 2-го типа человеческого рецептора эпидермального фактора роста человека (HER2). Мы исследовали эффективность Т или L с неоадъювантной химиотерапией и биомаркеры эффективной эффективности.
Пациенты со стадиями I-III (включая воспалительный) HER2-положительный рак молочной железы были рандомизированы для получения циклов эпирубицина (E) плюс циклофосфамид (C) × 4 с последующим доцетакселом (D) плюс либо T (EC-DT), либо L (EC- DL). Конечные точки включали pCR (первичный), клинический ответ, токсичность и pCR-прогнозирующие биомаркеры.
Мы рандомизировали 102 пациентов в EC-DT (50) и EC-DL (52). Средний возраст составил 48, 56% — предклимактерический, а у 58% — эстрогеновые рецепторы (ER) -положительные опухоли. Патологический полный ответ в груди составил 52,1% (95% ДИ: 38,0-66,2%) для EC-DT и 25,5% (95% ДИ: 13,5-37,5%) для EC-DL (P = 0,0065). Патологический полный ответ в грудной клетке и подмышечной области составлял 47,9% для EC-DT и 23,5% для EC-DL (P = 0,011). Толерантность 3-4 степени не различалась в разных вариантах лечения, за исключением диареи (2% в EC-DT против 13,5% в EC-DL, P = 0,030). Многовариантный анализ показал, что лечение (P = 0,036) и ER (P = 0,014) были единственными предикторами pCR в обеих группах.
EC-DT проявлял более высокую эффективность и более низкую токсичность, чем EC-DL. Из изученных различных биомаркеров только отсутствие ER-экспрессии было связано с увеличением pCR.
Рак молочной железы — это гетерогенное заболевание, включающее различные биологические подтипы с отчетливой естественной историей. Рак молочной железы демонстрирует широкий спектр клинических проявлений, а также различные патологические и молекулярные особенности, каждый из которых имеет свои отличительные прогностические и терапевтические последствия (Bertucci and Birnbaum, 2008).
Неоадъювантная химиотерапия (НАК) была предпочтительным лечением для местных и воспалительных больных раком молочной железы. Мультимодальный подход, в том числе НАК, хирургия и радиация, является наиболее эффективным вариантом лечения, как показывают лучшие общие результаты выживания (Kaufmann et al, 2007). NAC показал высокие клинические и патологические показатели ответа и увеличивает вероятность сохранения груди; таким образом, в настоящее время это предпочтительная терапия для больших резектируемых опухолей (Fisher et al, 1997). Независимо от стадии заболевания при постановке диагноза пациенты, получающие патологический полный ответ (pCR), демонстрируют лучшие результаты выживания (Kuerer et al, 1999; Rouzier et al., 2002; Hennessy et al, 2005; Guarneri et al, 2006; Rastogi et al, 2008 ). Что касается биологии опухолей, то влияние pCR на прогноз пациента недавно было определено в соответствии с внутренними подтипами в ретроспективном анализе нескольких немецких неоадъювантных исследований. Согласно этому метаанализу, pCR является подходящей суррогатной конечной точкой для пациентов с рецептором 2 эпидермального фактора роста человека (HER2) -положительным (не светящимся), тройным отрицательным и просветным B / HER2-негативным опухолями, но не для просвета B / HER2-позитивные и просветные опухоли (von Minckwitz et al, 2012). Таким образом, идентификация и оценка новых схем приема лекарств, которые улучшают показатели рКР в действующих опухолях, становятся основными целями протоколов NAC, конечной целью которых является достижение лучших результатов выживания. Кроме того, неоадъювантная установка позволяет оценить эффективность лечения и удовлетворяет in vivo и позволяет идентифицировать подгруппы пациентов с различными прогнозами.
HER2 сверхэкспрессируется в 15-20% от рака молочной железы, и это связано с очень агрессивным поведением опухоли и плохими результатами. Наличие моноклонального антитела против HER2 (mAb) trastuzumab значительно улучшило прогноз пациентов с HER2-положительным раком молочной железы как в раннем, так и в позднем возрасте (Slamon et al, 2001; Marty et al, 2005; Piccart-Gebhart et al. , 2005; Romond et al, 2005; Joensuu et al, 2006; Slamon et al, 2011). Лапатиниб является ингибитором двойного тирозинкиназы HER1 и HER2, который в настоящее время одобрен для лечения пациентов с HER2-положительным прогрессирующим раком молочной железы, которые не реагируют на тератузумаб (Spector et al, 2005; Geyer et al, 2006; Konecny et al, 2006, Cameron et al, 2008; Di Leo et al, 2008; Gomez et al, 2008). Недавние исследования показывают, что в предоперационном режиме комбинация трастузумаба с последовательной химиотерапией с таксанами и антрациклинами приводит к высокой частоте pCR (Buzdar et al., 2007; Gianni et al, 2010; Untch et al, 2010).
На основе имеющихся доказательств мы разработали рандомизированное рандомизированное исследование фазы II стандартной химиотерапии с эпирубицином (E), циклофосфамидом (C) и доцетакселом (D) в комбинации с трастузумабом или лапатинибом. Основная цель исследования заключалась в оценке эффективности и безопасности этих двух неоадъювантных методов лечения пациентов с HER2-положительным раком молочной железы. Кроме того, в качестве исследовательской конечной точки мы рассмотрели предполагаемую прогностическую роль различных биомаркеров в патологическом ответе. Эти биомаркеры, присутствующие в биопсии опухоли перед обработкой, были отобраны на основании данных in vitro и клинических испытаний, а также их потенциала для опосредования изменений роста опухоли, вызванных фактором роста, включая гормональные рецепторы, пролиферацию и активацию ERK и PI3K / AKT (Okano et al, 2000; Xia et al, 2002; Song et al, 2005; Spector et al, 2005; Dave et al, 2011; Luporsi et al, 2012).
Женские субъекты с гистологически подтвержденными стадиями I, II, III или воспалительный рак молочной железы (по биопсии грудной клетки) и HER2-положительный статус по местным результатам были включены в это исследование. Усиление HER2 было подтверждено зондами Pathvysion FISH в центральной лаборатории в соответствии с рекомендациями ASCO / CAP (Wolff et al, 2007). Пациенты имели право только в том случае, если им было по меньшей мере 18 лет; имел статус Карнофского (PS) ⩾80; имели адекватный костный мозг, печень, почечную и сердечную функции; и были наименее лечебными. Для женщин детородного возраста также потребовались отрицательные тесты на беременность и использование адекватной контрацепции. Пациенты были исключены, если у них было следующее: двусторонний инвазивный или метастатический рак молочной железы, ранее существовавший уровень нейротоксичности ⩾2 (на основе национальной системы оценки рака, основанной на стандарте Cancer Institute — Common Terminology Criteria для неблагоприятных событий версии 3.0 (NCI-CTCAE v3.0) (Cancer Therapy Evaluation Program) (CTEP), 2006)), предыдущая история рака, отличная от рака шейки матки или немеланомы, адекватно обработана, или другие злокачественные опухоли, обработанные более чем за 10 лет до поступления в исследование; или любой другой тяжелой или неконтролируемой системной болезни. Все пациенты предоставляли письменное информированное согласие перед вступлением в исследование.
Это было многоцентровое, открытое рандомизированное исследование фазы II. Все подходящие пациенты были рандомизированы в соотношении 1: 1 к терапии NAC либо с EC × 4 циклами → доцетаксел + трастузумаб × 4 (стандартный рычаг, EC-DT), либо EC × 4 → доцетаксел + лапатиниб × 4 (экспериментальный рукав, EC -DL). Рандомизация была централизована в штаб-квартире Испанской группы исследований рака молочной железы (GEICAM для ее испанского акронима). Пациенты были стратифицированы в зависимости от размера опухоли (T1-T2 против T3 против T4) и статуса рецептора эстрогена (ER) (ER-положительный или ER-отрицательный).
В частности, NAC состоял из эпирубицина 90 мг м-2 плюс циклофосфамид 600 мг м-2, который вводили внутривенно (IV) на 1-й день каждые 21 день в течение четырех циклов, а затем доцетаксел 100 мг м-2 также вводили IV в 1-й день каждые 3 недели для четырех циклов. Терапия против HER2 была добавлена к доцетакселу следующим образом: пациенты в стандартном плече получали T 6 мг кг-1 (после нагрузочной дозы 8 мг кг-1) вводили IV на 1-й день каждые 21 день (EC-DT), тогда как пациентам в экспериментальной группе вводили суточную дозу лапатиниба 1250 мг перорально (EC-DL) (рисунок 1). По завершении лечения НАК пациенты прошли мастэктомию или консервативную хирургию плюс диссекция подмышечных лимфатических узлов (если только ранее не проводилась биопсия отрицательного дозорного лимфатического узла). Послеоперационное лечение было оставлено по критериям исследователя.
Это судебное разбирательство было одобрено местными советами по этическому обзору мест найма и министерством здравоохранения Испании. Он зарегистрирован в ClinicalTrials.Gov с номером NCT00841828. Испытание проводилось в соответствии с Хорошей клинической практикой и принципами Хельсинкской декларации. Письменное информированное согласие было получено от всех пациентов до ввода в исследование.
Первичной конечной точкой этого исследования было определение частоты pCR в груди при завершении лечения NAC. Вторичные конечные точки включали токсичность и клинические показатели ответа (по радиологическому методу). Кроме того, путем анализа образцов опухоли, определенных в протоколе исследования, мы исследовали потенциально прогностические ассоциации между опухолевыми биомаркерами и pCR.
Перед входом в исследование все пациенты подвергались оценке грудь и подмышечной болезни ультразвуком, маммографией или магнитно-резонансной томографией (МРТ). Кроме того, у пациентов была оценка ЭКГ ПС, биопсия ядра, положительная оценка HER2, полное количество клеток крови, химия сыворотки, электрокардиограмма и измерение фракции выброса левого желудочка (LVEF).
pCR оценивали при хирургическом вмешательстве на основании критериев Миллера и Пейна (Ogston et al, 2003). Клинический ответ, определенный как полный ответ (CR) + частичный ответ (PR), оценивался в соответствии с критериями оценки ответа в критериях твердых опухолей (RECIST) (Therasse et al, 2000) после четвертого цикла EC и до операции (после завершения NAC) используя ультразвук, маммографию или МРТ. Конкретные оценки конечных точек ответа включают следующее: частота pCR в груди, определяемая как отсутствие какой-либо остаточной инвазивной опухоли в груди, разрешенная остаточная DCIS (степень 5 по классификации Миллера и Пейна); молочной железы и подмышечной области pCR, определяемой как отсутствие какой-либо остаточной инвазивной опухоли в грудной клетке и подмышечной области при диагностике у узлов-отрицательных пациентов (класс 5-A) или у узлоположительных пациентов (степень 5-D). Неблагоприятные события были оценены в соответствии с версией NCI-CTCAE версии 3.0 (Cancer Therapy Evaluation Program (CTEP), 2006). Сообщалось о худшем уровне для каждого пациента. LVEF оценивали после четвертого цикла EC и, опять же, в конце NAC и до операции.
Биомаркерный анализ методом иммуногистохимии проводился в центральной лаборатории. Иммуноокрашивание проводили с использованием фиксированных в формалине фиксированных парафином тканей размером 3 мкм на платформах Dako Autostainer. Вкратце, после депарафинизации, поиск термического антигена проводили в буферном растворе на основе pH 9 EDTA. Эндогенную пероксидазу блокировали путем погружения секций в 0,03% перекиси водорода в течение 5 мин. Разделы были инкубированы с первичными mAb для ER (клон EP1, Dako, Glostrup, DK, USA), PR (PgR636, Dako), Ki67 (MIB1, Dako), PTEN (6H2.1, Dako), общий mAb кролика ERK1 / 2 (137F5, Cell Signaling, Danvers, MA, USA), фосфорилированный (p) ERK1 / 2 на Thr202 / Tyr204 (D13.14.4E, сигнализация клеток), AKT (11E7, сигнализация клеток) и p-AKT на Ser473 (D9E , Cell Signaling). Обнаружение проводилось системой EnVision FLEX (Dako). Те же секции, инкубированные с неиммунизированной сывороткой, использовали в качестве отрицательных контролей, тогда как участки опухоли человека с известной экспрессией маркера анализировали как положительный контроль.
Выражение изученных маркеров оценивали патологом, ослепленным клиническими параметрами. Статус ER и PR был классифицирован как положительный в соответствии с рекомендациями ASCO / CAP (Hammond et al, 2010) на основе порога 1%. Усиление HER2 было подтверждено зондами Pathvysion FISH (Vysis Abbott Molecular, Abbott Park, IL, USA) в центральной лаборатории в соответствии с рекомендациями ASCO / CAP (Wolff et al, 2007). Точка среза, рассмотренная для экспрессии Ki67, составляла 14% на основе оптимального порога, определенного Cheang et al (2009), чтобы отличить просвет B от просветных опухолей A. PTEN оценивали полуколичественно с использованием иммунореактивного показателя (IRS). IRS определяли как: IRS = интенсивность окрашивания (SI) × процент положительности (PP); где SI было классифицировано как 0 = отрицательное, 1 = слабое, 2 = умеренное и 3 = сильное; и PP при 0 = 80% положительных клеток. Высокий PTEN был определен как IRS ⩾6 (Nagata et al, 2004). Для ERK1 / 2 и AKT рассчитывали полуколичественный HistoScore (Hscore), оценивая процент опухолевых клеток, положительно окрашенных в ядре с низкой, средней или высокой интенсивностью окрашивания. Окончательная оценка была определена с использованием весового коэффициента для каждой оценки по формуле: H-score = (низкий%) × 1+ (средний%) × 2+ (высокий%) × 3. Результаты варьировались от 0 до 300, и медианные значения рассматривались как отсечки с высоким выражением. Экспрессия фосфорилированных форм ERK1 / 2 и AKT была скорректирована с полной экспрессией белка.
Размер образца экспериментального плеча рассчитывали с использованием двухэтапного метода Саймона и с pCR в качестве конечной конечной точки исследования. Размер выборки был основан на нулевой гипотезе pCR 40% и альтернативной гипотезе pCR 60%. Предполагая альфа-ошибку 0,05 и испытательную способность 80%, 92 пациента должны были быть завербованы и сохранены в исследовании. Шестнадцать пациентов на руку должны были быть включены в первую стадию, так как по крайней мере восемь pCR на руку были замечены, а 30 дополнительных пациентов на руку должны были быть включены во вторую стадию, в общей сложности для 46 пациентов в каждой группе. Предполагая, что ставка отсева 10%, набрали 102 пациента.
Показатели эффективности (pCR и клинический ответ) были проанализированы в оценочной популяции (определяемой как рандомизированные и леченные HER2-положительные пациенты). Количество и доля пациентов, получавших ответ в каждой группе лечения, и соответствующие двухсторонние 95% ДИ были рассчитаны для наилучшего общего ответа. Для генерации гипотезы мы использовали χ2 для сравнения скорости реакции и побочных эффектов между лечащими руками. Для изучения ассоциации биомаркеров с клиническими конечными точками были использованы однофакторный анализ и многомерный анализ логистической регрессии. Оценки экспрессии были проанализированы как дихотомические переменные (то есть группы с высоким / низким выражением) или введены как непрерывные переменные. В многомерном анализе мы выбрали переменные, связанные с pCR, используя пошаговый метод. Все анализы были выполнены с использованием программного обеспечения Enterprise Analysis System (SAS) Enterprise Guide 4.3 (SAS Institute Inc., Cary, NC, USA).
В период с февраля 2009 года по октябрь 2010 года были включены и рандомизированы 102 пациента из 16 участвующих центров (50 в EC-DT и 52 в EC-DL). Статус HER2 ретроспективно оценивался в центральной лаборатории с помощью IHC, а результаты 3+ считались HER2-положительными, тогда как результаты 2+ считались двусмысленными и дополнительно тестировались с использованием FISH.
В центральном анализе три пациента были отрицательными по отношению к FISH (два пациента в EC-DT и один в группе EC-DL), что сделало их неоценимыми для эффективности. Таким образом, 99 пациентов были оценены на эффективность (48 и 51 соответственно в EC-DT и EC-DL), однако все 102 пациента были оценены для безопасности (при анализе намерения к лечению). Характеристики пациентов и опухолей суммированы в таблице 1. Никаких статистически значимых различий не наблюдалось при любых клинико-патологических характеристиках между лечащими руками. Медианный возраст составлял 48 лет (диапазон: 30-79 лет), 56% пациентов были предклимактерическими, 46% опухолей были III, 59% Т2 и 69% пациентов были позитивными. Что касается статуса гормонального рецептора (локальная оценка), 58% были ER +, 44% PR +, 42% были ER + PR + и 16% ER + PR-. Выражения ER и PR были также подтверждены центральной лабораторией, что соответствует 88,6% и 84,8% соответственно.
На рисунке 2 показана блок-схема последовательности исследований CONSORT (Schulz et al, 2010). Двенадцать пациентов, 2 и 10 в группах EC-DT и EC-DL, соответственно, прекратили лечение раньше (P = 0,0143). Основной причиной прекращения было следующее: токсичность у семи пациентов (одна в EC-DT и шесть в EC-DL, P = 0,0551). Из шести пациентов, которые вышли из лапатиниба из-за токсичности, четыре случая были связаны с лапатинибом следующим образом: одна супраневрикулярная аритмия 1 степени; один сорт 4 мукозит-эстоматит плюс кожная сыпь 4-го класса; один диабет 3 степени; и один сорт 3 диарея плюс сыпь 3-го уровня. Другие причины отмены включали отрицательность HER2 у двух пациентов (по одному в каждой руке) и трех пациентов. Таким образом, 90 пациентов, 48 в группе EC-DT (один из них HER2-отрицательный) и 42 в плече EC-DL, завершили лечение, как планировалось.
Схема ЭК была подробно описана в другом месте (Alba et al, 2012). Всего было введено 195 циклов DT и 181 цикл DL. В стандартном плече 8,7% циклов DT были отложены; 6,2% доцетаксельных доз были опущены или уменьшены, и все дозы трастузумаба вводились, как планировалось. В экспериментальной группе 8,8% циклов DL были отложены; 7,7% доцетаксельных доз были опущены или уменьшены, а дозы лапатиниба были опущены или уменьшены в 18,2% циклов.
Основными причинами модификации дозы с помощью комбинации DT были нейтропения (4,1%), усталость (2,5%), инфекция (2,1%) и повышение трансаминазы (2,1%), тогда как в комбинации DL были диарея (8,8%), сыпь (7,7%) и нейтропения (2,2%). Средняя относительная интенсивность дозы для доцетаксела составляла 99,8% в обеих группах лечения, 99,8% для трастузумаба и 96,4% для лапатиниба.
В таблице 2 приведены все побочные явления 3-4 степени в исследовании. Наиболее частая токсичность 3-4 степени была нейтропения, наблюдаемая в 23 случаях (22%), а у двух пациентов (2%) наблюдалась фебрильная нейтропения. Степень токсичности 3-4 степени была одинаковой на всех плечах, за исключением диареи, которая чаще встречалась среди EC-DL, чем у пациентов с курсом EC-DT (13,5% против 2% P = 0,03). Больше пациентов в плече EC-DL прекратили лечение из-за токсичности, чем в плече EC-DT (6 против 1, соответственно, P = 0,055).
Не наблюдалось случаев симптоматической застойной сердечной недостаточности (ХСН) (снижение уровня ЛВЭД 3-4 степени). Медиана LVEF составляла 63% (диапазон: 52-88%) на исходном уровне и 63% (диапазон: 40-85%) в конце лечения. Только у трех пациентов было бессимптомное снижение ЛВЖ 2-й степени во время лечения (два пациента на руку EC-DT и один пациент на плече EC-DL), и ни одна из них не прекратила лечение по этой причине.
В таблице 3 приведены данные эффективности лечения. Достигнутый уровень pCR в молочной железе (класс 5 по классификации Миллера и Пейна) был значительно выше в группе EC-DT (52,1% пациентов, 95% ДИ: 38-66,2%) по сравнению с пациентами, получавшими EC-DL (25,5% случаев, 95% ДИ: 13,5-37,5%) (P = 0,0065). Кроме того, в режиме EC-DT также были улучшены показатели pCR грудной клетки и подмышечной области у узлов-отрицательных пациентов (класс 5-A) и у пациентов с положительным положением (класс 5-D) (47,9%, 95% ДИ: 33,8-62,0% ), чем в EC-DL (23,5, 95% ДИ: 11,9-35,1%, P = 0,0112).
После четырех циклов EC общий клинический показатель ответа (ORR) был одинаковым в обеих группах (47,9% для EC-DT и 45,1% от EC-DL, P = 0,7787). Однако различия в ORR обеих групп перед операцией, хотя и были различны, также статистически не отличались статистически значимо (77% в группе EC-DT и 63% в плече EC-DL, P = 0,1208).
Все пациенты, оценивающие эффективность, подверглись хирургическому вмешательству. Сохранение молочной железы было достигнуто у 58 пациентов (58,6%) (28 пациентов в группе EC-DT и 30 пациентов в группе EC-DL). На одномерном уровне pCR ассоциировался с статусом ER (локальные результаты) независимо от лечения (34,3% в ER + опухолях против 66,5% в ER-опухолях, P = 0,0008). Однако однофакторный анализ на руку показал, что эффект ER-статуса на pCR обнаружен у пациентов, получавших трастузумаб (OR = 7,5 (95% ДИ: 2,04-27,6, P = 0,0024) для ER-Vs ER +), но не в обработанную лапатинибом (OR = 3,6 (95% ДИ: 0,9-14,0, P = 0,0680) для ER — vs ER +).
Мы провели анализ биомаркеров в 79 пациентах (77,5%) с имеющимися образцами опухолей предварительной обработки. Шестнадцать случаев (20,3%) показали потерю экспрессии PTEN, а 19 пациентов (24,1%) представили низкую экспрессию Ki67. Выражения ER и PR были обнаружены в 64,6% и 43,0% случаев, соответственно. Пропорции случаев с гиперэкспрессией ERK и AKT составили 69,6% и 88,6% соответственно.
Результаты одномерного и многомерного анализа суммированы в таблицах 4 и 5. На одномерном уровне только лечение (P = 0,038), ER (P = 0,014) и PR (P = 0,019) статистически связано с pCR в молочной железе и подмышечной области (оценки 5-D и 5-A по классификации Миллера и Пейна, таблица 4). Маркеры активации AKT и ERK не были связаны с ответом (P = 0,5799 и P = 0,2287, соответственно). Доля активированных факторов в общей экспрессии белка не коррелировала с ответом (P = 0,8477 и P = 0,2287, соответственно). Низкая экспрессия Ki67 не была статистически связана с pCR в груди и подмышечной впадине (OR = 1,02, 95% ДИ: 1,00-1,04, P = 0,069). Только высокая экспрессия PTEN достигла значительной связи с плохим pCR (OR = 2,90, 95% ДИ: 0,95-8,97, P = 0,063).
Многовариантный анализ показал, что только лечение (OR = 2,95; 95% CI: 1,07-8,15, P = 0,0366) и отсутствие ER-экспрессии (OR = 3,56, 95% ДИ: 1,29-9,80, P = 0,014) в грудной клетке и подмышечной области (таблица 5).
источник
В развитых странах в структуре онкологической заболеваемости женщин рак молочной железы (РМЖ) занимает 1-е место (26% всех случаев рака).
По данным ВОЗ, в мире ежегодно умирает от РМЖ 590 000 женщин.
В 2006 г. в России рак молочной железы составил 17,8% всех злокачественных опухолей у женщин.
Показатель заболеваемости в 2006 г. составил 65,5 случая на 100 000 населения, абсолютное число заболевших — 48 821. Смертность в 2006 г. равнялась 29,5 случая на 100 000 женского населения, 1-летняя летальность — 11,5%. Мутация генов BRCA1 и BRCA2 увеличивает риск РМЖ.
Выбор метода лечения больных раком молочной железы зависит от стадии заболевания и от биологической характеристики опухоли (степень злокачественности, рецепторный статус, экспрессия HER2).
Ниже приводится классификация РМЖ по системе TNM и группировка по стадиям (табл. 9.17).
ТХ — недостаточно данных для оценки первичной опухоли.
Т0 — признаков первичной опухоли нет.
Tis — рак in situ.
Tis (DCIS) — протоковый рак in situ.
Tis (LCIS) — дольковый рак in situ.
Tis (Paget’s) — рак Педжета соска при отсутствии опухоли в паренхиме железы. При этом рак Педжета в сочетании с опухолью паренхимы оценивают в соответствии с размерами последней.
Т1 — опухоль не более 2 см в наибольшем измерении.
T1mic — микроинвазивный рак размером 0,1 см и менее в наибольшем измерении.
Т1а — опухоль более 0,1 см, но не более 0,5 см.
T1b — опухоль более 0,5 см, но не более 1 см.
T1c — опухоль более 1 см, но не более 2 см.
Т2 — опухоль более 2 см, но не более 5 см в наибольшем измерении.
Т3 — опухоль более 5 см в наибольшем измерении.
Т4 — опухоль любого размера с непосредственным распространением на а) грудную стенку, б) кожу с учетом описанных ниже принципов:
Т4а — опухоль поражает грудную стенку;
Т4b — отек (включая симптом лимонной корки), изъязвление кожи или метастазы в
коже той же молочной железы;
Т4с — сочетание признаков Т4а и Т4b;
T4d — диффузный рак.
NX — недостаточно данных для оценки регионарных лимфоузлов (например, они были ранее удалены).
N0 — регионарные лимфоузлы не пальпируются.
N1 — пальпируются подвижные подмышечные лимфоузлы с той же стороны.
N2 — пальпируются подмышечные лимфоузлы с той же стороны, спаянные друг с другом или окружающими тканями, либо имеются клинические признаки метастазов в окологрудинных лимфоузлах той же стороны при отсутствии таких признаков для подмышечных лимфоузлов.
N2a — подмышечные лимфоузлы на стороне опухоли спаяны друг с другом или окружающими тканями.
N2b — клинические признаки метастазов в окологрудинных лимфоузлах той же стороны при отсутствии таких признаков для подмышечных лимфоузлов.
N3 — пальпируются подключичные лимфоузлы (лимфоузел) вне зависимости от состояния подмышечных лимфоузлов, либо имеются клинические признаки метастазов в окологрудинных и подмышечных лимфоузлах, либо имеются метастазы в надключичных лимфоузлах, необязательно в сочетании с метастазами в подмышечных или окологрудинных лимфоузлах.
MX — недостаточно данных для оценки отдаленных метастазов.
М0 — отдаленных метастазов нет.
M1 — отдаленные метастазы имеются.
Таблица 9.17. Группировка рака молочной железы по стадиям (6-е издание, 2002)
Своеобразное течение РМЖ и биологические особенности этой опухоли обусловливают использование на определенных этапах заболевания всех существующих методов лечения — хирургического, лучевого, гормонального, химиотерапевтического, включая таргетную терапию; однако оптимальная последовательность их применения до настоящего времени остается предметом активных клинических исследований.
По современным представлениям, для выбора оптимальной терапии больной раком молочной железы необходимо иметь сведения о содержании в опухоли рецепторов стероидных гормонов (рецепторов эстрогена (РЭ), рецепторов прогестерона (РП)), экспрессии HER2 и степени злокачественности опухоли, определяемой по степени ее дифференцировки.
С точки зрения биологических особенностей, определяющих возможности лечения, все больные РМЖ делятся на три группы:
1) больные с гормоночувствительными опухолями, содержащими РЭ, РП; в лечении этих больных, как правило, используется гормонотерапия;
2) больные, опухоль которых характеризуется гиперэкспрессией HER2; этим больным показан трастузумаб (Герцептин);
3) больные РМЖ, у которых опухоль не содержит ни рецепторов стероидных гормонов, ни HER2 (так называемые трижды негативные опухоли); при лечении таких больных наиболее перспективна цитотоксическая химиотерапия (XT).
Эти клинические группы соответствуют молекулярным подтипам рак молочной железы (люминальный А и Б HER2-позитивный, базальный нормоклеточный).
Гормонотерапия — один из важнейших методов лечения РМЖ. Около 60% больных РМЖ (а среди пожилых больных до 80%) имеют гормонозависимые опухоли, т.е. опухоли, содержащие РЭ и РП.
Существует прямая корреляция между наличием и уровнем рецепторов стероидных гормонов и эффективностью гормонотерапии. Эффективность лечения РЭ-положительных опухолей составляет 50-60%, тогда как при РЭ-отрицательных злокачественных опухолях молочной железы положительный эффект гормонотерапии отмечается лишь у 5-10% больных. Около 30% больных с неизвестным рецепторным статусом отвечают на гормональные воздействия.
К методам гормонотерапии относятся: хирургическая, лучевая и химическая (с помощью суперагонистов LH-RH) кастрация у женщин с сохранной менструальной функцией, применение антиэстрогенов, ингибиторов ароматазы, прогестинов, андрогенов и их аналогов, кортикостероидов.
В принципе в основе всех методов гормонотерапии рака молочной железы лежит попытка воспрепятствовать стимулирующему воздействию стероидных гормонов (эстрогенов) на клетки опухоли.
У женщин в пременопаузе это может быть достигнуто путем овариэктомии или облучения яичников либо с помощью применения суперагонистов LH-RH, под влиянием которых функционируют яичники. Такая химическая кастрация носит обратимый характер и достигается применением гозерелина (Золадекс) или лейпрорелина, бусерелина.
У женщин в менопаузе синтез эстрогенов происходит в основном в жировой ткани путем реакции ароматизации андрогенов, продуцируемых корой надпочечников, а следовательно, использование ингибиторов ароматазы снижает содержание эстрогенов.
К селективным ингибиторам ароматазы относятся нестероидные — летрозол (Фемара), анастрозол (Аримидекс) — и стероидный ингибитор экземестан (Аромазин).
Антиэстрогены блокируют РЭ в опухоли. В эту группу входят селективные модуляторы эстрогенных рецепторов (SERM) — тамоксифен и торемифен и селективный супрессор эстрогенных рецепторов (SERD) — фульвестрант (Фазлодекс). Эти препараты активны как в пре-, так и в менопаузе.
Менее ясен механизм противоопухолевого действия прогестинов (мегестрол, медроксипрогестерон), которые также используются в гормонотерапии РМЖ.
РМЖ — опухоль, чувствительная к большинству современных противоопухолевых цитотоксических препаратов, прежде всего к антрациклинам — доксорубицину, который эффективен у 40% больных. Аналогичная эффективность и у эпирубицина, митоксантрона, циклофосфамида (35%), метотрексата (35%), фторурацила и тегафура (25 %). В 1990-е годы в клиническую практику вошли таксаны: паклитаксел (Таксол), эффективность 56-60%, доцетаксел (Таксотер) — 57-75%, винорелбин (Навельбин) — 41-51 %, капецитабин (Кселода) вторая линия — 20-36%, гемцитабин (Гемзар) вторая линия — 25%. У больных с гиперэкспрессией HER2 эффективен таргетный препарат трастузумаб (Герцептин) — гуманизированное МКА к EGFR — и лапатиниб (Тайверб, Тайкерб) — двойной ингибитор тирозинкиназы рецепторов EGF (HER2/HER1).
Больные с операбельным раком молочной железы нуждаются в дополнительной (адъювантной) лекарственной терапии, улучшающей отдаленные результаты лечения, снижающей риск рецидива заболевания и увеличивающей выживаемость больных. Исключение составляет лишь небольшая прогностически благоприятная группа больных старше 35 лет с высокодифференцированной (G1) гормоночувствительной (РЭ+, РП+) опухолью размером до 1 см, без метастазов в лимфоузлах (T1aN0M0) и без гиперэкспрессии HER2.
Важнейшими прогностическими факторами являются наличие и число пораженных лимфоузлов, размер первичной опухоли, степень злокачественности, определяемая по дифференцировке опухоли (G), возраст больной и состояние ее менструальной функции, содержание РЭ и/или РП в опухоли, а также гиперэкспрессия HER2 (табл. 9.18).
Таблица 9.18. Распределение больных раком молочной железы на категории риска
Рекомендации по выбору методов лечения в зависимости от чувствительности РМЖ к гормонотерапии приведены в табл. 9.19 и 9.20.
Таблица 9.19. Рекомендации по выбору методов лечения в зависимости от чувствительности к гормонотерапии (ГТ)
Примечание: При необходимости назначения XT и тамоксифена прием последнего должен быть начат после завершения XT (ХТ->ГТ) Вопрос относительно последовательности назначения ингибиторов ароматазы и XT (XT + ГТ или ХТ->ГТ) остается дискутабельным У больных в пременопаузе применение аналогов гонадотропин-рилизинг гормона может быть начато одновременно с XT для максимально быстрого достижения менопаузы.
Таблица 9.20. Рекомендации по лечению больных с гормоночувствительными опухолями
Примечание: В круглых скобках указаны лечебные опции, являющиеся предметом дискуссий и оцениваемые в соответствующих клинических исследованиях. Т — тамоксифен; ИА — ингибиторы ароматазы, ГТ — гормонотерапия; ОС — овариальная супрессия
При высоком риске N0 и отсутствии гормональных рецепторов послеоперационно проводится 4-6 курсов химиотерапии с включением антрациклинов (AC, FAC) или 6 курсов CMF. Больным в пременопаузе с положительными рецепторами и N0 после XT назначается тамоксифен на 5 лет. Альтернативой у этой категории пациенток служит выключение функции яичников с назначением тамоксифена.
У больных с низким риском в пременопаузе с N0 используется выключение функции яичников с помощью агонистов LH-RH в течение 2 лет, изучается целесообразность более длительного применения этих препаратов.
У больных в постменопаузе с N0 и положительными рецепторами используются ингибиторы ароматазы либо тамоксифен в течение 5 лет или прием тамоксифена в течение 2-3 лет с последующим переходом на ингибиторы ароматазы (до 5 лет). У больных в постменопаузе адъювантная гормонотерапия на любом этапе ее проведения может включать ингибиторы ароматазы. В ряде исследований было показано, что лечение тамоксифеном неэффективно у НЕR2-позитивных больных, что служит показателем резистентности к тамоксифену.
При высоком риске и N0 даже в менопаузе считается целесообразным назначение химиотерапии, а затем гормонотерапии ингибиторами ароматазы или тамоксифеном. У больных старше 70 лет основой адъювантной лекарственной терапии является тамоксифен.
При N+ в пременопаузе и при количестве метастазов в подмышечных лимфоузлах менее 4 показано проведение 6 курсов антрациклинсодержащих комбинаций CAF, FAC, АС или 6 курсов классического режима CMF с пероральным приемом циклофосфамида. При наличии 4 метастазов и более считается целесообразным назначение более длительной химиотерапии с дополнительным использованием таксанов. Далее при положительных рецепторах назначается тамоксифен на 5 лет.
У больных с сохранной менструальной функцией при поражении не более 3 лимфоузлов и положительных рецепторах допустимо выключение функции яичников с одновременным приемом тамоксифена.
У больных в постменопаузе с положительными рецепторами основой адъювантного лечения считается гормонотерапия (ингибиторы ароматазы или тамоксифен), но при поражении 4 лимфоузлов и более показано на I этапе проведение XT с последующей гормонотерапией. При отрицательных рецепторах в постменопаузе рекомендуется только XT.
Комитет экспертов конференции (St. Gallen, 2009) предложил упростить вопрос выбора показаний к применению гормонотерапии при операбельном РМЖ: все больные, у которых обнаружены РЭ+ (независимо от их уровня), должны получать гормонотерапию. РЭ-положительными считаются все опухоли, в которых при иммуногистохи-мическом исследовании обнаруживается даже минимальное количество РЭ-положительных клеток. При окрашивании более 50% клеток опухоль рассматривается как высокочувствительная к гормонотерапии.
Стандарт гормонотерапии для больных в пременопаузе — это применение тамоксифена либо тамоксифена + выключение функции яичников; ингибиторы ароматазы пациенткам в пременопаузе противопоказаны и могут применяться лишь в случае противопоказаний к использованию тамоксифена, при условии надежного выключения функции яичников по показателю содержания эстрадиола в сыворотке крови (верификация выключения функции яичников желательна даже при назначении ингибиторов ароматазы пациенткам в менопаузе моложе 60 лет). Для женщин в менопаузе предпочтительна гормонотерапия ингибиторами ароматазы, хотя у отдельных больных возможно использование тамоксифена. У больных с высоким риском предпочтительны ингибиторы ароматазы.
Показано, что у больных в менопаузе при рецептор-положительном раком молочной железы длительное применение летрозола (Фемара) по 2,5 мг/сут после окончания 5-летнего приема тамоксифена улучшает эффективность адъювантной гормонотерапии, снижая к 4 годам наблюдения относительный риск рецидива на 42 %.
Современный выбор оптимальных режимов адъювантной химиотерапии достаточно широк и включает использование антрациклинов и таксанов.
Применение антрациклинсодержащих комбинаций позволяет по сравнению с CMF уменьшить риск рецидива на 12%, риск смерти — на 11 % и увеличить 5-летнюю безрецидивную выживаемость на 3,2%, 5-летнюю общую выживаемость — на 2,7%. В США в адъювантном лечении у больных с плохим прогнозом используется паклитаксел после нескольких курсов антрациклинсодержащих комбинаций, в Европе активно ведутся исследования по использованию доцетаксела в адъювантной терапии, показавшие его высокую активность.
У больных с HER2+ РМЖ в рандомизированных исследованиях показано значение адъювантного применения трастузумаба (Герцептин).
На основании предварительного анализа результатов этих исследований международным консенсусом в 2007 г. рекомендовано использование трастузумаба при ранних стадиях HER2+ РМЖ в течение 1 года. Остается неясным вопрос о длительности его применения, целесообразности назначения при N0 и Т 5 лет);
• пожилой возраст;
• метастазы в костях, локорегионарные метастазы, минимальные метастазы в легких;
• гистологически установленная I-II степень злокачественности (G1-G2);
• большая длительность полученной ранее ремиссии в результате предшествовавшей гормонотерапии.
Ответ на гормонотерапию маловероятен в следующих случаях:
• короткий период без метастазирования (
источник

Стоимость химиотерапии рака молочной железы в Израиле – от 2 700$ за курс.
Медицинский сервис Tlv.Hospital окажет помощь в организации химиотерапии рака молочной железы в клиниках Израиля. Уровень развития медицины данного государства позволит провести максимально эффективное лечение.
Наша компания предлагает услуги профессионального провайдера в Израиле. Мы организуем программу диагностики и лечения, выбор ведущего врача и клиники, бытовое сопровождение по приемлемой стоимости и многое другое.
Адъювантная химиотерапия при лечении рака молочной железы в Израиле осуществляется после операции. Подобное лечение назначают пациентам без очевидных признаков рака после проведенного хирургического вмешательства. Цель адъювантной терапии – уничтожить злокачественные клетки, которые могли сохраниться и остаться незамеченными. Этот вспомогательный вид лечения снижает риск рецидива.
Даже на начальных стадиях заболевания раковые клетки способны отрываться от первичного опухолевого очага и распространяться по организму через кровоток. Они не проявляют себя, не отображаются на результатах диагностики. Но если эти клетки начнут расти, они станут причиной образования новых опухолей в других местах. Цель адъювантной терапии – уничтожить их.
Неоадъвантная химиотерапия назначается до операции. Часто здесь используются те же методики, что и при адъювантной, только перед, а не после операции. Основное преимущество неоадъвантной химиотерапии в том, что она способна уменьшить большие опухоли до размера, когда возможно проводить оперативное лечение. Другое преимущество заключается в том, что врачи могут видеть реакцию организма женщины на химиопрепараты.
Ведущими специалистами по терапии рака груди в Израиле является Юлия Гринберг, доктор Моше Инбар и доктор Ирина Стефански. Они имеют большой опыт работы в лечении рака молочной железы с помошью химиотерапии, радиотерапии и с помощью других новых методов.
В некоторых случаях злокачественные образования молочной железы являются слишком большими, чтобы их можно было удалить хирургическим путем в момент постановки диагноза. Данный вид онкологии называют местно-распространенным. С помощью химиотерапии уменьшают размеры, чтобы удалить хирургическим способом.
Для распространенного рака груди химиотерапия может быть использована в качестве основного метода лечения, когда метастазы проникли за пределы молочной железы и подмышечной области. Продолжительность терапии будет зависеть от того, с какой скоростью уменьшается опухоль, сколько времени и как женщина переносит лечение.
После хирургического лечения в Израиле пациентке рекомендуют тест «Онкотайп», посредством которого определяют потенциальную пользу химиотерапии.
В большинстве случаев, особенно это касается адъювантного и неоадъювантного лечения, более эффективны именно комбинации препаратов, а не какое-либо одно лекарственное средство. Применяются различные схемы химиотерапии, и нет конкретно какой-либо одной, которая, несомненно, является лучшей.
Наиболее распространенными химиотерапевтическими препаратами для лечения начальных стадий рака молочной железы являются антрациклины, угнетающие грамположительные бактерии и обладающие 
Некоторые из наиболее распространенных схем химиотерапии рака молочной железы:
- CAF (или FAC): Циклофосфамид, Доксорубицин (Адриамицин), 5-ФУ.
- TAC: Доцетаксел/Таксотер, Доксорубицин (Адриамицин) и Циклофосфамид.
- AC → Т: Доксорубицин (Адриамицин) и Циклофосфамид с последующим введением Таксола (Паклитаксела) или Таксотера (Доцетаксела).
- FEC: → Т: 5-ФУ, Эпирубицин и Циклофосфамид с последующим введением Таксотера (Доцетаксела) или Таксола (Паклитаксела)
- TC: Таксотер (Доцетаксел) и Циклофосфамид.
- TCH: Таксотер (Доцетаксел), Карбоплатин, и Герцептин (трастузумаб)
Руководство мировыми медицинскими протоколами, а также разработка уникальных протоколов химиотерапии являются одним из факторов высокой эффективности лечения рака в Израиле.
В меньшей степени используемые схемы химиотерапии рака молочай железы:
- CMF: Циклофосфамид (Cytoxan ®), Метотрексат* (Methotrexate*) и Фторурацил (5-ФУ).
- → CMF: Доксорубицин (Адриамицин), а затем схема CMF.
- ЕС: Epirubicin (Эпирубицин) и Циклофосфамид (Cytoxan ®)
- AC: Доксорубицин (Адриамицин), Циклофосфамид (Cytoxan ®).
Другие химиопрепараты, полезные при лечении женщин с раком груди:
- Платиновые агенты (Цисплатин, Царбоплатин).
- Винорелбин (Navelbine ®)
- Капецитабин (Кселода ®)
- Липосомальный доксорубицин (Doxil ®).
- Гемцитабин (Гемзар ®).
- Митоксантрон.
- Иксабепилон (Ixempra ®).
- ABRAXANE(Абраксан)
- Eribulin (Halaven ®)
Врачи проводят химиотерапию циклами, период лечения сменяется периодом покоя, чтобы дать организму возможность восстановиться от последствий приема лекарственных средств. Терапия начинается с первого дня каждого цикла, но график меняется в зависимости от используемых препаратов. Например, некоторые из них дают только в первый день цикла, другие – каждый день в течение 14 дней и т.д. Циклы чаще всего длятся 2 или 3 недели, но меняются в зависимости от конкретного лекарства или их комбинации.
Адъювантую и неоадьювантную химиотерапию в основном проводят в течение 3-6 месяцев, зависит от используемых медикаментозных средств. Лечение может длиться дольше при распространенном раке молочной железы, его период обусловлен действенностью и побочными эффектами.
Врачи обнаружили, что высокоинтенсивные курсы химиотерапии могут снизить вероятность рецидива и улучшить выживаемость. Это означает следующее: те же циклы химиотерапевтического лечения, которые дают каждые три недели, начинают давать каждые две недели. Препарат (фактор роста) может помочь повысить уровень лейкоцитов в крови после химиотерапии, чтобы удостовериться, что количество лейкоцитов возвращается к норме на начало следующего цикла лечения. Этот подход используется для неоадъювантной и адъювантной терапии. Однако он может привести к более значительным побочным эффектам, а также высокодозная химиотерапия не подходит для всех.

Для уменьшения побочных эффектов химиотерапии израильские врачи успешно применяют различные современные препараты и методики, к примеру, колониестимулирующие факторы с определенными схемами цитостатических средств (против нейтропении, анемии).
Негативные явления от химиотерапии обусловлены видом лекарств, их количеством и продолжительностью приема. Наиболее распространенные побочные эффекты:
- выпадение волос;
- язвы в полости рта;
- увеличение или потеря аппетита;
- тошнота и рвота;
- низкое количество кровяных клеток.
Химиотерапия может повлиять на кроветворные клетки костного мозга, что станет причиной повышенного риска:
- инфекций из-за недостаточного количества белых кровяных телец;
- гематом и кровотечений из-за низкого уровня тромбоцитов;
- разовьется усталость в связи с низким уровнем эритроцитов и других причин.
Эти побочные эффекты обычно длятся недолго и уходят после окончания лечения.
Для молодых женщин изменения в менструальном цикле — распространенный побочный эффект химиотерапии. Преждевременная менопауза или бесплодие могут быть нежелательным последствием временного или постоянного характера. Чем старше женщина, тем выше вероятность отрицательных последствий лечения. Когда это происходит, существует риск потери костной массы и остеопороза. Назначаются лекарства, которые лечат или предотвращают потерю костной массы.
Даже если месячные прекращаются, когда женщина находится на химиотерапии, она в состоянии забеременеть. Беременность во время химиотерапевтического лечения может привести к врожденным дефектам у ребенка, а также мешать процессу борьбы с онкологией. Поэтому с врачом обсуждаются возможности применения противозачаточных средств.
Если женщина была беременна, когда диагностировали рак груди, существует возможность лечения. Некоторые химиопрепараты безопасны в течение последних 2-х триместров.
Также перед началом лечения обсуждается с врачом вопрос о желании пациентки в будущем иметь детей.
Невропатия
Многие препараты, используемые для лечения рака груди, в том числе таксана (Доцетаксел и Таксол), препараты платины (Карбоплатин, Цисплатин), Винорелбин, Эрибулин и Икземпра могут повредить нервы за пределами головного и спинного мозга. Иногда это приводит к появлению таких симптомов (в основном в руках и ногах), как онемение, боль, жжение или покалывание, чувствительность к холоду или жаре, слабость. В большинстве случаев они проходят, как только лечение прекращается, но у некоторых женщин может продолжаться длительное время.
Доксорубицин, Эпирубицин и ряд других лекарственных средств могут привести к необратимому повреждению сердца, так называемой кардиомиопатии. Риск зависит от количества препарата и длительности применения, особенно в высоких дозах. Врачи внимательно следят за этим побочным эффектом. Они проверяют работу сердца пациента с помощью теста MUGA (тест ядерной медицины, оценивающий функцию желудочков сердца) или эхокардиограммы перед началом приема одного из этих препаратов. Врачи тщательно контролируют дозы, следят за симптомами. Если функция сердца начинает снижаться, лечение этими препаратами останавливают. Тем не менее, у некоторых пациентов процесс повреждения протекает в течение длительного времени: признаки могут не проявляться на протяжении нескольких месяцев или даже лет после того, как терапию прекратили.
Некоторые химиопрепараты, такие как Капецитабин (Capecitabine) и Доксорубицин (Doxorubicin), могут раздражать ладони рук и подошвы ног. К ранним симптомам относится онемение, покалывание и покраснение. Если состояние ухудшается, возможны отеки, болезненность, сыпь, очаговое шелушение, зуд. Специфического лечения нет, но некоторые крема могут помочь. Симптомы постепенно исчезают, когда прекращается прием лекарственных средств, или снижают дозу. Лучший способ предупредить данный синдром, рассказать врачу о ранних признаках.

Очень редко химиопрепараты способны привести к повреждению костного мозга, что провоцирует развития миелодиспластического синдрома (МДС) или даже острого миелоидного лейкоза. Это происходит в основном в течение 10 лет после окончания лечения.
После химиотерапии многие женщины не ощущают себя здоровыми, как это было раньше. Присутствует остаточное чувство боли, потери физической активности.
Усталость является очень распространенным симптомом после данного вида лечения для женщин. Она может сохраняться в течение нескольких лет.
Смотрите видео о химиотерапии метастатического рака молочной железы.
источник
Лапатиниб – новый противоопухолевый препарат, двойной ингибитор тирозинкиназных рецепторов HER1/HER2. В настоящее время широко применяется в комбинации с капецитабином при распространенном и/или метастазирующем РМЖ с гиперэкспрессией HER2 рецепторов больных, ранее получавших терапию трастузумабом, при развитии резистентности к последнему. Продолжаются интенсивные исследования по оценке эффективности лапатиниба в сочетании с различными цитостатиками, препаратами эндокринотерапии, а также с другими таргетными агентами. Изучается возможность применения лапатиниба в качестве адъювантной и неодъювантной терапии.
Создание и внедрение в клиническую практику противоопухолевых препаратов нового поколения, к числу которых относится и низкомолекулярный ингибитор тирозинкиназных рецепторов эпидермального фактора роста ErbB1/EbB2 лапатиниб, стали возможными благодаря более глубокому пониманию биологии опухоли.
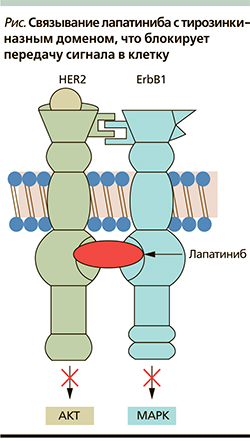
Тирозинкиназные рецепторы эпидермального фактора роста (Human Epidermal Growth Factor Receptors – HER/ErbB) располагаются на мембранах клеток нормальных тканей и опухолей, они регулируют постоянную активацию сигнальных путей, что стимулирует опухолевые клетки к митозу. Количество HER-рецепторов в опухолевых клетках больше, чем в нормальных тканях.
Семейство рецепторов эпидермального фактора роста состоит из четырех тирозинкиназных рецепторов: EGFR/HER1/ErbB1, HER2/ErbB2, HER3/ErbB3, HER4/ErbB4 [1, 2]. Для ряда опухолей, в т.ч. рака молочной железы (РМЖ), характерно увеличение числа копий генов (амплификация) и/или повышение уровней мРНК и белковых продуктов генов-рецепторов (гиперэкспрессия). Гиперэкспрессия ErbB2/HER2 при РМЖ встречается, по разным данным, в 10–37 % случаев [3, 4]. Тирозинкиназный рецептор состоит из внеклеточного лигандсвязывающего домена, трансмембранного домена и внутриклеточного каталитического или белкового тирозинкиназного домена [1, 5]. При связывании лиганда (фактора роста) с внеклеточным доменом происходит димеризация рецептора, т.е. объединение двух связанных с лигандом рецепторов в единый функциональный комплекс. В процессе димеризации образуются гомо- и гетеродимеры. После димеризации рецептора происходит активация внутриклеточного домена и аутофосфорилирование тирозинкиназы. Этот процесс инициирует сигнальные каскады с участием MAPK–ERK1/2 и PI3K/AKT и трансдукцию сигнала внутрь клетки [1, 6]. HER2, существующий в закрытой форме, не связывается с лигандом, но является предпочтительным партнером в формировании димера для других HER-рецепторов [7]. Коэкспрессия HER1 и HER2 обратно коррелирует со статусом рецепторов эстрогенов в опухоли, а гетеродимеры HER1/2 увеличивают метастатический потенциал клеточных линий РМЖ [9]. Поэтому возникло представление, будто двойное ингибирование обоих рецепторов может быть более эффективным, чем ингибирование каждого в отдельности [10].
Лапатиниб – двойной ингибитор тирозинкиназных рецепторов HER1/HER2. Он блокирует активацию рецептора и таким образом прерывает передачу сигнала внутрь клетки (см. рисунок). Предотвращение активации обоих рецепторов дает возможность эффективного применения препарата при HER2(+)-опухолях, резистентных к трастузумабу (Герцептину). In vitro была продемонстрирована аддитивная активность лапатиниба и фторурацила (активный метаболит капецитабина) при использовании в комбинации на четырех линиях опухолевых клеток. Ингибирующий эффект оценивался на обработанных трастузумабом клетках. Исследования I фазы показали, что лапатиниб в монорежиме характеризуется хорошей переносимостью и обладает противоопухолевой активностью при различных HER2+-солидных опухолях, в т.ч. при РМЖ [6, 11].
В рандомизированном исследовании III фазы EGF 100 151 больной распространенным HER2-позитивным РМЖ при прогрессировании после химиотерапии, включившей антрациклины, таксаны и трастузумаб, назначили капецитабин 2500 мг/м2/сут 1–14-й дни (201 пациентка) или капецитабин 2000 мг/м2/сут 1–14-й дни в комбинации с лапатинибом 1250 мг/сут (198 пациенток).
В группе больных, получавших комбинацию препаратов, медиана времени до прогрессирования (ВДП) составила 26,7 недели против 20,7 – в группе пациентов, получавших капецитабин в режиме монотерапии (отношение рисков [ОР] – 0,54; 95 % доверительный интервал [ДИ] – 0,28–1,03; p = 0,046). Медиана общей выживаемости составила 75 недель при комбинации препаратов и 64,7 – при монотерапии (ОР – 0,87; 95 % ДИ – 0,71–1,08; p = 0,21) [14, 15].
Таким образом, комбинация лапатиниба с капецитабином продемонстрировала значительный выигрыш в отношении медианы ВДП у больных метастатическим HER2-позитивным РМЖ по сравнению с капецитабином в монорежиме при удовлетворительной переносимости.
В другом исследовании сравнили эффективность паклитаксела и паклитаксела с лапатинибом для 579 больных метастазирующим РМЖ. Значительного различия в медиане ВДП среди HER2-негативных пациентов не отмечено. Лечение лапатинибом и паклитакселом 86 пациентов с HER2-позитивным РМЖ (15 %) привело к статистически значимому увеличению ВДП, частоты объективного эффекта и безрецидивной выживаемости [16, 17].
Однако в сравнительном рандомизированном исследовании COMPLETE [12] показано, что по противоопухолевой активности лапатиниб уступает трастузумабу. В нем 636 больных метастатическим HER2+ РМЖ получали в качестве 1-й линии лечения комбинацию лапатиниба или трастузумаба с таксанами (паклитаксел, доцетаксел). Безрецидивная выживаемость в группе больных, получавших лапатиниб, составила 8,8 месяца, в группе трастузумаба – 11,4. По общей выживаемости различий между группами не было.
В исследовании CEREBEL [13] сравнивали эффективность комбинаций капецитабина с трастузумабом и лапатинибом в отношении 475 больных HER2+-РМЖ с метастазами в ЦНС. Предшествующая терапия включала антрациклины или таксаны. Безрецидивная выживаемость в группе больных, получавших лапатиниб, составила 6,6 месяца, в группе получавших трастузумаб – 8. Медиана общей выживаемости также была ниже в группе лапатиниба: 22,4 против 27,3 месяца.
Таким образом, на основе представленных данных лапатиниб используется прежде всего больными HER2+-РМЖ, ранее получавшими трастузумаб и ставшими резистентными к нему.
Препарат продемонстрировал обнадеживающую активность в отношении метастазов в головной мозг. Результатом II фазы клинических исследований применения лапатиниба 39 больными HER2-позитивным РМЖ с метастазами в головной мозг стало достижение 1 частичной ремиссии (частота ответов – 3 %).
У 7 пациентов обеих групп с поражением и без поражения ЦНС медиана ВДП составила 16 недель. Данные об уровне безрецидивной выживаемости были оценены по критериям RECIST. Кроме того, в настоящее время изучаются возможности применения лапатиниба в комбинации с ингибиторами ароматазы и уже имеются данные о его эффективности в комбинации с летрозолом [17].
В исследовании ALTTO (Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization) сравнивали 4 режима лечения: 1 год использовали трастузумаб, 1 год – лапатиниб, комбинация двух препаратов – в течение года, 3 месяца – трастузумаб с последующим 6-недельным перерывом и 7,5 месяцев – лапатиниб. В исследование включен 8381 пациент из 50 стран 6 континентов. Большинство женщин (4613) получали трастузумаб и/или лапатиниб после химиотерапии, остальные получали трастузумаб и/или лапатиниб одновременно или последовательно с химиотерапией. Медиана наблюдения составила 4,5 года. Комбинация лапатиниба с трастузумабом в качестве адъювантного лечения ранних стадий HER2+ РМЖ не показала статистически значимого преимущества в отдаленных результатах лечения [18, 31].
CALGB 40601 (Alliance) – рандомизированное исследование неоадъювантной химиотерапии III фазы с использованием паклитаксела и трастузумаба в еженедельном режиме с лапатинибом или без него. В исследование были включены 305 больных РМЖ. Пациенты получали паклитаксел (80 мг/м2/нед в/в) + трастузумаб (4 мг/кг далее 2 мг/кг/нед в/в) ± лапатиниб (750 мг/сут внутрь) в течение 16 недель перед оперативным лечением. В третьей группе больные получали паклитаксел с лапатинибом (1500 мг/сут). Эта группа вскоре была закрыта на основании отрицательных данных об эффективности и токсичности, полученных из предварительного исследования ALTTO. Частота полного патоморфологического эффекта при лечении паклитакселом, трастузумабом, лапатинибом составила 51 % (42–60 %), паклитакселом и трастузумабом – 40 % (32–49 %), паклитакселом и лапатинибом – 32 % (22–44 %); различия статистически недостоверны (p = 0,11) [19, 20].
В рандомизированном многоцентровом исследовании (NCT01013740) II фазы оценивались эффективность и токсичность комбинации лапатиниба с винорелбином или капецитабином в качестве первой и второй линий химиотерапии метастазирующего РМЖ с гиперэкспрессией HER2 [21].
В первую группу были включены 75 больных, во вторую – 37 (всего 112). Пациенты первой группы получали лапатиниб 1250 мг внутрь ежедневно + винорелбин 20 мг/м2 в/в 1-й, 8-й дни каждые 3 недели. Во второй группе назначали лапатиниб 1250 мг внутрь ежедневно + капецитабин 2000 мг/м2/сут внутрь в 2 приема с 12-часовым интервалом в 1–14-й дни каждые 3 недели. Медиана общей выживаемости в группе лапатиниба и винорелбина составила 24,3 месяца (95 % ДИ – 16,4–26,5), в группе лапатиниба и капецитабина – 19,4 (95 % ДИ – 16,4–27,2). Сорок два пациента при прогрессировании опухолевого процесса получали перекрестный режим, из них 29 – лапатиниб с капецитабином, 13 – лапатиниб с винорелбином. Медиана ВДП после перекреста составила 4 месяца (95 % ДИ – 2,1–5,8) при лечении лапатинибом и капецитабином и 3,2 месяца (95 % ДИ – 1,7–5,1) лапатинибом и винорелбином. Анализ выживаемости без прогрессирования и токсичности показал, что эти два режима сопоставимы.
Еще в одном рандомизированном многоцентровом исследовании (LPT111110; NCT00709618) II фазы оценивались эффективность и токсичность комбинации лапатиниба с винорелбином в качестве первой и второй линий химиотерапии метастазирующего РМЖ с гиперэкспрессией HER2 [22]. Больные получали лапатиниб 1500 мг внутрь ежедневно + винорелбин 20 мг/м2 в/в 1-й, 8, 15-й дни каждые 4 недели до прогрессирования или исключения из протокола. Оценивались частота объективного эффекта, безрецидивная выживаемость, общая выживаемость, время до достижения эффекта, продолжительность эффекта. В исследование были включены 44 больных. Частота объективного эффекта составила 41 % (95 % ДИ – 26,4–55,4; 4 – полных, 14 – частичных эффектов). Медиана безрецидивной выживаемости, составили 24,1 (95 % ДИ 16,9–36,7), медиана времени до достижения эффекта – 7,5 (95 % ДИ 7,1–8,1) и медиана продолжительности эффекта – 32,0 (95 % ДИ 18,0–42,3) недели соответственно.
В исследовании неоадъювантной терапии GeparQuinto частота патоморфологического эффекта при использовании стандартной антрациклин/таксан-содержащей химиотерапии в комбинации с лапатинибом была значительно ниже по сравнению с группой больных, получавших химиотерапию в сочетании с трастузумабом (22,7 против 30,3 %; р = 0,04) [23].
Для больных метастазирующим РМЖ в исследовании MA.31 лапа-тиниб в комбинации с таксанами оказался менее эффективным по сравнению с трастузумабом в комбинации с таксанами по ВДП (8,8 против 11,4 месяца; р = 0,01). По токсич-ности комбинация лапатиниба с таксанами оказалась выше за счет диареи [12].
В настоящее время известно, что лапатиниб не оказывает выраженного кардиотоксического действия.
В рандомизированном исследовании LETLOB II фазы оценивалась эффективность летрозола или летрозола и лапатиниба для пациенток в постменопаузе с гормонально-чувствительным HER2-негативным операбельным РМЖ. Побочные эффекты включали диарею, сыпь, общую слабость. Побочные эффекты III–IV степеней встречались редко [25]. Лапатиниб характеризуется потенциально низкой кардиотоксичностью по сравнению с трастузумабом и активирует аденозинмонофосфаткиназу, ключевой регулятор энергетического обмена и защиты клеток от ишемии [26]. Среди 2812 больных, получавших лапатиниб, только у 1,3 % наблюдалось снижение фракции выброса левого желудочка, которое имело обратимый характер приблизительно для половины пациентов [27].
В настоящее время продолжаются интенсивные исследования по оценке эффективности лапатиниба в сочетании с различными цитотоксиками, препаратами эндокринотерапии, а также с другими таргетными агентами. Изучается возможность применения лапатиниба в качестве адъювантной и неодъювантной терапии.
Международное многоцентровое исследование NeoALLTO показало возможность успешного сочетания лапатиниба и трастузумаба с паклитакселом. Больных инвазивным операбельным (Т > 2 см) HER2-позитивным РМЖ рандомизировали в 3 группы: 1) лапатиниб + паклитаксел, 2) трастузумаб + паклитаксел, 3) лапатиниб + трастузумаб + паклитаксел. После неоадъювантной терапии проведено оперативное лечение, затем 3 курса адъювантной химиотерапия по схеме FEC, далее назначалась терапия лапатинибом в первой группе, трастузумабом во второй и обоими препаратами в третьей группах. Суммарное время использования анти-HER-2-терапии составило 52 недели. Частота полного патоморфологического эффекта оказалась значительно выше в группе лапатиниба и трастузумаба – 51,3 %, тогда как в группе с лапатинибом она была 24 %, а в группе с трастузумабом – 29,5 %.
В клиническом исследовании IIb-фазы CHERLOB пациенты с HER2-позитивным первичным РМЖ (стадии II–IIIА) рандомизировались в группы, получавшие неоадъювантную химиотерапию с трастузумабом, лапатинибом или с обоими препаратами. Целью исследования стало достижение полного регресса опухоли. Результаты данного исследования показали преимущество сочетания лапатиниба и трастузумаба с химиотерапией по сравнению с использованием химиотерапии с трастузумабом или лапатинибом, подтвердив таким образом преимущество двойной ингибиции HER2 [29]
На основе представленных выше данных были разработаны следующие рекомендации по применению лапатиниба.
Лапатиниб показан: 1) при распространенном и/или метастазирующем РМЖ с гиперэкспрессией ErbB2+ (HER2+)-рецепторов в комбинации с капецитабином больным, ранее получавшим терапию с трастузумабом; 2) при распространенном гормонозависимом HER2-положительном РМЖ в сочетании с ингибиторами ароматазы.
Перед началом лечения необходимо оценить уровень фракции выброса левого желудочка, который следует контролировать во время терапии, чтобы не допустить снижения данного показателя ниже допустимых значений. Лечение лапатинибом следует прекратить в случае снижения фракции выброса до ≥ 3-й степени. Лече-ние лапатинибом может быть возобновлено не ранее чем через 2 недели в меньшей дозе (1000 мг/сут) и только если уровень фракции выброса левого желудочка находится в допустимых границах нормы. Постоянное снижение фракции выброса левого желудочка в течение 9 недель лечения, как правило, ограничивает длительность проводимой терапии [29].
Лечение лапатинибом должно быть прекращено и в случае появления легочных симптомов, свидетельствующих о развитии интерстициального легочного процесса/пневмонита ≥ 3-й степени (по классификации нежелательных явлений Национального онкологического института). Решение о прекращении применения или изменении дозы лапатиниба может быть принято, когда уровень развивающихся токсических эффектов соответствует ≥ 2-й степени по классификации нежелательных явлений Национального онкологического института. При снижении уровня токсических эффектов до 1-й степени и менее лечение может быть возобновлено в дозе 1250 мг/сут. В случае повторного возникновения токсических эффектов дозу лапатиниба сле-дует уменьшить до 1000 мг/сут.
источник


