Для верного лечения рака молочной железы необходимо провести множество тестов и анализов, среди которых определение индекса Ki-67. Этот маркер чрезвычайно важен, он позволит составить верный план лечения и определить, как развивается опухоль. Что нужно знать об этом маркере? Как проводится тест? Каковы прогнозы?
Под Ki67 подразумевается антиген раковой опухоли. Его можно увидеть в клетке при ее делении, но если она находится в фазе покоя, то обнаружить этот антиген невозможно. Благодаря этому маркеру можно прогнозировать поведение раковой опухоли. Тест берется с помощью биопсии или оперативным путем, проводится на образце ткани.
Тест на этот вид маркера проводится не только для рака груди, но и для других злокачественных опухолей. Но в большинстве случаев, именно на рак молочной железы приходится основной процент проведённых тестов с Ki-67. Если уровень антигена высокий, то прогнозы неутешительные и опухоль прогрессирует. Если процент Ki-67 большой, то вероятность рецидива увеличивается. Причем независимо от того, как реагирует новообразование на гормональное лечение.
Если после проведенного лечения заболевание снова дает о себе знать и при этом маркер еще выше, то это говорит о том, что нужно комбинировать несколько методов противораковой терапии.
Если онкология агрессивная, то врач назначает тест для того, чтобы убедиться влияет ли уровень антигена на развитие опухоли. Также сдается ряд и других тестов, например на наличие рецептора HER2 — Neu. Данные, полученные со всех тестов дадут основу для составления плана лечения.
Если опухоль растет быстро, меняется, это может служить основанием для проведения теста. Ведь индекс указывает на количество клеток в стадии деления, а чем больше их делится, тем больше становится.
Для того чтобы сдать анализ не нужно какой-то специальной подготовки или условий проведения. Берется часть пораженной ткани и окрашивается. Это позволит определить процент клеток, находящихся или готовящихся к делению. Чем больше клеток в стадии деления, тем еще больше их будет.
- Результат окрашивания оценивается с помощью световых микроскопов.
- Процент определяется соотношением окрашенных клеток ко всем остальным, при этом интенсивность окраски не имеет никакого значения.
- Метод на 15% был изучен врачами патологоанатом, также применяются рекомендации международных медицинских учреждений.
- Тест проводится с учетом раздела всей опухоли.
Итоги теста определяются процентом, если он равен 0%, то не одна из клеток рака не находится в стадии деления, а значит опухоль развивается очень медленно. Если индекс равен 100%, то значит, что все клетки в стадии пролиферации (деления) и опухоль прогрессирует быстро. Если меньше 20% — опухоль растет медленно, все что больше 20% — быстрорастущая онкология. Индекс также используется для оценки эффективности лечения, если оно удачное, то уровень понижается.
Ki 67 — маркер, который является хорошим показателем нахождения клетки в стадии деления (пролиферации). Именно поэтому индекс называют пролиферативным. Уровень маркера означает соотношение клеток, находящихся в стадии деления ко всем остальным. Зная уровень индекса можно сделать довольно точный прогноз выживаемости.
Если уровень индекса высок, то есть делящихся клеток много, то такой рак хорошо подается химиотерапии. Это связано с тем, что препараты химиотерапии убивают только те клетки, которые находятся в стадии пролиферации, а значит и эффективность их высока. Зная индекс, медики смогут подобрать наиболее эффективный план лечения злокачественной опухоли груди.
Ki-67 маркер при раке молочной железы имеет две стороны медали. С одной стороны, если индекс высокий, то прогноз неутешительный, но зато химиотерапия здесь будет точно эффективна.
Другой спорный вопрос об этом тесте заключается в том, будет ли он полезен при определении необходимости адъювантной химиотерапии.
Зная, что высокий уровень маркера означает плохой прогноз, у пациентки может появиться серьезное чувство тревоги за собственное здоровье. Но не стоит отчаиваться, ведь медицина имеет множество методов лечения рака даже на самых последних стадиях. И знать результаты анализов необходимо, пусть даже они неутешительные, это позволит назначить адекватное лечение.
Чтобы не падать духом, стоит искать поддержку в семье, также не лишним будет общение с женщинами, больными раком груди. Общение может быть как живым, так и через интернет, это позволит не оставаться со своей проблемой наедине, также можно получить много полезной информации.
Стоит знать и некоторую статистику выживаемости:
- При индексе меньше 10% выживаемость — 95%.
- Если индекс выше 10% выживаемость – 85%.
Вывод: при уровне антигена, приближающемся к 100%, шансов на выживание очень мало. Однако даже на такой стадии рак подвергается лечению. С помощью показаний маркера врач определит точно, как прогрессирует болезнь и найдет наиболее качественный способ лечения. Помните, надежду нельзя терять никогда. Шанс на исцеление есть всегда!
источник
Наиболее часто рак молочной железы диагностируется после сорока лет, но встречаются более ранние случаи заболевания – в подростковом возрасте, в возрасте 20-30 лет. Исследования на рак проводятся с помощью специальных тестов. Кi67 – это белок, который служит маркером разрастания тканей опухоли при делении клеток. Во время проведения исследований Кi67 обнаруживают только в делящихся клетках. Белок Кi67 указывается в процентах – чем больше процентное содержание, тем выше пролиферативная активность опухоли. Высокое содержание белка указывает на высокий риск метастазирования новообразования, рецидива заболевания. Тест с помощью Кi67 проводят при подозрении на рак молочной железы и другие злокачественные опухоли.
В онкологической клинике Юсуповской больницы пациентки с подозрением на рак молочной железы могут получить консультацию опытного врача-онколога, пройти обследование, лечение заболевания. Онкологическое отделение оснащено современным диагностическим оборудованием, которое позволяет диагностировать рак на ранней стадии развития. Врач направляет пациентку на проведение определенных тестов и анализов. В больнице проводят лечение с помощью химиотерапии, радиотерапии, лучевой терапии. Маркер Ki67 помогает вовремя определить риск развития рецидива – опухоль может появиться в других органах, в области операционного шва, в лимфатических узлах. Показатель белка при развитии рецидива указывает на особенности опухолевого процесса – если процентный показатель белка выше, чем в первичной опухоли, то вторичная опухоль считается агрессивным новообразованием.
Наиболее применяемым иммуногистохимическим тестом считается тест на определение белка Кi67, являющегося антигеном в ядре клеток во всех циклах, кроме GO. Определение процентного содержания белка позволяет своевременно выявлять развитие риска рецидива рака молочной железы, заменять препараты химиотерапии, которые не показывают высокой эффективности. Исследования на процентное содержание белка проводится на материалах опухоли взятых с помощью биопсии. Ki 67 невозможно определить при обыкновенном гистологическом исследовании, такие исследования выполняются при проведении диагностики во время деления клеток. Диагностическое исследование назначают при подозрении на высокую агрессивность опухоли, для контроля опухолевого процесса и выявления риска рецидива, для выбора эффективного лечения новообразования. Показатели нормы белка говорят о благоприятном прогнозе заболевания.
Существуют определенные показатели содержания белка, которые определяют тактику лечения. Норма Кi 67 составляет до 15 % — это говорит о благоприятном прогнозе выживаемости. Прогноз выживаемости зависит от показателей процентного содержания белка Кi 67:
- Ki 67 менее 10% — прогноз благоприятный для 95% женщин. При увеличении показателя от 10% до 15% пятилетний рубеж преодолевают 85% пациенток.
- Норма составляет до 15% содержания белка – прогноз благоприятный, применяется гормонотерапия.
- Ki 20% при раке молочной железы – это показатель активности развития новообразования. Прогноз при своевременно начатом лечении благоприятный.
- Ki 67 составляет 30% — карцинома активно растет, хорошо отзывается на лечение с помощью химиотерапии. Ки 67 высокий при раке молочной железы – это показатель хорошей реакции на препараты химиотерапии клеток опухоли во время активного роста.
- Ki 67 90% — выживаемость равна нулю, прогноз неблагоприятный.
Рак молочной железы – это распространенное заболевание, которое очень часто связано с повышенной гормональной активностью организма женщины. Период полового созревания, беременности, кормления грудью, предклимактерический – это периоды активного воздействия гормонов на железистую ткань груди, характеризующиеся изменениями в тканях молочной железы. Такие же изменения в тканях может вызывать длительное лечение большими дозами гормонов, отсутствие беременности у женщин старше 35 лет, бесплодие.
Ежегодно следует проходить осмотр у врача гинеколога женщинам до 35 лет, женщинам старше 35 лет следует посещать гинеколога два раза в год. Раз в год женщины старше 40 лет должны проходить маммографическое исследование. При появлении симптомов неблагополучия: изменения цвета и структуры кожи груди, втянутости соска, боли, дискомфорта следует посетить врача-маммолога или онколога. В Юсуповской больнице пациентки смогут пройти все необходимые исследования. В онкологическом отделении проводится диагностика злокачественных заболеваний молочной железы, лечение и реабилитация больных.
источник
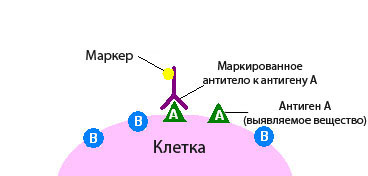
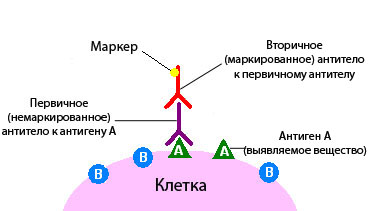
Иммуногистохимическое исследование в онкологии – это разновидность исследования ткани с помощью специальных реактивов по принципу антиген-антитело.
При иммуногистохимическом исследовании используются реактивы, которые содержат антитела, отмеченные специальными веществами.
Антитело – это белок, который связывается в тканях с определенными молекулами — антигенами, после чего возникает реакция. Если же таких молекул нет, то и реакции не будет.
По этому признаку можно судить, присутствует в ткани интересная нам молекула или нет. Это похоже на то, если нанести на белый стол бесцветный клей. Невооруженным глазом на белом фоне он практически незаметен, но стоит насыпать на стол мелкого песка, как клей становится виден за счет прилипших песчинок.
По правилам иммуногистохимическое исследование при раке всегда проводится в специализированной лаборатории. Для его проведения необходима опухолевая ткань, полученная в результате биопсии или операции.
Иммуногистохимическое исследование проводится для определения наличия в опухолевых клетках различных точек приложения, например, наличие рецепторов эстрогенов (ER) и прогестеронов (PR). Также иммуногистохимия выполняется для определения показателя Ki-67 (индекс пролиферативной активности опухолевых клеток), гиперэкспрессии белка Her2neu, VEGF (сосудистый фактор роста), р53.
Иммуногистохимическое исследование при раке выполняется для того, чтобы понять, какими препаратами можно лечить злокачественную опухоль, и к каким видам препаратов она чувствительна.
Самый распространённый анализ, определяемый при иммуногистохимическом исследовании, это наличие рецепторной чувствительности к гормонам у опухоли.
ER и PR — протеиновые рецепторы на поверхности опухолевых клеток.
В организме человека постоянно вырабатываются гормоны — эстроген и прогестерон. Эти гормоны воздействуют на ER и PR рецепторы, что приводит к стимуляции роста опухолевых клеток.
Определение Эстрогеновых и Прогетестероновых рецепторов является одним из важнейших моментов, определяющих чувствительность опухоли к терапии гормональными препаратами.
Чаще всего наличие рецепторов ER/PR определяют при раке молочной железы. Их наличие дает возможность, помимо стандартных методов лечения, применить гормональную терапию.
При гормон позитивном раке молочной железы, назначаются препараты: Тамосксифен, Экземестан (Аромазин), Летрозол (Фемара), Анастразол (Аримидекс), Гексэстрол (Синестрол) и другие.Также, считается, что гормонально-зависимый рак молочной железы отличается спокойным течением и редким метастазированием.
Чувствительность опухолевых клеток к гормональной терапии выражается в баллах от до 10. Опухоль считается гормонозависимой, начиная с 2-х баллов. и требует добавления к лечению гормональной терапии.
Her2Neu — это рецептор эпидермального фактора роста раковой клетки. Это — ген, который воздействует на мембранные рецепторы клетки, и стимулирует её к усиленному делению.
В некоторых опухолях (чаще всего рак молочной железы, рак пищевода, рак желудка) присутствует гиперэкспрессия (повышенная активность) Her2Neu, что вызывает быстрое деление опухолевой клетки и её повышенную активность.
Также снижается эффективность химиотерапии, лучевой терапии, гормональной терапии. Из-за этого опухоли с Her2neu позитивным статусом отличаются агрессивным течением.
Существует две методики определения наличия у опухоли гена Her2neu:
Результаты иммуногистохимического исследования выражаются в баллах:
- 0-1 означает, что опухоль без гиперэкспрессии Her2neu.
- 3 означает, что опухоль с гиперэкспрессией Her2neu.
2. Метод FISH (Флуоресцентная гибридизация in situ)
В отличие от иммуногистохимического исследования, при котором определяются белки, при методе FISH определяется наличие генов, кодирующих протеины Her2neu. В зависимости от их наличия, определяется гиперэкспрессия Her2neu.
Определение гиперэкспрессии рецептора Her2neu в опухоли молочной железы является очень важным для дальнейшего назначения лечения.
В современной онкологии гиперэкспрессию Her2neu определяют, чтобы понять, необходимо ли добавление к лечению ингибиторов Her2neu. Для лечения опухолей с гиперэкспрессией рецептора Her2Neu активно и успешно используются таргетные препараты Трастузумаб (Герцептин), Пертузумаб (Перьета), Трастузумаб-эмтанзин (Кадсила), Бейодайм (Трастузумаб+Пертузумаб). Эти препараты прицельно блокируют рецепторы Her2neu, тем самым останавливая активный рост опухолевых клеток и повышая их чувствительность к химиопрепаратам. Добавление таргетной терапии к стандартной химиотерапии при лечении Her2neu позитивных опухолей, серьезно увеличивает общую выживаемость и результат противоопухолевого лечения.
Ki-67 — это маркер пролиферативной активности опухолевой клетки. Данный параметр оценивается в процентах и показывает, сколько процентов опухолевых клеток активно делятся.
Если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной.
Также Ki-67 является фактором прогноза течения опухолевого заболевания и ответа опухоли на химиотерапевтическое лечение. Определяется это простым способом: чем ниже показатель Ki-67, тем хуже опухоль реагирует на химиотерапевтическое лечение. И наоборот — чем выше показатель Ki-67, тем лучше опухоль будет отвечать на химиотерапию.
Белок p53 — это транскрипционный фактор, регулирующий клеточный цикл. В быстро делящихся клетках обнаружено увеличение концентрации белка р53 по сравнению с клетками, делящимися медленно, что обусловлено высоким риском их онкогенности.
Белок p53 предотвращает образование злокачественных опухолей в нашем организме. В норме, антионкоген р53 находится в неактивном состоянии, а при появлении повреждений ДНК в здоровой клетке — активируется.
Функция белка р53 состоит в удалении тех клеток, которые являются потенциально онкогенными. Это называется — индуцированный апоптоз, уничтожение потенциально опасной клетки.
При иммуногистохимическом исследовании, повышенное содержание белка p53 обнаруживается в 50% злокачественных клеток, что позволяет им беспрепятственно делиться и избегать апоптоза (уничтожения).
Количество белка p53, определяют в дополнение к показателю Кi67, для того, чтобы понять насколько агрессивна опухоль и определить дальнейшее течение болезни. Если уровень белка p53 высокий, значит опухоль не агрессивная и не склонна к метастазированию и быстрому росту. Если же, показатель белка p53 низкий, то значит опухоль агрессивна и склонна к быстрому росту в окружающие ткани и метастазированию.
VEGF – это сигнальный белок, вырабатываемый клетками для активного роста новых сосудов в уже существующей сосудистой системе.
Есть несколько видов белка VEGF, и каждый воздействует на определенный рецептор VEGFR (Vascular endothelial growth factor receptor). Для того чтобы активно делиться, опухоли нужно питание, а для этого нужны сосуды, по которым это питание будет поступать. Именно по этой причине в опухолевых клетках содержится повышенное содержание белка VEGF — для того, чтобы в короткие сроки строить сосудистые сети.
Наличие белка VEGF в опухоли говорит о возможности применения таргетной терапии такими препаратами, как Бевацизумаб (Авастин), Рамуцирумаб (Цирамза), Афлиберцепт (Залтрап). Они перестраивают сосудистую сеть опухоли, тем самым лишая её питания.
Иммунотерапия в онкологии появилась сравнительно недавно, но уже успела показать удивительные результаты в лечении опухолей. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету увидеть опухоль и уничтожить её. Ответственные за «видимость» опухоли белки PD-1, PDL-1 и PDL-2 в достаточном количестве присутствуют не во всех опухолях. Именно поэтому одним пациентам иммунотерапия помогает, а другим нет.
Чаще всего определение гиперэкспрессии белка PD-1 и его лиганд PDL-1 и PDL-2 необходимо при меланоме, немелкоклеточном раке легкого, раке желудка и раке почки.
Для того чтобы отобрать пациентов, которым показана иммунотерапия, проводится определение наличия экспрессии PD-1 и его лиганд PDL-1 и PDL-2, при помощи флюоресцентной гибридизации in situ (FISH). При наличии экспрессии PD-1 и его лиганд PDL-1 и PDL-2, показано применение иммунотерапии препаратами Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Атезолизумаб (Тецентрик).
В современной онкологии иммуногистохимическое исследование играет очень важную роль, так как при помощи этого исследования онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
источник
Рак молочной железы, как известно, является гетерогенным заболеванием. Это означает, что одно и то же проявление болезни может быть обусловлено мутациями в разных генах или разными мутациями внутри одного гена. Существует много подвидов заболевания, которые могут быть определены с помощью генетического тестирования или на основе методов с использованием иммуногистохимических анализов.
В мультигенных тестах пролиферация (разрастание клеток) оказывает существенное влияние на прогнозирование риска рецидива заболевания. В дополнение к определению обычных гистологических параметров оценка пролиферации является одним из важнейших факторов для принятия решения о лечении у больных раком молочной железы.
Широкий диапазон методов доступен для оценки разрастания опухолевых клеток, в частности, вычисление митотических фигур в сегментах окрашенных тканей, анализ проточной цитометрии для определения доли клеток, находящихся в фазе роста клеточного цикла, рассмотрение индекса тимидин-маркирования пролиферирующих клеток ядерных антигенов.
Ki-67 представляет собой ядерный белок, связанный с клеточной пролиферацией. Первоначально он был идентифицирован в начале 1980-х годов при исследовании мышиного моноклонального антитела, направленного против ядерного антигена лимфомы Ходжкина. Наиболее распространенным методом анализа антигена Ki-67 является иммуногистохимическая оценки.
Было выявлено, что ядерный антиген Ki-67 экспрессируется в определенных фазах клеточного цикла. Экспрессия генов — это процесс преобразования информации от гена в конечный продукт — РНК или белок. С помощью иммунологического окрашивания с моноклональными антителами Ki-67 можно оценить долю роста популяции опухолевых клеток и выявить прогноз течения болезни.
Ki-67 является раковым антигеном, который обнаруживается в растущих, разделяющихся клетках, но отсутствует в фазе покоя клеточного роста. Эта характеристика делает Ki-67 хорошим маркером опухоли. Анализ проводится на образце ткани опухоли, чтобы помочь предсказать прогноз роста опухоли.
Тест Ki-67 не рекомендован как обязательный при проведении гистологического исследования опухоли молочной железы. Но при агрессивных формах рака врач может назначить этот тест, чтобы увидеть влияние Ki-67 на рост опухоли. Анализ делается в комплексе с другими исследованиями. На основании общих результатов всех полученных анализов вырабатывается план лечения.
Положительный анализ Ki-67 дает более высокий риск рецидива и худший уровень выживаемости у пациентов с ранними стадиями рака молочной железы. В повседневной клинической работе Ki-67 широко используется в качестве дополнительного фактора для принятия решений по адъювантной (дополняющей хирургическую и лучевую) стратегии лечения.
Опухоль молочной железы с высокими баллами Ki-67 состоит из клеток, которые быстро делятся и растут. Химиотерапевтические препараты высоко эффективны как раз для клеток-мишеней, которые растут за пределами нормальной скорости. Поэтому опухоли с более высоким уровнем Kи-67 хорошо реагируют на химиотерапию. Информация об уровне Ki-67 поможет врачу более точно определить, какое лечение будет работать лучше в данном конкретном случае.
Подготовка к анализу Ki-67 не требует каких-либо специальных условий проведения. Используются стандартные методы подготовки материала для гистологического исследования тканей молочной железы.
Анализ проводят путем окрашивания, что позволяет измерить процент опухолевых клеток, которые являются положительными для Ki-67. Чем больше положительных клеток, тем быстрее они делятся и образуют новые клетки.
При проведении анализа применяют следующие методы:
- проводится иммуногистохимическое окрашивание злокачественных клеток ядерного антигена Ki-67. Результат оценивается количественным и визуальным способом с помощью световых микроскопов;
- значение онкомаркера считается как процент положительно маркированных злокачественных клеток с использованием анти-человеческого Ki-67 моноклонального антитела MIB1, которое является одним из наиболее часто используемых антител и рассматривается как «золотой стандарт»;
- процентная оценка Ki-67 определяется как процент положительно окрашенных клеток опухоли среди общего количества злокачественных клеток. Результат не зависит от интенсивности окраски;
- точка отсечки Ki-67 на 15% была определена в соответствии с опытом различных патологоанатомов, а также общепринятых национальных и международных медицинских рекомендаций;
- подсчет результата проводится с учетом раздела всей опухоли.
При раке молочной железы результат Ki-67 менее 10% считается низким, 10-20% пограничным и 20% – высоким.
В таблице 1 показаны средние значения Ki-67 в зависимости от стадии заболевания, размера опухоли и других параметров.
Таблица 1 – Средние показатели Ki-67 в зависимости от различных показателей заболевания
| Характеристика | Абсолютное среднее значение Ki-67 (± разбежность) |
|---|---|
| Стадия менопаузы | |
| пременопаузальная | 24,1 (± 20,4) |
| постклимактерическая | 19.3 (± 17.3) |
| Размер опухоли | |
| pT1 | 17,7 (± 16,3) |
| pT2 | 24,1 (± 20,3) |
| pT3 | 20,7 (± 15,7) |
| pT4 | 20.1 (± 16.6) |
| Узловой статус | |
| N0 | 18,9 (± 17,9) |
| N1 | 21,6 (± 18,6) |
| N2 | 23,4 (± 17,9) |
| N3 | 24,4 (± 17,0) |
| Гистология | |
| Проточная | 21,8 (± 18,7) |
| Дольковая | 13,3 (± 10,7) |
| Другая | 14,5 (± 17,5) |
| Профилирование | |
| G1 | 9.7 (± 8.2) |
| G2 | 16,2 (± 12,7) |
| G3 | 37,4 (± 22,1) |
| Лимфатическая инвазия | |
| L 0 | 18.2 (± 17.3) |
| L 1 | 24,3 (± 18,9) |
| Сосудистое вторжение | |
| V0 | 19,7 (± 17,9) |
| V1 | 27,8 (± 19,9) |
| Экстрогенорецепторы | |
| положительный | 16.8 (± 14.1) |
| отрицательный | 16.8 (± 14.1) |
| Рецептора прогестерона | |
| положительный | 16,5 (± 13,8) |
| отрицательный | 33,5 (± 24,1) |
| HER2 / Neu | |
| положительный | 27.5 (± 19,0) |
| отрицательный | 18,7 (± 17,5) |
| Рецепторный статус | |
| ER + PR + | 16.1 (± 13.2) |
| ER + PR- | 21,9 (± 19,1) |
| ER- PR + | 40,6 (± 27,4) |
| ER- PR- | 41,9 (± 23,8) |
Отсутствие положительной динамики индекса онкомаркера в процессе проводимого лечения говорит о неблагоприятном течении и прогнозе болезни.
Ki67 служит индикатором прогноза остаточного риска у больных раком груди, получавших эндокринную терапию Летрозолом или Тамоксифеном. Использование эндокринной терапии напрямую коррелирует с уровнем Ki-67. Показатель онкомаркера после приема медикаментов рассматривается в качестве индекса резидуального (остаточного) заболевания после проведения лечения.
Динамика изменения индекса в ходе проведения химиотерапии помогает принять решение о ее целесообразности в конкретном случае. Снижение уровня Ki-67 происходит в любом случае проведения неоадъювантной химиотерапии. Отсутствие падения уровня онокомаркера является предвестником неблагоприятного прогноза заболевания.
источник
Стандартизованное иммуногистохимическое исследование: рецепторный статус при раке молочной железы (PR, ER, ki67, Her2 neu). Выполняется только при наличии готового микропрепарата на предметном стекле и образца ткани в парафиновом блоке.
ИГХ-исследование (РЭ, РП, Her2/neu, Ki-67), иммуногистохимический анализ рецепторного статуса рака молочной железы.
IHC (ImmunoHistoChemistry) Test for Breast Cancer Receptor Status (ER, PR, HER2, Ki67), HER2 Overexpression by IHC, Estrogen Receptors, Progesterone Receptors, ER and PR Status, Estrogen and Progesterone Receptor Status.
Какой биоматериал можно использовать для исследования?
Парафиновый блок с биоптатом образования молочной железы. Ткань первичной опухоли может быть получена с помощью толстоигольной биопсии, а также инцизионных и эксцизионных хирургических вмешательств. Для выявления метастазов на биопсию могут быть взяты ткани из стенки грудной клетки, регионарных лимфоузлов или отдаленных органов.
Общая информация об исследовании
Современные принципы и стратегии лечения рака молочной железы основываются, в том числе, на результатах оценки рецепторного статуса и пролиферативного потенциала опухолевых клеток. Клетки опухоли обладают способностью вырабатывать и располагать на своей поверхности специальные белки – рецепторы, стимуляция которых приводит к запуску клеточного деления и росту опухоли. Подобные рецепторы способны связываться с веществами, присутствующими в организме в норме и исходно никак не связанными с развитием злокачественного новообразования. Согласно актуальным клиническим рекомендациям, для рака молочной железы имеет значение наличие на опухолевых клетках следующих рецепторов, различные комбинации которых называются рецепторным статусом:
Рецепторы к гормонам – эстрогенам и прогестерону (ER, PR). Значительная часть опухолей молочной железы является гормонально-зависимыми, то есть их рост поддерживается и стимулируется эстрогенами и прогестероном. Опухоли с положительным гормональным рецепторным статусом хорошо отвечают на терапию аналогами гормонов (тамоксифен), которые блокируют соответствующие рецепторы – связываются с ними, но не вызывают активации внутриклеточных процессов и не дают рецептору впоследствии связаться с гормоном. Таким образом, исследование продукции опухолью ER и PR позволяет определить ее чувствительность к этим препаратам.
Рецептор второго типа к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2 – HER2/neu). В клетках некоторых опухолей молочной железы имеет место повышенная выработка данного рецепторного белка, который, соединяясь с естественным фактором роста, запускает в опухолевой клетке процесс деления. Общее число пациенток с HER2-положительным раком молочной железы составляет от 15% до 20%. Определение HER2/neu имеет не только прогностическое значение (такие опухоли обычно прогрессируют быстрее и имеют более агрессивное клиническое развитие), но и позволяет оценить возможность применения таргетных лекарственных препаратов – моноклональных антител к рецептору HER2 – трастузумаб (герцептин), лапатиниб, пертузумаб. Кроме того, HER2-позитивные опухоли резистентны к тамоксифену.
Пролиферативная активность – показатель способности опухолевых клеток к неограниченному делению, которое является основным фактором биологической агрессивности опухоли. Процесс деления сопровождается появлением в клетке определенных белков, один из которых – Ki-67. Он не продуцируется в клетках в состоянии покоя, что позволяет использовать его как маркер пролиферативной активности опухоли. Определение уровня Ki-67 имеет важное прогностическое значение, так как наибольшей пролиферативной активностью обладают опухоли из наименее зрелых и дифференцированных клеток.
Все указанные выше маркеры могут быть выявлены при иммуногистохимическом исследовании биоптата или операционного материала опухоли. Для анализа из готового парафинового блока с помощью специального микроножа нарезают тончайшие срезы, которые затем прикрепляют к предметным стеклам и красят рутинными красителями, чтобы было возможно отличить клетки друг от друга и от межклеточного вещества. Затем срезы на стеклах окрашиваются растворами антител, меченных флюоресцирующими метками, специфичных к одному из исследуемых рецепторов. Если в опухолевой клетке присутствует искомый рецептор, антитела связываются с ним и при просмотре стекла под специальным микроскопом можно увидеть флюоресценцию, что будет свидетельствовать о положительном результате теста. Кроме того, при просмотре среза врач-морфолог сможет увидеть, что окрашенный маркер располагается в ядре, клеточном веществе или на оболочке опухолевых клеток. Количество применяемых растворов с антителами соответствует количеству маркеров, которые исследуются в образце. Степень флюоресценции и процент клеток, в которых она есть, лежат в основе интерпретации результатов иммуногистохимического анализа и подробнее описаны в соответствующем разделе.
Для чего используется исследование?
- Для определения гормонорецепторного статуса и степени пролиферативной активности рака молочной железы для оценки прогноза и индивидуализации лечения, в том числе определения показаний для назначения таргетной терапии.
- По результатам детекции гормональных рецепторов определяется целесообразность использования антиэстрогенов, а рецептора HER2 – таргетных анти-HER2 препаратов. Выявленное отсутствие этих маркеров позволяет избежать назначения заведомо неэффективной терапии. Высокий индекс пролиферативной активности, а также негативность по рецепторному статусу по большей части являются показанием для добавления к лечению цитостатических препаратов.
Когда назначается исследование?
- При наличии гистологически верифицированного рака молочной железы — впервые выявленные, рецидивирующие и метастатические опухоли.
При интерпретации результатов иммуногистохимического определения рецепторного статуса стероидных гормонов (эстрогенов и прогестерона) в опухолях молочной железы следует оценивать не только процент окрашенных антителами клеток, но и интенсивность окрашивания. Оба эти параметра учитываются в шкале Allred, где процент позитивных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3. Сумма двух показателей является итоговым баллом, по которому определяется позитивность опухоли по рецепторному статусу: 0-2 негативная, 3-8 позитивная. Общий балл 3 по этой шкале соответствует 1-10% окрашенных клеток и является минимальным позитивным результатом, когда назначение гормональной терапии может иметь эффективность.
Иногда рецепторный статус определяется исключительно по проценту клеток с окрашенными ядрами. В таких случаях NCCN рекомендует считать позитивными все опухоли, где есть более 1% позитивных клеток.
При интерпретации окраски на рецептор HER2/neu учитывают только мембранное окрашивание (окрашивание клеточной оболочки), которое оценивают по шкале от 0 до +3:
результат 0 и +1 считается HER2-негативным;
+2 – пограничный результат, при нем по данным иммуногистохимического исследования нельзя судить о наличии на поверхности клеток рецептора HER2-neu, необходимо проведение FISH- или CISH-исследования;
+3 – положительный результат – таргетная терапия анти-HER2 препаратами будет эффективна.
Согласно классификации St. Gallen Consensus (2009), низким индексом пролиферативной активности считается уровень Ki-67 менее 15%, средним – 16-30%, а высоким – более 30%.
Что может влиять на результат?
- Качество предоставленных парафиновых блоков, опыт и квалификация врача-патоморфолога, так как иммуногистохимический метод не в полной мере стандартизирован и оценка его результатов в некоторой степени субъективна.
- Интерпретация результатов исследования должна проводиться исключительно врачом соответствующей специальности, приведенные данные об эффективности и целесообразности назначения определенных лекарственных средств в зависимости от результатов исследования носят исключительно рекомендательный характер и могут быть пересмотрены с учетом индивидуальных особенностей пациентки.
- При неопределенном HER2/neu-рецепторном статусе (результат иммуногистохимического исследования 2+) рекомендуется выполнение FISH- или CISH-исследования, которые позволят выявить гиперактивацию гена, кодирующего этот рецептор. При недоступности этих исследований допускается повторное иммуногистохимическое исследование, но на другом образце опухолевой ткани.
- Существует несколько шкал оценки рецепторного статуса рака молочной железы, в лабораторном отчете должно быть указано, по какой именно проводилась оценка позитивности опухоли в данном исследовании, а также дана описательная характеристика количества позитивных клеток, особенностей окрашивания клеточных структур и морфологических особенностей клеток.
Гистологическое исследование биопсийного материала образования молочной железы
Цитологическое исследование пунктатов молочной железы
Определение HER2 статуса опухоли методом FISH
Определение HER2 статуса опухоли методом CISH
Кто назначает исследование?
Онколог, маммолог, онкогинеколог.
Dana Carmen Zaha. Significance of immunohistochemistry in breast cancer. World Journal of Clinical Oncology, 2014; 5(3): 382-392.
NCCN Clinical Practice Guidelines in Oncology: Breast Cancer. Version 3.2017 – November 10, 2017. Available at www.nccn.org.
Клиническая лабораторная диагностика: национальное руководство: в 2 т. – T. I / Под ред. В. В. Долгова, В. В. Меньшикова. – М.: ГЭОТАР-Медиа, 2012. С. 658-660.
В. Ф. Семиглазов, Р. М. Палтуев, В. В. Семиглазов, Г. А. Дашян, Т. Ю. Семиглазова, П. В. Криворотько, К. С. Николаев. Общие рекомендации по лечению раннего рака молочной железы St. Galle- 2015, адаптированные экспертами Российского общества онкомаммологов. Опухоли женской репродуктивной системы, 2015; 3: 43-60.
источник
Иммуногистохимическое исследование пролиферативной активности по экспрессии Ki-67 (1 антитело) проводится для выявления в организме человека активного опухолевого роста. Если рак уже был выявлен ранее, то методика позволит выяснить, насколько хорошо он будет реагировать на паллиативное лечение. Ki-67 — это белковая структура, которая находится в раковых клетках.
Экспрессия Ki-67 помогает выявить раковые клетки в активной фазе клеточного цикла (G1-, S-, G2- и M-фазы). Только в период G0 отсутствует Кi-67. Активно пролиферирующие раковые клетки представляют «фракцию роста» опухоли. Пролиферативная активность является показателем определения фенотипа новообразования, определяющая скорость роста опухоли, риск метастазирования и ответ на терапию. Изменение пролиферативной активности влияет на течение и исход онкологического заболевания.
| Сроки выполнения | До 7 дней |
| Синонимы (rus) | ИГХ-определение индекса пролиферации при исследовании экспрессии Ki-67. Оценка пролиферативной активности опухолевых клеток. |
| Синонимы (eng) | IHC-determination of the proliferation index in the study of expression of Ki-67. Assessment of the proliferative activity of tumor cells. |
| Методы анализа | Иммуногистохимическое исследование |
| Подготовка к исследованию | Подготовку к анализу определяет лечащий врач. |
| Вид биоматериала и способы его забора | Биоптат любого ракового образования, взятый при биопсии. |
Индекс пролиферации при исследовании экспрессии Ki-67— это цифровое значение степени активности опухолевой прогрессии. Выражается в процентном соотношении. Суть определения этого значения основана на том, что все онкологические структуры в организме имеют интенсивный рост и деление. Этот показатель намного выше, чем процессы пролиферации в других органах, причем не только в физиологическом состоянии, но и при воспалениях. Получается, что при значительном увеличении индекса пролиферации, в организме имеется активный злокачественный рост.
В то же время, при наличии опухоли, существуют референсные показатели для каждого онкологического заболевания. При превышении этого порога, рак будет плохо отвечать на консервативное лечение. Наоборот, если показатель низкий, то можно рассчитывать, что стабилизация болезни произойдет на фоне специфической неоперативной терапии.
Показаниями к проведению иммуногистохимического исследования пролиферативной активности по экспрессии Ki-67 являются:
- рак любой локализации;
- подозрение на наличие опухолевого роста в организме;
- множественные доброкачественные образования с целью исключения озлокачествления;
- опухоль молочной железы для оценки возможности лечения гормонами.
Материалом для иммуногистохимического исследования пролиферативной активности служит биоптат любого ракового образования. Если опухоль только предполагается, то берется один кусочек с каждого подозрительного участка. Необходима прямая биопсия. Проводится либо щипцами, либо секторальной резекцией части органа. Пункционный биоптат не пригоден.
Материал заливают формалином, отправляют в гистологическую лабораторию. Готовится стандартный препарат с помощью микротомирования после парафинизации. Он фиксируется на предметном стекле и окрашивается маркером для определения белка Ki-67. В результате окрашивания белок становится отличим от других тканей. Врачу-гистологу под микроскопом предстоит подсчитать количество окрашенных фрагментов.
Заключение врача является важной информацией для лечащего специалиста. Первый вопрос, на который даст ответ гистолог — есть или нет экспрессия Ki-67.
Если окрашивание не произошло, то ответ отрицательный. Опухоли в организме нет.
При положительном варианте проводится подсчет окрасившихся клеток по сравнению с неокрашенными. Результат умножается на 100 и выражается в процентах. Этот показатель врач также включает в ответ. Показатели процентной активности для каждой опухоли индивидуальные, но чем выше процентное соотношение, тем агрессивнее новообразование.
Анализы Вопрос: Здравствуйте у мужа нашли половую инфекцию Enterococcus faecalis, какие анализы мне нужно сдать ?
уточнить цену Вопрос: Добрый день. Подскажите пожалуйста, мне нужно сдать комплекс анализов, однако в прейскуранте не все нашла. Рассчитайте мне какова сумма на сдачу данных анализов: Комплекс «Безопасный секс» +кровь на ВПГ1.2.6 ТИПЫ И цмви (Lg M и G). спасибо.
источник
Существуют различные методы измерения скорости пролиферации в опухолях, включая митотические подсчеты, оценка доли клеток в S-фазе клеточного цикла и иммуногистохимия ассоциированных с пролиферацией антигенов. Факты, преимущества и недостатки для каждого из этих методов наряду с другими новыми подходами рассматриваются в отношении рака молочной железы. Обсуждаются потенциальные клинические применения пролиферативных показателей, в том числе их использование в качестве прогностических показателей и предикторов реакции на системную терапию.
Развитие и дальнейшее развитие рака связано с изменением скорости пролиферации клеток. При раннем раке молочной железы измерение пролиферации может быть использовано в сочетании с размером опухоли, уровнем, узловым статусом и статусом стероидных рецепторов в качестве прогностического показателя [1,2]. Показатели распространения могут предоставить полезную информацию о прогнозе и агрессивности отдельных видов рака и могут использоваться для направления протоколов лечения в клинической практике. Показано, что адъювантная химиотерапия улучшает выживаемость у пациентов с раком молочной железы, но имеет потенциально серьезные побочные эффекты. Потенциал прогностических факторов заключается в том, чтобы определить, какие пациенты подвергаются более высокому риску рецидива, так что пациенты, которые могут больше выиграть от лечения адъювантом, могут быть идентифицированы. В будущем изменения скорости пролиферации во время или после системной терапии могут быть использованы в качестве предикторов ответа и позволяют дополнительно адаптировать терапию. Информация о скорости пролиферации также необходима для развития терапевтических агентов, некоторые из которых могут быть нацелены непосредственно на конкретные точки в пути деления клеток.
Разработаны различные методы оценки и количественной оценки показателей пролиферации в лаборатории. Оценки митотического счета широко используются как простая мера клеточной пролиферации и часто включаются в системы классификации опухолей [3]. Были разработаны другие методы, такие как обнаружение клеток, подвергающихся синтезу ДНК, с использованием анализов поглощения тимидина [4], проточной цитометрии для оценки процента клеток в S-фазе клеточного цикла или обнаружения антигенов, связанных с пролиферацией. В этом обзоре будут рассмотрены современные методы и методы развития для оценки распространения и потенциальных применений таких знаний в лечении рака молочной железы. В таблице 1 приведены эти методы и указаны их индивидуальные преимущества и ограничения.
Клеточная пролиферация включает несколько определенных фаз. Клетки в фазе покоя (G0) стимулируются для входа в активный цикл на первой стадии (G1). В течение этого периода времени клетка готовится к синтезу ДНК (S-фаза), за которой следует вторая фаза относительной бездеятельности (G2) и препарат для разделения хроматид в митотической (М) фазе. Затем ячейки могут перерабатываться, введя фазу G1 или вернуться к фазе покоя G0. Пролиферацию сначала измеряли путем подсчета митотических тел на вложенных парафином образцах опухолей, окрашенных с использованием гематоксилин-эозина и рассматриваемых с помощью микроскопии. Характерный внешний вид хромосомы в М-фазе позволяет выделить митотические фигуры. Стандартным способом выражения митотической активности было количество митотических тел в поле зрения высокой мощности (HPF). Было показано, что высокий митотический подсчет является прогнозом риска смерти от рака молочной железы. Клейтон [1] сообщил об исследовании 378 отрицательных опухолей молочной железы и обнаружил, что при многофакторном анализе митотический счет был более сильным предиктором выживания, чем размер опухоли, лимфатическая инвазия или инвазия кожи. Пациенты с более чем 4,5 митотическими показателями на 10 HPFs в 2,8 раза увеличивали риск смерти. Различные измерения уровня опухоли (ядерный сорт, сорт Блум-Ричардсон, модифицированный класс Scarff-Bloom-Richardson и класс Фишера) были индивидуально прогностическими, но при этом не учитывались дополнительные предсказательные значения при корректировке на митотический счет.
Вариации зарегистрированных значений митотических показателей обусловлены гетерогенностью опухолевой клеточности и изменениями размеров микроскопов HPF. Это можно в некоторой степени обойти, разделив количество митозов на количество раковых клеток в поле зрения, хотя это делает процесс оценки намного более трудоемким. Скоринг митотического индекса, по-видимому, относительно последователен в обычной практике, как показано в исследовании ван Диэста и его коллег [5]; В 14 лабораториях патологии было зарегистрировано 2469 образцов рака молочной железы, и результаты сравнивались с результатами в центральной лаборатории. Получен средний коэффициент корреляции 0,91 (от 0,81 до 0,96). Прогностически значимое несоответствие наблюдалось в 7,2% случаев (когда показатели митотического индекса привели к различным многовариантным оценкам прогностического индекса, основанным на митотическом индексе, размере опухоли и статусе лимфатических узлов). Причины расхождений в основном были связаны с плохой обработкой тканей, неточным подсчетом или несоблюдением указаний по выбору области подсчета [5].
Одна из проблем этого метода заключается в том, что трудно идентифицировать митотические клетки из-за путаницы с апоптозом или ядерным пикнозом. Еще одна критика митотического индекса как меры пролиферации заключается в том, что продолжительность митотической фазы клеточного цикла является переменной, и, следовательно, корреляция числа митозов и скорости пролиферации не обязательно линейна [6].
Измерение доли клеток, участвующих в синтезе хромосомной ДНК (S-фазная фракция (SPF)), стало одним из стандартных методов оценки пролиферации. Первоначальным методом измерения SPF было измерение индекса меченых тимидинов (3HTdR) (LI) [7]. Этот метод требовал использования свежего материала, который был инкубирован с предшественником ДНК, обычно в условиях высокого давления кислорода (для улучшения проникновения в фрагменты ткани) в культуральную систему in vitro. Затем на слайдах проводили авторадиографию, как правило, через несколько недель после включения, и клетки с вышележащими зернами, вызванные изотопической эмиссией 3H, были оценены. 3HTdR LI имеет тенденцию быть намного выше, чем митотический счет, потому что клетки тратят больше времени на S-фазу, чем на M-фазу (приблизительно от 7 до 24 часов, в отличие от менее чем за полчаса) [8]. Этот метод позволяет точно определять скорость пролиферации, даже если пролиферация происходит очень медленно и не имеет проблемы с трудностью идентификации митотических клеток, которые часто встречаются при измерениях митотического индекса. Мейер и его коллеги [9] обнаружили, что способ воспроизводиться с различными наблюдателями, забирая рентгенограммы, а также обнаружил хорошую корреляцию между первичными опухолями и их подмышечными метастазами или рецидивами. Корреляция внутри и между лабораториями хороша, с коэффициентами 0,96 и 0,93 соответственно [10].
Тубиана и его коллеги [2] измерили 3HTdR LI у 128 пациентов с раком молочной железы и сравнили это с выживаемостью через 10 лет. Как рецидив, так и общая выживаемость были значительно выше у пациентов, у которых опухоли имели низкий уровень LI. Как и в вышеупомянутой работе Клейтона, использующей митотические подсчеты, мера распространения была более прогнозируемой из-за выживания, чем другие установленные прогностические факторы, такие как размер опухоли, гистологический ранг и количество вовлеченных лимфатических узлов. Аналогичные результаты были подтверждены Мейером и его коллегами, при этом 3HTdR LI является прогнозом общей выживаемости при многофакторном анализе наряду с узловым статусом, статусом рецептора эстрогена (ER) и размером опухоли [11]. Однако измерение 3HTdR LI имеет ограничения; он требует свежих тканей, ему нужна авторадиография, которая требует много времени и требует обработки радиоизотопа.
Измерение проточной цитометрии SPF является, пожалуй, самым клинически подтвержденным методом измерения пролиферации. Его преимущество заключается в том, что его можно использовать на самых разных тканевых препаратах, включая свежие хирургические образцы, образцы замороженной биопсии и архивные блоки из парафина [12]. Однако были высказаны опасения по поводу стандартизации как тканевой подготовки, так и аналитической изменчивости между лабораториями. Клетки механически диспергируются, окрашиваются иодидом пропидия и проходят через проточный цитометр, который продуцирует гистограмму ДНК с распределениями, соответствующими фазам в клеточном цикле. Основной пик соответствует фазе G1 / G0. Содержание ДНК (ploidy) и пролиферацию можно оценить. Если есть второй главный пик, опухоль считается анеуплоидом, в противном случае она считается диплоидной. SPF может быть рассчитан с использованием простого алгоритма. Показано, что измерения проточной цитометрии SPF коррелируют с митотическим числом, гистологическими классами и 3HTdR LIs [13,14]. Кларк и его коллеги [15] продемонстрировали, что измерения плоидности и SPF с использованием проточной цитометрии могут прогнозировать отсутствие болезней и общую выживаемость. Ограничение этой методики состоит в том, что образцы содержат различные вклады от нормальной стромальной ткани, и поэтому гистограммы ДНК не только отражают злокачественный компонент.
В 1982 году Грацнер [16] описал использование моноклональных антител, специфичных для 5-бромдезоксиуридина (BrdU), для обнаружения репликации ДНК. Этот иммуногистохимический метод позволяет измерять SPF без использования авторадиографии или радиоизотопов и, как было показано, дает аналогичные результаты для маркировки 3HTdR [17]. Дальнейшая работа Мейера и его коллег показала, что маркировка образцов BrdU образцов рака молочной железы коррелирует с S-фазой, измеренной 3HTdR [18] и проточной цитометрией [14]. Маркировка BrdU имеет лучшее разрешение, чем маркировка 3HTdR, с меньшим искажением ядра или разливом в цитоплазму. Вальдман и его коллеги [19] обнаружили, что надежность между наблюдателями лучше для BrdU (r = 0,94), чем 3HTdR (r = 0,87). Сравнение подсчета BrdU и митотического индекса показало хорошие корреляции при условии, что митотические цифры очень тщательно подсчитаны [20]. Для успешной маркировки клеток S-фазы in vitro ткань должна быть метаболически жизнеспособной (то есть свежей) и адекватно подготовленной (нарезано толщиной менее 1 мм, чтобы позволить меченый агент проникать достаточно). Кроме того, тимидилатсинтазу следует блокировать для усиления включения метки, а не эндогенного тимидилата.
Вместо идентификации клеток, участвующих в определенных фазах цикла роста, альтернативным методом оценки пролиферации является обнаружение антигенов, которые тесно связаны с пролиферацией с использованием иммуногистохимии. Теоретически эти методы быстрее, дешевле и проще в использовании, чем проточная цитометрия и авторадиография, а также более надежный и воспроизводимый, чем митотический подсчет фигур. Они также имеют то преимущество, что они применимы к цитологическому материалу из аспирации молочных желез и нуждаются в меньшем количестве ткани, чем некоторые другие методы [21].
Индекс маркировки Ki67 в настоящее время широко используется в качестве меры распространения. Ki67 — это белок, выраженный в ядре во время клеточного цикла [22]. Клетки экспрессируют антиген во время фаз G1, S, G2 и M, но не во время G0. Первоначальные антитела, выращенные против Ki67, требовали свежих или замороженных образцов опухоли. Клетки, которые показали специфическое ядерное окрашивание, были оценены как положительные, а индекс маркировки Ki67 был выражен как процент от общего числа опухолевых клеток, которые окрашиваются положительно; это соответствует росту доли опухоли. Более высокий уровень рака имеет более высокие показатели Ki67 — одно исследование показало средние баллы 9% в опухолях I степени, 14% в II классе и 26% в III классе [23]. Индекс Ki67 существенно коррелирует с оценками митотического индекса [24] и SPF по проточной цитометрии [13,25,26], хотя некоторые из опубликованных коэффициентов корреляции являются скромными (r = 0,42 [13], r = 0,22 [26] ). Различные исследования показали корреляцию между Ki67 и безболезненной и общей выживаемостью с повышенным риском рецидива в опухолях с высоким Ki67 [27-33]. Пиерга и его коллеги [34] провели многомерный анализ и показали, что определяемая Ki67 фракция роста является независимым прогностическим фактором (p = 0,03) наряду с узловым статусом, возрастом и адъювантной терапией.
Более новые антитела, такие как MIB-1, идентифицируют пептиды из рекомбинантных фрагментов гена для антигена Ki67 и имеют то преимущество, что они эффективны в фиксированных архивных образцах после микроволнового облучения. Показано, что окрашивание моноклональным антителом MIB-1 хорошо коррелирует с гистологическим признаком, митотическим индексом, интервалом без рецидива и общей выживаемостью [35,36]. Были предприняты попытки определить значения отсечения для классификации опухолей с высокой или низкой пролиферативной активностью. Спиратос и его коллеги [35] провели многовариантный анализ на 185 опухолях молочной железы, используя 5 различных значений отсечения MIB-1. Ограничение MIB-1 на 25% было лучше всего для правильной идентификации высоко пролиферативных опухолей (хотя для уверенной идентификации опухолей с низким пролиферативным потенциалом требовалось срезать менее 10%).
Другие ядерные антигены, такие как ядерный антиген пролиферирующих клеток (PCNA), были исследованы, но, по-видимому, плохо коррелируют с Ki67 и митотическим числом, поэтому они могут быть более ограниченным использованием при оценке пролиферации [23]. В отличие от Ki67, PCNA также участвует в процессах восстановления ДНК, которые могут быть смешающим фактором в раке. Кларк и его коллеги [37] сообщили об экспериментальном исследовании с использованием моноклонального антитела против митозина (недавно описанный 350 кДа ядерный фосфопротеин, который экспрессируется в поздних фазах G1, S, G2 и M клеточного цикла, но не в G0), обнаруживая, что его выражение сильно коррелирует с SPF в серии 386 фиксированных формалином архивных молочных желез. Хотя в этом исследовании не было никакой связи с общей выживаемостью, они наблюдали, что высокий уровень митозина достоверно коррелирует с рецидивом в многофакторном анализе (SPF не коррелирует с рецидивом) [37].
Прогрессия через различные стадии клеточного цикла зависит от наличия комплексов, образованных между цикланами и циклинзависимыми киназами (CDK). Циклины представляют собой белки, которые различаются по экспрессии в течение различных фаз клеточного цикла. Циклин D1 экспрессируется во время фазы G1, cyclin E во время фазы G1 и ранней S, cyclin A во время фазы S и G2 и цикла B во время поздней фазы G2 [38-41]. Поэтому они являются полезными маркерами доли клеток в данных фазах клеточного цикла в любой момент времени. Более того, было показано, что различные циклы, такие как циклоны D1 и E, повышаются при злокачественности [42-44]. Высокая экспрессия циклин A [45,46] и E [47-50] связана с плохим прогнозом рака молочной железы. Свидетельства прогностической роли cyclin D1 менее убедительны, но избыточная экспрессия, по-видимому, связана с позитивностью рецепторов гормонов, и есть некоторые свидетельства взаимосвязи между высокими уровнями экспрессии и хорошим прогнозом [51-53].
Как и в случае Ki67, окрашивание для циклинов осуществляется с использованием иммуногистохимии с помощью специфических моноклональных антител. Таким образом, он может быть осуществлен на вложенном парафине материале, а опухолеспецифическая экспрессия различается от стромального окрашивания морфологией. Были продемонстрированы корреляции между экспрессией различных циклин и измерениями пролиферации Ki67 [43,45-47]. Однако циклины имеют преимущество в том, что они могут выборочно обнаруживать клетки, которые находятся в поздней фазе G1 и за ее пределами, и, таким образом, совершают деление клеток. Это свойство может иметь клиническую пользу при рассмотрении использования цитотоксических агентов, которые нацелены на конкретные точки в клеточном цикле [54].
Ингибиторы CDK также могут быть изучены с использованием иммуногистохимических методов. p27 является одним из таких ингибирующих белков; он связывает и предотвращает активацию комплексов циклина E-CDK2 или циклина D-CDK4 и, таким образом, контролирует прогрессирование клеточного цикла в G1. Низкие уровни ядерного p27 (и секвестрация p27 в цитоплазме) связаны с высокой пролиферативной активностью и, как было показано, связаны с высоким уровнем опухоли и плохим прогнозом [55-59]. Интересно, что существует значительная корреляция между низкой экспрессией p27 и сверхэкспрессией HER2 / neu в опухолях молочной железы, и было высказано предположение, что продукт HER2 / neu может играть роль в понижающей регуляции экспрессии p27 [60,61].
Другим белком для взаимодействия с комплексами CDK является p21 (WAF1 / CIP1). p21 связывает и ингибирует активность комплексов cyclin-CDK2 или -CDK4 и, следовательно, также функционирует как регулятор прогрессирования клеточного цикла в G1. Экспрессия p21 жестко контролируется белком-супрессором опухолей p53, через который он опосредует остановку фаз G1-зависимого клеточного цикла G1 в ответ на различные стрессовые стимулы. p21 также взаимодействует с PCNA и участвует в регуляции репликации ДНК S -фазы и восстановления повреждений ДНК. Прогностическая ценность p21 находится в стадии обсуждения, при этом некоторые исследования показывают, что низкая экспрессия является благоприятным маркером в отрицательных пациентах узла, а другие не показывают прогностической ценности [62-65].
Области органофильных ядрышковых организаторов (AgNOR) представляют собой негистонные белки, связанные с циклами ДНК, активно транскрибируемыми рибосомальной РНК. Количество и размер AgNOR можно оценить после окрашивания опухолевой ткани серебряными пятнами. Во время митотического цикла происходит агрегация и сегрегация НОР. Сразу после митоза НОР рассеиваются через ядро, и ядрышко не является очевидным. Окраска AgNOR выявила бы большое количество точек. Затем NOR группируются для образования одного или нескольких ядрышек и окрашивания AgNOR, а затем обнаруживают меньше точек, потому что NORs сливаются. В позднем G2 НОР склонны рассеиваться с растворением ядрышка. Наиболее экстремальная сегрегация NORs наблюдается во время митоза, когда хромосомы разделяются. Таким образом, подсчет AgNOR может быть выше в клетках в конце G2 или в начале G1, когда NORs сегрегированы, и они более легко различимы.
Количество AgNOR увеличивается при злокачественных новообразованиях, но не является диагностическим из-за совпадения с доброкачественной пролиферацией [66]. Похоже, что хотя число AgNOR на клетку не является достаточно дискриминационным для определения злокачественности, добавление измерений размера или площади с использованием анализа изображений дает улучшенную диагностическую и прогностическую специфичность [67,68]. Количество AgNOR может быть успешно получено из тонкоигольных аспирационных мазков [69]. Оценка AgNOR показала положительную корреляцию с ДНК-плоидностью, уровнем опухоли и SPF по проточной цитометрии [70-72], с окрашиванием Ki67 [73-76] и с PCNA [77] и поэтому была предложена в качестве альтернативы мера распространения опухоли. Как и в случае вышеупомянутых иммуногистохимических методов, оценка может занять много времени, и могут быть проблемы с воспроизводимостью [74].
Фермента тимидинкиназа (ТК) 1 участвует в фосфорилировании дезокситимидина во время синтеза ДНК. Он присутствует в цитоплазме и активируется на поздней фазе G1 клеточного цикла. Активность TK1 является высокой в пролиферирующих и злокачественных клетках, но является низкой или отсутствует в покоящихся клетках. Ван и его коллеги [78] разработали поликлональное антитело против TK1 и продемонстрировали зависимую от цикла клеточную экспрессию фермента. Существует хорошая корреляция с окрашиванием антител MIB-1 [35], и антитело можно использовать в архивной ткани. Ромен и его коллеги [79] изучили 154 узкоположительных рака молочной железы, получавших химиотерапию, и обнаружили, что у пациентов, у которых опухоли имели более высокий уровень активности TK1, повышенный риск рецидива или смерти.
источник