Исследование груди при помощи МРТ чаще проводится с целью выявления всевозможных новообразований в молочных железах.
В сравнении с другими диагностическими методами МР-томография в этой области в 2 раза эффективнее: доля обнаружения патологических очагов в тканях груди при МРТ составляет 90%, при маммографии в комбинации с ультразвуковым исследованием (УЗИ) – до 45%.
Врачи рекомендуют проходить ежегодно МР-обследование молочных желез женщинам с высоким риском развития онкологической патологии:
- При обнаружении у самой женщины или ее ближайших родственниц (матери, дочери, сестры) генов, отвечающих за рост раковых клеток (BRCA 1 или BRCA 2);
- Если женщине проводилась радиотерапия (облучение) по поводу злокачественных заболеваний в раннем возрасте;
- При наличии других факторов риска развития рака молочных желез (наследственные синдромы Кауден или Ли-Фраумени).
Онкологи в обязательном порядке назначают МРТ молочных желез пациенткам с опухолью в одной груди для того, чтобы выяснить, не поражена ли раком вторая железа. Магнитно-резонансная томография без хирургического вмешательства и просвечивания рентгеном дает детальное изображение внутренних структур молочных желез и кровеносных сосудов, позволяет обнаружить даже маленькие (до 3-5 мм) очаги патологической ткани на самых ранних этапах развития.
МРТ с контрастом
МРТ молочных желез может проводиться с контрастированием и без. Контраст (гадолиний – гипоаллергенное окрашивающее вещество) применяется для визуализации сосудистой сети железы. Раковые очаги усиленно кровоснабжаются, что хорошо видно на снимках МРТ.
Обследование без контраста проводится для определения плотности ткани и изучения структуры молочных желез.
МРТ груди назначается не только при подозрении на онкологию. Маммолог может направить женщину на это обследование для:
- определения состояния молочных желез и целостности силиконовых имплантатов;
- дифференциальной (сравнительной) диагностики доброкачественных образований при неэффективности других исследований;
- наблюдения за динамикой после проведенного противоракового лечения;
- диагностики любых других заболеваний молочной железы у беременных и при наличии противопоказаний к рентгенографии;
- выявления различных патологий при плохой визуализации другими методами (разрастание рубцовой ткани после операции или травмы).
Нередко результаты УЗИ или маммографии не дают настолько полной информации, чтобы удовлетворить женщину – успокоить или сподвигнуть к определенным действиям. Поэтому многие пациентки приходят на обследование без направления врача, по собственной инициативе.
Важно! У женщин, проходящих МРТ груди раз в год, возможность летального исхода от онкологии сводится к минимуму.
Несмотря на то, что МРТ является безопасным методом, у этой процедуры имеются противопоказания. Абсолютные и относительные – состояния, при которых МРТ категорически запрещается, и состояния преодолимые, т. е. при грамотно проведенной подготовке обследование становится возможным.
- Наличие металлических предметов в организме пациентки (имплантаты, клипсы, брекеты и др.): воздействие магнитного поля может спровоцировать их движение и вызвать внутреннее кровотечение или другие негативные последствия.
- Гиперкинез (непроизвольные движения), судороги, мышечные спазмы: больная должна соблюдать в течение всей процедуры полную неподвижность, иначе результат обследования может быть неточным (снимки получатся размытые, смазанные).
- Аллергия на контрастное вещество: гадолиний (внутривенный контраст) редко вызывает аллергические реакции, но при индивидуальной непереносимости его введение строго запрещено – вещество может вызвать развитие аллергии различной степени тяжести, вплоть до анафилактического шока.
- Хроническая почечная недостаточность или другие заболевания мочеполовой системы: контрастное вещество может спровоцировать обострение болезни, так как его вывод из организма осуществляется через почки.
- Наличие кардиостимулятора или инсулиновой помпы: воздействие магнитных волн способно повлиять на стабильную работу аппарата.
- Тучность пациентки: вес более 120-150 кг препятствует проведению процедуры, так как диаметр МРТ-капсулы не соответствует объему талии женщины.
- Период беременности и лактации: магнитное поле может оказать негативное влияние на внутриутробное развитие плода, а контрастное вещество, при попадании в грудное молоко, способно вызвать у ребенка аллергию и другие реакции.
- Клаустрофобия: боязнь замкнутого пространства может вызвать у пациента панику и спровоцировать хаотичную двигательную активность.
- Психические расстройства пациентки: возможны различные непредсказуемые реакции на нахождение в МРТ-сканере и проведение медицинских манипуляций.
- Татуировки, нанесенные с использованием красок с примесью металла: в области накожного рисунка возникает чувство жжения. Также может образоваться незначительные повреждения кожного покрова в виде ожога.
Специалисты рекомендуют проводить МРТ молочных желез на 8-12 день (в первую фазу) менструального цикла.
В это время у женщины в молочных железах отечность и инфильтрация вокруг крупных протоков отсутствуют (в отличие от предменструального периода), поэтому результат обследования будет более информативный. Если наступила менопауза, то подойдет любое другое время.
При необходимости врач назначит соблюдение особого пищевого режима или ограничит прием некоторых лекарственных средств.
Перед началом проведения диагностики пациентка снимает с себя все предметы, которые изготовлены из металла (украшения, пирсинги, заколки, часы и т. д.).
Во время процедуры больная лежит на животе на подвижной кушетке томографа (для молочных желез в ней предусмотрены специальные отверстия). Длительность процедуры составляет от 30 минут до 1 часа, поэтому женщине необходимо удостовериться, что поза выбрана удобная, и что во время сканирования у нее не возникнет желания пошевелиться.
При проведении МРТ молочной железы с контрастированием через внутривенный катетер медсестра вводит контрастное вещество. Для диагностики рака это обязательная манипуляция. При поступлении контраста в кровь пациентка может испытать холод или небольшой жар, разливающийся по ходу вены.
Для обеспечения наибольшего комфорта и защиты слуха от шумовых эффектов работающего аппарата (гул, щелчки, потрескивания) предусмотрено использование наушников.
Стол перемещается непосредственно в кольцо МР-томографа, где и происходит сканирование. В обследуемой области женщина может ощущать жжение или покалывание. Эти признаки считаются нормой. При возникновении непредвиденных ситуаций, сильных болевых ощущений или резкого ухудшения состояния пациентка может сообщить об этом врачу через встроенную систему обратной связи.
Явных побочных эффектов после МРТ молочных желез не наблюдается. Очень редко (в 1% случаев) некоторые пациенты после процедуры с контрастированием испытывают слабость, тошноту, головокружение, зуд в месте установки катетера.
Важно помнить, что если пациентка — кормящая мать, и ей вводят контрастное вещество, то от грудного вскармливания ребенка стоит воздержаться на 48 часов.
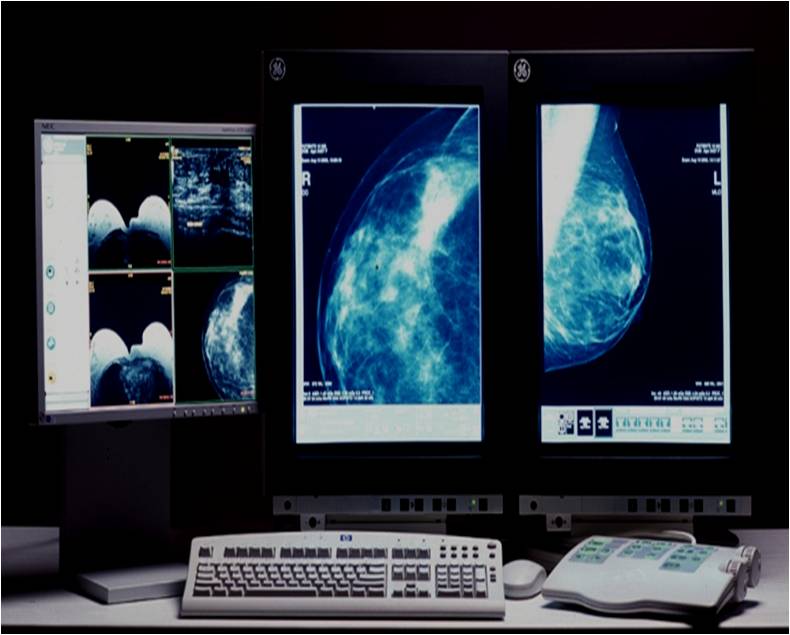
Заключение с результатом МРТ молочных желез пациентке выдается на руки в течение получаса после процедуры. В описании врач указывает выявленные изменения в груди больной, характер и степень их распространения, локализацию (месторасположение), точные размеры очага, другие параметры и сведения, заключительный диагноз. По данным обследования лечащий врач прогнозирует дальнейшее развитие заболевания и планирует наиболее эффективную схему лечения.
Диагностика с контрастным веществом:
- выявляет наличие патологических процессов в груди;
- устанавливает размер и точное месторасположение новообразования;
- определяет размеры лимфатических узлов;
- определяет степень злокачественности опухоли.
Диагностика без контрастного вещества:
- определяет плотность молочных желез;
- изучает состояние млечных протоков;
- выявляет образования в виде кист;
- обнаруживает гематомы;
- определяет разрывы имплантатов и степень повреждения окружающих тканей.
Проведение МРТ молочных желез в комплексной диагностике различных заболеваний целесообразно и желательно, так как:
- МРТ отлично визуализирует мягкие ткани органа, намного лучше, чем КТ, рентгенография и УЗИ;
- в МРТ отсутствует ионизирующее облучение, которое применяется в рентгенографии и компьютерной томографии;
- МР-сканирование позволяет получить наиболее полную и четкую картину, в отличие от маммографии, которая менее информативна;
- МРТ дает возможность изучить орган как снаружи, так и изнутри (в ультразвуковой диагностике возможно только оценка состояния внешней оболочки);
- МРТ позволяет определить наличие даже небольших образований (в отличие от маммографии).
Возможность же многократного повторения и отсутствие негативного воздействия на организм женщины делает этот вид исследования наиболее востребованным в современной диагностике.
источник
Позитронно-эмиссионная томография (ПЭТ) в последнее время становится все более популярным методом исследования, используемым для обнаружения, стадирования и контроля различных злокачественных опухолей. Метод основан на регистрации гамма-излучения, испускаемого радиоактивными элементами (радионуклидами), которые вводятся в организм человека в составе специальных меченых веществ — радиофармпрепаратов (РФП). При совмещении ПЭТ-сканера с компьютерным томографом (КТ) говорят о комбинированной позитронно-эмиссионной и компьютерной томографии (ПЭТ-КТ).
Комбинация ПЭТ и КТ позволяет совместить «функциональные» (ПЭТ) и «анатомические» (КТ) томограммы, что дает преимущества перед использованием только КТ, ведь анатомические срезы дополняются информацией, отражающей функциональные изменения. Так, при сравнении изменений, обнаруженных при ПЭТ-КТ (в исследовании приняло участие 58 пациенток) с данными, полученными только на основании КТ, комбинированная ПЭТ-КТ показала лучшие результаты в выявлении маленьких опухолей и множественных метастазов; а также в обнаружении лимфоузлов, пораженных опухолью, и в оценке ответа на химиотерапию по поводу рака молочной железы.
В основе таких методов, как КТ и МРТ, лежит визуализация анатомических структур с целью выявления патологических изменений у пациенток с раком молочной железы, стадирования и контроля. В то же время, позитронно-эмиссионная томография (ПЭТ) позволяет обнаружить патологические измененения метаболизма 18-фтор-2-дезокси-D-глюкозы (ФДГ), что делает возможным получение качественной информации о ее накоплении в опухоли, и является критичным моментом при постановке диагноза и при контрольных исследованиях. Комбинация ПЭТ-КТ имеет преимущества перед изолированным использованием ПЭТ, поскольку появляется возможность более точной привязки очагов повышенного захвата ФДГ к определенным анатомическим областям. Кроме того, при этом методе уменьшается время исследования. Также ПЭТ-КТ позволяет частично преодолеть ограниченную специфичность ПЭТ, при которой могут обнаруживаться очаги гиперметаболизма глюкозы в доброкачественных опухолях и воспалительно измененных тканях (например, при туберкулезе). Необходимым условием информативности метода является достоверная оценка изображений опытным радиологом, иногда с применением Второго мнения.
Рак молочной железы является самой распространенным новообразованием у женщин во всем мире и ведущей причиной женской смертности в результате рака. Во всем мире каждый год насчитывается примерно 1,38 миллионов вновь возникших случаев заболевания, а также 458 тысяч летальных исходов в течение года, обусловленных этой болезнью. Многие факторы риска хорошо известны. Тем не менее, точные причины возникновения рака молочной железы не определены. Например, наличие заболевания у родственников и предков является хорошо известным фактором риска: при нем вероятность развития рака возрастает в два или три раза. Также предполагается, что мутации в гене BRCA (1 и 2) и мутации белка p53 в значительной степени повышают риск развития опухоли. Ранняя диагностика является основополагающим способом контроля, так как определяет способ лечения, а также прогноз и шансы пациентки на выживание.
К методам диагностики, основанным на обнаружении анатомических изменений, относятся маммография, ультразвуковое исследование (УЗИ), компьютерная (КТ) и магнитно-резонансная томография (МРТ). Они широко используются в клинической практике для выявления первичной опухоли и определения стадии рака молочной железы. Эти методы диагностики постоянно улучшаются, кроме того, в практику также внедряются новые способы исследования молочных желез: оптическая маммография, однофотонная эмиссионная томография (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ), которые позволяют перенести информацию относительно анатомических изменений, функции, метаболизма с макроскопического на молекулярный уровень.
Радионуклидные методы исследования, включающие в себя ОФЭКТ и ПЭТ, позволяют оценить in vivo клеточные, молекулярные и биохимические особенности новообразований и нормальных тканей. В то время как в «анатомических» методах диагностики происходит упор на повышение пространственного разрешения и качества изображения, цель использования радионуклидных методов является более специфической – увеличение контраста между опухолью и нормальными тканями.
В сочетании с традиционными методами лучевой диагностики, радионуклидные методы исследования, позволяющие визуализировать биологические процессы, позволили сделать шаг вперед в обнаружении рака. И теперь новыми целями использования радионуклидных методов является разделение различных биохимических изменений в тканях.
Возможность обнаружения рака молочной железы посредством ПЭТ зависит от размера и тканевого строения опухоли. Сообщается, что чувствительность ПЭТ составляет 68% для малых опухолей (меньше 2 см), и 92% для опухолей большего размера (2-5 см), однако, общая точность при выявлении рака in situ является низкой (чувствительность составляет 2-25%). Таким образом, главным фактором, ограничивающим использование ПЭТ при визуализации молочной железы, является низкий уровень обнаружения маленьких опухолей и неинвазивного рака.
Протоковый рак in situ у 49-летней женщины. А: на УЗИ определяется гипоэхогенное объемное образование размером 2,5 см с нечеткими краями, расположенное в верхних отделах левой молочной железы (отмечено стрелками). В: на ПЭТ-КТ скане не выявлено признаков повышенного захвата ФДГ в левой молочной железе. При оперативном вмешательстве подтвердился неинвазивный протоковый рак.
Тем не менее, метод играет важную роль для некоторых групп пациенток, например, с плотными молочными железами либо с наличием имплантов. Позитронно-эмиссионная томография используется для определения множественности опухолевого поражения; для выявления локализации первичной опухоли у пациенток с метастазами, когда маммография неинформативна; а также у тех пациенток, которым противопоказана биопсия. ПЭТ-КТ имеет потенциальные преимущества перед изолированной ПЭТ при оценке поражений малого размера, в которых может быть выявлен пониженный захват ФДГ вследствие эффекта частичного объема при ПЭТ, так как гиперметаболизм глюкозы может быть характерен и для патологических, и для нормальных анатомических структур.
Инвазивный рак молочной железы у 57-летней женщины. А: на скрининговой рентгенограмме левой молочной железы в косой медиолатеральной проекции определяется объемное образование со спикулообразными краями, размером около 1,1 см (отмечено стрелкой). В: при ПЭТ обнаружен очаг слабо выраженного гиперметаболизма ФДГ (стандартизированный уровень накопления = 1,2) в левой молочной железе. Очаг поражения сложно обнаружить в результате эффекта частичного объема. С: на ПЭТ-КТ определяется очаг гиперметаболизма ФДГ на ограниченном участке (отмечен стрелкой) в левой молочной железе.
Вторая задача метода — это обнаружение метастазов рака молочной железы в лимфатических узлах. Метастатическое поражение подмышечных лимфоузлов является важным фактором, определяющим прогноз. У пациенток, страдающих раком молочной железы, при вторичном поражении четырех и большего количества лимфоузлов подмышечной группы, имеется значительно более высокий риск рецидива. Сообщается о чувствительности ПЭТ при визуализации подмышечных лимфоузлов у пациенток с раком молочной железы в пределах 79-94%, и специфичности 86-92%. При ПЭТ-КТ можно точно определить местоположение и отличить друг от друга лимфатические узлы, вторично пораженные опухолью, и реактивно измененные (незлокачественные) лимфоузлы, в то время как на КТ будут обнаруживаться лишь множественные увеличенные лимфоузлы подмышечной группы без четких дифференциальных признаков.
Метастазы в подмышечные лимфатические узлы у 45-летней женщины с инвазивным протоковым раком молочной железы. А: на ПЭТ визуализируется очаг гиперметаболизма ФДГ в правой железе (черная стрелка) и в подмышечной области (белая стрелка). В: на КТ определяются два увеличенных подмышечных лимфоузла справа (отмечены стрелками). С: ПЭТ-КТ позволяет определить точную локализацию лимфоузлов, вторично пораженных опухолью (белая стрелка, стандартизированный уровень накопления РФП = 9,9), визуализируется также реактивно измененный лимфоузел (черная стрелка). Среди 21 лимфоуза, удаленного во время операции, метастазы были выявлены только в одном.
Метастазы рака молочной железы во внутригрудные или медиастинальные лимфоузлы часто клинически ничем себя не проявляют. Количество обнаруживаемых патологических изменений со стороны внутригрудных или медиастинальных узлов (у пациенток с метастатическим либо рецидивным раком молочной железы) при ПЭТ почти в два раза больше по сравнению с традиционной КТ. Кроме того, ПЭТ-КТ выглядит более применимой по сравнению с КТ для оценки внутригрудных лимфатических узлов и лимфоузлов средостения, поскольку возможности КТ в обнаружении метастазов в лимфоузлы малого размера довольно ограничены.
Метастазы в лимфоузлы средостения у женщины, 10 месяцев назад перенесшей модифицированную радикальную левостороннюю мастэктомию. А: на ПЭТ определяются множественные участки гиперметаболизма РФП в верхних отделах грудной клетки слева. В: на КТ визуализируется небольшой участок мягкотканной плотности в переднем средостении (отмечен стрелкой). В: на ПЭТ-КТ обнаружено, что мяготканный участок в переднем средостении, выявленный при КТ, соотносится с зоной гиперметаболизма ФДГ, что позволяет предположить метастазы во внутригрудные лимфатические узлы.
Рак молочной железы часто дает отдаленные метастазы в легкие, печень и кости. Преимуществом ПЭТ всего тела перед традиционными методами диагностики, такими как рентгенография органов грудной клетки, сцинтиграфия скелета и УЗИ органов брюшной полости, является возможность обнаружения отдаленных метастазов в различных областях тела и органах во время одного исследования. Было обнаружено (Moon et al.), что ПЭТ всего тела обладает высокой диагностической точностью в отношении пациенток, у которых имеется подозрение на рецидив рака или на метастатическое поражение. На основании количества обнаруженных очагов чувствительность метода в обнаружении отдаленных метастазов составила 85%, а специфичность 79%.
Множественные отдаленные метастазы у 44-летней пациентки, страдающей раком обеих желез. А: на ПЭТ определяются множественные зоны гиперметаболизма ФДГ в грудной клетке и брюшной полости. B, C: на ПЭТ обнаружены также зоны гиперметаболизма ФДГ в обеих молочных железах (отмечены белыми стрелками на томограмме B), в лимфоузлах средостения (отмечены черными стрелками на томограмме B), и во внутренних органах (отмечены стрелками на томограмме C).
В исследовании (Cook et al.) было обнаружено, что ПЭТ превосходит сцинтиграфию скелета при выявлении остеолитических метастазов рака молочной железы. И, наоборот, остеобластические метастазы характеризуются низкой метаболической активностью и часто не обнаруживаются посредством ПЭТ. Однако ПЭТ-КТ позволяет преодолеть это ограничение: остеобластические метастазы, даже если они не видны на ПЭТ, будут визуализироваться на КТ-сканах.
Метастазы в кости у 64-летней женщины, которой была выполнена правосторонняя модифицированная радикальная мастэктомия 36 месяцев назад. A: при сцинтиграфии скелета обнаруживаются очаги гиперфиксации ФДГ в первом ребре справа и седьмом ребре слева (стрелки), которые, скорее всего, связаны с метастатическим поражением ребер. B: на ПЭТ-КТ не определяется гиперметаболизма ФДГ в седьмом ребре слева (стрелка). C: на КТ определяется остеобластическое поражение седьмого ребра слева (стрелка).
Для лечения пациенток, у которых опухоль имеет большой размер, либо наблюдается ее локальное распространение, используется неоадъювантная химиотерапия с целью уменьшения стадии первичной опухоли перед оперативным вмешательством и устранения метастазов. Кроме того, в нескольких исследованиях было продемонстрировано, что выживаемость пациенток с резистентными опухолями может увеличиваться при использовании альтернативной химиотерапии и (или) при удлинении курсов химиотерапии. Так как химиотерапия имеет побочные эффекты, необходимо как можно скорее выделить пациенток, которые не получают эффекта от применяемого лечения.
В настоящее время лучевые методы диагностики часто используются для определения ответа на терапию путем оценки изменений размеров опухоли. Тем не менее, последовательные измерения размера опухоли во многих случаях не позволяют сделать вывод о наличии раннего ответа. Эффективность ПЭТ при оценке ответа на терапию была подтверждена для различных типов новообразований. В исследовании (Smith et al.) было показано, что средняя редукция захвата ФДГ после первого курса химиотерапии была в большей степени выражена в очагах, для которых макроскопически был обнаружен частичный или полный ответ, или полный ответ при микроскопическом исследовании, по сравнению с резистентными поражениями при гистопатологическом исследованиях. По данным (Rose et al.) после единственного курса химиотерапии при помощи позитронно-эмиссионной томографии было возможно спрогнозировать полный ответ на терапию при патогистологическом исследовании, чувствительность при этом составляла 90%, а специфичность 74%. Если принять степень снижения захвата ФДГ меньше 55% от первоначального значения за пороговое значение, свидетельствующее о наличии реакции на лечение, изменения на ПЭТ у всех респондентов в данном исследовании были корректны и подтвердились патогистологически (100% чувствительность и 85% специфичность).
Изображения иллюстрируют контроль химиотерапии у 35-летней пациентки, страдающей раком молочной железы с метастазами в кости. A-C: на ПЭТ, выполненной изначально (A, B) и ПЭТ-КТ (C) определяется в значительной степени выраженный гиперметаболизм ФДГ в обоих молочных железах и во многих позвонках. D-F: на контрольной ПЭТ (D, E) и ПЭТ-КТ (F), выполненных спустя три курса химиотерапии, определяется существенное снижение гиперметаболизма ФДГ в обоих молочных железах и позвонках.
ПЭТ-КТ также играет роль для лучевой терапии, т. к. позволяет точно оценить распространенность опухоли.
Раннее распознавание рецидива опухоли является важным моментом, улучшающим выживаемость, поскольку подталкивает клиницистов к использованию различных способов лечения. Однако отличить истинный рецидив от постоперационных и лучевых изменений сложно при использовании лишь традиционных методов лучевой диагностики. При ограниченном, регионарном рецидиве преимущественно поражается молочная железа, кожа, подмышечные и надключичные лимфоузлы, а также грудная стенка.
Было обнаружено, что чувствительность и специфичность ПЭТ при обнаружении рецидива составляет 84% и 78% соответственно, в то время как чувствительность и специфичность традиционных методов исследования 63% и 61% соответственно. Предполагается, что ПЭТ является более эффективным методом оценки рецидива рака молочной железы по сравнению с традиционными методами визуализации в плане обнаружения изменений всего тела. Данные КТ, полученные при ПЭТ-КТ, позволяют установить соответствие анатомических структур и очагов гиперметаболизма ФДГ.
Локальный рецидив опухоли у 74-летней женщины, которой была выполнена модифицированная правосторонняя радикальная мастэктомия 8 лет назад. А: на УЗИ выявлено объемное образование овоидной формы, 1,4 см, с усиленным кровотоком, расположенный в правой грудной мышце в зоне мастэктомии. B, C: на ПЭТ определяется ограниченный очаг гиперметаболизма ФДГ (стандартизированный уровень накопления = 3,3) (стрелки) в правой половине грудной клетки. D: на ПЭТ-КТ определяется очаг гиперметаболизма ФДГ (стрелка) в правой грудной мышце, в то время как при использовании только ПЭТ определение точной локализации очага является затруднительным.
В ряде случаев для повышения достоверности оценки результатов ПЭТ-КТ рекомендуется получить второе мнение специализированного радиолога. Это бывает необходимо при сомнительных или неоднозначных результатах первичного прочтения снимков. Второе мнение по ПЭТ-КТ помогает решить следующие задачи: снижение риска врачебной ошибки, более достоверная оценка первичной опухоли, уточнение стадии заболевания, достоверное исключение признаков метастатического поражения костей, печени или легких. Кроме того, в результате такой консультации онколог получает более подробное описание исследования, что помогает ему выбрать наиболее подходящий протокол лечения.
ПЭТ/КТ играет важную роль в диагностике рака молочной железы, которая заключается в обнаружении и определении местоположения метастазов, контроле лечения и раннем выявлении рецидивов. Тем не менее, ограничивающим фактором ПЭТ/КТ в выявлении рака молочной железы является недостаточная способность обнаруживать опухоли малого размера.
Василий Вишняков, врач-радиолог
При подготовке текста использованы материалы:
источник
Строение молочной железы МРТ молочных желез
Обследование груди на МРТ выполняется для выявления новообразований (патологических очагов воспаления) и злокачественных опухолей.
На сегодняшний день магнитно-резонансная томография молочных желез является самой безопасной и эффективной диагностикой состояния груди. МРТ позволяет сделать вывод о необходимости операции при выявлении рака груди и разрыве импланта.
- с генетической предрасположенностью к онкологии — при наличии у пациентки или родных (мать, сестры, дочери) генов, ответственных за развитие раковых клеток (BRCA1/BRCA2);
- проходившим ранее курс лечения радиотерапией в связи с злокачественными заболеваниями;
- при наличии дополнительных факторов риска раковых образований;
- при обнаружении опухолевых образований в одной груди — проверка второй.
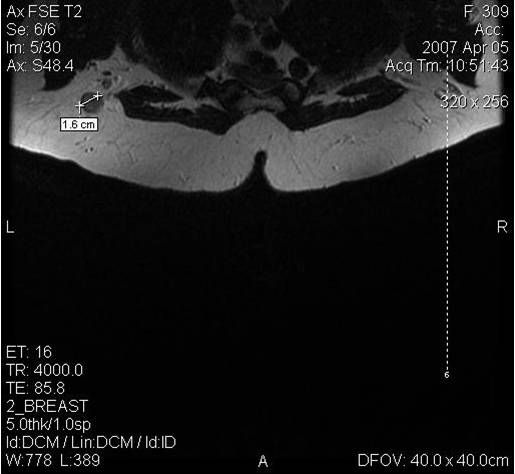
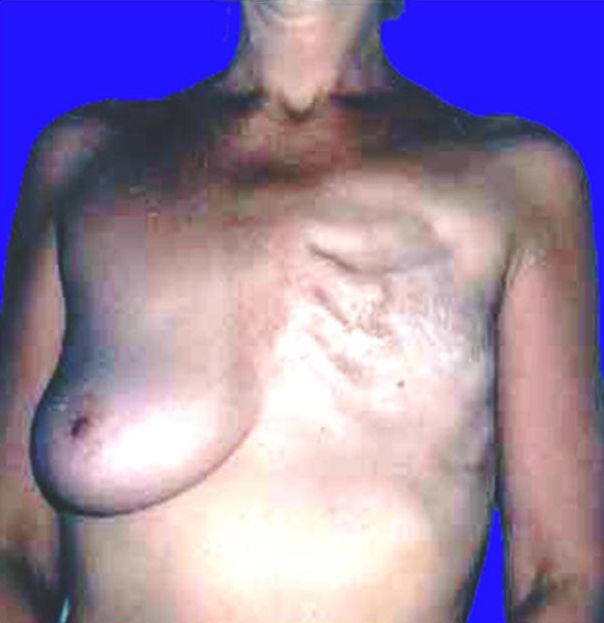
* Рецидив рака левой молочной железы на МРТ груди *
- получить подробную детализацию кровеносных сосудов и внутренних тканей молочных желез;
- увидеть небольшие очаги патологических изменений размером от 3 мм на начальных этапах развития.
- диагностирование на ранних стадиях опухолевых образований, их размеров и характера;
- подозрение на нарушение целостности (разрывы) грудных имплантов;
- наблюдение за динамикой во время лечения химиотерапией;
- для оценки состояния соединительных тканей после операции для исключения рецидива заболеваний;
- жалобы на болезненные ощущения и уплотнения в области груди;
- подтверждение необходимости проведения операции;
- исследование при невозможности проведения других обследований;
- выявления заболеваний у беременных женщин и при противопоказаниях к рентгеновским методам диагностики.
- электронные приборы в теле (кардиостимулятор, слуховой аппарат и проч.), работа которых может быть нарушена магнитным полем, что может угрожать здоровью и жизни;
- вес более 130 кг, что связано с техническими ограничениями томографа;
- металл в теле (импланты, брекет-система, клипсы на сосудах и др.) — является относительным противопоказанием;
- клаустрофобия (панические атаки) — боязнь замкнутого пространства;
- беременность, хотя пока нет доказательств отрицательного воздействия магнитного поля на плод;
- период грудного вскармливания при проведении МРТ груди с контрастом — существует возможность появления аллергической реакции у ребенка про попадании контрастной жидкости в молоко;
- психические заболевания, вызывающие непредсказуемое поведение пациентки во время процедуры;
- острая почечная недостаточность — при введении контраста возможно обострение, так как его вывод происходит через почки.
- для большей информативности рекомендуется проводить на 8-12 день менструального цикла — в период отсутствия отечности вокруг крупных протоков в молочных железах;
- в случае наступления менопаузы — подойдет любое время;
- в редких случаях может потребоваться ограничить прием лекарственных препаратов и соблюдать определенную диету.
- снять все мелкие металлические украшения, часы, заколки и пр.;
- в течение исследования (8-10 мин.) пациентка неподвижно лежит лицом вниз на столе закрытого томографа 1,5 Тл, молочные железы находятся в углублениях специальной катушки;
- при подозрении на онкологию (рак груди) внутривенно вводится контрастное вещество и уже через несколько минут можно начинать исследование;
- чтобы не испытывать дискомфорт от щелчков внутри томографа пациентке могут предложить специальные наушники;
- стол-кушетка перед сканированием сдвигается вглубь тоннеля томографа;
- в случае возникновения проблем пациентка может вызвать врача лучевой диагностики через прибор обратной связи.
катушка для проведения МРТ молочной железы
Заключение выдается в течение 15 минут по окончании исследования.
По данным диагностики лечащий врач назначает необходимое лечение (при необходимости), учитывающее состояние пациентки и динамику развития заболевания.
- диск DVD с файлами в формате DICOM и программой для просмотра МРТ снимков на компьютере;
- текстовое заключение профессора Холина А.В. с параметрами выявленных нарушений, в случае опухолей — это размеры, характер, локализация;
- снимки на пленке (заказываются отдельно).
- плотность внутренних тканей груди;
- есть ли разрывы имплантов и их характер;
- вид млечных протоков;
- гематомы;
- кисты;
- очаги воспаления;
- размеры, характер и локализацию опухолевых новообразований;
- оценить увеличение лимфоузлов;
- сделать вывод о характере опухоли, ее злокачественности.
разрывы имплантов на МРТ груди
- абсолютно безопасна для здоровья — отсутствует лучевая нагрузка и ионизирующее облучение в отличие от рентгенографии (маммографии);
- возможность проводить неоднократные исследования, с необходимой периодичностью безо всякого вреда;
- выявляет образования малого размера в отличие от маммографии;
- позволяет дать однозначную рекомендацию по необходимости проведения операции;
- показывает мягкие ткани молочной железы с лучшим качеством, чем УЗИ и компьютерная томография;
- показывает многие заболевания, особенно рак груди, в случае несостоятельности других методов диагностики.
Если Вас беспокоят неприятные ощущения груди, нащупали уплотнения — сделайте МРТ молочной железы не откладывая! Это безопасно, эффективно и может спасти Ваше здоровье, привлекательность и даже жизнь!
источник
Динамическая контрастно-усиленная грудная магнитно-резонансная томография для прогнозирования ранних и поздних рецидивов при раке молочной железы
Цель исследования состояла в том, чтобы оценить характеристики динамического контрастного увеличения нагрузочного магнитного резонанса (DCE-MRI) для прогнозирования ранних и поздних рецидивов у пациентов с раком молочной железы.
Из 1030 пациентов с раком молочной железы, перенесших операцию в нашей больнице с января 2007 года по июль 2011 года, в этом исследовании было зарегистрировано 83 рецидивирующих больных раком молочной железы. Мы сравнили функции МРТ (усиление паренхимы фона [BPE], внутреннее усиление, знак соседнего сосуда, сосудистую систему цельной грудной клетки, начальную картину усиления, типы кинетических кривых и количественные кинетические параметры) и клинико-патологические переменные (возраст, стадия, гистологический класс, ядерный сорт, наличие лимфо-сосудистой инвазии и обширный компонент интрадуктальной карциномы и иммуногистохимические профили) между пациентами с ранним (≤2,5 года после операции) и поздним рецидивом (через 2,5 года после операции). Был проведен анализ регрессии пропорционального риска Кокса для оценки независимых факторов риска для раннего и позднего повторения.
На МРТ молочной железы значительная ипсилатеральная сосудистая система всего тела независимо ассоциировалась с ранним рецидивом (отношение риска [HR], 2,86, 95% доверительные интервалы [CI], 1,39-5,88) и умеренный или выраженный BPE (HR, 2,08, 95% ДИ , 1,04-4,18) и усиление обода (HR, 2,14, 95% ДИ, 1,00-4,59) были независимо связаны с поздним рецидивом. Клинико-патологические переменные, независимо связанные с ранним рецидивом, включали отрицательный рецептор эстрогена (HR, 0,53, 95% ДИ, 0,29-0,96), тогда как T2-стади (HR, 2.08, 95% ДИ, 1,04-4,16) и ядерный класс III (HR, 2,54, 95% ДИ, 1,29-4,98) были связаны с поздним рецидивом.
В DCE-МРТ значительная ипсилатеральная сосудистая система с полной грудью, умеренная или выраженная BPE и усиление обода могут быть полезны для прогнозирования сроков рецидивов у пациентов с раком молочной железы.
Рак молочной железы является одной из наиболее распространенных причин смерти от рака у женщин во всем мире. [1] Несмотря на достижения в ранней диагностике, лечении и идентификации биомаркеров этого рака, от 20% до 30% пациентов с раком молочной железы испытывают рецидив и существенно ухудшают общую выживаемость [2,3]. Поэтому крайне важно определить факторы риска, которые могут предсказывать рецидив рака молочной железы.
Ангиогенез является требованием неопластического роста, прогрессирования и метастазов. Для рака молочной железы контрастно-усиленная грудная магнитно-резонансная томография (МРТ) является хорошей способностью визуализации, чтобы изобразить ангиогенез опухоли, потому что картина усиления контрастности опухоли коррелирует с плотностью микрососудов, характерной для опухолевого ангиогенеза [4,5]. Кроме того, динамический контраст Усиленные функции МРТ (DCE-MRI), такие как усиление периферических ободов, более быстрое улучшение и тип кривой вымывания, коррелируют с общим рецидивом и общей выживаемостью пациентов с раком молочной железы [6,7].
Определение прогнозирующих факторов для ранних и поздних рецидивов рака молочной железы становится все более важным, учитывая, что
70% раннего рецидива происходит в течение 3 лет после постановки диагноза, а у пациентов с ранним рецидивом наблюдаются более короткие медианные выживаемости и более агрессивный курс, чем у пациентов с поздним рецидивом [ 8] Кроме того, понимание того, что рак молочной железы может повториться, имеет отношение к клиницистам при выборе вариантов лечения адъювантом. [8-10] Например, при применении эстрогеновых рецепторов (ER) -положительных форм рака молочной железы, которые связаны с поздним рецидивом, выбор ингибитора тамоксифен-ароматазы терапия в качестве адъювантной эндокринной терапии может улучшить выживаемость без болезни и общую выживаемость [11]. Пациенты с раком молочной железы, показывающие признаки, связанные с ранним рецидивом, потребуют химиотерапии [12]. Предыдущие исследования показали, что клинико-патологические факторы, такие как N-стадия, гистологический класс, ядерный сорт, p53, Ki-67, рецептор 2 эпидермального фактора роста человека (HER-2) и ER, связаны со временем рецидива [13]. , 14]. Насколько нам известно, функции DCE-MRI, связанные с сроками рецидива рака молочной железы, еще не исследованы.
Целью настоящего исследования было оценить особенности DCE-MRI для прогнозирования ранних и поздних рецидивов у пациентов с раком молочной железы. Мы предположили, что выявление признаков DCE-MRI, прогнозирующих ранний и поздний рецидив, может помочь клиницистам установить протокол для наблюдения и прогнозировать прогноз у пациентов с рецидивирующим раком молочной железы даже до операции.
Это ретроспективное исследование было одобрено административным советом по обзору нашей больницы, и требование об информированном согласии было отменено. С января 2007 года по июль 2011 года 1030 женщин-подрядчиков завершили лечебную операцию по поводу рака молочной железы в нашей больнице. После операции адъювантная терапия, такая как лучевая терапия, химиотерапия или гормональная терапия, вводилась в зависимости от состояния пациента и клинических и молекулярных характеристик опухоли. Среди этого населения в этом исследовании было зарегистрировано 602 женщины (рис.1). Критерии включения были следующими: (а) у пациентов был патологически подтвержденный рак молочной железы; (b) у пациентов не было случаев рака в груди или на любом другом месте; (c) пациенты имели предоперационную МР-визуализацию груди; и (d) у пациентов не было отдаленного метастаза во время диагностики. Оставшиеся 428 женщин, которым проводилась биопсия с предварительной или вакуумной поддержкой до предоперационной МР-визуализации (n = 163), получали неоадъювантную химиотерапию (n = 92), имели клинический или патологический рак T4 (n = 81) или были потеряны -up (n = 92) были исключены из этого исследования.
Блок-схема 1030 пациентов с раком молочной железы. Bx = биопсия, CTx = химиотерапия.
Рецидив рака молочной железы определялся как локо-региональный (ограничивался ипсилатеральной грудью или грудной стенкой и / или подмышечным, интраклавикулярным или надключичным лимфатическими узлами) или отдаленными (метастазами в другие части тела). Последующее наблюдение планировалось каждые 6 месяцев в течение первых 2 лет после операции и ежегодно начиналось третий год в рамках обычного клинического стандарта ухода в нашем учреждении. Все пациенты были обследованы с помощью двусторонней маммографии и двусторонней ультразвуковой ультразвуковой диагностики с использованием ручного ультразвука для наблюдения за локально-региональным рецидивом. Для наблюдения за удаленными метастазами проводили рентгенографию грудной клетки, компьютерную томографию грудной клетки, сканирование костей и / или фтороксиглюкозную фемтосекулярную эмиссионную томографию всего тела. После того, как были обнаружены подозрения на рецидив, обнаруженные на последующей визуализации, для подтверждения повторения проводились тонкоигольная аспирация, биопсия центральной иглы, биопсия с использованием вакуума или эксцизионная биопсия. Если никакого гистопатологического результата не было получено, последующая визуализация была выполнена для оценки роста интервалов или дополнительных повреждений, подозрительных для рецидива.
Все исследования МРТ груди проводились с использованием системы 1,5 ТТ (Symphony, Siemens Healthcare, Эрланген, Германия) с специальной грудной спиралью. Сглаженные Т2-взвешенные сагиттальные изображения спин-эха получены с использованием следующих параметров изображения: время повторения мс / эхо-мс мс, 2900/150; матрица, 320 × 240; поле зрения 200 × 200 мм; толщина сечения 3 мм без зазоров. Впоследствии была получена трехмерная быстрая низкоугловая серия выстрелов (время повторения мс / эхо-мс, 11,0 / 4,5, матрица 320 × 221, угол поворота — 25 °, поле зрения 200 × 200 мм, толщина разреза , 2 мм без зазоров) проводили с 1 доконтрастной и 5 постконтрастных динамических рядов, полученных сразу же после внутривенного введения болюсной инъекции 0,1 ммоль / кг гадобутрола (Gadovist; Schering AG, Берлин, Германия) с последующим 20-мл физиологическим раствором скорость впрыска 3 мл / с с использованием автоматического форсунки. Стандартные изображения вычитания были получены путем вычитания преконтрастных изображений из второго динамического ряда (или раннего пика) постконтрастных изображений по пиксельной основе. Кроме того, к изображениям вычитания были применены реконструкции максимальной интенсивности проекции.
Два рентгенолога с 3-х и 5-летним опытом в МР-томографии груди, ослепленные клинической информацией, отличной от рака молочной железы, независимо проанализировали DCE-MRI индексного поражения на мониторе рабочей станции архивации и обмена данными (m-view; Marotech, Seoul, Южная Корея ). У пациентов с мультифокальным или многоцентровым заболеванием оценивался наибольший фокус / центр. Радиологи проанализировали усиление паренхимы фона (BPE) (минимальное / умеренное или умеренное / выраженное) и внутреннее усиление (nonrim или обод) индекса рака в соответствии со вторым изданием лексики МРТ грудной визуализации и данных (BI-RADS). [15] Для знаков смежных сосудов на вычитаемых изображениях присутствие сосудов, попадающих в усиливающее поражение или находящихся в контакте с краем поражения, принималось как знак положительного соседнего сосуда. [16] Сосудородность всей грудной клетки ипсилатеральной груди с раком сравнивалась с таковой контралатеральной груди при каждом изображении максимальной интенсивности-проекции на основе количества сосудов длиной 3 см или более и 2 мм или более в максимальной поперечной диаметр. [17] Степень разницы сосудистых заболеваний была классифицирована как «видная», если количество сосудов в ипсилатеральной груди было 3 или больше, чем у контралатеральной груди; «Умеренный», если выше на 2; «Мягкий», если выше на 1; и «не увеличилось», если количество сосудов в ипсилатеральной груди было таким же или меньше, чем количество контралатеральной груди. [18] Каждый рентгенолог с помощью специального программного обеспечения DCE-MRI ретроспективно генерировал кривые интенсивности интенсивности индексных раковых опухолей (средняя кривая: Siemens Healthcare, Эрланген, Германия). Область интереса (ROI) была помещена в наиболее быстрорастущую область или область, где показана наиболее подозрительная картина кривой вымывания. Для оценки кинетической кривой начальная картина улучшения и картина кинетической кривой были классифицированы как медленные, средние или быстрые и как стойкие, плато или вымывание соответственно. [15] В случаях, когда имело место несогласованность между оценками радиологов DCE-MRI особенностей BPE, внутреннего улучшения, знака соседнего сосуда, васкуляризации цельной грудной клетки и картины кинетической кривой, был достигнут консенсус.
Количественные кинетические параметры были получены из изображений кривой интенсивности времени. Для каждой кривой начальный процент повышения (E1), процент повышения пика (Epeak) и увеличение времени до максимума (TTP) измеряли следующим образом: [19] E1 = 100 × (S1 — S0) / S0, Epeak = 100 × (Speak — S0) / S0, где E1 — начальное процентное усиление, Epeak — это увеличение максимального значения, S1 — интенсивность сигнала в ROI в первой точке с усилением контраста, Speak — интенсивность пикового сигнала, а S0 — интенсивность необработанного сигнала в ROI. Увеличение времени до максимума — это время в секундах между введением контрастного материала и пиком кривой интенсивности сигнала. Коэффициент усиления сигнала (SER) был рассчитан как мера вымывания следующим образом: [20] SER = (S1 — S0) / (Slast — S0), где Slast — интенсивность сигнала в ROI в последней точке усиления контраста ,
После анализа медицинских записей пациентов мы составили данные о возрасте пациента, стадии опухоли, состоянии подмышечных узлов, гистологическом раке, ядерном уровне, наличии лимфоваскулярной инвазии и обширном компоненте интрадуктальной карциномы, а также ER, рецепторе прогестерона (PR), Ki-67 , HER-2, p53 и экспрессию цитокератина-5. Позитивность ER и PR определялась как наличие 10% или более положительно окрашенных ядер в 10 мощных полях. Маркировка Ki-67 определялась как отрицательная ( 2,2. Молекулярный подтип опухоли был классифицирован на просвет (положительный положительный гормональный рецептор и отрицательный HER-2), тройной отрицательный (отрицательный отрицательный уровень рецептора и отрицательный HER-2) и обогащенный HER-2 (HER-2 положительный).
Медицинские записи всех пациентов были рассмотрены для раннего и позднего повторения рака молочной железы. Время повторения рассчитывали с даты операции до даты первого повторного диагноза. Пациенты с рецидивом были разделены на 2 группы по времени рецидива: раннее (≤2,5 года после операции) и позднее (через 2,5 года после операции). Отсечение 2,5 лет было выбрано для стратификации, поскольку широко признано, что максимальное время повторения рака молочной железы составляет от 2 до 3 лет после постановки диагноза [21,22]
источник
По статистике, рак молочной железы является самым частым видом рака у женщин. И именно его так страшатся обнаружить у себя женщины. Согласно исследованиям, проведенным Американским Онкологическим Обществом, каждый год в мире регистрируется рак у 1,3 млн. женщин. Причем примерно половина таких случаев заканчивается смертельным исходом. Хотя за последние 10 лет уровень смертности постепенно снижается благодаря возможности диагностировать рак на более ранней стадии, что значительно увеличивает шансы на выздоровление. Такая диагностика включает в себя регулярный осмотр молочной железы у маммолога, рентгеновскую маммографию, УЗИ и магнитно-резонансную томографию (МРТ).
Метод МРТ основан на получении снимков молочных желез при помощи радиомагнитных волн, и показывает их структуру в объеме.
- получение ясных, трехмерных изображений, позволяющие заметить рак на начальной стадии;
- единственный способ обследования, подходящий для пациенток, имеющих силиконовые имплантаты в грудных железах;
- совершенно безболезненный и неопасный для здоровья метод.
Какие либо уплотнения, прощупывающиеся внутри молочной железы, трещины на коже уже являются достаточной причиной, чтобы сделать МРТ молочных желез. Существуют и другие показания проведению
- профилактический осмотр, чтобы исключить рак;
- проверка целостности имплантатов;
- определение локализации раковых клеток перед оперативным вмешательством местного характера без удаления молочной железы;
- оценка развития раковых метастаз;
- контрольное исследование после операции молочной железы.
Для получения более четкого изображения молочных желез при проведении МРТ внутривенно вводится контрастный раствор с гадолинием, который позволяет выявить рак благодаря концентрации контрастного вещества в раковых клетках. Данное вещество разработано компанией Bayer Schering Parma и практически безопасно для здоровья и гипоаллергенно.
Первое контрастное вещество было выпущено компанией в 1988 г. и с тех пор изобретение новых составов постоянно совершенствовалось. Однако если у пациента есть аллергия на что бы то ни было, обязательно нужно сообщить об этом врачу.
Также имеются еще некоторые противопоказания к МРТ:
Беременность. Поскольку влияние МРТ на плод недостаточно изучено.
Почечная недостаточность и другие серьезные нарушения хронического характера.
Стандартное устройство закрытого типа выглядит как большая труба, окруженная по периметру магнитом. Пациент укладывается на стол, который затем задвигается в трубу. Такая конструкция дает возможность проводить МРТ и стационарным больным. Если пациент страдает от клаустрофобии, МРТ проводится в аппаратах, не имеющих боковых стенок. Также это удобно, если вследствие большого веса пациент не умещается в аппарате.
Для МРТ молочной железы больная должна лечь на живот. В поверхности стола предусмотрено отверстие для молочной железы, что предотвращает ее сжимание и с точностью выявляет рак. Устройство для снятия изображения встроено в саму платформу. Для получения точной картины пациентка должна оставаться неподвижной в течение всей процедуры. Поэтому изначально нужно занять удобное положение и расслабить все тело.
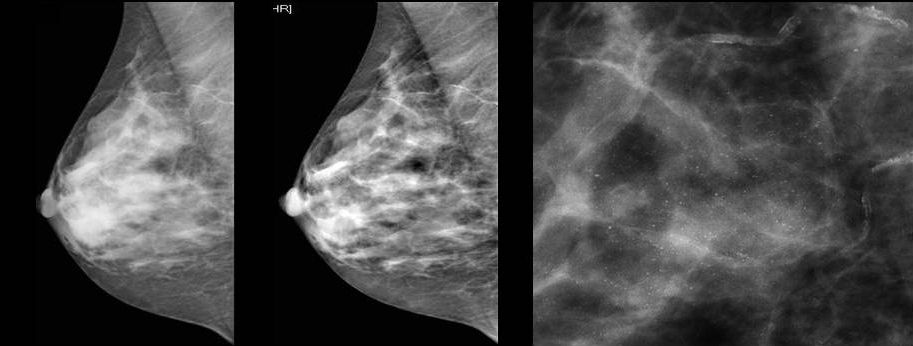
В сущности, МРТ считается наиболее точным методом диагностики рака молочных желез. Так как рентгенография, например, не фиксирует рак в 35% случаях, в случае если ткани молочной железы очень плотные
источник
По распространенности рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний. Он поражает ежегодно 1 млн. 600 тыс. женщин в мире и свыше 66 тыс. в Российской Федерации.
В ближайшие 20 лет во всех странах прогнозируется почти двукратное увеличение заболеваемости женщин раком груди, что объясняется увеличением продолжительности жизни и улучшением методов диагностики.
За последние годы, благодаря более раннему выявлению опухолей, смертность от рака груди у женщин снижается. В развитых странах, где применяется маммографический скрининг населения, этот показатель снизился на 30–50%.
Рак молочной железы – это не единообразное заболевание. При лечении клиницисты учитывают принадлежность опухоли к конкретному подтипу. Генетическое тестирование и иммуногистохимический метод, позволяют надежно определить биологические подтипы РМЖ. Эти подтипы сами по себе включают многие факторы риска и предсказывающие признаки, что позволяет выбрать наиболее эффективную терапию для больного.
Доказанное с помощью молекулярно-генетического анализа и иммуногистохимического исследования патогенетическое разнообразие РМЖ позволяет индивидуализировать лечение.
Увеличение выживаемости при раке молочной железы связано не только с широкомасштабным внедрением маммографического скрининга, но и адекватным использованием системных видов лечения.
Для выявления злокачественных опухолей молочной железы существует определенный алгоритм диагностики, и его первичный элемент — маммографический скрининг. Чувствительность этого метода диагностики для опухолей от 2 мм до 5 мм составляет около 85%. Маммографическое исследование выполняют в двух проекциях.
Молодым женщинам с плотным строением молочной железы необходимо включение в программу наблюдения методов УЗИ и МРТ.
Поскольку традиционный маммографический скрининг у женщин до 40 лет малоэффективен, для скрининга может понадобиться альтернативная методика — МРТ. Современная контрастная магнитно-резонансная томография — высокочувствительный метод диагностики заболеваний молочной железы.
МРТ-диагностика рака молочной железы
У женщин с мутациями BRCA1 или BRCA2 при проведении МРТ возможно диагностировать рак молочной железы на самых ранних стадиях.
При ряде показаний женщинам назначается биопсия молочной железы под контролем УЗИ. Это исследование позволяет прицельно брать биологический материал для гистологического исследования, определения уровня экспрессии стероидных гормонов и статуса Her-2.
Известно множество факторов, повышающих риск возникновения рака молочной железы. На некоторые из них повлиять невозможно:
- семейная история по РМЖ,
- раннее менархе (начало месячных),
- позднее наступление менопаузы.
В то же время существуют и модифицируемые факторы, такие как:
- избыточный вес в постменопаузе,
- использование заместительной гормонотерапии,
- потребление алкоголя,
- курение
Стратегические шаги, направленные на снижение риска возникновения РМЖ включают контроль веса и борьбу с ожирением, регулярную физическую активность, уменьшение потребления алкоголя.
Большинство факторов риска рака молочной железы связано с действием гормонов на ткань молочной железы (раннее менархе, позднее наступление менопаузы, ожирение, применение гормональных препаратов). Считается, что именно женские половые гормоны, стимулируют процессы клеточного роста и повышают риски повреждения ДНК, что может привести к развитию злокачественного новообразования.
Только 5–10% случаев рака молочной железы обусловлены унаследованными мутантными генами BRCA. Но при этом, среди носителей мутаций риск возникновения заболевания может достигать 80%.
Чем младше возраст выявления первичного заболевания рака груди, тем выше вероятность заболеть контралатеральным раком, т.е. противоположной молочной железы.
Семейная история с наличием заболеваний раком молочной железы у кровных родственников, даже без ассоциации с мутациями BRCA, также повышает риск возникновения РМЖ.
Ожирение
Различными исследованиями доказано существование связи между заболеваемостью первичным РМЖ в постменопаузе и ожирением. Есть подтверждение связи между избыточным весом и низкой выживаемостью при всевозможных видах РМЖ.
Алкоголь
Алкоголь — также установленный фактор риска возникновения первичного РМЖ. Достоверность его отрицательного воздействия на пациентов, перенесших рак молочной железы, убедительна, так как он влияет на увеличение количества циркулирующих эстрогенов.
Только врач может оценить значимость различных симптомов. Однако каждой женщине необходимо знать, при каких симптомах надо обращаться к маммологу:
- «Образование», уплотнения, узел, инфильтрат, опухоль, «шарик» — что-то подобные этому вы обнаружили. Это еще не повод решить, что у вас РМЖ, но повод показаться специалисту.
- Деформация контура молочной железы, ареолы или соска (втяжение кожи или наоборот выбухание)
- Втяжение соска; особенно, если появилось недавно
- Выделение крови из соска
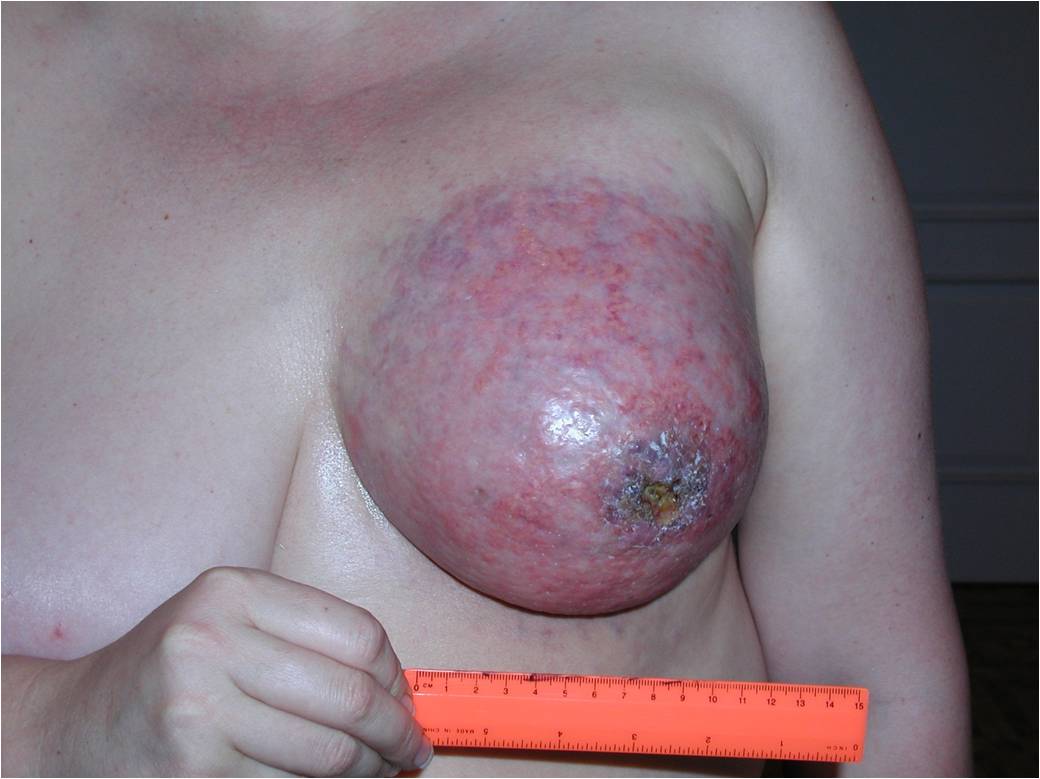
- Отек кожи всей молочной железы или ее локального участка
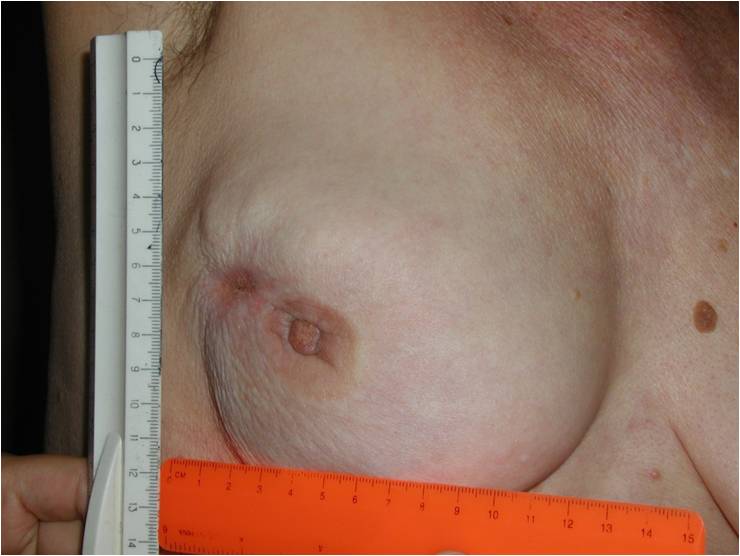
- Появление раздражения, мокнутые «ранки», язвочки, корочки на соске или ареоле
- Изъязвления (длительные, без видимой причины) на коже груди
- Дискомфорт в подмышечной области и обнаружение лимфоузлов ( «шариков» ) в подмышечной области
- Изменение цвета кожи молочной железы — покраснение, повышение температуры кожи в этой области.
Все эти симптомы могут быть проявлениями различных заболеваний (их насчитывается несколько десятков), возможно, не злокачественной природы. Однако, это может решить только специалист по заболеваниям молочной железы.
Признаки и симптомы рака молочной железы
0 стадия
Это стадия, когда не выявлена первичная опухоль, или она не может быть оценена, а также в случае неинвазивного рака молочной железы (что означает опухоль не выходит за границы своего появления, так называемый рак in situ).
1 стадия
Раковые клетки в этой стадии инвазируют или прорастают в соседние ткани. Опухолевый узел не более 2 см, лимфоузлы при этой стадии не поражены.
2 стадия
В этой стадии опухолевый узел превышает 2см и может достигать до 5см. При этой стадии могут быть поражены лимфоузлы, но поражение лимфоузлов носит одиночный характер, они не спаяны друг с другом и находятся на той же стороне, что и опухоль. В случае поражения лимфоузлов размер опухоли может быть и менее 2см.
3 стадия
Инвазивный рак, более 5 см или с явным и значительным поражением лимфатических узлов. При этом лимфоузлы могут быть спаяны между собой.
4 стадия
На этой стадии опухоль прорастает в кожу груди, грудную стенку либо во внутренние грудные лимфатические узлы. Она может быть любых размеров.
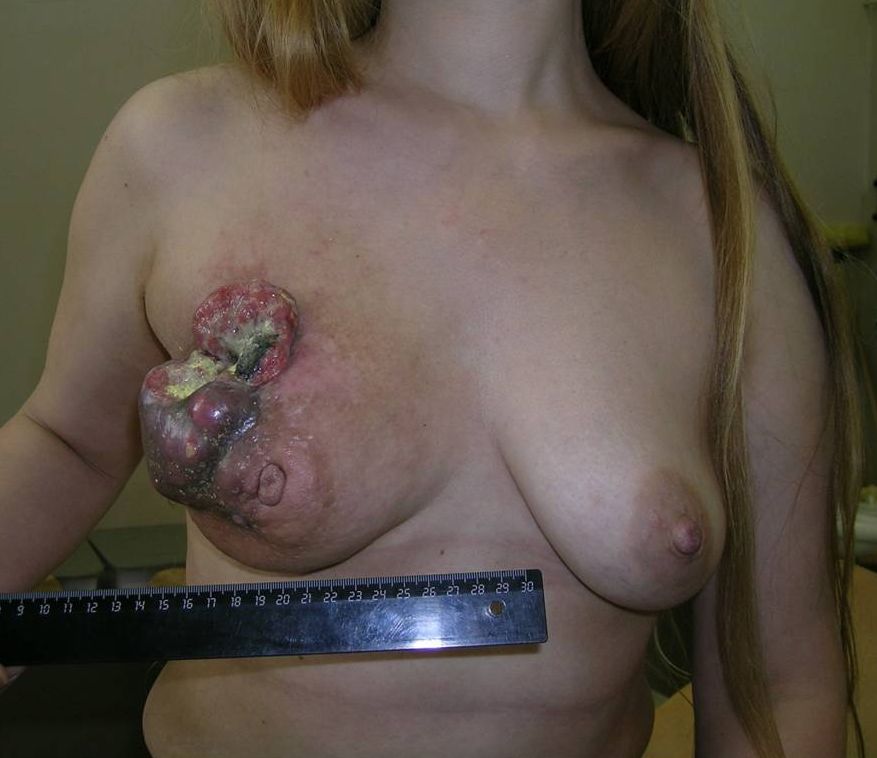
К 4 стадии рака молочной железы относится воспалительный рак, он встречается до 10 % всех случаев. Симптомы воспалительной формы рака груди это покраснение кожных покровов, железа становится теплой, отмечается увеличение и/или уплотнение части либо всей молочной железы. Кожа приобретает вид апельсиновой корки. Эту форму рака надо дифференцировать с воспалением молочной железы – маститом.
Также при 4 стадии опухоль может распространяться за пределы грудной клетки, в подмышечную область, внутренние грудные лимфатические узлы. Возможны метастазы в надключичные лимфатические узлы, а также в легкие, печень, кости или головной мозг.
Как выглядит рак груди в разных стадиях:
Хирургическая операция — основной метод лечения при опухолях груди, и от качества его проведения во многом зависит исход заболевания. По данным некоторых штатов Индии, в которых по религиозным мотивам не проводится хирургическое лечение, показатели заболеваемости практически равняются показателям смертности. Обычно смертность от РМЖ в два — четыре раза уступает заболеваемости.
Однако, после хирургического лечения чаще всего следует лучевое. Местное лечение без послеоперационной лучевой терапии часто приводит к локально-регионарным рецидивам заболевания. Дело в том, что после завершения хирургической операции невозможно исключить существования скрытых отдаленных метастазов. Даже у больных с опухолями менее 1 см в диаметре в 10% случаев возможен рецидив заболевания.
Локализация отдаленных метастазов при РМЖ
Сейчас во всем мире наблюдается тенденция к сокращению объема хирургического вмешательства без потери эффективности. Хирургическое и лучевое лечение РМЖ развивается и совершенствуется в направлении органосохранения.
Благодаря внедрению маммографического скрининга, резко возросло число больных с ранней стадией заболевания, когда лимфоузлы не поражены метастазами. В этом случае «классическое» удаление всех уровней лимфоузлов было бы избыточной калечащей процедурой. На помощь хирургам пришел метод биопсии сигнальных (сторожевых) лимфатических узлов.
Поскольку, метастазы в подмышечных лимфоузлах появляются последовательно от первого ко второму, затем к третьему уровню, то достаточно определить наличие метастазов именно в первом лимфоузле. Его назвали «сигнальным»: если сигнальный лимфатический узел не содержит метастазов, то другие лимфоузлы также не метастатические.
Благодаря этому органосохраняющему методу, тысячи пациенток избежали избыточной полной хирургической диссекции, удаление раковой опухоли не привело к удалению груди.
Последние результаты клинических испытаний, в том числе и при участии НИИ онкологии им. Н.Н. Петрова, подтвердили безопасность отказа от полной подмышечной диссекции. Биопсия сигнальных (сторожевых) лимфатических узлов постепенно вытесняет подмышечную диссекцию как стандартную процедуру стадирования РМЖ.
Концепция биопсии сигнальных лимфатических узлов приобретает все большее признание и введена для многих локализаций опухолей в стандарты хирургического лечения Европейской Организацией по Изучению и Лечению Рака (EORTC).
Химиотерапия, наряду с хирургическим вмешательством, является одним из основных методов терапии рака. Послеоперационная химиотерапия улучшает результаты хирургического лечения, как и прогноз заболевания.
Ранее решение о назначении химиотерапии основывалось на двух факторах:
- стадия заболевания
- состояние регионарных лимфоузлов.
Благодаря многочисленным исследованиям ученых изменяются представления о биологии рака молочной железы, и выбор режимов химиотерапии значительно расширяется. И сегодня химиотерапевтическое лечение назначают даже при отсутствии метастазов в лимфоузлах, если небольшие по размеру опухоли обладают агрессивными биологическими характеристиками.
Люминальный А рак
При люминальном А раке избегают назначать проведение химиотерапии, особенно при негативных лимфоузлах, и применяют одну эндокринотерапию.
Люминальный В рак
Люминальные В опухоли характеризуются высокой агрессивностью. В этом случае чаще всего будет назначена химиотерапия, а выбор лечения основывается на оценке риска развития рецидива.
HER2-позитивный рак молочной железы
Лечение HER2-позитивного рака молочной железы основано на применении стандартных схем химиотерапии – трастузумаб и ХТ, основанная на антрациклинах и таксанах. Однако, только небольшой процент пациентов выигрывает от лечения, но все подвержены связанной с этим токсичностью.
Трижды негативный РМЖ
Трижды негативный рак молочной железы обычно ассоциируется с плохим прогнозом. Из-за редкой встречаемости особых типов РМЖ нет достаточных данных о роли адъювантной химиотерапии.
Химиотерапия при РМЖ у очень молодых женщин
Рак молочной железы в молодом возрасте обычно протекает агрессивно, часто встречаются гормонорезистеные и HER2-позитивные опухоли с иными свойствами, чем у более пожилых женщин. Для таких пациенток, моложе 35 лет, адъювантная полихимиотерапия почти всегда является необходимым методом лечения.
Химиотерапия пожилых пациенток
У пожилых пациенток (старше 65 лет) при решении вопроса о назначении адъювантной химиотерапии обязательно учитываются общее состояние организма и наличие сопутствующих хронических заболеваний.
В идеале пожилые пациенты должны подвергаться гериатрической оценке для определения их «пригодности» к адъювантому лечению. Потенциальный эффект лечения должен быть сбалансирован с теми рисками для организма, которые несет химиотерапия. Врач определяет наиболее эффективный и при этом наиболее безопасный специфический режим, основываясь на подтипе опухоли и индивидуальных характеристиках пациента.
Гормонотерапия
Молодые женщины с гормоноположительным раком молочной железы сохраняют риск рецидива заболевания на протяжении по крайней мере 15 лет после первичного заболевания. Онкологи должны определить, кто из пациентов нуждается в долгосрочной адъювантной терапии тамоксифеном или ингибиторами ароматазы.
Неоадъюватная (предоперационная) терапия
Неоадъюватная терапия занимает ведущую роль в лечении женщин с неоперабельным раком молочной железы, а также имеет важное значение при операбельных опухолях, когда выполняются органосохраняющие операции.
Эффект неоадъювантного лечения ДО (слева) и ПОСЛЕ (справа)
Лучевое лечение после проведенного хирургического вмешательства играет важную роль в терапии рака молочной железы и прогнозе заболевания. В НМИЦ онкологии им. Н.Н. Петрова было проведено исследование роли лучевой терапии после органосохраняющих операций (секторальная резекция с аксиллярной лимфоаденэктомией) у пациенток с минимальным РМЖ.
Анализ десятилетней безрецидивной выживаемости доказал более высокую эффективность лечения в группе больных, где применялась послеоперационная лучевая терапия.
Использование лекарственных препаратов для снижения риска заболевания называется химиопрофилактикой. На сегодняшний день одобренными препаратами для профилактики рака молочной железы являются тамоксифен и ралоксифен.
Тамоксифен может использоваться как пременопаузальными, так и постменопаузальными женщинами. Прием тамоксифена приводит к снижению риска РМЖ на 38% на более чем 10 летний период. Наиболее распространенными нежелательными явлениями на фоне приема препарата являются приливы.
В настоящее время клинические исследования изучают роль другого класса препаратов – ингибиторов ароматазы для оценки эффектов снижения риска РМЖ, которые сегодня используются только для лечения РМЖ. Предварительные результаты оказываются многообещающими. Ингибиторы ароматазы действуют только у женщин с нефункционирующими яичниками.
Профилактические хирургические операции по удалению молочных желез проводятся только в одном случае – если женщина является носителем мутаций в генах BRCA1 и BRCA2, известных как «синдром Анджелины Джоли». Мировой практикой доказано, что при удалении ткани обеих молочных желез риски РМЖ снижаются более чем на 90%. Такие операции выполняются в клиниках США и Израиля. В Европе подход к этому вопросу более консервативный.
В НМИЦ онкологии им. Н.Н. Петрова при проведении хирургического лечения женщинам с мутациями BRCA1 предлагается профилактическое удаление и реконструкция молочной железы.