Причины рака молочной железы у женщин связывают с неблагоприятной экологической обстановкой в мире и качеством питания. Но это причины не все.
Любой онкологический процесс предполагает злокачественное перерождение клеток. Изменяется их генетическая структура. Процесс отличается агрессивными свойствами:
- начинают быстро делиться клетки;
- в организм проникают токсичные продукты жизнедеятельности клеток;
- образование прорастает в здоровые ткани, повреждая их;
- опухолевые клетки разносятся по телу с помощью лимфы и крови.
При развитии рака молочных желез причины возникновения его выявить сложно. Рак грудной железы возникнуть может по многим причинам. Повлиять на рост образования в молочной железе может наличие следующих факторов:
- Старение. Риск возникновения новообразования увеличивается с возрастом женщины. 85% случаев заболевания наблюдается после менопаузы.
- Генетика. Развитие заболевания обычно встречается у женщин, имеющих близких родственников с такой же проблемой. От родителей может передаваться измененный ген, который увеличивает риск возникновения онкологического заболевания грудной железы. Унаследованная мутация способна не проявлять себя в течение длительного периода, но повышается риск развития рака яичников, разных видов кожного рака (саркома), опухоли головного мозга.
- Индивидуальный анамнез. Причины рака молочной железы до конца еще не изучены. Появление новообразования в одной железе влечет за собой риск появления новой опухоли во второй железе. Иногда наблюдается образование в другой области той же самой железы.
- Менструальный период. Если менструация появилась рано (до 11 лет) или менопауза наступила после 50 лет, то это опасное для здоровья состояние. Его связывают с длительным действием гормона эстрогена.
- Злокачественная опухоль способна возникать при гормональной заместительной терапии. Врачи назначают прогестерон и эстроген для облегчения состояния при климаксе. Эти же гормоны рекомендуются и при остеопорозе. Но это лечение надо пересмотреть, если повышен риск появления злокачественного новообразования.
- Отсутствие детей. Женщины, которые делали искусственное прерывание беременности, бездетные или родившие впервые поле 35 лет, также имеют повышенный риск, особенно в том случае, если была искусственно прервана первая беременность.
- Грудное вскармливание. Важно кормить новорожденного грудным молоком. Кормящие женщины менее подвержены риску появления злокачественного новообразования. Чем длительнее лактация, тем меньше риск развития рака молочной железы у женщин.
- Избыточный вес. После менопаузы очень опасно ожирение. Избыточная жировая ткань сама принимает функции эндокринного органа и активно вырабатывает гормон эстроген, который развитие опухоли начинает провоцировать.
- Прием алкоголя. Злоупотребление спиртными напитками непременно приводит к появлению рака груди и считается одной из причин его возникновения.
- Плотные ткани. Женщины, имеющие плотную ткань грудной железы, имеют повышенную вероятность развития новообразования.
- Лучевое воздействие. Причиной может быть облучение области грудной клетки при диагностировании других патологий. Негативное воздействие окажет и частое рентгенологическое исследование грудной клетки при лечении туберкулеза или воспалительных заболеваний.
- Профессия. Контакт человека с возможными канцерогенами и эндокринными разрушителями также очень опасен. Это относится к производству пластмассы и металлообработке. При систематическом пользовании дезодорантами не исключено появление опухоли.
- Травмы грудных желез. Причиной новообразования бывает и травмирование грудных желез. Грудные железы — субстанции очень нежные.
- Мастопатия. При этом заболевании в молочных железах образуются уплотнения, которые достигают наибольших размеров перед менструацией. Исчезать они могут самостоятельно. Но иногда клетки этих уплотнений преобразовываются в злокачественные. Поэтому лечить патологию следует обязательно.
- При сахарном диабете и гипертонии эндокринные нарушения сопровождаются резкими скачками эстрогенов в крови. Это вызывает рост злокачественных клеток.
Очень важно вовремя выявить заболевание. Первые признаки болезни:
- втягивание и шелушение соска;
- отек и покраснение грудной железы;
- язвы в области железы;
- выделение сукровицы;
- изменения и боль при пальпации ;
- увеличение лимфатических узлов в области подмышечных впадин.
Врачи настоятельно рекомендуют женщинам самостоятельно следить за состоянием грудных желез.
При первых признаках патологии молочных желез без промедления надо обращаться к специалисту-маммологу. После 40 лет обследование должно проводиться в онкологическом диспансере. Будет назначена маммография и УЗИ, что позволяет выявить опухоли даже очень небольшие.
источник
Почти все раки молочной железы возникают из клеток железистого эпителия, выстилающего альвеолярные и дольковые молочные протоки, и поэтому представляют собой типичные аденокарциномы. Правда, при скрининге особенно часто обнаруживаются настоящие внутрипротоковые карциномы in situ (DCIS). Большинство первичных раков к моменту постановки диагноза инвазируют строму железы (инвазивная карцинома).
Подавляющее большинство опухолей представляют собой плотные новообразования, расположенные внутри железы, иногда к моменту постановки диагноза наблюдаются изъязвления кожного покрова, и опухоль приобретает инфильтрирующий характер. При небольшом поражении кожных покровов наблюдается морщинистость или втяжение кожи, при инфильтрации кожи опухолью происходит обструкция локальных лимфатических протоков и развивается симптом апельсиновой корки.
Опухоли крайне полиморфны, и их классификация основана на данных микроскопических исследований. В последнее время широко используются гистохимические красители. Стадия развития опухоли, и особенно степень ее дифференцировки, имеет большое прогностическое значение.
Очевидно, что неинвазивная карцинома молочных протоков (DCIS и дольковых структур in situ) представляет собой предраковое изменение. Иногда она сопровождается развитием различных аномалий молочной железы. С тех пор как широкое распространение получили массовые скрининговые исследования, DCIS стали диагносцировать гораздо чаще. В действительности, настоящую карциному протоков правильно называют «новая болезнь». Природа этой опухоли не вполне ясна, однако облучение и тамоксифен снижают риск ее перехода в инвазивную форму.
Пути распространения опухолей молочной железы являлись предметом обсуждения. Выяснялся ответ на вопрос: всегда ли рак молочной железы распространяется «радиально» или по лимфатической системе, и затем в патологический процесс активно вовлекается кровоток, или же гематогенный путь реализуется даже без участия регионарных лимфатических узлов? В настоящее время известно, что метастазы гематогенного происхождения, действительно, могут образовываться независимо, однако поражение подмышечных лимфатических узлов свидетельствует о большой вероятности гематогенного распространения опухоли.
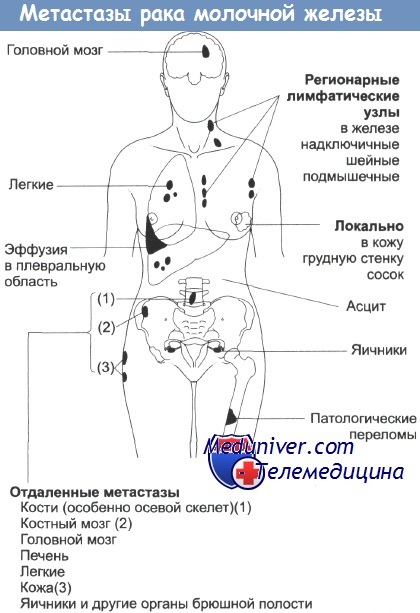
Локальное распространение опухоли происходит вглубь, на грудную стенку и связанные с ней структуры (ребра, плевру и плечевое сплетение), или кнаружи, на кожу. По лимфатической системе опухоль распространяется на подмышечные и надключичные лимфоузлы, а также на внутриорганную лимфатическую сеть или контрлатерально. Метастазы гематогенного происхождения в основном возникают в костях (особенно в осевом скелете), печени, легких, коже и в органах центральной нервной системы (головной и спинной мозг). Часто они обнаруживаются в области брюшины и таза, включая яичники и надпочечники.
Нередко отмечается необычное распространение опухоли, например обширное метастазирование костей без признаков поражения мягких тканей. У некоторых пациенток наблюдается агресссивный местный рецидив опухоли, так называемый рак en cuirasse (склеро-дермоподобная форма), который не сопровождается образованием отдаленных метастазов. Опухоль в виде обширной язвы поражает большую часть грудной стенки. Причины такой агрессивности опухоли неясны, однако она не связана с гистологической ее характеристикой и со стадией развития.
Гематогенное рапространение опухоли играет критическую роль, поскольку пациентки умирают от отдаленных метастазов, а не от ее локального роста. Вероятность метастазирования в подмышечные лимфатические узлы хорошо коррелируется с размером первичной опухоли. Выявлена взаимосвязь между количеством пораженных лимфатических узлов и выживаемостью. Поражение внутренних лимфатических узлов является ранним и важным признаком существования опухоли, расположенной в центральной зоне молочной железы.
Для этих опухолей особенно характерна высокая опасность рецидивирования, и смертность от них выше, чем от опухолей, расположенных в других участках молочной железы. Особенно неблагоприятным клиническим признаком является поражение подключичных лимфатических узлов. Согласно последним данным, большое прогностическое значение имеет факт обнаружения опухолевых клеток в костном мозге. По-видимому, эти клетки распространяются гематогенным путем, и их количество, циркулирующее в кровотоке, может быть независимым прогностическим фактором, даже при оценке общей выживаемости больных.
Результаты скрининговых исследований помогают понять природу возникновения и развития опухолей молочной железы. Можно утверждать, что в данном случае рак представляет собой прогрессирующее заболевание. Поэтому время постановки диагноза является чрезвычайно важным фактором, от которого зависит результат лечения, и для небольших опухолей достаточно эффективными могут оказаться методы локального лечения. Оценка степени индивидуального риска также стала более точной.
На протяжении последних нескольких лет интенсивно развиваются клинические исследования с использованием генного профиля опухолей, полученного методом «микроаррей». Результаты этих исследований позволяют прогнозировать исход заболевания. Так, в Нидерландах были изучены 70 генных профилей опухолей от 295 пациенток с ранней стадией рака молочной железы. Были обнаружены две четко различающиеся между собой прогностические группы. Первая группа включала 180 пациенток с неблагоприятным прогнозом (10-летняя выживаемость составляла 55%).
Вторая группа состояла из 115 человек и имела благоприятный прогноз (10-летняя выживаемость составляла 95%). Таким образом, по сравнению с традиционными клиническими методами метод «микроаррей» является более надежным и эффективным для прогнозирования исхода заболевания. Например, этот метод дает возможность спланировать для каждой пациентки наиболее подходящий курс химиотерапии с учетом степени индивидуального риска.
источник
«Результаты УЗИ молочных желез выявили образование, подозрительное на онкологию», «результаты маммографии не позволяют однозначно исключить наличие злокачественного образования», «биопсия показала наличие раковых изменений в молочной железе и требуется расширенное обследование». Это лишь немногие из самых страшных слов, которые женщина может услышать от своего врача.
Молочные железы состоят из трех основных типов тканей — жировой, соединительной и железистой. Раком молочной железы (РМЖ) называют злокачественные опухоли, развивающиеся именно из клеток железистой ткани. Вопреки расхожему мнению, РМЖ заболевают как женщины, так и мужчины, однако у женщин он встречается примерно в 100 раз чаще.
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными.
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
«Молекулярно-генетический портрет» опухоли имеет важное значение при выборе оптимального лечения.
Чаще всего опухоли молочных желёз развиваются из клеток молочных протоков — в этом случае врачи говорят о протоковом раке молочной железы или протоковой карциноме. Довольно часто злокачественные опухоли вырастают из клеток долек молочной железы, этот тип рака называют инвазивной лобулярной карциномой (инвазивный рак молочной железы). Стоит отметить, что рост опухоли возможен и из других клеток железистой ткани.
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Довольно часто на ранних стадиях рак молочной железы протекает бессимптомно. Но в ряде случаев признаки, указывающие на наличие заболевания, все же есть, и их можно заметить.
В первую очередь, к симптомам, которые должны насторожить, относят уплотнения в молочных железах, рядом с ними или в подмышечной впадине. В 9 случаях из 10 уплотнения бывают доброкачественными, однако установить это наверняка можно только на осмотре у маммолога.
К симптомам рака молочной железы относят:
- Отвердение кожи
- Участок втяжения кожи
- Эрозия кожи
- Покраснение кожи
- Выделения из соска
- Деформация молочной железы по типу ряби
- Припухлость кожи
- Увеличенные в размерах вены
- Втяжение соска
- Нарушение симметрии молочных желез
- Симптом лимонной корки
- Пальпируемый узел внутри молочной железы.
При появлении указанных симптомов, а также любых других изменений в молочных железах (например, необычных или болезненных ощущений) нужно немедленно проконсультироваться с маммологом.
В Европейской клинике ведёт консультативный приём и выполняет операции известный российский хирург-маммолог, доктор медицинских наук Сергей Михайлович Портной (автор более 300 печатных работ, член правления Российского общества онкомаммологов, автор трех патентов на изобретения).
Сергей Михайлович выполняет весь объем оперативных вмешательств на молочной железе, включая органосохраняющие и реконструктивные пластические операции.
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц, по окончании менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:
Для подтверждения или исключения диагноза в первую очередь проводится мануальное обследование груди. Затем, при наличии подозрений или в качестве скрининговой процедуры, может быть назначена маммография, рентгенологическое исследование молочных желез. Как правило, женщинам до 35 лет ее выполнение не рекомендуется, в молодости ткань молочных желез особенно чувствительна к радиоактивному облучению.
Ультразвуковое исследование (УЗИ) молочных желез позволяет оценить структуру их ткани и отличить, например, опухоль от кисты, наполненной жидкостью.
Если результаты маммографии или УЗИ указывают на наличие новообразований в молочной железе, врач, как правило, назначает биопсию, лабораторное исследование образца тканей из молочной железы. Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой, что также влияет на схему лечения.
При необходимости могут использоваться и другие диагностические методы, например, магнитно-резонансная томография (МРТ).
После постановки диагноза основной задачей лечащего врача является определение стадии онкологического заболевания, то есть размера опухоли, ее расположения, наличия метастазов и агрессивности. От этих факторов зависит прогноз лечения и подбор оптимальных методов терапии. Как правило, для уточнения стадии проводятся анализы крови, маммография другой молочной железы, сканирование костей, а также компьютерная или позитронно-эмиссионная томография. В некоторых случаях определить стадию опухоли можно только при проведении операции.
Стратегия лечения рака молочной железы зависит от многих факторов — типа рака, стадии, чувствительности клеток опухоли к гормонам, а также общего состояния здоровья пациентки.
Основной метод лечения рака груди — хирургическая операция. Если болезнь удалось диагностировать на ранней стадии, хирург может выполнить лампэктомию, удаление тканей опухоли и небольшой части окружающей ее здоровой ткани. При более крупных опухолях молочная железа удаляется целиком (такая операция называется мастэктомией), равно как и ближайшие к ней лимфатические узлы. Если по оценке врача риск развития рака во второй молочной железе достаточно высок, пациентке может быть рекомендовано удаление обеих молочных желез сразу.
Чтобы разобраться, распространились ли раковые клетки в лимфатические узлы, и определиться с объемом хирургического вмешательства, может быть проведена сентинель-биопсия, или биопсия сторожевого лимфоузла. Во время операции в опухоль вводят радиофармпрепарат или флуоресцентный краситель — это помогает визуализировать лимфоузел, который первым принимает лимфу от ткани молочной железы. Его удаляют и проводят гистологическое исследование. Если в сторожевом лимфоузле не обнаруживают опухолевых клеток, можно ограничиться удалением очага в молочной железе. В противном случае показано иссечение регионарных лимфоузлов.
Лучевую терапию (то есть воздействие на опухоль ионизирующим излучением) при раке молочной железы, как правило, используют после проведения хирургической операции. Терапия проводится с целью уничтожения раковых клеток, которые могли остаться в организме.
Химиотерапия, то есть использование препаратов, убивающих раковые клетки, может проводиться после операции по удалению опухоли, как и лучевая терапия. В некоторых случаях химиотерапию проводят до оперативного лечения для того, чтобы уменьшить размер слишком крупной для удаления опухоли.
В Европейской клинике для лечения рака молочной железы применяются наиболее современные, оригинальные европейские и американские химиопрепараты. У нас есть возможность составить «молекулярный отпечаток» опухоли, подобрать на основании его анализа наиболее эффективные и безопасные комбинации лекарств.
Для лечения рака молочной железы, чувствительного к гормонам, используют гормональную терапию — к ней относится несколько разных методов, останавливающих выработку гормонов в организме или блокирующих их поступление к опухоли. Гормональная терапия позволяет снизить вероятность рецидива опухоли, а также, в случае выявления неоперабельной опухоли, помогает контролировать ее рост.
Для лечения рака молочной железы применяют также таргетную терапию — препараты, поступающие непосредственно к тканям опухоли и минимально воздействующие на здоровые клетки организма. Таргетную терапию используют либо отдельно, либо в комбинации с другими методами лечения — в зависимости от того, какая схема лучше всего подойдет пациенту.
Если рак молочной железы диагностирован на ранних стадиях (0-I), пятилетняя выживаемость приближается к 100%. То есть, можно сказать, что удается вылечить практически всех женщин. Далее, в зависимости от стадии, прогноз относительно пятилетней выживаемости ухудшается:
- На II стадии — 93%.
- На III стадии — 72%.
- На IV стадии — 22%.
Совокупность имеющихся в арсенале онкологов методов лечения рака молочной железы позволяет в большинстве случаев добиться ремиссии заболевания или, как минимум, продлить жизнь с сохранением ее качества. Однако следует помнить, что эффективность лечения в целом напрямую зависит от того, было ли лечение начато своевременно, то есть на ранних стадиях заболевания.
Максимальная эффективность противоопухолевого лечения достигается только в том случае, если оно проводится в соответствии с международными протоколами, при этом учитываются индивидуальные особенности каждого пациента. Именно так назначают лечение онкологи Европейской клиники.
источник
Кандидат биологических наук А. ЛУШНИКОВА, кандидат медицинских наук Л. ЛЮБЧЕНКО, ГУ Российский онкологический научный центр имени Н. Н. Блохина РАМН.
Рак молочной железы — наиболее распространенный вид опухолей среди женского населения Европы, Америки и некоторых стран Азии. Ежегодно в мире регистрируется более одного миллиона случаев этого заболевания, а при средней продолжительности жизни 80 лет риск заболеть раком молочной железы составляет 12,5%. В течение последних 20 лет в мире, а также в России наметилась устойчивая тенденция к росту заболеваемости этим видом рака, особенно в городах и мегаполисах. С 1985 года он занимает первое место среди онкологических заболеваний у женщин, составляя 31,2%. Хорошо известно, что ежегодный профилактический осмотр способствует раннему выявлению опухолей. Однако часто пациентки обращаются к врачу уже с явными признаками опухоли, а это затрудняет последующее лечение. Одна из причин — непонимание важности ранней диагностики заболевания. Сейчас ученые глубоко проникли в механизмы возникновения раковой клетки, хотя многое до сих пор неясно. Как и другие онкологические заболевания, рак молочной железы по-прежнему остается коварным и агрессивным. Поэтому любому человеку очень важно иметь представление о развитии этого заболевания: предупрежден, значит, вооружен. Откуда такая напасть?
Вряд ли найдется однозначный ответ на этот вполне законный вопрос. Рак молочных желез известен с незапамятных времен: его случаи описаны, например, в древнеегипетских папирусах врача Имхотепа (3000 лет до н.э.), в вавилонском врачебном кодексе Хаммурапи (2250 лет до н.э.); о нем неоднократ но упоминает Гиппократ (400 лет до н.э.), а Гален (130-200 гг.н.э.) называет опухоли молочной железы раком из-за их внешнего сходства с крабом (по-гречески слова «краб» и «рак» звучат одинаково: karkinos). В отличие от множества заболеваний, причины которых выяснены, в основе развития злокачественных опухолей лежат более сложные механизмы и целый ряд причин, включая генетические особенности, факторы окружающей среды и многие другие.
Опухоли молочной железы могут быть как доброкачественными, так и злокачественными, или раковыми. Последние встречаются гораздо реже. Злокачественные опухоли возникают случайно или связаны с наследственностью. В 10% случаев заболевание передается из поколения в поколение и обусловлено врожденными мутациями в генах предрасположенности BRCA1 или BRCA2 (от англ. BReast CАncer).
Наиболее распространенное доброкачественное заболевание молочных желез — различные мастопатии, которые относятся к большой группе дисгормональных гипер-плазий (разрастания ткани молочных желез, обусловленные гормональными нарушениями) и связаны с нарушениями функций яичников, надпочечников, гипофиза, щитовидной железы или с нарушениями гормонального обмена в связи с заболеваниями печени, ожирением и т.д. Эти разрастания ткани молочных желез могут быть в виде плотных узелков, кист или диффузных образований. Некоторые из таких изменений можно отнести к предраковым.
И вот что удивительно, рак молочных желез встречается не только у женщин, но и у мужчин, но гораздо реже: с мужским населением связано около 1% всех случаев заболевания. Среди причин опухолей молочных желез у мужчин — редкие мутации в гене предрасположенности BRCA2, ожирение, гормональные нарушения. В отличие от доброкачественного разрастания ткани молочных желез злокачественное перерождение обязательно требует оперативного лечения.
Известно, что в отличие от нормальных клеток опухолевые не переходят после деления в фазу покоя, а продолжают бесконтрольно размножаться. Образование опухоли — многоступенчатый процесс. Рост и прогрессия опухоли, то есть ее переход от начальной к более агрессивной стадии, врастание опухоли в окружающие ткани, или инвазия, зависят от клеточных генов. Они контролируют клеточный цикл, межклеточные взаимодействия, старение и гибель клетки, а также отвечают за восстановление ДНК и стабильность клеточного генома.
Под действием различных факторов в нормальных генах могут возникать мутации. Чем дольше делятся клетки, тем вероятность таких мутаций выше, а значит, вероятнее злокачественное перерождение клеток под действием канцерогенов. Накопление повреждений в клеточном геноме связано как с ошибками репликации ДНК, так и с внешними, внеклеточными факторами.
К факторам риска на уровне человеческого организма можно отнести повышенный уровень эстрогенов (женских половых гормонов), нарушения менструального цикла, функций щитовидной железы и надпочечников, аборты и отсутствие грудного вскармливания. Эти особенности нередко встречаются в анамнезе больных раком молочной железы. К факторам, повышающим риск заболевания им, относятся также ранний возраст менархе (11-12 лет); поздние первые роды (28-30 лет); большие площадь и вес плаценты, усиливающие риск возникновения рака молочной железы у дочерей; аборты, особенно до первых родов; хроническое воспаление придатков; эндометриоз (разрастание клеток, выстилающих матку); кисты яичников и другие заболевания.
В возрасте после 65 лет наблюдается второй пик заболеваемости злокачественными опухолями молочной железы, связанный с эстрогенами надпочечников и повышенной массой тела. В общем разнообразные факторы риска этого заболевания можно условно разделить на три группы:
связанные с репродукцией (рождение детей/аборты, лактация, возраст менархе), сопутствующие гинекологические заболевания;
связанные с генетической предрасположенностью: злокачественные опухоли, особенно женских репродуктивных органов и молочных желез у близких родственников;
связанные с нарушениями обмена веществ и гормональными нарушениями, в том числе с приемом гормональных препаратов, содержащих эстрогены.
Развитию рака молочной железы предшествует разрастание ее ткани гиперплазия (увеличение числа клеток) и появление в протоках железы нетипичных клеток. Эти изменения называются предраковыми. К таковым относится и упомянутая нами мастопатия — кистозно-фиброзные и диффузные изменения ткани молочной железы. Хотя злокачественное перерождение при мастопатии происходит довольно редко, все же появление первых признаков мастопатии, выявляемых при пальпации, то есть осторожном прощупывании железы, — это повод для обращения к маммологу.
Маммография (рентгеновское обследование) и УЗИ — основные методы раннего выявления опухолей молочной железы и мастопатии. Результаты этих исследований нередко подтверждают ся с помощью пункции молочной железы, когда взятый иглой шприца образец предполагаемого новообразования исследуется под микроскопом. Очень часто изменения молочной железы обнаруживают сами пациентки при осмотре желез в первые 6-10 дней после начала менструаций.
Какие же признаки должны насторожить при самостоятельном обследовании? Во-первых, ощутимые уплотнения в молочной железе; изменение контура железы и ее плоская, а не округлая поверхность над уплотнением; отек железы, когда кожа напоминает пористую лимонную корку; втяжение соска внутрь. При запущенной злокачественной опухоли большая часть молочной железы отекает и краснеет, а при прорастании опухоли в кожу появляются язвы. Опухолевые клетки через лимфатические сосуды попадают в ближайшие лимфатические узлы, которые увеличиваются в размерах, нарушается отток жидкости из молочной железы, и развиваются отеки. Через кровеносные сосуды опухолевые клетки разносятся по организму и дают начало новым злокачественным очагам — метастазам.
Нередко предположение или заключение врача-маммолога о наличии патологических изменений в молочной железе порождает у пациенток самые неприятные опасения, а порой и панику. Однако на сегодняшний день уже имеется немало методов, позволяющих уточнить диагноз рака молочной железы и назначить соответствующее лечение, если диагноз подтвердится. Речь идет, прежде всего, о маркерах (факторах риска) опухолевого роста, обнаруживаемых в крови пациенток. Основное их предназначение — раннее выявление злокачественных новообразований и рецидивов, а также оценка эффективности лечения заболевания. При направлении в диспансер или специализированную клинику пациентке предложат сдать кровь на анализ таких маркеров. В отношении рака молочной железы пока не существует строго специфичного маркера, поэтому применяется комплекс тестов на несколько маркеров. Концентрации этих маркеров в сыворотке крови пациенток зависят от степени злокачественности и стадии заболевания и поэтому важны для диагноза и прогноза заболевания. Существуют и другие параметры, позволяющие специалисту заподозрить прогрессирование заболевания или метастатическое поражение других органов. Анализ этих показателей, в той или иной степени связанных с опухолями молочной железы, дает возможность спланировать дальнейшие действия: назначить химио- или гормональную терапию, хирургическое лечение либо лечебно-профилактические препараты в случае мастопатии или доброкачественных новообразований, к примеру фиброаденомы молочной железы. Перечень диагностических тестов меняется в зависимости от материальных возможностей клиники и пациенток, а также от конкретного случая заболевания.
Главное — своевременно и профессионально сделать анализы, руководствуясь рекомендация ми специалистов. В жизни, к сожалению, нередки случаи обращения пациенток к разного рода целителям и к так называемой народной медицине. Не умаляя значения фитотерапии и гомеопатии, врачи-онкологи настоятельно советуют обращаться именно в профильные учреждения: специализированные диспансеры и клиники, где пациентке помогут квалифицированные врачи. Промедление в выборе правильного метода терапии очень опасно.
В основу лечения рака молочной железы положен комбинированный комплексный подход в сочетании с хирургическим лечением. На опухоль воздействуют лекарственными препаратами, облучением, гормонами. Удаление всей молочной железы, или мастэктомию, зачастую заменяют компромиссным органосохраняющим лечением: удалением сегментов железы с подмышечными лимфатическими узлами. Сохранить и восстановить форму молочной железы позволяют реконструктивные операции, важность которых очевидна, особенно для молодых пациенток. Операбельны (подлежащие операции) обычно первая-вторая стадии рака. При запущенных опухолях или неоперабельном раке требуется дополнительное лечение, которое затормаживает рост опухоли и дает возможность хирургического вмешательства. Однако в большинстве случаев одного хирургического лечения недостаточно. Если риск рецидива низок, то есть опухоль мала (менее 1 см), отсутствуют метастазы в близлежащие и отдаленные лимфатические узлы, степень злокачественности низкая, а опухолевые клетки несут рецепторы опухолевых клеток к эстрогенам и прогестерону (главным половым гормонам женщины), то хирургическое лечение нередко дает устойчивый положительный эффект. Но иногда развиваются послеоперационные осложнения в виде кровотечений и нагноения раны. Вследствие удаления лимфатических узлов нарушается отток лимфы из тканей и развивается лимфостаз, обычно это происходит спустя несколько недель после операции. Нередко лимфостаз провоцируется инфекциями, горячими и солнечными ваннами, физическими нагрузками. Вот почему больным, перенесшим мастэктомию, не рекомендуются инъекции в руку на оперированной стороне, противопоказаны солярии и сауны, им нужно избегать инфицирования кожи через трещины или царапины. Полезны специальный массаж рук и гимнастика, улучшающие циркуляцию лимфы и восстанавливающие работу суставов.
Успех зависит от прогноза
Наиболее эффективное лечение опухолей молочной железы возможно лишь с учетом прогноза течения заболевания и реакции пациента на тот или иной препарат, то есть имеется ряд факторов, указывающих на благоприятный или неблагоприятный исход заболевания, а также на чувствительность опухоли к проводимому лечению. К таким факторам относятся размер опухоли, наличие метастазов в лимфатические узлы, гистология опухоли (ее строение, определяющее злокачественность), уровень эстрогеновых и прогестероновых рецепторов в опухолевых клетках и другие.
Морфологические и молекулярно-биологические факторы прогноза рака молочной железы и эффективности лечения
Количество пораженных метастазами лимфатических узлов
Прорастание опухоли кровеносными и лимфатическими сосудами
Показатели активности синтеза ДНК
Плоидность опухолевых клеток
Интенсивность деления опухолевых клеток (уровень ядерного белка митозина, уровень ядерного антигена Ki-67 и т.д.)
Наличие рецепторов эстрогенов и прогестерона
Уровень активаторов и ингибиторов (блокаторов) плазминогена (белка, участвующего во многих клеточных взаимодействиях, в инвазии и метастазировании и др.).
Исследованию этих и других факторов посвящены многие монографии, мы отметим лишь принципиально важные для развития рака молочной железы у женщин. Во-первых, это рецепторы стероидных гормонов — специфические белки, которые избирательно связывают молекулы соответствующих стероидов, проникающих в клетки (рис. 2). Наличие в опухолевых клетках рецепторов к эстрогенам и прогестерону говорит о чувствительности опухоли к гормональной терапии и о малой возможности метастазирования. На чувствительность опухоли к лечению гормонами указывает также наличие в опухолевой ткани эпидермальных факторов роста (веществ, способствующих росту определенных типов клеток). Когда в опухолевых клетках нет рецепторов к стероидным гормонам, то лечить опухоли с помощью гормональной терапии бессмысленно.
В передаче сигналов к делению клеток участвует также рецептор HER2/neu (рис. 3). Его блокирование может замедлить или остановить деление опухолевых клеток и рост опухолей, которые зависят от этих сигналов. Для такой блокировки был разработан препарат герцептин. Когда ген, кодирующий этот рецептор, активно транскрибируется (переписывается), то целесообразно использовать химиотерапию с применением герцептина, а лечение гормонами в этом случае неэффективно.
Злокачественные опухоли способны к метастазированию и инвазии. В этих процессах главную роль играют белки uPA и PAI-1. Если их уровни превышают определенные минимальные значения, то риск рака молочной железы увеличивается в 1,5-2 раза, поэтому данные важны для прогноза.
Рост злокачественной опухоли сопровождается формированием в ней разветвленной сети капилляров — сравнительно мелких кровеносных сосудов. Процесс регулируется фактором роста эндотелия сосудов. Высокий уровень этого белка в опухоли свидетельствует о неблагоприятном прогнозе как при раннем, так и при прогрессирующем злокачественном процессе. Анализ активности фактора роста эпителия стимулировал создание новых препаратов, блокирующих рост злокачественных клеток, например перспективного препарата авастин.
В последнее время выяснилось, что в ткани молочной железы с помощью фермента ароматазы синтезируются собственные эстрогены. Поэтому подавление синтеза этого фермента с помощью препаратов, например аримедекса и аромазина, может снизить риск рака молочной железы. Таким образом, благодаря исследованиям биохимиков и молекулярных биологов в распоряжении врачей оказались биологически значимые параметры, позволяющие прогнозировать течение заболевания на различных стадиях и подбирать подходящую терапию при распространяющемся раке молочной железы. Во-первых, это уровни рецепторов к эстрогенам и прогестерону в опухоли, которые дают возможность оценить целесообразность гормональной терапии и предвидеть ее результат. Во-вторых, уровень активности гена Her2/neu (см. рис.3), позволяющий обнаружить пациенток с повышенным риском рецидива опухоли молочной железы и риском ее метастазирования на ранних стадиях заболевания. В-третьих, уровень фактора роста эпителия, указывающий на прогноз развития опухоли как в начале, так и на более поздних стадиях заболевания.
Молекулярно-биологическая подоплека рака молочной железы
Какие молекулярные механизмы лежат в основе рака? Известно, что развитие опухоли связано с нарушением роста и дифференцировки клеток и злокачественным их перерождением. Во многих случаях такие нарушения обусловлены мутациями или резким повышением активности клеточных онкогенов — нормальных генов, которые участвуют в регуляции клеточного цикла, передаче сигналов и в других процессах жизнедеятельности клеток. Сейчас известно немногим более 100 различных протоонкогенов — нормальных клеточных генов, повышенная активность изменения которых или изменение их структуры приводит к синтезу онкобелков, играющих ключевую роль в клеточной жизнедеятельности. Такая активация протоонкогенов и превращение их в онкогены возможны в результате мутаций, хромосомных перестроек и других механизмов. В клетке человека около 50 000 функционирующих генов, поэтому доля потенциальных онкогенов, ответственных за злокачественный рост клеток, достаточно велика. В случае рака молочной железы, вероятно, задействовано не более 10 онкогенов.
Кроме того, нарушения клеточного цикла и бесконтрольное размножение клеток могут быть связаны с мутациями в генах-супрессорах, или подавителях опухоли. К ним относятся, например, мутации в уже упомянутых нами генах BRCA1 и BRCA2. Эти гены кодируют высокомолекулярные ядерные белки, которые исправляют повреждения ДНК и поддерживают стабильность генома, а продукт гена BRCA1 участвует в правильном распределении хромосом при делении клеток, подавляет чрезмерное гормонозависимое размножение клеток молочной железы, которое происходит, например, при половом созревании и подготовке к лактации у беременных женщин. Вот почему мутации этого гена приводят к целому спектру нарушений, начиная от новых генных мутаций и хромосомных перестроек и кончая безудержным размножением клеток эстрогензависимых органов, определяю щим развитие опухолей молочной железы и яичников. Таким образом, мутации в генах BRCA1/BRCA2 нарушают контроль за повреждениями ДНК и поддержанием целостности клеточного генома, что обусловливает появление злокачественных клеточных клонов.
Помимо мутаций активность генов-супрессоров опухоли и других генов, ответственных за регуляцию, может изменяться в результате нарушений в молекуле ДНК. Это справедливо и по отношению к раку молочной железы.
В некоторых лабораториях с помощью специальных микрочипов исследуются профили изменений клеток опухолей молочной железы. Например, французские исследователи сравнили профили таких изменений в разных образцах злокачественных клеток до и после лечения препаратом доксорубицин, что позволило наметить и обосновать стратегию химиотерапии. Они выделили группу из 496 генов, активность (экспрессия) которых отличается от экспрессии этих генов в нормальной ткани молочной железы. Несколько лет назад были опубликованы результаты исследования экспрессии 200 генов, полученные на 122 образцах опухолевой ткани молочной железы. Выделили несколько групп генов рака молочной железы, начиная с экспрессии генов близкой к норме и кончая генами с экспрессией, дающей наихудший прогноз.
Во многих лабораториях проводятся эксперименты по созданию «молекулярного портрета» опухолей молочной железы. Японские исследователи, например, получили молекулярный профиль генов в процессе лечения пациенток препаратом доцетаксел. Оказалось, что чувствительные и устойчивые к этому препарату опухоли четко различаются по активности 76 генов.
Конечно, эти подходы пока очень трудоемки и дороги для применения на практике, однако они важны для разработки более специфичных и простых методов анализа эффективности лечения. Такие данные помогут в дальнейшем прогнозировать течение заболевания и чувствительность опухоли к терапии.
Возникновение рака может быть связано не только с нарушением работы онкогенов и других генов, но и с вирусными инфекциями.
В последние 10 лет появились веские доказательства того, что в организме человека циркулирует ретровирус, родственный вирусу опухолей молочных желез мышей, или MMTV (от англ. Mouse Mammary Tumor Virus). Их активация — сложная цепочка биохимических процессов, похожая на активацию некоторых ретровирусов, вызывающих лейкозы у человека и животных.
Сначала в сыворотках крови многих больных раком молочной железы обнаружили антитела к белкам, родственным структурным белкам оболочки MMTV. Затем в ДНК лимфоцитов периферической крови и в опухолевой ткани примерно у 40% больных спорадическим раком молочной железы с помощью высокочувствительных методов обнаружили последовательности, похожие по строению на гены этого ретровируса. Из генома опухолевых клеток, попадающих в плевральную полость больных раком молочной железы, были выделены и клонированы последовательности ДНК, на 95-97% соответствующие полноразмерному провирусу.
MMTV-родственный провирус человека, или hMTV (от англ. human Mammary Tumor Virus), был обнаружен в геноме лимфоцитов и опухолевых клеток, но не в нормальных тканях человека (рис. 4). Это указывает на внешний источник ретровирусной инфекции. Частота встречаемости MMTV-гомологичных последовательностей меняется от 0-1% (Великобритания) до 75-80% (Тунис). По нашим оценкам, в России она составляет от 39-42% при спорадическом раке молочной железы до 52-56% при семейном раке и у беременных женщин со злокачественной опухолью груди. Высказано несколько предположений о путях попадания вируса в организм человека, в том числе инфицирование через лимфоидную ткань желудочно-кишечного тракта из загрязненных мышиными фекалиями продуктов. Это предположение, по-видимому, небезосновательно, так как MMTV-гомологичные последовательности были выявлены в лимфоидной ткани больной раком молочной железы и раком толстой кишки, а провирусные последовательности обнаружены у домовых мышей Mus musculus sp.domesticus, обитающих в московском регионе. Более того, распределение MMTV-гомологичных последовательностей в человеческих популяциях соответствует распространению этого вида мышей. Не исключена передача MMTV человеку от мыши как непосредственно, так и через промежуточных «хозяев» (кошек, приматов).
Недавно группа исследователей из США под руководством доктора С. Росс показала, что первичной мишенью для ретровирусной инфекции могут быть древовидные клетки — определенные лимфоидные клетки, которые поглощают чужеродные белки и вирусные частицы путем пиноцитоза — процесса поглощения жидкостей и инородных тел (рис. 5). Оказалось, что эти клетки могут затем продуцировать инфекционный вирус и передавать его другим клеткам, в частности В- и Т-лимфоцитам. При отсутствии дендритных клеток эффективность инфекции MMTV резко ослабевает; несомненно, она зависит и от других причин. Для циркуляции в организме как мышей, так и человека MMTV использует лимфоциты периферической крови. На этом этапе число копий провируса в геноме сравнительно мало. Во время активного деления эпителиальных клеток молочной железы, растущей под действием гормонов, встроенный в клеточный геном провирус получает возможность быстрого умножения копий в тысячи раз. По-видимому, провирус может встраиваться в клетки молочной железы, обладающие свойствами стволовых клеток, которые впоследствии дают начало множественным очагам опухолевого роста. Есть данные о возможном прямом или опосредованном участии hMTV в развитии рака молочной железы. В экспериментах с культурами клеток рака молочной железы человека, содержащими (+) и не содержащими (-) провирусные последовательности, группа американских исследователей обнаружила, что в (+)-клетках наблюдается высокая активность генов, связанная с иммунным ответом на инфекцию. Кроме того, в этих (+)-клетках активировались восемь генов, которые были совершенно неактивны в (-)-клетках. Сравнение картин генной экспрессии с помощью микрочипов показало, что суммарная активность генов в инфицированных hMTV клетках соответствует активности генов при воспалительном процессе с участием интерферонов, то есть вирусная инфекция играет в развитии рака молочной железы вполне определенную роль.
Чем же отличаются инфицированные и не инфицированные hMTV опухоли? Ответить на этот вопрос попытались австралийские биологи. Они показали, что на ранних стадиях рака молочной железы у пациенток одной из клиник Сиднея инфицированные этим ретровирусом опухоли по своему строению и росту сходны с опухолями молочной железы у мышей. Однако определенное сходство в развитии рака молочной железы мышей и человека было замечено задолго до этой работы. И у человека и у мышей известны опухоли молочной железы, в которых очень быстрый рост начинается сразу в нескольких очагах. Есть основания предположить, что такие опухоли возникают из клеток типа стволовых, которые приобрели способность к злокачественному росту вследствие либо геномных нарушений в клетках, либо вирусной инфекции. Новым в исследовании австралийских ученых стал факт накопления в ядрах инфицированных hMTV опухолей молочной железы человека неактивного белка — продукта гена р53, подавляющего рост опухоли, о котором мы упоминали выше. Почему этот белок не работает, еще предстоит разобраться, но для таких опухолей характерен более быстрый рост, чаще всего они локализованы в области протоков молочных желез.
В то же время группа исследователей под руководством проффесора Сельмона из Австрии с помощью генно-инженерных конструкций показала, что продукт одного из генов МMTV содержит последовательность аминокислот, соответствующую последовательностям аминокислот в иммунорецепторах, или ITAM (от англ. Immunoreceptor Tyrosine-based Activation Motifs), участвующих в передаче сигналов, регулирующих развитие клеток. Гиперактивация этих сигнальных путей вследствие проявления провируса в эпителиальных клетках молочной железы может привести к перерождению клеток и развитию рака молочной железы. Возможность появления морфологически измененных клеток, способных к трехмерному росту в культуральной среде in vitro, проверена нами в экспериментах с клетками эпителия эмбриональной почки человека, которые культивировали с вирус-продуцирующими клетками мышей. Было показано, что вирусные последова тельности действительно встраиваются в клеточный геном и на них образуются транскрипты РНК. Внедрение провируса в геном клетки может повлечь изменение активности генов в области такого объединения. Кроме того, в геноме мышиного ретровируса имеются чувствительные к действию гормонов регуляторные элементы, которые также могут изменить или полностью нарушить работу клеточных генов. Вспомним также о кодируемых MMTV аминокислотных последовательностях в составе ITAM, которые могут опосредовать существенные изменения в инфицированных вирусом клетках. Однако при последующих делениях клеток в результате хромосомных перестроек некоторые из хромосом утрачиваются вместе со встроенными в клеточный геном копиями провируса. Таким образом, опухолевое перерождение вероятно лишь в ограниченном числе клеток. Другими словами, кроме горизонтальной передачи hMTV, по-видимому, существует и вертикальная: от матери к детям. При этом лимфоидная ткань кишечника человека может служить «воротами» ретровирусной инфекции, а лимфатические узлы — резервуаром. Важно, что при умножении числа провирусных копий в составе клеточного генома наблюдается минимальный иммунный ответ на инфекцию, хотя в инфицированных клетках и обнаруживаются признаки, характерные для воспаления. Например, как уже говорилось, активны гены, кодирующие белки, которые участвуют в регуляторных процессах вместе с интерфероном. По мнению некоторых исследователей, само воспаление в молочных железах, равно как и их резкая инволюция, то есть массовое уменьшение тканей (например, после аборта или внезапного прекращения лактации), может повышать риск злокачественного перерождения клеток.
Участие МMTV в развитии злокачественной опухоли, а возможно, и опухолей других локализаций позволяет выделить носительниц hMTV в группу риска наряду с пациентками из наследственно отягощенных семей, несущими мутации в генах предрасположенности.
Итак, благодаря усилиям специалистов в области клинической биохимии и генетики, молекуляр ной биологии, вирусологии и иммунологии удалось составить довольно емкий «молекулярный портрет» рака молочной железы. В то время как усилия ученых сосредоточены на выяснении причин и механизмов возникновения опухолей, врачи стремятся распознать опухоли на возможно ранних стадиях, которые хорошо поддаются лечению и прогнозу. Вот почему число параметров для диагностики рака и оценки его развития продолжает расти. О некоторых из них мы рассказали в предлагаемой читателю статье. Какие из таких маркеров окажутся наиболее эффективными и найдут применение в клинике, покажет ближайшее будущее.
Хотя неумолимая статистика говорит о росте заболеваемости раком молочной железы, у специалистов есть повод для оптимизма. Как заметил доктор Сельмон: «Насколько коварен рак, настолько изобретателен человеческий разум…» Несомненно, ранняя предклиническая диагностика уже сейчас позволяет значительно улучшить результаты лечения и добиться лучшей выживаемости пациенток, вернуть их к активной жизни и вселить надежду на полное выздоровление.
Рак молочной железы в 10% случаев передается по наследству. Если одна из двух копий, или аллелей, гена BRCA1 у женщины несет мутацию, то вероятность развития у нее рака молочной железы возрастает до 85%, а рака яичников — до 40%. У носителей таких мутаций возрастает и риск рака толстой кишки, а у мужчин — рака предстательной железы. В гене BRCA1 выявлено до 700 различных мутаций, которые характерны для жительниц определенных географических регионов. В случае мутаций в гене BRCA2 риск развития злокачественных опухолей груди и яичников сравнительно ниже. Показано, что в России частота мутаций в гене BRCA1 у пациенток с семейным раком молочной железы примерно на порядок выше, чем в гене BRCA2. Мутации в гене BRCA1 обнаруживаются в 16% семей с двумя и более близкими родственника ми, страдающими злокачественными опухолями груди в отсутствие рака яичников. Сочетание этих двух заболеваний в семье также обусловлено мутациями в генах BRCA1/BRCA2 (см. схему на стр. 21). Оказалось, что мутации в гене BRCA1 встречаются у 61% российских пациенток с семейными случаями рака молочной железы и яичников. Мутации в генах BRCA1/BRCA2 могут обусловить и другие формы рака. Если одни и те же мутации в гене BRCA2 у российских пациенток встречаются очень редко, то в гене BRCA1 преобладает особая мутация, которая характерна для европейской части России и встречается также в странах Европы.
Носительницы этих мутаций нуждаются в регулярном посещении маммолога, поскольку риск рака молочной железы у них достигает 80-90%, а их ближайшим родственникам рекомендована консультация врача-генетика. Кроме указанных имеются и другие гены, мутации или определенные аллельные варианты которых могут способствовать развитию опухолей молочной железы и некоторых других злокачественных новообразований. Однако этот вклад не столь значителен, как в случае генов BRCA1/BRCA2.
Предположение о возможной мутации возникает у генетика, если среди ближайших родственников пациентки обнаруживаются две и более больных раком молочной железы, если заболевание развивается в возрасте до 45 лет, при опухолях в двух молочных железах или при раке с множественными очагами опухоли, а также при наличии рака яичников.
Спорадический рак молочной железы развивается без особых очевидных причин, хотя имеются определенные, не связанные с наследственной предрасположенностью факторы, повышающие риск его возникновения.
источник
Рак молочной железы (РМЖ) — это гетерогенное заболевание, включающее в себя множество молекулярных и морфологических подтипов, возникающее вне зависимости от возраста, гормонального статуса, расы и пр. и клинически проявляющееся спектром от «безобидных» до агрессивных образований.
Этиология РМЖ в настоящее время изучена недостаточно, однако можно выявить конкретные факторы, повышающие риск возникновения данного заболевания. Одним из наиболее важных факторов риска в заболеваемости РМЖ является наследственность. Семейные формы рака составляют около 20 % от всех РМЖ, однако большую часть генов, отвечающих за эти формы, только предстоит идентифицировать. Наиболее изученные мутации генов BRCA1 и BRCA2 составляют более половины от всех доминантно наследуемых мутаций, определяющих семейные формы рака. Их наличие в геноме повышает вероятность развития заболевания в 10–30 раз в сравнении со средней в популяции, а индивидуальный риск составляет до 85 %.
Такие мутации передаются достаточно редко, тем не менее, в определенных этнических группах распространенность заболевания значительно выше (например, превалентность семейной формы РМЖ у ашкенази составляет 1 случай к 40).
В генах BRCA1 и BRCA2 было выявлено более тысячи генеративных мутаций. Чаще всего они приводят к укорачиванию белковых молекул или изменению функций уже существующих белков. Интересно, что пенетрантность патогенетических мутаций генов BRCA и возраст появления первых симптомов заболевания совершенно различны даже в пределах одной семьи. Областью исследований также являются специфические мутации BRCA, возникшие в результате взаимодействия с другими генами и/или окружающей средой. Такие мутации могут служить для определения увеличения риска возникновения BRCA-опосредованного РМЖ.
BRSA1-ассоциированный рак молочной железы наиболее характерен для женщин молодого возраста и имеет более «агрессивные» характеристики, такие как:
- высокая степень гистологической дифференцировки;
- интенсивный пролиферативный рост;
- анеуплоидия;
- отсутствие рецепторов к эстрогену(ER), прогестерону (PgR) и человеческому эпидермальному фактору роста-2 (human epidermal growth factor 2 – HER2).
Такой трижды негативный подтип BRCA1-ассоциированного рака МЖ также характеризуется экспрессией генов, кодирующих цитокератины 5/6, 14 и 17, кадгерин-3. Хотя гены BRCA1 и BRCA2 кодируют множество белков с разнообразными функциями, их первоначальная роль как генов-супрессоров заключалась в поддержании геномной стабильности с помощью облегчения восстановления двухцепочечной молекулы ДНК после гомологичной рекомбинации. При потере гетерозиготности (прим. — LOH (loss of heterozygosity) – хромосомное нарушение, приводящее к потере всего гена и окружающей его хромосомной области) — то есть при утрате, изменении или угнетении «дикого», немутантного аллеля BRCA1 или BRCA2, нарушается процесс репарации ДНК, что ведет к быстрому присоединению ложных нуклеотидов (особенно во время репликации ДНК) и, в конце концов, дает начало канцерогенезу.
Также существуют гены, обладающие высокой пенетрантностью и повышающие риск возникновения заболевания, но они встречаются достаточно редко. К таким относятся TP53, PTEN, STK11/LKB1 и CDH1. Они повышают вероятность проявления заболевания в 8–10 раз, но суммарно составляют менее 1 % всех генов, являющихся причинами возникновения РМЖ. Как и BRCA1/2, эти гены являются супрессорами и передаются аутосомно-доминантно.
Повышать риск возникновения РМЖ могут мутации не только статичных, но и вариабельных элементов ДНК. Считается, что синдром Линча (доминантно наследуемое аутосомное заболевание) является фактором, увеличивающим риск возникновения РМЖ из-за генеративных мутаций в микросателлитах при нарушении репарации неспаренных оснований (mismatch repair — MMR) в генах MLH1, MSH2, MSH5, MSH6 и PMS2. Однако, по последним данным, только два гена из перечисленных — MSH6 и PMS2, непосредственно играют роль в развитии РМЖ, увеличивая вероятность возникновения заболевания в 2–3 раза. Мутации остальных генов обнаруживаются чаще при колоректальном и других видах рака.
Кроме того, последние исследования предлагают рассматривать точечные мутации (ОНП — однонуклеотидные полиморфизмы) микроРНК также в качестве фактора, повышающего вероятность возникновения заболевания. Они регулируют активность множества онкогенов и генов-супрессоров, следовательно, любые изменения в микроРНК будут отражаться на экспрессии соответствующих генов, что может модифицировать вероятность развития РМЖ. Например, проведенный недавно мета-анализ подтвердил, что ОНП, расположенные в генах pre-mir-27a и mir-196a-2, связаны со снижением риска возникновения рака молочной железы.
Подавляющее большинство РМЖ имеют спорадическое происхождение, в конечном счете их причиной является возникновение соматических и генетических изменений. Множество из них являются результатом нарушения репликации молекулы ДНК. Другие же возникают из-за воздействия экзо- и эндогенных мутагенов. Определение роли каждой выявленной мутации в процессе развития РМЖ представляет собой значительную проблему.
По данным последних исследований, подавляющее большинство выявленных соматических мутаций молекул ДНК в конкретных опухолях — это транзитные мутации-«пассажиры». Они представляют собой безвредные, биологически нейтральные изменения в структуре гена, не содействующие канцерогенезу. И, напротив, драйверные мутации-«водители», выявленные в клетках, дают преимущество в росте и развитии рака.
В действительности именно драйверные мутации находят среди раковых генов-«кандидатов» (CAN — candidate cancer genes).Благодаря множественным исследованиям был создан комплексный каталог соматических мутаций и CAN. Когда определенный драйверный ген попадает в ряд различных генов рака МЖ, возникает двухвершинный геномный ландшафт, охватывающий небольшое количество одинаково мутировавших генов. Вершины этого ландшафта соответствуют наиболее часто встречающимся мутациям, опосредующим возникновения РМЖ: TP53, CDH1, PI3K (прим. — фосфатидилинозитол-3-киназы), cyclin D, PTEN, и AKT.
С другой стороны, каждая отдельная “низменность” этого геномного ландшафта представляет собой совокупность генов, которые являются причинами РМЖ не более, чем в 5 % всех случаев. Значительная гетерогенность мутаций ДНК способна объяснить вариабельность фенотипов опухолей, их поведения и ответных реакций на лечение.
Изначально внимание ученых концентрировалось на генах «вершин», в частности потому, что только они были доступны для исследований. Однако новые данные свидетельствуют о том, что гены «низменностей» занимают центральную позицию в развитии РМЖ. Это согласуется с идеей о том, что большое количество мутаций в этих генах, уменьшающее процент их выживаемости, является направляющим фактором в процессе развития опухоли.
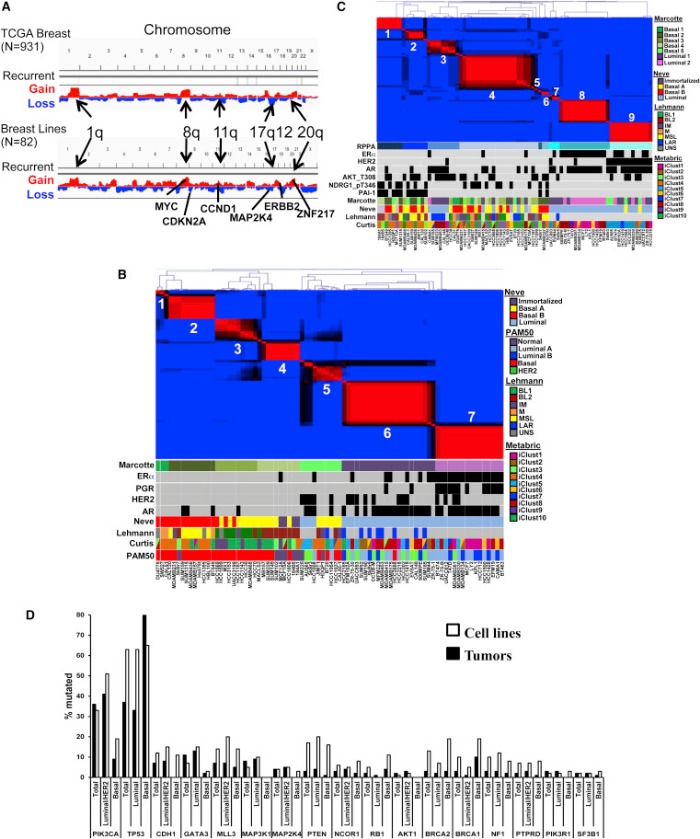
По новым данным, в геноме есть определенные амплифированные участки, содержащие гены, которые способны управлять канцерогенезом. Лучшим примером такого амплифицированного участка можно назвать ампликон 17q12, содержащий онкоген HER2.Этот онкоген управляет развитием наиболее агрессивного фенотипа опухоли МЖ и сейчас является мишенью моноклональной антительной терапии, пользующейся особым успехом (трастузумаб).
Было выяснено, что РНК-опосредованное вмешательство приводит к нарушению амплификации генов в ампликоне 17q12. В результате происходит снижение клеточной пролиферации и усиление апоптоза. Таким образом, ампликон 17q12 участвует в зашифровке конкретной генетической программы, влияющей на онкогенез. Существует еще несколько ампликонов, которые, в дополнение к 17q12, участвуют в развитии ракового фенотипа. Например, 11q13(CDN1)и 8q24(MYC), 20q13. Эти участки содержат наборы генов, которые участвуют в поддержании хромосомной целостности регуляции метаболизма ДНК.
Таким образом, наличие этих функционирующих ампликонов может определять ответ ДНК на повреждающие агенты, используемые в качестве противораковой терапии. Вклад генетических изменений в функционирование может проявляться в виде гиперэкспрессии не только отдельного гена, но и целых генетических «кассет» —ампликонов. Однако, благодаря развитию технологий в области идентификации и классификации генетических мутаций возникают новые возможности в диагностике и лечении каждого отдельного пациента.
Исторически раковые опухоли молочной железы классифицировались по патоморфологическим отличиям, а именно по стадии и степени дифференцировки. В качестве важных диагностических критериев, которые отражают биологию опухоли, также можно рассматривать гистологические особенности опухоли, наличие лимфососудистой инвазии и пролиферативный статус. Спустя время, знания о биологии РМЖ существенно увеличились и привели к пониманию, что рак молочной железы представляет собой гетерогенную группу опухолей, а поведение опухоли и ее ответ на лечение предопределены лежащими в основе биологическими особенностями. Современная классификация рака молочной железы основывается на иммуногистохимических (ИГХ) показателях — т. е. на экспрессии определенных биомаркеров. К таким относятся эстрогеновые рецепторы (ER), прогестероновые рецепторы (PR), рецепторы человеческого эпидермального фактора роста 2 (HER2) и пролиферативный индекс (Ki67).
Таким образом, в настоящее время опухоли молочной железы можно поделить на ER-положительные/-отрицательные, HER2-положительные/отрицательные и трижды негативные(ER-, PR-, HER2-). Показатели экспрессии этих двух маркеров в различных комбинациях могут использоваться в качестве важных диагностических критериев. Например, ответ на гормонотерапию будет существенно отличаться у опухолей ER+/HER- и ER+/HER+.
Люминальный тип рака молочной железы (ER+)
Этот тип РМЖ непосредственно связан с экспрессией эстрогена и изменениями эстроген-ассоциированных сигнальных путей. Эстроген – это стероидный гормон, который проявляет свое действие, связываясь с ядерным эстрогеновым рецептором. До связывания со своим лигандом, рецептор «скреплен определенным образом со специальными регуляторными белками и располагается в промоторном участке эстроген-зависимого гена. Это необходимо для управления процессами транскрипции множества генов, включая гены факторов роста.
Уровень экспрессии эстрогеновых рецепторов является важнейшим диагностическим критерием, поскольку демонстрирует то, как клетка будет отвечать на антиэстрогены, рекомендованные в качестве лечения всех ER+ опухолей. Для всех РМЖ люминального типа характерна высокая экспрессия эстрогеновых рецепторов(люминальные опухоли = опухоли ER+) и наличие прогестероновых рецепторов (PR+).
По результатам множества исследований, было выявлено два подтипа люминального РМЖ. Это люминальные А и Б подтипы (встречаемость (?) 40 и 20 % соответственно), основное отличие которых проявляется в экспрессии HER2 и пролиферативном индексе Ki67 (прим. — если Ki-67 меньше 15%, опухоль считается слабоагрессивной, при показателе Ki-67 от 30 до 50% опухоль считается агрессивной, а при показателе Ki-67 выше 50% опухоль является высокоагрессивной).
Люминальный подтип А характеризуется достаточно низким индексом пролиферации (Ki67 HER2-положительный тип рака молочной железы (HER2+)
Рак молочной железы типа HER2+(ER+, PR+, HER2+, Ki67 ≈ 90 %) составляет от 10 до 15 % всех случаев РМЖ. HER2 (EGFR2 илиErbB2) относится к семейству рецепторов с тирозинкиназной активностью, которое также включает EGFR (HER1, ErbB1), ErbB3 иErbB4. Лиганды, которые связываются с внеклеточными доменами ErbB1, ErbB3 и ErbB4, активируют различные киназы. Белок HER2 хоть и приобретает такую конформацию, в которой связывание с лигандами невозможно, все равно принимает участие в деятельности других рецепторов этого семейства.
Генетически, возникновение HER2-положительных опухолей опосредовано высокой частотой возникновения мутаций в TP53 (72 %) и PIK3CA (39 %). На молекулярном уровне амплификация HER2 связана с нарушением контроля G1- и S-фаз клеточного цикла при гиперэкспрессии или деградации белков, отвечающих за этот процесс (например, циклины D1, E, cdk6). Кроме того, HER2 взаимодействует с важными вторичными посредниками, участвующими в передаче сигналов в клетке, включая SH2-домен содержащие белки (Src-киназы).
ER-отрицательный тип рака молочной железы (базальноподобный)
ER-подтип представляет собой гетерогенную группу опухолей, однако наиболее часто встречающимися (50–75 %, 15–20 % от всех случаев РМЖ) являются опухоли, развившиеся из базальных клеток молочной железы. Генетические мутации, характерные для данного подтипа опухолей, чаще всего возникают в TP53 (80 %). Обычно, они лишены рецепторов к эстрогену, прогестерону и человеческому фактору роста-2 (ER-, PR-, HER2-), поэтому в клинической практике получили название трижды негативных. Характерная особенность таких опухолей заключается в гиперэкспрессии генов, отвечающих за синтез цитокератинов и пролиферацию, однако гены, регулирующие нормальное протекание клеточного цикла практически не функционируют.
Хотя базальноподобные опухоли составляют бóльшую часть всех ER-отрицательных опухолей, существуют и другие их разновидности (приблизительно 6 видов), которые наглядно подтверждают гетерогенность данной группы опухолей. Некоторые из них отличаются низким уровнем клаудина (трансмембранного белка), но при этом большей экспрессией рецепторов к интерферонам и андрогенам. Пониженный уровень клаудина приводит к нарушению функционирования клеточных контактов, что является главным отличием таких опухолей от базальноподобных.
Источники:
- Devita Jr V. T., Lawrence T. S., Rosenberg S. A. DeVita, Hellman, and Rosenberg’s cancer: principles & practice of oncology. – Lippincott Williams & Wilkins, 2015.
- Ten Broeke S. W., Suerink M., Nielsen M. Response to Roberts et al. 2018: is breast cancer truly caused by MSH6 and PMS2 variants or is it simply due to a high prevalence of these variants in the population? //Genetics in Medicine. – 2018. – С. 1.
- Win A. K., Lindor N. M., Jenkins M. A. Risk of breast cancer in Lynch syndrome: a systematic review //Breast Cancer Research. – 2013. – Т. 15. – №. 2. – С. R27
- Rakha E. A., Green A. R. Molecular classification of breast cancer: what the pathologist needs to know //Pathology. – 2017. – Т. 49. – №. 2. – С. 111-119.
источник