Любченко Л.Н., Гарькавцева Р.Ф., Портной С.М., Брюзгин В.В.
Среди злокачественных новообразований рак молочной железы (РМЖ) является основной причиной смерти женщин репродуктивного возраста в России (1). В последнее десятилетие решение вопросов этиологии, патогенеза, ранней диагностики и профилактики РМЖ связывают с открытиями в области молекулярной генетики, благодаря которым появилась возможность выявлять гены, вовлеченные в процесс канцерогенеза и определяющие предрасположенность к данному заболеванию. На сегодняшний день мы уже можем дифференцировать наследственные и спорадические формы РМЖ в зависимости от того, в какой клетке — герминальной или соматической произошло повреждение генетического аппарата. В результате стало возможным детальное изучение наследственной предрасположенности к развитию РМЖ, генетической гетерогенности рака этой локализации и на этой основе выявление лиц с потенциально высоким риском заболевания с последующим использованием эффективных профилактических и адекватных лечебных мер.
Генетическая предрасположенность к раку молочной железы
До 1980 года изучение генетической предрасположенности к раку молочной железы было ограничено описанием больших семей, в которых, по меньшей мере, одна женщина в каждом поколении страдала раком молочной железы. В 1982 г. W.Albano и соавторы (2) выделили особую нозологическую единицу — наследственный рак молочной железы, в рамках которого возможно существование различных генетически детерминированных форм и синдромов. Последующие исследования подтвердили, обосновав как формально-генетически так и с помощью молекулярных методов, существование наследственных синдромов: органоспецифического РМЖ, сочетанных РМЖ/рака яичников, синдрома Линч II, при котором в семьях наблюдается накопление злокачественных новообразований органов женской репродуктивной сферы и желудочно-кишечного тракта; Ли-Фраумени, в состав которого входят неоплазии различной локализации в сочетании с РМЖ, синдромы SBLA, CRAC, Гарднера, Пейтца-Егерса, атаксии-телеангиэктазии, основной составляющей которых является РМЖ. Критериями для постановки генетического диагноза наследственного РМЖ служат наличие в семье двух и более родственников I-II степени родства, страдающих РМЖ, ранний возраст манифестации заболевания, двухстороннее поражение молочных желез, первичная множественность новообразований у пробанда или его родственников, специфические опухолевые ассоциации (3).
В ранних работах на материале 200 датских родословных W.Williams и D.Anderson (4) с помощью сегрегационного, корреляционного и компонентного анализов установили, что наиболее приемлемой является модель аутосомно-доминантного наследования гипотетического гена, ответственного за развитие наследственного РМЖ, с возраст-зависимой пенетрантностью. B.Newman с соавт. при сегрегационном анализе родословных показали, что частота гипотетического гена составила 0,006 в общей популяции, а его пенетрантность — 0,82 (5).
В более поздних работах E.Claus с соавт. (1991 г.) и D.Easton с соавт. (1993г.), на основе проведения генетического анализа получили сходную частоту носительства гена и сделали вывод, что одна из 20 женщин с онкологически отягощенным анамнезом, страдающая РМЖ, является носительницей наследственной предрасположенности. В общей популяции это соотношение составляет 1:200 (6,7). Такая частота гена (генов) относит генетическую предрасположенность к РМЖ к одной из самых широко распространенных и обосновывает актуальность ее ранней диагностики.
Пролиферативная форма фиброзно-кистозной болезни и рак молочной железы возникают и развиваются под влиянием одних и тех же эндогенных и экзогенных факторов. Данные, заслуживающие особого интереса, были получены в исследовании W. Dupont и D.Page (8), наблюдавших 3 303 женщин в течение 17 лет. Они показали, что наличие в семье больных родственниц I степени родства, страдающих РМЖ, повышает риск развития этого заболевания в 2,5 раза, как при наличии атипической гиперплазии, так и без нее. С точки зрения авторов, отягощенный семейный анамнез незначительно повышает риск развития заболевания у женщин без пролиферативных изменений ткани молочной железы, но наличие кальцинатов и отягощенный РМЖ семейный анамнез значительно повышают риск развития РМЖ, что и является основанием для включения таких женщин в «группу риска». В этой же работе показано, что абсолютный риск РМЖ, ассоциированный с атипической гиперплазией составил 20% в течение 15 лет после первичного биопсийного исследования.
Haagensen c cоавт. продемонстрировали взаимосвязь РМЖ с кистозным изменением ткани молочной железы. Эта группа исследователей сделала вывод, что наличие кист повышает риск развития РМЖ у женщин, имеющих родственниц I степени родства, страдающих аналогичным заболеванием. Такой ассоциации не отмечалось среди женщин без семейного отягощения (9). При этом вклад доброкачественных опухолей также имеет существенное значение. Dupont с соавт. проследили судьбу 1 950 пациенток с диагнозом фиброаденома и сочетанием фиброаденоматоза с фиброзно-кистозной болезнью. Контрольную группу составили сестры мужей этих женщин. Риск развития РМЖ при одиночных фиброаденомах составил 2,17 и повышался до 3,1 у пациенток при наличии сочетанных фиброаденом и кист, фиброаденом и склерозирующего аденоза, кальцинатов или папилломатоза. Причем, при отягощенном семейном анамнезе накопленный 25-летний риск составил 20%. Две трети пациенток, имеющих единичные фиброаденомы и здоровых родственниц, рисковали заболеть РМЖ наравне с женщинами из общей популяции (10).
Генетический анализ, проведенный М. Skolnick с соавт. показал, что существует наследственная предрасположенность как к РМЖ, так и к пролиферативным доброкачественным изменениям ткани молочной железы. 103-м женщинам из 20-ти семей, в которых, по крайней мере, 2 родственницы 1 степени родства (мать, дочь или сестра) страдали РМЖ и 31 женщине из контрольной группы было выполнено клиническое, рентгенологическое обследование и 4-х квадрантная биопсия обеих молочных желез. Результаты такого исследования показали, что 35% клинически здоровых женщин опытной группы по сравнению с 13% контрольной, имели цитологические признаки пролиферации эпителия. Из этого можно сделать вывод, что генетическая предрасположенность к РМЖ на первом этапе выражается доброкачественной дисплазией молочной железы (11). Это предположение подтверждено и в исследовании А. Baildam, в котором при патоморфологическом исследовании ткани молочной железы, удаленной при профилактической двухсторонней мастэктомии у 43-х женщин, в т.ч. носительниц генов BRCA1\2, в 35 случаях (81%) имела место доброкачественная дисплазия (12). H. Cody ссоавт., используявскрининговомисследованиидвухстороннююбиопсию у 871 пациентки, показали, что только один фактор – первая степень родства в отношении больной РМЖ, коррелировала с синхронным поражением молочных желез. В результате проведенных исследований было выявлено 54 случая заболевания, из них 14 инвазивного рака и 40 рака insitu. Таким образом, выполнение двухсторонней биопсии у женщин с семейным накоплением РМЖ вполне оправданная процедура (13).
Попытки выявить единые патобиологические механизмы проводились на хромосомном и молекулярном уровнях. М. Teixeiraet с соавт. в 5-ти из 6-ти образцов, полученных при профилактической двухсторонней мастэктомии и в 1 образце карциномы in situ, выполненной у 4-х женщин в связи с отягощенным семейным анамнезом цитогенетическим методом, выявили клональные хромосомные нарушения. Все образцы имели гистологические признаки эпителиальной гиперплазии без атипии и карциному in situ. Делеция сегмента короткого плеча хромосомы 3 (р12-14) была определена при раке in situ в одном образце с гиперплазией. Признаки хромосомных аберраций в профилактически удаленных тканях доказали, что неопластический процесс уже имел место (14). При изучении аллельной потери хромосомной зоны 17g 12-21 (зона BRCA 1 гена) 25 образцов доброкачественных и злокачественных опухолей женщин из семей, отягощенных как органо-специфичным РМЖ, так и из семей, с различной онкологической патологией, Р. Lalle с соавт. констатировали, что аллельная потеря встречается чаще в опухолях членов семей с органо-специфичным РМЖ (15). Таким образом, генетические изменения, происходящие в доброкачественных опухолях, подтверждают, что гиперплазия ткани представляет собой первую ступень в канцерогенезе в семьях с наследственным отягощением. С другой стороны, М.Kasami с соавт. в исследовании 25 образцов ДНК, выделенной из пролиферативно измененных тканей молочной железы, включая внутрипротоковые папилломы, на предмет потери гетерозиготности и микросателлитной нестабильности по 10 локусам, включая локус D 17S 579 (зона BRCA 1 гена) выявили неполную корреляцию между генетическими изменениями и пролиферацией с атипией. Важным выводом в этой работе было то, что генетические изменения могут иметь место и без четких клинических признаков, предшествующим злокачественным и опираться в таких случаях следует на отягощенный семейный анамнез (16).
Молекулярная генетика РМЖ
На сегодняшний день хорошо изучены высокопенетрантные гены BRCA 1 и BRCA 2 (BReastCAncer), играющие определенную роль при возникновении наследственного РМЖ. Герминальные мутации генов Тр 53, PTEN (PhosphatesTENsin) и АТМ являются этиологичными в отношении специфической индивидуальной и семейной предрасположенности — синдромам Ли-Фраумени, Каудена и атаксии-телангиэктазии. Существуют другие гены и полиморфизмы, имеющие отношение к наследственному предрасположению возникновения РМЖ (CHEK2, NBS1, СYP17,CYP19, NAT2), но их изменения связаны с меньшим риском развития РМЖ, по сравнению с генами BRCA (17, 18)
BRCA 1 ген был идентифицирован с помощью позиционного клонирования в 1994 г. Y. Mikietal. на длинном плече 17 хромосомы (19). BRCA 2 ген был картирован на 13q хромосоме и выделен в 1995 г. S.Tavtigian et al. (20). BRCA1 и BRCA2 гены являются супрессорными генами, с аутосомно-доминантным типом наследования и высокой пенетрантностью в пределах одной семьи. В совместном исследовании BreastCancerLinkageConsortium (BCLC 2003) включившим данные большого количества семей, наследующих герминальные мутации генов BRCA1 И BRCA2, было показано, что оба этих гена несут высокий 80–95% риск развития РМЖ у женщин в течение всей жизни, однако кривая пенетрантности для носителей мутаций гена BRCA 1 начинает возрастать в более раннем возрасте по сравнению с носителями мутаций гена BRCA 2. Анализ данных продемонстрировал высокую вероятность возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, меланомы, мочевого пузыря, опухолей головы и шеи при патологическом BRCA1/2 генотипе, что необходимо учитывать при медико-генетическом консультировании и наблюдении пациентов-носителей. Риск развития двухстороннего РМЖ составляет 64% для носителей мутаций гена BRCA1 и 58% для носителей мутаций BRCA 2 гена. Мутации генов BRCA1/2 одновременно находят примерно в 80% семей с 4-мя и более случаями РМЖ, диагностированным после 60-ти лет (21, 22).
Молекулярные исследования BRCA1 и BRCA2 генов, проведенные за последние годы, демонстрируют огромный спектр мутаций этих генов. Breast Cancer Information Core (BIC) содержит свыше 800 различных вариантов мутаций генов BRCA1/2. Большинство этих мутаций относятся к делеторным, в результате которых структурные перестройки изменяют функциональность белкового продукта, что, в свою очередь снижает способность клетки к репарации ДНК. Значительная часть – 34% мутаций гена BRCA 1 и 38% BRCA 2 гена, являются миссенс – мутациями. Описано большое количество однонуклеотидных полиморфных вариантов, клиническое значение которых на сегодняшний день не определено. В нашей совместной работе с Медико-генетическим Научным Центром РАМН по скринированию гена BRCA 1 у пациентов, страдающих РМЖ и/или раком яичников, из семей с онкологически отягощенным анамнезом, в 52,4% случаев одна аллель гена BRCA 1 содержала 8 полиморфных вариантов, наследуемых в семье как целое (23).
В отношении оценок пенетрантности генов BRCA1 и BRCA2 также важно этническое происхождение пациентов-носителей. Изучение популяций исландцев и евреев Ашкенази выявило низкую пенетрантность этих генов, а риск развития РМЖ на протяжении жизни составил 50-60% и 37% у ашкеназцев и исландцев соответственно. В этих популяциях только несколько мутаций являются ответственными за генетическую предрасположенность к РМЖ и/или раку яичников. Они связаны с эффектом родоначальника, т.е. мутация, возникшая в одной из гамет предка, так называемая неомутация или мутация «de novo», в последствии передается из поколения в поколение. Интересно отметить, что из 14 пациентов-россиян, страдающих РМЖ и имеющих значимые делеторные мутации, у 11 (78,5%) выявлена мутация 5382insC в 20 экзоне — у 7-ми русских и 4-х евреек (24). В предыдущей нашей совместной работе с Кембриджским университетом по изучению спектра мутаций гена BRCA 1 в российской популяции, на долю мутации 5382incC пришлось 47% случаев (25). Предполагают, что семьи имеют общий гаплотип, который охватывает 850 кБ гена BRCA 1, и что существуют определенные внутригенные маркерные аллели, наследуемые от общего предка (26).
Особенности рака молочной железы у носителей мутаций генов BRCA1 или BRCA2
Герминальные мутации редко встречаются при спорадическом РМЖ, хотя снижение экспрессии BRCA 1 имеет место. Различный молекулярный патогенез между BRCA–ассоциированых и ненаследственных опухолей молочной железы предполагает, что эти опухоли могут кардинальным образом отличаться по фенотипическим и прогностическим признакам. Многими группами исследователей отмечена фенотипическая гетерогенность РМЖ, обусловленная герминальными мутациями генов BRCA1 или BRCA2. Показано, что отсутствие пораженных регионарных лимфатических узлов не снижает смертности у носителей мутаций этих генов. Опухоли, обусловленные герминальными мутациями гена BRCA 1, имеют более высокую степень злокачественности, большую частоту медуллярного рака, отсутствие рецепторов эстрогенов и прогестерона (27, 28). Оценки выживаемости спорны из-за различных методологических подходов. Результаты работы, проводимой в РОНЦ им. Н.Н. Блохина РАМН показали, что общая выживаемость больных, страдающих РMЖ, ассоциированного с мутациями гена BRCA2, статистически достоверно лучше значений выживаемости больных спорадическим РМЖ – 87,4% и 71,0% соответственно (р 30 лет, чем у рожавших до 20 лет (33).
Ранние роды не оказывают защитного действия у женщин, имеющих мутации BRCA1 или BRCA2. Рожавшие женщины-носительницы мутаций BRCA1 или BRCA2 существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска заболеть РМЖ в возрасте до 40 лет (34).
Профилактическое применение тамоксифена в группах риска широко обсуждается. В основу предлагаемой на сегодняшний день гормонотерапии положены факты, представленные впервые в 1976 г. V. Jordan с соавт. свидетельствующие о том, что применение тамоксифена в 90% случаев подавляет опухолевый рост при РМЖ (35). Это позволило предположить, что применение тамоксифена возможно и с профилактической целью. Подробное изучение механизма действия препарата выявило, что тамоксифен блокирует G1-фазу клеточного цикла и подавляет деление опухолевых клеток. С 1980 года были проведены большие клинические рандомизированные исследования по определению эффективности профилактического применения тамоксифена у женщин с высоким риском развития РМЖ. Наиболее полные исследования были выполнены в 1986 г. в Англии (Royal Mansden Hospital) под руководством T. Powles (36). Подобные исследования начаты в 1992 г. группой Европейского института Онкологии в Италии под руководством U.Veronesi c соавт. (37), и в США (National Surgical Adjuvant Breast and Bowel Project, — NSABBP) под руководством B.Fisher с соавт. (38). Обобщенные результаты этих исследовательских групп были опубликованы в 1998 г.
Рандомизированное исследование американцев включало 13,388 женщин, разделенных на группы, принимающих тамоксифен и плацебо в дозе 20мг в день в течение 5 лет. Участницы исследования были отобраны в связи с наличием факторов высокого риска развития РМЖ, который рассчитывался по алгоритму, учитывая возраст, число родственниц I степени родства, страдающих РМЖ, отсутствие родов в анамнезе или возраст первых родов, число биопсийных исследований ткани молочной железы, рак in situ, возраст менархе. Результаты этого исследования были представлены раньше предполагаемого срока, так как консультативным комитетом было определено, что выборка достаточно представительна и основной вывод, показывающий, что тамоксифен снижает риск инвазивного РМЖ на 49% (р 0.00001), был аргументировано обоснован. На 69% снизилась частота РЭ+ опухолей; частота РЭ- опухолей изменилась статистически незначимо. Риск неинвазивного РМЖ был снижен на 50% (р 50 лет) ожидалось 50,3 случая РМЖ, наблюдалось 2; снижение риска развития болезни – 96,0%.
RebbeckT.R. и соавторы представили анализ эффективности двусторонней профилактической мастэктомии у здоровых женщин-носителей мутаций геновBRCA1 и BRCA2 (42). 105 женщинам была выполнена профилактическая операция с или без оофорэктомии, 378 пациенток отказались от профилактического вмешательства. При средней длительности прослеженности 6,4 года РМЖ был выявлен в двух случаях у оперированных женщин (1.9%) и в 184 случаях (48.7%) у не оперированных. Двусторонняя профилактическая мастэктомия в сочетании с удалением яичников снижала риск развития РМЖ на 95%, а в случаях с интактными яичниками — на 90%.
Целесообразность выполнения профилактических мастэктомий у носителей мутаций генов BRCA1 или BRCA2 подтверждается высокой частотой обнаружения предраковых изменений и рака in situ в удаленных органах. В Манчестерском госпитале (Англия) хирургом А. Baildam с 1995 года профилактическая двухсторонняя мастэктомия была выполнена 43 женщинам. Важным фактом было то, что при гистологическом исследовании удаленных тканей в 8 случаях (18%) были выявлены злокачественные изменения – 4 дольковых рака in situ, 2 протоковых рака in situ, и в 2-х случаях – смешанный протоково-дольковый рак in situ (43). N.Hoogerbrugge и соавторы также приводят данные о морфологических находках в «здоровых» молочных железах, удалённых профилактически: протоковая атипическая гиперплазия наблюдалась в 39%, дольковая атипическая гиперплазия – в 37%, протоковый рак in situ – в 15%, дольковый рак in situ – в 25%, инвазивный рак – в 1% (44).
Требования EUSOMA (Европейское общество мастологов) по контролю качества при выполнении профилактической мастэктомии направлены на исключение необоснованно предлагаемых операций и минимизацию психологической травмы, связанной с ее выполнением. Пациентка должна быть обследована генетиком, генетический диагноз должен быть подтверждён ДНК-диагностическими методами. Генетик должен изложить варианты дальнейшей тактики: динамическое наблюдение, приём тамоксифена, профилактическая оофорэктомия, профилактическая мастэктомия. Если пациентка выбирает профилактическую мастэктомию, с хирургом-маммологом следует обсудить вариант мастэктомии: подкожная либо кожесохраняющая (то есть с удалением сосково-ареолярного комплекса). Необходима консультация пластического хирурга для выбора варианта реконструкции и сроков проведения реконструкции (45).
Таким образом, генетические подходы к ранней диагностике и профилактике РМЖ объединяют формально-генетические, цитогенетические, молекулярные и клинические методы, направленные на создание специализированного клинико-генетического регистра лиц-носителей патологического генотипа, организацию и координацию мониторинга за состоянием их здоровья, решение морально-этических и юридических проблем, связанных с доклинической диагностикой наследственной предрасположенности к развитию РМЖ, а так же использование лекарственной и хирургической профилактики у таких лиц.
1. Давыдов М.И., Аксель Е.М., В сборнике: «Злокачественные новообразования в России и странах СНГ в 2002г». Москва 2004. с. 110.
2. Albano W, Recabaren J, Lynch H, et al. Natural history of hereditary cancer of the breast and colon. Cancer 1982; 50: 360-363.
3. Любченко Л.Н., Гарькавцева Р.Ф., Поспехова Н.И. и соавт. ДНК-диагностика и медико-генетическое консультирование при наследственной предрасположенности к раку молочной железы. В сборн. «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва 2003, с.44-47.
4. Williams W, Anderson D. Genetic epidemiology of breast cancer analysis of 200 danish pedigrees. Genet. Epidem. 1984; 1: 7-20.
5. Newman B, Austin M, Lee, King M. Inheritance of human breast cancer. Evidence for autosomal dominant transmission in high-risk families. Proc. Nat. Acad. Sci. USA. 1988; 85: 3044-3048.
6. Claus E, Risch N, Thompson W. Genetic analysis of breast cancer in the cancer and steroid hormone study. AM J Hum Genet. 1991; 48: 232.
7. Easton D, Bishop D, Ford D, et al. Genetic linkage analysis in familial breast and ovarian cancer: Results from 214 families. Am J Hum Genet. 1993; 52: 678.
8. Dupont WD, Page DL, Risk faktors for breast cancer in women with proliferative breast disease. N Engl J Med 1985; 312: 146-151.
9. Haagensen CD, Bodian C, Haagensen DE, et al. Breast Canser Risk and Detection. Philadelphia, WB Saunders, 1981: 70-75.
10. Dupont WD, Page DL, Parl FF, et al. Long-term breast cancer risk in women with fibroadenoma. N Engl J Mtd 1994; 331: 10-15.
11. Skolnic MH, Cannon-Albright L.A., Goldar DE. et al. Inheritance of proliferative breast disease in breast cancer kindreds. Science 1990; 250; 1715-1720.
12. Baildam AD The role of bilateral prophylactic mastectomy in women at high risk of breast cancer. Abstract. Familial Breast Cancer Demonstration Project Symposium 1999, Heidelberg, Germany.
13. Cody HS Routine contralateral breast biopsy: helpful or irrelevant? Experience in 871 patients, 1979-1993. Ann Surg 1997; 225: 370-376.
14. Teixeira M. Pandis N., Gerdes L. Breast Cancer Res Treat 1996 38
15. Lalle P, De Latour M, Rio P, et al. Detection of allelic losses on 17q12-q21 chromosomal region in benign lesions and malignant tumors occurring in familial context. Oncogene 1994; 9(2): 437-442.
16. Kasami M, Vnencak-Jones CL, Manning S, et al. Loss of heterozygosity and microsatellite instability in breast hyperplasia. Am J Pathol 1997; 150: 1925-32.
17. Артамонов В.В., Любченко Л.Н., Шабанов М.А. с соавт. Изучение ассоциации полиморфных маркеров генов CYP19 и CYP17 со спорадическим раком молочной железы. Молекулярная биология, Москва 2003, Т.37, N. 6, с. 975-982.
18. Артамонов В.В., Любченко Л.Н., Шабанов М.А. с соавт. Ассоциация полиморфизма NAT2 cо спорадическим раком молочной железы. Молекулярная биология, Москва 2004, Т. 38, N. 3, с. 457-462.
19. Miki Y, Swensen J, Shattuck-Eidens D, et al. A Strong candidate for the breast and ovarian cancer susceptibility gene BRCA 1. Science 1994; 266: 66.
20. Tavtigian SV, Simard J, Rommens J, et al. The complete BRCA 2 gene and mutations in chromosome 13q-linked kindreds. Nat genet 1996; 12: 333.
21. BCLC. Familial Cancer. 2003; v.2 N3-4; p.18-32.
22. Ford D, Easton DF, Stratton M, et al. Breast Cancer Linkage Consortium. Genetic Heterogeneity and Penetrance Analysis of the BRCA1 and BRCA2 Genes in Breast Cancer Families. Am J Hum Genet 1998; 62: 676-689.
23. Карпухин А.В., Поспехова Н.И., Любченко Л.Н., с соавт. Частоты однонуклеотидных полиморфизмов и мутаций в гене BRCA1 при наследственно обусловленном раке молочной железы и/или раке яичников. Доклады Академии Наук (ДАН), Москва 2002, Т.383, N 5, с.1-4.
24. Любченко Л.Н., Гарькавцева Р.Ф., Поспехова Н.И. и соавт. ДНК-диагностика и медико-генетическое консультирование при наследственной предрасположенности к раку молочной железы. В сборн. «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва 2003, с.44-47.
25. Gayther S, et al Frequently occring germline mutations of BRCA 1 gene. Am J Hum Genet 1997; 60: 1013-20.
26. Easton D, Bishop D, Ford D, et al. Genetic linkage analysis in familial breast and ovarian cancer: Results from 214 families. Am J Hum Genet. 1993; 52: 678.
27. Любченко Л.Н., Гарькавцева Р.Ф., Поспехова Н.И. и соавт. ДНК-диагностика и медико-генетическое консультирование при наследственной предрасположенности к раку молочной железы. В сборн. «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва 2003, с.44-47.
28. Lakhani S, Sloane JP, Gusterson Ba, et al. A detailed analysis of the morfological features associated with breast cancer in patients harbouring mutations in BRCA1 and BRCA2 predisposition genes. J Natl Cancer Inst 1999; 90: 1138-1145.
29. Любченко Л.Н. Генодиагностика наследственной предрасположенности к раку молочной железы и разработка системы индивидуального прогнозирования развития, течения и профилактики заболевания. Автореферат канд. дис. Москва 2002.
30. Haffty BG, Harrold E, Khan AJ, Pathare P, Smith TE, Turner BC, Glazer PM, Ward B, Carter D, Matloff E, Bale AE, Alvarez-Franco M. Outcome of conservatively managed early-onset breast cancer by BRCA1/2 status. Lancet 2002 Apr 27;359 (9316):1471-7.
31. L.A.Brinton & S.S.Devesa. Incidence, Demographics, and Enviromental Factors. In: Harris JR, Morrow M, Lippman ME, et al., eds.: Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996, pp 159-168.
32. Wohlfahrt J., Melbye M. Age at any birth is associated with breast cancer risk. Epidemiology, 2001, 12, 1, 68-73.
33. Tavani A, Gallus S, La Vecchia C, Negri E, Montella M, Dal Maso L, Franceschi S Risk factors for breast cancer in women under 40 years. Eur J Cancer, 1999, 35, 9, 1361-1367.
34. Jernstrom H, Lerman C, Ghadirian P, et al. Pregnancy and risk of early breast cancer in carriers of BRCA1 and BRCA2. Lancet, 1999, 354(9193), 1846-1850.
35. Jordan VC. Effect of tamoxifen on initiation and growth of DMBA-induced rat mammary carcinoma. Eur J Cancer 1976; 12: 419-424.
36. Powles T, Eles R, Ashley S, et al. Interim analysis of the incidence of breast cancer in the Royal Marsden Hospital tamoxifen randomized prevention trial. Lancet 1998; 352: 98-101.
37. Veronesi U, Maisonneuve P, Costa A, et al. Prevention of breast cancer with tamoxifen: Preliminary findings from the Italian randomized trial among hysterectomized women. Lancet 1998; 352: 93-97.
38. Fisher B, Constantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast cancer. Report of the National Surgical Adjuvant Breast and Bowel Project P-1 stady. J Natl Cancer Inst 1998; 90: 1371-1388.
39. Rebbeck TR, Lynch HT, Neuhausen SL, Narod SA, Van’t Veer L, Garber JE, Evans G, Isaacs C, Daly MB, Matloff E, Olopade OI, Weber BL; Prevention and Observation of Surgical End Points Study Group. Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 2002 May 23;346(21):1616-22.
40. Hartmann LC, Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, Petty PM, Sellers TA, Johnson JL, McDonnell SK, Frost MH, Jenkins RB Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer. N Engl J Med; 340(2):77-84 1999.
41. McDonnell SK, Schaid DJ, Myers JL, Grant CS, Donohue JH, Woods JE, Frost MH, Johnson JL, Sitta DL, Slezak JM, Crotty TB, Jenkins RB, Sellers TA, Hartmann LC Efficacy of contralateral prophylactic mastectomy in women with a personal and family history of breast cancer J Clin Oncol; 19(19):3938-43 2001
42. Rebbeck TR, Friebel T, Lynch HT, Neuhausen SL, van ‘t Veer L, Garber JE, Evans GR, Narod SA, Isaacs C, Matloff E, Daly MB, Olopade OI, Weber BL.
Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol. 2004 Mar 15;22(6):1055-62.
43. Baildam AD The role of bilateral prophylactic mastectomy in women at high risk of breast cancer. Abstract .Familial Breast Cancer Demonstration Project Symposium 1999, Heidelberg, Germany.
44. Hoogerbrugge N, Bult P, de Widt-Levert LM, Beex LV, Kiemeney LA, Ligtenberg MJ, Massuger LF, Boetes C, Manders P, Brunner HG. High prevalence of premalignant lesions in prophylactically removed breasts from women at hereditary risk for breast cancer. J Clin Oncol 2003 Jan 1;21(1):41-5.
источник
Онкологическое отделение (генетики) РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова проводит молекулярно-генетические исследования для выявления мутаций в генах наследственной предрасположенности к развитию рака молочной железы и яичников:
- молекулярно-генетический анализ мутаций в генах BRCA1 и BRCA2 методом ПЦР;
- молекулярно-генетическое исследование генов BRCA1 и BRCA2 методом секвенирования.
Рак – это распространенное генетическое заболевание, ключевую роль в развитии которого играет повреждение ДНК клетки.
Особой разновидностью онкологических заболеваний являются наследственные формы рака (наследственные опухолевые синдромы), которые характеризуются передачей из поколения в поколение предрасположенности к развитию того или иного вида злокачественной опухоли.
Это связано с наследованием мутантного или «ракового» гена. У лиц, имеющих такое генетическое повреждение, значительно увеличен риск возникновения рака.
Однако, важно иметь в виду, что примерно 30% пациентов с выявленными мутациями могут не иметь семейной истории, так как эти изменения являются мутациями de novo – впервые возникшими.
Наследственный «синдром рака молочной железы/рака яичников» (РМЖ/РЯ) является самой частой разновидностью семейных опухолевых синдромов. На его долю приходится до 5-7% всех случаев рака молочной железы и, как минимум, 15-20% всех случаев рака яичников также можно объяснить наличием генетического дефекта.
Основная часть случаев наследственного «синдрома рака молочной железы/рака яичников» вызвана мутациями в генах BRCA1 (Breast Cancer 1) и BRCA2 (Breast Cancer 2). Эти гены играют ключевую роль в восстановлении поврежденной ДНК, защищая клетку от воздействия канцерогенных факторов внешней среды.
Мутации в генах связаны с повышенным риском возникновения рака молочной железы и рака яичников у женщин. Мужчины с наличием данной мутации также имеют высокий риск развития рака молочной железы и рака предстательной железы. Имеются данные и о повышенном риске возникновения опухолей желудка, поджелудочной железы, органов головы и шеи.
Мутации в генах наследственной предрасположенности могут быть унаследованы как от матери, так и от отца. Эти мутации передаются и мальчикам и девочкам. Вероятность передачи «раковой» мутации составляет 50%, т.е. только в половине случаев Вы можете получить генетический дефект от родителей или передать его детям.
Проведение генетического анализа обязательно для всех пациентов со злокачественной патологией молочных желез, у которых имеются косвенные клинические характеристики семейной формы рака:
- в семье (у ближайших родственников) есть хотя бы еще один случай онкологического заболевания;
- опухоль появилась в раннем возрасте (до 45 лет);
- имеются множественные формы опухолей;
- в семье есть хотя бы еще один случай рака молочной железы у мужчин.
При установлении наследственного характера заболевания у онкологических пациентов может измениться тактика лечения, в частности, объём операции и/или характер назначаемой противоопухолевой терапии.
- Проведение генетического анализа показано всем пациенткам со злокачественным поражением яичников, поскольку при данном заболевании отсутствуют косвенные клинические характеристики семейной формы рака.
- Проведение генетического анализа рекомендовано, если Вы имеете близкого родственника, у которого диагностирован рак молочной железы, рак яичников, опухоли поджелудочной железы, рак желудка, рак предстательной железы, либо другие онкологические заболевания, возникшие в возрасте до 45 лет.
- Проведение генетического анализа необходимо, если в Вашей семье у двух или более родственников были диагностированы онкологические заболевания.
- Проведение генетического анализа крайне важно здоровым родственникам пациентов, у которых выявлена «раковая» мутация. Это позволяет ответить на вопрос, передали ли родители потомству гены с опасными мутациями.
- Проведение генетического анализа вполне обосновано у совершенно здоровых людей, у которых в семье не было случаев злокачественных новообразований — случайное выявление мутаций вполне вероятно.
Своевременное выявление наследственных мутаций у здоровых людей может помощь им принять важные решения, касающиеся сохранения здоровья (выбор профессии, гормональные и репродуктивные факторы, более регулярные обследования, превентивные меры).
Учитывая, что генетическая информация не изменяется на протяжении всей жизни, анализ на наличие мутаций в генах наследственной предрасположенности выполняется только один раз!
Тестирование можно проводить в любом возрасте, но, обычно, не ранее 18 лет.
В случае подтверждения наличия мутации необходимо обратиться к врачу-онкологу и регулярно проходить необходимые в этом случае обследования:
- самообследование молочных желез (с 18 лет, ежемесячно);
- обследование молочных желез у маммолога (с 25 лет, 1 раз в 6 мес.);
- магнитно-резонансная томография молочных желез (с 25-30 лет, 1 раз в 12 мес.);
- маммографическое исследование (с 25 лет, 1 раз в 6-12 мес.);
- трансвагинальное ультразвуковое исследование (с 35 лет, 1 раз в 6 мес.);
- определение уровня маркера СА-125 (с 35 лет, 1 раз в 6 мес.).
- Для проведения молекулярно-генетического анализа необходимо сдать кровь из вены в объеме 1-2 мл в пробирку с ЭДТА (вакутайнер с сиреневой крышкой).
- Для выявления мутаций в генах наследственной предрасположенности используются методы полимеразной цепной реакции (ПЦР) и секвенирования.
Выявление мутаций в генах наследственной предрасположенности у здоровых женщин – это не установление диагноза рака. Это предупреждение женщины о риске развития заболевания в течение жизни, который возрастает до 60-90%.
Тестирование уже известных мутаций в генах BRCA1 и BRCA2 не исключает наличие более редких генетических изменений. Для их выявления используется метод молекулярного секвенирования.
У мужчин с наследственными мутациями также существует риск развития злокачественных новообразований (рака молочной железы, предстательной железы, желудка, поджелудочной железы), поэтому они нуждаются в консультации медицинского генетика и врача-онколога.
Онкологическое отделение (генетики) РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова проводит молекулярно-генетические исследования для выявления мутаций в генах наследственной предрасположенности к развитию рака молочной железы и яичников:
- молекулярно-генетический анализ мутаций в генах BRCA1 и BRCA2 методом ПЦР;
- молекулярно-генетическое исследование генов BRCA1 и BRCA2 методом секвенирования.
источник
Этиология и встречаемость наследственного рака молочной железы и яичников. Мутации основных генов предрасположенности к опухолям составляют от 3 до 10% случаев рака груди и имеют предполагаемую распространенность от 1 на 300 до 1 на 800. Два таких гена — BRCA1 и BRCA2.
В общей популяции Северной Америки распространенность мутаций в гене BRCA1 — от 1 на 500 до 1 на 1000; распространенность мутаций в гене BRCA2 приблизительно в два раза выше. Тем не менее существуют значимые различия в этническом распределении патогенных мутаций среди семей с двумя или более случаев опухолей груди и/или яичника.
Мутации BRCA1 или BRCA2 вызывают приблизительно 70-80% семейного рака груди, но только небольшую долю рака груди в целом.
Гены BRCA1 и BRCA2 кодируют повсеместно экспрессируемые ядерные белки. Полагают, что они поддерживают целостность генома, регулируя репарацию ДНК, транскрипционную трансактивизацию и клеточный цикл.
Несмотря на повсеместную экспрессию BRCA1 и BRCA2, мутация этих генов предрасполагает преимущественно к новообразованиям молочных желез и яичников. Утрата функции BRCA1 или BRCA2, вероятно, приводит к накоплению других мутаций, уже непосредственно ответственных за новообразования. В соответствии с этой гипотезой, карциномы груди и яичников у больных с мутациями BRCA1 или BRCA2 имеют хромосомную нестабильность и частые мутации в других генах-супрессорах опухолевого роста.
Образование опухолей у носителей мутаций BRCA1 или BRCA2 в половых клетках соответствует «двухударной» гипотезе; т.е. в клетках опухоли оба аллеля гена BRCA1 или BRCA2 теряют функцию. Соматическая потеря функции вторым аллелем происходит при потере гетерозиготности, внутригенной мутации или гиперметилировании промотора. Из-за высокой частоты утраты функции вторым аллелем генов BRCA1 или BRCA2 семьи несущие мутации BRCA1 или BRCA2 проявляют аутосомно-доминантное наследование новообразований.
Популяционная распространенность наследуемых мутаций генов BRCA1 или BRCA2 сильно варьирует и часто демонстрирует эффект родоначальника. В Исландии мутация BRCA2 999del5 встречается в специфическом гаплотипе и имеет распространение 0,6%. Среди евреев ашкенази мутации BRCA1 185delAG и 5382insC и мутация BRCA2 6174delT также встречаются в специфических гаплотипах и имеют распространенность 1; 0,4 и 1,2% соответственно.
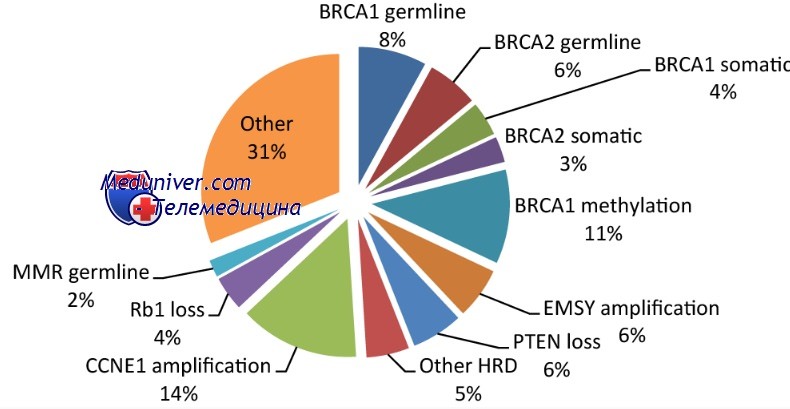
Пациенты с наследуемыми мутациями генов BRCA1 или BRCA2 имеют повышенный риск развития нескольких типов опухолей. Кроме повышенного риска рака молочной железы и яичников у женщин, мутации BRCA1 вызывают повышенный риск рака простаты и, возможно, опухоли кишечника. Аналогично, кроме женского рака груди и яичников, мутации гена BRCA2 увеличивают риск рака простаты, поджелудочной железы, желчных протоков, желчного пузыря и мужского рака груди.
Среди носительниц наследуемых мутаций генов BRCA1 или BRCA2 общую пенетрантность рака молочной железы, яичников или и того и другого оценивают приблизительно в 50-80% для мутаций BRCA1 и несколько меньше для мутаций BRCA2 (40% для рака груди и 10% для опухоли яичников). Приблизительно две трети семей с анамнезом рака молочной железы и яичников у женщин передают мутацию в гене BRCA1, тогда как приблизительно две трети семей с наличием в анамнезе мужского и женского рака молочной железы имеют мутацию в гене BRCA2.
Особенности фенотипических проявлений наследственного рака молочной железы и яичников:
• Возраст начала: зрелость
• Рак молочной железы
• Опухоли яичников
• Опухоли простаты
• Многочисленные первичные опухоли
Текущие рекомендации для женщин с наследуемыми мутациями в генах BRCA1 или BRCA2 включают частые осмотры груди и яичников, включая визуализационные исследования. Оказание помощи мужчинам группы риска включает частые обследования простаты и молочных желез и лабораторные тесты для подтверждения опухоли простаты. В семьях с известными мутациями молекулярный анализ помогает сфокусировать наблюдение или профилактику на носителях мутации.
Полная двусторонняя мастэктомия может уменьшить риск рака молочных желез более чем на 90%, хотя полностью риск не устраняется, поскольку часто остается некоторое количество железистой ткани. Аналогично двусторонняя сальпингоофорэктомия может снизить риск опухоли яичников более чем на 90%.
Женский пол, возраст и семейный анамнез — наиболее важные факторы риска рака молочных желез. В популяциях западных стран совокупная встречаемость женского рака молочной железы — 1 на 200 в 40 лет, 1 на 50 в 50 лет и 1 на 10 к 70 годам жизни. Если пациенты имеют родственников первой степени родства с раком груди, возникшим после 55 лет, их риск возрастает в 1,6 раза относительно возрастного риска, тогда как относительный риск возрастает в 2,3 раза, если рак груди развился у одного из членов семьи ранее 55 лет, и в 3,8 раза, если ранее 45 лет.
Если родственник первой степени родства имел двусторонний рак молочной железы, относительный риск возрастает в 6,4 раза.
Дети пациентки с наследуемой мутацией в генах BRCA1 или BRCA2 имеют 50% риск унаследовать эту мутацию.
Вследствие неполной пенетрантности и переменной экспрессивности точно предсказать факт развития или возраст появления опухоли невозможно.
Пример наследственного рака молочной железы и яичников. С.М., 25-летняя прежде здоровая женщина, направлена в клинику онкогенетики ее гинекологом, после того как у нее диагностирован рак груди. Она была обеспокоена риском развития опухолей у ее детей и собственным риском развития рака яичников. Ее мать, две тетки по матери и дед по матери имели рак груди; у ее матери также была опухоль яичников.
Генетический консультант объяснил, что семейная история рака груди свидетельствует об унаследованной склонности, и вычислил, что риск у пробанда оказаться носительницей мутации предрасположенности к раку груди в генах BRCA1 или BRCA2 значительно выше порогового для направления на секвенирование гена. На основе последующего обсуждения прогноза и рисков повторения СМ. решила сделать секвенирование генов BRCA1 и BRCA2.
Исследование показало, что у нее мутация преждевременного завершения считывания в одном аллеле BRCA2, которая ранее была описана у других пациентов с ранним раком груди. При обсуждении полученных результатов СМ. захотела обследовать своих дочерей 6 и 7 лет. Генетический консультант объяснил, что, поскольку мутация приводит лишь к незначительному риску в детстве, решение провести генетическое тестирование лучше оставить до того времени, когда дети будут достаточно зрелыми, чтобы самим принять решение о полезности такого исследования, и пациентка согласилась с этим доводом.
Пять взрослых родственников захотели провести тестирование, и четверо из них, включая одного мужчину, оказались носителями мутации; одна из них, женщина, решила провести профилактическую двустороннюю мастэктомию; также со всеми носителями мутации обсужден риск опухолей другой локализации.
источник
Наследственный рак молочной железы — это ее злокачественная опухоль из эпителиальных клеток, возникновение которой вызвано генетической мутацией. Отмечается повышенный риск образования этой опухоли у кровных родственников.
Многие характеристики наследственного рака молочной железы похожи на характеристики других злокачественных новообразований. Но также отмечаются некоторые особенности данной опухоли – это более раннее начало, высокая частота двухсторонних поражений и частое сочетание с опухолями, которые развиваются в других органах и тканях.
В диагностике патологии должны учитываться семейная история и результаты молекулярно-генетического анализа.
Суть наследственного рака молочной железы – его возникновение из-за генетической мутации, которая передается из поколения в поколение. Практически у всех злокачественных новообразований установлен наследственный компонент – но наследственный рак молочной железы входит в число наиболее распространенных наследственных форм рака.
В структуре всех новообразований молочной железы на данное заболевание приходится от 5 до 10% всех диагностированных клинических случаев.
От других злокачественных новообразований молочной железы патология отличается тем, что очень часто имеет раннее начало – первые признаки появляются у женщин в возрасте до 50 лет. Чаще всего заболевание диагностируется у женщин в возрасте от 55 до 60 лет.
В зависимости от регионов распространенность двухстороннего поражения молочных желез при описываемом заболевании составляет от 5-20 до 60%.
В отличие от максимального большинства добро- и злокачественных новообразований, причины которых не установлены по сей день, факторы возникновения наследственного рака молочной железы известны – это перестройки в наборе генов. Выявлен целый ряд генетических мутаций, при развитии которых увеличивается вероятность возникновения рака молочной железы. Чаще всего при этой патологии выявляются мутации генов под кодовым названием BRCA1 и BRCA2.
Благодаря выявлению мутаций стало возможным проводить диагностику наследственного рака молочной железы на ранних этапах его развития. Но исследования продолжаются – генные мутации, которые удалось изучить на сегодняшний день, провоцируют развитие описываемого заболевания всего у 20-30% пациенток с семейными случаями рака молочной железы. У остальных больных возникновение этой злокачественной патологии провоцируется другими разновидностями генных мутациями – к тому же, установлено, что у жительниц разных регионов планеты описываемая патология возникает из-за разных генетических мутаций.
Из-за генных мутаций наряду с повышенным риском развития наследственного рака молочной железы у женщины увеличивается вероятность возникновения других злокачественных новообразований – и не только гинекологической сферы (о локализации поражений будет сказано ниже).
Также изучен целый ряд факторов, на фоне которых риск возникновения наследственного рака молочной железы у носительниц мутировавших генов возрастает. Это такие группы факторов, как:
- особенности гинекологического анамнеза;
- длительный прием некоторых медицинских препаратов;
- эндокринные нарушения;
- патологии обмена;
- некоторые сердечно-сосудистые заболевания;
- вредные привычки;
- наличие доброкачественных пролиферативных изменений ткани молочной железы;
- некоторые патологии женских половых органов.
Из всех особенностей гинекологического анамнеза на повышенный риск возникновения наследственного рака молочной железы указывают:
- раннее менархе – первое менструальное кровотечение. Данный фактор очень часто выявляется при сборе анамнеза у пациенток, у которых был диагностирован наследственный рак молочной железы;
- позднее начало климакса – периода жизни, во время которого наблюдается изменение деятельности половых желез у женщин, связанное с приближением старости и инволютивными (связанными с угасанием) изменениями в половых железах;
- отсутствие в анамнезе беременностей и родов.
Установлено, что риск «реализации» дефектных гормонов и развития наследственного рака молочной железы, связанный с приемом медицинских средств, больше всего возрастает при длительном приеме гормональных препаратов.
Эндокринные нарушения, на фоне которых вероятность возникновения описываемой патологии возрастает, это чаще всего:
- сахарный диабет – нарушение обмена углеводов, которое возникает из-за стойкой нехватки в организме инсулина;
- гипотиреоз – недостаточный синтез гормонов щитовидной железы;
- гипертиреоз – чрезмерная выработка гормонов щитовидной железы;
- недостаточность коры надпочечников.
Из всех патологий обмена чаще всего фактором риска возникновения описываемой патологии является ожирение – отложение избыточного жира в организме, которое связано с избыточным поглощением пищи, пониженным расходом энергии, а также с некоторыми нарушениями со стороны организма (в частности, гормональными).
Сердечно-сосудистые заболевания, которые чаще всего провоцируют возникновение описываемой патологии, это:
- гипертоническая болезнь– стойкое повышение артериального давления;
- ишемическая болезнь сердца (ИБС) – кислородное голодание сердца по причине патологии коронарных сосудов, которые обеспечивают его кровоснабжение.
Из вредных привычек больше всего в свете возникновения наследственного рака молочной железы следует остерегаться:
- курения. Заболеть описываемой патологией рискуют не только заядлые курильщицы со стажем, но и женщины, которые, по их словам, «просто балуются сигареткой» – выкуривают не больше 1-2 сигарет в день или за несколько дней, но при этом курят регулярно. С другой стороны, риск возникновения наследственного рака молочной железы у таких женщин возрастает с увеличением стажа курения;
- злоупотребления алкоголем.
Доброкачественными пролиферативными изменениями ткани молочной железы, которые выступают фактором риска возникновения описываемой патологии, являются:
- мастопатии – морфологическое поражение молочных желез, возникновение и развитие которого связано с нарушением гормонального баланса (в частности, со стороны женских половых гормонов);
- доброкачественные опухоли.
Практически все мастопатии являются фактором риска, на фоне которого возрастает возможность заболевания наследственным раком молочной железы. Это мастопатии:
- аденозные (железистые);
- фиброаденозные (железисто-соединительнотканные);
- фиброкистозные (соединительнотканные с наличием кист);
- узловые
Наследственный рак молочной железы более «охотно» возникает на фоне практически всех известных опухолей молочной железы – это:
- липомы – жировые опухоли;
- фибромы – соединительнотканные опухоли
Выявлено, что данная болезнь чаще возникает у женщин, у которых были диагностированы некоторые заболевания женских половых органов – а именно:
- аднексит – воспалительное поражение яичника;
- кисты яичника;
- фиброма – доброкачественная опухоль
Необходимо помнить, что при наличии одной близкой родственницы, у которой был выявлен наследственный рак молочной железы, риск развития этой опухоли у других членов семьи женского рода возрастает в два раза. Если в семье было выявлено две больные, то риск развития описываемой патологии увеличивается в пять раз. Вероятность развития наследственного рака молочной железы увеличиваются еще больше, если у одной или более родственниц первые признаки заболевания появились в возрасте до 50 лет.
Также следует иметь в виду, что при возникновении наследственного рака молочной железы высокой является вероятность ракового поражения у женщины других органов и тканей – чаще всего это:
- яичники;
- эндометрий (внутренняя оболочка матки);
- толстый кишечник;
- желудок;
- поджелудочная железа;
- мочевой пузырь;
- кожа (в частности, развивается меланома кожи).
Это значит, что при выявлении описываемого заболевания необходимо в обязательном порядке обследовать все упомянутые органы.
При развитии наследственного рака молочной железы чаще всего увеличивается риск формирования рака яичников, на втором месте по заболеваемости – злокачественные новообразования эндометрия. Более низким при наличии наследственного рака молочной железы является риск злокачественного перерождения тканей тех органов, которые не относятся к женской репродуктивной системе.
Ранние стадии наследственного рака молочной железы характеризуются бессимптомным течением. Довольно редко в начале заболевания могут появляться:
- болевые ощущения в молочных железах (зачастую наблюдаются при наличии той или иной формы мастопатии);
- боли в животе во время менструации. Появляются у тех женщин, у которых раньше альгоменорея (боли при месячных) не появлялась, и усиливаются у тех пациенток, которые ранее уже жаловались на такие боли внизу живота.
Зачастую женщина выявляет у себя опухолевое образование раньше, чем появляется полноценная развернутая клиническая картина патологии. Опухоль в таких случаях определяется:
- случайно – при проведении гигиенических процедур или во время обследования в клинике (профилактического либо по поводу другого заболевания). Упоминаются случаи, когда наличие опухолевого образования у женщин случайно выявляли их половые партнеры;
- во время целенаправленного самостоятельного смотра, рекомендуемого маммологами и гинекологами.
Характеристики опухоли:
- по форме – в виде узла;
- по расположению – может находиться в разных отделах молочной железы;
- по размеру – 1 см в диаметре и больше;
- по консистенции – средней плотности;
- по чувствительности – на ранних этапах узел является слегка чувствительным, на поздних – болезненным.
При дальнейшем прогрессировании наследственный рак молочной железы проявляется такой клинической симптоматикой, как:
- выделения из соска;
- увеличение лимфатических узлов;
- изменение кожи над опухолью;
- деформация молочной железы;
- симптом лимонной корки;
- изъязвление тканей;
- признаки нарушения со стороны общего состояния организма.
Характеристики выделений из соска:
- по количеству – скудные;
- по цвету – беловатые или бесцветные;
- по прозрачности – прозрачные;
- по запаху – без особенностей.
При развитии заболевания наблюдается увеличение подмышечных лимфатических узлов со стороны пораженной молочной железы. Поражение лимфоузлов с другой стороны возможно при дальнейшем прогрессировании и появлении в них метастазов.
Изменения кожных покровов, покрывающих опухоль, следующие:
- появляется и усиливается морщинистость кожи;
- развивается умбиликация – втягивание кожи над опухолью;
- появляется симптом площадки – участок тканей молочной железы над опухолью становится плоским, словно площадка.
Деформация молочной железы и симптом лимонной корки (кожа молочной железы становится похожей на шкурку лимона) появляются на более поздних этапах развития патологии, также возможно изъязвление в виде дефектов кожных покровов над опухолью.
Признаки нарушения со стороны общего состояния организма появляются на более поздних стадиях. Их развитие связано с попаданием в кровоток продуктов жизнедеятельности опухолевых клеток и продуктов распада погибших клеток. Такими признаками являются:
- ухудшение трудоспособности – как физической, так и умственной;
- общие слабость и вялость;
- постоянное недомогание;
- отвращение к мясной пище;
- ухудшение аппетита, а далее – и его полное отсутствие;
- гипертермия – повышение температуры тела. Зачастую температура достигает субфебрильных цифр – 37,3-37,5 градусов по Цельсию. Температура может подниматься до более высоких цифр при присоединении инфекционных осложнений наследственного рака молочной железы.
На поздних стадиях описываемой патологии также появляются признаки нарушения функций тех органов, которые были поражены раковыми метастазами.
При разных генетических мутациях течение наследственного рака молочной железы может отличаться:
- опухоли, которые образуются у женщин-носительниц гена BRCA1, имеют высокую степень злокачественности;
- течение рака, связанного с мутациями BRCA2, более благоприятное.
Особенностями данного заболевания независимо от того, какие генные мутации его вызвали, являются:
- высокая вероятность возникновения контралатеральных поражений – то есть, возникновения опухоли в другой молочной железе. Этот риск более высокий, чем при заболевании спорадическим (обычным) раком молочной железы;
- высокая вероятность рецидивов рака в одной и той же молочной железе после того, как были проведены так называемые органосохраняющие операции – то есть, удаление пораженных раком тканей и сохранение молочной железы.
Для понимания склонности наследственного рака молочной железы к рецидивам приведем статистику: обычный рак молочной железы рецидивирует в 1-1,5% случаев в течение года, при наследственной форме раке железы контралатеральные опухоли выявляются у 42% пациенток, ипсилатеральные (в той же молочной железе, где изначально возник рак) – у 49%.
Диагноз наследственного рака молочной железы ставят, опираясь на жалобы больных, анамнез (историю) заболевания, результаты дополнительных методов исследования – физикальные, инструментальные, лабораторные. Особенно важными в диагностике являются:
- семейный анамнез – выявление заболевания у кровных родственников (бабушки, мамы, родных сестер);
- результаты молекулярно-генетических исследований.
Генетическое обследование не является массовым из-за его сложности и дороговизны, поэтому в диагностике наследственного рака молочной железы привлекается в случае, если были выявлены семейно-анамнестические признаки описываемого заболевания, а именно:
- наличие патологии у близких родственников;
- раннее начало;
- высокая частота двухстороннего поражения молочных желез.
Инструментальные методы обследования, которые применяются в диагностике наследственного рака молочной железы, следующие:
- маммография – ряд инструментальных методов для комплексного обследования молочной железы;
- дуктография – рентгенологическое исследование молочной железы после введения в ее протоки контрастного вещества;
- биопсия молочной железы – делают забор фрагментов подозрительных тканей с их последующим изучением под микроскопом.
При проведении маммографии привлекаются такие методы обследования, как:
- рентгеновская маммография;
- ультразвуковая маммография – при ее помощи можно выявить опухолевый узел, установить его размер и форму, оценить состояние окружающих тканей;
- томосинтез – это создание двухмерного изображения молочной железы, на котором обнаруживают опухолевое образование;
- магнитно-резонансная (МРТ-) маммография – методика получения томографического изображения молочной железы;
- оптическая маммография – исследование молочной железы при помощи специального оптического оборудования.
Для выявления отдаленных метастазов применяются такие инструментальные методы диагностики, как:
- рентгенография грудной клетки – при помощи рентгенологических снимков можно выявить метастатические очаги в легочной паренхиме;
- сцинтиграфия всего скелета – в организм вводят радионуклидные препараты, излучение которых затем фиксируют при помощи специальной гамма-камеры, полученную цветную картинку анализируют на предмет изменений;
- ультразвуковое исследование печени (УЗИ) – эхо-исследование паренхимы печени;
- магнитно-резонансная томография головного мозга (МРТ).
Лабораторные методы, применяемые в диагностике описываемого заболевания, это:
- общий анализ крови – при раке существенно повышается СОЭ;
- гистологическое исследование – изучение биоптата на предмет строения тканей;
- цитологическое исследование – изучение биоптата на наличие опухолевых клеток.
Дифференциальную (отличительную) диагностику наследственного рака молочной железы чаще всего проводят с такими патологиями, как:
- спорадический (обычный) рак молочной железы – злокачественное новообразование, формирующееся из эпителиальных клеток;
- доброкачественные опухоли железы;
- абсцесс – ограниченный гнойник;
- туберкулезный очаг.
Наиболее частыми осложнениями, которые сопровождают наследственный рак молочной железы, являются:
- абсцесс молочной железы – ограниченный гнойник, который развивается при присоединении инфекционного агента;
- флегмона молочной железы – разлитое гнойное поражение, которое развивается по тем же причинам, что и абсцесс молочной железы;
- прорастание опухоли в соседние структуры – в частности, в грудную стенку, плевру и паренхиму легких;
- метастазирование – перемещение клеток опухоли по кровеносному или лимфатическому руслу в другие органы и ткани с образованием вторичных метастатических злокачественных опухолей;
- раковая интоксикация – отравление организма продуктами жизнедеятельности клеток опухоли, а также продуктами их распада. Наблюдается на поздних стадиях заболевания;
- раковая кахексия – истощение больной, которое наблюдается на поздних стадиях ракового процесса и обусловлено нарушением работы органов, в которые метастазировала опухоль, а также раковой интоксикацией.
Пациентки с наследственным раком молочной железы проходят лечение у онколога и маммолога. Методами лечения этой патологии являются:
- химиотерапия;
- лучевая терапия;
- хирургическое лечение.
Ранее наследственный рак молочной железы лечили теми же методами, что и спорадический – сейчас методики изменены исходя из того, что чувствительность наследственного рака молочной железы к определенным химиопрепаратам может быть иная, чем чувствительность спорадического рака.
В связи со склонностью наследственного рака молочной железы к рецидивам показана радикальная мастэктомия – удаление всей молочной железы, после чего подбирается ее протез.
В основе профилактики наследственного рака молочной железы – следующие меры и действия:
- прием гормональных препаратов исключительно под контролем врача;
- профилактика эндокринных заболеваний, болезней обмена, сердечно-сосудистых патологий, мастопатий и доброкачественных опухолей молочных желез, заболеваний женской половой сферы, а при их возникновении – своевременное выявление и адекватное лечение;
- отказ от вредных привычек;
- регулярные самоосмотры;
- регулярные профилактические осмотры у маммолога, проведение маммографии не реже, чем 1 раз в год;
- здоровый образ жизни – сбалансированное питание, правильный режим труда, отдыха, сна, половой жизни, избегание стрессов и психоэмоционального перенапряжения, занятия физкультурой.
При высоком риске развития данной формы онкопатологии выполняют профилактическую двухстороннюю мастэктомию, в ряде случаев – в сочетании с оофорэктомией (удалением яичников).
Прогноз при наследственном раке молочной железы сложный – в первую очередь, из-за склонности опухоли к рецидивам. Увеличения длительности жизни можно добиться при помощи радикальной операции – удаления молочной железы.
Ковтонюк Оксана Владимировна, медицинский обозреватель, хирург, врач-консультант
2,806 просмотров всего, 1 просмотров сегодня
источник