Этиология и встречаемость наследственного рака молочной железы и яичников. Мутации основных генов предрасположенности к опухолям составляют от 3 до 10% случаев рака груди и имеют предполагаемую распространенность от 1 на 300 до 1 на 800. Два таких гена — BRCA1 и BRCA2.
В общей популяции Северной Америки распространенность мутаций в гене BRCA1 — от 1 на 500 до 1 на 1000; распространенность мутаций в гене BRCA2 приблизительно в два раза выше. Тем не менее существуют значимые различия в этническом распределении патогенных мутаций среди семей с двумя или более случаев опухолей груди и/или яичника.
Мутации BRCA1 или BRCA2 вызывают приблизительно 70-80% семейного рака груди, но только небольшую долю рака груди в целом.
Гены BRCA1 и BRCA2 кодируют повсеместно экспрессируемые ядерные белки. Полагают, что они поддерживают целостность генома, регулируя репарацию ДНК, транскрипционную трансактивизацию и клеточный цикл.
Несмотря на повсеместную экспрессию BRCA1 и BRCA2, мутация этих генов предрасполагает преимущественно к новообразованиям молочных желез и яичников. Утрата функции BRCA1 или BRCA2, вероятно, приводит к накоплению других мутаций, уже непосредственно ответственных за новообразования. В соответствии с этой гипотезой, карциномы груди и яичников у больных с мутациями BRCA1 или BRCA2 имеют хромосомную нестабильность и частые мутации в других генах-супрессорах опухолевого роста.
Образование опухолей у носителей мутаций BRCA1 или BRCA2 в половых клетках соответствует «двухударной» гипотезе; т.е. в клетках опухоли оба аллеля гена BRCA1 или BRCA2 теряют функцию. Соматическая потеря функции вторым аллелем происходит при потере гетерозиготности, внутригенной мутации или гиперметилировании промотора. Из-за высокой частоты утраты функции вторым аллелем генов BRCA1 или BRCA2 семьи несущие мутации BRCA1 или BRCA2 проявляют аутосомно-доминантное наследование новообразований.
Популяционная распространенность наследуемых мутаций генов BRCA1 или BRCA2 сильно варьирует и часто демонстрирует эффект родоначальника. В Исландии мутация BRCA2 999del5 встречается в специфическом гаплотипе и имеет распространение 0,6%. Среди евреев ашкенази мутации BRCA1 185delAG и 5382insC и мутация BRCA2 6174delT также встречаются в специфических гаплотипах и имеют распространенность 1; 0,4 и 1,2% соответственно.
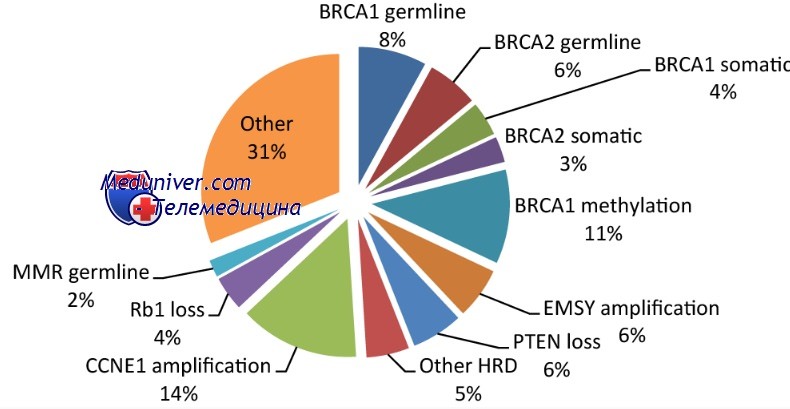
Пациенты с наследуемыми мутациями генов BRCA1 или BRCA2 имеют повышенный риск развития нескольких типов опухолей. Кроме повышенного риска рака молочной железы и яичников у женщин, мутации BRCA1 вызывают повышенный риск рака простаты и, возможно, опухоли кишечника. Аналогично, кроме женского рака груди и яичников, мутации гена BRCA2 увеличивают риск рака простаты, поджелудочной железы, желчных протоков, желчного пузыря и мужского рака груди.
Среди носительниц наследуемых мутаций генов BRCA1 или BRCA2 общую пенетрантность рака молочной железы, яичников или и того и другого оценивают приблизительно в 50-80% для мутаций BRCA1 и несколько меньше для мутаций BRCA2 (40% для рака груди и 10% для опухоли яичников). Приблизительно две трети семей с анамнезом рака молочной железы и яичников у женщин передают мутацию в гене BRCA1, тогда как приблизительно две трети семей с наличием в анамнезе мужского и женского рака молочной железы имеют мутацию в гене BRCA2.
Особенности фенотипических проявлений наследственного рака молочной железы и яичников:
• Возраст начала: зрелость
• Рак молочной железы
• Опухоли яичников
• Опухоли простаты
• Многочисленные первичные опухоли
Текущие рекомендации для женщин с наследуемыми мутациями в генах BRCA1 или BRCA2 включают частые осмотры груди и яичников, включая визуализационные исследования. Оказание помощи мужчинам группы риска включает частые обследования простаты и молочных желез и лабораторные тесты для подтверждения опухоли простаты. В семьях с известными мутациями молекулярный анализ помогает сфокусировать наблюдение или профилактику на носителях мутации.
Полная двусторонняя мастэктомия может уменьшить риск рака молочных желез более чем на 90%, хотя полностью риск не устраняется, поскольку часто остается некоторое количество железистой ткани. Аналогично двусторонняя сальпингоофорэктомия может снизить риск опухоли яичников более чем на 90%.
Женский пол, возраст и семейный анамнез — наиболее важные факторы риска рака молочных желез. В популяциях западных стран совокупная встречаемость женского рака молочной железы — 1 на 200 в 40 лет, 1 на 50 в 50 лет и 1 на 10 к 70 годам жизни. Если пациенты имеют родственников первой степени родства с раком груди, возникшим после 55 лет, их риск возрастает в 1,6 раза относительно возрастного риска, тогда как относительный риск возрастает в 2,3 раза, если рак груди развился у одного из членов семьи ранее 55 лет, и в 3,8 раза, если ранее 45 лет.
Если родственник первой степени родства имел двусторонний рак молочной железы, относительный риск возрастает в 6,4 раза.
Дети пациентки с наследуемой мутацией в генах BRCA1 или BRCA2 имеют 50% риск унаследовать эту мутацию.
Вследствие неполной пенетрантности и переменной экспрессивности точно предсказать факт развития или возраст появления опухоли невозможно.
Пример наследственного рака молочной железы и яичников. С.М., 25-летняя прежде здоровая женщина, направлена в клинику онкогенетики ее гинекологом, после того как у нее диагностирован рак груди. Она была обеспокоена риском развития опухолей у ее детей и собственным риском развития рака яичников. Ее мать, две тетки по матери и дед по матери имели рак груди; у ее матери также была опухоль яичников.
Генетический консультант объяснил, что семейная история рака груди свидетельствует об унаследованной склонности, и вычислил, что риск у пробанда оказаться носительницей мутации предрасположенности к раку груди в генах BRCA1 или BRCA2 значительно выше порогового для направления на секвенирование гена. На основе последующего обсуждения прогноза и рисков повторения СМ. решила сделать секвенирование генов BRCA1 и BRCA2.
Исследование показало, что у нее мутация преждевременного завершения считывания в одном аллеле BRCA2, которая ранее была описана у других пациентов с ранним раком груди. При обсуждении полученных результатов СМ. захотела обследовать своих дочерей 6 и 7 лет. Генетический консультант объяснил, что, поскольку мутация приводит лишь к незначительному риску в детстве, решение провести генетическое тестирование лучше оставить до того времени, когда дети будут достаточно зрелыми, чтобы самим принять решение о полезности такого исследования, и пациентка согласилась с этим доводом.
Пять взрослых родственников захотели провести тестирование, и четверо из них, включая одного мужчину, оказались носителями мутации; одна из них, женщина, решила провести профилактическую двустороннюю мастэктомию; также со всеми носителями мутации обсужден риск опухолей другой локализации.
источник
Цена исследования 42000 руб.
Срок выполнения
35 раб.дн.
Записаться на исследование
+7 (495) 150-66-47
Исследуем: 20 генов
Панель «Наследственный рак молочной железы и яичников» предназначена для выявления врождённых патогенных мутаций в генах, ассоциированных с наследственными опухолевыми поражениями этих органов. 5-10% онкологических заболеваний молочных желёз и 15-25% опухолей яичников являются генетически детерминированными, т.е. обусловлены наличием мутаций в генах, связанных с развитием опухоли.
Применение этой панели показано следующим группам:
Здоровым женщинам с семейной историей онкологических заболеваний (например, при наличии трёх и более случаев рака молочной железы в семье в одной линии).
Здоровым женщинам без семейной истории онкологических поражений этих органов тест может дать важную информацию о генетической предрасположенности к онкологическим заболеваниям такого профиля, поскольку человек может быть носителем новых мутаций, которых нет у родителей. Кроме того, наследственный рак может наследоваться от здоровых носителей мутаций. При этом ранее в семье могло не быть случаев рака, но у данной конкретной пациентки будет присутствовать новая комбинация онкогенных мутаций, унаследованных от обоих родителей-носителей, которая может вызвать рак.
Пациенткам с диагностированным раком молочной железы или яичников в случае подозрения на наследственную природу заболевания, например,
- в случае отягощённого семейного анамнеза,
- в случае относительно раннего (до 45 лет) возраста развития рака,
- всем пациенткам с раком яичников,
- при определённых типах опухолей молочной железы (например, пациенткам моложе 60 лет с тройным негативным фенотипом),
- при наличии двух и более первичных очагов опухоли (например, опухоли обеих молочных желёз) либо нескольких первичных типов рака (например, рак молочной железы и рак поджелудочной железы) у одной пациентки,
- беременным пациенткам,
- пациентам-мужчинам с раком молочной железы.
У этой группы пациентов поиск мутации может быть необходим для выбора тактики лечения и назначения определённой таргетной терапии (например, в случае наличия мутаций в генах BRCA 1/2 может быть назначен препарат олапариб). Таргетная терапия направленно блокирует рост клеток опухоли, прицельно нарушая реализацию действия конкретных молекул, необходимых для опухолевого роста и развития онкологического процесса.
Конечная цель исследования – полная информация о мутациях, связанных с наследственными формами рака молочной железы и яичников, интерпретированная специалистом с точки зрения клинической значимости.
Гены, включенные в панель (на основе рекомендаций Национальной онкологической сети США, NCCN ):
ATM, BARD1, BRCA1, BRCA2, BRIP1, CDH1, CHEK2, EPCAM, MLH1, MSH2, MSH6, NBN, NF1, PALB2, PMS2, PTEN, RAD51C, RAD51D, STK11, TP53
Материал для исследования – венозная кровь, взятая в специальную пробирку.
Кровь можно сдать в лаборатории Genetico либо по месту жительства. Наша логистическая служба доставит биоматериал из любой точки России до места проведения исследования.
Метод исследования – высокопроизводительное секвенирование ДНК нового поколения (next generation sequencing , NGS ). Секвенирование, то есть определение последовательности нуклеотидов ДНК, относится к высокоточным методам молекулярного анализа.
Мы проводим исследование и формируем итоговое заключение в течение 35 рабочих дней.
Сроки могут показаться внушительными, но это не так. Это самая высокая скорость на рынке для исследований такого объёма, проводимых с использованием технологии NGS .
35 рабочих дней нужны для выполнения многоступенчатого исследования, включающего в себя большое количество лабораторных этапов и этапов промежуточного контроля качества. В результате получается большой массив данных, требующих анализа и интерпретации с помощью методов биоинформатики, на что тоже необходимо время.
Заключение содержит описание результатов исследования и представляет их следующим образом:
- в случае здорового человека – список патогенных и вероятно патогенных мутаций, их описание и интерпретация. Мутации с неизвестным клиническим значением в заключение не выносятся в связи с серьёзными сложностями их дальнейшей клинической интерпретации у здорового человека и низкой информативностью для дальнейших диагностических мероприятий.
- в случае пациентов с диагностированным раком – список патогенных, вероятно патогенных мутаций и мутаций с неизвестным клиническим значением, их описание и интерпретация.
Заключение отправляется заказчику исследования по электронной почте. Если есть необходимость получить заключение в бумажном варианте, мы отправим его в любой регион почтой России без дополнительных расходов для заказчика.
В итоге после выполнения панели исследований, анализа полученных данных и оформления заключения врач получит информацию о наличии мутаций, ассоциированных с наследственными формами рака молочной железы и яичников и наследственными опухолевыми синдромами, ассоциированными с повышенным риском развития опухолевых поражений этих органов. В случае обнаружения мутаций возможны следующие варианты дальнейших действий:
- обсуждение выявленных мутаций с врачом-генетиком (возможно онлайн) с целью клинической интерпретации полученных результатов;
- обсуждение с врачом-онкологом плана профилактических (УЗИ, маммография, МРТ и т.д.) и превентивных (мастэктомия, сальпинго-оофорэктомия) лечебно-диагностических мероприятий у здоровых пациенток;
- обследование ближайших кровных родственников на наличие мутации для выявления носительства методом секвенирования по Сэнгеру;
- обсуждение с врачом-генетиком возможностей планирования беременности для рождения здорового потомства (пренатальная диагностика, ПГД) у пациентов детородного возраста;
- уточнение диагноза и прогноза у пациентов с диагностированным раком;
- выбор стратегии и тактики лечения, в т.ч. назначение таргетной терапии у пациентов с диагностированным раком.
При этом у здоровых женщин появится возможность ранней диагностики опухолевого процесса или даже предотвращения развития рака, обусловленного наличием единичной мутации или множественных мутаций, а у пациентов с уже диагностированным раком в случае выявления мутаций может быть выработана тактика направленного лечения.
Стоимость панели составляет 42 000 рублей, это минимальная цена для исследования такого уровня и такого охвата. При этом мы берём на себя все возможные логистические издержки (доставку биоматериала из других городов, отправку заключений).
Если вы хотите определить предрасположенность к наследственным формам рака, но не знаете, что именно искать, рекомендуем пройти обследование по панели «Наследственный рак» (полная)
Это максимально полная панель в России, охватывающая наибольшее количество генов (всего – 207), мутации в которых наблюдаются при различных наследуемых злокачественных опухолях.
источник
1. По западным странам подсчитана частота встречаемости наследственного РМЖ среди женщин по отношению к общей популяции и среди всех случаев заболевания раком груди. Каковы эти цифры для России? Каковы риски развития рака молочной железы и рака яичников при таких показателях по сравнению с рисками в общей популяции?
Считается, что в среднем в популяции 5-10% от всех случаев РМЖ являются наследственными. В ФГБУ «РОНЦ им. Н.Н.Блохина» РАМН в было проведено исследование по определению частоты встречаемости мутаций в генах BRCA1 и BRCA2. Показано, что среди больных раком молочной железы без учета семейного анамнез доля BRCA-ассоциированного РМЖ не превышает 6%, тогда как у пациенток, в семьях которых были случаи заболевания раком молочной железы или яичников, заболевание было связано с наследованием мутации в генах BRCA в 25-30%. При таком сценарии риск развития рака молочной железы очень высок, по данным различных авторов – от 60 до 85% (при среднем общепопуляционном показателе 5-7%). У носительниц этих мутаций риск развития рака яичников колеблется от 27 до 60%, тогда как общепопуляционный показатель не превышает 1%.
2. В каких случаях женщине рекомендуют сделать генетическое тестирование? Врач какой специальности обычно рекомендует его провести? Можно ли выделить “группы риска” — женщин, которые по некоторым особенностям должны особенно внимательно подходить к вопросу наследственного РМЖ?
Вопрос о генетическом тестировании встает тогда, когда случаи рака прослеживаются в нескольких поколениях семьи пациетнки, особенно при возникновении рака яичников и рака молочных желез до 35ти лет и РМЖ у мужчин. Также учитывают и степень родства онкологического/ой больного/больной к консультируемой женщине. Чтобы подтвердить наличие наследственной предрасположенности, нужна консультация онколога- генетика и молекулярно-генетическое исследование. Важно помнить, что не все семейные случаи являются наследственными — они могут быть связаны с соматическими мутациями, которые не передаются по наследству. С другой стороны, если никто из родственников не болел раком, это не значит, что у него нет такой предрасположенности. Это обстоятельство многих, вероятно, насторожит и испугает. Но ситуации действительно бывают разные: можно не знать всех своих родственников или их диагнозы – люди порой скрывают от родных, что больны онкологическим заболеванием и т.д., и тогда проведение генетического обследования поможет прояснить ситуацию.
Общепринятых критериев включения в группы риска нет — они варьируют в разных странах. Есть обстоятельства, когда обратиться к генетику желательно, даже если нет поводов подозревать, что есть наследственная предрасположенность к онкологическим заболеваниям. Например, сделать это стоит в том случае, если у пациента или родственников были или есть множественные доброкачественные опухоли (полипы, пигментные невусы), или если супруги с онкологически отягощенным семейным анамнезом планируют беременность или процедуру ЭКО.
Вопрос о назначении необходимого объема молекулярно-генетического тестирования решается врачом-генетиком в ходе медико-генетического консультирования. Показания для проведения самого консультирования определяют врач онколог, маммолог, гинеколог, химиотерапевт, врач общей практики.
3. Какие специалисты принимают участие в консультировании женщины, которой рекомендовано провести анализ ДНК на наличие значимых мутаций в целевых генах? Какие линейки генов помимо BRCA1/2 смотрят в России?
Медико-генетическое консультирование сегодня является обязательной составляющей онкологической помощи и проводится сертифицированным врачом-генетиком, специализирующимся в области онкологии, с привлечением медицинского психолога при возникновении этических и психологических проблем. На первом этапе производится сбор личного и семейного онкологического анамнеза, составляется родословная пациента, определяется соответствие критериям включения в группы риска с наследственной предрасположенностью к РМЖ и/или РЯ. При получении информированного согласия проводится генетическое тестирование. На повторной консультации пациенту сообщаются результаты генетического тестирования, обсуждаются программа динамического наблюдения и необходимость информирования родственников I степени родства.
В ходе расширенного обследования с целью дифференциальной диагностики и исключения ложноотрицательного результата при отсутствии мутаций в генх BRCA1 и BRCA2 может быть исследована структура других генов: MLH1, MSH2, TP53, CHEK2, PALB2, PTEN, NBN, ATM, BRIP1, RAD50, BLM, FGFR2, ассоциированных с риском развития РМЖ и/или РЯ.
4. Если ДНК-анализ выявил у пациентки мутации в целевых генах, то какова схема ее дальнейшего наблюдения?
При выявлении мутации генов BRCA у здорового члена семьи рекомендуются самообследование молочных желез, посещение маммолога 2-4 раза в год и ежегодная маммография и/или магнитно-резонансная томография молочных желез после достижения 25 лет. Однако необходимо помнить, если мама заболела в возрасте 40 лет, то такая предрасположенность может реализовываться в следующем поколении на 5-10 лет раньше. Близким родственникам рекомендована консультация врача-генетика. Патологический BRCA-генотип повышает риск возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, мочевого пузыря, опухолей головы и шеи, железы, а также меланомы кожи.
Выбор стратегии индивидуальной «таргетной» терапии определяется в каждом конкретном случае с учетом мутационного статуса и/или молекулярной характеристики опухоли. Так, например «целевые» препараты для наследственного BRCA-ассоциированного рака молочной железы могут быть использованы как для лечения так и для профилактики.
5. Существует ли единое мнение врачей по поводу превентивных операций? В каком возрасте и при каких показателях риска их рекомендуют проводить? Как часто в России проводят превентивные мастэктомия и (сальпинго)-оофоректомию?
В мировой онкологической практике показан хороший эффект профилактических операций – двусторонних мастэктомии и сальпинго-овариэктомии, которые снижают и заболеваемость, и смертность от РМЖ и РЯ. Профилактическая мастэктомия исключительно эффективна, она снижает риск развития РМЖ на 90–95%. Двусторонняя сальпинго-овариэктомия снижает риск развития РЯ, рака фаллопиевых труб, первичного перитонеального рака и РМЖ. У носителей BRCA мутаций овариоэктомия снижает риск развития рака яичников на 90%, рака молочной железы на 50%, а защитный эффект сохраняется в течении 15 лет. С одной стороны, считается оправданным рекомендовать профилактическую овариоэктомию носительницам BRCA, кто завершил детородную функцию, с последующей заместительной гормонотерапией до достижения 50 лет. С другой стороны, есть мнение, что даже яичники даже после наступления менопаузы продолжают продуцировать гормоны, которые защищают женщин от остеопороза и других возрастзависимых заболеваний.
Наибольший опыт в выполнении контрлатеральных профилактических мастэктомий (более 60) имеет ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН в связи с наличием официального разрешения Росздравнадзора РФ на выполнение подобных операций. Методика и профессиональный уровень выполнения операций в РОНЦ соответствует мировому.
6. Можно ли говорить, что по сравнению с западными странами России не отстает в диагностике, наблюдении и лечении данного вида новообразований? В каких российских центрах можно провести ДНК-тестирование и последующую консультацию специалистов? Есть ли потребность усиленно развивать данную область (или она уже развита, или не является приоритетной?
Оказание данного вида помощи в РФ находится на мировом уровне. Помощь можно получить помимо ФГБУ “РОНЦ им.Н.Н.Блохина” в крупных онкологических центрах Томска, Новосибирска, Санкт-Петербурга.
В московском РОНЦ разработана стратегия медико-генетического консультирования семей с онкологически отягощенным анамнезом с использованием высокотехнологичных диагностических методик в том числе и при наследственном раке молочной железы и рака яичников, которая предусматривает расчет риска развития заболевания, возможность ранней диагностики, выбор тактики лечения и профилактики, а также решение проблем планирования семьи и деторождения.
Для развития этого научного направления на базе Онкологического Центра функционируют медико-генетические кабинеты для детей и взрослых. Основная задача которых — выявлять семьи с наследственными формами злокачественных опухолей, формировать группы риска из числа родственников больных и наблюдать их.
Не все медицинские заведения имеют право проводить превентивные операции, однако «РОНЦ им. Н.Н. Блохина» имеет соответствующее разрешение на применение новой медицинской технологии «Профилактическая мастэктомия с одномоментной реконструкцией» (ФС №2011/009 от 03.02.2011 г.,)
7. Каковы юридические аспекты, связанные с наследственным РМЖ, о которых надо помнить врачу и пациенту?
Перед проведением генетического тестирования должно быть получено добровольное информированное согласие пациента. При этом врач обязан обеспечить его адекватной и правдивой информацией относительно тестирования. В РФ действует ФЗ «Об основах охраны здоровья граждан» (Статья 20. Информированное добровольное согласие на медицинское вмешательство и на отказ от медицинского вмешательства). Врач-генетик должен обеспечить конфиденциальность генетической информации: доступ к ней не должны иметь работодатели, страховые компании и другие третьи лица во избежание возможной дискриминации.
Зав.лабораторией клинической онкогенетики РОНЦ Л.Н.Любченко
источник
Наследственный рак молочной железы – онкологическое заболевание, обусловленное генетической мутацией и проявляющееся повышенным риском развития злокачественных опухолей молочной железы у кровных родственников. Отличается от спорадических неоплазий более ранним началом, большим количеством двухсторонних поражений и частыми сочетаниями с новообразованиями других органов. Диагностируется с учетом семейной истории, данных молекулярно-генетического анализа и инструментальных исследований. При наличии предрасположенности проводятся регулярные осмотры, по показаниям осуществляется профилактическая мастэктомия. Лечение – операции, химиотерапия, радиотерапия.
Наследственный рак молочной железы – заболевание, сопровождающееся повышением вероятности возникновения злокачественных новообразований молочной железы вследствие генетической мутации, передающейся из поколения в поколение. Является одной из наиболее распространенных наследственных форм рака. Составляет от 5 до 10% от общего количества неоплазий молочной железы. Характеризуется частым ранним началом (в возрасте до 50 лет). Распространенность двухсторонних поражений при разных мутациях колеблется от 5-20 до 60%.
При наследственном раке молочной железы существует высокая вероятность развития других опухолей, в том числе – рака яичников, эндометрия, толстого кишечника, желудка, поджелудочной железы и мочевого пузыря, а также меланомы кожи. При наличии одной близкой родственницы, страдавшей данным заболеванием, риск неоплазии увеличивается в два раза, при двух случаях рака молочной железы в семье – в пять раз. Вероятность развития новообразования еще больше возрастает, если у одной или более родственницы симптомы болезни появились в возрасте младше 50 лет. Лечение проводят специалисты в сфере онкологии и маммологии.
Специалистам известен целый ряд генетических мутаций, увеличивающих вероятность возникновения рака молочной железы. В литературе чаще всего упоминаются мутации генов-супрессоров BRCA1 и BRCA2. Связь этих генов с опухолями данного органа была достоверно установлена в 1994 году. Проведенные исследования позволили повысить уровень ранней диагностики наследственного рака молочной железы и стали основой для последующих изысканий в этой области. В последующем ученым удалось обнаружить, что перечисленные гены выявляются всего у 20-30% больных с семейными случаями рака молочной железы и рака яичников.
У остальных пациенток заболевание провоцируется другими мутациями, при этом в разных регионах планеты преобладают различные генетические аномалии. Наряду с повышенной вероятностью развития наследственного рака молочной железы дефектные гены могут увеличивать риск возникновения других злокачественных новообразований, чаще всего – уже упомянутого выше рака яичников. Несколько реже у пациенток возникают опухоли эндометрия, еще реже – неоплазии органов, не являющихся частью женской репродуктивной системы.
Существует ряд факторов риска, провоцирующих наследственный рак молочной железы у носительниц дефектного гена. В числе таких факторов – раннее менархе (частое явление при данной патологии), позднее начало климакса, отсутствие беременностей и родов, длительный прием гормональных препаратов, сахарный диабет, ожирение, гипертоническая болезнь, курение, злоупотребление алкоголем, наличие доброкачественных пролиферативных изменений ткани молочной железы и некоторых заболеваний женских половых органов.
На ранних стадиях наследственный рак молочной железы протекает бессимптомно. Иногда первыми признаками становятся болезненность в молочных железах (при наличии мастопатии) и интенсивные боли во время менструаций. Как правило, опухоль обнаруживают до возникновения развернутой клинической картины. Возможно как самостоятельное выявление узла (случайное или в процессе самоосмотра), так и возникновение подозрений на онкологическое заболевание при проведении очередного обследования.
При прогрессировании наследственного рака молочной железы появляются выделения из соска. Увеличиваются подмышечные лимфоузлы на стороне поражения. Кожа над опухолью становится морщинистой, выявляются умбиликация и положительный «симптом площадки». В последующем наблюдаются прогрессирующая деформация органа и симптом «лимонной корки». Возможно изъязвление. На поздних стадиях наследственного рака молочной железы к проявлениям первичной неоплазии присоединяются нарушения функций различных органов, обусловленные отдаленным метастазированием, и общие симптомы онкологического заболевания: расстройства аппетита, потеря веса, гипертермия.
Отмечаются различия в течении наследственного рака молочной железы, вызываемого разными генетическими мутациями. Новообразования, выявляемые у женщин-носительниц гена BRCA1, характеризуются высокой степенью злокачественности. Рак, ассоциированный с мутациями BRCA2, протекает более благоприятно по сравнению со спорадическими случаями заболевания. Отличительной особенностью всех форм наследственного рака молочной железы является высокая вероятность возникновения контрлатеральных поражений и рецидивов опухоли в той же молочной железе после проведения органосохраняющих операций. Для сравнения: средняя частота местных рецидивных неоплазий при спорадическом раке составляет 1-1,5% в течение года. При наследственном раке молочной железы контрлатеральные новообразования выявляются у 42%, ипсилатеральные – у 49% больных.
Диагноз устанавливается с учетом семейного анамнеза, результатов молекулярно-генетических исследований и данных дополнительного обследования. Генетический анализ выполняют после выявления семейно-анамнестических признаков наследственного рака молочной железы (наличия заболевания у близких родственников, раннего начала, высокой частоты двухсторонних поражений). При положительном результате анализа регулярно назначают маммографию. При образовании узла осуществляют УЗИ молочной железы, дуктографию, МРТ и другие диагностические процедуры. При подозрении на наличие отдаленных метастазов проводят рентгенографию грудной клетки, сцинтиграфию всего скелета, УЗИ печени, МРТ головного мозга и другие исследования.
Традиционно при наследственном раке молочной железы применяли стандартные схемы, составленные с учетом более высокой вероятности рецидивирования. Однако в последние годы в литературе все чаще встречаются указания на необходимость использования специальных лечебных программ, составленных с учетом чувствительности наследственного рака молочной железы, ассоциированного с различными генетическими аномалиями. Так, пациенткам с дефектом BRCA1 из-за низкой эффективности не рекомендуют назначать средства из группы таксанов. При наследственном раке молочной железы с мутацией BRCA2 успешно применяют цисплатин – препарат, не входящий в стандартную схему лечения рака молочной железы, но успешно используемый при лечении опухолей других локализаций. Для снижения частоты рецидивов даже на начальных стадиях выполняют радикальную мастэктомию, а не органосохраняющие операции.
Меры по предотвращению и своевременному выявлению наследственного рака молочной железы включают в себя отказ от вредных привычек, регулярные самоосмотры и осмотры специалиста. Основной инструментальной методикой, используемой при проведении профилактических обследований, является маммография, однако в последние годы при наличии возможностей ее все чаще заменяют ЯМР, исключающим облучение пациентки. При высоком риске развития наследственного рака молочной железы (более 25%) осуществляют профилактическую двухстороннюю мастэктомию, иногда – в сочетании с оофорэктомией.
источник
Онкологическое отделение (генетики) РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова проводит молекулярно-генетические исследования для выявления мутаций в генах наследственной предрасположенности к развитию рака молочной железы и яичников:
- молекулярно-генетический анализ мутаций в генах BRCA1 и BRCA2 методом ПЦР;
- молекулярно-генетическое исследование генов BRCA1 и BRCA2 методом секвенирования.
Рак – это распространенное генетическое заболевание, ключевую роль в развитии которого играет повреждение ДНК клетки.
Особой разновидностью онкологических заболеваний являются наследственные формы рака (наследственные опухолевые синдромы), которые характеризуются передачей из поколения в поколение предрасположенности к развитию того или иного вида злокачественной опухоли.
Это связано с наследованием мутантного или «ракового» гена. У лиц, имеющих такое генетическое повреждение, значительно увеличен риск возникновения рака.
Однако, важно иметь в виду, что примерно 30% пациентов с выявленными мутациями могут не иметь семейной истории, так как эти изменения являются мутациями de novo – впервые возникшими.
Наследственный «синдром рака молочной железы/рака яичников» (РМЖ/РЯ) является самой частой разновидностью семейных опухолевых синдромов. На его долю приходится до 5-7% всех случаев рака молочной железы и, как минимум, 15-20% всех случаев рака яичников также можно объяснить наличием генетического дефекта.
Основная часть случаев наследственного «синдрома рака молочной железы/рака яичников» вызвана мутациями в генах BRCA1 (Breast Cancer 1) и BRCA2 (Breast Cancer 2). Эти гены играют ключевую роль в восстановлении поврежденной ДНК, защищая клетку от воздействия канцерогенных факторов внешней среды.
Мутации в генах связаны с повышенным риском возникновения рака молочной железы и рака яичников у женщин. Мужчины с наличием данной мутации также имеют высокий риск развития рака молочной железы и рака предстательной железы. Имеются данные и о повышенном риске возникновения опухолей желудка, поджелудочной железы, органов головы и шеи.
Мутации в генах наследственной предрасположенности могут быть унаследованы как от матери, так и от отца. Эти мутации передаются и мальчикам и девочкам. Вероятность передачи «раковой» мутации составляет 50%, т.е. только в половине случаев Вы можете получить генетический дефект от родителей или передать его детям.
Проведение генетического анализа обязательно для всех пациентов со злокачественной патологией молочных желез, у которых имеются косвенные клинические характеристики семейной формы рака:
- в семье (у ближайших родственников) есть хотя бы еще один случай онкологического заболевания;
- опухоль появилась в раннем возрасте (до 45 лет);
- имеются множественные формы опухолей;
- в семье есть хотя бы еще один случай рака молочной железы у мужчин.
При установлении наследственного характера заболевания у онкологических пациентов может измениться тактика лечения, в частности, объём операции и/или характер назначаемой противоопухолевой терапии.
- Проведение генетического анализа показано всем пациенткам со злокачественным поражением яичников, поскольку при данном заболевании отсутствуют косвенные клинические характеристики семейной формы рака.
- Проведение генетического анализа рекомендовано, если Вы имеете близкого родственника, у которого диагностирован рак молочной железы, рак яичников, опухоли поджелудочной железы, рак желудка, рак предстательной железы, либо другие онкологические заболевания, возникшие в возрасте до 45 лет.
- Проведение генетического анализа необходимо, если в Вашей семье у двух или более родственников были диагностированы онкологические заболевания.
- Проведение генетического анализа крайне важно здоровым родственникам пациентов, у которых выявлена «раковая» мутация. Это позволяет ответить на вопрос, передали ли родители потомству гены с опасными мутациями.
- Проведение генетического анализа вполне обосновано у совершенно здоровых людей, у которых в семье не было случаев злокачественных новообразований — случайное выявление мутаций вполне вероятно.
Своевременное выявление наследственных мутаций у здоровых людей может помощь им принять важные решения, касающиеся сохранения здоровья (выбор профессии, гормональные и репродуктивные факторы, более регулярные обследования, превентивные меры).
Учитывая, что генетическая информация не изменяется на протяжении всей жизни, анализ на наличие мутаций в генах наследственной предрасположенности выполняется только один раз!
Тестирование можно проводить в любом возрасте, но, обычно, не ранее 18 лет.
В случае подтверждения наличия мутации необходимо обратиться к врачу-онкологу и регулярно проходить необходимые в этом случае обследования:
- самообследование молочных желез (с 18 лет, ежемесячно);
- обследование молочных желез у маммолога (с 25 лет, 1 раз в 6 мес.);
- магнитно-резонансная томография молочных желез (с 25-30 лет, 1 раз в 12 мес.);
- маммографическое исследование (с 25 лет, 1 раз в 6-12 мес.);
- трансвагинальное ультразвуковое исследование (с 35 лет, 1 раз в 6 мес.);
- определение уровня маркера СА-125 (с 35 лет, 1 раз в 6 мес.).
- Для проведения молекулярно-генетического анализа необходимо сдать кровь из вены в объеме 1-2 мл в пробирку с ЭДТА (вакутайнер с сиреневой крышкой).
- Для выявления мутаций в генах наследственной предрасположенности используются методы полимеразной цепной реакции (ПЦР) и секвенирования.
Выявление мутаций в генах наследственной предрасположенности у здоровых женщин – это не установление диагноза рака. Это предупреждение женщины о риске развития заболевания в течение жизни, который возрастает до 60-90%.
Тестирование уже известных мутаций в генах BRCA1 и BRCA2 не исключает наличие более редких генетических изменений. Для их выявления используется метод молекулярного секвенирования.
У мужчин с наследственными мутациями также существует риск развития злокачественных новообразований (рака молочной железы, предстательной железы, желудка, поджелудочной железы), поэтому они нуждаются в консультации медицинского генетика и врача-онколога.
Онкологическое отделение (генетики) РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова проводит молекулярно-генетические исследования для выявления мутаций в генах наследственной предрасположенности к развитию рака молочной железы и яичников:
- молекулярно-генетический анализ мутаций в генах BRCA1 и BRCA2 методом ПЦР;
- молекулярно-генетическое исследование генов BRCA1 и BRCA2 методом секвенирования.
источник
Рак молочной железы и рак яичников — тема, волнующая многих женщин. Это связано с тем, что рак молочной железы — самое распространенное онкологическое заболевание среди женщин. При продолжительности жизни до 80 лет риск заболеть раком молочной железы составляет 12,5%, то есть им заболевает каждая восьмая женщина.
Приблизительно 10% от общего количества заболеваний раком молочной железы наследственные и связаны с определенными генами. Нормальное функционирование генов BRCA1 и BRCA2 препятствует развитию рака молочной железы и рака яичников. Если в одной из копий генов происходит «поломка» (мутация), сильно возрастает вероятность развития рака молочной железы (до 85%).
Рак яичников является первым по смертности среди гинекологических злокачественных заболеваний. Его особенность заключается в том, что, несмотря на новейшие диагностические возможности, до сих пор 85% женщин с раком яичников обращается к онкогинекологу уже на 3-й и 4-й стадиях, когда шансы на излечение даже с самыми прогрессивными хирургическими техниками и новейшими схемами химиотерапии остаются не очень высокими.
При наличии мутации гена BRCA1, например, риск заболеть раком яичников составляет 54%, а риск умереть от этого заболевания у каждого здорового носителя этой мутации – около 20%.
Ген, ответственный за возникновение рака молочных желез и яичников, может передаваться как от матери, так и от отца. Если этот ген присутствует у кого-то из одного родителей, то риск его наследования составляет 50%. Если ген передался по наследству, то риск развития рака зависит от специфичности гена, его проявления в семейном анамнезе, а также от индивидуальных особенностей организма. Риск развития рака молочной железы в таких семьях колеблется в пределах от 40 до 80%, а рака яичников – от 25 до 54%.
Следует помнить, что рак молочных желез и яичников, возникший в результате генетической предрасположенности, проявляется и лечится точно так же, как онкологические заболевания, возникающие у неносителей мутаций, но чаще поражает более молодых женщин.
Многие женщины, родственницы которых больны раком молочной железы или раком яичников, хотят знать, повышен ли у них риск развития данных заболеваний, чтобы по возможности предотвратить возникновение опухоли.
Сдав кровь на исследование, Вы можете определить, унаследована ли Вами предрасположенность к возникновению рака молочной железы и рака яичников, связанная с генами BRCA1 и BRCA2.
Показания для проведения исследования генетической предрасположенности к возникновению рака молочной железы и рака яичников:
наличие двух или более родственников, имеющих рак молочной железы;
выявление рака молочной железы в возрасте до 45 лет;
двусторонний или мультифокальный рак молочной железы;
заболевание раком яичников;
наличие даже одного родственника с раком яичников или раком молочной железы, который был диагностирован до 40-летнего возраста;
если раком молочной железы страдает мать, сестра или дочь;
если у многих поколений в семье был рак молочной железы или яичников;
родственницы, страдающие раком молочной железы в относительно молодом возрасте (моложе 50 лет);
родственницы, страдающие раком обеих молочных желез.
Информация о наследственной предрасположенности к раку груди и/или яичников в комплексе с гинекологическим и маммологическим обследованием поможет врачам определить индивидуальную профилактическую и лечебную тактику.
Цели генетического исследования:
оценка риска возникновения наследственного рака молочной железы и рака яичников;
разработка оптимальной тактики наблюдения пациенток с повышенным риском, составление плана лечения рака молочной железы и рекомендаций для проведения профилактических операций, значительно снижающих риск возникновения рака яичников в будущем.
Если у вас есть родственники с этой генетической аномалией, генетическое исследование имеет неоспоримые преимущества:
Если мутации генов не обнаружены, врач с большой вероятностью может сказать, что у вас такой же низкий риск развития рака молочной железы или рака яичников, как и у остальных женщин.
Если результаты генетического тестирования положительные, то тщательный контроль за состоянием молочной железы и яичников может помочь выявить рак на ранних стадиях, когда он еще излечим. Для этого используются принципиально иные протоколы ранней диагностики, чем в обычных случаях, скрининг начинается на 5-10 лет раньше.
Вам могут рекомендовать определенные препараты для профилактики развития рака груди, например, тамоксифен или гормональные препараты.
Вам могут предложить профилактическое оперативное вмешательство (удаление молочной железы, яичников, маточных труб или всех этих органов).
Если у вас обнаружен рак, генетическая характеристика может дать больше информации для выбора наиболее оптимального и специфичного метода лечения.
Наконец, если вы знаете, что являетесь носителем мутации гена рака яичников и молочной железы, вы можете изменить прежний образ жизни.
Главными целями диагностики наследственных форм рака молочной железы и рака яичников являются не только выявление носительства мутаций в генах, но и определение наиболее оптимальной, индивидуальной тактики дальнейшего скрининга и профилактики возникновения этих серьезных заболеваний.
источник
Рак груди относится к числу наиболее распространенных злокачественных заболеваний. Ежегодно в Израиле диагностируется около 4.000 новых случаев рака молочной железы. В последние годы ученым удалось доказать наличие предрасположенности к раку молочной железы. Известно, что примерно 10-12% случаев рака груди и 40% случаев рака яичников обусловлены генетической мутацией, передающейся по наследству. Мутация затрагивает гены BRCA1 или BRCA2. Наследственный рак проявляется, как правило, в молодом возрасте (до 40- 50 лет), для него характерно присутствие нескольких первичных очагов или же формирование опухолей в обеих молочных железах или обоих яичниках. Лечение рака молочной железы в Израиле обычно включает в себя генетический анализ на предрасположенность к раку. Если клиническая картина заболевания вызывает подозрение на наследственный рак груди и яичников, специалисты клиники Шиба рекомендуют обратиться за генетической консультацией и выполнить тестирование не только самой пациентке, но и членам ее семьи.
Мутации в генах BRCA1 и BRCA2 исчисляются десятками видов. Их носителями могут являться как женщины, так и мужчины. Мужчины, как известно, тоже болеют раком груди, и у каждого пятого пациента мужского пола эта болезнь развивается на фоне мутации в гене BRCA2. Носители любого пола могут передавать генетическую мутацию своему потомству.
Чтобы оценить степень влияния мутации на риск наследственного рака груди и яичников, за последнее десятилетие был выполнен ряд научных исследований. Ученым в Израиле удалось доказать, что наличие мутации существенно повышает частоту раковых опухолей молочной железы и яичников. Кроме того, была выявлена разница в заболеваемости между носительницами мутации в гене BRCA1 и гене BRCA2. Так, например, у носительниц мутации в гене BRCA1 риск заболеваемости раком молочной железы до достижения 80-летнего возраста равнялся 80% , а раком яичников – 50% до достижения 75-летнего возраста. У носительниц мутации в гене BRCA2 аналогичные показатели составляют 35% (рак груди) и 50% (рак яичников). Для сравнения среднестатистический показатель заболеваемости раком молочной железы в Израиле равняется 12%, раком яичников – 1.5%.
В рамках израильского научного проекта исследовались специфические мутации, характерные для женщин ашкеназско-еврейской этнической группы. Мутации, свойственные представительницам других национальностей и рас, исследовались учеными из разных стран. Полученные результаты могут несколько отличаться, однако все они свидетельствуют о том, что генетическая мутация действительно несет в себе предрасположенность к раку груди и яичников.
- Генетическое тестирование с целью определения заранее известной мутации. Для однородных этнических групп, например, жительниц Израиля, являющихся еврейками по национальности, характерны специфические мутации в генах BRCA1 и BRCA2. По этой причине в Израиле стандартная процедура генетического анализа на предрасположенность к раку включает в себя определение десяти наиболее распространенных мутаций в генах BRCA1 и BRCA2.
- Секвенирование генома. У представительниц других этнических групп определение специфических мутаций неэффективно. В этих случаях производят секвенирование – анализ последовательности всех нуклеотидов, входящих в состав генов BRCA1 и BRCA2. Секвенирование – более сложная и дорогая процедура.
- Анализ на наличие мутаций вне генов BRCA1 и BRCA2. В ситуациях, когда в пределах одной семьи присутствуют множественные случаи рака груди, но при этом не определяются мутации в генах BRCA1 и BRCA2, рекомендуется обратиться за генетической консультацией. На сегодняшний день идентифицированы несколько форм наследственного рака (например, синдром Коудена), которые обусловлены мутациями в дополнительных генах.
Скрининговые мероприятия. В группе риска проводятся более интенсивные диагностические проверки, чем это принято у широкого населения. Женщинам — носительницам мутации рекомендуют выполнять обследования молочных желез, начиная с 25-30-летнего возраста: осмотры, маммографии или УЗИ и МРТ. В целях ранней диагностики рака яичников производят регулярное УЗИ органов малого таза и анализ крови на уровень онкомаркера CA-125.
Профилактическая мастэктомия. Двусторонняя мастэктомия с последующей реконструкцией молочных желез позволяет снизить риск рака груди на 90%. Однако данную операцию невозможно рассматривать только с точки зрения целесообразности, не учитывая ее психологический аспект.
Удаление обоих яичников. Такая операция на 95% снижает риск рака яичника и на 50% — риск рака груди (при условии, что операция выполняется у женщин моложе 40 лет). Она может рассматриваться как средство профилактики наследственного рака у женщин, не планирующих в дальнейшем рождение ребенка.
Лекарственная терапия. Эффективность лекарственной терапии в профилактике наследственного рака груди и яичников однозначно не подтверждена. В то же время, существуют свидетельства того, что прием тамоксифена на 50% снижает риск рака груди у носительниц мутации в гене BRCA2.
источник
Тема наследственных раков стала активно обсуждаться после шумихи вокруг оскароносной кинодивы Анджелины Джоли, сделавшей себе профилактическую мастэктомию (удалению молочных желез) и овариэктомию (удаление яичников). Актриса – носительница наследственной мутации в гене BRCA-1, который уже прозвали геном Анджелины Джоли, приняла решение избавиться от этих органов после неутешительного прогноза – вероятность заболеть раком молочной железы у нее составила 80%, раком яичников 70%.
О наследственных — генетических раках молочной железы и о том, как влияет выявление генетических мутаций на тактику лечения пациентов рассказывает Александр Алексеевич Бессонов, врач-онколог отделения опухолей молочной железы НИИ онкологии им Н.Н. Петрова, член Европейского общества хирургов-онкологов.
Теорию, согласно которой в основе возникновения злокачественной клетки лежат генетические поломки, сегодня можно назвать самой распространенной теорией возникновения рака.
Наш организм постоянно подвергается воздействию канцерогенных факторов, которые приводят к «озлокачествлению» клеток.
К таким факторам относятся:
- ионизирующее излучение,
- действия химических канцерогенов.
Даже в процессе нормального метаболизма клетки, образуются вещества, агрессивно воздействующие на наследственный аппарат клетки — свободные радикалы.
Эти вещества и другие канцерогенные факторы оказывают повреждающее влияние, которое может привести к возникновению серьезной генетической поломки, которая в свою очередь вызывает начало опухолевого процесса.
Поломки случаются постоянно во всех клетках организма, но, к счастью, у человека есть многоуровневая система защиты от них. Существуют эффективные механизмы восстановления поврежденных клеток и уничтожения клеток с неисправимыми повреждениями. Когда эти механизмы дают сбой, может возникнуть опухоль.
Если же система имеет врожденный дефект, тогда риски возникновения рака у носителя этой генетической аномалии существенно возрастают.
Выделяют отдельные синдромы, которые связаны с наследованием генетической патологии. Это поврежденные копии генов, ответственных за восстановление целостности ДНК.
На сегодняшний день порядка 30% в общей структуре наследственного рака молочной железы мы можем объяснить изученными генетическими аномалиями. 2/3 таких случаев – мутации в генах BRCA-1 и BRCA-2. Это наиболее изученный вариант генетической аномалии, связанный с наследственным раком молочной железы.
В российской популяции широко распространены т.н. «founder мутации» — это мутации, связанные с «эффектом прародителя». Европеоидная часть населения России генетически достаточно однородна, поэтому тестирование на носительство основных founder мутаций в 80% случаев позволяют выявить носительство генетической аномалии в генах BRCA-1 и BRCA-2.
Такое тестирование выполняется в молекулярно-генетической лаборатории НИИ онкологии им. Н.Н. Петрова.
Показания для генетического тестирования:
- молодой возраст пациента,
- наличие родовой истории по онкологическим заболеваниям, а также иным заболеваниям молочной железы, яичников, толстой кишки,
- наличие первично-множественных заболеваний — рака молочной железы и рака яичников.
Сбор семейного анамнеза – очень важный элемент общения врача с пациентом, так он получает представление об истории заболевания в рамках семьи и может рекомендовать генетическое тестирование.
Проведение этого анализа — важный элемент диагностики и лечения пациентов, так как он направляет врачей и помогает определить:
- объемы хирургического вмешательства,
- тактику предоперационного и послеоперационного лекарственного лечения,
- тактику проведения профилактических мероприятий.
Носительство мутаций гена BRCA-1 сопряжено с достаточно высоким риском возникновения рака яичников, об этом обязательно информируется сам носитель.
С учетом данных тестирования планируется реализация репродуктивного потенциала онкологической пациентки – наступление беременности, вынашивание ребенка и роды. При этом принимается во внимание также и биологический портрет опухоли (на основе иммуногистохимического заключения с учетом уровня рецепторов эстрогенов, прогестерона и HER2), наличие носительства мутации BRCA.
На основании этого врач-онколог подбирает индивидуальный, ориентированный на конкретного больного, план комплексного лечения:
- лекарственного противоопухолевого лечения
- хирургического лечения
- и лучевой терапии.
После получения необходимой и всесторонней информации о своем заболевании пациентка сама принимает решение о планировании своей беременности, учитывая сроки, в которые беременность могла бы протекать максимально безопасно и для будущего ребенка и для его матери.
Авторская публикация:
Александр Алексеевич Бессонов
врач-онколог отделения опухолей молочной железы
НИИ онкологии им Н.Н. Петрова
член Европейского общества хирургов-онкологов
источник
Рак груди – это злокачественное образование, которое может развиваться как в одной, так и в обеих молочных железах. На сегодняшний день считается, что наследственный рак молочной железы связан с генами BRCA1 и BRCA2. Зачастую патологии генов, которые отвечают за это онкологическое заболевание, диагностируют у молоденьких женщин, не достигших 40 лет. Эти гены проводят регулировку полноценного разрастания клеток молочных желез и снижают возможность появления в них раковых образований. Но при имеющейся патологии в этих генах становится выше риска РМЖ. Патология генов BRCA1 и BRCA2, по статистике, составляет около 10% всех случаев заболевания.
Первый раз аномальные гены определили в процессе изучения семей, в которых молодые женщины уже имели рак груди. Высокая вероятность того, что аномальные гены, провоцирующие РМЖ, передаются наследственно, бывает по таким причинам:
- Имеются прямые родственники женского пола по линии одного из родителей, у которых диагностировали рак груди в возрасте, не достигнув пятидесяти лет.
- В семье имеются женщины, которые на сейчас больны РМЖ.
- У прямых родственников было заболевание рака обоих молочных желез.
- В семье был диагностирован РМЖ у представителя мужского пола.
Существуют такие наследственные формы РМЖ:
- Дуктальная, при которой клетки рака дислоцируются только в молочных протоках железы и не переходят на ткани, которые ее окружают. Такой наследственный рак зачастую поддается лечению.
- Лобулярная, которая начинается, поражая дольки молочной железы.
- Инфильтративная – когда клетки ракового образования начинают выходить за пределы молочных протоков.
- Воспалительная, которой характерны признаки проходящего воспалительного процессе: краснота и отек груди, при пальпации она горячая.
- Болезнь Пэджета, которая характеризуется появляющейся на соске сыпи, похожей на экзему.
- Тубулярная — когда онкологические клетки формой похожи на трубочку.
- Слизистая — начинающаяся из молочных протоков. Клетки богаты на содержание слизи.
- Мозговая – когда опухолевое образование напоминает ткань мозга.
- Папиллярная, при которой онкологические клетки похожи на ворсинки.
Многие ошибаются думая, что наследственный рак груди протекает более агрессивно, чем приобретенный. Но исследования доказали, что РМЖ, спровоцированный наследственным фактором, наоборот, менее агрессивен.
Если у кого-либо из вашей семьи были обнаружены аномальные клетки, провоцирующие развитие рака груди, это не значит, что вам заболевание достанется наследственно. Предположим, что у вашей мамы или папы присутствуют аномальные гены BRCA1 или BRCA2. Риск унаследовать их будет примерно 50%. А ваши дети рискуют унаследовать такие гены с вероятностью в 25%.
У представительниц женского пола, имеющих аномальные гены, вероятность развития РМЖ в старости очень высокая. Но не обращая внимания на высокие риски нужно знать, что РМЖ появляется не у каждого, кто имеет наследственные склонности. Все зависит от того, какой человек ведет образ жизни, какая вокруг него окружающая среда, как другие гены проводят защиту организма от раковых образований и т.д.
Первым делом правильнее будет обратиться за консультацией к врачу-генетику. Онкогенетика достигла такого уровня, когда стало очень легко проводить профилактику и раннюю диагностику рака молочной железы, а также сформировывать новые способы скрининга РМЖ, в состав которых входит генотипирование. Для проведений консультаций больных, находящихся в группе риска развития РМЖ, предпочтительным является генетический анализ генов BRCA1/2, TP53, CHEK2.
Другой вариант исследования — генетический тест слюны на наличие наследственного рак груди. В ряде случаев, даже отрицательный результат теста (отсутствие аномалии гена), не значит, что отсутствует наследственная склонность к онкологии. Поэтому, когда получены результаты теста, женщину консультирует врач-генетик, который, если возникает такая необходимость, определяет дополнительные меры наблюдения пациентки.
Генетический анализ на рак груди помогает представительницам женского пола узнать, имеют ли они наследственные аномальные гены, повышающие вероятность появления РМЖ. Анализ проводят, чтобы найти изменения в генах, напрямую связанных с этим онкологическим заболеванием (BRCA1 и BRCA2). Изменения в этих генах диагностируются редко, но, если они находятся, у женщины растут шансы столкнуться с раком.
Если генетический анализ показал наличие аномальных генов, повышающих вероятность появления рака МЖ, рекомендовано постоянно контролировать свое состояние. Для этого подойдет исследование при помощи МРТ. Также, рекомендуется проходить УЗИ молочных желез и сдавать кровь на онкомаркеры, отвечающие за наличие РМЖ. Если специалисты разрешат, в целях профилактики онкологии, можно принимать медицинский препарат “Тамоксифен”. Необходимо вести здоровый образ жизни: правильно питаться, заниматься спортом, вести контроль веса и отказаться от вредных привычек (сигареты и спиртные напитки).
Женщинам, у которых определили наследственную склонность к раку груди, необходимо избегать факторов, которые увеличивают риск заболевания:
- имеются ли доброкачественные изменения в молочных железах (мастопатия);
- очень рано или наоборот, поздно началась менструация;
- до 35 лет женщина не рожала, или последний ребенок рожден после этого возраста;
- лечение гормонами в период после менструации;
- наличие вредных для организма привычек, таких как курение и употребление алкогольных напитков в большом количестве;
- лишний вес, сахарный диабет, болезни печени и щитовидки;
- недостаточность витамина D, необходимого для полноценного функционирования организма;
- ионизирующая радиация.
Все эти факторы оказывают влияние на смену гормонального фона и способствуют повышению вероятности появления рака груди у женщин, имеющих наследственную склонность к болезни, и даже у тех, кто ее не имеет.
Какова будет тактика наблюдения здорового носителя наследственной мутации определяется сугубо индивидуально, специалистом и пациентом. Проинформировать кровных родных о подтверждении имеющейся наследственной аномалии генов, отвечающей за РМЖ, и имеющемся у них наследственном риске, должен в обязательном порядке сам пациент.
Процедуры, способствующие снижению онкологического риска, подразделяют на несколько групп:
- наблюдение (скрининг);
- хирургия в профилактических целях;
- лечение лекарственными препаратами.
Наиболее часто используемой является тактика наблюдения. Снизить вероятность развития и повысить шансы раннего диагностирования рака груди можно проходя каждый год клиническое обследование, а также МРТ или маммографию молочных желез. Такая тактика помогает существенно снизить вероятность появления РМЖ, но зависима от того, соблюдает ли человек рекомендации, которые были даны специалистами.
Необходимо с умом подходить к планированию беременности и рождения ребенка. В целях профилактики рекомендуют не затягивать с беременностью, а также, если это возможно, не принимать гормональные препараты, отдав предпочтение контрацептивам барьерного типа.
Женщинам, имеющим аномальные гены BRCA1 или BRCA2, можно сделать операцию по удалению молочной железы (мастэктомию). Но прежде, чем пойти на этот шаг, необходимо хорошо подумать, взвесив все за и против.
Если имеется наследственная предрасположенность к появлению РМЖ, не стоит паниковать. Далеко не всегда это означает, что наследственный рак молочной железы у вас проявится. Чтобы максимально избежать этого заболевания, носителям аномальных генов рекомендуется проводить профилактику заболевания и регулярно консультироваться с врачом-генетиком.
источник
