Рак молочной железы — злокачественная опухоль железистой ткани молочной железы. В мире это наиболее частая форма рака среди женщин, поражающая в течение жизни от 1/13 до 1/9 женщин в возрасте от 13 до 90 лет. Это также второе по частоте после рака лёгких онкологическое заболевание в популяции в целом, рак молочной железы иногда встречается и у мужчин, но случаи этого вида рака у мужчин составляют менее 1 % от общего количества больных данным заболеванием. По данным американских специалистов ежегодно рак молочной железы поражает 180 тыс. женщин, 46 тыс. из них умирают от этой болезни. В России на 100 тыс. женского населения приходится 36, случаев рака.
Молекулярная генетика рака молочной железы:
На сегодняшний день хорошо изучены высоко пенетрантные гены BRCA 1 и BRCA 2, играющие определенную роль при возникновении наследственного РМЖ. Терминальные мутации генов являются этиологичными в отношении специфической индивидуальной и семейной предрасположенности — синдромам Ли-Фраумени, Каудена.
Существуют другие гены и полиморфизмы, имеющие отношение к наследственному предрасположению возникновения рака молочной железы: СНЕК2, NBS1, CYP17, CYP19, NAT2, но их изменения связаны с меньшим риском развития рака молочной железы по сравнению с генами BRCA.
BRCA 1-ген был идентифицирован с помощью позиционного клонирования в 1994г. и соответствует на длинном плече 17-й хромосомы. BRCA 2-ген был найден на 13q — хромосоме и выделен в 1995 г. BRCA 1 и BRCA 2-гены являются супрессорными генами с аутосомно-доминантным типом наследования и высокой пенетрантностью в пределах одной семьи. В совместном исследовании, включившим данные большого количества семей, наследующих терминальные мутации генов BRCA 1 И BRCA 2, было показано, что оба этих гена несут высокий (80— 95 %) риск развития рака молочной железы у женщин в течение всей жизни, однако кривая пенетрантности для носителей мутаций гена BRCA 1 начинает возрастать в более раннем возрасте по сравнению с носителями мутаций гена BRCA 2.
Анализ данных продемонстрировал высокую вероятность возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, меланомы, мочевого пузыря, опухолей головы и шеи при патологическом BRCA 1/2 — генотипе, что необходимо учитывать при медико-генетическом консультировании и наблюдении пациентов-носителей. Риск развития двухстороннего рака молочной железы составляет 64% для носителей мутаций гена BRCA 1 и 58 % — для носителей мутаций гена BRCA 2.
Мутации генов BRCA 1/2 одновременно находят примерно в 80% семей с 4 и более случаями РМЖ, диагностированными после 60 лет.
Молекулярные исследования BRCA 1 и BRCA 2-генов, проведенные за последние годы, демонстрируют огромный спектр мутаций этих генов. Сущкствует свыше 800 различных вариантов мутаций генов BRCA 1/2. Большинство этих мутаций относятся к делеторным, в результате которых структурные перестройки изменяют функциональность белкового продукта, что, в свою очередь, снижает способность клетки к репарации ДНК. Значительная часть (34%) мутаций гена BRCA 1 и 38% BRCA 2-гена, являются миссенс-мутациями. Описано большое количество однонуклеотидных полиморфных вариантов, клиническое значение которых на сегодняшний день не определено. У пациентов, страдающих раком молочной железы или раком яичников, из семей с онкологически отягощенным анамнезом в 52,4% случаев одна аллель гена BRCA 1 содержала 8 полиморфных вариантов, наследуемых в семье как целое.
В отношении оценок пенетрантности генов BRCA 1 и BRCA 2 также важно этническое происхождение пациентов-носителей. Изучение популяций исландцев и евреев Ашкенази выявило низкую пенетрантность этих генов, возможность развития рака молочной железы на протяжении жизни составил 37 %.
В этих популяциях только несколько мутаций являются ответственными за генетическую предрасположенность к раку молочной железы и раку яичников. Они связаны с эффектом родоначальника, то есть мутация, возникшая в одной из гамет предка, так называемая неомутация, или мутация de novo, впоследствии передается из поколения в поколение.
Особенности рака молочной железы у носителей мутаций генов BRCA 1 или BRCA 2:
Различный молекулярный патогенез между BRCA-ассоциированными и ненаследственными опухолями молочной железы предполагает, что эти опухоли могут кардинальным образом отличаться по фенотипическим и прогностическим признакам. Многими группами исследователей отмечена фенотипическая гетерогенность РМЖ, обусловленная терминальными мутациями генов BRCA I или BRCA 2. Показано, что отсутствие пораженных регионарных лимфатических узлов не снижает смертности у носителей мутаций этих генов.
При планировании лечения носителей мутаций BRCA 1 или BRCA 2 больным рака молочной железы следует учитывать, что оставление ткани молочной железы приводит к развитию в ней новых опухолей. Так, Всемирная организация здоровья приводят отдаленные результаты органо-сохраняющего лечения таких больных: операции были выполнены при среднем возрасте 42 года. Средняя длительность наблюдения — 12 лет. Частота вторых РМЖ составила: 42 %.
Классификация рака молочной железы:
По клиническому течению различают несколько форм рака молочной железы:
•инфильтративно-отечную форма, чаще развивается у молодых женщин в период беременности и лактации. Течение острое. Боль чаще отсутствует. Быстро увеличиваются размеры уплотненного участка молочной железы. Характерен отек ткани молочной железы и кожи в результате распространения раковых клеток по внутрикожным лимфатическим сосудам и внутридольковым лимфатическим щелям
•маститоподобную форма, чаще встречается у молодых женщин, беременных и кормящих. Заболевание проявляется подъемом температуры тела, увеличением и плотностью отдельного участка или всей молочной железы, отеком, гиперемией кожи. Болезнь быстро прогрессирует, рано появляются метастазы
•рожистопадобную форма, проявляется уплотненим молочной железы, ее инфильтрацией, местным повышением температуры, краснотой кожи в виде пятна с неровными, языкообразными краями. Опухолевый узел не выявляется при пальпации. Раковые клетки распространяются преимущественно по внутрикожным лимфатическим сосудам раковый лимфангиит
•панцирный вариант рака, плотная инфильтрация кожи над молочной железой. При этой форме раковые клетки распространяются на железистую ткань, кожу и подкожную жировую клетчатку железы. Молочная железа уменьшена в размерах, ограниченно подвижна, кожа над ней уплотнена, поверхность неровная, напоминающая панцирь
Подтипы рака молочной железы:
На основании результатов генетического исследования раковой клетки специалисты выделяют три подтипа рака молочной железы:
1. Эстроген-рецептор положительный (ER-положительный) рак молочной железы. Для развития этого типа рака необходим гормон эстроген, который ускоряет размножение и предотвращает гибель раковых клеток. ER-положительный рак молочной железы – наименее агрессивная форма рака молочной железы, которую часто можно вылечить с помощью назначения лекарственных препаратов из группы селективных модуляторов эстрогеновых рецепторов, таких как тамоксифен, ралоксифен, торемифен, а также ингибиторов ароматазы, например, летрозола, анастрозола и экземестана. Модуляторы эстрогеновых рецепторов предотвращают передачу раковой клетке сигналов, стимулирующих ее рост и деление. Результаты исследований продемонстрировали эффективность применения этой группы лекарственных препаратов как в качестве средств терапии ER-положительного рака молочной железы, так и в качестве средств его профилактики. Ингибиторы ароматазы снижают поглощение эстрогена клетками и снижают концентрацию эстрогена в сыворотке крови, тканях и злокачественных клетках. Обычно препараты этой группы применяются у женщин в постменопаузальном периоде.
2. HER2-положительный рак молочной железы. При этом типе рака злокачественные клетки содержат большое количество специфического белка-протоонкогена HER2, помогающего им расти и размножаться. Такие лекарственные препараты, как трастузумаб, лапатиниб, пертузумаб и трастузумаба эмтансин, блокируют синтез белка и препятствует росту опухоли, уничтожая злокачественные клетки.
3. Тройной негативный (ER-негативный/PR-негативный/HER2-негативный) рак молочной железы – самый агрессивный тип рака молочной железы с наиболее неблагоприятным прогнозом. При этом типе рака злокачественные клетки не содержат рецепторов к эстрогенам, прогестерону и белку HER2. В настоящее время отсутствуют одобренные персонализированные методы лечения пациенток с тройным негативным раком молочной железы, но ученые смогли выделить шесть подтипов опухолей. Это – первый шаг на пути выявления биомаркеров, которые могут помочь разработать персонализированный подход к терапии тройного негативного рака молочной железы.
Предраковые заболевания:
Предраковые заболевания– состояния, предшествующие развитию ракового процесса. Современные ученые предполагают, что злокачественные новообразование практически никогда не развиваются в здоровом организме и каждому раку предшествует определенное предраковое заболевание. Считается, что процесс перехода нормальных клеток в опухоль имеет промежуточные этапы, диагностировать которые можно с помощью морфологических методов (изучения структуры тканей и клеток). Выявление предраковых заболеваний позволяет врачам выделять людей с повышенным риском возникновения рака, проводить систематическое наблюдение за ними и вовремя начинать противораковое лечение.
Выделяют четыре последовательные фазы развития рака:
I — факультативные предраковые заболевания;
II — облигатные предраковые заболевания;
III — прединвазивный рак или carcinoma in situ;
IV — ранний инвазивный рак.
Факультативные предраковые заболевания:
К факультативным предраковым состояниям можно отнести различные хронические болезни, сопровождающиеся атрофическими и дистрофическими изменениями ткани, а также нарушением восстановительных механизмов клеток. Это приводит к возникновению очагов чрезмерного деления клеток, среди которых возможен опухолевый рост. Факультативный предрак переходит в злокачественное новообразование относительно редко
Облигатные предраковые заболевания:
Облигатные предраковые заболевания чаще обусловлены врожденными или генетическими факторами и со временем перерождаются в рак. К ним относят дисплазию тканей и органов, которая сопровождается неполным развитием стволовых клеток ткани, нарушением равновесия между процессами размножения и созревания клеток. В большинстве органов дисплазия развивается на фоне предшествующего увеличения количества клеток (гиперплазии), связанного с хроническим воспалением.
Существует три степени дисплазии:
1)слабо выраженная (I степень),
2)умеренно выраженная (II степень)
Определяющий критерий степени дисплазии – выраженность атипии (изменения структуры) клеток. Со временем дисплазия может развиваться в различных направлениях – прогрессировать или, наоборот, регрессировать. Чем больше выражена дисплазия, тем меньше вероятность ее обратного развития и восстановления нормального строения ткани. Облигатные предраковые процессы требуют обязательного наблюдения у онколога и проведения комплекса мероприятий, направленных на предотвращение рака
Прединвазивный рак:
Прединвазивный рак («рак на месте») представляет собой раковый процесс, ограниченный только эпителиальным пластом при сохранении целостности базальной мембраны. Это скопление измененных клеток, которые не проникают в подлежащую ткань. Подтверждение диагноза прединвазивного рака основано на тщательном изучении пораженной ткани (гистологическом исследовании). Эта фаза может длиться довольно долго – до 10 лет и более. Моментом, определяющим формирование злокачественной опухоли из прединвазивного рака, является инвазивный (проникающий в другие ткани) рост новообразования.
Ранний инвазионный рак:
Микрокарцинома или ранний инвазивный рак – это злокачественная эпителиальная опухоль, которая прорастает за пределы базальной мембраны, но не более чем на 3 мм, не имеет метастазов. На этой фазе опухоль хорошо поддается лечению и имеет благоприятный прогноз (высокий уровень 5-летней выживаемости). При раннем инвазивном раке, как правило, показано хирургического лечения без дополнительного использования лучевой или химиотерапии.
Профилактика рака молочной железы у носителей мутаций генов BRCA 1 или BRCA 2:
В клинической генетике существует несколько подходов для наблюдения носителей мутаций генов BRCA I или BRCA 2. Они различны для больных и клинически здоровых пациентов из группы риска. При наблюдении больных — носителей патологического BRCA l/2-генотипа на первый план выходят вопросы: отличается ли клинико-морфологическая патология опухолей отягощенных пациентов, каковы оценки их выживаемости, какова чувствительность больных — носителей мутаций генов BRCA 1/2 к лучевой и химиотерапии, какие скрининговые методы должны использоваться для выявления вторых первичных опухолей, нужно ли проводить таким пациентам профилактические операции и какова их эффективность?
Для практически здоровых носителей мутаций наиболее актуальным является раннее выявление заболевания посредством скрининговых программ, изменение стиля жизни, химиопрофилактика и клинико-хирургические профилактические методы.
Доказано, что во всех развитых странах маммографический скрининг снижает смертность от рака молочной железы на 20%. Существует общая практика проведения ежегодного маммографического обследования в возрасте 35—50 лет женщинам — носительницам терминальных мутаций BRCA l/2-генов . Многие клиники продолжают настаивать на ежегодной маммографии до 70 лет. Если в семье есть случаи рака молочной железы, возникшего до 30 лет, маммографический скрининг следует начинать в 30 лет, однако нельзя забывать о возможности возникновения индуцированных облучением опухолей. Альтернативным скрининговым методом для наблюдения здоровых носителей мутаций BRCA 1 или BRCA 2 и женщин с неизвестным мутантным статусом из отягощенных семей является ядерно-магнитный резонанс молочных желез. Этот метод признан более чувствительным и безопасным.
Защитный эффект родов:
У женщин, имевших поздние первые роды в возрасте более 30 лет или не имевших родов, риск заболеть РМЖ в 2— 3 раза выше, чем у рожавших до 20 лет.
Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска. Риск заболеть раком молочной железы в возрасте до 40 лет в 5,3 раза выше у женщин, рожавших в возрасте более 30 лет, чем у рожавших до 20 лет.
Ранние роды не оказывают защитного действия у женщин, имеющих мутации BRCA I или BRCA 2. Рожавшие женщины — носительницы мутаций BRCA 1 или BRCA 2 существенно чаще (в 1,71 раза) заболевают раком молочной железы в возрасте до 40 лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска заболеть раком молочной железы в возрасте до 40 лет.
Применение тамоксифена:
Профилактическое применение тамоксифена в группах риска широко обсуждается. В основу предлагаемой на сегодняшний день гормонотерапии положены факты, свидетельствующие о том, что применение тамоксифена в 90 % случаев подавляет опухолевый рост при раке молочной железы. Это позволило предположить, что применение тамоксифена возможно и с профилактической целью. Подробное изучение механизма действия препарата выявило, что тамоксифен блокирует G1-фазу клеточного цикла и подавляет деление опухолевых клеток.
С 1980 г. были проведены большие клинические рандомизированные исследования по определению эффективности профилактического применения тамоксифена у женщин с высоким риском развития ракамолочной железы. Наиболее полные исследования были выполнены в 1986 г. в. Подобные исследования начаты в 1992 г. группой Европейского института онкологии в Италии. Обобщенные результаты этих исследовательских групп были опубликованы в 1998 г.
Рандомизированное исследование включало 13 388 женщин, разделенных на группы, принимающих тамоксифен и плацебо в дозе 20 мг вдень в течение 5 лет.
Участницы исследования были отобраны в связи с наличием факторов высокого риска развития рака молочной железы, который рассчитывался по алгоритму, учитывая возраст, число родственниц 1 степени родства, страдающих раком молочной железы, отсутствие родов в анамнезе или возраст первых родов, число биопсийных исследований ткани молочной железы.
Лечение рака груди:
Основными методами лечения рака молочной железы являются:
хирургическое удаление опухоли;
Хирургическое лечение:
Этот метод является основным и наиболее эффективным. Проводится частичное или полное удаление молочной железы.
Лампэктомия применяется для удаления пораженного небольшой опухолью (не более 4 см) участка молочной железы. При этом вместе с опухолью удаляются здоровые участки близлежащих тканей. После удаления проводится курс облучения или химиотерапии для уничтожения оставшихся раковых клеток и предотвращения повторного образования опухоли.
Если поражены лимфатические узлы, то производят их удаление. При неинвазивных формах рака узлы стараются сохранить, так как после их удаления у женщины развивается отек рук, ограничение движения в плечевом суставе, боли в груди.
Чтобы определить точно, поражены раком лимфоузлы или нет, во время операции обязательно проводится так называемая «биопсия сторожевого узла». Для этого вырезается один из подмышечных лимфатических узлов, обследуется на наличие в нем раковых клеток. Если они не обнаружены, остальные лимфоузлы сохраняются. Если же раковые клетки в лимфоузле обнаруживаются, это является свидетельством высокого риска распространения заболевания в другие органы и участки тела.
Обязательно проводится исследование удаленной ткани гистологическим методом для подтверждения раковой природы новообразования.
Секторальная резекция проводится в том случае, когда уплотнение небольшое (размер опухоли обычно 1-2 см) и не распространяется за пределы молочной железы. Делается надрез, пораженный участок удаляется, накладывается внутрикожный шов.
Центральная резекция применяется при множественных внутрипротоковых папилломах. Разрез проходит через все млечные протоки, вырезается здоровая ткань на 2-3 см вокруг опухоли. После такой операции впоследствии женщина не сможет кормить ребенка грудью.
Резекция соска проводится для диагностики рака соска и ареолы вокруг него. При этом затрагивается часть млечных протоков. После заживления в будущем могут возникнуть осложнения с лактацией.
Онкопластическая резекция — это операция частичного удаления пораженной ткани и ближайших к ней здоровых участков с одновременной пластической операцией по восстановлению формы груди. Используется пересадка здоровых тканей, причем, нередко приходится оперировать и вторую грудь для восстановления симметрии сосков и идентичной формы молочных желез. После такой операции обязательно проводится лучевая терапия.
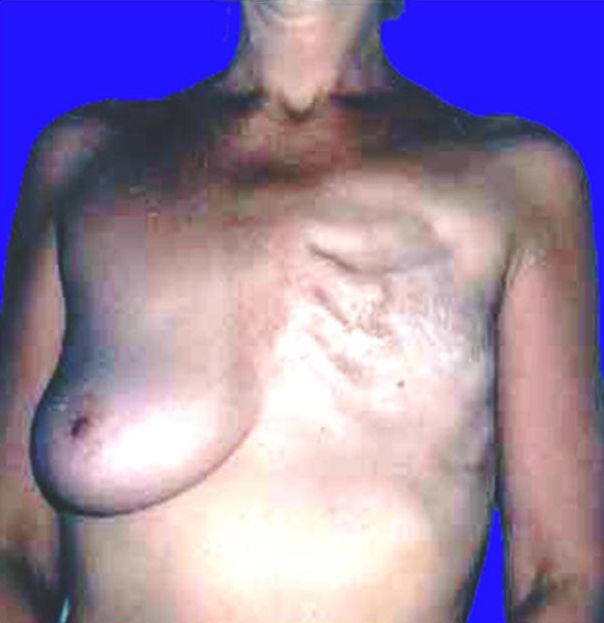
Мастэктомия. Удаляется молочная железа полностью, но лимфатические узлы не затрагиваются. Такая операция проводится при неинвазивных опухолях большого размера, наличии наследственной предрасположенности к раку груди, а также в профилактических целях. С помощью пластической операции можно восстановить железу.
Радикальная мастэктомия. Оперативное лечение рака молочной железы заключается в удалении не только ее самой, но и полном или частичном удалении соседних мышц и жировой ткани. Метод применяется при запущенных стадиях, когда множественные метастазы находятся в лимфатических узлах, пронизывающих эти ткани и мышцы. «Радикальное» удаление подразумевает полное избавление организма от раковых клеток и защиту от возникновения метастаз. Хирургическое удаление обязательно дополняется последующим радиолучевым и химиотерапевтическим лечением рака молочной железы.
Паллиативная мастэктомия. В том случае, когда метастазы уже появились или опухоль настолько обширна, что метастазы неизбежно должны появиться, проводятся операции, назначением которых является облегчение состояния пациентки. Опухоль устраняется частично для уменьшения площади поражения. При этом удаляются наиболее разрушенные или кровоточащие участки тканей. После этого применяется лекарственное лечение, помогающее снять боль, продлить жизнь.
Химиотерапия:
Лечение рака молочной железы с помощью лекарственных препаратов, убивающих раковые клетки. Лекарства назначаются строго индивидуально, так как выбор препарата зависит от многих факторов, среди которых тип опухоли, степень поражения, характер проведенной операции, орган, где была проведена операция.
Препараты химиотерапии являются сильнейшими аллергенами, вызывают тошноту и сильную рвоту. Они токсичны, влияют на работу сердца, печени, почек и других органов. Поэтому при выборе препаратов учитываются возраст и сопутствующие заболевания. Одновременно с приемом таких препаратов назначаются противоаллергические средства, которые должны приниматься заблаговременно.
Лечение можно проводить амбулаторно или в стационаре. Предпочтительнее проводить его в больнице под постоянным наблюдением врача. Здесь в случае появления рвоты больная может получить квалифицированную помощь, тогда как в домашних условиях ввести противорвотные средства, провести обезболивание в ночное время, как правило, труднее.
Обычно для излечения требуется 5-7 курсов химиотерапии. С учетом побочных действий и индивидуальной реакции организма проводится также лечение сопутствующих болезней, иначе провести курс полностью не удастся.
Гормонотерапия:
Большая часть (около 75%) всех видов злокачественных опухолей молочных желез являются гормонозависимыми. В их клетках имеются рецепторы, чувствительные к действию женских половых гормонов. Воздействуя на эти рецепторы, эстрогены и прогестероны ускоряют рост опухоли. Причем 10% из них чувствительны только к прогестерону, остальные зависят от гормонов обоих видов. Гормонозависимостью объясняется ускорение роста опухоли во время беременности или в разные фазы менструального цикла.
С помощью гормональных препаратов снижается уровень соответствующих гормонов, что приводит к уменьшению размеров опухоли или ее уничтожению. Эффективность гормонотерапии составляет от 10 до 70%.
Гормональная терапия назначается в тех случаях, когда у женщин имеется генетическая предрасположенность к раку молочной железы. Лечение проводится, если биопсия показала аномальный рост клеток какой-либо ткани при мастопатии. Это позволяет предотвратить их злокачественное перерождение.
Гормонотерапия применяется для уменьшения размеров большой опухоли перед проведением операции по ее удалению. Этот метод позволяет снизить риск повторного возникновения опухоли после операции, а также переход неинвазивной формы рака (карциномы) в инвазивную. Гормонотерапия, проведенная после комплексного оперативного, химиотерапевтического, радиолучевого лечения, позволяет защитить организм от распространения метастаз.
Лучевая терапия:
Метод радиоактивного облучения раковых опухолей позволяет на ранней стадии избавиться от них полностью, а на более поздних — существенно увеличить срок жизни пациенток. Особенно важную роль играет такое лечение при неполном удалении железы (органосохраняющих операциях).
Проводится облучение либо самой молочной железы со стороны опухоли, либо лимфатических узлов и мышц в области поражения. В зависимости от характера опухоли проводится наружное облучение или введение радиоактивного препарата в опухоль с помощью катетера.
Такое лечение рака груди не применяется при ряде заболеваний (сердечно-сосудистой недостаточности, анемии, сахарном диабете), а также не используется для лечения повторных опухолей из-за риска возникновения лучевой болезни. Использование современных методик позволяет избежать таких побочных действий, как тошнота и облысение, однако после лечения возможно появление лучевого дерматита, изъязвления кожи, а также болевых ощущений в груди, появления отека руки со стороны облучения, воспаления легкого.
Для наблюдения за ходом лечения рака молочной железы используются сцинтиграфия (рентген) костей грудной клетки и МРТ обследование. Курс облучения длится от 3-4 дней до 3-4 недель в зависимости от вида и стадии опухоли.
Таким образом, генетические подходы к ранней диагностике и профилактике рака молочной железы объединяют формально-генетические, цитогенетические, молекулярные и клинические методы, направленные на создание специализированного клинико-генетического регистра лиц — носителей патологического генотипа, организацию и координацию мониторинга за состоянием их здоровья, решение морально-этических и юридических проблем, связанных с доклинической диагностикой наследственной предрасположенности к развитию рака молочной железы, а также использование лекарственной и хирургической профилактики у таких лиц.
источник
По распространенности рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний. Он поражает ежегодно 1 млн. 600 тыс. женщин в мире и свыше 66 тыс. в Российской Федерации.
В ближайшие 20 лет во всех странах прогнозируется почти двукратное увеличение заболеваемости женщин раком груди, что объясняется увеличением продолжительности жизни и улучшением методов диагностики.
За последние годы, благодаря более раннему выявлению опухолей, смертность от рака груди у женщин снижается. В развитых странах, где применяется маммографический скрининг населения, этот показатель снизился на 30–50%.
Рак молочной железы – это не единообразное заболевание. При лечении клиницисты учитывают принадлежность опухоли к конкретному подтипу. Генетическое тестирование и иммуногистохимический метод, позволяют надежно определить биологические подтипы РМЖ. Эти подтипы сами по себе включают многие факторы риска и предсказывающие признаки, что позволяет выбрать наиболее эффективную терапию для больного.
Доказанное с помощью молекулярно-генетического анализа и иммуногистохимического исследования патогенетическое разнообразие РМЖ позволяет индивидуализировать лечение.
Увеличение выживаемости при раке молочной железы связано не только с широкомасштабным внедрением маммографического скрининга, но и адекватным использованием системных видов лечения.
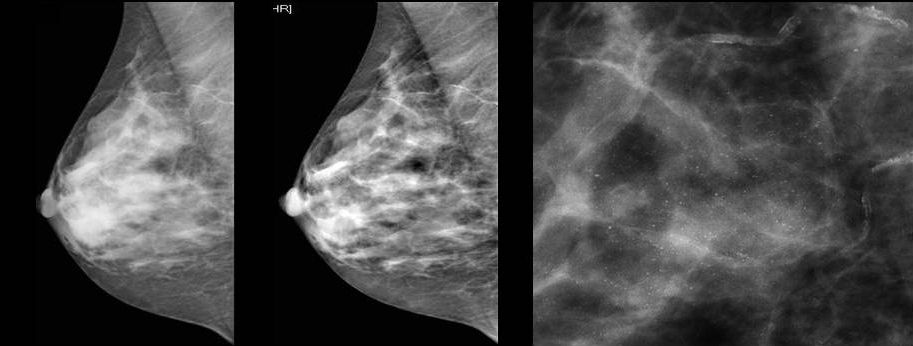
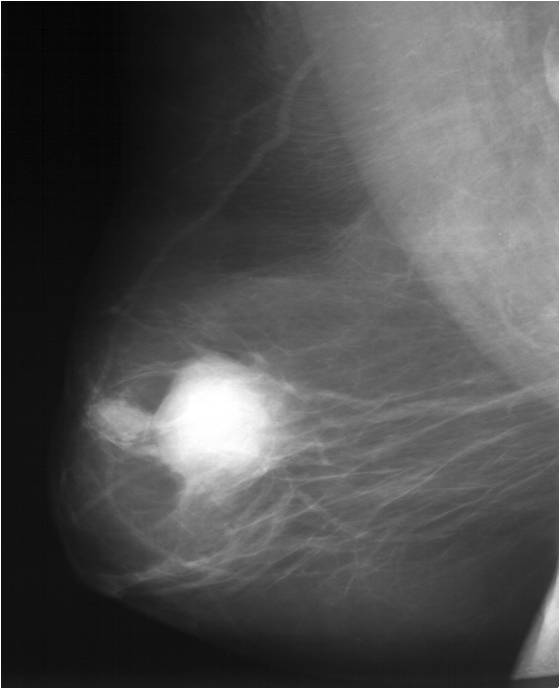
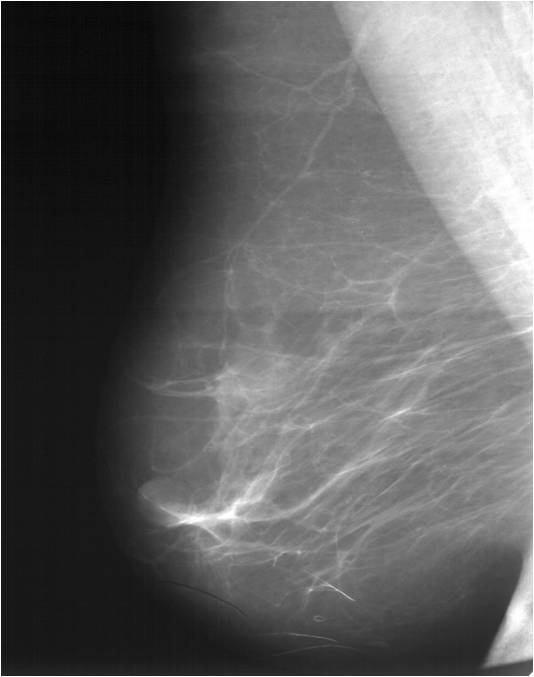
Для выявления злокачественных опухолей молочной железы существует определенный алгоритм диагностики, и его первичный элемент — маммографический скрининг. Чувствительность этого метода диагностики для опухолей от 2 мм до 5 мм составляет около 85%. Маммографическое исследование выполняют в двух проекциях.
Молодым женщинам с плотным строением молочной железы необходимо включение в программу наблюдения методов УЗИ и МРТ.
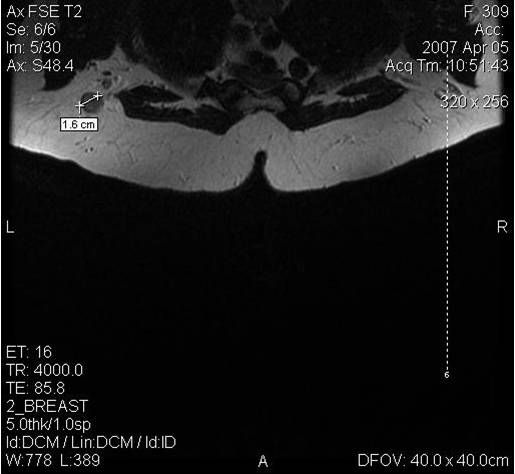
Поскольку традиционный маммографический скрининг у женщин до 40 лет малоэффективен, для скрининга может понадобиться альтернативная методика — МРТ. Современная контрастная магнитно-резонансная томография — высокочувствительный метод диагностики заболеваний молочной железы.
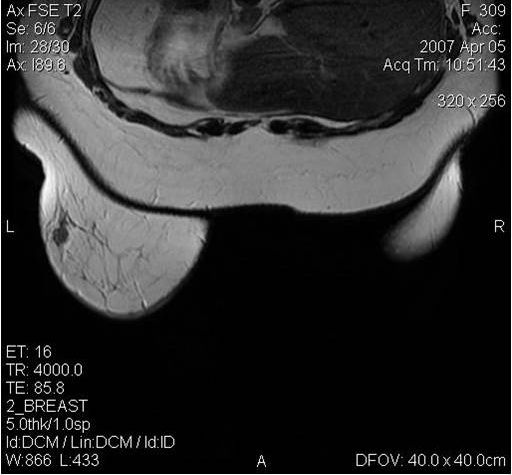
МРТ-диагностика рака молочной железы
У женщин с мутациями BRCA1 или BRCA2 при проведении МРТ возможно диагностировать рак молочной железы на самых ранних стадиях.
При ряде показаний женщинам назначается биопсия молочной железы под контролем УЗИ. Это исследование позволяет прицельно брать биологический материал для гистологического исследования, определения уровня экспрессии стероидных гормонов и статуса Her-2.
Известно множество факторов, повышающих риск возникновения рака молочной железы. На некоторые из них повлиять невозможно:
- семейная история по РМЖ,
- раннее менархе (начало месячных),
- позднее наступление менопаузы.
В то же время существуют и модифицируемые факторы, такие как:
- избыточный вес в постменопаузе,
- использование заместительной гормонотерапии,
- потребление алкоголя,
- курение
Стратегические шаги, направленные на снижение риска возникновения РМЖ включают контроль веса и борьбу с ожирением, регулярную физическую активность, уменьшение потребления алкоголя.
Большинство факторов риска рака молочной железы связано с действием гормонов на ткань молочной железы (раннее менархе, позднее наступление менопаузы, ожирение, применение гормональных препаратов). Считается, что именно женские половые гормоны, стимулируют процессы клеточного роста и повышают риски повреждения ДНК, что может привести к развитию злокачественного новообразования.
Только 5–10% случаев рака молочной железы обусловлены унаследованными мутантными генами BRCA. Но при этом, среди носителей мутаций риск возникновения заболевания может достигать 80%.
Чем младше возраст выявления первичного заболевания рака груди, тем выше вероятность заболеть контралатеральным раком, т.е. противоположной молочной железы.
Семейная история с наличием заболеваний раком молочной железы у кровных родственников, даже без ассоциации с мутациями BRCA, также повышает риск возникновения РМЖ.
Ожирение
Различными исследованиями доказано существование связи между заболеваемостью первичным РМЖ в постменопаузе и ожирением. Есть подтверждение связи между избыточным весом и низкой выживаемостью при всевозможных видах РМЖ.
Алкоголь
Алкоголь — также установленный фактор риска возникновения первичного РМЖ. Достоверность его отрицательного воздействия на пациентов, перенесших рак молочной железы, убедительна, так как он влияет на увеличение количества циркулирующих эстрогенов.
Только врач может оценить значимость различных симптомов. Однако каждой женщине необходимо знать, при каких симптомах надо обращаться к маммологу:
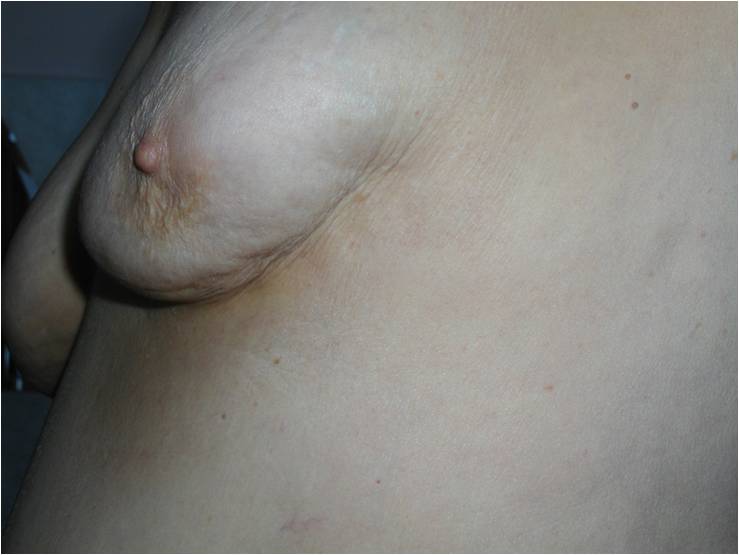
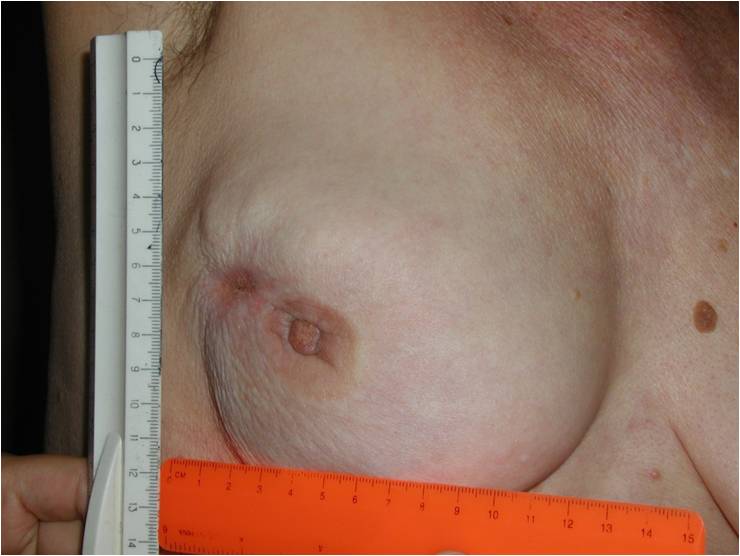
- «Образование», уплотнения, узел, инфильтрат, опухоль, «шарик» — что-то подобные этому вы обнаружили. Это еще не повод решить, что у вас РМЖ, но повод показаться специалисту.
- Деформация контура молочной железы, ареолы или соска (втяжение кожи или наоборот выбухание)
- Втяжение соска; особенно, если появилось недавно
- Выделение крови из соска
- Отек кожи всей молочной железы или ее локального участка
- Появление раздражения, мокнутые «ранки», язвочки, корочки на соске или ареоле
- Изъязвления (длительные, без видимой причины) на коже груди
- Дискомфорт в подмышечной области и обнаружение лимфоузлов ( «шариков» ) в подмышечной области
- Изменение цвета кожи молочной железы — покраснение, повышение температуры кожи в этой области.
Все эти симптомы могут быть проявлениями различных заболеваний (их насчитывается несколько десятков), возможно, не злокачественной природы. Однако, это может решить только специалист по заболеваниям молочной железы.
Признаки и симптомы рака молочной железы
0 стадия
Это стадия, когда не выявлена первичная опухоль, или она не может быть оценена, а также в случае неинвазивного рака молочной железы (что означает опухоль не выходит за границы своего появления, так называемый рак in situ).
1 стадия
Раковые клетки в этой стадии инвазируют или прорастают в соседние ткани. Опухолевый узел не более 2 см, лимфоузлы при этой стадии не поражены.
2 стадия
В этой стадии опухолевый узел превышает 2см и может достигать до 5см. При этой стадии могут быть поражены лимфоузлы, но поражение лимфоузлов носит одиночный характер, они не спаяны друг с другом и находятся на той же стороне, что и опухоль. В случае поражения лимфоузлов размер опухоли может быть и менее 2см.
3 стадия
Инвазивный рак, более 5 см или с явным и значительным поражением лимфатических узлов. При этом лимфоузлы могут быть спаяны между собой.
4 стадия
На этой стадии опухоль прорастает в кожу груди, грудную стенку либо во внутренние грудные лимфатические узлы. Она может быть любых размеров.
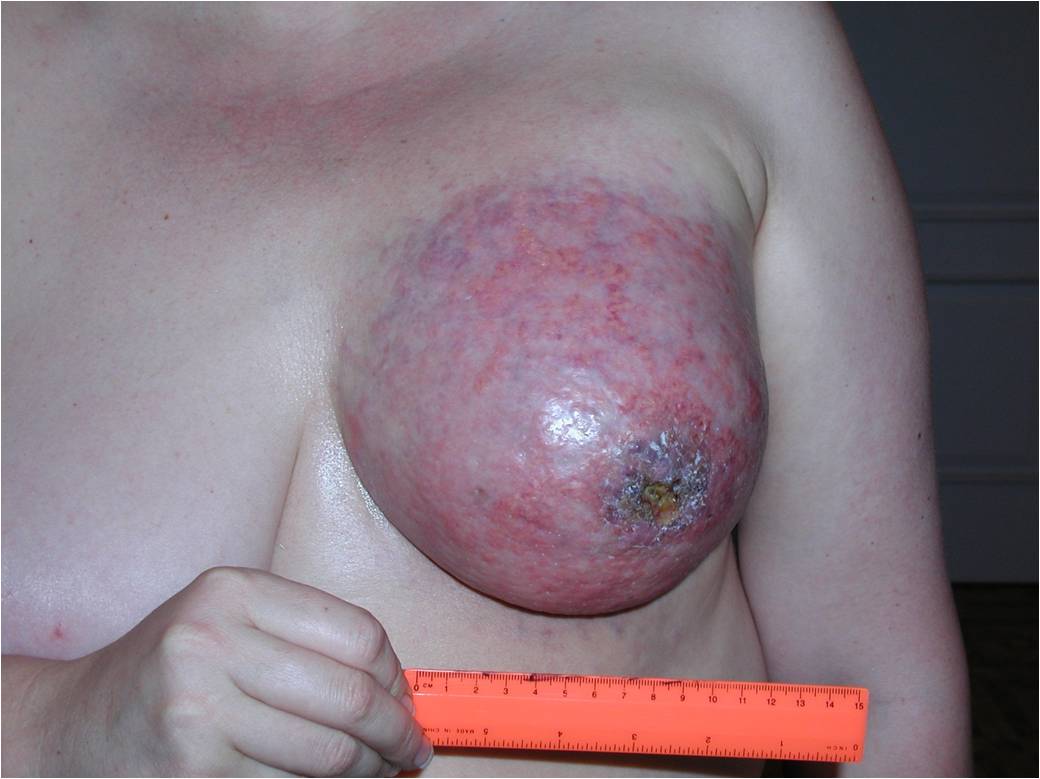
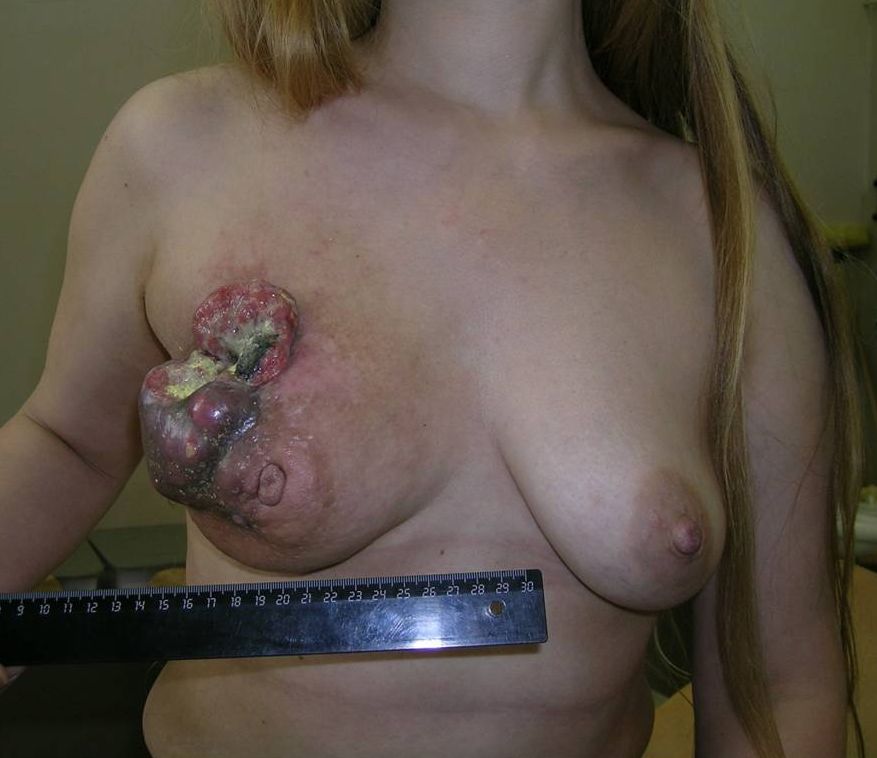
К 4 стадии рака молочной железы относится воспалительный рак, он встречается до 10 % всех случаев. Симптомы воспалительной формы рака груди это покраснение кожных покровов, железа становится теплой, отмечается увеличение и/или уплотнение части либо всей молочной железы. Кожа приобретает вид апельсиновой корки. Эту форму рака надо дифференцировать с воспалением молочной железы – маститом.
Также при 4 стадии опухоль может распространяться за пределы грудной клетки, в подмышечную область, внутренние грудные лимфатические узлы. Возможны метастазы в надключичные лимфатические узлы, а также в легкие, печень, кости или головной мозг.
Как выглядит рак груди в разных стадиях:
Хирургическая операция — основной метод лечения при опухолях груди, и от качества его проведения во многом зависит исход заболевания. По данным некоторых штатов Индии, в которых по религиозным мотивам не проводится хирургическое лечение, показатели заболеваемости практически равняются показателям смертности. Обычно смертность от РМЖ в два — четыре раза уступает заболеваемости.
Однако, после хирургического лечения чаще всего следует лучевое. Местное лечение без послеоперационной лучевой терапии часто приводит к локально-регионарным рецидивам заболевания. Дело в том, что после завершения хирургической операции невозможно исключить существования скрытых отдаленных метастазов. Даже у больных с опухолями менее 1 см в диаметре в 10% случаев возможен рецидив заболевания.
Локализация отдаленных метастазов при РМЖ
Сейчас во всем мире наблюдается тенденция к сокращению объема хирургического вмешательства без потери эффективности. Хирургическое и лучевое лечение РМЖ развивается и совершенствуется в направлении органосохранения.
Благодаря внедрению маммографического скрининга, резко возросло число больных с ранней стадией заболевания, когда лимфоузлы не поражены метастазами. В этом случае «классическое» удаление всех уровней лимфоузлов было бы избыточной калечащей процедурой. На помощь хирургам пришел метод биопсии сигнальных (сторожевых) лимфатических узлов.
Поскольку, метастазы в подмышечных лимфоузлах появляются последовательно от первого ко второму, затем к третьему уровню, то достаточно определить наличие метастазов именно в первом лимфоузле. Его назвали «сигнальным»: если сигнальный лимфатический узел не содержит метастазов, то другие лимфоузлы также не метастатические.
Благодаря этому органосохраняющему методу, тысячи пациенток избежали избыточной полной хирургической диссекции, удаление раковой опухоли не привело к удалению груди.
Последние результаты клинических испытаний, в том числе и при участии НИИ онкологии им. Н.Н. Петрова, подтвердили безопасность отказа от полной подмышечной диссекции. Биопсия сигнальных (сторожевых) лимфатических узлов постепенно вытесняет подмышечную диссекцию как стандартную процедуру стадирования РМЖ.
Концепция биопсии сигнальных лимфатических узлов приобретает все большее признание и введена для многих локализаций опухолей в стандарты хирургического лечения Европейской Организацией по Изучению и Лечению Рака (EORTC).
Химиотерапия, наряду с хирургическим вмешательством, является одним из основных методов терапии рака. Послеоперационная химиотерапия улучшает результаты хирургического лечения, как и прогноз заболевания.
Ранее решение о назначении химиотерапии основывалось на двух факторах:
- стадия заболевания
- состояние регионарных лимфоузлов.
Благодаря многочисленным исследованиям ученых изменяются представления о биологии рака молочной железы, и выбор режимов химиотерапии значительно расширяется. И сегодня химиотерапевтическое лечение назначают даже при отсутствии метастазов в лимфоузлах, если небольшие по размеру опухоли обладают агрессивными биологическими характеристиками.
Люминальный А рак
При люминальном А раке избегают назначать проведение химиотерапии, особенно при негативных лимфоузлах, и применяют одну эндокринотерапию.
Люминальный В рак
Люминальные В опухоли характеризуются высокой агрессивностью. В этом случае чаще всего будет назначена химиотерапия, а выбор лечения основывается на оценке риска развития рецидива.
HER2-позитивный рак молочной железы
Лечение HER2-позитивного рака молочной железы основано на применении стандартных схем химиотерапии – трастузумаб и ХТ, основанная на антрациклинах и таксанах. Однако, только небольшой процент пациентов выигрывает от лечения, но все подвержены связанной с этим токсичностью.
Трижды негативный РМЖ
Трижды негативный рак молочной железы обычно ассоциируется с плохим прогнозом. Из-за редкой встречаемости особых типов РМЖ нет достаточных данных о роли адъювантной химиотерапии.
Химиотерапия при РМЖ у очень молодых женщин
Рак молочной железы в молодом возрасте обычно протекает агрессивно, часто встречаются гормонорезистеные и HER2-позитивные опухоли с иными свойствами, чем у более пожилых женщин. Для таких пациенток, моложе 35 лет, адъювантная полихимиотерапия почти всегда является необходимым методом лечения.
Химиотерапия пожилых пациенток
У пожилых пациенток (старше 65 лет) при решении вопроса о назначении адъювантной химиотерапии обязательно учитываются общее состояние организма и наличие сопутствующих хронических заболеваний.
В идеале пожилые пациенты должны подвергаться гериатрической оценке для определения их «пригодности» к адъювантому лечению. Потенциальный эффект лечения должен быть сбалансирован с теми рисками для организма, которые несет химиотерапия. Врач определяет наиболее эффективный и при этом наиболее безопасный специфический режим, основываясь на подтипе опухоли и индивидуальных характеристиках пациента.
Гормонотерапия
Молодые женщины с гормоноположительным раком молочной железы сохраняют риск рецидива заболевания на протяжении по крайней мере 15 лет после первичного заболевания. Онкологи должны определить, кто из пациентов нуждается в долгосрочной адъювантной терапии тамоксифеном или ингибиторами ароматазы.
Неоадъюватная (предоперационная) терапия
Неоадъюватная терапия занимает ведущую роль в лечении женщин с неоперабельным раком молочной железы, а также имеет важное значение при операбельных опухолях, когда выполняются органосохраняющие операции.
Эффект неоадъювантного лечения ДО (слева) и ПОСЛЕ (справа)
Лучевое лечение после проведенного хирургического вмешательства играет важную роль в терапии рака молочной железы и прогнозе заболевания. В НМИЦ онкологии им. Н.Н. Петрова было проведено исследование роли лучевой терапии после органосохраняющих операций (секторальная резекция с аксиллярной лимфоаденэктомией) у пациенток с минимальным РМЖ.
Анализ десятилетней безрецидивной выживаемости доказал более высокую эффективность лечения в группе больных, где применялась послеоперационная лучевая терапия.
Использование лекарственных препаратов для снижения риска заболевания называется химиопрофилактикой. На сегодняшний день одобренными препаратами для профилактики рака молочной железы являются тамоксифен и ралоксифен.
Тамоксифен может использоваться как пременопаузальными, так и постменопаузальными женщинами. Прием тамоксифена приводит к снижению риска РМЖ на 38% на более чем 10 летний период. Наиболее распространенными нежелательными явлениями на фоне приема препарата являются приливы.
В настоящее время клинические исследования изучают роль другого класса препаратов – ингибиторов ароматазы для оценки эффектов снижения риска РМЖ, которые сегодня используются только для лечения РМЖ. Предварительные результаты оказываются многообещающими. Ингибиторы ароматазы действуют только у женщин с нефункционирующими яичниками.
Профилактические хирургические операции по удалению молочных желез проводятся только в одном случае – если женщина является носителем мутаций в генах BRCA1 и BRCA2, известных как «синдром Анджелины Джоли». Мировой практикой доказано, что при удалении ткани обеих молочных желез риски РМЖ снижаются более чем на 90%. Такие операции выполняются в клиниках США и Израиля. В Европе подход к этому вопросу более консервативный.
В НМИЦ онкологии им. Н.Н. Петрова при проведении хирургического лечения женщинам с мутациями BRCA1 предлагается профилактическое удаление и реконструкция молочной железы.
«Пациенты вообще могут поверить в любую чушь»
Октябрь во всем мире — месяц борьбы против рака молочной железы. Почему раком груди называют разные типы онкологии, как лечат их в России и почему при бесплатной медицине за лечение и анализы приходится платить? Что на самом деле значит диагноз «мастопатия»? Когда действительно стоит удалить грудь, как Анжелина Джоли, в целях профилактики? Всем ли надо делать генетические тесты на рак или не стоит тратить на это деньги?
The Village пригласил директора Фонда профилактики рака, онколога Илью Фоминцева задать профессиональные вопросы практикующему врачу, профессору Петру Криворотько — крупнейшему российскому маммологу, заведующему отделением опухолей молочной железы Национального онкологического центра имени Н. Н. Петрова.
Илья Фоминцев: Насколько онкологи могут влиять на смертность от рака молочной железы? Среди пациентов бытует такое мнение, что рак — это неизлечимая болезнь, а онкологи, напротив, постоянно «развенчивают этот миф».
Петр Криворотько: Я как раз отношусь к таким онкологам, которые этот миф не развенчивают. Впрочем, вот именно при раке молочной железы онкологи влияют на смертность, и влияют очень сильно. Да, рак неизлечим, но мы нередко можем перевести рак молочной железы в то состояние, когда он не повлияет на причину смерти. Мы можем отложить онкологическую историю на некоторый, довольно приличный период времени. И чаще всего этого периода хватает человеку, чтобы умереть от какой-то другой болезни, или, проще говоря, от старости.
— А в какой степени на эту отсрочку влияют действия онкологов, а в какой — биологические свойства самого рака груди?
— Да вообще-то, все влияет — и то, и другое. Впрочем, свойства опухоли влияют, наверное, больше, чем онкологи. Мы сейчас дошли до понимания, что рак молочной железы — это не один диагноз. Это маска, за которой скрывается огромное количество разных подтипов рака. Теперь мы даже начали думать, что научились их различать, хотя на самом деле это не совсем так. И наши успехи — это скорее доказательство нашего недостаточного понимания этой болезни. Есть представление у онкологов о том, что мы что-то знаем про рак молочной железы. Но в этом своем знании мы очень часто сталкиваемся с ситуациями, когда наши знания попросту не работают. Вот, например, мы знаем, что на поверхности опухоли есть молекулярный рецептор, мы даже имеем лекарство, которое этот рецептор может заблокировать, мы знаем, что при идеальном стечении обстоятельств у большинства таких пациенток мы сможем повлиять на размер опухоли. Но есть категория пациенток, у которых все есть: есть рецептор, есть молекула, а наше воздействие вообще никак не работает. Причин тут может быть огромное количество: может быть, мы неправильно определили этот рецептор, может быть, лекарство не очень хорошо работает. Но, скорее всего, все в порядке и с тем, и с другим, но есть какой-то третий фактор, на который мы пока никак не можем повлиять, поскольку вообще ничего о нем не знаем. Ровно так происходит с гормонотерапией рака молочной железы, которая применяется уже десятки лет. Идеальная, казалось бы, ситуация, чтобы вылечить пациентку. У пациентки есть опухоль, у опухоли есть рецепторы к половым гормонам. Мы блокируем эти рецепторы, гормоны не действуют на опухоль, и какое-то время опухоль не растет или не появляется вновь. Это может длиться месяцами, может годами. Но в какой-то момент опухоль начинает расти, не меняя своей биологии. Опухоль та же, лекарство то же, но оно не помогает. Почему? Не знаю.
Поэтому, если говорить о том, кто больше влияет на историю жизни и смерти — онколог или биология опухоли, я бы сказал так: онкологи пытаются влиять, и иногда им это удается. При раке молочной железы в большинстве случаев это удается.
Я не хочу сказать, что мы были шаманами, но на тот период мы недалеко от них ушли. При этом подавляющее большинство пациентов получали химиотерапию совершенно зря
— Раньше схем лечения рака груди было не так много, а сейчас их великое множество, и они подбираются для каждого пациента буквально индивидуально. На основе чего это происходит?
— История с эволюцией схем лечения вообще суперинтересная. Еще лет 10–15 назад все методы системной терапии рака были эмпирическими. Я не хочу сказать, что мы были шаманами, но на тот период мы недалеко от них ушли: мы тогда подбирали дозу, режим введения препарата, по большому счету никак не основываясь на биологических характеристиках опухоли. Еще 15 лет назад все клинические протоколы основывались только на статистических данных о том, как это снижает смертность у всех пациенток без разбору. И при этом подавляющее большинство пациентов получали эту терапию совершенно зря: она никак не влияла на их выживаемость. Самый яркий пример такого лечения — это адъювантная химиотерапия. Она проводится пациенткам, у которых уже нет никакой опухоли, мы ее хирургически удалили. И вот тут врач подходит к пациентке и говорит: «Вы знаете, Марьиванна, я блестяще провел операцию, у вас не осталось ни одной опухолевой клетки, но я вам назначу сейчас химиотерапию, от которой у вас вылезут волосы, вас будет тошнить, вы будете ненавидеть родственников, а родственники в итоге возненавидят вас. Это будет длиться шесть месяцев, и это вам поможет!»
И знаешь, что самое прикольное? Врач это говорил, абсолютно не зная, поможет или нет. Потому что, если мы возьмем оксфордский мета-анализ исследований адъювантной терапии рака молочной железы (это послеоперационная химиотерапия. — Прим. Ильи Фоминцева), по его результатам она действительно помогала. Но помогала только 10–12 % от всех пациенток. Фишка в том, что еще 15 лет назад врач не имел ни единого инструмента, чтобы заранее понять, кому она поможет, а кому нет. И вот, чтобы не потерять эти 10–12 %, ее назначали буквально всем!
С тех пор многое изменилось. Рак молочной железы тщательно изучили фундаментальные онкологи, и выяснилось, что рак молочной железы — это не одно заболевание. Это вообще разные болезни с разными биологическими характеристиками: с разным набором рецепторов на поверхности клеток, с разными мутациями внутри самой опухоли. И оказалось, что то лечение, которое проводилось раньше, эффективно только для определенных подтипов рака. И если это лечение применять в группе пациенток, которым оно не помогает, это не только не поможет, это ухудшит их состояние. Потому что она за просто так будет получать очень токсичное лечение. Химиотерапия — это ведь вовсе не витаминка.
Теперь уже есть такие термины, как «персонифицированная терапия», или «индивидуализация лечения». За этими словами фактически стоит стремление подобрать для конкретного пациента то лечение, которое — вероятно — будет для него эффективным в зависимости от биологических свойств конкретно его опухоли.
— Мы сейчас с тобой говорим по большей части о терапии рака груди. Но вот я хочу спросить тебя про хирургию. За последние годы объемы хирургического вмешательства при раке груди значительно уменьшились и продолжают уменьшаться. Нет ли такого шанса, что хирургию при раке молочной железы в скором времени можно будет и вовсе избежать?
— С одной стороны, действительно сейчас идут исследования о том, что есть подтипы опухолей, которые, скорее всего, вообще нет смысла оперировать, им достаточно будет подобрать схему терапевтического лечения. В MD Anderson Cancer Center уже год идет такое исследование, и, возможно, у нас они тоже будут (очень надеюсь, что мы найдем на них средства). Однако ожидать, что хирургия вообще исчезнет из маммологии в ближайшие десять лет, не стоит. Может быть, когда-нибудь у определенного биологического подтипа рака мы позволим себе не делать операцию.
— То, о чем ты рассказываешь: индивидуализация терапии, малоинвазивная хирургия рака груди. Насколько это вообще распространено в России?
— Страна у нас огромная. Есть центры, где блестяще лечат рак молочной железы, а есть центры, где медицина остановилась на Холстеде (операция Холстеда, калечащая операция большого объема при раке молочной железы. — Прим. И. Ф.). Я тут в одном диспансере спросил: «Сколько у вас выполняется органосохраняющих операций?» Они говорят: «Три». Спрашиваю: «Всего три процента. », — а мне в ответ: «Нет, три штуки в год». А так там всем делают Холстеда. Ты знаешь, моя любимая тема — биопсия сигнальных лимфоузлов, которую не просто не выполняют практически нигде в России. 90 % маммологов у нас считают, что это полная чушь!
— Расскажи немного об этом, пожалуйста, давай сделаем читателей более образованными, чем 90 % маммологов. Может, и врачей зацепим.
— Если коротко, это тест, который нужен для обоснованного уменьшения объема хирургического вмешательства. История такова: более 100 лет, чтобы вылечить рак молочной железы, удаляли первичную опухоль максимально широко и вместе с ней все лимфатические узлы, в которые чаще всего метастазирует рак. Для молочной железы — это подмышечные лимфоузлы. Так и делали: удаляли всю молочную железу и все подмышечные лимфоузлы. Считалось, что это лечебная процедура, которая положительно влияет на длительность жизни. После многих исследований оказалось, что в принципе это не сильно влияет на продолжительность жизни. Влияет биология опухоли, системная терапия. А вот удаление лимфоузлов практически не влияет на результаты лечения, при этом у большинства женщин на момент операции в лимфоузлах нет никаких метастазов.
И вот, представь себе, ты выполняешь операцию, а патоморфолог тебе говорит: «Ты выполнил блестящую операцию, удалил 30 лимфоузлов. И ни в одном из них нет метастазов!» Ты в этот момент можешь объяснить главному врачу, зачем ты это сделал, объяснить это своему коллеге абдоминальному хирургу (абдоминальные онкологи занимаются опухолями ЖКТ, как правило, меньше знают о биологии опухоли и гораздо больше о хирургии. — Прим. И. Ф.). Ты, разумеется, можешь объяснить это пациенту: пациенты вообще могут поверить в любую чушь. Но вот попробуй объяснить это себе! Зачем ты удалил 30 здоровых лимфатических узлов?!
Ведь это очень сильно влияет на качество жизни, это очень жестокая хирургическая травма. Рука со стороны операции после этого не сможет нормально функционировать, будет отечной. Ведь даже инвалидность пациенткам дают именно из-за этого — потому что рука плохо работает, а вовсе не из за отсутствия молочной железы!
При этом в большинстве случаев эта травма наносится совершенно зря. Скажу больше, она, скорее всего, выполняется зря всем. В реальности нам от лимфоузлов достаточно только знать, поражены они метастазами или нет, удалять их при этом, скорее всего, нет никакой необходимости, даже если они и поражены. И сейчас уже проходят исследования, которые это подтверждают.
Так вот, биопсия сигнальных лимфоузлов нужна, чтобы понять, что с лимфоузлами — поражены они или нет. И на основании этого обоснованно отказаться от вмешательства на лимфоузлах у подавляющего большинства пациентов, чтобы сохранить им качество жизни. И вот этого не просто не делают, этого даже не понимают практически нигде в России.
Самое крутое, с моей точки зрения, — это научное обоснование возможности сохранить молочную железу. Еще 30 лет назад молочную железу не сохранял никто и нигде
— Кромешный ужас, конечно, но не новость. Перейдем к хорошему, что ж мы все о плохом. Какие бы ты назвал основные прорывы в лечении рака груди за последние 50 лет? За что бы ты дал свою личную премию имени Петра Криворотько?
— Самое крутое, с моей точки зрения, — это научное обоснование возможности сохранить молочную железу. Еще 30 лет назад молочную железу не сохранял никто и нигде. Это следствие не только изменения в понимании прогрессирования рака, это еще и достижения в области лучевой терапии.
Второй прорыв на самом деле совсем недавний. Только в 2000-х годах появились первые революционные исследования, которые показали, что основным фактором в прогнозе является биологический подтип рака, а не стадия. И это и есть объяснение тому, как такое происходит, когда мы выявляем совсем маленькую опухоль, оперируем ее, хлопаем в ладоши от радости, а через год пациентка умирает от метастазов, или, наоборот, когда мы выявляем огромную опухоль, и пациентка потом живет долгие годы.
За последние десять лет выделили уже более 20 молекулярных подтипов рака молочной железы. И, сдается мне, их количество будет только увеличиваться. А с ними и наше понимание, как правильно подобрать лечение пациентке. И сейчас уже большинство пациенток укладывается в наше понимание биологических подтипов. Непонимание остается только уже с относительно небольшой группой людей — там мы все еще подбираем лечение наугад.
— А есть ли в России вообще технические возможности все эти биологические подтипы определять? Равномерно ли они распределены по регионам?
— Да, конечно, тут есть проблемы. Можно много говорить о великом, но если нет материальной базы для этого всего, то ничего не будет. Для того чтобы понять биологию опухоли, необходимо провести серию тестов, которые позволяют оценить биологию опухоли хотя бы суррогатно, не на генном уровне. Эти тесты дорогие, и они доступны, скажем так мягко, не везде. Хотя, впрочем, и тут за последние десять лет картина изменилась. Сейчас в той или иной форме хотя бы основные тесты делают практически во всех диспансерах страны, но проблема тут в качестве и сроках. Сроки этих исследований доходят в некоторых диспансерах до пяти недель, хотя в нормальной лаборатории это можно сделать за три дня. И все это время и пациентка, и врач ждут результатов, без которых продолжить лечение невозможно. А время идет, за пять недель опухоль может вырасти.
— Как ты думаешь, сколько нужно пациентке денег, чтобы закрыть финансовые дыры в государственных гарантиях? Можно ли лечить рак груди в России полностью бесплатно и при этом качественно?
— Я работаю в федеральном учреждении, тут совершенно другие принципы финансирования лечения, чем в регионах. У нас прекрасные возможности по лечению рака, тут мы практически все можем сделать за счет государства, но государство нам не оплачивает диагностику рака до момента установления диагноза. Так устроено финансирование федеральных центров. Приходится пациентам платить за все обследования до тех пор, пока диагноз не будет полностью установлен, и если это рак, то с этого момента для них все действительно бесплатно, ну, во всяком случае, на бумаге. В реальности бывают ситуации, когда пациентам целесообразнее заплатить за что-то. Однако основную часть все-таки покрывает государство.
Что касается сумм, то давай будем говорить поэтапно: вот пациентка почувствовала что-то неладное в молочной железе, или в ходе какого-то спонтанного обследования у нее выявилось подозрение на РМЖ. Для того чтобы поставить диагноз быстро, адекватно и правильно, ей понадобиться примерно 50 тысяч рублей. Именно столько придется потратить на исследования, которые нужны для верной постановки диагноза. Для жителей больших городов эта сумма еще более ли менее доступна, хотя даже здесь у всех разные возможности. И это, заметь, только диагностика, которая необходима, чтобы назначить лечение.
А теперь поговорим о самом лечении. На самом деле, как это ни странно, но в РФ стандарт лечения бесплатно может получить любая женщина. Вопрос только в том, какой это будет стандарт. Выполнить удаление молочной железы с полным удалением лимфоузлов можно бесплатно в любом диспансере, и его выполняют. Но вот тут начинаются нюансы. Во-первых, вопрос в том, насколько грамотно было проведено дооперационное обследование. Как я уже говорил, необходимую иммуногистохимию делают далеко не все. И, например, если стандарт нашего учреждения — это выполнение обследований с использованием КТ грудной клетки и брюшной полости с контрастированием, то в регионах этого, как правило, нет и в помине: в большинстве учреждений делают только флюорографию и УЗИ брюшной полости. Я сейчас не говорю даже о качестве. Но флюорография, даже в самых опытных руках, не имеет никакой адекватной информативности для онкологов.
Вот еще пример: рентген легких, сделанный на протяжении последних трех месяцев повсеместно принимается как подтверждение отсутствия метастазов в легкие. Я и многие мои коллеги считаем, что это, мягко говоря, неправильно.
Одним словом, стандартное лечение доступно бесплатно каждой гражданке нашей необъятной Родины. Вопрос только в стандартах, которые применяются. В реальности в очень многих диспансерах невозможно современное лечение. Ну что вот делать онкологу, у которого либо вовсе нет лучевой терапии, либо есть такая, что лучше бы не было ее? Разумеется, он не сможет делать органосохраняющие операции, ведь ему потом невозможно нормально облучить пациентку. Он сделает мастэктомию из лучших побуждений.
Ну и наконец, следующий этап — стоимость лекарств. Лекарства стоят дорого, и здесь, и во всем мире. И не все регионы могут себе позволить купить весь спектр препаратов. Поэтому пациенту часто предлагается «стандартная» терапия, которая существует уже давно и, строго говоря, не является ошибочной. Парадокс химиотерапии в том, что она предлагает огромный спектр препаратов — от дешевых схем до очень дорогих. При этом разница в результате лечения не такая уж и революционная: не в два или три раза. Дорогая может быть эффективнее на 15–40 %.
Что в этом случае делает врач? Врач назначает дешевую схему за счет бюджета государства, не слишком кривя душой: честно назначает то, что его диспансер закупил. Если он назначит дорогие препараты, которые его диспансер не закупает, ему, безусловно, влетит от начальства. А когда пациентка приходит, например, за вторым мнением к онкологу, не имеющему отношения к ситуации, и он говорит, что можно применить более дорогостоящее и эффективное лечение, то вот тут и начинаются дополнительные траты. А сколько их будет, зависит от ситуации, бывает, что и очень много.
— Это просто ад! Мастопатия — это не болезнь. Нет такого диагноза нигде в мире. И уж конечно, это не «переходит в рак» — это уж полная ахинея. Самое ужасное, что это отнимает силы и время у врачей, которые погружаются в эту историю.
Я много думал на эту тему и даже не понимаю, откуда эта хрень вообще пошла. Помню, что в 1998 году, когда я пришел работать в диспансер, этого добра там уже было навалом. Молочная железа может болеть не только раком. Болезни, кроме рака, могут быть: есть доброкачественные опухоли, есть всевозможные состояния, связанные с образованием кист. Иногда кисты бывают огромных размеров, они воспаляются, болят. Это все можно и нужно лечить. Но мы снова и снова упираемся в вопрос квалификации наших докторов: узистов, онкологов, маммологов. Им легче поставить какой-то непонятный диагноз, чем сказать женщине, что у нее все хорошо.
— Если говорить о сухих данных, то заболеваемость среди женщин от 20 до 40 лет никак не изменилась с 70-х годов. Вообще, это любопытный миф! Откуда он взялся? Во-первых, за последние 20 лет информационное поле расширилось до неимоверных границ. И если социальных сетей раньше не было, то теперь у нас огромное количество каналов, в которых все обсуждают важные и личные темы. Если раньше пациентки с таким диагнозом особенно никому о нем не говорили, порой даже родственники не знали, что женщина больна, то теперь есть огромное количество пациентов, которые открыто об этом говорят и даже делают из лечения что-то вроде шоу. В американском и британском фейсбуке есть даже премии за лучший блог больной раком груди. На этом уже даже умудряются делать деньги. И в информационном пространстве чаще проскакивают сообщения о том, что раком болеет какая-нибудь молодая симпатичная женщина. Вообще-то, 20 лет назад другая симпатичная молодая женщина тоже болела, но а) она часто просто не знала своего диагноза, б) она его стыдилась, если даже и знала, и в) ей было негде распространить эту информацию.
— Да, но сложно сказать однозначно за всех. Есть молодые, которые уже хорошо и по-настоящему знакомы с болезнью. И они настолько хорошо разбираются в теме, что иногда даже пасуешь давать какие-то советы. Я не знаю, хорошо это или плохо.
Есть и другие пациенты, которые перечитали кучу информации о РМЖ, но совершенно не той — ложной. И переубедить их порой бывает просто невозможно. Есть и третий тип — те, кто смирился с концом. Чаще всего у них есть пример старших родственников — бабушек, мам, у которых болезнь протекала очень тяжело.
А бывает напротив, что пациентки после курса лечения преображаются, начинают какую-то совершенно новую жизнь, в их глазах загорается огонь. Но таких немного, и они, как правило, уже постарше. В основном все-таки это трагедия.
Да, пожалуй, с молодыми работать тяжелее.
Если говорить о тех, у кого перед глазами были плохие примеры с тяжелыми болезнями. Тут речь идет о наследственном раке молочной железы.
Как правило, это женщины с онкогенными мутациями. Сейчас, к слову, генетическое тестирование нужно не только, чтобы оценить риск заболеть раком. Это нужно еще и для того, чтобы определиться с тактикой у тех, кто уже заболел.
— Я бы сказал всем, но боюсь, мне влетит от всего онкологического сообщества. Правда, всем этого делать не стоит. Начнем с того, что это недешево. Стоит пройти тестирование, если мы говорим о наследственном раке. Тут у нас в любом случае есть какая-то семейная история: если болели и бабушка, и мама, то дочь находится в группе риска. Если были случаи рака яичников в семье, и это была близкая родственница. Этот тест достаточно сделать один раз в жизни.
— Это огромная головная боль не только пациентки, но и моя. Вот что могу сказать. Во-первых, «предупрежден — значит вооружен». Мы знаем, что генетическая предрасположенность повышает шанс заболеть раком, но это не значит, что это случится завтра или вообще случится. Во-вторых, можно более активно проходить обследования — делать ежегодно МРТ молочной железы, и это вовсе не значит, что нужно перестать жить, — можно продолжать рожать детей, растить их, радоваться жизни. А когда вопрос с детьми закрыт, прийти к онкологу и попросить профилактическую мастэктомию. Но дело в том, что даже полное удаление железы не гарантирует того, что женщина не заболеет. Это бывает редко, но не предупредить пациентку мы об этом не можем. И все-таки тестирование нужно делать: это знание может снизить риск смерти от рака молочной железы.
— Не отчаиваться. И не впадать в панику. Это штука, которая в большинстве случаев вылечивается. И даже если уже есть метастазы, это не катастрофа. Это болезнь, которую онкологи стараются перевести в состояние хронической болезни. Мы, может, не можем ее вылечить окончательно, но в наших силах сделать так, что жизнь будет продолжаться, и это очень важно. Это первый совет.
Второй очень важный совет: найдите медицинский центр, не врача, а центр, где вы будете получать лечение.
— Это очень тяжело, очень. Во-первых, этот центр должен иметь соответствующее оснащение. Но для обывателей тяжело понять, какое оснащение хорошее, а какое нет. Например, лучевая терапия обязательно должна быть в принципе, бывает, что ее нет вовсе. Патоморфологическая лаборатория обязательно должна быть такая, которая может делать любые молекулярные тесты. Должно быть собственное отделение химиотерапии.
— Вот если, предположим, придет женщина к врачу и спросит: «Какой процент органосохраняющих операций вы выполняете?» Это критерий?
— Ты знаешь, большинство врачей просто пошлют ее и даже не будут разговаривать. Впрочем, если ко мне придет женщина и спросит, какой процент, я ей отвечу — мне не стыдно отвечать. Мне кажется, вот какой критерий важен: любой уважающий себя центр должен владеть всем спектром хирургических вмешательств при раке молочной железы. В нем должны делать мастэктомию, органосохраняющие операции, все виды реконструкций: с пересаженными лоскутами, с имплантами, с экспандерами, с совмещением методик. И если центр не владеет хотя бы одной методикой — это неправильно. Значит, что-то у них там в Датском королевстве не так.
Что еще? Важно, чтобы в центре, который вы выбираете для лечения, врачи говорили на английском языке. Хотя бы некоторые. А все остальные читали. Но проверить это или сложно, или невозможно.
Ну и наконец, ремонт еще должен быть нормальный. Должны палаты быть чистыми и красивыми. Ну не верю я, что в 12-местной палате оказывают нормальное лечение. Если бардак в отделении, значит, бардак и в головах. Если у главврача хватает времени и сил банальные вещи создать, то есть шанс, что у него хватит времени и сил сделать нормальную патоморфологию. Не помню я, чтобы была шикарная патоморфология, а вокруг разруха. Обычно все наоборот.
Но сейчас на самом деле много диспансеров в стране более чем приличных.
— Казань. Вообще шикарные ребята. Самара — шикарные ребята. Липецк — шикарные. Это, кстати, мой родной город, и там хорошая служба, там хорошее оснащение.
Ты знаешь, Тюмень приятно удивляет. Иркутск! Но Иркутск, надо понимать, это «роль личности в истории» (в Иркутске много лет работает главным врачом онкодиспансера легендарная среди онкологов В. В. Дворниченко. — Прим. И. Ф.). Иркутск — очень сильная контора. Новосибирск еще. В Екатеринбурге сильный центр у профессора Демидова в 40-й больнице.
— А вот такой вопрос тебе провокационный. Если взять всех маммологов РФ, какой процент из них ты бы навскидку назвал хорошими?
— Я не совсем понимаю, когда говорят «хороший доктор» в нашей профессии. Безусловно, доктор Айболит должен быть хорошим. Но современная онкология и лечение рака молочной железы в частности — это команда. Поэтому вместо «хороший доктор» надо говорить «хороший центр». А доктор, с которым вы будете общаться, — это зависит от вашего психотипа. Если вам надо в жилетку плакать, найдите доктора, которому вы будете плакать в жилетку. Если с вами надо строгим тоном в армейском стиле — найдите себе такого. Но ищите их в хорошем центре.
— Окей, тогда перефразирую вопрос. Всего в стране около сотни центров, которые занимаются раком молочной железы: по одному в регионах, еще федеральные центры, частные клиники. Какой процент из них хороших?
— Я не везде бывал. Но думаю, что нормальных процентов 30. Опять же, когда мы посещаем коллег, мы видим позитивные стороны. Понятное дело, что это может быть «ошибкой выжившего», ведь я посещаю центры, в которые зовут, а, стало быть, это во всяком случае активные люди. Но надеюсь, что хотя бы 30 % из всех центров в стране — хорошие.
источник