Рак молочной железы является одним из распространенных онкологических заболеваний, которое поражает, как молодых девушек, так и пожилых женщин. Курс химиотерапии при раке молочной железы основывается на использовании лекарственных препаратов, замедляющих развитие раковых клеток и разрушающих опухоль. При правильно подобранных терапевтических мероприятиях отмечается улучшение прогноза заболевания и состояние женщины.
В Юсуповской больницы специалисты выполняют высокоточную диагностику онкологических заболеваний в минимальные сроки. Химия терапия при раке молочной железы проводится врачами-онкологами с использованием различных схем, применяемых в зарубежных странах. Специалисты клиники онкологии ответственно подходят к лечению каждой пациентки. В ходе прима врач-онколог объясняет, как проходит химиотерапия при раке молочной железы, пациенткам, которым показана данная процедура и рассказывает о возможных последствиях.
Специалистами Юсуповской больницы накоплен большой опыт онкологических заболеваний у женщин. Правильно поставленный диагноз позволяет выбрать наиболее эффективный метод лечения, поэтому при обращении пациенток с симптомами данного заболевания проводится комплексная диагностика. Химиотерапевтическое лечение является самостоятельным методом лечения, который при сочетании с оперативным вмешательством или лучевой терапией позволяет улучшить состояние женщины и добиться длительного излечения болезни.
Выделяют следующие виды химиотерапии, проводимые при данном заболевании:
- неоадъювантная терапия рака молочной железы показана пациенткам перед оперативным вмешательством. Предоперационная терапия подавляет рост злокачественной опухоли и снижает вероятность ее метастазирования;
- адъювантная химиотерапия направлена на предупреждение развития онкологического процесса после хирургического вмешательства. Схема химиотерапии ас при раке молочной железы, основанная на использовании циклофосфамида и паклитаксела является одни из компонентов адъювантной терапии. Данная разновидность химиотерапии может применяться в качестве дополнительного метода лечения для устранения скрытых метастаз;
- таргетная терапия при раке молочной железы является быстроразвивающимся методом. Перед его использованием пациенткам назначаются иммуногистохимическое и генетическое исследование, после которых возможно использование препаратов. Принцип действия таргетных препаратов заключается в замедлении роста пораженных клеток и запуске механизма саморазрушения;
- индукционная терапия назначается женщинам при наличии противопоказаний для оперативного удаления опухоли или чувствительности новообразования к лекарственным препаратам. Лечебная химиотерапия используется в качестве одного из методов паллиативной помощи для устранения симптоматики;
- гипертермическая химия при раке молочной железы эффективна при крупных опухолях. Принцип действия данного метода заключается в воздействии на опухоль лекарственными средствами при высоких температурах;
- щадящая химиотерапия основывается на использовании препаратов, обладающих минимальными побочными эффектами, в результате чего специалистами отмечается низкая эффективность данного метода;
- платиновая химиотерапия предполагает использование препаратов, содержащих платину. Такие лекарственные препараты, как Фенантриплатин и Цисплатин обладают выраженным действием в борьбе с раковыми клетками;
- паллиативная химия терапия при раке молочной железы показана пациенткам при неблагоприятных прогнозах. Основной целью данного метода является улучшение качества жизни больных, увеличение продолжительности жизни и снижение негативного воздействия раковых клеток на организм.
Пациенты с онкологическими заболеваниями нуждаются в регулярном уходе и психологической поддержке, которые оказывает персонал Юсуповской больницы. Поддержка близких и родных людей имеет особое значение для пациентов клиники онкологии, поэтому время их посещения не ограничено. Для стационарного лечения пациентов в Юсуповской больнице предусмотрены комфортные палаты с необходимой мебелью, оборудованием, выходом в сети Интернет.
Химиотерапевтическое лечение принято также подразделять в зависимости от цвета используемого препарата. Наиболее часто при лечении данной болезни проводится белая и красная химия при раке молочной железы.
Красная химиотерапия отличается большим количеством побочных эффектов, вызванных следующими препаратами: идарубицин, доксорубицин и эпирубицин. Данные лекарственные препараты агрессивно разрушают раковые клетки, однако при этом также поражаются здоровые ткани.
Химиотерапевтические препараты красного цвет показаны пациенткам для уменьшения размера первичного очага, предотвращения дальнейшего метастазирования опухоли и при неэффективности других препаратов для достижения ремиссии. Отказ от химиотерапии при раке молочной железы возможен при наличии серьезных противопоказаний, однако при этом лечение пациентки осуществляется другими методами.
Химиотерапия при раке молочной железы назначается женщинам после комплексного обследования. В клинике онкологии Юсуповской больницы имеется современное диагностическое оборудование, позволяющее выявлять очаги поражения на начальной стадии развития. Информация, полученная в ходе обследования, позволяет специалистам выбрать наиболее эффективные пути лечения онкологии. После определения объема терапевтических мероприятий рассчитывается стоимость химиотерапии при раке молочной железы.
Белые препараты для химиотерапии при раке молочной железы основана на введении таксола и такосела. Одним из основных показаний к белой терапии является повышенная чувствительность к другим медикаментам. Данная схема лечения отличается сниженной токсической нагрузкой на организм.
Курс химиотерапии при раке молочной железы, длительность которого определяется стадией заболевания и объемом поражения, подбирается врачами-онкологами Юсуповской больницы после высокоточной диагностики. При лечении онкологических заболеваний специалисты используют только обоснованные методы, применяемые в мировой медицинской практике.
Одним из основных методов лечения является неоадъювантная химиотерапия при раке молочной железы. Прием химиотерапевтических препаратов направлен на подготовку организма к хирургическому вмешательству. После проведения операции пациентке также назначаются лекарственные препараты, однако их токсическое воздействие на организм снижено.
В клинике онкологии Юсуповской больницы каждый обратившийся пациент получает качественную медицинскую помощь. Высококвалифицированные врачи-онкологи проводят лечение даже тех пациентов, от которых отказались в других медицинских учреждениях. Схемы химиотерапии при раке молочной железы составляются специалистами с учетом множества факторов.
Врачи-онкологи Юсуповской больницы обращают внимание пациенток на то, что реакция на химиотерапию при раке молочной железы может быть различной. Лечению химиотерапевтическими препаратами предшествуют подготовительные мероприятия.
Обязательным условием при онкологических заболеваниях является отказ от употребления алкоголя и курения. Специалисты Юсуповской больницы на подготовительном этапе проводят лечение сопутствующих заболеваний. Химиотерапия ас при раке молочной железы и другие схемы являются серьезной нагрузкой для почек, печени и желудочно-кишечного тракта, поэтому для их защиты назначаются определенные медикаменты.
Врачами-онкологами Юсуповской больницы используются различные виды химиотерапии, так, таргетная терапия при раке молочной железы назначается пациенткам, у которых обнаружены метастазы и другие препараты не дают положительного эффекта.
Современное оборудование, большой опыт специалистов Юсуповской больницы и сотрудничество с крупными научными центрами позволяют врачам-онкологам проводить эффективное лечение злокачественных опухолей и минимизировать последствия химиотерапии при раке молочной железы.
Сочетание различных методов терапии позволяет не только улучшать качество жизни больных, но и достигать длительной ремиссии. Химиотерапия при раке молочной железы после операции применяется для уничтожения микроскопических опухолевых очагов.
источник
Роль полусинтетического Таксола (паклитаксел) для инъекций в неоадъювантном лечении рака молочной железы
НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ В ЛЕЧЕНИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Неоадъювантная химиотерапия стала стандартной процедурой в лечении местнораспространенной формы рака молочной железы, и в настоящее время исследуются ее показания в отношении ранних форм операбельного заболевания [1-3]. Главные задачи неоадъювантной химиотерапии заключаются в улучшении местного контроля заболевания за счет подавления первичной опухоли (до более низкой стадии), в обеспечении возможности хирургической операции, сберегающей молочную железу, и теоретически в уничтожении отдаленных микрометастазов (Таблица 1) [2-4]. В исследованиях по неоадъювантной химиотерапии сообщалось о высоком общем проценте ремиссий, включая полные ремиссии, подтвержденные данными патологического исследования, а также об эффективном снижении стадии первичной опухоли: после неоадъювантной химиотерапии у 60-80% больных с операбельной формой рака молочной железы можно проводить орган-сберегающую хирургическую операцию [2].
Таблица 1. Преимущества неоадъювантной химиотерапии при лечении рака молочной железы [2-4]
| Раннее начало системного лечения |
Из работы Хортобади и соавт. [4]
Важным клиническим преимуществом неоадъювантной химиотерапии является то, что она позволяет оценить реакцию первичной опухоли и лимфатических узлов с метастазами на лечение in vivo [3, 4]. В нескольких исследованиях было показано, что полная ремиссия первичной опухоли после неоадъювантной химиотерапии, подтвержденная данными патологического исследования, является надежным предиктором отсутствия опухолевого процесса в лимфатических узлах [5-7]. Далее, полная ремиссия в ответ на неоадъювантную химиотерапию является достоверным предиктором улучшения общей выживаемости и удлиннения периода, свободного от признаков заболевания [5, 7, 8].
Эти результаты говорят о ценности неоадъювантной химиотерапии в плане идентификации подгрупп больных, у которых лечение дает ориентир для прогноза [5]. Более консервативное лечение может оказаться возможным у больных с полной ремиссией в первичной опухоли, подтвержденной данными патологического исследования, и с негативным статусом в отношении поражения лимфатических узлов по данным клинической оценки [6]. Оценка ответа на неоадъювантную химиотерапию может помочь выявить больных, которым требуется более агрессивная форма лечения, а также больных с устойчивым к лечению заболеванием, для которых адъювантная химиотерапия может оказаться неэффективной [5]. Для определения оптимальной стратегии лечения в разных подгруппах больных требуются дополнительные исследования.
В настоящее время имеются лишь немногочисленные данные, посвященные сравнению положительных результатов по выживаемости за счет неоадъювантной терапии по сравнению с адъювантной химиотерапией. Для выяснения роли неоадъювантной терапии в лечении рака молочной железы необходимы результаты долгосрочных рандомизированных испытаний.
ПОЛУСИНТЕТИЧЕСКИЙ ТАКСОЛ (ПАКЛИТАКСЕЛ) ДЛЯ ИНЪЕКЦИЙ В КОНТЕКСТЕ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ
Активность Таксола при лечении метастатической формы рака молочной железы хорошо доказана [9]. В исходных испытаниях применение Таксола у больных метастатической формой рака молочной железы, которым ранее не проводилась интенсивная химиотерапия (один курс или менее), было показано, что общие проценты ремиссий составляют от 56 до 62%, включая полные ремиссии [10, 11]. Было также показано, что у таких больных активна также комбинация Таксола и доксорубицина [12]. В нескольких испытаниях по Фазе II и III была продемонстрирована активность и профиль токсичности комбинации доксорубицин/Таксол при метастатической форме рака молочной железы [13-15]. Недавние исследования сосредоточили внимание на том, чтобы попытаться использовать эффективность Таксола в контексте неоадъювантной химиотерапии рака молочной железы, когда Таксол применяется как в форме монотерапии, так и в комбинации с доксорубицином [16, 17]. В настоящей монографии описываются многообещающие результаты двух недавно опубликованных исследований применения Таксола в контексте неоадъювантной химиотерапии.
ИССЛЕДОВАНИЯ ОНКОЛОГИЧЕСКОГО ЦЕНТРА им. М. Д. АНДЕРСОНА ТЕХАССКОГО УНИВЕРСИТЕТА (MDACC): РАНДОМИЗИРОВАННОЕ ИСПЫТАНИЕ ПОЛУСИНТЕТИЧЕСКОГО ТАКСОЛА (ПАКЛИТАКСЕЛ) ДЛЯ ИНЪЕКЦИЙ В ФОРМЕ МОНОТЕРАПИИ ПО СРАВНЕНИЮ СО СХЕМОЙ FAC В КАЧЕСТВЕ ИНДУКЦИОННОЙ ТЕРАПИИ У БОЛЬНЫХ С ОПЕРАБЕЛЬНОЙ ФОРМОЙ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
В MDACC проведено рандомизированное испытание по сравнению Таксола, применявшегося в форме монотерапии, с комбинацией 5-фтороурацила, доксорубицина и циклофосфамида (FAC) для неоадъювантной химиотерапии у шести больных с операбельной формой рака молочной железы. Основой этого испытания были данные о высоком проценте ремиссий, полученные ранее в MDACC при использовании Таксола у больных с метастатической формой рака молочной железы, а также отсутствие перекрестной резистентности между Таксолом и антрациклинами, продемонстрированное ранее [9]. Было высказано предположение, что использование для индукционной терапии не того же самого режима, который применяется позже в ходе лечения, а агента, не дающего с ним перекрестной резистентности, понизит риск рецидивирования [18]. Главным критерием для оценки испытания была выживаемость без признаков заболевания; вторичные критерии включали клинические ремиссии, остаточное заболевание по данным патологического исследования (молочная железа и лимфатические узлы), а также общая выживаемость больных [18, 19].
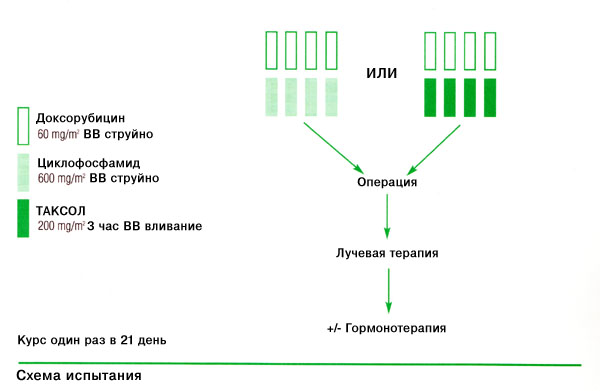
С июня 1994 г. по июль 1998 г. 174 больных было рандомизировано на лечение Таксолом или схемой FAC в течение четырех курсов, после чего проводилась хирургическая операция и четыре дополнительных курса FAC (Рисунок 1) [16, 17].
Рис. 1. Схема испытания неоадъювантной терапии в MDACC [16,18].
После завершения первых четырех курсов химиотерапии больных оценивали в многопрофильной клинике, занимавшейся вопросами дальнейшего планирования лечения, для определения возможности сохранения молочной железы и степени пораженности лимфатических узлов. Всем больным с персистирующим, определяемым путем пальпации поражением подмышечных лимфатических узлов, проводили иссечение подмышечных лимфатических узлов. После химиотерапии определяемая стадия опухоли уменьшалась до стадии N0-2, N0, и такие больные были кандидатами на сохранение молочной железы и дальнейшее лечение, проводившееся путем иссечения подмышечных лимфатических узлов или облучения после второй рандомизации в рамках отдельного протокола. После химиотерапии все больные с положительным статусом опухоли по эстрогеновым рецепторам в возрасте старше 50 лет получали тамоксифен в течение 5 лет [18].
Таблица 2. Характеристики больных до лечения
Полусинтетический Таксол (паклитаксел) для инъекций No. (%)
Клиническое состояние лимфоузлов
Статус по эстрогеновым рецепторам
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
Клинический ответ на лечение был сходным в двух леченых группах после четырех курсов химиотерапии (Таблица 3). Общий процент ремиссий в группе, получавшей схему FAC, составлял 79% (24% полный ремиссий) по сравнению с 80% (27% полных ремиссий) в группе, получавшей полусинтетический Таксол (паклитаксел) для инъекций. У трех больных, получавших лечение схемой FAC, и одного больного в группе Таксола отмечалась прогрессия заболевания во время индукционной фазы терапии. Между двумя группами не наблюдалось статистически достоверных различий в отношении остаточного заболевания в молочной железе и подмышечных лимфатических узлах по данным патологического обследования на момент хирургической операции (Таблица 4). Несколько более высокий процент больных в группе FAC не имел остаточного заболевания или заболевания in situ; однако большее число больных в группе, получавшей Таксол, дало уменьшение размеров опухоли до величины менее 1 см. Орган-сберегающая хирургическая операция выполнялась у несколько большего процента больных, получавших лечение Таксолом (Таблица 5) [18].
Таблица 3. Клинический ответ
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
Выживание без признаков заболевания
При среднем (медиана) сроке наблюдения, составлявшем 23 месяца (интервал от 3 до 52 месяцев), рецидив заболевания отмечался у 100 больных в группе FAC и 7 больных в группе Таксола. По проведенным оценкам, выживание в течение 2 лет без признаков заболевания наблюдалось у 89% больных в группе FAC и у 94% больных в группе Таксола (Р=0,44) [18]. Данные по общему проценту выживания пока отсутствуют.
Таблица 4. Остаточное заболевание по данным оценки патолога
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
*Двум больным хирургическая операция не проводилась, 9 больным не проводилось иссечение подмышечных лимфатических узлов, и 1 больная, относительно которой неизвестно, проводилось ли облучение.
**Одна больная потеряна для последующего наблюдения. В одном случае тип хирургической операции неизвестен. У восьми больных иссечения подмышечных лимфатических узлов не проводилось и 3 больных, относительно которых неизвестно, проводилось ли облучение.
Таблица 5. Местное лечение в зависимости от варианта
Тип хирургической операции
Сегментная+иссечение подмышечных лимфатических узлов
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
*Двум больным хирургическая операция не проводилась, 9 больным не проводилось иссечение подмышечных лимфатических узлов, и 1 больная, относительно которой неизвестно, проводилось ли облучение.
**Одна больная потеряна для последующего наблюдения. В одном случае тип хирургической операции неизвестен. У восьми больных иссечения подмышечных лимфатических узлов не проводилось и 3 больных, относительно которых неизвестно, проводилось ли облучение.
Токсические эффекты, описанные для обоих вариантов лечения, представлены в Таблице 6. Средняя кумулятивная полученная доза составляла 100% для схемы FAC (интервал 50-100%) и 100% для полусинтетического Таксола (паклитаксел) для инъекций (интервал 0-100%). Токсические эффекты, которые наблюдались в группе, получавщей Таксол, соответствовали тем, которые обычно описываются для схемы с вливанием Таксола на протяжении 24 часов. Частота нейтропенической лихорадки была более высокой в группе Таксола; однако профилактическое применение G-CSF или антибиотиков снижало частоту этого осложнения в ходе последующих циклов химиотерапии. Летальных исходов, связанных с лечением, не наблюдалось, и отсутствовали эпизоды клинически регистрируемых нарушений сердечной деятельности в обоих вариантах исследования. У небольшого процента больных в обеих группах лечения наблюдались транзиторные аритмии, однако они не требовали каких-либо вмешательств или изменения характера лечения [18].
Таблица 6. Токсичность
Тяжелые аллергические реакции
Застойная сердечная недостаточность
FAC=5-фтороурацил, доксорубицин, циклофосфамид; G-CAF=гранулоцитный колониестимулирующий фактор.
*Приведены токсические эффекты только 3-й степени.
Предварительные данные этого рандомизированного испытания показывают, что полусинтетический Таксол (паклитаксел) для инъекций, применяемый в форме монотерапии, и комбинированная терапия с использованием схемы FAC обладают сходным противоопухолевым действием при применении в качестве неоадъювантной химиотерапии у больных с операбельной формой рака молочной железы [18]. Степень циторедукции по данным объема остаточного заболевания в молочной железе и лимфатических узлах была сходной для обоих вариантов индукционного лечения [19]. Важно отметить, что ни один из вариантов лечения не приводил к кардиотоксическому эффекту, а главные побочные эффекты носили транзиторный характер и с ними можно было легко справиться. Для определения того, приведет ли использование данной схемы «неперекрестной в плане устойчивости» химиотерапии к дальнейшему снижению риска рецидивирования, требуются длительные сроки наблюдения за больными [18].
ОПЫТ, ПОЛУЧЕННЫЙ ВО ФРАНЦИИ: РАНДОМИЗИРОВАННОЕ ИСПЫТАНИЕ ПО СРАВНЕНИЮ КОМБИНАЦИИ ДОКСОРУБИЦИН/ ТАКСОЛ (ПАКЛИТАКСЕЛ) ДЛЯ ИНЪЕКЦИЙ (ПО ФАЗЕ II) ДЛЯ НЕОАДЪЮВАНТНОЙ ТЕРАПИИ ЛОКОРЕГИОНАЛЬНОЙ ФОРМЫ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
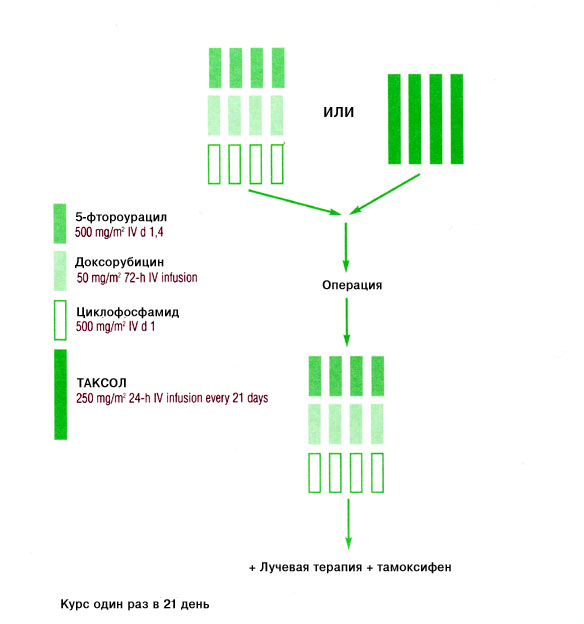
Многоцентровое рандомизированное испытание, проведенное во Франции, было посвящено сравнению неоадъювантного применения комбинации доксорубицин/циклофосфамид (АС) с комбинацией доксорубицин/Таксол (АТ) у 247 больных с ранее не леченым локорегиональным раком молочной железы. Соображения, на которых было основано настоящее испытание, относятся к трем категориям [17]. Во-первых, результаты национального хирургического адъювантного проекта по раку молочной железы (NSABP) по протоколу В-18 показали, что предоперационное использование схемы АС уменьшает размер опухоли в большинстве случаев и снижает частоту позитивных лимфатических узлов, что позволяет выполнять более консервативные хирургические процедуры [20]. Во-вторых, при использовании схемы АТ при метастатической форме заболевания отмечена высокая активность, включая полные ремиссии [13-15]. Наконец, отсутствие перекрестной устойчивости между Таксолом и антрациклинами говорит в пользу целесообразности их использования в комбинации в таком контексте [21]. Главным конечным критерием в данном испытании были полные ремиссии с подтверждением, полученным патологом; вторичные критерии включали общий процент ремиссий, выживание без признаков заболевания и общую выживаемость [17]. Схема испытания приведена на Рисунке 2.
Рис. 2. Схема испытания [17].
В марте 1998 г. независимая группа выполнила заранее запланированный промежуточный анализ первых 120 пригодных для оценки больных (40 больных в группе АС и 80 больных в группе АТ). Правила раннего прекращения использования той или иной схемы лечения требовали, чтобы при наличии трех или менее подтвержденных патологически полных ремиссий (7,5% или менее) в группе АС и семи или менее (9% и менее) в группе АТ набор больных в соответствующую группу был прекращен. На указанный момент в группе АС наблюдалось две полные ремиссии, подтвержденные данными патологического исследования, а в группе больных, получавших схему АТ, таких ремиссий было 11. Соответственно, дальнейшее включение больных в группу АС было прекращено, а в группу АТ продолжено. Всего в испытание было включено 247 больных; 67 из них были рандомизированы на получение схемы АС, а 180 на получение схемы АТ. Группы были хорошо сбалансированы по таким критериям, как возраст, распространенность заболевания, статус в отношении менопаузы и статус в отношении гормонорецепторов [17].
Полные ремиссии, подтвержденные данными гистологического исследования, отмечались у 10% больных в группе АС, по сравнению с 16% в группе АТ (Таблица 7) [17]. Общий процент ремиссий составлял 66% для группы АС и 83% для группы АТ, причем процент клинически полных ремиссий составлял 9% и 14%, соответственно. Проведение неоадъювантной химиотерапии позволило ограничиться орган-сберегающей хирургической операцией у 45% больных, получавших лечение схемой АС, и у 56% больных из группы, получавшей лечение схемой АТ.
Таблица 7. Эффективность схемы АС по сравнению со схемой АТ при локорегиональной форме рака молочной железы
Полная ремиссия, подтвержденная гистологически
Клиническая полная ремиссия
Проведено консервативное хирургическое лечение
АС=доксорубицин/циклофосфамид; АТ=доксорубицин/Таксол.
Проводилось тщательное мониторирование кардиотоксичности. Фракция выброса левого желудочка (ФВЛЖ) определялась исходно, после второго курса химиотерапии, а также на момент завершения испытания. Аномальные значения были отмечены у 5 и 8% больных в группах АС и АТ, соответственно. У одной больной в группе АС развилась застойная сердечная недостаточность [17].
В соответствии с данными, полученными исследователями, комбинированная химиотерапия на схеме полусинтетический Таксол (паклитаксел) для инъекций/доксорубицин является высокоэффективной формой лечения в предоперационном периоде при раке молочной железы. Общий процент ремиссий на этой схеме составил 83%, включая подтвержденные патологически полные ремиссии у 16% больных. Эти результаты являются показанием для дальнейших исследований этого комбинированного режима в контексте неоадъювантной химиотерапии, и авторы заявляют, что схема АТ будет стандартным вариантом лечения в их будущем испытании [22].
Комментарии д-ра А.У. Буздара
Определение роли полусинтетического Таксола (паклитаксел) для инъекций при неоадъювантной терапии
Результаты двух описанных выше испытаний говорят об активности Таксола при неоадъювантном лечении рака молочной железы. В исследованнии, проведенном Pouillart и соавт., комбинация доксорубицина и Таксола продемонстрировала более высокую активность по сравнению с комбинацией доксорубицин/циклофосфамид с точки зрения процента клинических ремиссий, ремиссий, подтвержденных данными патологического исследования, и возможности орган-сберегающего хирургического лечения [17]. Исследование MDACC показало, что Таксол, применяемый в форме монотерапии, обладает клинической активностью, сходной с активностью схемы FAC, которая является золотым стандартом в нашем центре [23]. Эти исследования позволяют предположить, что схема попеременного лечения препаратами, не дающими перекрестной резистентности, может улучшить конечный результат по сравнению с непрерывным использованием одной формы лечения [10]. Анализ ранних испытаний по раку молочной железы показал, что непрерывное использование одной и той же терапевтической схемы после выполнения нескольких циклов лечения не дает дальнейшего снижения риска рецидивирования и не улучшает выживаемость больных [24].
В крупномасштабном исследовании Интергруппы проводилась оценка преимуществ схем лечения препаратами, не дающими перекрестной резистентности, за счет сравнения эффективности применения схемы АС в адъювантном режиме с последовательным применением Таксола в дозе 175 мг/м 2 или без Таксола. Предварительный анализ указывает на значительные преимущества в группе, получавшей лечение схемой АС+Таксол, по сравнению с группой, получавшей лечение только схемой АС, в отношении таких критериев, как выживание без признаков заболевания и общая выживаемость (P=0,0077 и P=0,039, соответственно). Обычные токсические явления (степени 3 и выше) у больных, получавших лечение Таксолом, включали транзиторную миелосупрессию у 21% больных, нейропатию у 5%, болевые эффекты у 5% и гипергликемию у 5% больных. Кардиотоксические явления в период после химиотерапии отмечались у 6% больных, однако не давали достоверной корреляции с дозами доксорубицина и применением (или отсутствием применения) Таксола [25]. Было высказано предположение, что преимущества в группе, получавшей лечение Таксолом в рамках данного испытания, были связаны с более длительным курсом лечения, а не обусловлены специфически самой схемой лечения. Однако, в испытании MDACC обе группы лечения получили восемь циклов химиотерапии с аналогичной эффективностью, что четко демонстрирует активность Таксола в данных условиях [23].
Оптимальная доза и график применения Таксола
Таксол применялся в различных дозах и по различным графикам введения при лечении рака молочной железы. Наш выбор дозы, составлявшей 250 мг/м 2 , вводившейся путем 3-часового внутривенного вливания, основан на результатах испытания по Фазе II в MDACC, когда было показано, что Таксол, применяемый в форме монотерапии и вводимый таким образом, обеспечивает высокий процент ремиссий. Для практических целей Таксол в дозе 175 мг/м 2 может быть удобным вариантом [23]. Доза, составлявшая 175 мг/м 2 , применявшаяся в исследовании Интергруппы, дала впечатляющие результаты, а данные, полученные в рамках недавнего испытания у больных с метастатической формой рака молочной железы в группе CALGB (исследование CALGB 9342), показывают, что более высокие дозы полусинтетического Таксола (паклитаксел) для инъекций не обязательно улучшают ответ на лечение или выживаемость при метастатической форме рака молочной железы [26].
Следствия в отношении лечения операбельной формы рака молочной железы
В прошлом высказывалось опасение, что неоадъювантная химиотерапия может задерживать заживление раны после хирургической операции, увеличивать время восстановления или вызывать какие-то другие послеоперационные осложнения. Эти вопросы были подвергнуты анализу MDACC, однако не было обнаружено ни какого-либо повышения частоты болезненных эффектов, ни каких-либо нарушающих воздействий на последующую терапию. Главное преимущество неоадъювантной формы лечения связано с возможностью оценить эффект терапии на интактную опухоль. Ответ на неоадъювантную терапию дает важную прогностическую информацию уже на ранних стадиях курса лечения. Если, например, стадия опухоли у больной уменьшается со стадии III до стадии I, то более вероятен благоприятный конечный результат. Однако, больные, которые не реагируют на неоадъювантную химиотерапию, могут выиграть за счет применения переменных схем лечения или экспериментальных подходов [23].
Исследование MDACC и убедительные результаты, полученные в испытании Интергруппы, показывают, что добавление более активных агентов, например Таксола, к стандартным схемам лечения, может заметно снизить риск рецидива заболевания. На основании этих результатов MDACC принял схему FAC+Таксол в качестве нового стандарта для адъювантной и неоадъювантной терапии при лечении операбельных форм рака молочной железы. Я полагаю, что более длительные сроки наблюдения продемонстрируют лучшие результаты с использованием данного терапевтического подхода, а именно, речь идет о последовательном лечении, когда за применением Таксола следует схема FAC или после применения схемы АС следует применение Таксола [23].
Перспективы
В следующем испытании, проводимом в MDACC, будет сравниваться эффективность четырех циклов применения Таксола (контроль) с последующим применением схемы FAC и применение Таксола раз в неделю с последующим применением схемы FAC [23]. Более ранние данные указывают на то, что быстрое еженедельное вливание Таксола лучше переносится и дает больший противоопухолевый эффект, чем схема лечения, когда данный препарат применяют с интервалом в три недели. В контрольной группе ведущегося в настоящее время исследования мы снизили дозу Таксола до 225 мг/м 2 . Результаты этого испытания дополнительно определят роль Таксола при неоадъювантном лечении рака молочной железы и предоставят новую информацию в отношении преимуществ плотнодозовой терапии.
источник
Адъювантная ХТ рака молочной железы
Используются схемы: 1) АС, 2) АС ->Паклитаксел, 3) А ->СМF, 4) САF-> (GАLGВ), 5) САF (SWОG), 6) САМ, 7) СЕF, 8) FАС, 9) FЕС, 10) М->F, И) ТАС.
У постменопаузальных больных адъювантная ХТ по схеме СМР не дает эффекта; у больных пожилого возраста отмечается также высокая чувствительность к токсическому действию СМF.
Доцетаксел (в еженедельном режиме) через 3 дня или 14 дней после операции у 70 пожилых больных РМЖ= заживление операционной раны происходило одинаково в обеих группах, лейкопения 1-2 степени — соотв. у 16,3% и у 14,8%, ХТ была эффективной соотв. у 41,9% и 44,4% больных.
Схема ЕС в сравнении с СМР (6 циклов) у пременопаузальных больных с >4 положительными подмышечными ЛУ = безрецидивная выживаемость — соотв. 5,5 и 4,2 года, общая выживаемость — соотв. 8,3 и 6,8 года.
Схема FЕС в сравнении с СМР = 6-летняя выживаемость — соотв.93% и 83%, гемотоксичность была сходной, алопеция — соотв. 87% и 7%, аменорея у пременопаузальных больных — соотв. 80% и 60%.
Схема FЕС-50 (500/50/500 один раз в 3 недели, 6 циклов) в сравнении с FЕС-100 (500/100/500 один раз в 3 недели, 6 циклов) у 565 пре- и постменопаузальных больных РМЖ с поражением подмышечных ЛУ = при медиане наблюдения 5-лет безрецидивная выживаемость — соотв. 52% и 65% (р=0,007), общая выживаемость — соотв. 63% и 76% (р=0,007); токсичность схемы FЕС-100 была выше, но не была фатальной.
Схема FЕС-100 (500/100/500 один раз в 3 недели, 6 циклов) в сравнении с аЕС-100 х 3 цикла + затем 3 цикла Таксотера (при обеих схемах после завершения адъювантной ХТ больные получали ЛТ, а при положительных гормонорецепторах — Тамоксифен в течение 5 лет) = 5-летняя безрецидивная выживаемость — соотв. 73,2% и 78,3% (р=0,014), общая выживаемость — соотв. 86,7% и 90,7% (р=0,017), частота фебрильных нейтропений — соотв. 8,4% и 11,2%.
Схема ТАС у соотв. 745 и 746 больных РМЖ с метастазами в подмышечных Л У = частота рецидивов — соотв. у 119 (16%) и 170 (23%) больных (р=0,0002), фебрильная нейтропения — соотв. у 24 и 2 больных (р=0,049).
в ЛУ = 5-летняя берецидивная выживаемость — соотв. 75% и 68% (р=0,01), общая выживаемость — 87% и 81% (р=0,008); при схеме ТАС были менее выражены тошнота и рвота, но она чаще осложнялась фебрильной нейтропенией.
Неоадъювантная ХТ рака молочной железы
Доцетаксел (100 мг/м2 один раз в 3 недели; 4 цикла) у 51 больной локально распространенным РМЖ (от 4 до 30 см) = 75% Рм, в т. ч. 27% полных Рм; стабилизация — у 25%; патоморфологически полная или почти полная Рм — у 20% больных. После операции больные получали адъювантную ХТ из 4 циклов АС (60/60 мг/м2 один раз в 3 недели) = выживаемость 1 и 2 года — соотв.98% и 78%; наилучшие результаты были у больных с Рм после неоадъювантной ХТ.
Паклитаксел (175 мг/м2 24-часовая инфузия) 4 цикла по 3 недели в сравнении с неоадъювантной ХТ по схеме РАС у больных первично-операбельным РМЖ стадии Т1-3М0-1М0 = соотв. 26% и 24% полных Рм и 54% и 55% частичных Рм.
Паклитаксел (еженедельный режим) с последующим РАС в сравнении Паклитаксел (введение один раз в 3 недели) с последующим РАС = соотв. 29% и 13,6% (р
Методы лечения рака предстательной железы — узнать больше информации в статьях врачей Европейской клиники.
источник
В 2003 г. St. Gallen Consensus Panel подразделила множество доступных схем адъювантной химиотерапии (XT) па комбинации со стандартной и наилучшей эффективностью. Препараты, отнесенные к стандартно эффективным, включили в себя доксорубицин (Адриамицин) и циклофосфамид (АС х 4), циклофосфамид, метотрексат и 5-фторурацил (CMF х 6).
Препараты с наилучшей эффективностью включали FA(E)C х 6, CA(E)F х 6, AE-CMF, ТАС х 6, АС х 4 + паклитаксел (Р) х 4 или доцетаксел (D) х 4, FEC х 3 + D х 3.
«Практические клинические рекомендации по лечению рака молочной железы (РМЖ)» (документ канадского консенсуса) были опубликованы в 1998 г. Был проведен исчерпывающий анализ литературы с учетом уровня доказательности исследований. Хотя проблема РМЖ была рассмотрена полностью, замечания из доклада будут ограничены обсуждением XT.
По мнению руководящего комитета, до выбора адъювантной системной терапии в первую очередь следует оценить прогноз без лечения. На основании размера опухоли, гистологической картины и морфологии клеточного ядра, статуса ЭР, инвазии в кровеносные и лимфатические сосуды риск рецидива может быть расценен как низкий, умеренный или высокий.
Пациенткам в пре- и постменопаузе, у которых предполагается низкий риск рецидивов, можно не рекомендовать адъювантную системную терапию. У женщин со средней степенью риска и ЭР-положительными опухолями средством выбора служит тамоксифен. Его следует принимать ежедневно в течение 5 лет. Женщинам с высокой степенью риска показана системная терапия. XT следует рекомендовать всем женщинам с ЭР-отрицательными опухолями. Два рекомендуемых режима:
1) 6 циклов CMF;
2) 4 цикла АС.
В исследованиях, сравнивающих два режима, были отмечены близкие показатели выживаемости без прогрессирования и общей выживаемости. Многие исследователи предпочитают схему АС, поскольку требуется меньше времени для ее проведения, меньшее количество визитов в клинику и она обладает меньшей токсичностью. Для многих женщин старше 70 лет и с более высоким риском рекомендуется монотерапия тамоксифеном.
Согласно канадским консенсусным рекомендациям, всем женщинам в период пременопаузы со II стадией РМЖ следует проводить химиотерапию (XT). Полихимиотерапия (ПХТ) предпочтительнее длительной монотерапии. Предлагается 6-месячный курс CMF или 3-месячный курс АС. 6-месячный курс CMF был таким же эффективным, как 4 цикла АС (согласно протоколу В-15 NSABP). В других исследованиях показано, что 6-месячный курс CMF так же эффективен, как 12—24-месячный курс CMF.
Если возможно, должны использоваться полные стандартные дозы. В миланском исследовании с 20-летним периодом наблюдения только у больных, получивших хотя бы 85 % запланированной дозы CMF, наблюдался эффект от адъювантной терапии. Женщинам в постменопаузе со 11 стадией ЭР-положительных опухолей следует назначать тамоксифен.
Рекомендации NCCN по проведению химиотерапии (XT) детально описаны на Интернет-сайте 2006 NCCN. Было выявлено, что наклитаксел (Таксол) эффективен в лечении рака молочной железы (РМЖ). В настоящее время паклитаксел и доцетаксел (Таксотер) включаются в стандартные протоколы лечения больных раком молочной железы (РМЖ). Было показано, что паклитакссл обладает выраженной противоопухолевой активностью при доксорубицин-резистентном раке молочной железы (РМЖ).
При раке молочной железы (РМЖ) с гиперэкспрессией HER-2 эффективно применение трастузумаба (Герцептин) — гуманизированного моноклонального антитела, селективно с высокой аффинностью связывающегося с внеклеточным доменом рецептора-2 человеческого эпидермального фактора роста (EGFR). Обнадеживающие результаты получены не только при рецидивах рака молочной железы (РМЖ), но и в составе полихимиотерапии (ПХТ) первой линии.

а Благоприятные прогностические факторы: хорошо дифференцированная опухоль.
b Неблагоприятные прогностические факторы:
умеренно- или низкодифференцированная опухоль, инвазия в кровеносные или лимфатические сосуды, гиперэкспрессия HER-2.
источник
Системная терапия улучшает выживаемость у пациенток, страдающих раком молочной железы на ранних стадиях.
Более половины пациенток с операбельным раком молочной железы, подвергающихся только локально-регионарному лечению, умирают от метастазов.
Это указывает на то, что микрометастазы существуют уже на момент установления диагноза.
Единственный способ улучшить выживаемость — назначать системную фармакотерапию. Системную терапию можно назначать в виде эндокринной, химио- или целевой терапии. Она может назначаться после (адъювантная) или до (неоадъювантная) локально-регионарного лечения.
Адъювантная эндокринная терапия признается единственным эффективным средством у пациенток с рецепторам эстрогена (ЭР) и рецепторам прогестерона (ПР) положительными опухолями. До недавнего времени тамоксифен был наиболее часто используемым препаратом у женщин как до менопаузы, так и после нее.
Тамоксифен является частичным антагонистом эстрогенов, однако оказывает агонистический эффект на эндометрий, жировой обмен и костную ткань. При его назначении в течение 5 лет снижается риск развития рака молочной железы на противоположной стороне на 40-50% (табл. 5.6).
Таблица 5.6. Пропорциональноеснижениерискапосле5летприема тамоксифена по возрастным группам после исключения пациенток с опухолями, содержащими низкий процентэстрогенных рецепторов
| Доля (%) ЭР-положительных пациенток | Пропорциональное (%) снижение (СО) ежегодной вероятности | ||
| Рецидив | Летальный исход | ||
| 70 | 94 | 54 (13) | 34 (13) |
| Все | 94 | 47 (3) | 26 (4) |
Примечание: СО — стандартное отклонение.
Препарат может быть менее эффективен в отношении HER2-положительных опухолей.
Селективные ингибиторы ароматазы (ИА) третьего поколения — анастрозол, летрозол и эксеместан — являются основным достижением в адъювантной терапии пациенток в постменопаузе, страдающих раком молочной железы на ранней стадии.
У данной группы пациенток они демонстрируют свое превосходство над тамоксифеном, действуя путем блокирования синтеза эстрогенов, осуществляемого посредством фермента ароматазы. Они демонстрируют улучшение безопухолевой и безметастазной выживаемости и превосходят в этом тамоксифен. Ингибиторы ароматазы третьего поколения, по сравнению с тамоксифеном, дополнительно снижают риск рака молочной железы на противоположной стороне на 40-50%.
Данные из первого исследования, в котором сравнивали тамоксифен с анастрозолом (ATAC, Arimidex, Tamoxifen Alone or in Combination) среди более чем 9000 женщин, продемонстрировали существенное улучшение безопухолевой выживаемости на фоне применения анастрозола по сравнению с тамоксифеном.
После этого исследования в других клинических испытаниях было показано преимущество летрозола над тамоксифеном в качестве препарата первого ряда, а также перехода с тамоксифена после его приема в течение 2-3 лет на анастрозол или эксеместан в течение 2-3 лет, по сравнению с приемом в течение 5 лет только тамоксифена.
Дополнительные данные, указывающие на эффективность этих препаратов, получены в ходе клинического испытания MA17, проведенного в Канаде. В ходе него было выявлено, что летрозол, назначаемый после 5 лет приема тамоксифена, снижает риск местного рецидивирования у пациенток с ЭР-положительными опухолями без метастазов в лимфатические узлы и с метастазами в них, а также вызывает существенное улучшение выживаемости у пациенток с метастазами в лимфатические узлы.
Поэтому в настоящее время доступные варианты лечения пациенток в постменопаузе — это прием только тамоксифена в течение 5 лет, прием в течение 5 лет анастрозола или летрозола, прием в течение 2-3 лет тамоксифена с последующим переходом на прием в течение 2-3 лет анастрозола или эксеместана или прием в течение 5 лет тамоксифена с последующим переходом на прием в течение 5 лет летрозола.
У женщин в периоде предменопаузы с гормонально-чувствительными опухолями варианты лечения включают назначение тамоксифена или тамоксифена в сочетании с подавлением гормональной активности яичников, наиболее часто с помощью аналогов гонадотропин-рилизинг гормона, например госерелина.
Добавление тамоксифена к госерелину демонстрирует улучшение выживаемости у пациенток с ЭР-положительными опухолями. Пока еще неясно, достигается ли данный результат при добавлении госерелина к тамоксифену. По данному вопросу проводятся клинические испытания, в которых сравниваются госерелин и тамоксифен с госерелином и ингибитором ароматазы.
Наибольшие преимущества химиотерапии наблюдаются у женщин до 70 лет. Химиотерапия опосредует свои эффекты не только за счет индукции аменореи. В настоящее время увеличение размеров опухоли, вовлечение лимфатических узлов, отсутствие рецепторов эстрогена, HER2-положительность, наличие лимфатической или сосудистой инфильтрации (ЛСИ) и возраст пациентки (младше 35 лет) являются факторами, рассматриваемыми при определении показаний и типа химиотерапии.
Химиотерапия не демонстрирует значимых преимуществ у получающих соответствующую эндокринную терапию пациенток в постменопаузе с опухолями на I или II стадии, опухолями, насыщенными ЭР, HER2-отрицательным раком молочной железы.
Включающие антрациклин комбинации, в которых используются доксорубицин или эпирубицин, более эффективны, чем традиционные комбинации циклофосфамида, метотрексата и фторурацила, и в настоящее время являются стандартом.
Добавление таксанов к антрациклинам дополнительно улучшает выживаемость при метастазах в лимфатические узлы, по сравнению с изолированным применением антрациклинов. При назначении новых схем лечения 5-летняя выживаемость у пациенток с метастазами в лимфатические узлы выросла с 65% до 85% и выше (табл. 5.7).
Таблица 5.7. Снижение частоты рецидивирования и летальности в клинических испытаниях полихимиотерапии (из Early Breast Cancer-Trialists’ Collaborative Group, 1998)