Цель адъювантной химиотерапии рака молочной железы — элиминация микрометастазов опухоли, которые могли появиться после или присутствовать до хирургического лечения и не обнаруживаться существующими методами в ходе стадирования заболевания.
В зависимости от стадии и типа опухоли молочной железы использование системной терапии позволяет достичь снижения летальности на 35-72%. Уровень экспрессии рецептора эстрогена (РЭ) и наличие гиперэкспрессии (амплификации) HER2 являются наиболее достоверными предиктивными факторами для выбора адъювантной химиотерапии рака молочной железы. При этом, по данным рекомендаций Европейского общества медицинской онкологии, опухоли с любой определяемой экспрессией РЭ и (или) РП (> 1%) можно считать эндокриночувствительными. Среди других характеристик, которые могут помочь предположить отсутствие чувствительности к эндокрино-терапии, выделяют низкий уровень экспрессии стероидных гормонов, в том числе низкий уровень экспрессии РП, низкую дифференцировку опухоли (G3), высокий уровень экспрессии маркеров пролиферации (Ki67), гиперэкспрессию или амплификацию HER2. При отсутствии описанных выше признаков опухоль можно считать высокочувствительной к эндокринотерапии.
Все опухоли люминальных подтипов в рамках комплексного адъювантного лечения должны получать эндокринотерапию. При этом химиотерапия должна проводиться при люминальном А подтипе только в тех ситуациях, когда ожидаемый риск рецидивирования крайне высок, например при массивном поражении регионарных лимфатических узлов. Отдельно необходимо сказать, что опухоли люминального В подтипа характеризуются разнообразной агрессивностью течения, что определяет крайнюю неточность в определении целесообразности цитостатической терапии в этой группе пациентов. При этом в случае опухоли с экспрессией HER2 люминального В подтипа должна проводиться системная лекарственная терапия с использованием всех известных методов: эндокринотерапии, цитостатической терапии и анти-HER2 терапии.
Больные с признаками эндокриночувствительных опухолей могут получать только эндокринотерапию или комбинацию эндокринотерапии вместе с химиотерапией. При сомнительной чувствительности опухоли к гормональным воздействиям чаще всего предлагается использовать комбинированный подход. Независимо от экспрессии РЭ/ РП в случае наличия гиперэкспрессии/амплификации HER2 больные должны получать таргетную терапию анти-HER2 препаратами. При этом чаще всего схемы с использованием антрациклинов не комбинируются с анти-HER2 препаратами в связи с крайне высоким риском кардиотоксичности.
В каждом случае выбор тактики профилактической лекарственной терапии должен базироваться на потенциальном преимуществе от использования агрессивного лечения, возможных осложнений лечения и предпочтениях больного.
У больных репродуктивного возраста стандартом адъювантной эндокринотерапии является монотерапия тамоксифеном 20 мг/сут в течение 5-10 лет или его комбинация с подавлением функции яичников. При этом подавление функции яичников может быть достигнуто либо билатеральной овариэктомией, либо при помощи ингибиторов гонадотропин-рилизинг гормонов. При этом последние должны использоваться не менее 2 лет.
В случае постменопаузы стандартный подход включает использование ингибиторов ароматазы (ИА) в течение 5 лет или последовательное использование тамоксифена в течение 3 лет с последующим переходом на ИА.
Адъювантная химиотерапия рака молочной железы рекомендована пациентам с отсутствующей или неопределенной эндокриночувствительностью, а также пациентам с гиперэкспрессией (амплификацией) HER2. При этом наибольшие преимущества от проведения цитостатической адъювантной терапии достигаются именно в группе опухолей без экспрессии РЭ. При этом в группе РЭ+ РМЖ по некоторым данным противоопухолевый эффект химиотерапии отчасти реализуется за счет подавления функции яичников. На настоящий момент в адъювантном режиме при РМЖ изучено и предложено для клинического применения много различных режимов лекарственной терапии. Наиболее часто используемыми препаратами являются антрациклины и таксаны. При этом более интенсивные стандартные режимы несколько превосходят по эффективности менее агрессивные варианты даже у пожилых пациентов. Так, четыре цикла химиотерапии доксорубицин + цикло-фосфан считаются сходными по эффективности с шестью циклами циклофосфан + метотрексат + 5-фторурацил. Использование в адъювантном режиме таксанов улучшает отдаленные результаты независимо от всех прогностически значимых клинических факторов, таких как возраст, поражение лимфоузлов, размеры первичной опухоли, экспрессии стероидных рецепторов. Совместное последовательное использование таксанов и антрациклинов позволяет снизить вероятность рецидива заболевания на одну треть.
Одним из основных прорывов последнего десятилетия в адъювантной химиотерапии рака молочной железы было выявление драматического улучшения результатов лечения одной из самых прогностически неблагоприятных групп опухолей молочной железы — HER2 позитивной. Наиболее изученным и широко используемым среди анти-HER2 препаратов является трастузумаб. Так, применение трастузумаба у больных РМЖ с гиперэкспрессией или амплификацией HER2 позволяет снизить риск рецидива заболевания практически вдвое, что приводит к увеличению 3-летней выживаемости на 3%. В большинстве исследований больные получали лечение трастузумабом в течение 1-го года, продолжение лечения до 2 лет не приводило к дальнейшему улучшению отдаленных результатов.
А. Стадии II и IIIA (N1). Если органосохраняющей операции мешает лишь размер первичной опухоли, для ее уменьшения можно провести химиотерапию. Неоадъювантная химиотерапия не повышает выживаемость по сравнению с адъювантной. Неизвестно, нужна ли адъювантная химиотерапии, если больная до операции получала и антрациклины, и таксаны.
- Перед лечением проводят пункционную биопсию первичной опухоли для определения гормональных рецепторов и экспрессии гена ERBB2. Подозрительные лимфоузлы также подвергают пункции или пункционной биопсии.
- Схема должна включать антрациклины (с таксанами или без них). В случае прогрессирования рака на фоне химиотерапии выполняется мастэктомия. Органосохраняющая операция возможна лишь при значительном уменьшении опухоли.
- После определения гормональных рецепторов и экспрессии гена ERBB2 необходимо исключить отдаленные метастазы. Обследование включает сцинтиграфию костей и УЗИ печени, для поиска метастазов в окологрудинные лимфоузлы проводят КТ грудной клетки.
- Показана химиотерапия с применением антрациклинов (с таксанами или без них) до или после операции. Если опухоль содержит гормональные рецепторы, в дальнейшем обязательна гормональная терапия.
- При эффективности химиотерапии выполняется мастэктомия или секторальная резекция, в обоих случаях с подмышечной лимфаденэктомией. Затем облучают грудную стенку (после мастэктомии) или молочную железу (в случае ее резекции) и надключичную область. При стадии IIIC показано облучение окологрудинных лимфоузлов. 4. Неясно, нужна ли адъювантная химиотерапии, если неоадъю-вантная химиотерапия включала и антрациклины, и таксаны.
А. Химиотерапия. Оптимальная схема химиотерапии диссеминиро ванного рака молочной железы неизвестна.
1. Опухоли без эстрогеновых рецепторов и усиления экспрессии гена ERBB2
а. Преимущество полихимиотерапии перед последовательным использованием тех же препаратов в рандомизированных испытаниях не доказано.
б. В качестве монотерапии предпочтительнее антрациклины (доксорубицин, обычный или липосомный, и эпирубицин), таксаны (паклитаксел, доцетаксел), капецитабин, винорельбин.
в. Помогают также гемцитабин, препараты платины, фторурацил (длительная в/в инфузия), винбластин, митомицин.
2. Опухоли с усилением экспрессии гена ERBB2
а. Эффективен трастузумаб в качестве монотерапии или в сочетании с каким-либо цитостатиком.
б. В одном рандомизированном испытании сочетание трастузумаба с химиотерапией повышало выживаемость, однако на фоне трастузумаба и доксорубицина у 27% больных развилась сердечная недостаточность.
в. Трастузумаб можно сочетать и с другими цитостатиками (п. IX.А. 1). Исследования in vitro показали его синергизм с доцетакселом, винорельбином и препаратами платины.
Б. Опухоли с гормональными рецепторами. В большинстве случаев рекомендуется гормональная терапия. Химиотерапия показана при непосредственной угрозе жизни (например, при раковом лимфангиите легких или быстро растущих метастазах в печени).
1. Женщины в постменопаузе. Гормональные препараты назначают в следующем порядке.
1) анастрозол, 1 мг/сут внутрь;
2) экземестан, 25 мг/сут внутрь;
3) летрозол, 2,5 мг/сут внутрь.
б. Тамоксифен, 20 мг/сут внутрь; или торемифен, 60 мг/сут внутрь.
в. Фульвестрант, 250 мг в/м 1 раз в месяц.
г. Мегестрол, 40 мг внутрь 4 раза в сутки.
д. Флуоксиместерон, 10 мг внутрь 2—3 раза в сутки.
е. Диэтилстильбэстрол, 5 мг внутрь 3 раза в сутки.
2. Женщины детородного возраста
б. Аналоги гонадолиберина, овариэктомия или лучевая кастрация.
д. Диэтилстильбэстрол. В. Дифосфонаты показаны при метастазах в кости. Памидронат натрия, 90 мг в/в 1 раз в месяц, и золедроновая кислота, 4 мг в/в
1 раз в месяц, уменьшают боль в костях и риск патологических переломов. Вероятно, золедроновая кислота в большей степени снижает риск переломов, гиперкальциемии, сдавления спинного мозга, а также потребность в паллиативной лучевой терапии. Г. Местное лечение. Отдаленные метастазы обычно требуют системного лечения, но иногда прибегают и к лучевой терапии.
- Метастазы в кости часто не требуют специального лечения. При боли и угрозе перелома обычно помогает лучевая терапия. При метастазах в позвонки в поле облучения включают по одному позвонку выше и ниже пораженного. Кроме того, всем больным вводят дифосфонаты (п. IX.B). Сдавление спинного мозга требует немедленной операции: в недавнем испытании хирургическая декомпрессия увеличила долю больных, которые смогли ходить, по сравнению с получавшими лишь лучевую терапию, хотя выживаемость в обеих группах была одинаковой.
- Метастазы в шейные позвонки и шейку бедренной кости независимо от симптомов обычно требуют лучевой терапии из-за угрозы перелома. При поражении шейки бедренной кости может понадобиться и профилактическая фиксация.
- Метастазы в головной мозг и глазницу. Головная боль, тошнота и рвота при метастазирующем раке молочной железы требуют немедленного исключения метастазов в головной мозг и мозговые оболочки. Для этого нужна МРТ, с контрастированием или без него. При одиночном метастазе возможна операция или стереотаксическое облучение, при множественных метастазах показано облучение всего головного мозга.
- Рецидив в грудной стенке. Обычно начинают с гормональной терапии или химиотерапии; в некоторых случаях, главным образом при изолированном рецидиве, применяют лучевую терапию.
Под понятием «химиотерапия» в медицине подразумевается применение любых лекарственных препаратов. Но по разным причинам этот термин чаще всего используется в онкологии, часто сокращают его до простого слова «химия», подразумевая, что химиотерапия влияет на весь организм, распространяясь через кровоток. Химиотерапия при раке молочной железы, как при других злокачественных заболеваниях, способна остановить или замедлить онкопроцесс.
Польза химиотерапии при лечении любой злокачественной опухоли заключается в том, что химиотерапевтический препарат может внедрятся в генетический аппарат раковой клетки в момент её деления.
Проникнув в геном этой клетки, он вызывает нарушения несовместимые с её жизнью. В результате этого запускаются механизмы самоликвидации (суицида клетки). Но борясь со злокачественными клетками, химиотерапия не способна отличить их от делящихся нормальных клеток организма. Большинство нормальных клеток взрослого человека не делятся и химиотерапия на них не действует. Тем не менее, клетки костного мозга, волосяных фолликул, слизистой желудочно-кишечного тракта постоянно размножатся и разрушаются при проведении химиотерапии. Гибель как нормальных клеток, так и злокачественных во время химиотерапии приводит к её побочным эффектам.
В этой статье вы узнаете: какие виды химиотерапии при раке молочной железы применяются, о противоопухолевых препаратах, используемые при этом заболевании, об их побочных эффектах.
Онкологи химиотерапию рака молочной железы подразделяют в зависимости от целей, которые она преследует на:
- химиотерапию при неметастатическом (2–3 стадии) раке;
- и при метастатическом раке молочной железы (4 стадия).
Схемы химиотерпии при раке молочной железы включают уколы и таблетки
Применение химиотерапии при 2–3 стадиях рака молочной железы рассматривается, как вспомогательный (адъювантный) вид лечения, дополняющий основной хирургический. При этих стадиях используют химиотерапевтические препараты с целью уничтожить раковые клетки, оставшиеся в послеоперационной ране или те, которые циркулируют с током крови по всему организму. Чаще используется комбинация этих препаратов. Они вводятся в организм через вену или через рот в виде таблеток. Клинические испытания показали, что адъювантная химиотерапия увеличивает сроки выживания и уменьшает риск рецидива среди больных, получивших её, а не только местное лечение (хирургическое или радиационное).
Онкологами используется значительный арсенал противоопухолевых препаратов и их комбинаций (схем). Например, такая как CMF, включающая в себя циклофосфамид, метотрексат и фторурацил, считается первой стандартной схемой, применяемой у женщин с раком молочной железы 2–3 стадии и широко используется по сегодняшний день. CMF обычно состоит из 6 циклов и длится приблизительно 4–6 месяцев.
Исследования доказали, что включение препарата доксорубицина (адриамицин) в схемы адъювантной химиотерапии увеличивает выживаемость среди женщин с 2–3 стадии в сравнении с теми, которые не получали доксорубицин. Наиболее часто применяются при лечении этих стадий схемы CAF (циклофосфамид, доксорубицин, фторурацил) и AC (доксорубицин и циклофосфамид). Тем не менее, эти схемы, как правило, связаны с более частыми побочными проявлениями, чем CMF.
Таксаны — вид противоопухолевых препаратов, которые, как показали последние исследования, улучшают выживаемость женщин с раком груди 2–3 стадии. В этой группе таксотер (доцетаксел) считается более эффективным, чем паклитаксел при лечении женщин с распространённым раком молочной железы (3 стадия). Таксаны, как правило, применяются в комбинации с AC схемой. Схема, содержащая таксотер ТАС (доцетаксел, доксорубицин, циклофосфамид), показала, что общая выживаемость у женщин, получавших эту комбинацию, составляет 87%. В свою очередь, у тех пациенток с 3 стадией рака груди, которые лечились FAC (5-фторурацил, доксорубицин, циклофосфамид) она была 81%.
У больных, получающие таксотер и циклофосфамид, наблюдается более высокая безрецидивная выживаемость, чем у тех, которые получают стандартные схемы химиотерапии (CMF, FAC, AC, CAF). Кроме того, комбинация таксотера и циклофосфамида менее токсична для сердца.
Эффективность лечения зависит не только от назначенного препарата, но и от того, как проводится химиотерапия при раке молочной железы, какие интервалы между её введениями. Схемы ТАС, CMF и другие, как правило, проводятся каждые 3 недели. «Dose-dense» химиотерапия проводят каждые 2 недели. Этим достигается увеличение суммарной дозы противоопухолевых препаратов. Исследования доказали, что пациентки с поражением лимфатических узлов, получившие этот вид химиотерапии, живут дольше без рецидива, чем женщины, у которых использовались обычные схемы.
Неоадъювантная терапия в отличие от адъвантной проводится перед операцией. Её цель — быстрое уменьшение размера опухоли в молочной железе для увеличения вероятности выполнения хирургического вмешательства. Результаты проведенных клинических испытаний ясно показывают, что неоадъювантная химиотерапия увеличивает вероятность выполнения органосохраняющих операций.
Рекомендуем к прочтению статью о раке молочной железы 3 стадии. В этой статье вы сможете подробнее узнать о клинических проявлениях на этой стадии рака, какие методы лечения применяются, прогноз на этой стадии заболевания.
В настоящее время существует несколько стандартных схем химиотерапии 4 стадии рака груди, которые примерно у 25% пациенток могу полностью затормозить на длительный срок развитие опухоли. К сожалению, у каждой четвертой пациентки они окажутся совершенно неэффективными.
Тип химиотерапии при 4 стадии зависит от цели лечения. Если цель — уменьшить симптомы и улучшить качество жизни, более целесообразно выбрать химиотерапию с минимальными побочными эффектами.
С другой стороны, если цель — попытаться вылечить рак, потребуются более агрессивные схемы или участие в клинических исследованиях, предоставляющие новые стратегии лечения, которые могут быть более подходящими в каждом конкретном случае.
Важно изначально женщине определиться с целью лечения. Причина здесь в том, что начальное лечение рака молочной железы 4 стадии, как правило, более эффективно, чем лечение рецидива, который неизбежно случится. Неудача лечения рецидива в том, что раковые клетки становятся невосприимчивыми к терапии. Пациентки, заинтересованные в агрессивном лечении, могут принять участие в клинических исследованиях, где в качестве первой терапии используются агрессивные схемы.
Тяжесть побочного действия химиотерапии при раке молочной железы зависит от конкретного препарата, способа его введения и особенностей организма. Врачи располагают достаточным арсеналом эффективных средств борьбы с побочными проявлениями химиотерапии. Их можно разделить на две группы.
Побочные эффекты химиотерапии, встречаемые часто, но серьёзную опасность для организма пациента они не представляют:
- тошнота и рвота;
- усталость;
- выпадение волос;
- диарея или запор;
- потеря веса;
- язвочки и инфекционное воспаление ротовой полости;
- реакция со стороны кожи или ногтей;
- депрессия.
Побочные эффекты химиотерапии редко встречаемые, но довольно опасные:
- инфекция, связанная с низким уровнем лейкоцитов;
- кровотечение;
- проблемы с почками или мочевым пузырём;
- проблемы с сердцем;
- проблемы с нервами.
Адъювантная химиотерапия. Без адъювантной системной терапии десятилетняя выживаемость в отсутствие метастазов в лимфоузлы составляет около 65%, при метастазах в 1—3 лимфоузла — 40%, при 4 и более лимфоузлах — 15%. У половины больных из последней группы отдаленные метастазы появлялись в течение 18 мес.
Адъювантная терапия заметно повышает выживаемость
- Показания. Химиотерапия показана почти всем больным с метастазами в лимфоузлы, в отсутствие метастазов она рекомендуется при опухолях без эстрогеновых и прогестероновых рецепторов, с умеренной и низкой дифференцировкой и усиленной экспрессией ERBB2. Эффективность зависит от возраста и наличия гормональных рецепторов.
- Эффективность. Как показал метаанализ, опубликованный в 1998 г. Объединенной группой исследователей ранних стадий рака молочной железы (Early Breast Cancer Trialists Collaborative Group, 1998), эффективность адъювантной химиотерапии снижается с возрастом.
а. У женщин моложе 40 лет адъювантная химиотерапия снижает риск рецидива на 39%, у женщин 50—59 лет — лишь на 22%.
б. При опухолях без эстрогеновых и прогестероновых рецепторов эффективность химиотерапии вышес’Так, у женщин 50 лет и старше риск рецидива снижается на 30%, если опухоль не содержит эстрогеновых рецепторов, и лишь на 18% при их наличии.
в. Если риск рецидива составляет 100%, тридцатипроцентное снижение уменьшит его до 70%, но при исходном риске, равном 10%, абсолютное снижение составит лишь 3%. Таким образом, к назначению химиотерапии на ранних стадиях следует подходить взвешенно.
3. Схемы химиотерапии (табл. 10.4). Согласно рекомендациям. Национальной онкологической сети США (National Compre-hensive Cancer Network — NCCN) от 2003 г., выбор схемы зависит от состояния лимфоузлов.
а. Метастазов в лимфоузлы нет CMF (циклофосфамид, метотрексат и фторурацил). FAC/CAF (циклофосфамид, доксорубицин и фторурацил). АС (доксорубицин и циклофосфамид).
б. Метастазы в лимфоузлы CMF. FAC/CAF.
CEF (циклофосфамид, эпирубицин и фторурацил). АС. АС, затем паклитаксел. ЕС (эпирубицин и циклофосфамид). ТАС (доцетаксел, доксорубицин и циклофосфамид). Доксорубицин каждые 3 нед, затем CMF.
в. Вероятно, при опухолях с усилением экспрессии ERBB2 более эффективны схемы с доксорубицином. Кроме того, схемы с антрациклинами предпочтительнее при метастазах в лимфоузлы.
источник
Химиотерапия – лечение различных заболеваний с помощью токсинов и ядов, которые губительно воздействуют на злокачественные новообразования, а также наносящие меньший урон организму человека или животного.
Адъювантная химиотерапия — воздействие цитостатических препаратов, а точнее данные препараты проникают непосредственно в злокачественные клетки и разрушают цепь нуклидов ДНК клеток. Применяют такую терапию в первые моменты обнаружения опухоли, после операций и при возникновении метастазов.
Адъювантную химиотерапию назначают строго по показаниям. Для того, чтобы появились показания, необходимо сдать целый комплекс анализов, пройти медицинское обследование, которое будет включать в себя:
- УЗИ (ультразвуковую) диагностику;
- Рентгенографические исследования;
- Анализ на онкомаркеры;
- МРТ (Магнитно-резонансная томография);
- КТ (компьютерная томография);
Цитостатические препараты имеют действия при лечении онкологий на такие опухоли:
- Лейкоз, лейкемия (рак крови, белокровие) – злокачественное заболевание крови;
- Рабдомиосаркома – онкологическое заболевание поперечнополосатой мускулатуры, то есть мышц, которые выполняют двигательную функцию.
- Хорионкарциномами – злокачественная патология, характеризующаяся перерождением хорионического слоя эпителия, то есть происходят изменения хорионического слоя и в последствии это выглядит как однородная гомогенная масса.
- Лимфома Беркитта (неходжикинская лимфома) – злокачественное поражение лимфатической системы, а в дальнейшем и всех органов.
- Опухоль Вильмса – опухолевое образование, которое характеризуется поражением паренхимы почек.
Адъювантная химиотерапия применяется после удаления опухолей таких как: бронхогенная карцинома (рак легкого, аденокарцинома, плоскоклеточный рак, рак пищеварительного тракта, опухоли придатков, новообразования на кожных покровах, при раке молочной железы и т.д.
Если опухолевое образование больших или гигантских размеров, цитастатичскую терапию назначают для уменьшения опухоли, для дальнейшего удалении менее обширного очага.
Для облегчения состояния проводится паллиативная помощь больным. Когда онкологические заболевания в запущенной форме цитостатические лекарства помогают облегчить состояние, уменьшить болевые ощущения, предоставить больному более комфортную жизнь. Чаще всего назначают детям.
Химиотерапия цитататиками переносится, как правило, достаточно тяжело, потому что они обладают иммунодепрессиным характером. Иногда возникают побочные реакции, которые могут ухудшить состояние пациента.
Адъювантную терапию проводят курсами. Курсы могут продолжаться от двух до семи месяцев. Обычную «химию» проводят от шести до восьми курсов химиотерапевтического воздействия на злокачественный очаг.
Бывают случаи, когда один курс химиотерапии проводится три-четыре дня подряд и повторяют его две-четыре недели. Все процедуры проводятся в стационарных условиях, строго под наблюдением врачей. После каждого воздействия химиопрепаратов проводят общий и биохимический анализы крови, а также в перерывах между курсами в случаи осложнений.
Ни для кого не секрет, что после химиотерапии пациенты чувствую себя плохо, в этом и заключается причина тяжести химических реагентов. Лечение онкологии сопровождается рядом побочных эффектов и самый неблагоприятный это угнетение кроветворной системы, а именно уничтожение белых кровяных телец (лейкоцитов, лимфоцитов).
Лейкоциты и лимфоциты нужны для защиты организма, именно они отвечают за иммунитет. Поражение этих клеток приводит к нарушению работы иммунной системы организма, после чего наблюдают апатичное и угнетенное состояние больного.
Организм становится «стерильным» и поэтому могут присоединяться другие вирусные или бактериальные заболевания. Внешние побочные эффекты:
- Выпадение волос;
- Появление алопеций;
- Анемичность кожи и слизистых;
- Сам человек становится безразличным к внешним раздражителям, плаксивым;
- Наблюдается нарушение сна;
- Постоянная депрессия;
- Наблюдается диарея;
- Тошнота;
- Рвота;
- Слезотечение.
Неоадъювантная химиотерапия применяется перед лучевой или перед хирургической операцией. Все действия врача имеют четкую последовательность.
Основное преимущество неоадъювантного лечения в том, что оно не заставляет расслаблять сфинкторы организма (анального сфинктера, сфинктора мочевого пузыря, гортани), то есть человек после этой терапии не станет «ходить под себя».
Также благодаря данной терапии возможно избежать хирургических операций (рак желудка, рак матки, рак молочной железы, онкологию костей и мягких тканей). Так как рак может поражать не только весь орган, а только его часть. Данная терапия позволяет сохранить жизнеспособность одного участка. Могут удалить часть не пораженной груди, часть опухоли яичников и т.д.
Данный режим ПХТ (полихимитерапия) позволяет уничтожить субклинические метастазы (метастазы, которые еще не дают о себе знать, только начинают зарождаться). Еще такой метод позволяет оценить чувствительность опухоли, то есть к какому препарату более чувствительно новообразование.
Если проявляется высокая чувствительность опухоли к цитостатикам, их используют для дальнейшей борьбы с новообразованием, а точнее для адъювантной терапии, при низкой – назначают другие препараты.
Неоадъювантную применяю как пробный вариант, а адъювантную для полноценной борьбы с онкологией. Не всегда врач знает какой именно препарат будет наиболее эффективен для того или иного вида опухоли. Поэтому проводят эксперимент и смотрят на результат. Если выбранное лечение помогает, опухоль уменьшается, тогда реагент оставляют и уже полноценно используют в лечении.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Х имиотерапия и гормонотерапия играют существенную роль в комплексном лечении рака молочной железы практически при всех стадиях заболевания. Это объясняется особенностями данной опухоли – даже на ранних стадиях заболевания велик риск существования отдаленных микрометастазов, особенно при наличии факторов риска (поражении подмышечных лимфоузлов, отрицательных рецепторах эстрадиола и прогестерона, гиперэкспрессии Неr–2/neu и т.д.). Применение адъювантной химио– и гормонотерапии значительно улучшило результаты лечения операбельного рака молочной железы. При запущенном раке молочной железы химиотерапия и гормонотерапия являются основными методами лечения, позволяющими значительно продлить жизнь больного и улучшить ее качество. У 10–25% женщин с диссеминированным раком молочной железы возможно достижение полной регрессии опухоли с длительным безрецидивным периодом.
Адъювантная терапия рака молочной железы сегодня представляет собой систему стандартов, эффективность которых доказана в большом числе клинических исследований [1].
До настоящего времени остается четыре независимых прогностических фактора при резектабельном раке молочной железы: поражение регионарных лимфатических узлов, размер первичной опухоли, степень дифференцировки и содержание рецепторов к стероидным гормонам (к эстрогенам – РЭ и к прогестерону – РП).
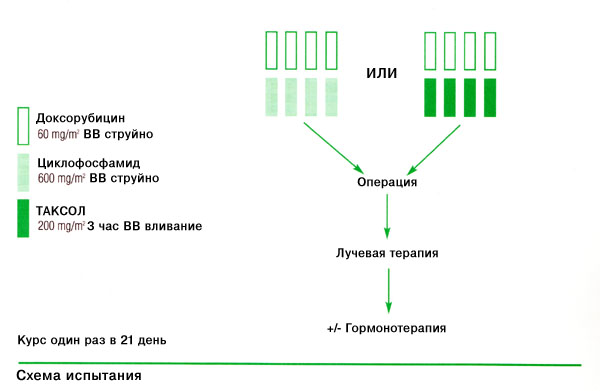
Стандартами химиотерапии и эндокринной терапии являются: 4 цикла химиотерапии в режиме АЦ (адриамицин + циклофосфан) или АЦФ (адриамицин + циклофосфан + фторурацил) или 6 циклов химиотерапии по схеме ЦМФ (циклофосфан + метотрексат + фторурацил), а также тамоксифен 20 мг в день в течение 5 лет.
Первый фактор, положенный в основу назначения адъювантной терапии – поражение регионарных лимфатических узлов, разделяет всех больных на две группы.
Рак молочной железы без метастазов в регионарные лимфоузлы
Для назначения адъювантной терапии в этой группе необходимо определение групп повышенного риска. Граница для назначения адъювантной лекарственной терапии, что означает группу повышенного риска – снижение пятилетней выживаемости до 95% и менее (табл. 1).
Только в группе низкого риска пятилетняя выживаемость больных составляет более 95%. Во всех остальных группах проведение адъювантной лекарственной терапии улучшает результаты хирургического лечения.
Больным в пременопаузе с умеренным или высоким риском и положительным уровнем эстрогенных рецепторов показана химиотерапия с последующим назначением тамоксифена. При гормононезависимых опухолях показано назначение только химиотерапии.
Больным в постменопаузе с умеренным или высоким риском и положительным уровнем эстрогеновых рецепторов показан прием тамоксифена, а в группе высокого риска – комбинация химиотерапии с тамоксифеном. При отрицательном уровне рецепторов к эстрогенам показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена, а в группе высокого риска возможно дополнительное назначение химиотерапии. С уче– том возраста больных дополнительное назначение химиотерапии должно быть индивидуально обоснованным.
Рак молочной железы с метастазами в регионарные лимфоузлы
У всех больных раком молочной железы с метастазами в регионарные лимфатические узлы применение адъювантной лекарственной терапии улучшает результаты лечения.
При положительном уровне рецепторов к эстрогенам вне зависимости от менструальной функции показана комбинированная адъювантная терапия – химиотерапия и эндокринная терапия тамоксифеном.
При гормононезависимых опухолях показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена вне зависимости от уровня эстрогеновых рецепторов. Если уровень рецепторов к эстрогенам отрицательный, возможно дополнительное назначение химиотерапии. С учетом возраста больных дополнительное назначение химиотерапии должно быть индивидуальным.
При всей внешней простоте и схематичности назначения адъювантного лечения лишь методы, доказавшие свою эффективность в результате длительных клинических исследований, применяются для лечения больных. Оптимальная тактика адъювантной терапии постоянно совершенствуется. Совсем недавно химиотерапия рекомендовалась только больным в пременопаузе с метастазами в регионарные лимфатические узлы. В настоящее время только больным с низким риском и пожилым больным с положительными эстрогеновыми рецепторами не показано проведение химиотерапии.
При проведении адъювантной химиотерапии необходимо строго придерживаться оптимального режима (стандартных доз и интервалов между циклами). Неоправданные модификации режимов химиотерапии, несомненно, ухудшают результаты лечения.
Сегодня продолжаются исследования роли выключения функции яичников и рутинное применение данного метода адъювантного лечения нецелесообразно.
Появились данные об эффективности таксанов, как дополнительной химиотерапии к антрациклин–содержащим комбинациям у больных с неблагоприятным про– гнозом.
В связи с широкими исследованиями роли гиперэкспрессии рецептора Her2/neu наметились новые тенденции в оценке прогноза и лечения больных. Однако пока необходимо дополнительное число исследований для изменения практических рекомендаций.
Исследования по адъювантной терапии рака молочной железы интенсивно продолжаются, и можно надеяться, что в ближайшее время все больше и больше женщин будут излечиваться от рака молочной железы.
Неоадъювантная терапия – системное лечение, которое проводится до начала локального лечения (хирургического вмешательства или лучевой терапии).
Задачи неоадъювантной терапии:
- уменьшение размеров первичной опухоли и регионарных метастазов
- уменьшение объема оперативного вмешательства (радикальная резекция вместо радикальной мастэктомии)
- определение чувствительности опухоли к цитостатикам, выявление резистентных случаев с целью использования альтернативных режимов для адъювант– ной химиотерапии
- увеличение общей и безрецидивной выживаемости
- оценка новых режимов лечения по частоте полной клинической и морфологической ремиссии.
Стандартом неоадъювантной химиотерапии по результатам многоцентрового исследования NSABP B–18 признана схема АЦ, при применении которой объективный эффект составил 80%, полная морфологическая ремиссия отмечена у 15% больных.
Предполагалось, что раннее воздействие противоопухолевых лекарств на микрометастазы приведет к увеличению общей и безрецидивной выживаемости. Однако анализ 7 крупных рандомизированных исследований, в том числе NSABP B–18, включившего 1500 женщин с операбельным раком молочной железы, проведенный Wolff [2], не подтвердил эту гипотезу. Продолжительность жизни может быть увеличена только за счет рационального подхода к лечению – использования альтернативных режимов для адъювантной химиотерапии в случае низкой эффективности неоадъювантного лечения.
Продолжается поиск наиболее эффективного режима неоадъювантной химиотерапии. Особенно важным показателем является достижение полной морфологической регрессии опухоли, так как именно этот показатель статистически достоверно коррелирует с ростом общей выживаемости. С этой целью исследуются комбинации, включающие наиболее эффективные препараты, входящие в режимы неоадъювантной химиотерапии в последние годы – цисплатин, навельбин, таксаны. Некоторые авторы показали преимущество комбинаций антрациклинов и таксанов по сравнению со стандартным режимом АС. Разрабатываются новые режимы, включающие препараты, недавно вошедшие в практику химиотерапии, например, кселода и герцептин. Исследуются интенсивные режимы химиотерапии, однако пока не получено достоверных доказательств влияния интенсификации неоадъювантной химиотерапии на отдаленные результаты лечения.
Обсуждается количество курсов неоадъювантной химиотерапии. Признано, что эффект химиотерапии и частота полных регрессий опухоли зависят от количест– ва курсов лечения. Поэтому целесообразно проводить не менее 4 курсов, что безопасно для больных при условии регулярного контроля за динамикой заболевания.
У больных в менопаузе с положительными РЭ и/или РП применяется неоадъювантная гормонотерапия. Объективный эффект гормонотерапии достигает 50–70%. Для неоадъювантной гормонотерапии могут быть рекомендованы тамоксифен, анастразол, летрозол, экземестан.
Диссеминированный рак молочной железы
Для выбора метода лечения перед началом терапии необходимо оценить ряд прогностических факторов, определяющих возможный ответ заболевания на проводимое лечение. Длительный период, прошедший после лечения первичной опухоли до появления отдаленных метастазов, поражение только мягких тканей и костной системы или единичные отграниченные очаги в легких, медленный рост опухоли, удовлетворительное общее состояние больной, пожилой возраст и постменопауза, положительный уровень рецептов эстрадиола и/или прогестерона свидетельствуют о вероятно высокой чувствительности опухоли к гормонотерапии. В случае раннего появления отдаленных метастазов после лечения первичной опухоли, быстрого прогрессирования заболевания, молодого возраста больной, при множественных висцеральных метастазах, наличии лимфангоита кожи или легких лечение необходимо начинать с химиотерапии.
Эффективность гормонотерапии при положительном уровне РЭ и РП достигает 50–70%, снижается при положительных рецепторах одного вида (33%). При отрицательных РЭ и РП существует небольшой процент больных (5–10%), отвечающих на гормонотерапию. Традиционными препаратами, рекомендованными для первой линии гормонотерапии у больных в менопаузе, являются антиэстрогены – тамоксифен и торемифен. В настоящее время в I линии эндокринотерапии альтернативой тамоксифену являются антиароматазные препараты – анастрозол и летрозол. Во II линии эндокринотерапии больных раком молочной железы в менопаузе (при использовании тамоксифена в I линии) в настоящее время вместо прогестинов используются антиароматазные препараты (анастрозол, летрозол, экземестан). Применять прогестины во II линии гормонотерапии считается неэтичным.
У больных в пременопаузе гормонотерапию можно начинать с выключения функции яичников с помощью агониста гонадотропин–рилизинг гормона гипофиза – гозерелина (золадекса), а также хирургическим или лучевым методами.
Эффект гормонотерапии оценивается через 6–8 нед после начала лечения. Положительным ответом считается не только полная или частичная регрессия опухоли, но и длительная стабилизация заболевания (>=6 месяцев). Лечение продолжается до прогрессирования болезни. В случае быстрого прогрессирования болезни после гормонотерапии первой линии следует начать химиотерапию. При прогрессировании после длительного положительного эффекта на фоне первой линии гормонотерапии, а также кратковременной полной или частичной регрессии опухоли начинают гормонотерапию второй линии – ингибиторы (инактиваторы) ароматазы.
Наиболее известные ингибиторы ароматазы – аминоглютетемид (ориметен, мамомит), ингибитор ароматазы первого поколения, стероидный инактиватор ароматазы – экземестан (аромазин) и препараты третьего поколения – летрозол (фемара), анастрозол (аримидекс). Экземестан, летрозол и анастрозол менее токсичны и не требуют заместительной кортикостероидной терапии. Они эффективны и у больных, принимавших ранее аминоглютетемид: если лечение аминоглютетемидом было эффективным, частота ответа составляет 25–33%, если неэффективным – 6–12%. У пременопаузальных больных ингибиторы ароматазы назначаются только после выключения функции яичников, чтобы избежать активизации синтеза эстрогенов в функционирующих яичниках по принципу «обратной связи».
Третья линия гормонотерапии – прогестины – медроксипрогестерона ацетат (фарлутал, провера) и мегестрола ацетат (мегейс). Достаточно редко в наше время в III линии гормонотерапии используются андрогены и у женщин в постменопаузе – эстрогены.
Стандартами I линии химиотерапии рака молочной железы являются схемы: ЦМФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, метотрексат 40 мг/м 2 в/в дни 1,8, фторурацил 600 мг/м 2 в/в дни 1,8, интервал 4 нед), ЦАФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, доксорубицин 30 мг/м 2 в/в дни 1,8, фторурацил 500 мг/м 2 в/в дни 1, 8, интервал 4 недели), АЦФ (фторура– цил 500 мг/м 2 , доксорубицин 50 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), ЕЦФ (фторурацил 500 мг/м 2 , эпирубицин 100 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), АЦ (доксорубицин 60 мг/м 2 , циклофосфан 600 мг/м 2 каждые 3 нед).
Большинство исследователей отдают предпочтение антрациклиновым комбинациям, учитывая более высокий противоопухолевый эффект этих комбинаций по сравнению с ЦMФ. Комбинация ЦМФ чаще используется у пожилых больных, при противопоказаниях к применению антрациклинов.
Высокую эффективность показали комбинации антрациклинов и таксанов – АТ (доксорубицин 50–60 мг/м 2 , паклитаксел 175 мг/м 2 , интервал 3 нед), ЕД (эпирубицин 100 мг/м 2 , доцетаксел 75 мг/м 2 , интервал 3 нед).
Длительность химиотерапии обычно определяется ответом опухоли: после достижения максимального эффекта проводится дополнительно 2 курса ПХТ. Затем предпочтение может быть отдано наблюдению за больным до прогрессирования. При продолжении лечения до прогрессирования увеличивается время до прогресси– рования, однако общая выживаемость не меняется, при этом снижается качество жизни больных.
Ведется поиск эффективных комбинаций для первой линии лечения диссеминированного рака молочной железы, включающих новые препараты, в частности, капецитабин (кселода). Показано, что капецитабин имеет лечебную активность, сходную с ЦМФ.
У больных, имевших прогрессирование после химиотерапии антрациклинсодержащими комбинациями, стандартом дальнейшего лечения являются таксаны (паклитаксел 175 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед, доцетаксел 100 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед). В монотерапии у резистентных к антрациклинам больных объективный эффект составляет 41%. В последнее время все более популярным становится еженедельное введение таксанов, при этом увеличивается интенсивность лечения без увеличения токсичности. Эффективны комбинации таксанов с другими препаратами: навельбин 20 мг/м 2 в/в дни 1, 5-й + доцетаксел 75 мг/м 2 в/в со стандартной премедикацией день 1-й, интервал 3 нед; паклитаксел 175 мг/м 2 в/в со стандартной премедикацией день 1-й + фторурацил 1 г/м 2 /день в/в кап. 72–часовая инфузия дни 1, 2, 3-й, интервал 3 нед; кселода 1650 мг/м 2 дни 1–14 + паклитаксел 175 мг/м 2 (или доцетаксел 75 мг/м 2 )1 раз в 3 нед; гемцитабин 1 г/м 2 дни 1, 15-й + паклитаксел 135 мг/м 2 дни 1, 15-й, интервал 4 нед.
Для третьей и последующих линий лечения четких стандартов не разработано. Применяются комбинации препаратов, включающие навельбин, препараты платины (цисплатин, оксалиплатин), антиметаболиты (длительные инфузии фторурацила, гемцитабин, томудекс, кселода). Следует отметить высокую эффективность кселоды у больных во II (объективный ответ у 36% больных) и III (20%) линиях химиотерапии. Препарат может быть рекомендован, как альтернатива таксанам во II линии химиотерапии.
Некоторые режимы, эффективные во II–III линии лечения диссеминированного рака молочной железы: МММ – митомицин 8 мг/м 2 в/в день 1 + митоксантрон 8 мг/м 2 в/в день 1 + метотрексат 30 мг/м 2 в/в день 1; МЕП – митомицин 10 мг/м 2 в/в день 1 + цисплатин 40 мг/м 2 в/в дни 2, 7 + вепезид 100 мг/м 2 в/в дни 3 ,4, 5, интервал 4 нед; цисплатин 80 мг/м 2 в/в день 1 + кселода 2000 мг/м 2 внутрь ежедневно дни 1–14; навельбин 25 мг/м 2 в/в дни 1, 8 + митомицин 7 мг/м 2 в/в день 1, интервал 4 недели; навельбин 20 мг/м 2 в/в дни 1, 15 + цисплатин 80 мг/м 2 в/в день 1, интервал 4 нед; циклофосфан 600 мг/м 2 в/в день 1 + лейковорин 500 мг/м 2 в/в кап. в течение 2 часов + фторурацил 1,5 г/м 2 в/в постоянная 24–часовая инфузия, дни 1, 15, интервал 4 нед; навельбин 25 мг/м 2 в/в дни 1, 8 + томудекс 1 мг/м 2 в/в дни 1, 8, интервал 3 нед.
В 25–30% случаев в опухоли молочной железы отмечается гиперэкспрессия Неr–2/neu, коррелирующая с плохим прогнозом заболевания. У таких больных эф– фективен Герцептин – препарат принципиально нового механизма действия – рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором Неr–2/neu. Герцептин применяется еженедельно, первое введение – 4 мг/кг в/в, последующие – 2 мг/кг. Лечение продолжается до прогрессирования заболевания. Герцептин рекомендуется к применению у больных с гиперэкспрессией Неr–2/neu в комбинации с гормонотерапией и химиотерапией. Добавление герцептина к комбинации АС повысило частоту объективных эффектов с 42 до 60%. При резистентности к антрациклинам комбинация герцептина с таксолом была эффективна у 49% больных (при монотерапии таксолом эффект составил 17%). Изучаются комбинации герцептина с другими цитостатиками, например, с кселодой, навельбином [5].
1. Материалы шестой конференции по адъювантной терапии рака молочной железы, Сан–Галлен Швейцария, 1998 год.
2. A.C.Wolff, N.E. Davidson: Primary systemic therapy in operable breast cancer. J Clin Oncol 18:1558–1569, 2000.
3. C.А. Тюляндин: Химиотерапия диссеминированного рака молочной железы. Практическая онкология, 2, 2000.
источник
Роль полусинтетического Таксола (паклитаксел) для инъекций в неоадъювантном лечении рака молочной железы
НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ В ЛЕЧЕНИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Неоадъювантная химиотерапия стала стандартной процедурой в лечении местнораспространенной формы рака молочной железы, и в настоящее время исследуются ее показания в отношении ранних форм операбельного заболевания [1-3]. Главные задачи неоадъювантной химиотерапии заключаются в улучшении местного контроля заболевания за счет подавления первичной опухоли (до более низкой стадии), в обеспечении возможности хирургической операции, сберегающей молочную железу, и теоретически в уничтожении отдаленных микрометастазов (Таблица 1) [2-4]. В исследованиях по неоадъювантной химиотерапии сообщалось о высоком общем проценте ремиссий, включая полные ремиссии, подтвержденные данными патологического исследования, а также об эффективном снижении стадии первичной опухоли: после неоадъювантной химиотерапии у 60-80% больных с операбельной формой рака молочной железы можно проводить орган-сберегающую хирургическую операцию [2].
Таблица 1. Преимущества неоадъювантной химиотерапии при лечении рака молочной железы [2-4]
| Раннее начало системного лечения |
Из работы Хортобади и соавт. [4]
Важным клиническим преимуществом неоадъювантной химиотерапии является то, что она позволяет оценить реакцию первичной опухоли и лимфатических узлов с метастазами на лечение in vivo [3, 4]. В нескольких исследованиях было показано, что полная ремиссия первичной опухоли после неоадъювантной химиотерапии, подтвержденная данными патологического исследования, является надежным предиктором отсутствия опухолевого процесса в лимфатических узлах [5-7]. Далее, полная ремиссия в ответ на неоадъювантную химиотерапию является достоверным предиктором улучшения общей выживаемости и удлиннения периода, свободного от признаков заболевания [5, 7, 8].
Эти результаты говорят о ценности неоадъювантной химиотерапии в плане идентификации подгрупп больных, у которых лечение дает ориентир для прогноза [5]. Более консервативное лечение может оказаться возможным у больных с полной ремиссией в первичной опухоли, подтвержденной данными патологического исследования, и с негативным статусом в отношении поражения лимфатических узлов по данным клинической оценки [6]. Оценка ответа на неоадъювантную химиотерапию может помочь выявить больных, которым требуется более агрессивная форма лечения, а также больных с устойчивым к лечению заболеванием, для которых адъювантная химиотерапия может оказаться неэффективной [5]. Для определения оптимальной стратегии лечения в разных подгруппах больных требуются дополнительные исследования.
В настоящее время имеются лишь немногочисленные данные, посвященные сравнению положительных результатов по выживаемости за счет неоадъювантной терапии по сравнению с адъювантной химиотерапией. Для выяснения роли неоадъювантной терапии в лечении рака молочной железы необходимы результаты долгосрочных рандомизированных испытаний.
ПОЛУСИНТЕТИЧЕСКИЙ ТАКСОЛ (ПАКЛИТАКСЕЛ) ДЛЯ ИНЪЕКЦИЙ В КОНТЕКСТЕ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ
Активность Таксола при лечении метастатической формы рака молочной железы хорошо доказана [9]. В исходных испытаниях применение Таксола у больных метастатической формой рака молочной железы, которым ранее не проводилась интенсивная химиотерапия (один курс или менее), было показано, что общие проценты ремиссий составляют от 56 до 62%, включая полные ремиссии [10, 11]. Было также показано, что у таких больных активна также комбинация Таксола и доксорубицина [12]. В нескольких испытаниях по Фазе II и III была продемонстрирована активность и профиль токсичности комбинации доксорубицин/Таксол при метастатической форме рака молочной железы [13-15]. Недавние исследования сосредоточили внимание на том, чтобы попытаться использовать эффективность Таксола в контексте неоадъювантной химиотерапии рака молочной железы, когда Таксол применяется как в форме монотерапии, так и в комбинации с доксорубицином [16, 17]. В настоящей монографии описываются многообещающие результаты двух недавно опубликованных исследований применения Таксола в контексте неоадъювантной химиотерапии.
ИССЛЕДОВАНИЯ ОНКОЛОГИЧЕСКОГО ЦЕНТРА им. М. Д. АНДЕРСОНА ТЕХАССКОГО УНИВЕРСИТЕТА (MDACC): РАНДОМИЗИРОВАННОЕ ИСПЫТАНИЕ ПОЛУСИНТЕТИЧЕСКОГО ТАКСОЛА (ПАКЛИТАКСЕЛ) ДЛЯ ИНЪЕКЦИЙ В ФОРМЕ МОНОТЕРАПИИ ПО СРАВНЕНИЮ СО СХЕМОЙ FAC В КАЧЕСТВЕ ИНДУКЦИОННОЙ ТЕРАПИИ У БОЛЬНЫХ С ОПЕРАБЕЛЬНОЙ ФОРМОЙ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
В MDACC проведено рандомизированное испытание по сравнению Таксола, применявшегося в форме монотерапии, с комбинацией 5-фтороурацила, доксорубицина и циклофосфамида (FAC) для неоадъювантной химиотерапии у шести больных с операбельной формой рака молочной железы. Основой этого испытания были данные о высоком проценте ремиссий, полученные ранее в MDACC при использовании Таксола у больных с метастатической формой рака молочной железы, а также отсутствие перекрестной резистентности между Таксолом и антрациклинами, продемонстрированное ранее [9]. Было высказано предположение, что использование для индукционной терапии не того же самого режима, который применяется позже в ходе лечения, а агента, не дающего с ним перекрестной резистентности, понизит риск рецидивирования [18]. Главным критерием для оценки испытания была выживаемость без признаков заболевания; вторичные критерии включали клинические ремиссии, остаточное заболевание по данным патологического исследования (молочная железа и лимфатические узлы), а также общая выживаемость больных [18, 19].
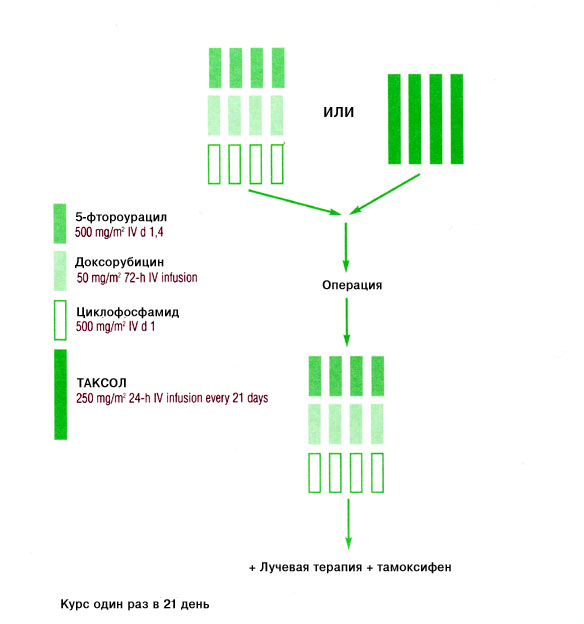
С июня 1994 г. по июль 1998 г. 174 больных было рандомизировано на лечение Таксолом или схемой FAC в течение четырех курсов, после чего проводилась хирургическая операция и четыре дополнительных курса FAC (Рисунок 1) [16, 17].
Рис. 1. Схема испытания неоадъювантной терапии в MDACC [16,18].
После завершения первых четырех курсов химиотерапии больных оценивали в многопрофильной клинике, занимавшейся вопросами дальнейшего планирования лечения, для определения возможности сохранения молочной железы и степени пораженности лимфатических узлов. Всем больным с персистирующим, определяемым путем пальпации поражением подмышечных лимфатических узлов, проводили иссечение подмышечных лимфатических узлов. После химиотерапии определяемая стадия опухоли уменьшалась до стадии N0-2, N0, и такие больные были кандидатами на сохранение молочной железы и дальнейшее лечение, проводившееся путем иссечения подмышечных лимфатических узлов или облучения после второй рандомизации в рамках отдельного протокола. После химиотерапии все больные с положительным статусом опухоли по эстрогеновым рецепторам в возрасте старше 50 лет получали тамоксифен в течение 5 лет [18].
Таблица 2. Характеристики больных до лечения
Полусинтетический Таксол (паклитаксел) для инъекций No. (%)
Клиническое состояние лимфоузлов
Статус по эстрогеновым рецепторам
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
Клинический ответ на лечение был сходным в двух леченых группах после четырех курсов химиотерапии (Таблица 3). Общий процент ремиссий в группе, получавшей схему FAC, составлял 79% (24% полный ремиссий) по сравнению с 80% (27% полных ремиссий) в группе, получавшей полусинтетический Таксол (паклитаксел) для инъекций. У трех больных, получавших лечение схемой FAC, и одного больного в группе Таксола отмечалась прогрессия заболевания во время индукционной фазы терапии. Между двумя группами не наблюдалось статистически достоверных различий в отношении остаточного заболевания в молочной железе и подмышечных лимфатических узлах по данным патологического обследования на момент хирургической операции (Таблица 4). Несколько более высокий процент больных в группе FAC не имел остаточного заболевания или заболевания in situ; однако большее число больных в группе, получавшей Таксол, дало уменьшение размеров опухоли до величины менее 1 см. Орган-сберегающая хирургическая операция выполнялась у несколько большего процента больных, получавших лечение Таксолом (Таблица 5) [18].
Таблица 3. Клинический ответ
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
Выживание без признаков заболевания
При среднем (медиана) сроке наблюдения, составлявшем 23 месяца (интервал от 3 до 52 месяцев), рецидив заболевания отмечался у 100 больных в группе FAC и 7 больных в группе Таксола. По проведенным оценкам, выживание в течение 2 лет без признаков заболевания наблюдалось у 89% больных в группе FAC и у 94% больных в группе Таксола (Р=0,44) [18]. Данные по общему проценту выживания пока отсутствуют.
Таблица 4. Остаточное заболевание по данным оценки патолога
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
*Двум больным хирургическая операция не проводилась, 9 больным не проводилось иссечение подмышечных лимфатических узлов, и 1 больная, относительно которой неизвестно, проводилось ли облучение.
**Одна больная потеряна для последующего наблюдения. В одном случае тип хирургической операции неизвестен. У восьми больных иссечения подмышечных лимфатических узлов не проводилось и 3 больных, относительно которых неизвестно, проводилось ли облучение.
Таблица 5. Местное лечение в зависимости от варианта
Тип хирургической операции
Сегментная+иссечение подмышечных лимфатических узлов
FAC=5-фтороурацил, доксорубицин, циклофосфамид.
*Двум больным хирургическая операция не проводилась, 9 больным не проводилось иссечение подмышечных лимфатических узлов, и 1 больная, относительно которой неизвестно, проводилось ли облучение.
**Одна больная потеряна для последующего наблюдения. В одном случае тип хирургической операции неизвестен. У восьми больных иссечения подмышечных лимфатических узлов не проводилось и 3 больных, относительно которых неизвестно, проводилось ли облучение.
Токсические эффекты, описанные для обоих вариантов лечения, представлены в Таблице 6. Средняя кумулятивная полученная доза составляла 100% для схемы FAC (интервал 50-100%) и 100% для полусинтетического Таксола (паклитаксел) для инъекций (интервал 0-100%). Токсические эффекты, которые наблюдались в группе, получавщей Таксол, соответствовали тем, которые обычно описываются для схемы с вливанием Таксола на протяжении 24 часов. Частота нейтропенической лихорадки была более высокой в группе Таксола; однако профилактическое применение G-CSF или антибиотиков снижало частоту этого осложнения в ходе последующих циклов химиотерапии. Летальных исходов, связанных с лечением, не наблюдалось, и отсутствовали эпизоды клинически регистрируемых нарушений сердечной деятельности в обоих вариантах исследования. У небольшого процента больных в обеих группах лечения наблюдались транзиторные аритмии, однако они не требовали каких-либо вмешательств или изменения характера лечения [18].
Таблица 6. Токсичность
Тяжелые аллергические реакции
Застойная сердечная недостаточность
FAC=5-фтороурацил, доксорубицин, циклофосфамид; G-CAF=гранулоцитный колониестимулирующий фактор.
*Приведены токсические эффекты только 3-й степени.
Предварительные данные этого рандомизированного испытания показывают, что полусинтетический Таксол (паклитаксел) для инъекций, применяемый в форме монотерапии, и комбинированная терапия с использованием схемы FAC обладают сходным противоопухолевым действием при применении в качестве неоадъювантной химиотерапии у больных с операбельной формой рака молочной железы [18]. Степень циторедукции по данным объема остаточного заболевания в молочной железе и лимфатических узлах была сходной для обоих вариантов индукционного лечения [19]. Важно отметить, что ни один из вариантов лечения не приводил к кардиотоксическому эффекту, а главные побочные эффекты носили транзиторный характер и с ними можно было легко справиться. Для определения того, приведет ли использование данной схемы «неперекрестной в плане устойчивости» химиотерапии к дальнейшему снижению риска рецидивирования, требуются длительные сроки наблюдения за больными [18].
ОПЫТ, ПОЛУЧЕННЫЙ ВО ФРАНЦИИ: РАНДОМИЗИРОВАННОЕ ИСПЫТАНИЕ ПО СРАВНЕНИЮ КОМБИНАЦИИ ДОКСОРУБИЦИН/ ТАКСОЛ (ПАКЛИТАКСЕЛ) ДЛЯ ИНЪЕКЦИЙ (ПО ФАЗЕ II) ДЛЯ НЕОАДЪЮВАНТНОЙ ТЕРАПИИ ЛОКОРЕГИОНАЛЬНОЙ ФОРМЫ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Многоцентровое рандомизированное испытание, проведенное во Франции, было посвящено сравнению неоадъювантного применения комбинации доксорубицин/циклофосфамид (АС) с комбинацией доксорубицин/Таксол (АТ) у 247 больных с ранее не леченым локорегиональным раком молочной железы. Соображения, на которых было основано настоящее испытание, относятся к трем категориям [17]. Во-первых, результаты национального хирургического адъювантного проекта по раку молочной железы (NSABP) по протоколу В-18 показали, что предоперационное использование схемы АС уменьшает размер опухоли в большинстве случаев и снижает частоту позитивных лимфатических узлов, что позволяет выполнять более консервативные хирургические процедуры [20]. Во-вторых, при использовании схемы АТ при метастатической форме заболевания отмечена высокая активность, включая полные ремиссии [13-15]. Наконец, отсутствие перекрестной устойчивости между Таксолом и антрациклинами говорит в пользу целесообразности их использования в комбинации в таком контексте [21]. Главным конечным критерием в данном испытании были полные ремиссии с подтверждением, полученным патологом; вторичные критерии включали общий процент ремиссий, выживание без признаков заболевания и общую выживаемость [17]. Схема испытания приведена на Рисунке 2.
Рис. 2. Схема испытания [17].
В марте 1998 г. независимая группа выполнила заранее запланированный промежуточный анализ первых 120 пригодных для оценки больных (40 больных в группе АС и 80 больных в группе АТ). Правила раннего прекращения использования той или иной схемы лечения требовали, чтобы при наличии трех или менее подтвержденных патологически полных ремиссий (7,5% или менее) в группе АС и семи или менее (9% и менее) в группе АТ набор больных в соответствующую группу был прекращен. На указанный момент в группе АС наблюдалось две полные ремиссии, подтвержденные данными патологического исследования, а в группе больных, получавших схему АТ, таких ремиссий было 11. Соответственно, дальнейшее включение больных в группу АС было прекращено, а в группу АТ продолжено. Всего в испытание было включено 247 больных; 67 из них были рандомизированы на получение схемы АС, а 180 на получение схемы АТ. Группы были хорошо сбалансированы по таким критериям, как возраст, распространенность заболевания, статус в отношении менопаузы и статус в отношении гормонорецепторов [17].
Полные ремиссии, подтвержденные данными гистологического исследования, отмечались у 10% больных в группе АС, по сравнению с 16% в группе АТ (Таблица 7) [17]. Общий процент ремиссий составлял 66% для группы АС и 83% для группы АТ, причем процент клинически полных ремиссий составлял 9% и 14%, соответственно. Проведение неоадъювантной химиотерапии позволило ограничиться орган-сберегающей хирургической операцией у 45% больных, получавших лечение схемой АС, и у 56% больных из группы, получавшей лечение схемой АТ.
Таблица 7. Эффективность схемы АС по сравнению со схемой АТ при локорегиональной форме рака молочной железы
Полная ремиссия, подтвержденная гистологически
Клиническая полная ремиссия
Проведено консервативное хирургическое лечение
АС=доксорубицин/циклофосфамид; АТ=доксорубицин/Таксол.
Проводилось тщательное мониторирование кардиотоксичности. Фракция выброса левого желудочка (ФВЛЖ) определялась исходно, после второго курса химиотерапии, а также на момент завершения испытания. Аномальные значения были отмечены у 5 и 8% больных в группах АС и АТ, соответственно. У одной больной в группе АС развилась застойная сердечная недостаточность [17].
В соответствии с данными, полученными исследователями, комбинированная химиотерапия на схеме полусинтетический Таксол (паклитаксел) для инъекций/доксорубицин является высокоэффективной формой лечения в предоперационном периоде при раке молочной железы. Общий процент ремиссий на этой схеме составил 83%, включая подтвержденные патологически полные ремиссии у 16% больных. Эти результаты являются показанием для дальнейших исследований этого комбинированного режима в контексте неоадъювантной химиотерапии, и авторы заявляют, что схема АТ будет стандартным вариантом лечения в их будущем испытании [22].
Комментарии д-ра А.У. Буздара
Определение роли полусинтетического Таксола (паклитаксел) для инъекций при неоадъювантной терапии
Результаты двух описанных выше испытаний говорят об активности Таксола при неоадъювантном лечении рака молочной железы. В исследованнии, проведенном Pouillart и соавт., комбинация доксорубицина и Таксола продемонстрировала более высокую активность по сравнению с комбинацией доксорубицин/циклофосфамид с точки зрения процента клинических ремиссий, ремиссий, подтвержденных данными патологического исследования, и возможности орган-сберегающего хирургического лечения [17]. Исследование MDACC показало, что Таксол, применяемый в форме монотерапии, обладает клинической активностью, сходной с активностью схемы FAC, которая является золотым стандартом в нашем центре [23]. Эти исследования позволяют предположить, что схема попеременного лечения препаратами, не дающими перекрестной резистентности, может улучшить конечный результат по сравнению с непрерывным использованием одной формы лечения [10]. Анализ ранних испытаний по раку молочной железы показал, что непрерывное использование одной и той же терапевтической схемы после выполнения нескольких циклов лечения не дает дальнейшего снижения риска рецидивирования и не улучшает выживаемость больных [24].
В крупномасштабном исследовании Интергруппы проводилась оценка преимуществ схем лечения препаратами, не дающими перекрестной резистентности, за счет сравнения эффективности применения схемы АС в адъювантном режиме с последовательным применением Таксола в дозе 175 мг/м 2 или без Таксола. Предварительный анализ указывает на значительные преимущества в группе, получавшей лечение схемой АС+Таксол, по сравнению с группой, получавшей лечение только схемой АС, в отношении таких критериев, как выживание без признаков заболевания и общая выживаемость (P=0,0077 и P=0,039, соответственно). Обычные токсические явления (степени 3 и выше) у больных, получавших лечение Таксолом, включали транзиторную миелосупрессию у 21% больных, нейропатию у 5%, болевые эффекты у 5% и гипергликемию у 5% больных. Кардиотоксические явления в период после химиотерапии отмечались у 6% больных, однако не давали достоверной корреляции с дозами доксорубицина и применением (или отсутствием применения) Таксола [25]. Было высказано предположение, что преимущества в группе, получавшей лечение Таксолом в рамках данного испытания, были связаны с более длительным курсом лечения, а не обусловлены специфически самой схемой лечения. Однако, в испытании MDACC обе группы лечения получили восемь циклов химиотерапии с аналогичной эффективностью, что четко демонстрирует активность Таксола в данных условиях [23].
Оптимальная доза и график применения Таксола
Таксол применялся в различных дозах и по различным графикам введения при лечении рака молочной железы. Наш выбор дозы, составлявшей 250 мг/м 2 , вводившейся путем 3-часового внутривенного вливания, основан на результатах испытания по Фазе II в MDACC, когда было показано, что Таксол, применяемый в форме монотерапии и вводимый таким образом, обеспечивает высокий процент ремиссий. Для практических целей Таксол в дозе 175 мг/м 2 может быть удобным вариантом [23]. Доза, составлявшая 175 мг/м 2 , применявшаяся в исследовании Интергруппы, дала впечатляющие результаты, а данные, полученные в рамках недавнего испытания у больных с метастатической формой рака молочной железы в группе CALGB (исследование CALGB 9342), показывают, что более высокие дозы полусинтетического Таксола (паклитаксел) для инъекций не обязательно улучшают ответ на лечение или выживаемость при метастатической форме рака молочной железы [26].
Следствия в отношении лечения операбельной формы рака молочной железы
В прошлом высказывалось опасение, что неоадъювантная химиотерапия может задерживать заживление раны после хирургической операции, увеличивать время восстановления или вызывать какие-то другие послеоперационные осложнения. Эти вопросы были подвергнуты анализу MDACC, однако не было обнаружено ни какого-либо повышения частоты болезненных эффектов, ни каких-либо нарушающих воздействий на последующую терапию. Главное преимущество неоадъювантной формы лечения связано с возможностью оценить эффект терапии на интактную опухоль. Ответ на неоадъювантную терапию дает важную прогностическую информацию уже на ранних стадиях курса лечения. Если, например, стадия опухоли у больной уменьшается со стадии III до стадии I, то более вероятен благоприятный конечный результат. Однако, больные, которые не реагируют на неоадъювантную химиотерапию, могут выиграть за счет применения переменных схем лечения или экспериментальных подходов [23].
Исследование MDACC и убедительные результаты, полученные в испытании Интергруппы, показывают, что добавление более активных агентов, например Таксола, к стандартным схемам лечения, может заметно снизить риск рецидива заболевания. На основании этих результатов MDACC принял схему FAC+Таксол в качестве нового стандарта для адъювантной и неоадъювантной терапии при лечении операбельных форм рака молочной железы. Я полагаю, что более длительные сроки наблюдения продемонстрируют лучшие результаты с использованием данного терапевтического подхода, а именно, речь идет о последовательном лечении, когда за применением Таксола следует схема FAC или после применения схемы АС следует применение Таксола [23].
Перспективы
В следующем испытании, проводимом в MDACC, будет сравниваться эффективность четырех циклов применения Таксола (контроль) с последующим применением схемы FAC и применение Таксола раз в неделю с последующим применением схемы FAC [23]. Более ранние данные указывают на то, что быстрое еженедельное вливание Таксола лучше переносится и дает больший противоопухолевый эффект, чем схема лечения, когда данный препарат применяют с интервалом в три недели. В контрольной группе ведущегося в настоящее время исследования мы снизили дозу Таксола до 225 мг/м 2 . Результаты этого испытания дополнительно определят роль Таксола при неоадъювантном лечении рака молочной железы и предоставят новую информацию в отношении преимуществ плотнодозовой терапии.
источник