Рак молочной железы (РМЖ) — самое распространённое онкологическое заболевание среди женщин. Учёные всего мира стараются найти новые, более эффективные лекарства для лечения злокачественных опухолей груди. Больших успехов в этом достигли израильские специалисты.
Благодаря изучению генетики рака молочной железы открываются новые горизонты и возможности в области таргетной терапии, то есть применения лекарств, прицельно воздействующих исключительно только на клетки рака, не затрагивая здоровые ткани. В целом, на сегодняшний день учёные используют два направления в поиске новых лекарств от рака груди:
- Изобретение совершенно новых лекарств — это длительный и сложный путь, но он позволяет разработать принципиально новые подходы к терапии рака молочной железы.
- Применение для лечения РМЖ уже существующих медицинских препаратов, которые были изначально созданы и с успехом использовались для терапии других видов онкологических опухолей.
Перечень препаратов для лечения различных видов рака молочной железы постоянно пополняется. Для этого, помимо поиска принципиально новых лекарств, учёные ведут активные исследования в области применения уже имеющихся лекарственных средств, которые хорошо себя зарекомендовали при лечении других видов рака. На данный момент особого внимания заслуживают следующие препараты:
Изначально препарат «Кейтруда» был создан для терапии метастатической неоперабельной меланомы. В ходе клинических испытаний препарат показал ошеломляющие результаты, значительно повысив общую выживаемость пациентов, страдающих продвинутой стадией меланомы.
Одним из действий «Кейтруды» является блокировка белка PD-1, который находится на поверхности иммунных клеток Т-лимфоцитов, предназначенных для уничтожения любого агрессивного агента в теле человека. Многие злокачественные опухоли продуцируют протеин PD-L1 или PD-L2, который связывается с белком PD-1 и тем самым деактивирует Т-лимфоциты. Такой механизм позволяет раковым клеткам избежать нападения Т-лимфоцитов. При блокировке белка PD-1 не происходит связи с протеином PD-L1 или PD-L2, что позволяет иммунной системе свободно обнаруживать и атаковать опухоль.
Данное действие «Кейтруды» учёные надеются использоваться для лечения РМЖ у женщин с позитивным PD-L1. Пока что в данном направлении ведутся клинические испытания, в которых принимают участие медицинские центры Израиля.
Данный препарат представляет собой моноклональные антитела, которые подавляют VEGF — фактор роста эндотелия сосудов, главным образом отвечающий за образование кровеносных сосудов опухоли. Другими словами, препарат блокирует рост сосудов злокачественных образований, что ведёт к критическому снижению питания опухоли и, как следствие, её гибели.
По результатам клинического исследования, под названием TANIA, в котором участвовали женщины с HER2-негативным рецидивирующим или метастатическим раком молочной железы, было выявлено, что комбинация «Авастина» с химиотерапией приводит к стабилизации заболевания в 48,9 % случаев, против 33,5 % при лечении только цитостатическими средствами. В исследовании IMELDA принимали участие женщины с HER2-негативным метастатическим РМЖ, ранее не получавшие химиотерапию. Согласно результатам этого исследования, у пациенток, получавших «Авастин» в комбинации с «Капецитабином», показатели общей выживаемости и снижение случаев прогрессирования заболевания были гораздо лучше, чем у тех, кому давали только «Авастин». Эти исследования показали, что «Авастин» следует использовать в комбинации с другими противоопухолевыми препаратами. Эта схема терапии уже активно применяется в клиниках Израиля.
Новый таргетный препарат, который блокирует молекулы CDK 4/6, отвечающие за рост злокачественных клеток. Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) в феврале 2015 года одобрило использование «Палбоциклиба» в комплексе с «Летрозолом» (эстроген-блокатор) в лечении эстрогенпозитивного (ER+) и HER2-негативного (HER2-) метастатического РМЖ (гормонозависимая опухоль, клетки которой на своей поверхности не имеют HER2-рецепторов) у женщин, ранее не проходивших системного лечения. Одобрение было дано на основе результатов исследования PALOMA-1, показавшего высокую эффективность подобной комбинации при РМЖ ER+/HER2. Данная схема лечения сегодня применяется в США, Израиле и развитых странах Европы.
Также компанией «Pfizer» было проведено исследование PALOMA-2 и PALOMA-3. По результатам исследования PALOMA-2, у женщин, страдающих раком молочной железы ER+/HER2 и уже имевших рецидив после гормональной терапии, применение «Летрозола» в сочетании с «Палбоциклибом» значительно увеличило срок ремиссии. Исследование PALOMA-3 показало значительное увеличение срока до начала прогрессии заболевания у женщин с РМЖ ER+/HER2, имевших ранее рецидив после или во время первичной гормонотерапии, при использовании «Палбоциклиба» в комбинации с «Фазлодекс», нежели при использовании только «Фазлодекса». Исследования в данном направлении продолжаются.
Это стероидный антиэстрогенный препарат, на данный момент применяемый для лечения гормнозависимого (ER+) рака молочной железы. Он уже проходил исследования PALOMA-3, описанное выше, и показал хорошие результаты в комбинации с препаратом «Палбоциклиб». Также в Национальном институте рака (NCI) США было проведено исследование сочетания «Фазлодекса» и «Бортезомиба», используемого для лечения множественной меланомы и метастатического гормонозависимого рака молочной железы. По результатам клинического исследования, было выявлено значительное повышение выживаемости пациенток с ER+ метастатического РМЖ при использовании данной комбинации, нежели при лечении только «Фазлодексом». Исследования в этой области продолжаются.
Это экспериментальный препарат, который пока что находится на стадии разработки и проходит испытание на мышах. Он предназначен для лечения HER2-положительного рака молочной железы. HER2-TDB представляет собой неспецифические антитела, которые должны активировать Т-лимфоциты против опухоли. Результаты последних исследований вселяют большую надежду на этот препарат.
источник
Опубликовано в журнале:
В мире лекарств »» №4 2000 НА ФАРМРЫНКЕ РОССИИ ПРОФЕССОР Н.Б. ДРЕМОВА,
ЗАВЕДУЮЩАЯ КАФЕДРОЙ ЭКОНОМИКИ И УПРАВЛЕНИЯ ЗДРАВООХРАНЕНИЕМ КУРСКОГО МЕДИЦИНСКОГО УНИВЕРСИТЕТА, АКАДЕМИК РАЕН
Т.М. ЛИТВИНОВА,
АССИСТЕНТ КАФЕДРЫ
Несмотря на значительные достижения последней четверти века в понимании этиологии и клиники рака молочной железы, а также кардинальные изменения в подходах к лечению, проблема борьбы с ним продолжает оставаться серьезной. Основные научные исследования направлены на изыскание путей снижения смертности при данной патологии с помощью ранней диагностики и адекватного локального лечения, в том числе химио- и гормонотерапии. Для их реализации, с учетом индивидуальных особенностей как течения заболевания, так и организма больной, требуется широкий ассортимент противоопухолевых средств.
В связи с этим представляет интерес анализ целевого сегмента фармацевтического рынка России, в частности лекарственных средств, предназначенных для лечения рака молочной железы, в 1997-2000 годах. Исходные данные получены в ходе контент-анализа информационных источников: «Государственный реестр лекарственных средств», «Регистр лекарственных средств России», «Справочник Видаль. Лекарственные препараты в России». Отбор лекарственных средств (ЛС) базировался на предварительном изучении основных методов современной лекарственной терапии этого заболевания, а также на указаниях в инструкциях к ЛС.
За период исследования в РФ зарегистрировано 180 торговых названий ЛС, систематизация которых проведена в соответствии с Международными непатентованными наименованиями (МНН) и анатомо-терапевтическо-химической системой классификации (АТС), принятой и рекомендованной ВОЗ (1995). Общий ассортимент лекарственных средств для лечения рака молочной железы можно систематизировать в 16 групп (см. таблицу). Наибольшее место (19,4%) в структуре ассортимента занимают алкалоиды растительного происхождения; антагонисты гормонов и родственные им средства — 17,2%; антиметаболиты — 14,4%. Доли остальных групп составляют менее 10%, в том числе 8,3% в структуре приходится на цитотоксичные антибиотики; прогестагены, алкилирующие средства и фитопрепараты занимают соответственно 7,2%, 6,1% и 5,6%.
ПРЕДЛОЖЕНИЯ ЛС, ПРИМЕНЯЕМЫХ ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, НА РОССИЙСКОМ ФАРМАЦЕВТИЧЕСКОМ РЫНКЕ В 1997-2000 ГОДАХ
| Международное непатентованное наименование | Торговые названия (синонимы)1 | Кол-во предлож. | Кол-во лек. форм | Страна производитель2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. Алкилирующие средства | Melphalan | Мелфалан Алкеран | 1 | 1 | Великобритания | Streptozocin | Стрептозоцин Занозар | 1 | 1 | США | Thiotepa | Тиотепа | 2 | 1 | Великобритания | Россия Chlorambucil | Хлорамбуцил | 2 | 2 | Великобритания | Россия Cyclophosphamide | Циклофосфамид | 5 | 2 | Мексика | Израиль Россия США Германия 2. Антиметаболиты | Gemcitabine | Гемцитабин Гемзар | 1 | 1 | Франция | Methotrexate | Метотрексат | 15 | 2 | Австралия (2) | Австрия (2) Бельгия Германия Израиль Индия Кипр Мексика Нидерланды Россия США Финляндия Франция Чехия Tegafur | Тегафур | 3 | 2 | Израиль | Латвия Россия Fluorouracil | Флуороурацил | 7 | 7 | Австралия (2) | Австрия Бельгия Израиль Мексика Россия Швейцария 3. Алкалоиды растительного происхождения и другие природные вещества | | ||||||||||||
Примечания:
1. Торговые названия препаратов приведены в алфавитном порядке (в скобках указано количество препаратов с одинаковым названием)
2. Страны-производители приведены в алфавитном порядке (в скобках указано количество фирм-производителей)
Оставшиеся менее 22% в структуре ассортимента составляют следующие группы препаратов: андрогены — 4,4%, другие противоопухолевые средства — 4,0%, гормоны и родственные средства — 3,3%, гормональные противозачаточные средства системного действия — 2,8%. Иммуностимуляторы и анаболические стероидные средства в структуре занимают по 1,6%; на долю противоопухолевых средств и эстрогенов приходится 1,1% и 0,6% соответственно. Субстанции карубицина (противоопухолевый антибиотик) и фотретамина (фосфорорганическое соединение) не имеют пока группы АТС, но отнесены к противоопухолевым средствам. Такие ЛС, как пентоксил, леакадин и ликопид, также пока не отнесены в определенные группы.
В общем ассортименте доминируют монопрепараты — 92,2% (166), на основе 41 действующего вещества. Остальные ЛС, в числе которых препараты из растений и бактерий, относятся к комбинированным, так как содержат комплекс веществ. Их доля в ассортименте составляет 7,8% — всего 14 препаратов. С расширением фармацевтического рынка России в последнее десятилетие процесс обновления ассортимента лекарств для лечения рака молочной железы значительно ускорился. Анализ сроков регистрации препаратов в России показал, что до 1992 г. ассортимент составлял всего 40 наименований препаратов. К 2000 г. он увеличился в 4,5 раза, причем среди отдельных групп с обновлением от 10% (андрогены; индекс обновления 0,1 — отношение новых препаратов, зарегистрированных в последние 3 года, к общему числу) до 100% (другие противоопухолевые средства). По всему ассортименту индекс обновления равен 0,5, что свидетельствует о прогрессивных тенденциях в лечении рака молочной железы и возможной доступности для российских женщин назначения им современных эффективных лекарств.
Большую часть (57,8%) в структуре занимают лекарственные формы для инъекций (водные, спиртовые и масляные растворы), что обусловлено спецификой лечения на этапе химио- и гормонотерапии. Примерно третья часть (34,4%) приходится на твердые лекарственные формы. Жидкие формы для внутреннего применения и дозированные аэрозоли представлены в общей структуре ассортимента незначительно — 6,7% и 1,1% соответственно.
Доминирующая доля в ассортименте лекарственных средств для лечения рака молочной железы приходится на зарубежные препараты — 85,0% (153). В то же время рейтинг 27 стран-производителей ЛС для лечения рака молочной железы и зарегистрировавших их в России показал, что первое место по числу препаратов на рынке занимает Россия — 27 препаратов (15,0%). Германия и Индия предлагают меньший ассортимент — 20 (11,0%) и 15 (8,3%) препаратов соответственно. Остальные страны-производители зарегистрировали на российском фармацевтическом рынке от 1 до 11 препаратов.
Особенности ассортимента отдельных групп
Алкилирующие средства применяются для лечения рака молочной железы главным образом в качестве компонента комбинированной химиотерапии. Их действие основано на переносе алкильных групп на различные компоненты клетки, что сопровождается цитотоксическими эффектами. Наиболее важным действием является алкилирование ДНК, которое приводит к гибели пораженной клетки. Побочным эффектом данной группы ЛС являются угнетение функции костного мозга и сопутствующие лейко- и тромбоцитопения, которые исчезают при прекращении приема препаратов.
На российском фармацевтическом рынке эта группа ЛС представлена 11 препаратами пяти действующих веществ, объединенных в три подгруппы: аналоги азотистого иприта, этиленамина и нитрозомочевины. Подгруппа аналогов азотистого иприта включает 8 ЛС, 5 из которых содержат одно действующее вещество — циклофосфамид (ледоксина, циклофосфамид-тева, циклофосфан, цитоксан, эндоксан). Лейкеран и хлор-бутил разработаны на основе хлорамбуцила. Алкеран содержит мелфалан.
Подгруппа этиленаминов представлена тиофосфамидом и тиотепа-тиоплексом. Единственный природный сахаросодержащий препарат нитрозомочевины — занозар — интересен тем, что обладает минимальной токсичностью в отношении костного мозга. Регистрация алкилирующих средств осуществлялась с 1972 г., причем вначале это были два российских препарата: циклофосфан и хлорбутил, в последние годы зарегистрирован только эндоксан производства Германии. Значительную долю ассортимента этой группы представляют препараты зарубежного производства (82%). Алкеран, занозар, тиотепа-тиоплекс и тиофосфамид выпускаются только в форме порошка для инъекций, остальные 7 препаратов применяются в таблетках, драже или в виде раствора для инъекций.
2. Антиметаболиты
Метаболизм опухолевых клеток имеет некоторые отличия по сравнению с нормальными клетками, поэтому пораженные клетки более восприимчивы к некоторым антиметаболитам и структурным аналогам. Для многих ЛС это был целенаправленный синтез на основе знаний о клеточных процессах, хотя некоторые из них первоначально были открыты как антибиотики.
Антиметаболиты представлены аналогами фолиевой кислоты и пиримидина. В группе 26 препаратов четырех действующих веществ, причем 15 из них (58%) — это синонимы метотрексата, являющегося антагонистом фолиевой кислоты. Синонимов флуороурацила (подгруппа аналогов пиримидина) всего 7; 3 — у действующего вещества тегафур. Гемцитабин производится под одним торговым названием. На отечественном рынке эти противоопухолевые средства представляют 16 стран-производителей, среди которых и Россия. Практически все ЛС этой группы выпускаются в форме раствора для инъекций и в таблетках, за исключением флуороурацила, который применяется в стационарных условиях только парентерально.
3. Алкалоиды растительного происхождения и другие природные вещества
Препараты этой группы вызывают остановку митотического цикла пораженных клеток. Однако нейротоксический эффект, как побочное действие препаратов, ограничивает их применение только короткими курсами.
Эта группа ЛС — самая значительная по количеству препаратов. В ней 35 торговых названий, содержащих семь действующих веществ. Анализ ассортимента согласно АТС-классификации показал, что в терапии рака молочной железы используют следующие основные группы: алкалоиды барвинка и их аналоги, производные подофиллотоксина и таксаны. Наибольший удельный вес занимают алкалоиды барвинка и его аналоги — 51,4% (винбластин, винкристин, винорельбин, виндезим); 31,5% составляют производные подофиллотоксина (этопозид); остальные 17,1 % приходятся на таксаны (паклитаксел, доцетаксел). В подгруппе алкалоидов барвинка зарегистрировано 18 ЛС, среди которых 10 являются синонимами винкристина, 6 — винбластина; винорельбин и виндезим представлены одним торговым названием. На основе производных подофиллотоксина разработаны 11 препаратов, содержащих одно действующее вещество. Такцаны представлены 6 препаратами, основу которых составляют два действующих вещества. Значительная доля ассортимента этой группы приходится на препараты зарубежных стран (71,5%), среди которых Франция и Индия зарегистрировали по 6 и 5 ЛС соответственно; Италия, Бельгия, Австралия, Венгрия, Израиль, США, Мексика — по 2. Группа значительно обновлена в последние годы, индекс обновления 0,6. Все препараты выпускаются только в форме порошка для инъекций.
4. Цитотоксичные антибиотики и родственные субстанции
Скрининг продуктов жизнедеятельности микроорганизмов привел к открытию нескольких ингибиторов роста, которые оказались эффективными для химиотерапии рака молочной железы. Цитотоксичные антибиотики связываются с ДНК посредством встраивания между специфическими основаниями и блокируют синтез новых ДНК, влияя на репликацию. К наиболее эффективным из них относятся антрациклиновые антибиотики, выделенные из почвенного гриба. ЛС данной группы применяются в основном в комбинации с другими препаратами, например, с производными нитрозомочевины и циклофосфамидом, с которыми они действуют как синергисты, вызывая более продолжительную ремиссию, чем при монотерапии. При таком методе лечения уменьшаются некоторые токсические эффекты, которые возможны при назначении больших доз доксорубицина.
На российском фармацевтическом рынке антрациклиновые антибиотики представлены 15 препаратами трех действующих веществ. Это производные доксорубицина (10 наименований ЛС); 3 препарата являются синонимами митоксантрона; эпирубицин представлен 2 ЛС. В основном все препараты зарубежного производства, кроме доксорубицина гидрохлорида, зарегистрированного Россией в 1988 г. За последние 6 лет исследуемая группа обновлена на 70%. Лекарственной формой антрациклинов являются растворы для внутривенного введения.
5. Другие противоопухолевые средства
Среди других противоопухолевых средств в классификации АТС выделяют только одну подгруппу, применяемую для лечения рака молочной железы. В нее вошли препараты карбоплатина, относящегося к соединениям платины. Активным действием препаратов обладает неорганический металлосодержащий комплекс, который, по-видимому, является синергистом других противоопухолевых средств.
Карбоплатин зарегистрирован под 7 торговыми названиями препаратов зарубежного производства, причем первой была Австралия в 1995 году (карбоплатин). Препарат чешского производства циклоплатин предлагается с 1998 года. Все ЛС выпускаются в порошках или растворе для инъекций.
6. Гормоны и родственные средства
В настоящее время известно, что нарушение гормонального фона у женщин может приводить к развитию рака молочной железы. Рак, возникший в этой ткани, может быть подавлен или стимулирован соответствующим изменением гормонального баланса. Поэтому важной является разработка паллиативной терапии половыми гормонами.
На фармацевтическом рынке России предлагается 4 препарата двух действующих веществ, относящихся к эстрогенам (фосфэстрол и этинилэстрадиол), и 2 ЛС, являющихся синонимами гозерелина, отнесенных к группе аналогов гонадотропных рилизинг-гормонов. Эстрогены, применяемые для лечения рака молочной железы, появились в арсенале онкологов в семидесятых годах, в основном это отечественные препараты. Великобритания в 1993 г. и Индонезия в 1995 г. зарегистрировали на российском рынке препарат золадекс — синтетический пептидный аналог естественного гонадотропин-рилизинг гормона. Индекс обновления изучаемой группы незначителен и составляет всего 0,2.
7. Антагонисты гормонов и родственные средства
Антагонисты гормонов систематизированы в 2 подгруппы: антиэстрогены и ингибиторы ферментов. Эта группа по количеству достаточно велика: 31 препарат на основе пяти действующих веществ. К антиэстрогенам относятся 26 ЛС, содержащих 2 действующих вещества (тамоксифен и торемифен), причем 25 являются синонимами тамоксифена. Долгое время «золотым стандартом» гормонотерапии рака молочной железы, особенно у женщин старше 45 лет, был антиэстроген тамоксифен, конкурирующий с эндогенными эстрогенами за связывание с рецепторами эстрогена. Поиски более эффективных средств привели к созданию ряда новых препаратов (торимифен). Наибольший интерес представляет группа ингибиторов ферментов (аромаз). После наступления менопаузы эстрогены образуются в основном за счет периферической ароматизации андрогенов. Аромаза, присутствующая в жировой ткани печени, молочной железе и ее опухолевой ткани, превращает андрогены в эстрогены. Ингибиторы аромазы тормозят этот процесс.
Первым нестероидным ингибитором аромазы стал аминоглютетемид, позднее были созданы анастрозол и летрозол. По количеству ЛС подгруппа незначительна: 5 торговых названий трех действующих веществ. В целом препараты группы антагонистов гормонов появились в арсенале врачей-маммологов с 1992 года, причем 96,8% всех предложений на фармацевтическом рынке составляют препараты зарубежного производства. Выпускаются они только в виде таблетированных лекарственных форм.
8. Иммуностимуляторы
Механизм действия иммуномодулирующих средств на течение рака молочной железы до конца не изучен. Целью всех научных исследований, ведущихся в этой области, является создание препаратов, усиливающих иммунный ответ у пациенток. Основные показания к применению таких средств — лечение иммунодефицитных расстройств и рака. При раке молочной железы применяются ЛС двух видов: цитокины и другие иммуностимуляторы. Группа цитокинов представлена интерфероном b (ребиф) и филграстимом (нейпоген). Оба препарата зарубежного производства, зарегистрированы соответственно в 1997 и в 1994 году. К иммуностимуляторам, использующимся в терапии рака молочной железы, относится отечественный препарат вилозен, появившийся на рынке в 1987 году. Все ЛС этой группы выпускаются в форме порошка для инъекций.
9-12. Половые гормоны и модуляторы функции половых органов
Одним из традиционных методов, сохранившим свое значение в терапии рака молочной железы, является гормонотерапия. Механизм противоопухолевого действия гормонов сложен, так как иногда диаметрально противоположные агенты дают одинаковый результат. Полагают, что гормональные агенты связываются со специфическими рецепторами на поверхности клеток, в результате чего тормозится продукция или высвобождение факторов, способствующих росту опухоли. Успех гормонотерапии зависит от множества прогностических факторов, среди которых особенно важен рецепторный статус опухоли. В опухолевых клетках выявлены высокоспецифические рецепторные белки для эстрогенов, прогестерона и андрогенов, Согласно АТС — классификации в группу половых гормонов, используемых для лечения рака молочной железы, входят: гормональные противозачаточные средства системного действия (мегестрол, норэтистерон), андрогены (тестостерон), эстрогены (синестрол) и прогестагены (гестонорона капроат, гидроксипрогестерона капроат, медроксипрогестерон). В подгруппе прогестагенов 13 препаратов трех действующих веществ. К сожалению, только один из них — оксипрогестерона капроат — отечественного производства. Остальные 12 (92%) — зарубежных производителей. По 3 препарата зарегистрировали Германия и Индонезия; по 2 — Бельгия и Италия; Мексика и Великобритания — по 1. Подгруппа обновлена незначительно — индекс 0,3. Действующее вещество — тестостерон — зарегистрирован в России в 8 торговых названиях, причем 37,5% приходится на отечественных производителей. По 2 препарата предлагают Индия и Нидерланды, один препарат — Польша. В 70-80-х гг. на российском фармацевтическом рынке появились андрогены. Гормональные противозачаточные средства системного действия стали применяться в лечении рака молочной железы с 1993 г. Эта подгруппа незначительна по количеству — 5 торговых названии, содержащих два действующих вещества. Мегестрол выпускается под названием «мегейс» в США и Германии. Эти ЛС предназначены в основном ддя приема внутрь в таблетках; мегейс (производства США) выпускается в виде суспензии для внутреннего применения.
Эстрогены разработаны на основе гексестрола, выпускающегося в России под названием синестрол. Препарат зарегистрирован в 1970 году и рекомендуется к применению в форме таблеток и масляного раствора для инъекций.
13. Анаболические стероидные средства
Анаболические стероидные средства применяют в комбинации с другими ЛС для химиотерапии рака молочной железы у женщин в пременопаузном периоде. В эту группу входят производные эстрена-нандролона — ретаболил, декадураболин, феноболин. Эти монопрепараты, зарегистрированные в период с 1971 по 1980 год, выпускаются в виде масляных растворов для инъекций.
14. Фитопрепараты
По современным представлениям эффективность фитотерапевтических средств, используемых для лечения рака молочной железы, зависит от содержания действующих веществ (аминокислоты, микроэлементы, птерины, свободные фенолы, полисахариды, стерины, лигнин).
Ассортимент фитопрепаратов в настоящее время составляет 10 торговых названий, причем четыре ЛС содержат комплекс веществ из эхинацеи (иммунал, эхинабене, эхинацея Гексал, эхинацея ликвидум). Препараты бефунгин и березовый гриб чага получены из грибных наростов, образуемых на березах фитогенным паразитом. Французский препарат эндотелон разработан на основе экстракта виноградных косточек. Действие препаратов, в состав которых входит эхинацея, обусловлено компонентами полисахаридной природы. Эти ЛС способствуют повышению активности неспецифических факторов защиты организма и оказывают иммуностимулирующее действие. Они предлагаются зарубежными производителями с 1993 года. Выпускаются в виде капель и сока — раствора для внутреннего применения.
Эндотелон — единственный фитопрепарат, выпускаемый в таблетках. Фармакологическое действие определяется процианидоловыми олигомерами, которые оказывают защитное действие на эндотелий сосудов. Препарат показан при симптоматических нарушениях, обусловленных лимфатической недостаточностью после проведенной химиотерапии, зарегистрирован в России в 1995 году.
15. Противоопухолевые средства
Указание на фармакотерапевтическое действие противоопухолевых средств субстанций карубицина и фотретамина послужило аргументом для их объединения в группу. Карубицин (карминомицина гидрохлорид) представляет собой противоопухолевый антибиотик, производимый в России с 1979 года в форме порошка для инъекций. Фотрин содержит действующее вещество фотретамин, которое является синтетическим фосфорорганическим соединением, выпускается отечественным производителем также с 1979 года в виде порошка для инъекций.
16. Препараты, не отнесенные к группам
Сюда включены четыре препарата: пентоксил, ликопид и леакадин (2), который выпускается двумя латвийскими производителями. По химическому строению пентоксил является производным пиримидина. Его фармакологическое действие заключается в стимуляции метаболических процессов, в том числе лейкопоэза, поэтому он используется при состояниях, сопровождающихся лейкопенией, которая сопутствует проводимой химиотерапии. Выпускается в России с 1972 года в форме таблеток и порошка для внутреннего применения. Препарат леакадин — иммуномодулирующее средство, назначается в комбинации с другими противоопухолевыми препаратами при химиотерапии рака молочной железы. На фармацевтическом рынке зарегистрирован латвийскими производителями в 1992 г. Выпускается в таблетках и форме лиофильного порошка для инъекций.
Ликопид представляет собой структурный фрагмент клеточной стенки бактерий. Оказывает иммунокорригирующее и противовоспалительное действие. Выпускается отечественным производителем в таблетках с 1995 года.
Таким образом, фармацевтический рынок противоопухолевых средств, применяемых для лечения рака молочной железы, характеризуется разнообразием препаратов отечественного и импортного производства. Их ассортимент позволяет врачам-онкологам подбирать больным индивидуальные схемы и методы лечения. В настоящее время за рубежом ведутся исследования в области поиска альтернативных методов лечения раковых заболеваний. К ним относится стимулирование защитных сил организма за счет применения модификаторов биологических реакций. Среди таких средств выделяется класс противоопухолевых сахаридов. Так, например, в Японии и США проходят клинические испытания b-1,3-связанных глюканов, фруктаны, глюкоманнаны. Специалистами Университета г. Киото (Япония) изучаются проблемы клинического использования систем доставки лекарственного вещества с помощью макромолекулярных носителей при терапевтическом лечении злокачественных опухолей. Ряд противораковых институтов разрабатывает другие соединения с противораковой активностью, клиническое изучение которых планируется в ближайшее время или уже проводится.
В связи с этим можно прогнозировать дальнейшее расширение ассортимента лекарственных средств для лечения рака молочной железы на мировом фармацевтическом рынке, а следовательно, ожидается увеличение целевого сегмента предложений на рынке России.
источник
Способы лечения рака молочной железы зависят от стадии онкопроцесса и наличия вторичных образований.
Лечение рака молочной железы опирается на результаты генетического, иммунологического исследования, изменений в общеклинических и биохимических анализах, а также от наличия сопутствующих заболеваний.
Новые технологии приходят в Россию.
Приглашаем пациентов принять участие в новых методах лечения онкологических заболеваний, а также в клинических испытаниях препаратов на основе Т-клеток (LAK-терапия). Терапия проводится в различных научно-исследовательских онкологических центрах, в зависимости от вида опухоли.
Отзыв о методе министра здравоохранения РФ Скворцовой В.И.
Комментарий о клеточных технологиях главного онколога России, академика Давыдова М.И.
1. Первый этап болезни – удаление опухоли.
2. Вторая стадия – радикальное удаление, зачастую проводится расширенная мастэктомия. Лечение рака молочной железы дополняется лучевой и химиотерапией, возможны к назначению иммунологические и гормональные средства.
В настоящее время основная тенденция на начальных этапах – максимально сохранить нетронутые опухолью ткани. Зачастую лечение рака молочной железы сочетается с проведением радиотерапии, чтобы минимизировать размеры злокачественности во время хирургического лечения.
Их можно разделить на 2 большие группы:
• местного воздействия – облучение, операция,
• системного влияния – химио-, гормоно- и иммунотерапия.
При этом врачи руководствуются преимущественно следующими критериями:
• Маленькие онкоочаги и отсутствие отдаленных метастаз – секторальная резекция железы или мастэктомия с иссечением лимфоузлов, проведение инраоперационной биопсии, по результатам которой обычное удаление заменяют расширенной мастэктомией.
• В случае крупного онкообразования и наличия отдаленных патологий – химиотерапия и другое консервативное лечение рака молочной железы.
РМЖ часто является гормонозависимой опухолью, на рост которой влияют различные железы внутренней секреции. В ходе клинических наблюдений выявилось, что некоторые гормоны, в первую очередь эстрогены, прямо или опосредованно влияют на появление и дальнейшую скорость роста. Поэтому еще недавно самым популярным лечением рака молочной железы была овариоэктомия (удаление яичников), хотя полное излечение при этом наступало лишь у трети женщин.
Впоследствии были более досконально изучены механизмы воздействия гормонов на опухолевую ткань, включая действие по принципу положительной и обратной отрицательной связи. И с начала семидесятых годов прошлого столетия наступил прорыв в лечении рака молочной железы: были созданы и протестированы различные новые лекарственные препараты, обеспечивающие блокирование рецепторов гормонозависимых опухолей (тамоксифен, торемифен) или подавляющие производство эстрогенов (аримидекс, фемара).
Достаточно успешной альтернативой удалению яичников стал препарат госерилин (золадекс), который успешно подавляет образование эстрогенов на строго определенное время. Создавая таким образом состояние медикаментозного климакса и применяя комплексную терапию можно добиться успеха в лечении рака молочной железы. А после завершения терапевтического курса и при прекращении приема золадекса, яичники начинают функционировать снова.
Лечение рака молочной железы препаратом Тамоксифен является наиболее часто используемым лекарством при гормонозависимых раках. Однако у него имеются серьезные побочные эффекты, включая малигнизацию эндометрия и повышение риска возникновения тромбоэмболии.Поэтому в последние годы был предложен целый ряд лекарств, ингибирующих ароматазу, например:
Другие средства – аромазин, фемара. Они особенно показаны после приема тамоксифена в течение 5 последних лет.
Разработки ученых увенчались успехом, найден способ воздействовать на опухоль – это таргетные препараты. Сегодня таргетная терапия является серьезным продвижением в современной онкологии.
Органосохраняющую операцию выполняют в случае размера онкоочага до 2,5 см. Однако в качестве профилактики рецидива возможно иссечение регионарных лимфоузлов. При классической мастэктомии происходит полное удаление всех тканей железы. Установка протеза и пластика груди выполняются или непосредственно во время хирургического вмешательства, или спустя шесть месяцев. Это зависит от общего состояния пациентки и характера операции.
Онкохирурги рекомендуют следующие виды удаления молочной железы:
• иссечение лишь ее сектора – лампэктомия,
• полностью, но без резекции лимфоузлов подмышечной группы,
• с удалением лимфоузлов регионарных – модифицированная радикальная мастэктомия,
• единым блоком с прилежащими к ней мышцами – радикальная мастэктомия (расширенная),
• удаляются все ткани железы за исключением кожи и соска (важно для последующей реконструкции груди).
В лечебных дозах ионизирующее излучение угнетает развитие онкоклеток и вызывает их разрушение. Таким способом можно воздействовать на первичную патологию, и метастазы. Радиооблучение может стать единственным вариантом в качестве самостоятельного метода при неоперабельности новообразования или использоваться с целью минимизации размеров злокачественного процесса перед проведением хирургии.
После мастэктомии облучение ложа опухоли существенно уменьшает вероятность рецидива. В качестве основного метода радиотерапии обычно используется дистанционное облучение. Современные аппараты позволяют минимизировать поражение здоровых тканей, концентрируя свое пагубное воздействие именно в пределах опухолевого очага. Поэтому сегодня крайне редко наблюдаются типичные осложнения, возникающие после завершения курса радиотерапии, включая радиационные ожоги.
Обычно молочный рак имеет свойство метастазировать практически во все органы, включая легкие, кости, печень, брюшную полость и кожные покровы. Лечение отдаленных от материнского новообразования опухолей зависит от следующих факторов:
• размеры метастаз, их количество, локализация,
• степень чувствительности онкоклеток к эстрогенам, прогестерону,
• особенности функционирования яичников (состояние фертильности или климакс).
Наиболее успешно в лечении метастаз РМЖ считаются следующие средства:
Они часто сочетаются с медикаментами, уменьшающими токсичность первых и снижающими вероятность возникновения или выраженность уже существующих побочных эффектов. Например, при добавлении преднизона снижается токсическое воздействие на кроветворную систему и органы пищеварения, однако повышается вероятность появления тромбозов и вторичной инфекции. С целью повышения терапии цитостатиками также могут назначаться предварительные курсы иммуномодуляторами, включая интерфероны, интерлейкины и различные моноклональные антитела.
В случае рецидива показаны гормональные препараты и цитостатики. Если же положительного эффекта не наблюдается, то рекомендуют клеточную биоиммунотерапию или использование препаратов, проходящих клинические испытания.
После хирургического иссечения необходимо встать на учет у онколога и регулярно являться на контрольные осмотры. Они нужны для того, чтобы своевременно заметить возобновление злокачественного роста и предпринять соответствующие меры. Сначала визиты к доктору необходимы каждые 5 месяцев, а по прошествии 5 лет – ежегодно. На фоне лечения тамоксифеном важно ежегодно проходить ПЭТ или МРТ органов малого таза, чтобы своевременно обнаружить раковое перерождение клеток эндометрия. А при употреблении ингибиторов ароматазы – остеоденситометрию (проверку минеральной плотности костей). В случае рецидива или обнаружения МТС назначается курс химио- и лучевой терапии.
Когда дело касается онкобольных, то основным критерием эффективности проводимого лечения является показатель пятилетней выживаемости. Молочный рак имеет показатель чуть более 50%. Однако, перешагнув эту черту, рецидивов в ближайшие годы уже практически дальше не наблюдается.
Продолжительность жизни зависит от таких факторов, как:
• характер и скорость ее роста,
Наиболее неблагоприятным считается прогноз при диффузном типе роста клеток и запущенной форме болезни при наличии отдаленных МТС. В этом случае показатель пятилетней выживаемости практически равен нулю.
Однако при ранней диагностике заболевания и начале своевременного лечения шансы увеличить порог выживаемости значительно возрастают. Так при второй стадии 80% женщин живут более 5, а чаще и 10 лет, а свыше половины из них перешагнут и двадцатилетний рубеж. Вероятность успешного излечения значительно повышается при использовании сразу нескольких видов терапии.
В случае третьей стадии рака 5 и более лет живут 40-60% женщин (зависит от того, подстадия 3А или 3В). Однако и здесь адекватная медицинская помощь способна повысить продолжительность жизни и сделать ее более комфортной.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
На ежегодной 43–й конференции Американского Общества клинической онкологии (ASCO) в Чикаго компания Рош представила самые последние результаты клинических исследований противоопухолевых препаратов, позволяющих значительно продлевать, а иногда даже спасать жизнь онкологических пациентов. Речь идет об инновационных препаратах, относящихся к так называемой «таргетной группе» (от англ. target — цель, мишень). Их действие направлено против определенных биологических мишеней, которые способствуют росту злокачественных клеток, тканей, опухолей. Важно то, что они точечно воздействуют на злокачественные клетки, не оказывая вредного воздействия на организм.
Над разработкой точечных методов лечения ученые трудились не одно десятилетие. К внедрению таргетной терапии специалисты шли почти полвека. Еще в 60—70–х годах прошлого века американский ученый Фолкман предположил, что гораздо эффективнее бороться не с самой опухолью, а с факторами ее роста – ангиогенезом. Это было предпосылкой для зарождения нового направления таргетной терапии – антиангиогенной терапии. Она дает возможность предотвращать рост сети кровеносных сосудов, питающих злокачественные клетки, и тем cамым блокировать развитие опухоли.
Сегодня препараты таргетной группы имеют более высокую доказанную эффективность по сравнению с традиционной химиотерапией, а также высокую безопасность и способность значительно улучшать качество жизни онкологических пациентов. Такие препараты успешно применяются в лечении онкологических заболеваний при различных локализациях опухолей.
Рак легкого
Ежегодно в России выявляется свыше 63000 больных раком легкого, из них более 53 000 – мужчины. Немелкоклеточный рак легкого (НМРЛ) – наиболее часто встречающаяся форма (более 80% всех случаев заболевания). При этом его основная разновидность – неплоскоклеточный рак легкого обнаруживается примерно у 60% пациентов с НМРЛ.
Результаты исследования антиангиогенного препарата Авастин, в котором приняли участие более 1000 пациентов с неплоскоклеточным НМРЛ, показали, что добавление Авастина к режиму цисплатин/гемцитабин по сравнению с применением только химиотерапии позволяет сократить смертность и остановить развитие заболевания в 20–30% случаев. При этом частота ответа на опухоль возрастает на 70%, а длительность ответа на терапию увеличивается с 4,7 до 6,1 месяцев.
Авастин действует точечно: мишенью препарата является природный белок, который называется фактор роста эндотелия сосудов (VEGF), являющийся ключевым медиатором ангиогенеза. Воздействуя непосредственно на него, Авастин блокирует процесс роста кровеносных сосудов, которые поставляют опухоли питательные вещества и кислород, замедляет рост микрососудов, подавляет прогрессирование процесса метастазирования и снижает внутриопухолевое давление, в результате чего улучшается поступление цитотоксических препаратов в опухоль, что делает ее более уязвимой для химиотерапии.
Christian Manegold, руководитель исследования «AVAiL», профессор медицины университета г. Гейдельберг и медицинского центра университета г. Мангейм (Германия) отмечает: «Рак легкого чрезвычайно плохо поддается лечению. Полученные результаты дарят реальную надежду многим пациентам. Как показало базовое исследование E4599, Авастин – это единственный препарат, появившийся в этом десятилетии, который позволяет продлить жизнь пациентов с распространенным НМРЛ, не получавших предшествующего лечения. Кроме того, исследование AVAiL продемонстрировало, что Авастин также эффективен при его применении в сочетании с различными режимами химиотерапии».
Рак почки
Каждый год в нашей стране регистрируется более 35 тысяч новых случаев рака почки, и более 12 тысяч больных погибают от этого заболевания. По оценкам специалистов, эта цифра будет расти, так как методы лечения рака почки ограничены. Основным является хирургическое удаление части или всей почки, однако этот метод эффективен только на ранних стадиях заболевания. На поздних стадиях лечение, как правило, заключается в сдерживании роста опухоли и облегчении сопутствующих симптомов.
Результаты базового исследования III фазы AVOREN показали, что добавление Авастина к интерферону – стандарту лечения распространенного рака почки, почти вдвое увеличивает медиану выживаемости без прогрессирования заболевания с 5,4 до 10,2 месяцев. Также значительно (на 31,4%) увеличивается частота ответа опухоли. Полученные в ходе исследования данные свидетельствуют об улучшении показателя общей выживаемости, однако анализ этих результатов еще не завершен. Развития новых и неожиданных нежелательных явлений не наблюдалось.
Bernard Escudier, руководитель отдела иммунотерапии и инновационных методов лечения Института Густава–Русси (Париж, Франция) главный исследователь, профессор считает: «Полученные результаты представляются чрезвычайно важными, поскольку уже давно назрела необходимость в создании более эффективных методов лечения этого типа рака, при котором эффективность химиотерапии и лучевой терапии значительно ниже, чем при других онкологических заболеваниях. Авастин является новым эффективным и хорошо переносимым препаратом для борьбы с этим типом рака».
Рак молочной железы
Рак молочной железы (рак груди, РМЖ) сегодня занимает первое место среди всех онкозаболеваний у женщин и является одной из главных причин женской смертности во всем мире. Показатели заболеваемости раком молочной железы за 20 лет выросли на 50% и продолжают угрожающе расти. Кроме того, это заболевание заметно «помолодело» – нередки случаи заболевания тридцатилетних и даже двадцатилетних женщин. В России ежегодно рак молочной железы выявляется у 50 тыс. женщин.
Наиболее агрессивной формой заболевания является HER2–положительный РМЖ, когда на поверхности опухолевых клеток присутствует повышенное количество HER2 белка. Такая форма плохо поддается лечению, а также характеризуется быстрым ростом опухоли и высокой вероятностью рецидивирования .
Результаты исследования NeOAdjuvant Herceptin (NOAH) показали, что при комбинированном применении химиотерапии и препарата Герцептин перед операцией у пациенток с местнораспространенным HER2–положительным раком молочной железы, наиболее агрессивной формой заболевания, отмечается значительное увеличение частоты ответа на терапию (у 43% пациенток), который проявляется в выраженном сокращении объема опухолевой ткани, вплоть до полного ее исчезновения. Кроме того, препарат значительно улучшает качество жизни пациенток с HER2–положительным РМЖ.
Герцептин – это гуманизированное антитело, разработанное с целью связывания с HER2 белком и блокирования его функции. Препарат эффективен как при лечении РМЖ на начальных стадиях, так и при лечении распространенного (метастатического) РМЖ. Эффективен в качестве монотерапии, а также в комбинации со стандартной химиотерапией.
Jean–Jacques Garaud, глава подразделения Global Drug Development фармацевтической компании Рош подчеркивает: «Полученные данные служат еще одним доказательством того, что Герцептин является основой лечения HER2–положительного рака молочной железы. В настоящее время уже доказано, что Герцептин увеличивает показатели выживаемости у пациенток с распространенным HER2–положительным раком молочной железы и что он является препаратом выбора при лечении ранних стадий рака молочной железы, новые данные говорят о том, что применение Герцептина позволяет сократить объем хирургического вмешательства у пациенток с местнораспространенным раком, а это является чрезвычайно важным для женщин, страдающих этой особенно агрессивной формой заболевания».
На сегодняшний день проводятся исследования новых таргетных препаратов для лечения рака молочной железы. Недавно завершилось исследование II фазы, подтвердившее эффективность препарата пертузумаб, который должен значительно улучшить показатели лечения пациенток с HER2–положительным раком молочной железы, получавших ранее другое лечение. Результаты исследования показали, что комбинация препаратов пертузумаб и Герцептина обладает выраженной противоопухолевой активностью, у 20% пациенток отмечается ответ на лечение пертузумабом, а еще у 20% пациенток наблюдается стабилизация заболевания в течение 6 месяцев и более. Результаты особенно важны, так как положительный эффект наблюдается у пациенток с поздними стадиями заболевания, выбор метода лечения которых очень ограничен.
Пертузумаб является первым препаратом из нового класса инновационных препаратов целенаправленного действия, известных как ингибиторы димеризации HER–рецепторов (ИДР). Препарат предотвращает «образование пары» (димеризацию), белка HER2 с другими представителями семейства рецепторов эпидермальных факторов роста (HER1, HER2, HER3, и HER4). Считается, что это взаимодействие играет важную роль в появлении и прогрессировании различных типов рака. Благодаря различиям в механизме действия, комбинация пертузумаб + Герцептин увеличивает активность Герцептина.
Jean–Jacques Garaud, руководитель Global Pharma Development компании Рош резюмирует: «Положительные результаты, полученные в ходе исследования, способствовали принятию решения о развитии клинических исследований III фазы по изучению пертузумаба у больных раком молочной железы. Мы проведем изучение эффективности пертузумаба при метастатической стадии заболевания, а также при ранних стадиях рака молочной железы, до удаления опухоли хирургическим путем».
Колоректальный рак
Колоректальный рак (рак толстой и прямой кишки, КРР) входит в число лидеров в структуре онкологической заболеваемости и смертности. За последние 20 лет в нашей стране рак толстой кишки переместился с 6–го на 3–е место по частоте заболеваемости. При этом заболевание «молодеет». До недавнего времени колоректальным раком страдали в основном лица старше 50–60 лет. Сейчас в группе риска и люди среднего возраста. При этом в России на 100 новых больных колоректальным раком приходится более 70 умерших. Высокая смертность часто вызвана запущенностью опухолевого процесса. По данным статистики, в России при первичном обращении пациентов к врачу III–IV стадии рака диагностируются у 71,4% больных раком ободочной (толстой) кишки и у 62,4% больных раком прямой кишки.
Результаты исследования NO16966 показали, что эффективность схемы терапии XELOX (комбинация Кселоды и оксалиплатина) при колоректальном раке не уступает эффективности схем лечения, которые требуют внутривенного введения препаратов.
Кселода – это единственный препарат, который активируется непосредственно в опухоли, заставляя ее работать на самоуничтожение. У Кселоды есть важное преимущество – это таблетированный препарат. За счет этого терапия становится более гибкой, так как не требует нахождения пациента в стационаре. Кроме того, больные получили возможность избежать негативных последствий длительных внутривенных инфузий, чреватых риском развития у таких ослабленных больных различных осложнений и тяжелых инфекций, иногда угрожающих жизни.
Вот что говорит Jim Cassidy, руководитель исследования NO 16966, профессор британского исследовательского центра по проблемам рака Cancer Research UK, профессор онкологии Битсоновского онкологического центра при университете в Глазго (Шотландия): «Эти результаты наглядно демонстрируют огромное преимущество XELOX в отношении качества жизни у больных колоректальным раком. Полученные данные говорят, что при лечении распространенного колоректального рака Кселода не менее эффективна, чем химиопрепараты, вводимые внутривенно. Учитывая, что в настоящее время многие виды опухолей можно лечить с помощью пероральных средств, почему мы должны заставлять наших пациентов продолжать инфузионную терапию, делающую положение таких людей еще тяжелее?»
Неходжкинская лимфома
Термином неходжкинские лимфомы обозначают довольно большую группу лимфом, которые не являются лимфогранулематозом (болезнью Ходжкина). Если при микроскопическом исследовании находят специфические для болезни Ходжкина клетки Березовского–Штернберга–Рида, то ставят диагноз болезни Ходжкина. Если эти специфические клетки не находят, то лимфому относят к группе неходжкинских.
По расчетам специалистов, более миллиона человек в мире страдают от неходжкинской лимфомы, при этом смертность составляет 360 000 человек ежегодно, и эта цифра постоянно растет. В России диагностируется около 7 000 тысяч новых случаев заболеваний лимфомами (опухоли лимфатической системы) каждый год. Примерно в 40% случаев болезнь носит агрессивный характер и без лечения приводит к смерти пациента в течение шести месяцев. До сих пор точная причина появления лимфомы не известна. Опухоль может развиться у мужчин, женщин, детей – любого возраста и национальной принадлежности, ведущих самый различный образ жизни. Поэтому совершенствование схем терапии злокачественных опухолей является одним из наиболее важных направлений в онкологии.
Основным методом лечения неходжкинских лимфом считается химиотерапия. Но этот метод ограничен из–за токсичности и, как следствие – плохой переносимости. Радикально улучшить эффективность без повышения токсичности позволило применение таргетного препарата Мабтера, действие которого нацелено непосредственно на опухоль.
Анализ данных 7–летнего наблюдения больных агрессивной неходжкинской лимфомой (НХЛ) показал, что 7–летняя выживаемость пациентов, получавших Мабтеру, составляет 53% по сравнению с 36% у пациентов, получавших только химиотерапию. Это значит, что из 100 больных агрессивной НХЛ еще 17 человек проживут 7 лет благодаря лечению Мабтерой.
Мабтера является терапевтическим антителом, которое специфически связывается с особым белком (антигеном CD20) на поверхности нормальных и злокачественных В–клеток. После связывания антитело мобилизует естественные механизмы защиты для атаки и уничтожения помеченных В–клеток. Антиген CD20 отсутствует на стволовых кроветворных клетках (предшественниках В–клеток) в костном мозге, поэтому здоровые В–клетки восстанавливаются после лечения, и их концентрация достигает нормального уровня в течение нескольких месяцев.
William M. Burns, глава подразделения Фарма компании Рош с оптимизмом смотрит в будущее: «Мабтера все так же эффективно продлевает и восстанавливает жизнь больных агрессивной неходжкинской лимфомой. Спустя семь лет после завершения исследования GELA более половины пациентов, принимавших Мабтеру, живы. Этот пример дарит надежду на выздоровление тысячам других больных».
источник
Злокачественная опухоль железистой груди довольно частое явление в современной онкологии. Среди женщин оно встречается от 8 до 11 случаев на 100 человек в возрасте от 12 лет и выше. 1% всех больных – мужчины. Они тоже могут подвергаться такой патологии.
Онкология груди стабильно занимает второе место в популяции таких болезней. Она носит летальный характер и очень опасна для человеческой жизни. Болезнь характеризуется появлением бесконтрольно делящихся клеток, которые способны инвазировать в рядом находящиеся ткани организма человека, давать метастазы. Поэтому лечение рака молочной железы – один из самых актуальных вопросов медицины.
Злокачественные новообразования женской грудной клетки – это многофакторная патология, процесс развития которой связан с изменением совокупности наследственного материала – геномы. Именно они содержат всю биологическую информацию, необходимую для поддержания и построения нормального функционирования организма. Эти клетки могут мутировать под воздействием внешних раздражителей и гормонов, которые регулируют обмен веществ и физиологические функции органов.
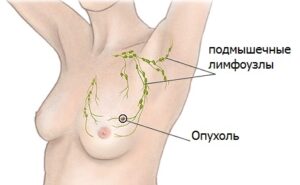
- генетическая предрасположенность и наследственность;
- раннее физиологическое развитие девочек и начало менструального цикла до 12-летнего возраста;
- поздняя менопауза, которая припадает на возраст за 55;
- большой вес и как результат – ожирение;
- радиоактивное излучение;
- никотиновая зависимость и злоупотребление спиртными напитками.
К симптомам относят:
- наличие уплотненных участков;
- водянистые и кровяные экскреции соска;
- трансформация контурных линий и цвета груди;
- увеличенные формы лимфатических узлов под мышками;
- болезнь Педжета – предраковое состояние, при котором поражаются соски и ткани вокруг них.
Основными методами установления диагноза становятся:
- внешний осмотр и прощупывание груди на предмет выявления затвердений;
- рентгенография или маммография;
- ультразвуковое обследование;
- биопсия – изучение изъятых больных тканей под микроскопом.
Многие женщины, проанализировав причины, обнаружив симптомы и проведя ощупывание желез, прибегают к лечению народными средствами, а именно травами, примочками, компрессами. Такие действия не имеют эффекта. Веточки рябины, настоянные на козьем молоке, не уничтожат пораженные клетки. А вот проволочка с обращением в медицинское учреждение усугубляет процесс раннего обнаружения аномалии.
Милые женщины! Помните! За долгие годы изучения этой болезни были накоплены колоссальные знания, разработаны новейшие, современные методы терапии. В лабораториях каждый день исследуются новейшие препараты. Благодаря этому онкологам удается полностью локализовать новообразование или же, как минимум, взять его протекание под строгий контроль. Основным фактором успешногоизбавления от заболевания является своевременное обращение за медицинской помощью!
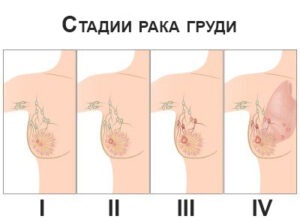
- 0 степень. Небольшая по формам опухоль носит неинвазивный характер. Находится в молочной протоке или в эпителиальном слое самой железы. Не распространяется на лимфатические узлы и не проникает в соседние органы. Обнаруживается при профилактическом осмотре врачом маммологом. Явных симптомов нет. Прогноз нулевой стадии в условиях адекватной терапии – 10-летняя выживаемость в 98% случаев.
- При дуктальной форме (пораженные частички находятся в молочной протоке) предполагает мастэктомию – резекцию молочной железы, более широкое иссечение новообразования и близлежащих слоев эпителия, последующее применение радиотерапии.
- При лобулярной форме (непосредственное поражение мышечной ткани) – систематическое обследование и ведение истории заболевания врачем, рентгенография, употребление томоксифена (или ралоксифена) возрастными дамами в период менопаузы для снижения риска развития метастазов. Реже применяют билатеральную мастэктомию – полное удаление обеих желез.
- 1 степень. Опухоль по размерам достигает двух сантиметров, не распространяется в окружающие органы. 10-летняя выживаемость составляет 94%. Могут применяться органосохраняющие хирургические вмешательства – резекцию очага поражения и близлежащего эпителия с последующими радио и химиотерапиями. Еще при первой стадии применяют мастэктомию – резекцию груди. Используют герцептин, который является блокатором влияния гормонов. Применяется биопсия с целью определения ограниченности распространения раковых клеток.
- 2 степень. Имеет два вида:
- А – размеры опухоли составляют до 2 см, злокачественные клетки распространились в несколько подмышечных лимфатических узлов, или же безинвазивное новообразование до 5 см в диаметре при отсутствии метастазов.
- Б – размеры достигают 5 см и адекватные клетки уже поразили несколько лимфатических узлов. Или же если новообразование более 5 см и отсутствуют метастазы. При второй стадии процент выживаемости составляет от 65 до 85%. Лечение проводится в такой же форме, как и при первой степени поражения, но перед оперативным всешательством проводят химиотерапию.
- 3 степень. Имеет 3 вида:
- А – злокачественное новообразование менее 5 см, но имеются 5–9 инфицированных лимфатических узлов в подмышечной части и значительные по размерам узлы в грудной ткани. 10-летняя выживаемость – 60–70%.
- Б – опухоль проникла в отделы грудной клетки, поразила кожу. Происходит воспаление тканей молочной железы. 10-летняя выживаемость – 20–40%.
- В – новообразованиеь локализовалась в подмышечных и окологрудинных лимфатических узлах. 10-летняя выживаемость едва доходит до 10%.
3 стадия предполагает удаление молочных желез, химиотерапию, применение герцептина – блокатора влияния гормонов. До операции проводятся химиотерапевтические методы, после – радиотерапия.
- 4 степень. Опухоль значительных размеров уже метастазировала в близко лежащие органы. Выживаемость 10 лет – до 5%. При этой степени применяют блокаторы гормонов, или препараты, направленные на снижение работы яичников, так как эти органы содействуют выработке эстрогенов – половых гормонов, способствующих дальнейшему развитию рака. Если метастазирование обнаружено в костях, коже и мозге – назначают радиотерапию. Лечение этой стадии подразумевает снижение болевого симптома, торможение развития заболевания и максимальное продление жизни пациента.

Непосредственное лечение рака молочной железы подразумевает: хирургические операции, химиотерапию, лучевую, иммунную, и таргетную терапии.
Все лечебные мероприятия подразделяются на:
- радикальные – полная резекция первичного очага поражения и регионального разрушения поврежденных лимфатических узлов;
- цитроредуктивные – условно радикальные – уменьшение размеров и локализации опухолевых клеток, снижение риска их интоксикации;
- паллиативные – облегчение общего физического состояния, оттягивание времени смерти пациента от быстрораспадающихся опухолевых ран, от перфорации плевры.
Это разделение условное. Мероприятия, в основных случаях носят комплексный характер. В дополнение можно воспользоваться народными средствами, но должного эффекта они не приносят.
- Лампэктомия– органосохраняющее хирургическое вмешательство. Удаляется опухоль, но большая часть молочной железы остается не затронутой. Такая операция допускается на начальных стадиях заболевания. Но риск рецидивов высок. При повторных случаях грудь удаляют полностью.
- Мастэктомия – полная резекция молочной железы, малой и большой грудной мышц. Но современные методы позволяют при этом сохранить кожу груди и сосок. Это дает эффективный результат при пластике, установке имплантанта и косметической хирургии. Визуальный дефект полностью устраняется.
Современные исследования доказали, что при размерах новообразования до 4 см лампэктомия приносит такой же результат, что и полная резекция.
Женщины редко соглашаются на полное удаление груди. Но это может иметь негативные последствия. Отзывы пациенток, в конечном результате, склоняются к мастэктомии.
Органосохраняющая операция может проводиться только в том случае, когда размер новообразования не превышает 2, 5 см в диаметре. Иногда с целью снижения риска рецидивов и недопущения развития метастаз удаляют и близлежащие лимфатические узлы. Их отсутствие нарушает процесс оттока лимфы, что может привести к появлению отеков, увеличению руки в размерах и частичной неподвижности. Специальные физические упражнения способствуют восстановлению основных двигательных функций руки.
Случаи, при которых приоритетным является полное удаление молочной железы:
- наличие мультифокального поражения, когда два или более злокачественных очага находятся в разных частях железы;
- раннее применение к груди лучевой терапии;
- размер опухоли почти равен размеру груди – полное поражение раковыми клетками;
- пациентка имеет заболевание соединительной ткани – склеродермию, что не позволяет в последствие провести лучевую терапию;
- Страх женщины перед развитием послеоперационных рецидивов и метастазов.
Одновременно с хирургической терапией применяют и другие методы. Если женщина является ярой сторонницей нетрадиционной медицины, то для укрепления общего нормального функционирования организма можно воспользоваться еще и народными средствами.
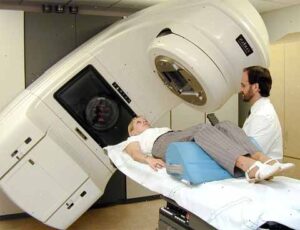
Ее цель – снижение вероятности проявления рецидивов после операционного вмешательства. Терапия облучением весьма эффективно убивает губительные для организма микроскопические клетки.
- Дистанционное облучение– внешний источник внедрения лучей линейным ускорителем. Такая радиотерапия снижает шансы рецидивов, но не является панацеей в отношении продления жизни пациентов. Облучению поддаются вся молочная железа или вся грудная клетка.
- Брахитерапию – ионизирующее излучение, выпускающее медицинским ускорителем. В этом случае радиоактивное вещество транспортируется непосредственно к источнику злокачественной опухоли.
Лучевая терапия не применяется к запущенным формам рака.
Основные факторы назначения радиотерапии:
- две и более опухоли, расположены в непосредственной близости;
- множественные очаговые поражения;
- микроскопическое повреждение кровеносных сосудов и лимфатических узлов;
- поражение кожи, соска и большой грудной мышцы;
- распространение новообразования за пределы лимфатических узлов.
Обычно дозы химиотерапии достаточно высокие, что гарантирует стопроцентное уничтожение атипичных новообразований. При этом значительный вред может наноситься здоровым тканям. Поэтому рекомендуют проведение 5–7 сеансов с перерывами для восстановления нормальных клеток, способных к регенерации.
Радиотерапия имеет также побочные эффекты:
- Локальные. Формирование лучевых ожогов, повышение ломкости кровеносных сосудов, малоочаговые кровоизлияния.
- Системные. Слабость и быстрая утомляемость, рвота, тошнота, высыпание волос на фоне распада клеток, подвергающихся облучению. Меняется кроветворение, изменяется состав крови, наблюдается ломкость ногтей.
Основные из них:
- Фтораруцил;
- Эпирубицин;
- Циклофосфамид;
- Доксорубицин;
- Метотрексат.
Препараты определяются лечащим врачом в зависимости от множественных факторов. Курс повторяется каждые 4 недели.
Химиотерапия применяется в следующих случаях:
- Для предоперационного уменьшения размера злокачественного образования.
- После хирургического вмешательства с целью уничтожения патологических клеток и небольших метастазов, которые могут стать причиной роста вторичной опухоли.
- Вместо операции при неоперабельности пациента для улучшения качества жизни.
Побочные эффекты носят такой же характер, как и при лучевой терапии. Очень редко, но после применения химиотерапии известны случаи развития бесплодия и наступления ранней менопаузы. В этот период жизнедеятельность организма можно поддерживать народными средствами, которые способствуют общему укреплению иммунной системы.

Выделяют три вида иммунотерапии:
- Активная. Ее цель – повышение активности общих иммунологических реакций с помощью бактериальных вакцин, специфических и неспецифических субклеточных составляющих.
- Пассивная. Введение сыворотки от иммунизированного организма или от больных с регрессирующей опухолью.
- Адаптивная. Заключается в введении аллогенных и ксеногенных лимфоцитов, которые изменяют процентное соотношение зараженных клеток и лимфоцитов, что способствует подавлению злокачественных новообразований.
Она еще носит название биологическая. Это новое веяние в цепочке традиционной терапии раковых заболеваний. И отзывы клиентов о его применении носят перспективный характер. Такое лечение блокирует рост злокачественных новообразований с помощью целевых молекул. Препараты, используемые для этого, являются биофармацевтическими. От предыдущих методов отличается эффективностью, так как наносит наименьший вред здоровым клеткам. В ее основе лежат разработки, воздействующие на молекулярные механизмы, которые отвечают за рост и прогрессию опухоли.
Таргетная терапия нацелена на конкретные белки, гены и ткани новообразования, способствующие ее росту и размножению.
Механизм действия:
- блокировка и отключение сигналов роста и деления агрессивных клеток;
- запуск процессов, которые ведут к естественной гибели злокачественных клеток;
- доставка токсинов непосредственно в клетки с целью их уничтожения.
Такие современные методы способствуют ремиссии рака, исчезновению метастазов, продлению жизни пациентов. Поддержка иммунитета народными средствами при таком лечении не имеет противопоказания.
Лечение рака молочной железы – достаточно длительный и сложный процесс. Он отнимает много сил и энергии, как у больной женщины, так и у ее родных и близких. Поэтому так важно своевременно обнаруживать новообразования еще на ранних стадиях. И ни в коем случае, узнав страшный диагноз, не начинать самолечение народными средствами. Новейшие препараты, высокоэффективная терапия помогут высококвалифицированным докторам приложить максимум усилий, оказать поддержку и необходимую медицинскую помощь каждой женщине! Будьте всегда здоровы!
источник

