Любченко Л.Н., Гарькавцева Р.Ф., Портной С.М., Брюзгин В.В.
Среди злокачественных новообразований рак молочной железы (РМЖ) является основной причиной смерти женщин репродуктивного возраста в России (1). В последнее десятилетие решение вопросов этиологии, патогенеза, ранней диагностики и профилактики РМЖ связывают с открытиями в области молекулярной генетики, благодаря которым появилась возможность выявлять гены, вовлеченные в процесс канцерогенеза и определяющие предрасположенность к данному заболеванию. На сегодняшний день мы уже можем дифференцировать наследственные и спорадические формы РМЖ в зависимости от того, в какой клетке — герминальной или соматической произошло повреждение генетического аппарата. В результате стало возможным детальное изучение наследственной предрасположенности к развитию РМЖ, генетической гетерогенности рака этой локализации и на этой основе выявление лиц с потенциально высоким риском заболевания с последующим использованием эффективных профилактических и адекватных лечебных мер.
Генетическая предрасположенность к раку молочной железы
До 1980 года изучение генетической предрасположенности к раку молочной железы было ограничено описанием больших семей, в которых, по меньшей мере, одна женщина в каждом поколении страдала раком молочной железы. В 1982 г. W.Albano и соавторы (2) выделили особую нозологическую единицу — наследственный рак молочной железы, в рамках которого возможно существование различных генетически детерминированных форм и синдромов. Последующие исследования подтвердили, обосновав как формально-генетически так и с помощью молекулярных методов, существование наследственных синдромов: органоспецифического РМЖ, сочетанных РМЖ/рака яичников, синдрома Линч II, при котором в семьях наблюдается накопление злокачественных новообразований органов женской репродуктивной сферы и желудочно-кишечного тракта; Ли-Фраумени, в состав которого входят неоплазии различной локализации в сочетании с РМЖ, синдромы SBLA, CRAC, Гарднера, Пейтца-Егерса, атаксии-телеангиэктазии, основной составляющей которых является РМЖ. Критериями для постановки генетического диагноза наследственного РМЖ служат наличие в семье двух и более родственников I-II степени родства, страдающих РМЖ, ранний возраст манифестации заболевания, двухстороннее поражение молочных желез, первичная множественность новообразований у пробанда или его родственников, специфические опухолевые ассоциации (3).
В ранних работах на материале 200 датских родословных W.Williams и D.Anderson (4) с помощью сегрегационного, корреляционного и компонентного анализов установили, что наиболее приемлемой является модель аутосомно-доминантного наследования гипотетического гена, ответственного за развитие наследственного РМЖ, с возраст-зависимой пенетрантностью. B.Newman с соавт. при сегрегационном анализе родословных показали, что частота гипотетического гена составила 0,006 в общей популяции, а его пенетрантность — 0,82 (5).
В более поздних работах E.Claus с соавт. (1991 г.) и D.Easton с соавт. (1993г.), на основе проведения генетического анализа получили сходную частоту носительства гена и сделали вывод, что одна из 20 женщин с онкологически отягощенным анамнезом, страдающая РМЖ, является носительницей наследственной предрасположенности. В общей популяции это соотношение составляет 1:200 (6,7). Такая частота гена (генов) относит генетическую предрасположенность к РМЖ к одной из самых широко распространенных и обосновывает актуальность ее ранней диагностики.
Пролиферативная форма фиброзно-кистозной болезни и рак молочной железы возникают и развиваются под влиянием одних и тех же эндогенных и экзогенных факторов. Данные, заслуживающие особого интереса, были получены в исследовании W. Dupont и D.Page (8), наблюдавших 3 303 женщин в течение 17 лет. Они показали, что наличие в семье больных родственниц I степени родства, страдающих РМЖ, повышает риск развития этого заболевания в 2,5 раза, как при наличии атипической гиперплазии, так и без нее. С точки зрения авторов, отягощенный семейный анамнез незначительно повышает риск развития заболевания у женщин без пролиферативных изменений ткани молочной железы, но наличие кальцинатов и отягощенный РМЖ семейный анамнез значительно повышают риск развития РМЖ, что и является основанием для включения таких женщин в «группу риска». В этой же работе показано, что абсолютный риск РМЖ, ассоциированный с атипической гиперплазией составил 20% в течение 15 лет после первичного биопсийного исследования.
Haagensen c cоавт. продемонстрировали взаимосвязь РМЖ с кистозным изменением ткани молочной железы. Эта группа исследователей сделала вывод, что наличие кист повышает риск развития РМЖ у женщин, имеющих родственниц I степени родства, страдающих аналогичным заболеванием. Такой ассоциации не отмечалось среди женщин без семейного отягощения (9). При этом вклад доброкачественных опухолей также имеет существенное значение. Dupont с соавт. проследили судьбу 1 950 пациенток с диагнозом фиброаденома и сочетанием фиброаденоматоза с фиброзно-кистозной болезнью. Контрольную группу составили сестры мужей этих женщин. Риск развития РМЖ при одиночных фиброаденомах составил 2,17 и повышался до 3,1 у пациенток при наличии сочетанных фиброаденом и кист, фиброаденом и склерозирующего аденоза, кальцинатов или папилломатоза. Причем, при отягощенном семейном анамнезе накопленный 25-летний риск составил 20%. Две трети пациенток, имеющих единичные фиброаденомы и здоровых родственниц, рисковали заболеть РМЖ наравне с женщинами из общей популяции (10).
Генетический анализ, проведенный М. Skolnick с соавт. показал, что существует наследственная предрасположенность как к РМЖ, так и к пролиферативным доброкачественным изменениям ткани молочной железы. 103-м женщинам из 20-ти семей, в которых, по крайней мере, 2 родственницы 1 степени родства (мать, дочь или сестра) страдали РМЖ и 31 женщине из контрольной группы было выполнено клиническое, рентгенологическое обследование и 4-х квадрантная биопсия обеих молочных желез. Результаты такого исследования показали, что 35% клинически здоровых женщин опытной группы по сравнению с 13% контрольной, имели цитологические признаки пролиферации эпителия. Из этого можно сделать вывод, что генетическая предрасположенность к РМЖ на первом этапе выражается доброкачественной дисплазией молочной железы (11). Это предположение подтверждено и в исследовании А. Baildam, в котором при патоморфологическом исследовании ткани молочной железы, удаленной при профилактической двухсторонней мастэктомии у 43-х женщин, в т.ч. носительниц генов BRCA1\2, в 35 случаях (81%) имела место доброкачественная дисплазия (12). H. Cody ссоавт., используявскрининговомисследованиидвухстороннююбиопсию у 871 пациентки, показали, что только один фактор – первая степень родства в отношении больной РМЖ, коррелировала с синхронным поражением молочных желез. В результате проведенных исследований было выявлено 54 случая заболевания, из них 14 инвазивного рака и 40 рака insitu. Таким образом, выполнение двухсторонней биопсии у женщин с семейным накоплением РМЖ вполне оправданная процедура (13).
Попытки выявить единые патобиологические механизмы проводились на хромосомном и молекулярном уровнях. М. Teixeiraet с соавт. в 5-ти из 6-ти образцов, полученных при профилактической двухсторонней мастэктомии и в 1 образце карциномы in situ, выполненной у 4-х женщин в связи с отягощенным семейным анамнезом цитогенетическим методом, выявили клональные хромосомные нарушения. Все образцы имели гистологические признаки эпителиальной гиперплазии без атипии и карциному in situ. Делеция сегмента короткого плеча хромосомы 3 (р12-14) была определена при раке in situ в одном образце с гиперплазией. Признаки хромосомных аберраций в профилактически удаленных тканях доказали, что неопластический процесс уже имел место (14). При изучении аллельной потери хромосомной зоны 17g 12-21 (зона BRCA 1 гена) 25 образцов доброкачественных и злокачественных опухолей женщин из семей, отягощенных как органо-специфичным РМЖ, так и из семей, с различной онкологической патологией, Р. Lalle с соавт. констатировали, что аллельная потеря встречается чаще в опухолях членов семей с органо-специфичным РМЖ (15). Таким образом, генетические изменения, происходящие в доброкачественных опухолях, подтверждают, что гиперплазия ткани представляет собой первую ступень в канцерогенезе в семьях с наследственным отягощением. С другой стороны, М.Kasami с соавт. в исследовании 25 образцов ДНК, выделенной из пролиферативно измененных тканей молочной железы, включая внутрипротоковые папилломы, на предмет потери гетерозиготности и микросателлитной нестабильности по 10 локусам, включая локус D 17S 579 (зона BRCA 1 гена) выявили неполную корреляцию между генетическими изменениями и пролиферацией с атипией. Важным выводом в этой работе было то, что генетические изменения могут иметь место и без четких клинических признаков, предшествующим злокачественным и опираться в таких случаях следует на отягощенный семейный анамнез (16).
Молекулярная генетика РМЖ
На сегодняшний день хорошо изучены высокопенетрантные гены BRCA 1 и BRCA 2 (BReastCAncer), играющие определенную роль при возникновении наследственного РМЖ. Герминальные мутации генов Тр 53, PTEN (PhosphatesTENsin) и АТМ являются этиологичными в отношении специфической индивидуальной и семейной предрасположенности — синдромам Ли-Фраумени, Каудена и атаксии-телангиэктазии. Существуют другие гены и полиморфизмы, имеющие отношение к наследственному предрасположению возникновения РМЖ (CHEK2, NBS1, СYP17,CYP19, NAT2), но их изменения связаны с меньшим риском развития РМЖ, по сравнению с генами BRCA (17, 18)
BRCA 1 ген был идентифицирован с помощью позиционного клонирования в 1994 г. Y. Mikietal. на длинном плече 17 хромосомы (19). BRCA 2 ген был картирован на 13q хромосоме и выделен в 1995 г. S.Tavtigian et al. (20). BRCA1 и BRCA2 гены являются супрессорными генами, с аутосомно-доминантным типом наследования и высокой пенетрантностью в пределах одной семьи. В совместном исследовании BreastCancerLinkageConsortium (BCLC 2003) включившим данные большого количества семей, наследующих герминальные мутации генов BRCA1 И BRCA2, было показано, что оба этих гена несут высокий 80–95% риск развития РМЖ у женщин в течение всей жизни, однако кривая пенетрантности для носителей мутаций гена BRCA 1 начинает возрастать в более раннем возрасте по сравнению с носителями мутаций гена BRCA 2. Анализ данных продемонстрировал высокую вероятность возникновения рака желудка, толстой кишки, эндометрия, поджелудочной железы, меланомы, мочевого пузыря, опухолей головы и шеи при патологическом BRCA1/2 генотипе, что необходимо учитывать при медико-генетическом консультировании и наблюдении пациентов-носителей. Риск развития двухстороннего РМЖ составляет 64% для носителей мутаций гена BRCA1 и 58% для носителей мутаций BRCA 2 гена. Мутации генов BRCA1/2 одновременно находят примерно в 80% семей с 4-мя и более случаями РМЖ, диагностированным после 60-ти лет (21, 22).
Молекулярные исследования BRCA1 и BRCA2 генов, проведенные за последние годы, демонстрируют огромный спектр мутаций этих генов. Breast Cancer Information Core (BIC) содержит свыше 800 различных вариантов мутаций генов BRCA1/2. Большинство этих мутаций относятся к делеторным, в результате которых структурные перестройки изменяют функциональность белкового продукта, что, в свою очередь снижает способность клетки к репарации ДНК. Значительная часть – 34% мутаций гена BRCA 1 и 38% BRCA 2 гена, являются миссенс – мутациями. Описано большое количество однонуклеотидных полиморфных вариантов, клиническое значение которых на сегодняшний день не определено. В нашей совместной работе с Медико-генетическим Научным Центром РАМН по скринированию гена BRCA 1 у пациентов, страдающих РМЖ и/или раком яичников, из семей с онкологически отягощенным анамнезом, в 52,4% случаев одна аллель гена BRCA 1 содержала 8 полиморфных вариантов, наследуемых в семье как целое (23).
В отношении оценок пенетрантности генов BRCA1 и BRCA2 также важно этническое происхождение пациентов-носителей. Изучение популяций исландцев и евреев Ашкенази выявило низкую пенетрантность этих генов, а риск развития РМЖ на протяжении жизни составил 50-60% и 37% у ашкеназцев и исландцев соответственно. В этих популяциях только несколько мутаций являются ответственными за генетическую предрасположенность к РМЖ и/или раку яичников. Они связаны с эффектом родоначальника, т.е. мутация, возникшая в одной из гамет предка, так называемая неомутация или мутация «de novo», в последствии передается из поколения в поколение. Интересно отметить, что из 14 пациентов-россиян, страдающих РМЖ и имеющих значимые делеторные мутации, у 11 (78,5%) выявлена мутация 5382insC в 20 экзоне — у 7-ми русских и 4-х евреек (24). В предыдущей нашей совместной работе с Кембриджским университетом по изучению спектра мутаций гена BRCA 1 в российской популяции, на долю мутации 5382incC пришлось 47% случаев (25). Предполагают, что семьи имеют общий гаплотип, который охватывает 850 кБ гена BRCA 1, и что существуют определенные внутригенные маркерные аллели, наследуемые от общего предка (26).
Особенности рака молочной железы у носителей мутаций генов BRCA1 или BRCA2
Герминальные мутации редко встречаются при спорадическом РМЖ, хотя снижение экспрессии BRCA 1 имеет место. Различный молекулярный патогенез между BRCA–ассоциированых и ненаследственных опухолей молочной железы предполагает, что эти опухоли могут кардинальным образом отличаться по фенотипическим и прогностическим признакам. Многими группами исследователей отмечена фенотипическая гетерогенность РМЖ, обусловленная герминальными мутациями генов BRCA1 или BRCA2. Показано, что отсутствие пораженных регионарных лимфатических узлов не снижает смертности у носителей мутаций этих генов. Опухоли, обусловленные герминальными мутациями гена BRCA 1, имеют более высокую степень злокачественности, большую частоту медуллярного рака, отсутствие рецепторов эстрогенов и прогестерона (27, 28). Оценки выживаемости спорны из-за различных методологических подходов. Результаты работы, проводимой в РОНЦ им. Н.Н. Блохина РАМН показали, что общая выживаемость больных, страдающих РMЖ, ассоциированного с мутациями гена BRCA2, статистически достоверно лучше значений выживаемости больных спорадическим РМЖ – 87,4% и 71,0% соответственно (р 30 лет, чем у рожавших до 20 лет (33).
Ранние роды не оказывают защитного действия у женщин, имеющих мутации BRCA1 или BRCA2. Рожавшие женщины-носительницы мутаций BRCA1 или BRCA2 существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска заболеть РМЖ в возрасте до 40 лет (34).
Профилактическое применение тамоксифена в группах риска широко обсуждается. В основу предлагаемой на сегодняшний день гормонотерапии положены факты, представленные впервые в 1976 г. V. Jordan с соавт. свидетельствующие о том, что применение тамоксифена в 90% случаев подавляет опухолевый рост при РМЖ (35). Это позволило предположить, что применение тамоксифена возможно и с профилактической целью. Подробное изучение механизма действия препарата выявило, что тамоксифен блокирует G1-фазу клеточного цикла и подавляет деление опухолевых клеток. С 1980 года были проведены большие клинические рандомизированные исследования по определению эффективности профилактического применения тамоксифена у женщин с высоким риском развития РМЖ. Наиболее полные исследования были выполнены в 1986 г. в Англии (Royal Mansden Hospital) под руководством T. Powles (36). Подобные исследования начаты в 1992 г. группой Европейского института Онкологии в Италии под руководством U.Veronesi c соавт. (37), и в США (National Surgical Adjuvant Breast and Bowel Project, — NSABBP) под руководством B.Fisher с соавт. (38). Обобщенные результаты этих исследовательских групп были опубликованы в 1998 г.
Рандомизированное исследование американцев включало 13,388 женщин, разделенных на группы, принимающих тамоксифен и плацебо в дозе 20мг в день в течение 5 лет. Участницы исследования были отобраны в связи с наличием факторов высокого риска развития РМЖ, который рассчитывался по алгоритму, учитывая возраст, число родственниц I степени родства, страдающих РМЖ, отсутствие родов в анамнезе или возраст первых родов, число биопсийных исследований ткани молочной железы, рак in situ, возраст менархе. Результаты этого исследования были представлены раньше предполагаемого срока, так как консультативным комитетом было определено, что выборка достаточно представительна и основной вывод, показывающий, что тамоксифен снижает риск инвазивного РМЖ на 49% (р 0.00001), был аргументировано обоснован. На 69% снизилась частота РЭ+ опухолей; частота РЭ- опухолей изменилась статистически незначимо. Риск неинвазивного РМЖ был снижен на 50% (р 50 лет) ожидалось 50,3 случая РМЖ, наблюдалось 2; снижение риска развития болезни – 96,0%.
RebbeckT.R. и соавторы представили анализ эффективности двусторонней профилактической мастэктомии у здоровых женщин-носителей мутаций геновBRCA1 и BRCA2 (42). 105 женщинам была выполнена профилактическая операция с или без оофорэктомии, 378 пациенток отказались от профилактического вмешательства. При средней длительности прослеженности 6,4 года РМЖ был выявлен в двух случаях у оперированных женщин (1.9%) и в 184 случаях (48.7%) у не оперированных. Двусторонняя профилактическая мастэктомия в сочетании с удалением яичников снижала риск развития РМЖ на 95%, а в случаях с интактными яичниками — на 90%.
Целесообразность выполнения профилактических мастэктомий у носителей мутаций генов BRCA1 или BRCA2 подтверждается высокой частотой обнаружения предраковых изменений и рака in situ в удаленных органах. В Манчестерском госпитале (Англия) хирургом А. Baildam с 1995 года профилактическая двухсторонняя мастэктомия была выполнена 43 женщинам. Важным фактом было то, что при гистологическом исследовании удаленных тканей в 8 случаях (18%) были выявлены злокачественные изменения – 4 дольковых рака in situ, 2 протоковых рака in situ, и в 2-х случаях – смешанный протоково-дольковый рак in situ (43). N.Hoogerbrugge и соавторы также приводят данные о морфологических находках в «здоровых» молочных железах, удалённых профилактически: протоковая атипическая гиперплазия наблюдалась в 39%, дольковая атипическая гиперплазия – в 37%, протоковый рак in situ – в 15%, дольковый рак in situ – в 25%, инвазивный рак – в 1% (44).
Требования EUSOMA (Европейское общество мастологов) по контролю качества при выполнении профилактической мастэктомии направлены на исключение необоснованно предлагаемых операций и минимизацию психологической травмы, связанной с ее выполнением. Пациентка должна быть обследована генетиком, генетический диагноз должен быть подтверждён ДНК-диагностическими методами. Генетик должен изложить варианты дальнейшей тактики: динамическое наблюдение, приём тамоксифена, профилактическая оофорэктомия, профилактическая мастэктомия. Если пациентка выбирает профилактическую мастэктомию, с хирургом-маммологом следует обсудить вариант мастэктомии: подкожная либо кожесохраняющая (то есть с удалением сосково-ареолярного комплекса). Необходима консультация пластического хирурга для выбора варианта реконструкции и сроков проведения реконструкции (45).
Таким образом, генетические подходы к ранней диагностике и профилактике РМЖ объединяют формально-генетические, цитогенетические, молекулярные и клинические методы, направленные на создание специализированного клинико-генетического регистра лиц-носителей патологического генотипа, организацию и координацию мониторинга за состоянием их здоровья, решение морально-этических и юридических проблем, связанных с доклинической диагностикой наследственной предрасположенности к развитию РМЖ, а так же использование лекарственной и хирургической профилактики у таких лиц.
1. Давыдов М.И., Аксель Е.М., В сборнике: «Злокачественные новообразования в России и странах СНГ в 2002г». Москва 2004. с. 110.
2. Albano W, Recabaren J, Lynch H, et al. Natural history of hereditary cancer of the breast and colon. Cancer 1982; 50: 360-363.
3. Любченко Л.Н., Гарькавцева Р.Ф., Поспехова Н.И. и соавт. ДНК-диагностика и медико-генетическое консультирование при наследственной предрасположенности к раку молочной железы. В сборн. «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва 2003, с.44-47.
4. Williams W, Anderson D. Genetic epidemiology of breast cancer analysis of 200 danish pedigrees. Genet. Epidem. 1984; 1: 7-20.
5. Newman B, Austin M, Lee, King M. Inheritance of human breast cancer. Evidence for autosomal dominant transmission in high-risk families. Proc. Nat. Acad. Sci. USA. 1988; 85: 3044-3048.
6. Claus E, Risch N, Thompson W. Genetic analysis of breast cancer in the cancer and steroid hormone study. AM J Hum Genet. 1991; 48: 232.
7. Easton D, Bishop D, Ford D, et al. Genetic linkage analysis in familial breast and ovarian cancer: Results from 214 families. Am J Hum Genet. 1993; 52: 678.
8. Dupont WD, Page DL, Risk faktors for breast cancer in women with proliferative breast disease. N Engl J Med 1985; 312: 146-151.
9. Haagensen CD, Bodian C, Haagensen DE, et al. Breast Canser Risk and Detection. Philadelphia, WB Saunders, 1981: 70-75.
10. Dupont WD, Page DL, Parl FF, et al. Long-term breast cancer risk in women with fibroadenoma. N Engl J Mtd 1994; 331: 10-15.
11. Skolnic MH, Cannon-Albright L.A., Goldar DE. et al. Inheritance of proliferative breast disease in breast cancer kindreds. Science 1990; 250; 1715-1720.
12. Baildam AD The role of bilateral prophylactic mastectomy in women at high risk of breast cancer. Abstract. Familial Breast Cancer Demonstration Project Symposium 1999, Heidelberg, Germany.
13. Cody HS Routine contralateral breast biopsy: helpful or irrelevant? Experience in 871 patients, 1979-1993. Ann Surg 1997; 225: 370-376.
14. Teixeira M. Pandis N., Gerdes L. Breast Cancer Res Treat 1996 38
15. Lalle P, De Latour M, Rio P, et al. Detection of allelic losses on 17q12-q21 chromosomal region in benign lesions and malignant tumors occurring in familial context. Oncogene 1994; 9(2): 437-442.
16. Kasami M, Vnencak-Jones CL, Manning S, et al. Loss of heterozygosity and microsatellite instability in breast hyperplasia. Am J Pathol 1997; 150: 1925-32.
17. Артамонов В.В., Любченко Л.Н., Шабанов М.А. с соавт. Изучение ассоциации полиморфных маркеров генов CYP19 и CYP17 со спорадическим раком молочной железы. Молекулярная биология, Москва 2003, Т.37, N. 6, с. 975-982.
18. Артамонов В.В., Любченко Л.Н., Шабанов М.А. с соавт. Ассоциация полиморфизма NAT2 cо спорадическим раком молочной железы. Молекулярная биология, Москва 2004, Т. 38, N. 3, с. 457-462.
19. Miki Y, Swensen J, Shattuck-Eidens D, et al. A Strong candidate for the breast and ovarian cancer susceptibility gene BRCA 1. Science 1994; 266: 66.
20. Tavtigian SV, Simard J, Rommens J, et al. The complete BRCA 2 gene and mutations in chromosome 13q-linked kindreds. Nat genet 1996; 12: 333.
21. BCLC. Familial Cancer. 2003; v.2 N3-4; p.18-32.
22. Ford D, Easton DF, Stratton M, et al. Breast Cancer Linkage Consortium. Genetic Heterogeneity and Penetrance Analysis of the BRCA1 and BRCA2 Genes in Breast Cancer Families. Am J Hum Genet 1998; 62: 676-689.
23. Карпухин А.В., Поспехова Н.И., Любченко Л.Н., с соавт. Частоты однонуклеотидных полиморфизмов и мутаций в гене BRCA1 при наследственно обусловленном раке молочной железы и/или раке яичников. Доклады Академии Наук (ДАН), Москва 2002, Т.383, N 5, с.1-4.
24. Любченко Л.Н., Гарькавцева Р.Ф., Поспехова Н.И. и соавт. ДНК-диагностика и медико-генетическое консультирование при наследственной предрасположенности к раку молочной железы. В сборн. «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва 2003, с.44-47.
25. Gayther S, et al Frequently occring germline mutations of BRCA 1 gene. Am J Hum Genet 1997; 60: 1013-20.
26. Easton D, Bishop D, Ford D, et al. Genetic linkage analysis in familial breast and ovarian cancer: Results from 214 families. Am J Hum Genet. 1993; 52: 678.
27. Любченко Л.Н., Гарькавцева Р.Ф., Поспехова Н.И. и соавт. ДНК-диагностика и медико-генетическое консультирование при наследственной предрасположенности к раку молочной железы. В сборн. «Возможности современной онкологии в диагностике и лечении злокачественных заболеваний», Москва 2003, с.44-47.
28. Lakhani S, Sloane JP, Gusterson Ba, et al. A detailed analysis of the morfological features associated with breast cancer in patients harbouring mutations in BRCA1 and BRCA2 predisposition genes. J Natl Cancer Inst 1999; 90: 1138-1145.
29. Любченко Л.Н. Генодиагностика наследственной предрасположенности к раку молочной железы и разработка системы индивидуального прогнозирования развития, течения и профилактики заболевания. Автореферат канд. дис. Москва 2002.
30. Haffty BG, Harrold E, Khan AJ, Pathare P, Smith TE, Turner BC, Glazer PM, Ward B, Carter D, Matloff E, Bale AE, Alvarez-Franco M. Outcome of conservatively managed early-onset breast cancer by BRCA1/2 status. Lancet 2002 Apr 27;359 (9316):1471-7.
31. L.A.Brinton & S.S.Devesa. Incidence, Demographics, and Enviromental Factors. In: Harris JR, Morrow M, Lippman ME, et al., eds.: Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996, pp 159-168.
32. Wohlfahrt J., Melbye M. Age at any birth is associated with breast cancer risk. Epidemiology, 2001, 12, 1, 68-73.
33. Tavani A, Gallus S, La Vecchia C, Negri E, Montella M, Dal Maso L, Franceschi S Risk factors for breast cancer in women under 40 years. Eur J Cancer, 1999, 35, 9, 1361-1367.
34. Jernstrom H, Lerman C, Ghadirian P, et al. Pregnancy and risk of early breast cancer in carriers of BRCA1 and BRCA2. Lancet, 1999, 354(9193), 1846-1850.
35. Jordan VC. Effect of tamoxifen on initiation and growth of DMBA-induced rat mammary carcinoma. Eur J Cancer 1976; 12: 419-424.
36. Powles T, Eles R, Ashley S, et al. Interim analysis of the incidence of breast cancer in the Royal Marsden Hospital tamoxifen randomized prevention trial. Lancet 1998; 352: 98-101.
37. Veronesi U, Maisonneuve P, Costa A, et al. Prevention of breast cancer with tamoxifen: Preliminary findings from the Italian randomized trial among hysterectomized women. Lancet 1998; 352: 93-97.
38. Fisher B, Constantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast cancer. Report of the National Surgical Adjuvant Breast and Bowel Project P-1 stady. J Natl Cancer Inst 1998; 90: 1371-1388.
39. Rebbeck TR, Lynch HT, Neuhausen SL, Narod SA, Van’t Veer L, Garber JE, Evans G, Isaacs C, Daly MB, Matloff E, Olopade OI, Weber BL; Prevention and Observation of Surgical End Points Study Group. Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 2002 May 23;346(21):1616-22.
40. Hartmann LC, Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, Petty PM, Sellers TA, Johnson JL, McDonnell SK, Frost MH, Jenkins RB Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer. N Engl J Med; 340(2):77-84 1999.
41. McDonnell SK, Schaid DJ, Myers JL, Grant CS, Donohue JH, Woods JE, Frost MH, Johnson JL, Sitta DL, Slezak JM, Crotty TB, Jenkins RB, Sellers TA, Hartmann LC Efficacy of contralateral prophylactic mastectomy in women with a personal and family history of breast cancer J Clin Oncol; 19(19):3938-43 2001
42. Rebbeck TR, Friebel T, Lynch HT, Neuhausen SL, van ‘t Veer L, Garber JE, Evans GR, Narod SA, Isaacs C, Matloff E, Daly MB, Olopade OI, Weber BL.
Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group. J Clin Oncol. 2004 Mar 15;22(6):1055-62.
43. Baildam AD The role of bilateral prophylactic mastectomy in women at high risk of breast cancer. Abstract .Familial Breast Cancer Demonstration Project Symposium 1999, Heidelberg, Germany.
44. Hoogerbrugge N, Bult P, de Widt-Levert LM, Beex LV, Kiemeney LA, Ligtenberg MJ, Massuger LF, Boetes C, Manders P, Brunner HG. High prevalence of premalignant lesions in prophylactically removed breasts from women at hereditary risk for breast cancer. J Clin Oncol 2003 Jan 1;21(1):41-5.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Раком называют злокачественное образование, сформированное из эпителиальных клеток. В медицинских кругах заболевание называется карциномой. Такое название опухоли дал еще Гиппократ, так как она по внешнему виду походит на краба.
На сегодняшний день ни у кого не вызывает сомнения наличие генетической предрасположенности к онкологическим заболеваниям. По некоторым данным от пяти до семи процентов случаев рака являются генетически обусловленными.
Среди медиков есть даже такой термин: «раковые семьи». В таких семьях рак перенесли не меньше сорока процентов кровных родных. Некоторые другие наследственные заболевания являются хорошей почвой для развития онкологии. Сегодня генетикам известны практически все гены, отвечающие за появление раковых опухолей. Поэтому, даже теоретически на консультации генетика можно обнаружить носителя «ракового гена» у детей и внуков.
К сожалению, методы молекулярной генетики достаточно дороги, поэтому широко использовать их на сегодняшний день невозможно. Поэтому главным методом работы генетика являются родословные.
Далеко не во всех случаях генетическая предрасположенность провоцирует развитие рака. Если выполнять меры профилактики, онкологическое заболевание с большой вероятностью можно предотвратить.
В первую очередь человек должен осознать сам, что он находится в группе риска по наследственному фактору. Поэтому очень важно получить грамотные советы специалиста по образу жизни, профессиональной деятельности, которые помогут предотвратить появление заболевания.
Например, людям, с наследственной предрасположенностью к раку кожи не следует долго находиться на солнце. Таким образом можно предотвратить появление опухоли.
Еще одним важнейшим методом профилактики семейного рака является выявление новообразований на ранней стадии. Голландские ученые, например, советуют всем людям, имеющим кровных родственников, больных раком, один раз в два года проходить обследование.
При различных формах рака и при разном возрасте пациентов промежутки между осмотрами могут быть больше или меньше. Но наиболее оптимальным в любом случае является срок в 12 месяцев.
Формы рака по характеру наследования
1. По наследству передается ген, провоцирующий какую-либо конкретную форму рака,
2. По наследству передается ген, увеличивающий вероятность заболевания,
3. Заболевание может развиться, если наследуется несколько признаков одновременно.
Несмотря на то, что науке сегодня известно около пяти десятков наследственных форм рака, наиболее часто встречающимися среди них, являются злокачественные новообразования:
- молочной железы,
- яичников,
- легкого,
- желудка,
- толстого кишечника,
- Злокачественная меланома,
- Острая лейкемия.
Кроме этого, нейробластомы, эндокринные неоплазии, ретинобластома, опухоль Вильмса.
Так как наследственный фактор – это только один из многих, для предупреждения рака желудка необходимо устранить из свой жизни максимальное количество подобных факторов.
Неграмотное питание
Это один из основных факторов, вызывающих карциному желудка. Обилие в рационе копчения, солений, вяленой пищи, продуктов, включающих большое количество нитратов, приводит к тому, что в пищеварительных органах скапливаются нитриты – вещества, вызывающие рост злокачественной опухоли. Скудное содержание в рационе растительной клетчатки (фруктов, овощей), а также витаминов С, А и Е увеличивает вероятность заболеть.
Распитие больших количеств алкоголя (больше относится к крепким напиткам) неблагоприятно влияет на состояние слизистой желудка и увеличивает вероятность онкологии.
Хронические заболевания желудка
Наиболее часто приводит к карциноме хронический атрофический гастрит. В процессе этого заболевания слизистая оболочка желудка постепенно становится похожей по строению на слизистую кишечника. Заболевание длится годами и часто протекает на фоне инфицирования хеликобактером пилори.
Полипы желудка являются доброкачественными новообразованиями. Но иногда они перерождаются в злокачественные. Поэтому врачи рекомендуют удалять их.
Резекция желудка также создает условия для развития карциномы. Такие пациенты в три раза чаще болеют раком желудка.
Язва желудка в полтора – два раза увеличивает вероятность карциномы.
Семейный диффузный полипоз толстого кишечника. Заболевание наследственное и врожденное. У половины пациентов появляются полипы не только в кишечнике, но и в желудке. А они достаточно легко малигнизируются (озлокачествляются).
Гастропатия гипертрофическая – при этом заболевании складки слизистой становятся толще, и увеличивается вероятность карциномы желудка.
Что делать?
- Максимально уменьшить долю копчений, солений, колбас.
- Увеличить долю овощей, фруктов и клетчатки. Рациональное питание с достаточным количеством всех элементов.
- Бросить курить и пить алкоголь.
- Вовремя посещать консультации гастроэнтеролога и проводить лечение полипов желудка и других хронических заболеваний.
- Лицам старше 45 лет ежегодно проходить обследование желудка даже при хорошем самочувствии.
Известны три гена, присутствие которых увеличивает вероятность карциномы молочной железы. Даже если у одного из родителей есть один из пораженных генов, вероятность его получить детьми составляет 50%.
Риск развития карциномы увеличивается если:
- У кого-либо из родных обнаружены злокачественные опухоли обоих желез,
- Карциномы у родных обнаружены в возрасте до 40 лет,
- Кто-либо из родных перенес карциному яичника,
- У кого-либо из родственников были онкологические заболевания в детстве,
- Среди родственников мужского пола кто-либо болел карциномой груди,
- Человек относится к этнической группе, в которой это заболевание бывает чаще,
- Женщина до 30 лет перенесла облучение молочных желез,
- Женщина не рожала,
- Первые роды пришлись на возраст после 35 лет,
- Слишком короткий период кормления грудью,
- Начало первой менструации до 12 лет,
- Женщина страдает лишним весом в период менопаузы.
Что делать?
- Раз в 6 месяцев посещать маммолога и гинеколога,
- Раз в 12 месяцев сдавать анализ крови на онкомаркеры,
- Рожать первого ребенка до 35 лет, а желательно двоих или даже троих, кормить их грудью как можно дольше,
- Уменьшить в рационе долю животных жиров, копчений, жареного, соленого,
- Заниматься физкультурой,
- По возможности следить за своим весом и стараться не набирать лишнего,
- Пить спиртного как можно меньше. Ведь даже малые количества алкоголя вполовину увеличивают риск заболеть карциномой,
- Беречь молочные железы от травм,
- Следить за содержанием витамина Д в рационе, его нехватка также может спровоцировать рост злокачественных клеток,
- Стараться избегать стресса и негативных эмоций.
При мутации гена BRCA 1 риск появления карциномы яичников возрастает в среднем на 50%. Если же мутирует ген BRCA 2, то вероятность заболевания увеличивается в среднем на 20%. При мутации гена PTEN у женщины развивается синдром Коудена, сочетающий в себе карциному груди, щитовидной железы и предрасположенность к опухоли яичников.
Можно сказать, что до сих пор не доказано определяющее влияние каких-либо факторов в развитии карциномы яичников. Поэтому и профилактика этого заболевания является довольно сложным и спорным вопросом. При этом существует несколько методов, позволяющих уменьшить риск заболевания. Перечисленные ниже методы влияют на вероятность заболеть в разной степени. Некоторые из них более доступны, некоторые менее. Тем не менее, при серьезной угрозе семейного рака следует обсудить с доктором эти методы.
Оральные противозачаточные средства
Они уменьшают вероятность заболевания наполовину, если прием препаратов длился от 5 лет и дольше.
Хирургические вмешательства
Удаление матки или перевязка фаллопиевых труб снижают вероятность карциномы яичников. Но подобные процедуры назначаются только при угрозе жизни пациентке, а вовсе не в профилактических целях.
Такие операции рекомендуют только в тех случаях, если семья действительно относится к «раковым» и лечить заболевание уже нужно.
Кроме этого, если у женщины наступил период менопаузы и существует большая вероятность развития карциномы. В любом случае о подобной операции можно говорить лишь после 40 лет.
Анальгетики
По некоторым не достаточно проверенным данным употребление аспирина и парацетамола может снизить вероятность развития карциномы яичников. Не следует принимать данные средства только в качестве профилактики рака.
Факторы, увеличивающие вероятность заболевания:
- Возраст после наступления менопаузы,
- Лишний вес. Индекс массы тела выше 30,
- Прием некоторых препаратов для лечения бесплодия (кломифена цитрат),
- Отсутствие продуктивных беременностей и кормления грудью,
- Прием препаратов мужских половых гормонов (даназол и другие андрогены),
- Заместительная терапия в период менопаузы на протяжении 5 – 10 лет. При употреблении одновременно эстрогена и прогестерона риск заболевания уменьшается,
- Рак груди у самой пациентки,
- Использование порошка талька,
- Высокий процент жира в рационе,
- Злоупотребление спиртным.
Гены, ответственные за возникновение заболевания, пока не выявлены.
Если уж в семье действительно есть несколько кровных родственников, страдающих злокачественной опухолью легких, остальным стоит подумать о профилактике.
Факторы риска:
- Мужской пол (мужчины болеют в шесть раз чаще женщин),
- Возраст от 50 лет и выше,
- Наличие карциномы другой локализации,
- Курение,
- Плохая экология, в том числе загазованность воздуха автомобильными выхлопами.
Что делать?
- Бросить курить, стараться не находиться в помещении, где курят,
- Поменять место жительства на более экологически чистое,
- Не работать в загрязненных дымом помещениях,
- Периодически проходить специальные обследования с целью своевременного выявления заболевания.
Как помочь себе бросить курить?
Проще отказаться от курения, если заменить сигареты другим видом никотина, например: пластырем, жевательной резинкой, пастилками или ингаляциями.
Врач может составить индивидуальный план отказа от курения, учитывающий все индивидуальные характеристики. Важным моментом в отказе от никотина является наличие отвлекающих маневров: например, пожевать ломтик сухофрукта или жвачку в то время, когда может захотеться покурить. Можно пойти почистить зубы. Важно быть постоянно занятым. Из дома следует выбросить все, что напоминает о курении: трубки, пепельницы и зажигалки. Нужно сообщить всем своим приятелям о том, что собираешься бросать курить и попросить их помощи.
К сожалению, у бросившего курить вероятность развития карциномы легких значительно выше, чем у того, кто никогда не брал в рот сигарету.
Наследственная форма карциномы тела матки может развиться при мутациях генов MSH6 и MLH1. При наличии таких мутаций вероятность заболевания увеличивается в среднем на 50%. Мутации в этих генах могут привести также к карциноме толстого кишечника.
Другие факторы риска:
- Повышенная масса тела. Если вес увеличен на 10 – 25 кг, вероятность развития заболевания возрастает в три раза,
- Сахарный диабет,
- Курение,
- Гипертония,
- Вирус папилломы человека,
- Длительный срок менструаций. Начало менструаций раньше 12 лет и окончание их позже 50 лет,
- Нерегулярные менструации,
- Повышенное количество жиров в меню,
- Возраст старше 55 лет,
- Наличие рака молочных желез или яичников,
- Отсутствие беременностей и родов,
- Роды в раннем возрасте,
- Употребление гормональных противозачаточных средств,
- Наличие хронических гинекологических заболеваний: эрозий, полипы, лейкоплакия, эндометрит,
- Беспорядочные половые связи.
Что делать?
- Нормализовать массу тела,
- Не запускать диабет,
- Откорректировать рацион, увеличив в нем долю овощей и фруктов,
- Вести здоровый образ жизни и заниматься зарядкой,
- Вовремя рожать не менее 2 детей,
- После 30 лет дважды в год посещать гинеколога,
- Не запускать гинекологические заболевания и обязательно их лечить,
- Уменьшить влияние канцерогенных факторов на организм.
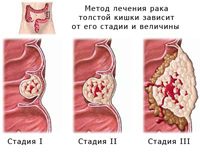
Все случаи карциномы толстого кишечника делят на семейные и спорадические. Семейных случаев приблизительно 15% от общего числа. Чаще всего пациент носит мутировавший ген длительное время без каких-либо негативных последствий. Но воздействие канцерогенных факторов внешней среды провоцируют развитие болезни. Факторы внешней среды могут вызвать и мутацию здоровых генов, что и бывает в большинстве случаев. В девяностые годы двадцатого века были обнаружены гены, мутация которых создает благоприятные условия для развития карциномы толстого кишечника.
Другие факторы риска:
- Возраст от 40 лет и выше,
- Онкологические заболевания половых органов (особенно у женщин),
- Воспалительный процесс в слизистой толстого кишечника,
- Раковые больные среди кровных родственников,
- Диета, содержащая большое количество мяса и малое количество клетчатки.
Что делать?
Все профилактические методы в данном случае делятся на первичные и вторичные.
Первичные – обнаружение и удаления факторов, провоцирующих заболевание и контроль над мутацией генов. Эта группа методов не является эффективной и даже более того, практически выполнить перечисленные методы невозможно.
Вторичная профилактика заключается в обнаружении полипов, в будущем перерождающихся в раковые опухоли и опухолей на такой стадии, когда их еще можно устранить без вреда для организма в целом. Поэтому людям с семейной историей карциномы толстого кишечника очень рекомендуется периодически проходить обследование и устранять полипы.
Кроме этого, увеличение клетчатки в рационе по некоторым данным также может снизить вероятность заболевания.
Наследственный полипозный синдром увеличивает вероятность заболевания в три – пять раз, а если не лечить заболевание, то уже к сорока годам практически в ста процентах случаев вызывает развитие карциномы. Большинство случаев карциномы у пациентов в возрасте до пятидесяти лет связано с наследственным фактором.
Другие факторы риска:
- Диета с обилием мяса,
- Возраст от 60 лет,
- Курение увеличивает риск заболевания и смерти от него на 35%,
- Малоподвижный образ жизни,
- Инфицирование некоторыми вирусами (ВПЧ),
- Злоупотребление спиртным,
- Работа на асбестном производстве, а также на деревообрабатывающих комбинатах,
- Аденома толстого кишечника,
- Иммунодефицит,
- Рак толстого кишечника или половых органов в прошлом.
Что делать?
- В профилактических целях принимать витамин В6. По некоторым данным он предупреждает развитие карциномы кишечника,
- Вести здоровый образ жизни и заниматься зарядкой,
- Изменить характер питания: ввести больше рыбы, овощей и фруктов, уменьшить долю красного мяса и жиров, кроме этого, рацион должен обеспечивать регулярную дефекацию,
- Расстаться с вредными привычками,
- По некоторым данным прием витаминов А, С, Е и группы В связывают канцерогены в кишечнике,
- При наличии полипов, геморроя или язв прямой кишки один раз в 12 месяцев необходимо посещать проктолога.
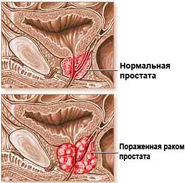
Статистика по карциноме предстательной железы практически ничем не отличается от статистики по другим видам рака. Десять процентов случаев обусловлено наследственностью. Среди мужчин моложе 55 лет половина имеет наследственную форму карциномы простаты.
Еще некоторое время назад считалось, что наследственную карциному излечить сложнее, однако недавно израильские ученые доказали, что «семейственность» заболевания не ухудшает прогноз для пациентов. Излечиваются они с тем же успехом, что и другие пациенты. Вероятность развития карциномы простаты увеличивается в два раза при наличии кровных родственников, страдающих этим заболеванием.
Факторы риска по мере значимости:
- Возрастные изменения в организме,
- Наследственная предрасположенность,
- Нарушение баланса питательных веществ в рационе (обилие жирной пищи, копчения, молочных продуктов, мяса, жареного и фаст-фуда),
- Хроническое отравление кадмием,
- Малоподвижный образ жизни,
- Недостаток витамина Д в рационе по некоторым данным может создавать благоприятные условия для развития заболевания,
- Наличие хронических урогенитальных инфекций.
Что делать?
- Вести здоровый образ жизни,
- Откорректировать рацион и максимально отказаться от вышеперечисленных продуктов,
- Заниматься физкультурой,
- Не менять часто половых партнерш,
- После 40 лет один раз в 6 месяцев посещать уролога,
- После консультации с врачом принимать курсы витамина Д.
Рекомендации по питанию для предотвращения карциномы простаты:
1. Жира в рационе должно быть не больше 20% по питательности.
2. Употреблять пищу, богатую витамином Е или принимать его в виде добавки по 800 МЕ в сутки.
3. Употреблять в пищу соевые продукты или соевый порошок. Вещества, находящиеся в сое, подавляют рост злокачественных опухолей.
4. Употреблять в пищу селен в виде биологически активной добавки или употреблять пищу, богатую селеном.
5. Есть помидоры, прошедшие термическую обработку. В них высокое содержание вещества ликопина, помогающего предотвратить онкологические заболевания.
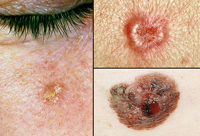
Американские исследователи из Калифорнии пошли еще дальше и обнаружили, что большему риску подвергаются те люди, у родных которых злокачественное новообразование появилось на открытом участке тела: кистях рук, лице.
Осторожность следует соблюдать и в том случае, если в семье есть множественные случаи альбинизма или пигментальной ксеродермы.
Другие факторы риска:
- Частый контакт с мышьяком, никотином, полициклическими ароматическими углеводородами (выделяются при сжигании различных отходов),
- Инфицирование ВПЧ,
- Обильное облучение ультрафиолетом,
- Частые термические ожоги,
- Травматизация кожи в одних и тех же местах, в том числе связанная с наличием кожных заболеваний.
Что делать?
- Защищать кожу от ультрафиолета,
- Защищать глаза, надевая солнцезащитные очки,
- Лечить все хронические заболевания, в том числе дерматологические,
- Тщательно выбирать косметику (учитывая возможность присутствия в ней ядовитых веществ),
- При наличии на теле родинок и родимых пятен обязательно показаться врачу с целью выявления потенциально опасных и склонных к малигнизации.
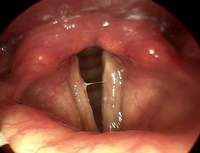
Факторы риска:
- Длительное курение. Особенно подвержены этому виду рака мужчины, курящие трубки. Это связано с тем, что в сигареты идет светлый табак, выделяющий дым, проникающий в самые отдаленные и мелкие бронхиолы, поэтому от сигарет скорее может развиться карцинома легких. А вот трубочный табак не обладает такой проникающей способностью, и большинство смол оседает в полости рта и в горле,
- Злоупотребление спиртным,
- Наследственная предрасположенность,
- Вирус папилломы человека,
- Наличие лейкоплакии, пахидермии, кист гортанных желудочков, а также хронических очагов воспаления,
- Нехватка витаминно-минеральных веществ в рационе,
- Рефлюкс-эзофагит,
- Частое вдыхание металлической пыли, радиоактивной пыли, химических реагентов,
- Принадлежность к негроидной расе,
- Наличие злокачественной опухоли в анамнезе.
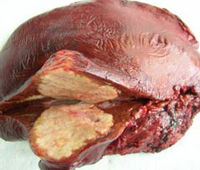
Наследственная предрасположенность к данному заболеванию не вызывает сомнения. Известно, что ряд наследственных заболеваний, например, гемохроматоз, являются хорошей базой для злокачественного перерождения печени. Поэтому при наличии семейного гемохроматоза необходимо обследовать всех новорожденных на наличие этого заболевания.
Другие факторы риска:
- Паразитарные заболевания (описторхоз, амебиаз и другие),
- Вирусные инфекции, в особенности гепатит В,
- Алкогольный цирроз,
- Воздействие токсинов, выделяемых грибами-аспергиллама (афлатоксины),
- Воздействие мышьяка.
Что делать?
- Вакцинироваться от гепатита В,
- Периодически проходить дегельминтизацию,
- Не пить спиртное,
- Уменьшить контакт с химическими ядами,
- Лечить наследственные заболевания, способствующие развитию карциномы печени. Например, при гемохроматозе рекомендуется уменьшить содержание железа в рационе и по показаниям врача делать кровопускания.
Факторы, провоцирующие гемобластозы:
- Генетическая предрасположенность,
- Влияние вирусов на клетки крови,
- Воздействие радиации,
- Воздействие канцерогенных химических веществ (неблагоприятная экология),
- Иммунодефицит,
- Стресс.
На сегодняшний день существуют анализы крови, по которым врач определяет наследственное ли заболевание крови или родственникам можно не беспокоиться.
Специфических методов профилактики лейкозов нет. Однако, людям, у которых есть кровные родственники, страдающие этим заболеванием, следует периодически проходить осмотр у гематолога и знать признаки этого заболевания, чтобы вовремя его обнаружить. При своевременном начале лечения прогноз его неплохой. Хорошо лечится лейкоз и у детей.
Консультация гематолога может понадобиться, если на лицо следующие симптомы:
- Побледнение кожных покровов,
- Слабость, вялость и падение трудоспособности,
- Уменьшение массы тела,
- Равнодушие к пище,
- Кровоточивость десен, склонность к синякам.
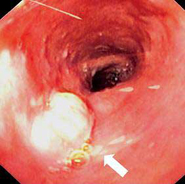
Именно поэтому людям с семейными случаями рака пищевода следует вовремя проходить обследования. Это позволит обнаружить заболевание на ранних стадиях и вовремя купировать его.
Факторы риска:
- Возраст от 50 лет,
- Наследственность,
- Приверженность к слишком горячей, холодной, острой, маринованной и жесткой пище,
- Злоупотребление спиртным,
- Курение и жевание табака,
- Хронические процессы: пептические язвы, ожоги, кардиоспазм, рефлюкс-эзофагит, дивертикулез.
К развитию заболевания могут привести также иные наследственные заболевания, например, кератодермия. При этом заболевании нарушается деление клеток плоского эпителия, покрывающего изнутри пищевод, и создаются благоприятные условия для малигнизации тканей. Кератодермия увеличивает вероятность злокачественного новообразования пищевода в десятки раз.
Что делать?
- Отказаться от курения,
- Отказаться от спиртного,
- Уменьшить долю пищи, травмирующей слизистую пищевода,
- Увеличить долю свежих фруктов и овощей в рационе,
- При наличии предраковых состояний стать на учет у врача и своевременно проходить обследования и лечение.
1. Хвоща полевого 15 гр., спорыша 8 гр., крапивы 10 гр., зверобоя 6 гр. Все хорошо перемешать и чайную ложку трав заварить 150 мл кипятка. Подержать 10 минут, пропустить через сито. Использованное сырье заварить 300 мл кипятка и держать на огне 10 минут, после чего сцедить и смешать с первым настоем. Пить по 150 мл трижды в сутки перед едой на протяжении 3 недель.
2. Свежие листья красной герани мелко нарезать, 12 столовой ложки сырья залить 150 мл кипятка, подержать 10 минут. Употребить за сутки понемногу.
3. Взять одинаковое количество омелы, ромашки, чистотела и катарантуса розового, перемешать. 1 ст. л. сырья залить стаканом кипятка. Дать настояться, пить по четверть стакана за 60 минут до еды. Этот сбор следует чередовать с таким: календула, тысячелистник, Марьин корень, корень одуванчика и бадана, цветы кипрея. Готовить так же, как предыдущий. Пить: утром первый, в обед второй и так чередовать.
4. Смешать одинаковые количества цветов гречихи, огуречной травы, репешка, медуницы и ярутки. 2 столовых ложки сбора заварить 300 мл кипятка, поставить на огонь до кипения, подержать 10 минут на малом жаре. Выстоять 2 часа и пропустить через сито. Употребить за день, разделив на три – четыре равные порции. Употреблять перед трапезой.
5. Мелко нарезать одинаковое количество ягод шиповника, плодов дикой яблони и груши, бузины, барбариса, боярышника, узколистного лоха. Делать отвар также как указано в №4.
6. Смешать 2 части порошка из корня цикория и по одной части гравилата городского и ягод китайского лимонника. Готовить и употреблять по рецепту №4.
7. Мелко нарезать по одной части корня лопуха, крапивы, пырея, медуницы и семечек большого подорожника, две части облепихи. Делать и принимать как в №4.
8. Иван-чая 10 гр. заварить 200 мл кипятка, держать на малом жаре четверть часа и оставить еще на час. Процедить и пить по одной столовой ложке трижды в сутки. Можно заваривать вместо чая.
9. 20 гр. сухой череды залить 200 мл воды комнатной температуры, нагреть до кипения, оставить на 60 минут настояться. Употреблять по 1 ст. л. трижды в сутки.
10. 1 ч. л. сухой душицы залить 200 мл кипятка, подержать двадцать минут, процедить. Употреблять по 100 мл трижды – четырежды в сутки за двадцать минут до трапезы. Запрещено во время беременности.
11. Спиртовой настойки календулы по 15 – 20 капель трижды в сутки пить, развести небольшим количеством воды. Можно сделать водный настой: 10 гр. сухого сырья заварить 100 мл кипятка, держать в термосе 2 часа. Употреблять по столовой ложке два или три раза в день.
12. 1 ст.л. травы и цветов мать-и-мачехи заварить 200 мл кипящей воды, подержать полчаса. Употреблять по 1 ст.л. четыре – пять раз в сутки. Употреблять по половине стакана дважды – четырежды в сутки.
13. Скорлупки от кедровых орешков залить водкой, чтобы были покрыты, закупорить и выдержать в кладовке 10 суток. Пить по 1 чайной ложке трижды в сутки.
14. Взять в равных частях: березовый лист, омелу, тимьян, буквицу, пижму, дурнишник, корень солодки, земляничный лист, ромашку, татарник, шиповник, аронию, чистотел, ежевику, зверобой, душицу, смородиновый лист, мяту, мелиссу, овес, лен, спорыш, бузину, крапиву, хвощ, родиолу розовую, фасолевые стручки, аралию, салеп, сабельник, маралий корень, лимонник и кирказон. Все измельчить и хорошо перемешать. 2 ст.л. сбора заварить 400 мл кипящей воды, подержать на малом огне до закипания и еще 3 минуты. Оставить на 60 минут, пропустить через сито и пить по 100 мл четырежды в день натощак.
Морковь
Бета-каротин, входящий в ее состав предупреждает рак гортани, легких, кишечника, груди и простаты. Кроме этого, в составе моркови присутствует фалкаринол – пестицид натурального происхождения, подавляющий развитие злокачественных опухолей. Полезна как в цельном виде, так и в виде соков. Для профилактики достаточно одной среднего размера морковки в сутки.
Яблоки
Совершенно точно известно, что ежедневное поедание яблок уменьшает вероятность развития рака кишечника. В яблоках присутствует вещество антоциан. Количества антоциана, соответствующее его содержанию в трех плодах, достаточно для уменьшения риска развития рака молочной железы на 38%. Кроме этого, яблоки богаты витамином С – сильным антиоксидантом.
Черника
В составе этих ягод присутствует сильный антиоксидант птеростильбен, предупреждающий злокачественные опухоли кишечника. Присутствие этого вещества в рационе на 58% снижает вероятность развития заболевания. Достаточно будет горсти ягод черники в день.
Лук
В луке высоко содержание биофлавоноидов – веществ, подавляющих свободные радикалы. Чем «злее» лук, тем эффективнее его употребление.
Авокадо
Это кладезь антиоксидантов, предупреждающих разрушение клеток свободными радикалами. Кроме этого, авокадо содержит бета-каротин и калий.
Капуста
Этот овощ предупреждает развитие рака кишечника и груди. В нем присутствует вещество фолат, которое благотворно влияет на состояние клеток кишечника. А для предотвращения рака груди следует употреблять в пищу различные виды капусты, содержащие разные виды антиоксидантов. Комбинация этих антиоксидантов среди специалистов называется 13С. Комбинация настолько эффективна, что ее применяют не только для профилактики, но и для лечения онкологических заболеваний в сочетании с химиотерапией. Конечно, для лечения необходима доза антиоксидантов, содержащаяся в нескольких кочанах капусты. Однако в качестве профилактики даже тарелка салата в день будет полезной.
Брокколи
В ней много глюкозинолатов – веществ, до недавнего времени считавшихся токсинами. Сегодня диетологи утверждают, что эти вещества подавляют раковые клетки и усиливают работу иммунитета против болезнетворных агентов.
По мнению американских и французских ученых трех – четырех порций брокколи в неделю будет достаточно для профилактики. Самым полезным способом приготовления брокколи является варка на пару. При покупке лучше обратить внимание на головки более мягкие. В них содержание активных компонентов выше.
Кресс-салат
В этом салате высок уровень бета-каротина и лютеина – веществ, активно предупреждающих озлокачествление клеток. Просто незаменимый продукт для курильщиков. В сутки довольно 90 граммов кресс-салата.
Перец чили
Капсаицин, входящий в него, предупреждает озлокачествление клеток и разрушает митохондрии уже существующих злокачественных клеток. Но в больших количествах может сам спровоцировать злокачественные опухоли пищевода и кишечника.
Томаты
В томатах содержится вещество ликопин – один из самых сильных антиоксидантов, который уменьшает вероятность развития опухолей легких, мочевого пузыря, груди, кишечника и простаты, связывая свободные радикалы. В томатах высокий уровень аскорбиновой кислоты. Очень эффективна комбинация капусты брокколи и томатов для профилактики и лечения онкологических заболеваний. Самая эффективная доза ликопина составляет всего 22 миллиграмма, то есть 2 чайные ложки томатной пасты в сутки. Сильнее действие ликопина, прошедшего термическую обработку.
Чеснок
Подавляет активность канцерогенов и предупреждает их проникновение в клетки организма. Даже при существующей опухоли тормозит ее развитие. Чеснок полезен как в виде добавки к пище, так и в виде спиртовых настоев.
Зеленый чай
Предупреждает развитие рака пищевода, кожи, кишечника, поджелудочной, желудка, мочевого пузыря, груди и простаты. В составе зеленого чая присутствуют полифенолы, являющиеся сильными антиоксидантами. По некоторым данным полифенолы ухудшают кровоснабжение измененных клеток. Кроме этого, зеленый чай подавляет синтез особого вида белка, необходимого для раковых клеток. Для профилактики следует употреблять не менее 5 чашек чая в сутки.
Розмарин
Полезен для профилактики рака молочной железы. Розмарин очень эффективен в виде свежей приправы к блюдам, салатам.
Морские водоросли
Включают в себя витамин В12, бета-каротин, хлорофилл, жирные кислоты, которые предупреждают развитие рака груди.
Куркума
Влияет не напрямую на злокачественные клетки, а на механизмы, приводящие к их появлению. В частности подавляет производство ферментов, участвующих в воспалении кишечника.
Врачи не советуют заниматься самостоятельным «назначением» себе лекарственных средств для профилактики рака. Но у некоторых препаратов действительно в качестве побочного эффекта есть и способность подавлять развитие раковых клеток.
1. Аспирин. По некоторым сведениям уменьшает вероятность развития рака легких, груди, желудка, кишечника.
2. Ибупрофен, сулиндак, пироксикам. Уменьшает вероятность развития рака толстой кишки.
3. Препараты кальция (глюконат кальция, глицерофосфат кальция, карбонат кальция, лактат кальция, хлорид кальция) предупреждают усиленный рост клеток слизистой кишечника, поэтому профилактируют полипы и злокачественные новообразования.
4. Проскар (финастерид) – используется для лечения аденомы и рака простаты, его можно применять и в качестве профилактики.
5. Статины – препараты, уменьшающие количество холестерина в крови. По данным американских ученых у женщин в период постменопаузы уменьшают вероятность развития карциномы молочной железы, если принимать их достаточно долго (более 5 лет).
6. Витамины С, Е, А, Д, В6, В3.
Так как все перечисленные выше препараты (кроме витаминов) имеют и побочные эффекты, не следует принимать их без консультации с врачом.
Автор: Пашков М.К. Координатор проекта по контенту.
источник