Сравнительная оценка и совершенствование методов вторичной профилактики рака молочной железы Демидов Денис Александрович
480 руб. | 150 грн. | 7,5 долл. ‘, MOUSEOFF, FGCOLOR, ‘#FFFFCC’,BGCOLOR, ‘#393939’);» onMouseOut=»return nd();»> Диссертация — 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
Автореферат — бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Демидов Денис Александрович. Сравнительная оценка и совершенствование методов вторичной профилактики рака молочной железы : диссертация . кандидата медицинских наук : 14.01.12 / Демидов Денис Александрович; [Место защиты: ГОУВПО «Башкирский государственный медицинский университет»].- Уфа, 2010.- 104 с.: ил.
Глава 1 Рак молочной железы, патогенез пролиферативных дисплазий и методы оценки пролиферативной активности
1.1 Статистика заболеваемости и смертности от рака молочной железы 10
1.2 Патогенез пролиферативных дисплазий и их связь с развитием рака молочной железы 15
1.3 Эволюция методов оценки пролиферативной активности 23
Собственные исследования 29
Глава 2 Материалы и методы исследования 29
Глава 3 Лечение пролиферативно-диспластических фиброадсноматозов молочных желез 41
3.1 Коррекция гормонального дисбаланса у женщин с пролиферативными дисплазиями молочных желез прогестинами 41
3.2 Коррекция гормонального дисбаланса у женщин с пролиферативными дисплазиями молочных желез антиэстрогенами 44
3.3 Коррекция гормонального дисбаланса у женщин с пролиферативными дисплазиями молочных желез гормональными контрацептивами 46
3.4 Коррекция гормонального дисбаланса у женщин с пролиферативными дисплазиями молочных желез производными этинилтестостерона 50
3.5 Сравнение результатов лекарственного лечения 5 I
Глава 4 Комбинированное лечение пролиферативно-диспластических фиброадсноматозов молочных желез сложно-модулированным низкочастотным электромагнитным полем 53
4.1 Лечение пролиферативных дисплазии молочных желез прогестинами в комбинации с электромагнитным полем 53
4.2 Лечение пролиферативных дисплазии молочных желез антиэстрогенами в комбинации с электромагнитным полем 55
4.3 Лечение пролиферативных дисплазии молочных желез гормональными контрацептивами в комбинации с электромагнитным полем 57
4.4 Лечение пролиферативных дисплазии молочных желез производными 17-этинилтестостерона в комбинации с электромагнитным полем 59
4.5 Сравнение результатов комбинированного лечения 60
Глава 5 Коррекция пролиферативной дисплазии молочных желез низкочастотным электромагнитным полем 63
Глава 6 Сравнение результатов всех методов лечения 68
Практические рекомендации 83
Актуальность исследования
Ежегодно в мире регистрируется более 1 млн новых случаев рака молочной железы (РМЖ), а к 2010-му году прогнозируется рост числа заболевших до 1,5 млн. Данная проблема является одной из приоритетных в онкологии. Рак молочной железы в России в течение последних 20 лет занимает первое место в структуре онкологической заболеваемости и смертности женщин. Ежегодно в России выявляется около 50 тыс. случаев рака молочной железы, что составляет почти пятую часть (19,8 %) от всех опухолей у женщин. Ежегодно от рака молочной железы умирают более 20 тыс. россиянок [Давыдов М. И., Аксель Е. М., 2007].
Наиболее перспективным направлением снижения заболеваемости раком молочной железы в настоящее время является вторичная профилактика: раннее выявление и лечение предопухолевых заболеваний молочных желез, ранняя диагностика путем различных вариантов скрининга, так как эффективные пути первичной профилактики опухолей пока не разработаны и нарастание частоты заболеваемости находится вне реального контроля [Берзин С. А., Мельников Д. Ю., 1996; Демидов С. М., 2001; Ханафиев Г. Х. и др., 2003].
В настоящее время обнаружено не менее 80 факторов риска развития рака молочной железы, и их поиск постоянно продолжается [Летягин В. П. и др., 2006; Семиглазов В. Ф. и др., 2006; Dumitrescu R. G., Cotarla I., 2005]. Это – генетические факторы – носители мутантных генов BRCA1 и BRCA2, мутации других генов – p53, ATM, NBS1, LKB1; возраст свыше 60 лет; репродуктивные, гормональные и обменные нарушения; сахарный диабет; болезни печени; заместительная гормональная терапия; воздействия ионизирующей радиации и химических канцерогенов.
Невозможно выделить основные факторы, и тем более подвергнуть их контролю. Это еще раз подтверждает сложность первичной профилактики рака молочной железы; определяет необходимость не только выявления предопухолевых состояний молочной железы, но и их лечения.
Сложившаяся ситуация настоятельно требует внедрения в лечебную практику новых современных технологий, учитывающих особенности патогенеза пролиферативных дисплазий молочной железы, направленных на достижение длительного терапевтического эффекта, снижение медикаментозной нагрузки на организм женщины, сокращение частоты рецидивов предрака, малигнизации и улучшение качества жизни.
Цель исследования
Улучшить результаты вторичной профилактики рака молочной железы.
Задачи исследования
Провести анализ эффективности лекарственной профилактики рака молочной железы на основании изучения динамики показателей пролиферации.
Определить перспективы дальнейшего развития (совершенствования методов) вторичной профилактики рака молочной железы.
Провести сравнительную оценку эффективности лекарственной профилактики рака молочной железы, методики биорегулируемого сложно-модулированного низкочастотного электромагнитного поля и их комбинации.
Определить показания и противопоказания к применению биорегулируемого сложно-модулированного низкочастотного электромагнитного поля для снижения пролиферативной активности у больных с очаговой формой фиброзно-кистозной мастопатии с пролиферацией и дисплазией.
Научная новизна исследования
Научно обосновано, что эффективная лекарственная профилактика рака молочной железы приводит к снижению индекса пролиферативной активности.
На основании сравнительного анализа методов лекарственной и комбинированной профилактики рака молочной железы с использованием сложно-модулированного низкочастотного электромагнитного поля, получены новые данные о том, что клинические, инструментальные и стандартные методы морфологического исследования недостаточно характеризуют динамику очаговой формы фиброзно-кистозной мастопатии.
Впервые доказано, что лекарственная терапия, в комбинации с сложно-модулированным низкочастотным электромагнитным полем, при лечении очаговой формы фиброзно-кистозной мастопатии с пролиферацией и дисплазией обладает большей клинической и морфологической эффективностью, чем при использовании данных методов лечения по отдельности.
Впервые установлено, что применение сложно-модулированного низкочастотного электромагнитного поля в лечении женщин с очаговой формой фиброзно-кистозной мастопатии с пролиферацией и дисплазией приводит к снижению степени дисплазии и индекса пролиферативной активности.
Практическая значимость работы
Разработанная методика оценки эффективности лекарственной профилактики рака молочной железы, с использованием иммуногистохимического метода, позволяет улучшить мониторинг лечения больных с предраковыми заболеваниями молочной железы. Разработана методика комбинированного лечения очаговой формы фиброзно-кистозной мастопатии с пролиферацией и дисплазией с использованием сложно-модулированного низкочастотного электромагнитного поля для улучшения результатов вторичной профилактики рака молочной железы.
Внедрение результатов исследования в практику
Разработанный способ контроля эффективности лечения предрака молочной железы и способ комбинированного лечения очаговой формы фиброзно-кистозной мастопатии с пролиферацией и дисплазией, с применением сложно-модулированного низкочастотного электромагнитного поля, внедрен в практику работы онкомаммологического центра муниципального учреждения «Городская клиническая больница № 40» (МУ ГКБ № 40) г. Екатеринбурга, медико-санитарной части (МСЧ) № 70 г. Екатеринбурга, МСЧ «ОАО» УЭТМ, Медицинского центра Первоуральского новотрубного завода группы ЧТПЗ, КДП № 94 Приволжского уральского военного округа; включен в материалы лекций и семинаров на кафедре онкологии и медицинской радиологии Государственного образовательного учреждения высшего профессионального образования «Уральская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Положения, выносимые на защиту
Клинически эффективные методы лечения очаговой формы фиброзно-кистозной мастопатии с дисплазией снижают степень пролиферации.
Существующие методы контроля вторичной профилактики рака молочной железы не дают полной картины течения очаговой формы фиброзно-кистозной мастопатии.
Комбинирование лекарственных препаратов и сложно-модулированного низкочастотного электромагнитного поля повышает эффективность лечения предраковых заболеваний молочной железы, снижает степень дисплазии.
Сложно-модулированное низкочастотное электромагнитное поле улучшает клиническое и морфологическое течение очаговой формы фиброзно-кистозной мастопатии.
Апробация работы
Основные положения диссертации доложены и обсуждены на X Российском онкологическом конгрессе (Москва, 2006) и VI Международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы» (Санкт-Петербург, 2009).
Диссертация доложена и обсуждена на совместном заседании кафедр онкологии и медицинской радиологии, общей хирургии, терапии с курсом эндокринологии, акушерства и гинекологии ГОУ ВПО «Уральская государственная медицинская академии Росздрава» (протокол от 21 октября 2009 г. № 2/09), на заседании кафедры хирургии и онкологии с курсом ИПО ГОУ ВПО «Башкирский государственный медицинский университет Росздрава» (протокол от « » _________ 2009 г. № _____).
Диссертация апробирована на заседании диссертационного совета Д 208.006.04 при ГОУ ВПО «Башкирский государственный медицинский университет Росздрава» (протокол от « __» _________ 2010 г. № ___).
Соответствие диссертации паспорту научной специальности
Научные положения диссертации соответствуют формуле специальности 14.01.12 – «Онкология» (медицинские науки). Результаты проведенного исследования соответствуют области исследования данной специальности, конкретно пунктам 2 и 3 паспорта научной специальности.
По теме диссертации опубликовано пять научных работ, в том числе две в журналах, включенных в перечень рецензируемых журналов и изданий, рекомендованных Высшей аттестационной комиссией Министерства образования и науки Российской Федерации для публикации основных результатов диссертаций на соискание ученой степени кандидата медицинских наук.
Объем и структура диссертации
Диссертационная работа изложена на 109 страницах, содержит 25 таблиц и 6 рисунков. Она состоит из введения, обзора литературы (три главы), собственных исследований (шесть глав), заключения, выводов и практических рекомендаций. Список литературы содержит 192 источника (120 отечественных и 72 зарубежных).
Изучение факторов пролиферативной активности (ПА) весьма актуально. Одним из перспективных направлений исследований в данной области является иммуногистохимическое изучение пролиферативной активности [БеккерВ. Ю., 1999].
Иммуногистохимия (ИГХ) — это один из методов исследования биологических объектов, изучаемых под микроскопом. Иммуногистохимические методы были предложены сравнительно недавно. Авторами этого метода по праву считается группа исследователей под руководством Альберта Кунса Coons A. et al., 1941, 1945], которые впервые получили меченные флюоресцеином антитела и применили их в диагностических целях. Более широкое распространение иммуногистохимия получила в 1970-е годы, после публикации Taylor и Burns, продемонстрировавших наличие иммуноглобулинов в плазматических клетках. Последующие годы были отмечены не только совершенствованием самого метода, но и расширением сфер его применения. Особенно бурное развитие иммуногистохимии наблюдается с начала 1980-х годов, с момента широкого внедрения моноклональных антител [Петров С. В. и др., 1998].
За последние 10-15 лет достигнуты большие успехи в изучении иммуногистохнмических факторов, отражающих разные стороны и уровни функционирования клетки, и дающих возможность определить активность течения заболевания [Пожарисский К. М., Леенман Е. Е., 2000].
Иммуногистохимия имеет своей целью установление локализации антигенов в определенных компонентах тканей, типах клеток и клеточных структурах с помощью специфических антител, т.е. иммуногистохимические реакции перенесены на предметное стекло морфолога [Петров СВ. и др., 1998]. Применение иммуногистохимии значительно расширило возможности морфологии, как и в изучении этиологии, патогенеза патологических процессов, так и в рутинной диагностической практике [Гуревич Л. Е., Исаков В. Л., 1999]. Методы иммуногистохимии широко используются во всех областях биологических наук. Этими методами определяются различные компоненты тканей (in situ) посредством специфической реакции антиген-антитело, которые метятся краси і елями, видимыми при микроскопическом исследовании. Возможность проведения реакции обеспечивается за счет наличия антигена в клетках или межклеточном вещеове и готовыми антителами. Имеется большое количество антител, выявляющих экспрессию тех или иных белков, связанных с определенными оріанами, тканями, типами клеток и их пролиферативной активностью [ПетровС. В. и др., 1998].
Делению клеток предшествует редупликация их хромосомного аппарата, синтез ДИК. Весь клеточный цикл состоит из 4 отрезков времени: собственно митоза (М), пресинтетического (G1), синтетического (S) и носі синтетического (G2). Клетки, находящиеся как бы вне цикла (GO), не делятся. В нормальных тканях и большинстве медленно пролиферирущпх новообразований с низким грейдом приблизительно 85 % популяции клеток находятся в фазах GO и G1, остальное 15 % клеток — в S-, G2- и М-фаза\ клеточного цикла [Ross J. S., 1996].
В клетках, предшествующих развитию опухолей, происходят сложные генетические изменения, приводящие к нарушению темпа пролиферации клеток fOijen М. et al., 1998]. Степень пролиферативной активности клеюк можно изучать путем выявления пролиферирующих клеток разными методами (таблица 4) [Ross J. S., 1996]. На протяжении десятилетий репродукцию клеток исследовали с помощью подсчета митозов.
В световом микроскопе при рутинных окрасках можно выявить только митозы клеточного цикла, что соответствует М-фазе, а это является лишь коротким отрезком от общего времени цикла. Например, относительная длительность М-фазы опухолевых клеток рака молочной железы составляет лишь 5,04 % от общего времени клеточного цикла [Упоров А. В. и др., 2000).
В 1970-1980-е годы в морфологии использовались инкорпоративиые методы изучения клеточного деления, основанные на принципе поглощения делящимися клетками меченых метаболитов, участвующих в синтезе ДМ К, — тимидина, меченного тритием, или бромодиоксиуридина (БДУР, BrdU), с их последующей радиоавтографической или иммуногистохимической детекцией [Коршунов Л. Г., Сычева Р. В., 1996J. Однако в последнее время разработаны новые, более информативные, методические подходы для определения особенностей пролиферации клеток. В настоящее время чаще используется метод иммуногистохимического выявления в ядрах клегок белков, принимающих участие в процессе клеточного деления, белка Ki-67 (Mib-1), дезоксирибонуклеазы (ДНК-азы) и антигена ядер пролиферирующих клеток PCNA (proliferating cell nuclear antigen). Метод исследования пролиферативной активности с использованием антител к ДМК-азе не нашел широкого применения ввиду отсутствия «коммерческих» антител [Коршунов А. Г., Сычева Р. В., 1996.
Несмотря на некоторые неясные вопросы о приуроченности PCNA к определенным фазам митотического цикла и на возможность его участия в репарации ДНК, он нашел широкое применение в онкоморфологпи. Использование PCNA сопровождается окрашиванием слишком большого количества клеток, не соответствующего пролиферативным потенциям ткани [Пожарисскпй К. М., Леенман Е. Е., 2000], и может стать причиной переоценки степени пролиферативной активности ткани [Ross J.S., 1996. PCNA — это дополнительный белок фермента ДНК-азы (кофактор ДНК полимеразы) с молекулярной массой 36 кДа, который играет ключевую роль в процессе редупликации ДНК через активацию вышеупомянутого фермента. Экспрессия PCNA начинает выявляться в ядре делящейся клетки в фазе GI. достигает максимума в фазе S, и постепенно снижется к концу фазы G2 [Коршунов А. Г., Сычева Р. В., 1996; Ross J. S., 1996].
Оптимальным и более специфическим пролиферативным маркером для широкого использования в патологоанатомической практике является Кі-67 Богданова Т. И. и др., 2000; Пожарисский К. М., Леенман Е. Е., 2000; Упоров А. В. и др., 2000]. Антиген Кі-67, впервые описан Gerdes и соавт. в 1983 г., состоит из двух полипептидных цепей с молекулярной массой 345 и 395 кДа. Это основная часть нуклеарного матрикса в течение интерфазы, ассоциирующаяся с хромосомами фазы митоза [Oijen М. et al., 1998]. Кі-67 является димерной молекулой, имеющей тесную связь с 10-й хромосомой, конкретная роль этого протеина в процессе клеючного деления до сих пор неизвестна [Коршунов А. Г., Сычева Р. В., 1996]. Экспрессия Кі-67 позволяет выделить клетки, находящиеся в активной фазе клеточного цикла на всём его протяжении (GI-, S-, G2- и М-фазы), кроме GO-периода [Ross J. S., 1996; Oijen M.etal., 1998].
Коррекция гормонального дисбаланса у женщин с пролиферативными дисплазиями молочных желез прогестинами
Основным результатом действия прогестинов считается антагонистический эффект по отношению к эстрогенам. Изучение действия экзогенных прогестинов на ткань молочной железы предполагает опосредованное, через пролактин, блокирование рецепторов эстрогенов и связь с рецепторами прогестерона, а также действие на уровне гонад путем торможения некоторых ферментов, участвующих в выработке стероидов. Исходя из концепции нейтрализующего, антагонистического действия прогестинов в отношении эстрогенов, в литературе предлагается применение прогестинов или препаратов, сочетающих прогестерон и эстрогены, как профилактическое средство у женщин в менопаузе при гиперпластических процессах молочной железы и эндометрия.
Лечение прогестинами проводилось после гинекологического обследования: в детородном возрасте после оценки менструальной функции, функциональных тестов гормонального статуса по типу , влагалищного мазка, кариопикнотическому индексу и состоянию эндометрия, устанавливаемого путем исследования аспирата из полости матки, и сонографическому исследованию. При недостаточности желтого тела и относительном гиперэстрогенизме, вызванном персистенцией фолликула, мы проводили гормонотерапию прогестинами во второй половине менструального цикла в течение 10-12 дней (обычно 16-25-й день цикла) в таком режиме (таблица 7).
Прогестины выпускаются в различных лекарственных формах, каждая из которых обладает теми или иными преимуществами и недостатками. В нижеприведенной таблице 7 указаны названия, формы выпуска и дозировки наиболее часто используемых прогестинов, которые применяются при лечении полиферативной мастопатии.
В случаях недостаточной эффективности оральных прогестинов и прогестинов местного действия, назначалась или дополнялась терапия пролонгированными прогестинами (таблица 8). Лечение проводилось под наблюдением гинеколога-эндокринолога с контрольными исследованиями аспирата эндометрия 1 раз в 2—3 месяца.
Описанные выше схемы гормонотерапии проводились в течение 3—6 месяцев с контрольными осмотрами через 2—3 месяца.
При наличии положительной динамики в виде подавления пролиферации и дисплазии в эпителии молочной железы и эндометрия, лечение прекращалось. В некоторых упорно текущих случаях проводилась поддерживающая терапия в половинных дозах до 9-12 месяцев. Результаты лечения представлены в таблице 9.
Общая эффективность лечения нрогестинами составила 76,6 процента. Хорошие результаты были отмечены у больных обеих возрастных групп — от 21 года до 30 лет и от свыше 30 до 40 лет, где отмечен положительный эффект о і лечения в виде существенного уменьшения пролиферации и подавления дисплазии в 77,4 % и 75,7 % случаев соответственно, только в 17,2 % случаев лечение было без эффекта: в 16,1 % — в возрастной группе 21 год -30 лет и 18,2 % в возрастной группе свыше 30-40 лет.
Отрицательные результаты получены в возрастной группе 21—30 лет в 6,5 % случаев, в возрастной группе св. 30-40 лет — в 6,1 % случаев. Общие отрицательные результаты получены в 6,2 % случаев. Исследование менструальной функции у больных, получивших гормонотерапию ирогестинами, показало, что у 87,5 % больных (14 из 16 женщин) наряду с подавлением пролиферативпо-диспластических изменений в молочных железах произошло уменьшение или подавление гнперпластичееких процессов и в эндометрии.
У большинства больных нормализовались характер и ритмичность менструальных циклов — у 18 из 22, где нарушение имело место, т.е. у 81,8 % женщин.
Последующее наблюдение за группой больных с положительными результатами от применения прогестинов показало, что достигнутый эффект был стойким. Рецидив пролиферативной фиброзно-кистозной мастопатии (ФКМ) с диснлазией I—11 ст., который проявился узлообразованием, возник лишь у 4 больных. В дальнейшем им были назначены другие виды терапии.
Таким образом, ирогестины представляют собой эффективное средство для лечения проявлений фиброзно-кистозной мастопатии и эндометриоза. Однако, как и многие другие гормональные препараты, они обладают побочными эффектами, которые многие женщины находят непереносимыми. Многие врачи находят их применение подходящим для женщин, которым необходимо длительное и повторное лечение.
В течение последних 35 лет в клинической практике для лечения рака молочной железы широкое применение нашли синтетические соединения, называемые нестероидными антиэстрогенами. Биохимически их нестероидная структура существенно отличается от андрогенов и прогестинов, также блокирующих влияние эсградиола на ткани-мишени. Как было показано, аптиэстрогены наиболее эффективны при лечении опухолей, содержащих эстрогепно-рецепторные белки. биохимические и фармакологические исследования показали, что в опухоли антиэстрогены взаимодействуют с эстрогенными рецепторами и практически выключают их промоторный механизм, что приводит к замедлению роста. Пролифератпвно-диспластические процессы в молочных железах, генерируемые п стимулируемые эстрогенами, несомненно, управляются ими тем же путем, что и высокодифференцированные раковые опухоли, т.е. через воздействие на рецепторы. Поэтому, мы сочли логичным изучить возможность подавления явлений пролиферации и дисплазии при фиброаденоматозах молочных желез антиэстрогенными препаратами.
Лечение антиэстрогенами (Тамоксифен, Фарестон) мы провели у 68 больных с пролиферативными дисплазиями молочных желез. Результаты представлены в таблице 10.
Коррекция гормонального дисбаланса у женщин с пролиферативными дисплазиями молочных желез производными этинилтестостерона
Из производных 17-этинилтестотерона использовался Даноген-200 (Даназол, Ф. США — 200 мг, Cipla LTD, Индия), содержащий 200 мг даназола в капсуле.
Препарат принимался перорально 1 раз в сутки после еды, лечение проводилось от 2 до 3 месяцев. Положительный эффект получен у большинства пациенток (таблица 12).
Общая эффективность лечения составила 73,5 процента. Наибольшая эффективность в виде подавления и снижения степени диеллазии отмечена, у больных в возрасте 21-30 лет — 73,9 %, в группе св. 30-40 лет результаты были чуть ниже 73,1 процента. Без эффекта от проведенного лечения остались 17,4 % в возрастной группе 21-30 лет и 19,2 % — в группе св. 30-40 лет. Отрицательные результаты получены в возрастной группе 21—30 лет у 8,7 % и в группе св. 30-40 лет — у 7,7 % больных.
Таким образом, эффективность лечения пролиферативных дисплазий молочных желез производными 17-этинилтестостерона оказалась одинаково эффективной в обеих возрастных группах.
Обобщенные результаты снижения степени дисплазии пролиферативно-диспластических фиброаденоматозов всеми изучавшимися нами препаратами представлены в таблице 13, из которой видно, что в целом все они оказались, хоть и в разной степени, но высоко эффективными: прогестины — 76,6 %, аишэстрогены — 72,1 %, гормональные контрацептивы — 78,6 %, производные 17-этинилтестостерона — 73,5 %. Общая эффективность лечения составила 76,5 %, без эффекта — 19,9 %, отрицательные результаты — 4,8 %.
У всех групп пациентов, получавших лекарственные препараты, отмечена положительная динамика вне зависимости от степени экспрессии Ki-67. Статистически значимая (р 0,()5) положительная динамика экспрессии белка Ki-67 была отмечена только после лечения прогестинами, антиэстрогенами и производными 17-этинилтестостерона (таблица 14).
При сравнении больных возрастных групп 21—30 лет и св. 30—40 лет, у всех применявшихся классов препаратов (прогестины, антиэстрогены, гормональные контрацептивы, производные 17-этинил тестостерона) при оценке индекса пролиферации отмечаются одинаковые результаты лечения (отличия не являются статистически значимыми). После лекарственного лечения всеми классами препаратов экспрессия белка Ki-67 снижается на 30 процентов.
Для лечения мы использовали: прогестерон, идентичный натуральному (Прожестожель гель, Утрожестан) и его синтетические производные: Дидрогестерон (Дюфастон), Медроксипрогестерона ацетат (Провера, Раловера), Ыорэтистерон (Примолют Н, Норколут). Из-за невозможности длительного совмещения и продолжительности лечения применение прогестипов пролонгированного действия мы сочли нецелесообразным.
В качестве источника сложно-моделированного низкочастотного электромагнитного поля использовался аппарат биорегулируемой низкочастотной электромагнитной терапии АНЭб-01 -«Гефест». Все больные получали от 40 до 60 сеансов. Использовалось 4 индуктора и датчик обратной связи. Два индуктора устанавливали паравертебрально на воротниковую область в проекции шестого и седьмого шейных позвонков, другие два индуктора располагали последовательно на зону молочных желез, перемещая 2—3 раза во время сеанса. Датчик обратной связи устанавливали в надключичную область справа. Экспозиция сеанса- от 12 до 24 минут.
В группы для исследования были взяты пациентки в возрасте от 21 года до 40 лет, общей численностью 45 человек. Лечение проводилось после гинекологического обследования: в детородном возрасте — после оценки менструальной функции, под наблюдением гинеколога-эндокринолога функциональных тестов гормонального статуса по типу влагалищного мазка, состоянию эндометрия, устанавливаемого путем сонографического исследования и (или) аспирата из полости матки. При недостаточности желтого тела и относительном гиперэстрогенизме, вызванном нерсистенцией фолликула, мы проводили гормонотерапию прогестипами во второй половине менструального цикла в течение 10-12 суток (обычно 16-25-е сутки цикла).
Лечение пролиферативных дисплазии молочных желез гормональными контрацептивами в комбинации с электромагнитным полем
Для лечения мы использовали оральные контрацептивы, содержащие гестоден, дезогестрел и норгеетимат, а также препараты с отсутствием эстрогенового компонента этинилэстрадиола, и схемы непрерывного применения комбинированных оральных контрацептивов (КОК). Благодаря отсутствию в КСП эстрогенного компонента и непрерывного режима их приема, в организме женщины не происходят колебания концентрации эстрогенов, в результате чего нет избыточной стимуляции молочной железы как органа-мишени. Мами использовался марвелон — прогестагендоминантный контрацептив, содержащий дезогестрел (прогестаген третьего поколения), обладающий высокой прогестагенной активностью, высоким сродством к рецепторам прогестерона.
Также для лечения больных с пролиферативными дисплазиями молочных желез нами использовались комплексные оральные контрацептивы: овидон, ригевидон, норколут а чаще тризистон, триквилар, три-регол, жанин, ярина, как наиболее физиологичные, содержащие синтетические прогестины в сочетании с крайне невысокими дозами эстрогенов.
Лечение назначалось с учетом характера гормональных нарушений, по рекомендованной в инструкции схеме. Одновременно обеспечивался и контрацептивный эффект.
В качестве источника сложно-моделированпого низкочастотного электромагнитного поля использовали аппарат АНЭб-01-«Гефест». Все больные получали от 40 до 60 сеансов. Экспозиция сеанса — от 12 до 24 минут.
В группы для исследования были взяты пациентки в возрасте от 21 года до 40 лет, общей численностью 65 человек. Лечение проводилось после гинекологического обследования и оценки менструальной функции, под наблюдением гинеколога. При наличии положительной динамики в виде подавления пролиферации и дисплазии в эпителии молочной железы и эндометрия, лечение электромагнитным полем прекращалось. А оральные контрацептивы, по желанию пациенток, в 38 случаях продолжены для получения контрацептивного эффекта. Продолжительность лечения составляла обычно от трех до шести менструальных циклов, в зависимости от получаемых результатов.
У всех женщин на основании физикальных, ультразвуковых, рентгенологических и морфологических исследований был поставлен диагноз: пролиферативный фиброаденоматоз с явлениями дисплазии 1-Й степени. Оценка эффективности проводимого лечения, как и в предыдущих случаях, проводилась по динамике выявленных в молочных железах изменений — клинических, рентгенологических, ультразвуковых и морфологических. Результаты комбинированного лечения оральными контрацептивами и сложно-моделированным электромагнитным полем представлены в таблице 17.
Хорошие результаты от проводимого лечения были отмечены в возрастной группе 21—30 лет: у 85,3 % — положительный результат, у 8,8 % -без эффекта, у 5,9 % — отрицательный результат. Необходимо отметить, что в этой возрастной группе лучшие результаты были получены у больных, имевших в анамнезе беременность, завершившуюся родами. У нерожавших больных случаев эффективного лечения значительно меньше, что отмечено в группе неэффективного лечения. Сопоставимо эффективны гормональные контрацептивы и ЭМП в группе женщин в возрасте св. 30-40 лет. Здесь положительный эффект от лечения в виде снижения дисплазии отмечен у 84,9 % больных, у 9,6 % — без эффекта, а у 6,4 % — отрицательная динамика в виде увеличения степени дисплазии или узлообразования, потребовавшего секторного иссечения.
Таким образом, комбинированное лечение оральными контрацептивами и сложно-моделированным электромагнитным полем представляют собой одинаково эффективное средство для лечения проявлений пролиферативной дисплазии в разных возрастных группах.
Для лечения мы использовали: производные 17-этинилтестостерона (Даногсн, Дановал, Данол). В качестве источника сложно-моделированного низкочастотного электромагнитного поля использовали аппарат биорегул ируемой низкочастотной электромагнитной терапии АНЭб-01-«Гефест». Все больные получали от 40 до 60 сеансов. Экспозиция сеанса — от 12 до 24 минут. В группы для исследования были взяты пациентки в возрасте от 21 года до 40 лет, общей численностью 53. У всех на основании физикальных, ультразвуковых, рентгенологических и морфологических исследований был поставлен диагноз: пролиферативный фиброаденоматоз с явлениями дисплазии I—II степени. Оценка эффекта от лечения, как и в предыдущих случаях, проводилась по динамике выявленных в молочных железах изменений — клинических, рентгенологических, ультразвуковых и морфологических. Результаты комбинированного лечения производными 17-этинилтестостерона и сложно-моделированным электромагнитным полем представлены в таблице 18.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
В статье рассматривается проблема мастопатии и риска рака молочной железы (РМЖ) с позиции трех специалистов: акушера-гинеколога, гинеколога-эндокринолога и онколога.
Представлены данные об эпидемиологии мастопатии и РМЖ, популяционные риски развития РМЖ, причины, предрасполагающие к мастопатии, и факторы риска РМЖ. Обсуждаются понятия мастопатии и масталгии. Подробно описаны клиническая симптоматика, методы физикального осмотра пациенток с нераковыми заболеваниями молочных желез (МЖ), включающие пальпацию МЖ и регионарных лимфоузлов. Представлены правила маммологического скрининга, предложенные Международной ассоциацией специалистов репродуктивной медицины. Среди инструментальных методов диагностики используются маммография, УЗИ, пункции узловых образований и подозрительных участков и цитологическое исследование пунктата.
Особое внимание уделено нарушениям гормонального баланса, поскольку МЖ является не только органом-мишенью для большого количества гормонов (в первую очередь половых) и факторов роста, но и местом локального биосинтеза и метаболизма половых гормонов.
В статье объяснена важность морфологического исследования ткани МЖ у женщин с подозрением на РМЖ и приведены примеры гистологических картин предраковых состояний. Описаны механизмы действия патогенетической терапии с приведением в качестве примеров некоторых лекарственных препаратов.
Ключевые слова: мастопатия, рак молочной железы, постменопауза, гиперэстрогенемия, Мамоклам.
Для цитирования: Керчелаева С.Б., Сметник А.А., Беспалов В.Г. Мастопатия и профилактика рака молочной железы как междисциплинарная проблема // РМЖ. 2016. № 15. С. 1018–1025.
Для цитирования: Керчелаева С.Б., Сметник А.А., Беспалов В.Г. Мастопатия и профилактика рака молочной железы как междисциплинарная проблема // РМЖ. Мать и дитя. 2016. №15. С. 1018-1025
Mastopathy and breast cancer prevention as interdisciplinary problem
Kerchelaeva S.B. 1 , Smetnik A.A. 2 , Bespalov V.G. 3
1 Pirogov Russian National Research Medical University, Moscow
2 Scientific Center for Obstetrics, Gynecology and Perinatology named after academician V.I. Kulakov, Moscow
3 Research Institute of Oncology named after N.N. Petrov, St.-Petersburg
The paper addresses the problem of mastopathy and the risk of breast cancer (BC) from the position of three specialists: obstetrician and gynecologist, endocrinologist and oncologist.
The data on mastopathy and BC epidemiology; population risks for BC; causes, predisposing to mastopathy and BC, and risk factors for BA is provided. The concept of mastopathy and mastalgia is discussed. Clinical symptoms, methods of physical examination for non-cancerous (benign) breast conditions , including palpation of breast and regional lymph nodes, are provided. The paper presents breast screening program proposed by International Federation of Fertility Societies. Instrumental diagnostic methods include mammography, ultrasound, puncture of nodules and suspicious sites, punctate cytology.
Special attention is paid to hormonal imbalance, since breast is not just the target organ for a large number of hormones (especially sex hormones) and growth factors, but a local place for sex hormones’ biosynthesis and metabolism.
The paper explains the importance of morphological examination of breast tissue in women with suspected BC and gives examples of precancerous conditions’ histology. Mechanisms of action of pathogenic therapy are discussed with focus on some drugs.
Key words: mastopathy, breast cancer, postmenopause, hyperestrogenemia, Mamoklam.
For citation: Kerchelaeva S.B., Smetnik A.A., Bespalov V.G. Mastopathy and breast cancer prevention as interdisciplinary problem // RMJ. 2016. № 15. P. 1018–1025.
В статье освещена междисциплинарная проблема мастопатии и профилактики рака молочной железы

Диагностика нераковых заболеваний молочных желез – профилактика рака молочной железы
Профессор С.Б. Керчелаева
ГБОУ ВО «РНИМУ им. Н.И. Пирогова» МЗ РФ, Москва
Эпидемиология. Известно, что в разных странах популяционные риски развития РМЖ неодинаковы. В России в 2013 г. заболеваемость РМЖ составила 320 на 100 тыс. населения, т. е. примерно 0,008% женской популяции ежегодно. Из 741 пациентки, жительниц Ганы, обратившихся за маммологической помощью, масталгия была основным симптомом в 50,2% случаев. РМЖ был диагностирован у 7,8% пациенток, рецидивирующий рак – у 0,8% пациенток. В остальных случаях (около 88%) масталгия не была ассоциирована со злокачественной трансформацией тканей МЖ [1, 2]. В ходе изучения связи между циклической масталгией и РМЖ с участием 5463 женщин 28% (1529 пациенток) сообщили о боли в груди. При этом у 15,8% был диагностирован РМЖ [3]. Таким образом, надо понимать, что масталгия не является маркером раковой трансформации, но ее следует признать значимым фактором риска.
В общей популяции фиброзно-кистозная болезнь встречается у 60–80% женщин, причем пациентки репродуктивного возраста с гинекологическими заболеваниями в анамнезе обеспечивают самый высокий процент. Клинические проявления мастопатии не только ухудшают качество жизни пациенток, но и повышают риск развития РМЖ в десятки раз [4]. Со стороны акушеров-гинекологов незаслуженно мало внимания уделяется доброкачественным заболеваниям МЖ. Клинические симптомы мастопатии приравнивают к норме, хотя это, как правило, свидетельствует о патологическом процессе.
Несмотря на то, что МЖ относится к визуальным локализациям и легко доступна для исследования, РМЖ в 1 и 2 стадии диагностируется лишь у 57,6% пациенток, причем летальность на первом году жизни с момента установления диагноза составляет около 12,6% случаев. Больные с запущенными формами РМЖ составляют высокий процент наблюдений. Анализ причин запущенности заболевания показал, что в значительной степени запущенность связана с низкой медицинской культурой населения: 42% пациенток откладывали свой визит к врачу, мотивируя это занятостью, неблагоприятной ситуацией на работе, семейными обстоятельствами и т. д., у 10,9% пациенток причиной была боязнь идти к врачу, в 6,5% случаев женщины занимались самолечением, что приводило к резкому прогрессированию заболевания. Однако в 32,5% случаев запущенность заболевания лежит на совести врачей общей лечебной сети ввиду их низкой онкологической грамотности и отсутствия онкологической настороженности. У 51,7% больных от момента появления клинических признаков РМЖ до постановки диагноза проходило от 1 до 6 мес. [5].
В любом современном государстве основу профилактики составляют скрининговые программы, причисленные по значимости к государственным программам, а борьба с раковыми опухолями на мировом уровне включена в глобальные задачи человечества.
С 2009 г. на основании приказа № 808 МЗ РФ выявление и терапия заболеваний МЖ входят в сферу ответственности акушеров-гинекологов, тогда как ранее этими вопросами занимались исключительно маммологи и хирурги.
В 2012 г. Минздрав России издал новое руководство к действию – приказ № 572н, регламентирующий, как и приказ № 808, что медицинскую помощь женщинам с целью выявления заболеваний МЖ оказывает врач акушер-гинеколог. Кроме того, в действующем приказе в пункте 85 написано, что женщин с выраженными кистозными узловыми изменениями МЖ направляют в онкологический диспансер для верификации диагноза.
Анатомия и физиология. МЖ – это гормонозависимые органы, входящие в репродуктивную систему женщины, которые развиваются и начинают функционировать под влиянием целого комплекса гормонов: рилизинг-факторов гипоталамуса, гонадотропных гормонов гипофиза (фолликулостимулирующего и лютеинизирующего), хорионического гонадотропина, пролактина, тиреотропного гормона, кортикостероидов, инсулина, эстрогенов, прогестерона, андрогенов. МЖ в своем развитии проходят несколько этапов. После рождения МЖ представляют собой рудиментарные образования. В период полового созревания, когда у девочек начинают функционировать яичники, МЖ начинают увеличиваться в объеме, и с наступлением менструальной функции ткань МЖ подвергается ежемесячным циклическим изменениям в соответствии с фазами менструального цикла. С прекращением менструальной функции ткань МЖ подвергается инволютивным изменениям, а именно жировому перерождению. Паренхима МЖ представлена сложными альвеолотрубчатыми железами, собранными в мелкие дольки, из которых формируются крупные доли. В МЖ имеется от 6 до 24 долей. Каждая из них имеет свой выводной проток, некоторые протоки могут сливаться перед выходом на поверхность соска.
Кровоснабжение МЖ осуществляется за счет внутренней грудной и подмышечной артерий и ветвей межреберных артерий. Вены МЖ сопровождают артерии и широко анастамозируют с венами окружающих областей.
С онкологических позиций большое значение имеет строение лимфатической системы МЖ. Выделяют внутриорганную и внеорганную лимфатическую систему МЖ. Различают следующие пути оттока лимфы от МЖ: подмышечный, подключичный, парастернальный, ретростернальный, межреберный, перекрестный и путь Героты.
Патогенез. По определению ВОЗ, мастопатия – это фиброзно-кистозная болезнь с нарушением соотношения эпителиального и соединительнотканного компонента, с разнообразными пролиферативными и регрессивными изменениями в тканях МЖ. У термина «мастопатия» имеется множество синонимов, наиболее часто используют такие как «фиброзно-кистозная болезнь», «доброкачественная дисплазия молочных желез», однако обобщающим считают термин «нераковые заболевания молочных желез».
В России для диагностики нераковых заболеваний МЖ применяют клинико-рентгенологическую классификацию мастопатии Н.И. Рожковой [6], согласно которой выделяют 5 форм диффузной мастопатии:
с преобладанием:
– железистого компонента;
– фиброзного компонента;
– кистозного компонента;
– смешанную форму диффузной фиброзно-кистозной мастопатии;
– склерозирующий аденоз.
Кроме того, по результатам биопсии устанавливают диагноз в соответствии с гистологической классификацией опухолей МЖ (ВОЗ, 1995).
Различают морфологически непролиферативную и пролиферативную формы доброкачественной дисплазии. При этом риск малигнизации при непролиферативной форме составляет 0,86%, при умеренной пролиферации – 2,34%, при резко выраженной пролиферации – 31,4% наблюдений. По данным гистологических исследований операционного материала, РМЖ сочетается с фиброзно-кистозной болезнью в 46% случаев [7].
Отмечается четкая связь между заболеваемостью РМЖ и детородной функцией. Женщина, родившая впервые в 18 лет, имеет втрое меньший риск заболеть РМЖ, чем впервые родившая в 35 лет. Ранняя первая беременность способствует резкому увеличению продукции одного из 3–х эстрогенов – эстриола, который является продуктом метаболизма эстрадиола и эстрона и тормозит канцерогенное воздействие последних. С другой стороны, поздние роды (после 30–40 лет) приводят к резкому повышению уровня эстрадиола, что может способствовать развитию РМЖ. Также к причинам, предрасполагающим к мастопатии, относят следующие факторы: неблагоприятный репродуктивный анамнез, гинекологические заболевания, гиперпролактинемию, факторы сексуального характера, эндокринные нарушения, повседневные фрустрирующие ситуации, заболевания печени, генетическую отягощенность [8]. Чрезвычайно важными являются факторы риска РМЖ: выделения из соска вне лактации, обнаружение мутации генов семейства BRCA в крови, в перименопаузальном периоде – наличие уплотнения ткани молочной железы по результатам маммографического скрининга.
Из вышеизложенного следует, что в противораковой борьбе большое значение имеют своевременное выявление и лечение нераковых заболеваний МЖ.
Диагностика заболеваний молочной железы основывается на осмотре МЖ, их пальпации, что должно проводиться с особой тщательностью и онкологической настороженностью. Физикальное обследование включает пальпацию МЖ, регионарных лимфоузлов (подключичных, надключичных, подмышечных).
Из дополнительных методов используются маммография, УЗИ, пункции узловых образований и подозрительных участков и цитологическое исследование пунктата. Кроме того, необходимо руководствоваться приказом № 572н, который регламентирует обязательное скрининговое обследование женщин старше 35 лет.
Международная ассоциация специалистов репродуктивной медицины, Российская ассоциация маммологов предложила Правила маммологического скрининга для акушера-гинеколога: каждую женщину моложе 35 лет необходимо опрашивать для выявления прогностических факторов РМЖ (разница между ростом в сантиметрах и массой тела в килограммах более 110, возраст начала менструации – до 13 лет, гинекологические заболевания в анамнезе (миома матки, полип матки, эндометриоз, кисты яичников, дисфункция яичников, бесплодие и др.), отсутствие родов, первые роды в возрасте старше 30 лет, стрессовые ситуации, ушибы, маститы, операции на МЖ, онкологические заболевания у близких родственников). Мануальное обследование проводить всем; при наличии факторов риска РМЖ, но при отсутствии изменений молочных желез направлять на УЗИ. При наличии пальпаторных изменений направлять не только на УЗИ, но и на маммографию.
Каждую женщину старше 35 лет направлять на маммографию с периодичностью 1 раз в 2 года при отсутствии изменений. При наличии рака в семье – направлять на ДНК-исследование крови с целью выявления мутаций генов BRCA-1 и -2. При обнаружении мутаций направлять на консультацию онколога для выработки плана наблюдения или лечения.
Главная цель первичных диагностических мероприятий – определить характер процесса. При обнаружении узлового очага пациентку нужно направить к рентгеномаммологу, который выполнит биопсию с цитологическим и гистологическим исследованием пунктата. С учетом результата пациентка будет направлена к маммологу-онкологу, который будет заниматься ее лечением. При диффузном процессе пациенткой должен заниматься акушер-гинеколог, который проведет полное обследование, в т. ч. и гормонального статуса, для дальнейшего консервативного лечения и мониторинга. При обнаружении галактореи (вне беременности и лактации) необходимо определить концентрацию гормона пролактина и тиреотропного гормона, а также взять отпечаток-мазок отделяемого для цитологического исследования. В зависимости от его результатов решается вопрос о дальнейшем ведении пациентки. Гиперпролактинемия – одна из причин эстроген-прогестеронового дисбаланса, именно пролактин стимулирует рост числа эстрогеновых рецепторов в тканях МЖ, повышает чувствительность клеток к действию эстрадиола и ускоряет пролиферацию эпителиальных клеток.
Профилактика заболеваний молочной железы. Основная задача акушера-гинеколога – вести среди женского населения пропаганду против абортов, проводить своевременное лечение воспалительных заболеваний органов малого таза, коррекцию нарушений менструального цикла на всех этапах жизни женщины, коррекцию хронической ановуляции, лечение эндометриоза, миомы матки, полипов матки, опухоли яичников. Перечисленные состояния характеризуются гормональным дисбалансом и дефицитом прогестерона, все это приводит к отеку и гипертрофии внутридольковой соединительной ткани, пролиферации протокового эпителия, что является причиной обтурации протоков и образования кист. Гиперэстрогенизм вследствие недостаточной лютеиновой фазы цикла обусловливает развитие дисгормональных дисплазий МЖ у женщин репродуктивного возраста.
Негормональная базовая терапия диффузной формы нераковых заболеваний МЖ включает: коррекцию диеты, психологическую коррекцию, нормализацию функционального состояния печени, желудочно-кишечного тракта, использование мочегонных средств, препаратов, улучшающих кровоснабжение, использование арсенала фитотерапии.
Многие специалисты сегодня задаются вопросом: есть ли возможности прогнозирования РМЖ? На основании исследовательских работ результаты экспериментов показали, что большая часть канцерогенного влияния эстрогенов связана с образованием агонистических метаболитов эстрогенов, преимущественно 16-гидроксиэстрогена (16-ОНЕı). Другие метаболиты, такие как 2-гидроксиэстрон (2-ОНЕı) и 2-гидроксиэстрадиол, обеспечивают протективное действие, выступая как антагонисты 16-гидроксиэстрогена [9, 10]. Установлено, что при нормальном соотношении стероидных гормонов в организме женщины концентрация метаболита 2-ОНЕı превышает концентрацию 16-ОНЕı не менее чем в 2 раза. Уменьшение этого соотношения признано фактором риска РМЖ. Таким образом, соотношение 2-ОНЕı к 16-ОНЕı менее 2,0 можно считать адекватным универсальным биомаркером и надежным диагностическим критерием для определения риска и прогноза развития эстрогензависимых опухолей [8, 11].
Заключение. Долгое время считали, что мастопатия – это не заболевание, поскольку очаги фиброза и кисты в МЖ очень распространены, а потому не требуют лечения. Однако сегодня, изучая данную проблему, мы пришли к выводу, что указанные изменения нельзя считать вариантом нормы. Сегодня нераковые заболевания МЖ следует рассматривать как маркер гормонального и тканевого неблагополучия МЖ, а также как фактор онкологической настороженности. Нераковые заболевания МЖ необходимо активно выявлять и лечить, тем самым обеспечить женщине приемлемое качество жизни и проведение онкопрофилактики.
Риск рака молочной железы и половые гормоны
К.м.н. А.А. Сметник
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» МЗ РФ, Москва
Молочная железа является органом-мишенью для большого количества гормонов и факторов роста, среди которых одну из ведущих ролей играют половые гормоны и экспрессия соответствующих рецепторов [12].
Клетки МЖ, экспрессирующие эстрогеновые рецепторы (ЭР), пролиферируют медленно, в отличие от ЭР-негативных клеток, которые митотически активны. Пролиферация здорового эпителия, не содержащего ЭР или прогестероновые рецепторы (ПР), происходит за счет паракринных эффектов от рядом расположенных покоящихся ЭР-позитивных клеток. В отличие от этого в опухолевых рецептор-позитивных клетках митозы регулируются аутокринными механизмами. В менструальном цикле в МЖ происходят последовательные волнообразные процессы пролиферации и апоптоза. Эндогенный прогестерон в синергизме с эстрадиолом способны стимулировать процессы пролиферации и апоптоза в МЖ, васкуляризацию, выработку протеогликанов, аккумуляцию жидкости в ткани МЖ, что приводит к субъективным ощущениям нагрубания МЖ и повышению маммографической плотности в лютеиновую фазу менструального цикла [13]. Именно в лютеиновую фазу в МЖ наблюдается максимальная частота митозов [14].
МЖ является местом локального биосинтеза и метаболизма половых гормонов. К ферментам, участвующим в локальном синтезе и метаболизме эстрогенов, относятся ароматаза (переход андрогенов в эстрогены), сульфатаза (переход неактивных сульфатных форм эстрогенов в активные), 17-дигидрогеназа I и II (из эстрона в эстрадиол и наоборот), сульфотрансфераза (образование сульфатных форм) [15]. Возможно, высокая распространенность гормонально зависимого рака в период низкой продукции половых гормонов яичниками (в постменопаузе) обусловлена отчасти ролью данных ферментных систем. Активность эстронсульфатазы в опухолевой ткани МЖ в 10–500 раз выше активности ароматазы. Также важную роль играют гидроксиметаболиты эстрогенов и ряд метаболитов прогестерона, которые оказывают пролиферативные либо антипролиферативные эффекты [16].
Клинические и экспериментальные данные о роли гормонов в развитии мастопатии зачастую противоречивы. Тем не менее, мастопатия является гормонозависимым заболеванием, обусловленным дисбалансом в гипоталамо-гипофизарно-яичниковой системе.
Если говорить о развитии РМЖ, то переход в гормонозависимой регуляции с паракринного на аутокринный механизм – важная часть опухолевого процесса [12, 17]. Андрогеновые рецепторы присутствуют в 70–80% случаев РМЖ (экспрессируются чаще, чем ЭР или ПР). В случае коэкспрессии андрогеновых рецепторов при ЭР-позитивных раках прогноз обычно лучше. Однако при ЭР-негативном раке андрогеновые рецепторы часто служат компенсаторным механизмом для роста опухоли [18]. Факторы риска РМЖ приведены в таблице 1 [19].
На приеме гинеколога-эндокринолога одним из самых частых вопросов со стороны пациенток является вопрос о возможности назначения им, в зависимости от возраста, комбинированных оральных контрацептивов (КОК) или менопаузальной гормонотерапии (МГТ). Врачу же приходится оценивать безопасность гормональной терапии в каждом конкретном случае, в т. ч. с позиций возможного влияния на риск РМЖ. Общепринятым является положение о том, что изменения синтеза и метаболизма эстрогенов и прогестерона имеют фундаментальное значение для риска развития РМЖ [21].
В случае сочетания мастопатии с гинекологическими заболеваниями, требующими гормональной коррекции, назначение последней возможно.
Метаанализ 13 проспективных когортных исследований КОК не выявил значимого повышения риска РМЖ. Однако различные типы гестагенов в составе КОК также по-разному влияют на различные прогестероновые рецепторы [22]. Например, согласно данным Ruan X. et al. (2012), следующие гестагены, входящие в состав КОК, повышали пролиферацию в культуре клеток РМЖ (MCF-7) при высоких концентрациях: дроспиренон, левоноргестрел, дезогестрел. В отличие от этого, пролиферативный эффект отсутствовал в случае хлормадинона ацетата и номегестрола ацетата [23].
В постменопаузе в опухолевой ткани МЖ концентрация локального эстрадиола в 20–50 раз выше, чем в плазме (результат локальной конверсии из андрогенов, эстрона и эстрона сульфата). При этом не наблюдаются значимые различия в концентрациях эстрадиола: в крови при РМЖ и в норме; в самой МЖ при раке в репродуктивном возрасте и постменопаузе; локально при РМЖ в постменопаузе на фоне приема МГТ и без МГТ. Таким образом, опухолевая концентрация эстрадиола не зависит от уровня в плазме [24].
Согласно рекомендациям Всемирной ассоциации по менопаузе (International Menopause Society) от 2016 г., возможное повышение риска РМЖ, связанное с МГТ, невелико и оценивается менее чем в 0,1% в год, или менее 1,0 случая на 1000 женщин на год использования [25]. Этот уровень схож или ниже, чем повышение риска, связанное с такими частыми факторами образа жизни, как сниженная физическая активность, ожирение и употребление алкоголя. Данные, полученные в исследовании WHI (Women’s Health Initiative – «Инициатива во имя здоровья женщин»), не показали повышения риска РМЖ у женщин, впервые применяющих МГТ в течение 5–7 лет после начала терапии [20]. Исследование WHI также показало, что монотерапия конъюгированными эквин-эстрогенами в течение 7,1 года снижала риск диагностирования РМЖ и смертности у женщин с удаленной маткой [26].
В 3-х исследованиях было высказано предположение, что микронизированный прогестерон или дидрогестерон могут быть связаны с более низким риском, чем синтетический прогестаген [27–29]. Доступные в настоящее время данные не позволяют предположить различия в риске между пероральным и трансдермальным путями применения эстрадиола [30]. Тем не менее в настоящее время недостаточно данных клинических исследований адекватной мощности для полной оценки возможной разницы в частоте развития РМЖ при использовании разных типов, доз и путей введения эстрогенов, типа прогестагена и применения андрогенов.
На сегодняшний день в мировую практику лечения расстройств, связанных с менопаузой, активно внедряется комбинация селективного модулятора эстрогеновых рецепторов – базедоксифена (который блокирует эстрогеновые рецепторы в МЖ и эндометрии) и конъюгированных эквин-эстрогенов [31]. Данный препарат способствует уменьшению плотности МЖ, но требуются дополнительные данные для подтверждения ее влияния на заболеваемость РМЖ [32].
Таким образом, можно сделать вывод, что с точки зрения любого увеличения риска РМЖ более значим именно прогестагенный компонент МГТ и КОК, а не эстроген. Риск может быть ниже при применении микронизированного прогестерона или дидрогестерона, чем при использовании синтетического прогестагена в составе МГТ. Риск РМЖ, связанный с применением МГТ, невелик, зависит от ее длительности и неуклонно снижается после ее прекращения. Имеющихся в настоящее время данных о безопасности недостаточно для поддержки назначения МГТ женщинам, перенесшим РМЖ. До назначения МГТ следует оценить соответствующий риск. Возможное увеличение риска РМЖ, связанное с МГТ, может быть частично снижено путем отбора женщин с исходно более низким индивидуальным риском, включая низкую плотность МЖ, а также путем образования по вопросам превентивных мер, направленных на коррекцию образа жизни (снижение массы тела, приема алкоголя и увеличение физической активности). У женщин, принимающих МГТ, следует проводить ежегодную маммографию [25]. Современные прогестагены, натуральный прогестерон и селективный модулятор эстрогеновых рецепторов оптимизируют влияние гормонотерапии на МЖ. Эти данные следует учитывать гинекологам-эндокринологам при ведении пациенток с мастопатией.
Мастопатия как фактор риска РМЖ: вопросы этиопатогенеза и лечения
Д.м.н. В.Г. Беспалов
ФГБУ «НИИ онкологии им. Н.Н. Петрова» МЗ РФ, Санкт-Петербург
Мастопатия (фиброзно-кистозная болезнь) – распространенная патология, ее частота в женской популяции составляет до 50% [33]. В целом мастопатия не является предраком или стадией онкологического процесса в МЖ. Однако нельзя недооценивать роль мастопатии в развитии РМЖ. Рост заболеваемости РМЖ в XX в. во многих странах сопровождался параллельным ростом частоты мастопатии. В 2014 г. в России зарегистрировано 65 088 новых случаев РМЖ, 21,2% (1-е место) в структуре заболеваемости женщин раком; за 10 лет стандартизованный показатель заболеваемости вырос на 19,79%, рост на 1,78% в год [34]. При этом мастопатия имеется у 50–60% российских женщин [35]. Выделяют более 50 доброкачественных заболеваний МЖ или форм мастопатии, среди которых многие существенно повышают риск РМЖ.
Взаимосвязь этиологии и патогенеза мастопатии и РМЖ
Существует 4 группы доказательств связи мастопатии с РМЖ: 1) у мастопатии и РМЖ общие факторы риска; 2) патогенез мастопатии и РМЖ имеет общие черты, ключевую роль играет относительная или абсолютная хроническая гиперэстрогения; 3) при мастэктомии в связи с РМЖ в тканях МЖ часто обнаруживают морфологические проявления мастопатии и предраковые изменения; 4) у больных РМЖ чаще была предшествующая мастопатия [36].
РМЖ – полиэтиологическое заболевание, идентифицировано более 80 факторов риска РМЖ, которые можно разделить на 5 групп: половые и возрастные, генетические, репродуктивные, гормональные и обменные, внешней среды и стиля жизни. Мастопатия – также полиэтиологическое заболевание, а основные факторы риска РМЖ и мастопатии совпадают [37]. Если РМЖ в большинстве случаев развивается в постменопаузальном возрасте, то пик заболеваемости мастопатии приходится на возраст 30–50 лет, т. е. данная патология предшествует развитию РМЖ. Кровные родственники, больные РМЖ; носительство мутантных генов, отвечающих за репарацию ДНК и биосинтез половых гормонов, являются одновременно факторами риска и РМЖ, и мастопатии. Большинство репродуктивных факторов риска одинаковы для РМЖ и мастопатии: раннее менархе, низкая частота родов, поздние первые роды, отсутствие или короткий период грудного вскармливания, искусственные аборты, высокая рентгеновская плотность маммограмм в позднем репродуктивном возрасте. Гормональные и обменные факторы риска в большинстве одинаковы для РМЖ и мастопатии: гиперэстрогения, гиперпролактинемия, гипотиреоз; гиперпластические заболевания гениталий и гинекологические заболевания, связанные с нарушениями гормонального баланса; ожирение, сахарный диабет, болезни печени. Из факторов внешней среды и стиля жизни одинаковы для РМЖ и мастопатии нарушения питания в виде избытка жиров, калорий, животных белков, алкоголя, недостатка овощей и фруктов, пищевых волокон, витаминов и минералов; депрессия, нарушения сна, работа в ночные смены; сниженная физическая активность.
Мастопатию можно считать биомаркером гормонального неблагополучия на уровне организма и локального неблагополучия в ткани МЖ. Множественные факторы риска нарушают гормональный баланс в организме женщины, вызывают гиперэстрогению и гиперпролиферацию эпителия в ткани МЖ, что приводит к развитию мастопатии, а при наличии врожденных или приобретенных повреждений генов – РМЖ.
Риск РМЖ у больных мастопатией
Мастопатия является и самостоятельным фактором риска РМЖ. В эпидемиологических когортных исследованиях при сроках наблюдения за женщинами от 6 до 20 лет установлено, что относительный риск РМЖ (в сравнении с частотой РМЖ в общей популяции, с женщинами без мастопатии, с непролиферативной мастопатией) при мастопатии без пролиферации эпителия статистически недостоверно, но в некоторых исследованиях и статистически достоверно, повышается в 1,27–2,23 раза; при мастопатии с гиперплазией без атипии достоверно повышается в 1,53–3,58 раза; при мастопатии с атипичной гиперплазией достоверно повышается в 2,03–10,35 раза [38]. Dyrstad S.W. et al. провели метаанализ 32 эпидемиологических ретроспективных и проспективных исследований о связи мастопатии с риском РМЖ; относительный риск РМЖ при непролиферативных формах мастопатии статистически недостоверно повышался до 1,17, при пролиферативных формах без атипии – достоверно повышался до 1,76, при пролиферативных формах с атипией – до 3,93 [39].
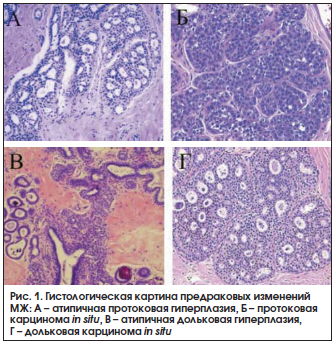
К предраковым изменениям МЖ относят протоковую атипичную гиперплазию и карциному in situ, дольковую атипичную гиперплазию и карциному in situ, склерозирующий аденоз, радиальный рубец [40]. Основные формы предрака МЖ приведены на рисунке 1.
В таблице 2 указывается степень риска РМЖ при мастопатии по данным R.J. Santen и R. Mansel [40].
Коллегия американских патологов рекомендовала подразделять женщин с мастопатией на 3 категории в зависимости от выявленных при биопсии МЖ морфологических изменений: 1) непролиферативная – риск РМЖ не повышен и равен популяционному; 2) пролиферативная без атипии – риск РМЖ повышен в 1,5–2 раза по сравнению с популяцией; 3) пролиферативная с атипией – риск РМЖ повышен в 4–5 раз по сравнению с популяцией [41]. При биопсии МЖ и морфологическом обследовании примерно у 5% женщин с мастопатией выявляется атипическая гиперплазия [42].
Лечение мастопатии и профилактика РМЖ
Стандартов лечения мастопатии на сегодняшний день нет. К общим недостаткам большинства применяемых сегодня средств можно отнести невысокую эффективность, побочное и токсическое действие, необходимость применения в виде комплекса с другими средствами, нацеленность только на облегчение патологической симптоматики, а не на более серьезную задачу – профилактику РМЖ. Поэтому актуальной является проблема создания специальных лекарственных средств для лечения мастопатии. С учетом характера данной патологии такие средства должны быть эффективными, безопасными, пригодными для длительного применения, направленными на профилактику РМЖ. Патогенетическое лечение мастопатии относят к первичной и вторичной профилактике РМЖ [43, 44].
В настоящее время для патогенетического лечения мастопатии существуют лишь единичные препараты. Например, лекарственный препарат Мамоклам, который производят из липидной фракции бурой морской водоросли Laminaria; действующими веществами Мамоклама являются органический йод, полиненасыщенные жирные кислоты омега-3 типа, хлорофилл. Мамоклам разрешен для медицинского применения в качестве лекарственного средства для лечения мастопатии. В эпидемиологических исследованиях показано, что все 3 действующих вещества Мамоклама снижают риск развития РМЖ. В клинических исследованиях доказано, что Мамоклам вызывает регрессию масталгии, ослабляет предменструальное нагрубание МЖ, вызывает регрессию уплотнений и кист в МЖ, снижает маммографическую плотность, нормализует процессы пролиферации эпителия МЖ, нормализует менструальный цикл и баланс тиреоидных и половых гормонов [45–47].
Патогенетическое лечение мастопатии должно быть направлено на нормализацию гормонального баланса в организме женщины, прежде всего баланса половых гормонов; на уменьшение гиперэстрогении как на системном уровне, так и на уровне рецепторного аппарата клеток в ткани МЖ; на подавление процессов гиперпролиферации железистого эпителия МЖ. Основным действующим веществом Мамоклама является йод в органически связанной форме (в составе аминокислот). При поступлении в организм в дозах, превышающих суточную потребность, йод накапливается в тканях МЖ и оказывает прямое действие на патогенетические пути развития мастопатии: подавляет пролиферацию эпителия, индуцирует апоптоз и дифференцировку клеток, снижает чувствительность ткани МЖ к эстрогенам; в щитовидной железе формируются йодолипиды, которые оказывают антиоксидантное действие и контролируют клеточную пролиферацию в МЖ; йод также опосредованно влияет на состояние МЖ, нормализуя баланс тиреоидных и половых гормонов, уменьшая местную гиперэстрогению в тканях МЖ [48–50]. Показано, что при лечении мастопатии йодом в дозах, превышающих суточную потребность, нормализуется архитектоника тканей МЖ [51]. Длительный прием йода в дозах, превышающих суточную потребность, возможен только для органического йода, который содержится в Мамокламе. Другой компонент Мамоклама – полиненасыщенные жирные кислоты омега-3 типа также влияют на патогенетические пути развития мастопатии: формируют структуру и определяют вязкость клеточных мембран, регулируют клеточные сигналы, нормализуют баланс эстрогенов, в результате чего уменьшают гиперэстрогению и ослабляют пролиферацию клеток в ткани МЖ [52].
Выводы
1. К группе повышенного онкологического риска женщины, страдающие мастопатией, могут быть отнесены после оценки всех индивидуальных факторов риска и морфологического анализа тканей МЖ.
2. Решающим в оценке степени риска развития РМЖ у больных мастопатией является морфологическое исследование ткани МЖ, полученной при биопсии. Риск РМЖ не повышается или является минимальным при непролиферативных формах мастопатии, при пролиферативной форме без атипии риск возрастает в 2 раза, при пролиферативной с атипией – в 4 раза и достигает наиболее высоких цифр (до 12 раз) при протоковой или дольковой карциноме in situ.
3. Своевременная диагностика и патогенетическое лечение мастопатии не только улучшают качество жизни, но и должны быть направлены на профилактику РМЖ. Мамоклам – эффективный и безопасный лекарственный препарат для патогенетического лечения мастопатии, при длительном применении Мамоклам снижает риск РМЖ.
источник