Остеосцинтиграфия в онкологии (радионуклидная диагностика) — один из самых востребованных методов радиоизотопного исследования применительно к онкологическим больным. Сканирование скелета при онкологических заболеваниях производится на современном диагностическом оборудовании, которое представлено в виде гамма-камеры и дополнительных диагностических устройств.
Метод позволят получить очень четкое изображение костной системы и выявить те патологические изменения, которые произошли в результате болезни. К таким изменениям относятся первичные опухоли костной ткани, либо метастазы злокачественных опухолей в других локализациях (опухоли молочной железы, предстательной железы, легких, щитовидной железы).
Процедура остеосцинтиграфии заключается во введении специального вещества (радиофармпрепаратов), которое накапливается в определенных органах и тканях, имитируя процессы, происходящие в организме. Например, образование и выведение желчи или мочи. В состав этих препаратов входит радиоактивная метка, излучения которой регистрируются детекторами гамма-камеры. Далее компьютер формирует плоское или объемное изображение. Обработав это изображение, получают графики, индексы и показатели, отражающие работу органов.
Посмотрите информационное видео про кабинет радиодиагностики в Онкологическом Диспансере в г. Москва:
Все, что нужно знать о процедуре остеосцинтиграфии, представляем на картинке:
Остеосцинтиграфия — классический метод радионуклидной диагностики с возможностью визуализации всего тела за одно высокочувствительное исследование.
Порядка 30-40% больных, умерших от рака легких и предстательной железы, имели множественные метастазы в костях. Главная задача специалистов сводится к своевременному выявлению таких метастазов при проведении остеосцинтиграфии перед подготовкой к хирургическому вмешательству и лучевой терапии.
Если у больных уже имеется болевой синдром, следует ускорить этап проведения радионуклидной диагностики в целях проверки онкологии костей.
Основные задачи исследования:
- диагностика (скрининг) костей на наличие онкологии;
- диагностика доброкачественных изменений;
- определение функционального состояния органов и систем;
- определение степени распространенности опухолевого процесса.
Выполнение поставленных задач помогает специалистам определиться с тактикой лечения, объемами хирургического вмешательства и последующей лучевой терапией. Кроме того, за одно исследование представляется возможным ответить на все вопросы обследуемых пациентов.
Своевременная диагностика способна определить пути лимфооттока от опухоли к здоровым тканям, которые могут быть вовремя прооперированы.
Главное отличительное свойство данного метода — это функциональность. Применительно к онкологии, сцинтиграфия дает возможность определить патологические процессы в клетках опухоли, когда анатомические и морфологические изменения еще не видны и не могут быть обнаружены с помощью общепринятых методов лучевой диагностики (рентген скелета при онкологии, КТ).
Исследование достаточно безопасно для пациентов. За одну процедуру можно оценить не только состояние костей, органов грудной и брюшной полостей, но и патологические изменения лимфатических узлов и молочных желез. Тем самым возможно не упустить время пациента и предоставить ему возможность как можно раньше начать противоопухолевое лечение.
Современное и успешное лечение рака молочной железы немыслимо без метода радионуклидной диагностики.
Сканирование молочной железы дает возможность диагностировать опухоли размерами менее 1 см. Главные преимущества этого метода — это выявление масштабов распространенности опухолевого процесса и оценка эффективности противоопухолевого лечения.
Современные методы лучевой диагностики позволяют оценить не только форму, размеры и строение внутренних органов, но и их функциональное состояние. Определение функций и есть главная заслуга остеосцинтиграфии.
Изображения костной системы, получаемые в результате остеосцинтиграфии, очень четкие и наглядные. Ни один другой метод не может так обширно показать изменения в скелете, как метод остеосцинтиграфии.
Выявить костные метастазы при сканировании костей возможно на ранних сроках возникновения злокачественных изменений. Исследование позволяет зафиксировать патологию на несколько месяцев раньше по сравнению с рентгеном костей скелета при раке. Компьютерно-томографическое исследование так же уступает остеосцинтиграфии по своим функциональным возможностям. Радионуклидная диагностика охватывает весь скелет, не выделяя отдельные области, в то время как при компьютерной томографии, как правило, исследуется лишь одна область.
При этом, если с помощью КТ обследовать весь скелет в целом, лучевая нагрузка будет в 10 раз больше, чем при остеосцинтиграфии.
Ядерная медицина объединяет все диагностические и терапевтические вмешательства, связанные с введением в организм радионуклидов. Позволяет на молекулярном уровне оценивать физиологические изменения, происходящие в организме.
В ряде случаев, болевого симптома может не быть даже при обширном метастазировании костной системы, а стандартные снимки рентгенографии показывают патологические изменения только на поздней стадии заболевания. Поэтому, при быстрорастущих опухолях и смешанных поражениях радионуклидному исследованию нет равных.
Сцинтиграфия костей имеет очень большое значение при выборе препаратов и оценке их эффективности на каждом этапе лечения онкологического заболевания. Данный метод применяется как в онкологии, так и в ортопедии.
Радионуклидная диагностика характеризуется объективностью и имеет очень большое прогностическое значение. Процедура отличается невысокой стоимостью и возможностью динамического наблюдения.
После введения контрастного вещества, на мониторе отражается пространственно-временное распределение радиофармпрепаратов в клетках, тканях и органах обследуемого человека.
Основными инструментами для сцинтиграфического исследования являются:
- гамма-камера, состоящая из блоков отслеживания, предназначенных для улавливания гамма-излучений;
- место для пациента (ложе);
- био-синхронизатор;
- экран;
- компьютер для принятия данных исследования;
- компьютер, обрабатывающий изображение.
Для проведения остеосцинтиграфии в большинстве случаев не требуется специальной подготовки. Обследование не обременительно для детей и физически слабых граждан. Пациенту не нужно раздеваться и испытывать чувства голода. Требуется лишь снять одежду с металлическими элементами. Некоторые пациенты отзываются об этом исследовании как о достаточно приятной процедуре, поскольку обследуемый пребывает в покое около 20 минут.
Остеосцинтиграфия не вредна и не вызывает каких-либо болевых ощущений.
При сцинтиграфии в качестве радиоактивной метки используется технетрил (короткоживущий радионуклид с периодом полураспада 6 часов и низкой энергией радиоактивного излучения). Препарат практически полностью выводится из организма в течение суток. Исследование планируется таким образом, чтобы минимизировать лучевую нагрузку. Так, при одном исследовании она не превышает 1-го миллизиверта.
Вопрос о безопасном проведении сканирования беременных женщин является открытым, так как ответ на него неоднозначен. По некоторым данным, беременность не является абсолютным противопоказанием к проведению исследования. Однако, ряд специалистов не готовы взять на себя ответственность по утверждению факта безопасности данной процедуры.
Вопрос назначения сцинтиграфии беременным женщинам рассматривается сугубо индивидуально, исходя из клинического состояния пациентки.
Ни ранний возраст, ни общее тяжелое физическое состояние не являются абсолютными противопоказаниями к проведению сцинтиграфии. Внутривенное введение радиофармпрепаратов не превышает по объему 1 мл, не вызывает аллергических реакций и является химически безопасным для пациента. Для детей и беременных женщин возможно проведение сцинтиграфии без применения определенных видов медикаментов.
Основные показания для проведения остеосцинтиграфии описаны на картинке:
Сцинтиграфия является незаменимым исследованием, когда стоит вопрос об определении жизнеспособности органов. Например, показатель функционального резерва почки невозможно получить ни одним из существующих методов. При этом, в ряде случаев метод настолько чувствителен, что позволяет диагностировать изменения на ранних клинических стадиях.
Очень информативны радионуклидные исследования при врожденных патологиях позвоночника, хронических воспалительных заболеваниях почек, печени, при определении кровоснабжения легких и сердца. В исследовании костной системы остеосцинтиграфия применяется для поиска костных метастазов и очагов остеомиелита. Для пациентов с эндокринной патологией проводится сканирование простаты, щитовидной и паращитовидной желез.
Сцинтиграфия дает важную клиническую информацию для планирования методов лечения при любых новообразованиях.
Как проходит процедура сцинтиграфии и в чем ее важность, рассказывается в следующем видеорепортаже:
источник
Рак груди — это злокачественная опухоль в железистой ткани молочной железы. Онкологические заболевания груди являются частой причиной летального исхода женщин разного возраста. Чаще всего раку молочной железы предшествует мастопатия. Это заболевание обусловлено нарушением гормонального фона пациентки.
Несмотря на огромные достижения современной медицины в сфере ранней диагностики и лечения рака, новообразования молочной железы до сих пор считают невероятно трудной проблемой.
Цель обследования молочных желез — это ранняя диагностика мастопатии и обнаружение различных доброкачественных новообразований и кист, которые классифицируют как предраковые болезни. Современная медицина установила, что рак груди на последних стадиях является практически не излечимым. На ранних этапах болезни имеются неплохие шансы на излечение и возвращение к полноценной жизни, поэтому диагностика молочных желез является важной для любой женщины.
Женщинам после 35 лет врачи рекомендуют регулярно проходить обследование груди на предмет выявления всевозможных патологий.
Методы обследования молочных желез
Существует множество методик обследования груди. Самым простым, а также возможным для проведения в домашних условиях, является самообследование. Каждый год врачи рекомендуют делать УЗИ молочных желез, маммографию, и проходить осмотр у хирурга. При подозрении на наличие злокачественного новообразования врачи дополнительно назначают:
- Анализ крови на онкомаркеры (назначается при подозрении на рак). Онкомаркеры – это особенные белки, продуцируемые клеткой злокачественного новообразования. В случае наличия таких маркеров можно говорить о наличии онкологического заболевания.
- КТ.
- МРТ.
- Маммосцинтиграфию.
- Пневмокистографию (применяется для исследования состояния кисты). При такой процедуре необходимо первоначально провести пункцию кисты, удаляя её содержимое. Далее врачи вводят внутрь кисты воздух. За счет воздействия воздуха происходит раздвигание стенок кисты, что позволяет осмотреть внутреннюю поверхность, применяя рентгеновские лучи.
- Биопсию.
Часто не удается обнаружить вовремя опухоль в связи с тем, что состояние груди напрямую зависит от возраста женщины и её гормонального фона. Изменения в ткани железы тесно связаны с менструальным циклом.
Раком молочной железы занимаются врачи-онкологи. Сегодня существует новая специальность в области онкологии – онкомаммолог. Эти специалисты занимаются диагностикой и лечением рака молочной железы. Отдельная специальность для такого заболевания связана с существованием множества методик лечения, среди которых выделяют лучевую терапию, хирургическое вмешательство, химиотерапию, а также огромное число их комбинаций. Лечение мастита или острых воспалительных процессов проводится хирургами, которые специализируются в гнойной хирургии.
Маммосцинтиграфия — это метод радионуклидной диагно¬стики патологии молочной железы, который основан на оценке распределения в ткани железы диагностических радиофарм-препаратов, обладающих повышенной тропностью к злокаче¬ственным новообразованиям молочной железы. Маммосцинтиграфия позволяет выявить узловые образования молочной железы и определить в них интенсивность обменных процессов. Она позволяет определить характер новообразования, место её расположения, и степень распространенности. Маммосцинтиграфия представляет собой чувствительную и специфичную методику в диагностике первичных опухолей молочной железы и его метастазов. Такое исследование считается относительно безопасным.
Главной целью маммосцинтиграфии является выявление злокачественных опухолей молочной железы, метастатической распространенности в лимфоузлы, и коррекция программ комплексного лечения рака. Главный принцип маммосцинтиграфии — это количественная и визуальная оценка накопления и распределения диагностического радиофармпрепарата в ткани железы. Этот препарат обладает повышенной тропностью к злокачественным клеткам.
- Выявить первичный очаг опухоли молочной железы до того как проявятся клинические признаки болезни.
- Выявить пораженные опухолевым процессом лимфатические узлы.
- Прогнозировать резистентность опухоли к химиотерапии.
- Оценить эффект лучевой терапии, и химиотерапии опухоли молочной железы.
Показания к проведению маммосцинтиграфии
Клинические показания к проведению маммосцинтиграфии:
- Мастопатия (фиброзно-кистозная).
- Подозрение на рак.
- Дифференциальная диагностика непальпируемых и пальпируемых опухолей молочной железы.
- Прогнозирование резистентности новообразования к химиотерапии.
- Наблюдение за результатами лучевой и химиотерапии при раке.
- Диагностика повторного возникновения рака молочной железы.
Противопоказания к проведению маммосцинтиграфии
Среди противопоказаний для проведения процедуры выделяют:
- Общее тяжелое состояние пациента, которое затрудняет выполнение определенных манипуляций, необходимых при маммосцинтиграфии (укладка на процедурный стол, введение радиофармпрепаратов, контроль физиологических отравлений).
- Беременность.
- Период лактации.
Метод проведения маммосцинтиграфии
Маммосцинтиграфию проводят с использованием специальных радиофармпрепаратов. Препарат вводится внутривенно. Пациенту необходимо не есть минимум четыре часа до проведения процедуры. Через полчаса после введения препарата врачи проводят планарную сцинтиграфию в 3-х стандартных проекциях (две боковые и передняя), которые иногда дополняются косыми проекциями. Цель последних, это уточнение локализации выявленной опухоли.
При прямой проекции пациенток размещают лежа на спине, руки закинуты за голову. При боковых проекциях пациентка лежит на животе, руки отведены вперед, молочные железы свободно свешены вниз. Врачи максимально приближают детектор к обследуемой железе.
Качественная «картинка» молочных желез, окружающих их тканей и органов обеспечивает регистрация 100 тысяч импульсов для прямой проекции. Для боковых проекций проводится регистрация по 500 тысяч импульсов.
После проведения маммосцинтиграфии врачи проводят анализ полученной информации.
Время проведения исследования составляет около тридцати минут.
Главными параметрами получаемой информации считаются сцинтиграммы, полученные с экрана гамма-камеры либо дисплея компьютера. Это цифровые данные, в которых содержатся результаты содержания препарата в областях, которые исследовались. Визуальная оценка позволяет выявить очаговую патологию, локализацию процесса, определить размеры и количество очагов поражения, а также остальных аномалий в распределении и накоплении радиофармпрепарата в мягких тканях желез и по ходу лимфоколлекторов.
Оценка накопления препарата в самой железе и лимфоузлах проводится по боковым сцинтиграммам. Сцинтиграммы прямой проекции служат для дополнительной оценки под-, надключичных, и парастернальных областей оттока лимфы на стороне поражения, а также с контрлатеральной стороны.
(495) 545-17-44 — клиники в Москве и за рубежом
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
Протонная терапия позволяет онкологам-радиологам добиваться максимально губительного влияния излучения на опухоль, одновременно сводя к минимуму воздействие на здоровые ткани и органы и сдерживая риск развития побочных эффектов лечения.
Позитронно-эмиссионная томография может оказать помощь врачу-радиологу там, где рентген-исследование или МТР остаются бессильны. Определить злокачественную природу некоторых опухолей возможно только во время операции, либо, использовав ПЭТ/КТ технологию. Второй метод является преимущественным, как безболезненный и эффективный. Достоверность информации, получаемой при ПЭТ диагностике, стремится к 90 процентам, в то время как МРТ дает только 50-70 процентов точности.
источник
Сканирование с использованием радиоактивных изотопов является простой и наиболее широко распространенной техникой обнаружения опухолевых метастазов. В ряде случаев эта методика бывает весьма неточна, т. е. выдает большой процент некорректных результатов. Это может быть связано, с одной стороны, с недостаточной чувствительностью детектирующих методов (влияет на процент позитивных результатов в опухолевой ткани), а с другой стороны — с низкой специфичностью (влияет на процент негативных результатов в здоровой ткани).
Однако доза получаемой пациентами радиации крайне низка, методика признана безопасной и обладает хорошей воспроизводимостью результатов. Кроме того, она относительно дешева в применении.
Изотопное сканирование наиболее ярко проявляет себя в диагностике скелетных метастазов. Сканирование костной ткани в настоящее время является процедурой, которую наиболее часто проводят в большинстве сервисных клинико-диагностических лабораторий. В сканировании обычно используют фосфоросодержащие соединения, помеченные технецием.
Изотопы быстро накапливаются в костной ткани, причем уровень поглощения зависит от регионального кровоснабжения и скорости образования новых костных тканей. Так как метастазы обычно характеризуются усиленным кровоснабжением и повышенной активностью остеобластов, эти области накапливают изотопные метки более интенсивно, чем здоровые ткани. У данного правила есть и исключения. Например, множественная миелома характеризуется крайне низкой активностью остеокластов.
Так как процесс поглощения изотопов является неспецифическим процессом, множество причин могут вызвать его увеличение. Трещины и переломы ребер, артриты и деформации позвоночника при остеопорозе — все это может вызвать повышенное поглощение изотопной метки и быть ошибочно принято за наличие метастазов у больных раком. Таким образом, наличие единичной области повышенного поглощения изотопа следует интерпретировать с большой осторожностью.
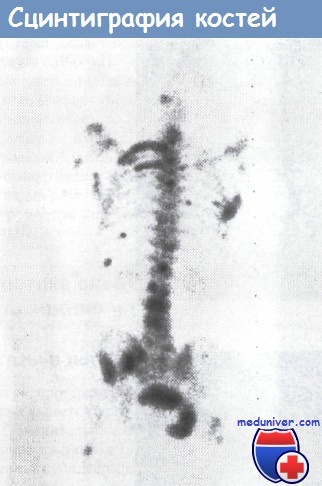
Представлены исследования больного карциномой простаты.
При обнаружении данного факта следует обследовать подозрительную область организма радиографически, а если потребуется, то и с помощью компьютерно-томографических методов. Особенно это касается обнаружения единичных областей повышенного поглощения в позвоночном столбе, так как для него характерна высокая вероятность дегенеративных заболеваний. И все же обнаружение областей повышенного накопления радиоактивной метки у онкологических больных чаще всего бывает связано с возникновением вторичных опухолей, и каждый такой случай нуждается в тщательной проверке.
При обнаружении множества очагов повышенного накопления изотопа почти с уверенностью можно говорить о распространении опухоли. В настоящее время изотопное сканирование костей считается основной диагностической процедурой в определении стадии заболеваемости и проводится у всех больных с первичной карциномой молочной железы.
При диагностике опухолей печени в сканировании используют серный коллоид, меченный 99m Тс. Метастазы детектируются как области пониженного поглощения изотопа. Изотопное сканирование печени является менее точным методом, чем КТ-сканирование, и использование этой методики в последнее время постоянно сокращается.
Для обнаружения отдаленных метастазов при колоректаль-ном раке сейчас используют сцинтиграфию — новую методику с применением следовых количеств меченных монокло-нальных антител. При раке молочной железы и злокачественной меланоме сейчас часто практикуется удаление железы Вирхова как альтернатива стандартной региональной лимфаденоктомии.
При хирургическом удалении железы Вирхова часто отпадает необходимость в чистке подмышечных лимфоузлов — например, у больных раком молочной железы эта операция с вероятностью 95% предотвращает их поражение. Данная методика требует предварительного проведения лимфосцинтиграфии для точной локализации железы и минимализации хирургического вмешательства.
В диагностике опухолей нейроэндокринной системы для точной локализации метастазов можно пометить лекарственные препараты, такие как окситоцин (аналог соматостатина), которые будут специфически связываться с соматостатиновыми рецепторами.
источник
Теперь-то я точно уверена: если человек заранее готов к возможности возращения болезни, это значительно поможет снизить страх рецидива. И рецидив в этом случае нужно рассматривать не как поражение, а как сигнал организма, имеющий важное психологическое значение.
Перемотать бы время назад, я бы, конечно, поступила по-другому (по крайней мере, уж план действий разработала бы на это случай).
Вот так он должен выглядеть (по моему мнению):
— УЗИ печени и малого таза – дважды в год;
— КТ или МРТ головного мозга – ежегодно;
— Сцинтиграфия скелета – ежегодно.
Сегодня мы поговорим о том, как я проходила сцинтиграфию костей скелета.
Первый раз мне назначил эту процедуру мой хирург (где-то на 7-й день после мастэктомии), т.к. опухоль моя располагалась аккуратно возле грудины, чтобы исключить вероятность «убегания метастазов».
Честно говоря, плохо помню всё эту процедуру. Так как аппаратуры такой в Белгороде нет, всех больных отправляют на обследование в Старый Оскол (Лебединский ГОК в свою больницу закупил это «сокровище»). Погрузили нас, шестерых женщин, (все с трубками, с дренажами, со швами) в «скорую» и отправили в путь – 150 км по раздолбанной дороге (ремонт дороги в этот год был в полном разгаре, жарища за 30). А для меня это счастливый случай – вырваться домой хоть на пару часиков…
Короче, ничего не отложилось в моей головушке… (при выписке сказали, что всё хорошо, на этом и успокоились).
Второй раз, через полтора года – обследование в Санкт-Петербурге. Привели меня к этому сильные боли в ноге (я об этом уже писала). Боли ужасные, такое ощущение, что горит кость. Обезболивающие пью горстями…
Конечно, стоит признаться самой себе, что отнеслась я к этому сигналу неправильно – нужно было сразу бить тревогу. А я просила врачей быстрее «поставить меня на ноги» с помощью блокад, уколов, таблеток. Ведь только начался учебный год в бассейне, вновь набранные группы детишек требовали моего постоянного присутствия и внимания, родители ждали результатов. Ну никак нельзя мне было болеть. Думала «проскочить» как с остеохондрозом, и не думала, что может быть всё гораздо серьёзнее.
А надо было подумать. Это ещё один мой горький опыт, который можно взять на вооружении тем, кто оказался в подобной ситуации, кто перенёс рак молочной железы. А ведь один из врачей настаивал на основательном обследовании. Но я оказалась настойчивей и убедила сама себя, что у меня остеохондроз (или ущемление седалищного нерва, или еще что-то).
Больные, имеющие болезни сердца, не должны принимать блокаторов, способных накапливаться в тканях. Следует исключить все препараты брома (например, в микстурах от кашля и успокоительных средствах). Это исключит появление погрешностей при диагностике.
Облучение пациента настолько мало, что можно проводить диагностику ежемесячно. Общая доза облучения при проведении одного исследования в пять – пятьдесят раз меньше, чем при проведении рентгенологической диагностики. Расчет эффективной дозы зависит от препарата с учетом возможности отдаленных последствий для организма в целом. Специалисты радиологи учитывают различную радиочувствительность отдельных органов. Так, мера риска появления стохастических эффектов в легких значительно выше, чем например, в щитовидной железе.
Сцинтиграфия костей проводится в два этапа.
На первом этапе внутривенно капельно вводится специальный контрастный краситель, после чего производится сканирование (один или два раза), при выполнении которого нужно лежать прямо и не двигаться. Чаще всего в организм вводится изотоп технеций или радиоактивный стронций. Через три часа после этого проводится сканирование всего организма — второй этап процедуры, при котором пациент должен удобно лежать на специальном столе. Продолжительность обследования — примерно час.
Особой подготовки к проведению остеосцинтиграфии не нужно, но перед обследованием нужно много пить. Это помогает получать более качественные снимки, а также способствует более быстрому выведению контрастного красителя из организма пациента. Результаты обследования отправляются врачу, который и объяснит больному и его родственникам полученные результаты, например, расскажет, есть ли костные метастазы злокачественных новообразований.
Метод проведения сцинтиграфии костей скелета
Сцинтиграфия скелета подразделяется на статическую и динамическую.
Статическая сцинтиграфия. Применяют для получения небольшого количества изображений и снимков с целью изучения морфологических особенностей. При этом обнаруживаются «горячие» и «холодные» зоны, соответствующие злокачественным опухолям.
Динамическая сцинтиграфия. В этом случае делается запись в виде целой серии снимков. Непрерывно либо через равнее промежутки времени сканером передается информация о состоянии скелета и наличии в нем патологических зон. Частота кадров пропорциональна скорости процессов, которые изучаются при диагностике.
Всю полученную информацию обрабатывают на компьютере и передают лечащему врачу вместе с описанием.
Сцинтиграфию костей скелета проводят в следующих случаях:
Диагностика причины необъяснимой боли в кости.
Диагностики перелома кости, которые не четко видны на рентгене.
Выявление рака кости и определения метастазов в другие органы.
Наблюдение в динамике процесса лечения рака и его эффективности.
— беременность и кормление грудью
— аллергические реакции на лекарственные препараты.
После проведения исследования пациент не имеет никаких ограничений в повседневной жизни.
В течение суток рекомендуется пить больше жидкости, соблюдать меры личной гигиены для избавления от остатков радионуклида в крови. После прохождения исследования, как только придете домой, обязательно примите тёплый душ: вымойте волосы, хорошо натрите тело мыльной мочалкой. Все вещи, в которых Вы были во время исследования, сразу запустите в стиральную машинку.
Ни в коем случае не приносите домой ватки, бинты или пластыри, которые Вы использовали после введения Вам радиоактивного вещества. Лучше всего их выбросить в клинике в специальные урны для радиоактивного мусора.
Возможно появление аллергической реакции на радиофармпрепараты в виде крапивницы или кожного зуда.
В тяжелых случаях возможны проблемы с затрудненным дыханием, изменением артериального давления, общим тяжелым состоянием.
В моём случае – повышенная сонливость.
Онкологические заболевания, которые чаще всего дают метастазы в кости:
Миелома – в 90 процентах случаев.
Рак молочной железы – в 75 процентах случаев.
Рак предстательной железы – в 65-75 процентах случаев заболевания.
Рак щитовидной железы – около 60 процентов всех случаев.
Рак легких – 30-40 процентов.
Рак почек – в четверти случаев.
Меланома – от 14 до 45 процентов.
И ещё. Процедура эта (сцинтиграфия) в подавляющем большинстве случаев платная. Но тем, кто перенёс рак молочной железы, экономить на ней не советую. Это должно быть понятным из выше сказанного.
Дорогая, Мариночка! К сожалению «правильная мысля — приходит опосля». И тема тактического поведения пациентов, перенесших РАК — очень актуальна. Так как каждый из Вас, прошедший через лечение онкологических заболеваний, старается забыть, сжечь и т.д. эту страничку жизни. Но настороженность ДОЛЖНА быть на протяжении всей жизни. Еще раз повторюсь НАСТОРОЖЕННОСТЬ, а не СТРАХ!
Есть небольшие неточности в тактике обследования:
1. Ультразвуковое исследование печение необходимо проходить 1 раз в 3 месяца на протяжении первого года после постановки на учет в онкологический диспансер;
2. В онкологических диспансерах на компьютерных томографах существует программа «TOTAL BODY SCAN», позволяющая минимализировать лучевую нагрузку на организм человека, при этом сканируется все тело пациента, что позволяет «отследить» отдаленно возникшие метастазы (это как флюорографическое обследование для онкологических пациентов).
Я думаю, что с твоими писательскими способностями и чертой характера — ВСЕГДА БЫТЬ ПЕРВОЙ, удача будет на твоей стороне! Ты сама с достоинством пройдешь этот путь и еще многим-многим поможешь.
Горжусь тобой, ровняюсь на тебя и ВЕРЮ.
Дорогая моя подружка! Мне тоже очень жаль «про эту мыслю». Сколько раз ты меня просила сделать обследование, а я только отмахивалась и оставляла «на потом». Но теперь, что об этом говорить…
Я тебе очень, очень благодарна за то, что ты для меня сделала и продолжаешь делать. За твоё терпение, любовь и поддержку.
Люблю, ценю и дорожу тобой.
Марина! Спасибо, за то, что делишься наболевшим. Контроль денйствительно весьма формальный, приходится действовать самой. твои советы и взгляд на жизнь очень помогают. А вообще, я очень рада, что ты опять появилась в моей жизни! Не унываешь сама и даешь радость общения с тобой!
Валентина Петровна! Я о вас всегда помню. Помню наши вечера в гостиницах, посиделки, разговоры. Здоровья вам.
источник
Радиоизотопное исследование молочных желез проводят с Тс-99т-Технетрилом. Тс-99т-Технетрил представляет собой комплекс органического носителя с метастабильным изотопом химического элемента Тс. Период полураспада Тс-99т — 6 часов. Препарат покидает организм преимущественно через гепатобилиарный тракт и тонкий кишечник (40%) и в меньшем количестве — с мочой (22%). Активность при введении радиофармацевтического препарата (РФП) составляет 555 МБк 99тТс на одного пациента. Лучевая нагрузка при исследовании составляет 2,5 мЗВ на одно введение препарата.
При работе с РФП, мечеными 99тТс, радиоизотопное исследование молочной железы выполняется в специализированной радиоизотопной лаборатории на томографической гамма-камере большого поля зрения с коллиматором высокого разрешения для низких энергий гамма-излучения с фотопиком для 99тТс — 140 КэВ и ширине окна дискриминатора 15-20%.
Для радиоизотопного исследования молочных желез препарат вводят внутривенно натощак или не менее чем через 4 часа после приема пищи (исключая чай и кофе). Спустя 30 минут после введения проводится планарная сцинтиграфия в трех стандартных проекциях (передняя и 2 боковые), которые могут быть дополнены косыми проекциями, для уточнения локализации выявленного образования.
Пациентки размещаются лежа на спине с закинутыми за голову руками (для прямой проекции), на животе, со свободно свешенной вниз молочной железой и отведенными вперед руками (для боковых проекций). Детектор должен быть максимально приближен к обследуемой железе. Общее время исследования 30 минут.
Качественное изображение молочных желез, окружающих органов и тканей обеспечивается регистрацией 1000 тысяч импульсов для прямой проекции и по 500 тысяч импульсов для боковых.
Основными параметрами получаемой информации являются сцинтиграммы с экрана гамма-камеры или дисплея компьютерной системы, цифровые данные по относительному содержанию препарата в исследуемых областях. Визуальная оценка заключается в выявлении очаговой патологии, локализации процесса, определении количества и размеров очагов поражения, а также других аномалий в накоплении и распределении РФП в мягких тканях молочных желез и по ходу лимфатических коллекторов.
Оценка накопления РФП в самой железе и в проекции аксиллярных групп лимфатических узлов осуществляется по боковым сцинтиграммам. На сцинтиграммах в прямой проекции дополнительно оцениваются парастернальные, над- и подключичные области лимфооттока на стороне поражения и с контрлатеральной стороны.
Для количественной характеристики выявленных патологических очагов накопления Тс -99т-Технетрил в молочной железе рассчитывается индекс очаг/фон как соотношение среднего счета сцинтилляций в соответствующих областях, при этом в качестве фона используется окружающая новообразование здоровая ткань. Индекс очаг/миокард отражает соотношение уровней кровотока в опухоли и в сердечной мышце, поскольку и для той и для другой ткани Тс -99т-Технетрил является маркером кровотока со сходными характеристиками кинетики. Определение первоначального объема опухолевого узла проводится путем измерения его размеров в 2-х проекциях, принимая, что опухоль имеет эллипсоидную форму.
Определение объема опухоли и индекса очаг/миокард используется для оценки эффективности проводимой химиотерапии при комплексном лечении рака молочной железы.
«Как проводят радиоизотопное исследование молочных желез» и другие статьи из раздела Заболевания молочных желез
источник
Высокий уровень достоверности, низкие лучевые нагрузки на больного, неинвазивность- свойства, характризующие радиоизотопные методы диагностики in vivo. Избирательное поглощение или выведение различными органами и тканями химических соединений, меченых радиоактивными изотопами, лежит в основе метода. Регистрация α-изучения (редко β,γ -излучения), испускаемого при распаде изотопа, методом сцинтиграфии, позволяет получить изображение исследуемого органа или пораженных тканей. Статическая сцинтиграфия позволяет составить представление о размерах, структуре, топографоанатомических особенностях исследуемого органа. Для этого используются препараты, которые относительно длительно задерживаются и медленно перераспределяются в исследуемом органе или пораженных тканях. Оценка функционального состояния исследуемого органа или системы возможна при применении тех радиофармпрепаратов, концентрация которых в органе быстро изменяется во времени. Радиоизотопное сканирование применяется как с целью решения проблем первичной диагностики, так и уточненной диагностики. В случае гиперфиксации радиофармпрепарата в очаге поражения изображение расценивается как позитивное, при гипофиксации — как негативное.
Основными задачами радиоизотопного сканирования в клинической онкологии являются:
диагностика первичной опухоли;
изучение распространенности опухолевого процесса;
оценка эффективности лечения онкологического больного;
выявление рецидивов заболевания.
Для диагностики опухолевого поражения лимфатической системы широко применяется непрямая радиолимфография с использованием радиофармпрепаратов 99mTс или 113min. Нижняя непрямая радиолимфография позволяет получить изображение пахово-бедренных, наружных и общих подвздошных, парааортальных лимфатических узлов. Подмышечные, над- и подключичные узлы исследуются при выполнении верхней радиолимфографии. Препарат вводится внутрикожно или подкожно. Место введения радиофармпрепарата определяет локализация лимфатических узлов, о состоянии которых необходимо получить информацию. Хорошие результаты получены при выявлении поражения лимфатических узлов (злокачественными лимфомами, метастазами) при внутривенном введении нитрата галлия — 67Ga. Однако число ложноположительных результатов при использовании нитрата галлия-67Ga, достаточно велико.
Сканирование печени широко применяется в клинической онкологии с целью диагностики как первичной опухоли, так и метастатического поражения органа. При этом наиболее часто применяется внутривенное введение коллоидных радиофармпрепаратов, меченных 99mTc. Сканирование скелета с целью выявления метастазов — чувствительный диагностический метод. Исследования проводят с помощью фосфатных комплексов 99mТс. В большинстве наблюдений в очагах метастатического поражения происходит гиперфиксация препарата. Метод позволяет выявить метастазы в костях на 2-12 месяцев раньше и в большем количестве, чем это возможно при рентгенологическом исследовании.
Сцинтиграфию поджелудочной железы проводят с применением метионина, меченного 75Se. Опухолевое поражение проявляется очагами снижения или отсутствия накопления радиофармпрепарата .
Для оценки структуры почек используют глюкогептонат и димеркаптосукγцинат, меченные 99mTc.
С целью диагностики очаговых поражений у онкологических больных применяют также сцинтиграфию костного мозга, надпочечников, щитовидной железы, головного мозга, вилочковой железы, слюнных желез и других органов.
Радиоиммуносцинтиграфия — метод, основанный на иммунной реакции антиген-антитело. При этом антитела, меченные радионуклидами, вводят больному внутривенно. Эти антитела получают путем гибридомного метода, они являются моноклональными и тропны к тумороспецифичным или так называемым опухолеассоциированным антигенам. После инъекции радиофармпрепарат накапливается в опухоли. Регистрация излучения наружными средствами позволяет определить наличие злокачественной опухоли и отдаленных метастазов, рецидива опухоли. Идеальный антиген должен быть тумороспецифичен, продуцироваться всеми клетками опухоли в количестве, достаточном для связывания с циркулирующими антителами, существовать в опухоли в неметаболизированном виде. Этим требованиям в достаточной мере соответствуют следующие антигены: карцино-эмбриональный антиген, α-фетопротеин, трофобластический β-глобулин, генотипические антигены при лейкемиях и лимфомах, вирус-зависимые антигены в гепатомах, эпителиальные поверхностные антигены в опухолях яичников, колоректальном раке, раке молочной железы. Радиоактивными метками могут быть 99mТс, 123J, 131J или 111In.
Термография. Сущность метода заключается в регистрации спонтанного теплового излучения поверхности тела человека и получении термографических изображений. Наиболее часто в диагностике новообразований применяют дистанционную инфракрасную термографию, этот метод называют еще тепловидением. Обнаружение асимметрии температурного рисунка лежит в основе диагностики патологических процессов. Злокачественные новообразования выявляются на термограммах патологической гипертермией, что обусловлено высоким уровнем метаболических процессов и особенностями кровоснабжения опухоли.
Применение термографии направлено на решение следующих задач:
дифференциальная диагностика доброкачественных и злокачественных опухолей;
определение распространенности опухолевого процесса;
диагностика рецидивов и метастазов при динамическом наблюдении за больными с применением тепловидения;
прогнозирование течения опухолевого процесса с учетом степени выраженности и площади;
контроль за эффективностью консервативного противоопухолевого лечения.
Наиболее широко термография применяется при обследовании больных с опухолями молочной и щитовидной желез, мягких тканей, костей, кожи, ЛОР-органов и при лимфопролиферативных заболеваниях.
Опухолевые маркеры. Несмотря на интенсивные исследования, не удалось обнаружить единственный и простой тест, который указывал бы на наличие у человека злокачественной опухоли. Тем не менее существуют лабораторные исследования, позволяющие подтвердить наличие рака и применяемые при наблюдении за больными в процессе и после лечения. В сыворотке крови были обнаружены онкофетальные протеины, которые имеют высокую концентрацию в период эмбрионального развития и фактически исчезают в послеродовом периоде. Появление их вновь в сыворотке крови взрослого человека связано с возникновением определенных типов рака. Однако оказалось, что чувствительность и специфичность этих биологических маркеров недостаточны для использования в целях диагностики, поскольку ряд неонкологических заболеваний сопровождается появлением этих антигенов. Все эти сведения позволяют так определить область применения опухолевых маркеров:
дифференциальная диагностика злокачественных и доброкачественных процессов,
первичная диагностика опухоли,
топическая диагностика опухоли при первично невыясненном очаге,
оценка распространенности процесса,
раннее выявление рецидивов и метастазов,
оценка эффективности проводимой терапии.
Наибольшее применение нашли раково-эмбриональный антиген, a-фетопротеин, хорионический гонадотропин и трофобластический бета-глобулин. Проведенными исследованиями установлено, что определение a- фетопротеина (АФП) наиболее перспективно в мониторинге гепатоцеллюлярного рака. Повышенный уровень a-фетопротеина обнаружен во всех незрелых тератомах, содержащих элементы желточного мешка, у больных с опухолями яичка и яичников, имеющих элементы желточного мешка. Выявлена корреляция между уровнем a-фетопротеина и количеством элементов желточного мешка в опухолях. Высокие уровни a-фетопротеина определяется у ряда больных раком желудка (около 15%), поджелудочной железы (24%), желчных путей (25%), пищевода (3%), толстой кишки и почки (3%).
Раково-эмбриональный антиген (РЭА). Относится к группе онкофетальных протеинов. Уровень РЭА определяется с помощью радиоиммунологического анализа (РИА), в сыворотке крови повышен у 40-80% больных со злокачественными новообразованиями эндодермального происхождения, у 20-30% больных с другими формами рака и у 10-20% больных с доброкачественными опухолями. Повышение уровня РЭА отмечено у курильщиков, больных алкогольным циррозом, инфекционными заболеваниями легких. Частота положительных тестов на РЭА при раке толстой кишки колеблется от 32 до 86% в зависимости от стадии, у 60-64% больных раком поджелудочной железы, у 40-60% раком желудка, у 50% раком щитовидной железы, у 30-50% раком молочной железы, у 30-36% больных раком мочевого пузыря . Высокий уровень РЭА в сыворотке крови коррелирует с плохим прогнозом.
Хорионический гонадотропин (ХГ) секретируется интерстициальными клетками опухолей трофобласта и хорионэпителиомы. Повышенный уровень ХГ наблюдается у 100% больных с опухолями трофобласта и у 70% больных с несеминомными опухолями яичка, содержащими элементы сцинтиотрофобласта, у некоторых больных раком молочной железы. Уровни ХГ и АФП бывают повышены при опухолях яичка и наличии в них элементов эмбрионального рака и сцинтиотрофобласта. Содержание ХГ увеличено в 8-11% случаев при воспалительных заболеваниях кишечника, язвенной болезни 12-перстной кишки, циррозе печени. Обнаружен ассоциированный с опухолью поверхностный антиген СА-125, повышенный уровень которого обнаружен у 80% женщин при раке яичников . Однако он также не пригоден для скрининга.
К маркерам опухолевых клеток относятся также изоферменты : щелочная фосфатаза, повышение уровня которой отмечено при метастатическом поражении печени, раке легкого, молочной железы, шейки матки, тела матки, толстой кишки, лимфомах, миеломе, при остеогенной саркоме и метастазах в кости, при различных заболеваниях печени. Повышение в сыворотке крови уровня кислой фосфатазы наблюдается при метастазах рака предстательной железы в кости и раке молочной железы; эктопические гормоны: АКТГ, АДГ, МСГ, ТТГ, СТГ, КТ, инсулин, глюкагон, пролактин, эстрогены, ФГС- при апудомах. Моноклональные иммуноглобулины — при определенных опухолях кроветворных и лимфоидных органов.
Морфологическое подтверждение диагноза имеет первостепенное значение для решения вопроса о лечении онкологического больного. Морфологические исследования в клинической онкологии включают цитологические и гистологические методы.
Пути получения материалов для цитологических исследований различны:
1 . Мазки-отпечатки получают путем непосредственного соприкосновения между поверхностью опухоли (при наружных локализациях) или кусочком опухоли и предметным стеклом. Для получения мазков-отпечатков можно использовать ватные или марлевые маленькие тампоны, синтетические щеточки, проволочные петли, кюретки, иглы. При эксфолиативном цитологическом исследовании после эксфолиации (отслоения эпителия полых органов с помощью специальных механических приспособлений или растворов) специальной обработке подвергаются жидкие среды полостных органов (слюна, мокрота, желудочный сок, моча, смывы и др.) с последующим нанесением материалов на предметное стекло.
Мазки-отпечатки можно приготовить с поверхности разреза опухоли или лимфатического узла во время операции; в онкологии широко применяется такой метод получения материала для цитологического и гистологического исследований как выскабливание слизистой оболочки цервикального канала и полости матки. При приготовлении материала для цитологического исследования используют мазки-отпечатки.
2. Цитологическое исследование осадка из жидкости (экссудативный плеврит, перикардит или асцитическая жидкость, спинномозговая жидкость с целью обнаружения опухолевых клеток. При этом жидкость получают с помощью плевральной, перикардиальной, спинномозговой пункции, лапароцентеза.
3. Цитологическому исследованию (по показаниям) подвергаются также костный мозг (получаемый с помощью пункции грудины или подвздошной кости) и кровь для обнаружения опухолевых клеток.
4. При пункционной аспирационной биопсии материал для цитологического исследования получают непосредственно из опухоли или из лимфатического узла, которые недоступны осмотру и не позволяют получить слущиваемые с их поверхности опухолевые клетки. С улучшением тщательно контролируемого изображения органов и опухолей (рентгеноскопия с электронно-оптическим преобразованием, рентгеновская КТ, ультразвуковая КТ) пункционная аспирационная биопсия опухоли тонкой иглой становится доступной практически в любой анатомической области. Опытный цитолог с помощью обычного микроскопа может поставить правильный диагноз в 90-95%.
Гистологическое исследование биопсийного материала — второй наиболее информативный и достоверный метод морфологической диагностики новообразований. Правильный диагноз с помощью этого метода м. б. установлен у 99% онкологических больных. Материал для гистологического исследования получают различными методами: путем пункции специальными иглами (получение столбика или кусочка опухолевой ткани), выскабливание ложечкой или кюреткой цервикального канала и полости матки, инцизионной (эксцизионной, операционной, открытой) биопсии, осуществляемой путем иссечения кусочка опухоли, тотальной биопсии, при которой для гистологического исследования удаляют новообразование (опухоль или лимфатический узел) полностью.
Материалы для цитологического и гистологического исследований должны быть своевременно доставлены в лабораторию.
Таким образом, современный арсенал диагностических методик достаточно велик, а каждая из них обладает высокой разрешающей способностью. Однако, результативной диагностика становится лишь в том случае, когда используется адекватный набор диагностических методик, применяемых в разумной последовательности. Незнание врачами этих вопросов в сочетании с недостаточной оснащенностью лечебных учреждений (в том числе онкологических) объясняют тот факт, что стала стабильной частота выявления опухоли в III-IV стадиях выше 60% в нашей стране.
Следует также подчеркнуть, что ранняя диагностика отчетливо влияет на результаты лечения: активное целенаправленное лечение предопухолевых процессов снижает риск развития малигнизации почти у всех больных, лечение доклинически выявленных злокачественных опухолей приводит к достижению 5-летних полных ремиссий более, чем у 80% больных, а клинически выявленные опухоли удается излечить (достичь 5-летних полных ремиссий) лишь в 5-15% случаев.
Эти сведения должны помочь врачу любой специальности сконцентрировать свое внимание на выборе адекватных диагностических методик для улучшения диагностики злокачественных опухолей.
Основу диагностики опухолей составляет современное их распознавание на ранних стадиях заболевания, когда наиболее эффективно применение радикальных методов лечения. Поскольку онкологические больные обращаются за помощью к врачам разных специальностей, то компетентным в вопросах своевременной диагностики опухолевых и предопухолевых заболеваний должен быть каждый врач.
Клинические проявления опухолевых и предопухолевых заболеваний часто бывают мало выражены, поэтому необходимо активное обследование больного. Диагностику опухолей разделяют на первичную, осуществляемую обычно в условиях поликлинического обследования или при проведении профилактических осмотров, и уточняющую, которую, как правило, проводят в стационаре.
В диагностике опухолей большое значение имеют клинические и инструментальные /рентгенологический, эндоскопический, ультразвуковой, радиоизотопный, морфологический/ методы исследования. При первичной диагностике опухолей клинические методы обследования позволяют заподозрить или диагностировать опухоль и наметить рациональный план применения инструментальных методов исследования. Уточняющая диагностика у больных с уже выявленной злокачественной опухолью или с подозрением на нее направлена на оценку индивидуальных особенностей заболевания и состояния больного, для выбора наиболее рационального вида лечения.
Для выявления индивидуальных особенностей заболевания используют различные диагностические методы. Самым распространенным является рентгенологическое исследование, позволяющее установить локализацию и границы опухоли. Оно включает бесконтрастные и контрастные методы исследования.
К бесконтрастным методам исследования относятся — полипозиционная рентгеноскопия /или просвечивание/, рентгенография и линейная томография. Данные методы в основном используются для оценки состояния органов грудной полости, головы и шеи, конечностей, реже брюшной полости. Многоосевое просвечивание с использованием функциональных проб позволяет составить план более сложного рентгенологического обследования. При рентгенографии некоторых органов используют естественный контраст — воздух, способствующий более четкому выявлению границ и структуры патологического очага, например в гортани, полых органах и т. п.
Наиболее показательно применение бесконтрастных методов рентгенологического исследования при опухолях органов грудной полости и, в частности, при раке легкого. В настоящее время следует различать три формы первичного рака легкого, которые обладают специфическими рентгенологическими признаками: 1/центральный; 2/ периферический; 3/ бронхиолоальвеолярный.
Рентгенологическая картина центрального рака обусловлена самой опухолью, возникающим нарушением проходимости бронха, осложнениями, развивающимися в связи с прогрессирующим ростом опухоли и метастазами. Для выявления рентгенологических симптомов обязательно выполняются рентгенограммы в двух проекциях /прямой и боковой со стороны поражения/, линейные томограммы /срединная — для получения отображения просветов трахеи и главных бронхов, а также косые томограммы или томограммы в боковой проекции для получения просвета долевых бронхов/. Дополнительно для возможного получения представления о состоянии лимфатических узлов средостения проводится контрастное исследование пищевода.
Наиболее частым рентгенологическим симптомом, встречающимся при центральном раке легкого, является нарушение бронхиальной проходимости различной фазы развития — от гиповентиляции до полного ателектаза, определяющегося на рентгенограммах в виде треугольной тени. Величина тени зависит от уровня поражения бронха — сегмент, доля или легкое, а также от сроков наступления обтурации соответствующего бронха. Наряду с нарушением бронхиальной проходимости определяются изменения корня легкого — увеличение его в размерах, расширение, уплотнение, нечеткость, полицикличность наружных контуров. Это обусловлено увеличением лимфатических узлов бронхепульмональной и трахеобронхиальной групп. Изменения лимфатических узлов можно определить более точно лишь при использовании линейных томограмм. Нередко течение центрального рака легкого осложняется воспалительными изменениями в недостаточно дренируемом участке легочной ткани и по мере прогрессирования воспалительного процесса может наступить гнойное расплавление с формированием полостей распада.
Одним из часто встречающихся осложнений рака легкого является скопление жидкости в плевральных полостях. Для выявления минимального количества жидкости необходимо применять рентгенографию в латеропозиции и полипозиционное просвечивание.
Особенно велико значение рентгенологического исследования при периферическом раке легкого, где оно нередко является единственным методом диагностики, развиваясь в периферических отделах легочной паренхимы, подолгу оставаясь клинически бессимптомной, опухоль нередко является находкой различных видов рентгенологического исследования.
Характерным для периферического рака является следующий симптомокомплекс: наличие тени узлового образования округлой или неправильно округлой формы, с нечеткими, нередко «спикулоподобными» контурами. По мере роста опухоли тень ее приобретает выращенную интенсивность.
Подчас она бывает неоднородной за счет наличия участков просветления, отображающих распад. При распространении опухоли по направлению в корню легкого отмечают симптом «отводящей дорожки». Довольно специфическим симптомом рака является вырезка Гитлера, сориентированная по направлению в корню легкого и обозначающая место входа в опухоль бронхо-сосудистого пучка.
Таким образом, рентгенологическое исследование является высокоинформативным методом в диагностике рака легкого. Однако он имеет не только преимущества, но и определенные недостатки. Поэтому рентгенологическое исследование не следует использовать в качестве единственного диагностического метода, а только в комплексе с другими методами диагностики.
Более сложные контрастные методы рентгенологического исследования применяют по специальным показаниям, чаще для диагностики опухолей органов желудочно-кишечного тракта. C этой целью используют жидкие контрастные вещества, например водную взвесь бария и высококонцентрированные водные растворы органических соединений йода.
Обследование больных раком пищевода следует начинать с классического рентгенологического исследования. Показанием к этому виду исследования являются данные клинического обследования. Рентгенологическое исследование является наиболее распространенным и доступным методом дооперационной диагностики рака пищевода. К его несомненным достоинствам, наряду с простотой и доступностью, относится возможность точно определить основные характеристики опухолевого процесса.
В практической работе рентгенологов получило распространение более простое деление рака пищевода на эндофитный или плоскоинфильтрирующий и экзофитный.
При эндофитном раке рентгенологически выявляется краевой или циркулярный дефект наполнения.
Контуры дефекта наполнения в большинстве случаев ровные и четкие. Чаще при эндофитном раке соответственно дефекту наполнения определяется участок, лишений складчатости. Однако при подслизистом росте опухоли складки слизистой оболочки могут сохранятся, но они ригидны. При резко выраженном циркулярном сужении пищевода изучать рельеф внутренней его поверхности не представляется возможным.
Основными рентгенологическими симптомами при экзофитном раке пищевода является атипичный рельеф слизистой оболочки и дефект наполнения, дефект наполнения при экзофитном раке обычно глубоко вдается в просвет пищевода и в большинстве случаев имеет неровные, неправильно зазубренные контуры, что также является отображением бугристой поверхности опухоли. Непостоянные симптомы /задержка бариевой взвеси в области сужения, дополнительная тень на фоне заднего средостения, расширение просвета пищевода на месте поражения, изъязвление и др./ при экзофитном раке по сравнению с эндофитным выражены реже. Сужение просвета пищевода развивается в основном в далеко зашедших стадиях развития опухоли. Супрастенотическое расширение при экзофитном раке развивается редко.
Среди тяжелых осложнений изъязвленного рака пищевода выделяют образование свища в дыхательные пути или клетчатку средостения, основным и ведущим методом диагностики этого осложнения является рентгенологическое исследование, при котором на снимках можно отчетливо документировать выход контрастного вещества за пределы органа. Если при рентгенологическом исследовании выявляется такое тяжелое осложнение рака пищевода, как свищ, то диагностический процесс на этом завершается.
Наиболее частыми, а, следовательно, и наиболее общими рентгенологическими симптомами развитого рака желудка являются: дефект наполнения, атипичный рельеф и аперистальтическая зона в месте расположения раковой опухоли. Дефект наполнения является наиболее характерным и легко выявляемым рентгенологическим признаком раковой опухоли желудка.
Протяженность дефекта измеряется в сантиметрах и это должно находить отражение в протоколе рентгенологического исследования. Обычно протяженность дефекта наполнения, независимо от формы и размеров раковой опухоли, заметно преобладает над его глубиной. Отдельно выделяется плоский дефект наполнения, обусловленный эндофитной, плоскоинфильтрирующей формой рака желудка. Данная форма нередко представляет значительные трудности для выявления, лимитом атипичного рельефа в участке расположения опухоли обусловлен поверхностью самой опухоли. Раковая опухоль в процессе развития прорастает подслизистую оболочку и инфильтрирует мышечные слои. Начиная с этого момента стенка желудка все более утрачивает способность к перистальтике и становится ригидной и неподатливой. В границах распространения раковой инфильтрации возникает аперистальтическая зона.
Основная методом рентгенологического исследования толстой кишки является введение контрастного вещества с помощью клизмы, так называемая ирригоскопия. Для контрастирования применяют также газовые среды, нередко одновременно используют жидкие контрастные вещества и газовые среды, например так называемом двойном контрастировании. Это позволят получить более четкое представление о макроскопической форме опухоли, ее поверхности, расположении. Данному исследованию — методике первичного двойного контрастирования — в последнее время отдается предпочтение.
Рентгенологическое исследование ободочной и прямой кишки должно производится лишь после тщательного учета клинико-анамнестических и эндоскопических данных. Особенно важна предварительная ректороманоскопия при наличии клинического синдрома опухоли левой половины толстой кишки.
Рак ободочной и прямой кишки имеет явную тенденцию локализоваться в местах, где физиологически происходит длительная задержка каловых масс — отсюда чаще всего поражаются прямая, сигмовидная и слепая части кишки. Большинство исследователей выделяют две основные формы роста — экзофитную и эндофитную. Общепринятым является взгляд, что экзофитная форма рака встречается преимущественно в правой половине толстой кишки, эндофитная — в левой.
Различная макроскопичесная форма, размеры и локализация раковой опухоли могут обусловить разнообразную рентгенологическую картину, однако ряд признаков являются постоянными. К этой группе относятся: дефект наполнения /краевой, центральный, циркулярный/, атипичный рельеф слизистой оболочки, ригидность стенок, дополнительная тень на фоне просвета раздутой газом толстой кишки, симптом «ампутации» кишки. Группу непостоянных симптомов составляют: сужение просвета кишки, супра- или инфрастенотическое расширение, отсутствие гаустрации, задержка контрастного вещества у нижнего полюса дефекта наполнения при ретроградном заполнении кишки. Данные симптомы при рентгенологическом исследовании возможно выявить лишь при хорошей предварительной подготовке больного.
К рентгенографии с использованием естественной разности плотности тканей относится метод
исследования молочных желез — маммография. Диагностическая ценность маммографии в распознавании первичной опухоли в значительной степени зависит от качества ренгенограмм, которые
можно получить лишь при использовании специальных рентгенологических аппаратов — маммографов, и при соблюдении всех правил рентгенологического исследования молочных желез. Обязательными условиями выполнения маммографии являются: исследование в двух взаимно перпендикулярных проекциях /прямой и боковой/, компрессия молочной железы при помощи специальных тубусов, исследование обеих молочных желез. При раке молочной железы выявляется тень узлового образования с нечеткими или спикулоподобными контурами. На фоне тени опухоли определяются множественные сгруппированные микрокальцинаты. Эффективность маммографии высока и метод сохраняет за собой приоритетные позиции в распознавании первичной опухоли. Особое значение метод имеет при выявлении непальпируемых опухолей.
источник