Владельцы патента RU 2371202:
Изобретение относится к области медицины, в частности к онкологии, и может быть использовано для радионуклидной диагностики рака молочной железы. Способ обеспечивает снижение лучевой нагрузки на организм. Проводят внутривенное введение радиоизотопа TICI. После чего проводят сцинтиграфическое исследование через 10-15 и 180 минут в планарном режиме с определением очага гиперфиксации радиофармпрепарата, причем вводят в качестве радиоизотопа 199 TICI в дозе 270 МБк. 1 табл.
Изобретение относится к медицине, онкологии и может быть использовано для радионуклеидной диагностики рака молочной железы.
Наиболее близким к предлагаемому является способ радионуклидной диагностики рака молочной железы с использованием радиофармпрепарата 201 ТIСI, период физического полураспада которого составляет 73,1 ч [3, 4]. Механизм накопления таллия клетками организма является универсальным, являясь биологическими аналогами калия, 201 ТIСI поступает в опухолевую клетку с помощью натрий-калиевого АТФ-зависимого насоса и накапливается в митохондриях, практически не вымываясь из нее на протяжении нескольких часов. Методика проведения исследования заключается в следующем: пациентке внутривенно, в противоположную заболеванию руку, вводится 201 ТIСI в дозе 111 МБк. Затем дважды проводится сцинтиграфическое исследование с использованием высокоразрешающего параллельного коллиматора для энергий излучения до 140 кэВ — через 10-15 мин и через 3 часа. Исследование выполняется в планарном режиме с использованием нескольких проекций — прямая, правая и левая косые. Результат оценивается визуально, патологическим считается асимметричный очаг гиперфиксации радиофармпрепарата. Недостатком данного метода является высокая лучевая нагрузка на тело пациента и критические органы, что ограничивает проведение сцинтиграфического исследования с 201 ТIСI у одного пациента и не позволяет проводить контрольные исследования в процессе динамического наблюдения за опухолью в ходе химиотерапии [1, 2].
Новая техническая задача — снижение осложнений, обусловленных высокой лучевой нагрузкой на организм.
Для решения поставленной задачи в способе радионуклидной диагностики рака молочной железы путем внутривенного введения радиоизотопа TICI и последующего проведения сцинтиграфического исследования через 10-15 мин и 180 минут в планарном режиме с определением очага гиперфиксации радиофармпрепарата вводят 199 ТlСl в дозе 270 МБк.
Способ осуществляют следующим образом.
Для проведения сцинтиграфического исследования молочных желез 199 ТIСI пациентке вводят внутривенно в дозе 270 МБк. Через 15 мин и 3 часа проводят сцинтиграфическое исследование в планарном режиме. Полипозиционное планарное исследование включает:
1. Боковые проекции — для оценки состояния молочных желез. Пациентка располагается на животе на специальном матрасе со свисающими молочными железами, в этом положении молочные железы максимально отходят от передней грудной стенки, и достигается их визуализация в полном объеме. Коллиматоры располагают параллельно молочным железам.
2. Передняя прямая проекция — для визуализации аксиллярных зон и миокарда. Пациентка находится в положении лежа на спине с поднятыми за голову руками. Детектор располагают параллельно грудной клетке. В поле зрение детектора входят грудная клетка с миокардом, аксиллярные области.
При записи планарного исследования используется матрица 256×256 при аппаратном увеличении в 2 раза, каждый кадр с набором 500000 импульсов. Полученные планарные сцинтиграммы оценивают визуально, определяя очаг гиперфиксации фармпрепарата.
199 ТlСl является короткоживущим изотопом с периодом полураспада 7,4 часа. Он широко используется в кардиологии для перфузионной сцинтиграфии миокарда [5, 6]. Из данных отечественной и зарубежной литературы не известно использование 199 ТIСI для диагностики рака молочной железы.
В таблице приведены данные о накоплении 199 ТIСI в органах.
Максимальная лучевая нагрузка на яичники, тестикулы и красный костный мозг соответственно в 6,5, 3,3 и 5,2 раза меньше, чем после применения ТIСI. При анализе лучевых нагрузок на органы второй группы радиочувствительности (ПДЦ до 150 мЗв) видно, что ТIСI оказывает на критические органы в 3,6-15,5 раз большую радиационную нагрузку, чем 199 ТIСI.
Таким образом, экспозиционная доза облучения критических органов при использовании 199 ТIСI оказывается в 4-15 раз более низкой, чем в случае применения 201 ТIСI, что позволяет проводить сцинтиграфическое исследование с 199 ТIСI до 5 раз в год у одного пациента.
Механизм накопления 199 ТIСI в клетках опухоли идентичен механизму накопления 201 ТIСI. Ввиду того, что он является короткоживущим изотопом с периодом полураспада 7,4 часа, значительно снижается лучевая нагрузка на тело пациента и критические органы. Максимальная лучевая нагрузка на яичники, тестикулы и красный костный мозг соответственно в 6,5, 3,3 и 5,2 раза меньше, чем после применения 201 ТIСI. При анализе лучевых нагрузок на органы второй группы радиочувствительности (ПДД до 150 мЗв) оказывается, что ТIСI оказывает на критические органы в 3,6-15,5 раз большую радиационную нагрузку, чем 199 ТIСI. Таким образом, экспозиционная доза облучения критических органов при использовании 199 ТIСI оказывается в 4-15 раз более низкой, чем в случае применения 201 ТIСI, что позволяет проводить сцинтиграфическое исследование с 199 ТIСI до 5 раз в год у одного пациента.
| Таблица | ||
| Органы | 185 МБк 199 ТI(мЗв) | ПДД (мЗв/год) |
| Все тело | 1,25 | 50 |
| Тестикулы | 0,75 | 1 группа органов |
| Яичники | 1,68 | |
| Красный костный мозг | 1,68 | |
| Мочевой пузырь | 1,48 | 150 |
| Желудок | 1,43 | 2 группа органов |
| Тонкая кишка | 1,88 | |
| Верхняя часть толстого кишечника | 7,75 | |
| Нижняя часть толстого кишечника | 1,33 | |
| Почки | 25 | |
| Печень | 5,5 | |
| Легкие | 2,5 | |
| Поджелудочная железа | 2,03 | |
| Щитовидная железа | 30 |
Клинический пример — пациентка В., 65 лет, с диагнозом: рак молочной железы справа T2N1M (II В стадия). По данным ультразвукового исследования и рентгеновской маммографии имеется объемное образование правой молочной железы и увеличенный аксиллярный лимфоузел справа, по данным пункционной биопсии узла в молочной железе — низкодифференцированный рак молочной железы. При проведении сцинтиграфического исследования с 199 ТIСI в проекции правой молочной железы и правой аксиллярной области визуализируются асимметричные очаги патологической гиперфиксации радиофармпрепарата. В последующем пациентке была выполнена операция в объеме радикальной мастэктомии справа с аксиллярной лимфодисекцией. Во время операции визуализировался опухолевый узел в верхнем наружном квадранте правой молочной железы и измененный лимфоузел в аксиллярной области. Гистологическое заключение звучало как инфильтрирующий протоковый рак с преобладанием инфильтративного компонента 2 степени злокачественности, метастаз в 1 лимфоузле.
Согласно предлагаемому способу проведено радионуклидное исследование с 199 ТIСI 15 пациенткам с диагнозом рак молочной железы: из них III В стадия — 4 пациентки, III А — 2, II А — 2, II В — 7. Из 15 пациенток у 6 был диагностирован мультицентричный рост опухоли. Всем пациенткам исследование проводилось на этапе первичного обследования до проведения курса химиотерапии или оперативного лечения. У всех больных определялось асимметричное накопление радиофармпрепарата высокой интенсивности в проекции опухоли и пораженных лимфатических узлов. После оперативного лечения по данным гистологического исследования в 100% случаев был подтвержден рак молочной железы.
1. Sehweil A., McKillop JH, Milroy R at al. 201 Т1 scintigraphy in the staging of lung cancer, breast cancer and lymphoma. / Nucl Med Commun. 1990 Apr; 11(4): 263-9.
2. Spencer RP. Tumour-seeking radiopharmaceuticals: nature and mechanisms. / Nuclear Medicine. 1994, Vol.2. P.649-662.
3. Vural G, Atasever T, Qzdemir A at al. 201 T1 scintigraphy in the evaluation of palpable and nonpalpable breast lesions: correlation with mammography and ultrasonography. / Nuklearmedizin. 1997, Dec; 36(8): 282-8.
4. Cimitan M, Volpe R, Candiani E at al. The use of thallium-201 the preoperative detection of breast cancer: an adjunct to mammography and ultrasonography. / Eur J Nucl Med. 1995. Oct; 22(10): 1110-7.
5. Лишманов Ю.Б., Чернов В.И., Кривоногов Н.Г. Перфузионная сцинтиграфия с 199 Т1 хлоридом в эксперименте. / Мед.радиология. 1988. №3. С.13-6.
6. Лишманов Ю.Б., Чернов В.И. Сцинтиграфия миокарда в ядерной кардиологии. / Томск: Издат-во ТГУ, 1997. — С.276.
Способ радионуклидной диагностики рака молочной железы путем внутривенного введения радиоизотопа TICI и последующего проведения сцинтиграфического исследования через 10-15 и 180 мин в планарном режиме с определением очага гиперфиксации радиофармпрепарата, отличающийся тем, что вводят 199 TICI в дозе 270 МБк.
источник
Рак груди — это злокачественная опухоль в железистой ткани молочной железы. Онкологические заболевания груди являются частой причиной летального исхода женщин разного возраста. Чаще всего раку молочной железы предшествует мастопатия. Это заболевание обусловлено нарушением гормонального фона пациентки.
Несмотря на огромные достижения современной медицины в сфере ранней диагностики и лечения рака, новообразования молочной железы до сих пор считают невероятно трудной проблемой.
Цель обследования молочных желез — это ранняя диагностика мастопатии и обнаружение различных доброкачественных новообразований и кист, которые классифицируют как предраковые болезни. Современная медицина установила, что рак груди на последних стадиях является практически не излечимым. На ранних этапах болезни имеются неплохие шансы на излечение и возвращение к полноценной жизни, поэтому диагностика молочных желез является важной для любой женщины.
Женщинам после 35 лет врачи рекомендуют регулярно проходить обследование груди на предмет выявления всевозможных патологий.
Методы обследования молочных желез
Существует множество методик обследования груди. Самым простым, а также возможным для проведения в домашних условиях, является самообследование. Каждый год врачи рекомендуют делать УЗИ молочных желез, маммографию, и проходить осмотр у хирурга. При подозрении на наличие злокачественного новообразования врачи дополнительно назначают:
- Анализ крови на онкомаркеры (назначается при подозрении на рак). Онкомаркеры – это особенные белки, продуцируемые клеткой злокачественного новообразования. В случае наличия таких маркеров можно говорить о наличии онкологического заболевания.
- КТ.
- МРТ.
- Маммосцинтиграфию.
- Пневмокистографию (применяется для исследования состояния кисты). При такой процедуре необходимо первоначально провести пункцию кисты, удаляя её содержимое. Далее врачи вводят внутрь кисты воздух. За счет воздействия воздуха происходит раздвигание стенок кисты, что позволяет осмотреть внутреннюю поверхность, применяя рентгеновские лучи.
- Биопсию.
Часто не удается обнаружить вовремя опухоль в связи с тем, что состояние груди напрямую зависит от возраста женщины и её гормонального фона. Изменения в ткани железы тесно связаны с менструальным циклом.
Раком молочной железы занимаются врачи-онкологи. Сегодня существует новая специальность в области онкологии – онкомаммолог. Эти специалисты занимаются диагностикой и лечением рака молочной железы. Отдельная специальность для такого заболевания связана с существованием множества методик лечения, среди которых выделяют лучевую терапию, хирургическое вмешательство, химиотерапию, а также огромное число их комбинаций. Лечение мастита или острых воспалительных процессов проводится хирургами, которые специализируются в гнойной хирургии.
Маммосцинтиграфия — это метод радионуклидной диагно¬стики патологии молочной железы, который основан на оценке распределения в ткани железы диагностических радиофарм-препаратов, обладающих повышенной тропностью к злокаче¬ственным новообразованиям молочной железы. Маммосцинтиграфия позволяет выявить узловые образования молочной железы и определить в них интенсивность обменных процессов. Она позволяет определить характер новообразования, место её расположения, и степень распространенности. Маммосцинтиграфия представляет собой чувствительную и специфичную методику в диагностике первичных опухолей молочной железы и его метастазов. Такое исследование считается относительно безопасным.
Главной целью маммосцинтиграфии является выявление злокачественных опухолей молочной железы, метастатической распространенности в лимфоузлы, и коррекция программ комплексного лечения рака. Главный принцип маммосцинтиграфии — это количественная и визуальная оценка накопления и распределения диагностического радиофармпрепарата в ткани железы. Этот препарат обладает повышенной тропностью к злокачественным клеткам.
- Выявить первичный очаг опухоли молочной железы до того как проявятся клинические признаки болезни.
- Выявить пораженные опухолевым процессом лимфатические узлы.
- Прогнозировать резистентность опухоли к химиотерапии.
- Оценить эффект лучевой терапии, и химиотерапии опухоли молочной железы.
Показания к проведению маммосцинтиграфии
Клинические показания к проведению маммосцинтиграфии:
- Мастопатия (фиброзно-кистозная).
- Подозрение на рак.
- Дифференциальная диагностика непальпируемых и пальпируемых опухолей молочной железы.
- Прогнозирование резистентности новообразования к химиотерапии.
- Наблюдение за результатами лучевой и химиотерапии при раке.
- Диагностика повторного возникновения рака молочной железы.
Противопоказания к проведению маммосцинтиграфии
Среди противопоказаний для проведения процедуры выделяют:
- Общее тяжелое состояние пациента, которое затрудняет выполнение определенных манипуляций, необходимых при маммосцинтиграфии (укладка на процедурный стол, введение радиофармпрепаратов, контроль физиологических отравлений).
- Беременность.
- Период лактации.
Метод проведения маммосцинтиграфии
Маммосцинтиграфию проводят с использованием специальных радиофармпрепаратов. Препарат вводится внутривенно. Пациенту необходимо не есть минимум четыре часа до проведения процедуры. Через полчаса после введения препарата врачи проводят планарную сцинтиграфию в 3-х стандартных проекциях (две боковые и передняя), которые иногда дополняются косыми проекциями. Цель последних, это уточнение локализации выявленной опухоли.
При прямой проекции пациенток размещают лежа на спине, руки закинуты за голову. При боковых проекциях пациентка лежит на животе, руки отведены вперед, молочные железы свободно свешены вниз. Врачи максимально приближают детектор к обследуемой железе.
Качественная «картинка» молочных желез, окружающих их тканей и органов обеспечивает регистрация 100 тысяч импульсов для прямой проекции. Для боковых проекций проводится регистрация по 500 тысяч импульсов.
После проведения маммосцинтиграфии врачи проводят анализ полученной информации.
Время проведения исследования составляет около тридцати минут.
Главными параметрами получаемой информации считаются сцинтиграммы, полученные с экрана гамма-камеры либо дисплея компьютера. Это цифровые данные, в которых содержатся результаты содержания препарата в областях, которые исследовались. Визуальная оценка позволяет выявить очаговую патологию, локализацию процесса, определить размеры и количество очагов поражения, а также остальных аномалий в распределении и накоплении радиофармпрепарата в мягких тканях желез и по ходу лимфоколлекторов.
Оценка накопления препарата в самой железе и лимфоузлах проводится по боковым сцинтиграммам. Сцинтиграммы прямой проекции служат для дополнительной оценки под-, надключичных, и парастернальных областей оттока лимфы на стороне поражения, а также с контрлатеральной стороны.
(495) 545-17-44 — клиники в Москве и за рубежом
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
Протонная терапия позволяет онкологам-радиологам добиваться максимально губительного влияния излучения на опухоль, одновременно сводя к минимуму воздействие на здоровые ткани и органы и сдерживая риск развития побочных эффектов лечения.
Позитронно-эмиссионная томография может оказать помощь врачу-радиологу там, где рентген-исследование или МТР остаются бессильны. Определить злокачественную природу некоторых опухолей возможно только во время операции, либо, использовав ПЭТ/КТ технологию. Второй метод является преимущественным, как безболезненный и эффективный. Достоверность информации, получаемой при ПЭТ диагностике, стремится к 90 процентам, в то время как МРТ дает только 50-70 процентов точности.
источник
Позитронно-эмиссионная томография (ПЭТ) в последнее время становится все более популярным методом исследования, используемым для обнаружения, стадирования и контроля различных злокачественных опухолей. Метод основан на регистрации гамма-излучения, испускаемого радиоактивными элементами (радионуклидами), которые вводятся в организм человека в составе специальных меченых веществ — радиофармпрепаратов (РФП). При совмещении ПЭТ-сканера с компьютерным томографом (КТ) говорят о комбинированной позитронно-эмиссионной и компьютерной томографии (ПЭТ-КТ).
Комбинация ПЭТ и КТ позволяет совместить «функциональные» (ПЭТ) и «анатомические» (КТ) томограммы, что дает преимущества перед использованием только КТ, ведь анатомические срезы дополняются информацией, отражающей функциональные изменения. Так, при сравнении изменений, обнаруженных при ПЭТ-КТ (в исследовании приняло участие 58 пациенток) с данными, полученными только на основании КТ, комбинированная ПЭТ-КТ показала лучшие результаты в выявлении маленьких опухолей и множественных метастазов; а также в обнаружении лимфоузлов, пораженных опухолью, и в оценке ответа на химиотерапию по поводу рака молочной железы.
В основе таких методов, как КТ и МРТ, лежит визуализация анатомических структур с целью выявления патологических изменений у пациенток с раком молочной железы, стадирования и контроля. В то же время, позитронно-эмиссионная томография (ПЭТ) позволяет обнаружить патологические измененения метаболизма 18-фтор-2-дезокси-D-глюкозы (ФДГ), что делает возможным получение качественной информации о ее накоплении в опухоли, и является критичным моментом при постановке диагноза и при контрольных исследованиях. Комбинация ПЭТ-КТ имеет преимущества перед изолированным использованием ПЭТ, поскольку появляется возможность более точной привязки очагов повышенного захвата ФДГ к определенным анатомическим областям. Кроме того, при этом методе уменьшается время исследования. Также ПЭТ-КТ позволяет частично преодолеть ограниченную специфичность ПЭТ, при которой могут обнаруживаться очаги гиперметаболизма глюкозы в доброкачественных опухолях и воспалительно измененных тканях (например, при туберкулезе). Необходимым условием информативности метода является достоверная оценка изображений опытным радиологом, иногда с применением Второго мнения.
Рак молочной железы является самой распространенным новообразованием у женщин во всем мире и ведущей причиной женской смертности в результате рака. Во всем мире каждый год насчитывается примерно 1,38 миллионов вновь возникших случаев заболевания, а также 458 тысяч летальных исходов в течение года, обусловленных этой болезнью. Многие факторы риска хорошо известны. Тем не менее, точные причины возникновения рака молочной железы не определены. Например, наличие заболевания у родственников и предков является хорошо известным фактором риска: при нем вероятность развития рака возрастает в два или три раза. Также предполагается, что мутации в гене BRCA (1 и 2) и мутации белка p53 в значительной степени повышают риск развития опухоли. Ранняя диагностика является основополагающим способом контроля, так как определяет способ лечения, а также прогноз и шансы пациентки на выживание.
К методам диагностики, основанным на обнаружении анатомических изменений, относятся маммография, ультразвуковое исследование (УЗИ), компьютерная (КТ) и магнитно-резонансная томография (МРТ). Они широко используются в клинической практике для выявления первичной опухоли и определения стадии рака молочной железы. Эти методы диагностики постоянно улучшаются, кроме того, в практику также внедряются новые способы исследования молочных желез: оптическая маммография, однофотонная эмиссионная томография (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ), которые позволяют перенести информацию относительно анатомических изменений, функции, метаболизма с макроскопического на молекулярный уровень.
Радионуклидные методы исследования, включающие в себя ОФЭКТ и ПЭТ, позволяют оценить in vivo клеточные, молекулярные и биохимические особенности новообразований и нормальных тканей. В то время как в «анатомических» методах диагностики происходит упор на повышение пространственного разрешения и качества изображения, цель использования радионуклидных методов является более специфической – увеличение контраста между опухолью и нормальными тканями.
В сочетании с традиционными методами лучевой диагностики, радионуклидные методы исследования, позволяющие визуализировать биологические процессы, позволили сделать шаг вперед в обнаружении рака. И теперь новыми целями использования радионуклидных методов является разделение различных биохимических изменений в тканях.
Возможность обнаружения рака молочной железы посредством ПЭТ зависит от размера и тканевого строения опухоли. Сообщается, что чувствительность ПЭТ составляет 68% для малых опухолей (меньше 2 см), и 92% для опухолей большего размера (2-5 см), однако, общая точность при выявлении рака in situ является низкой (чувствительность составляет 2-25%). Таким образом, главным фактором, ограничивающим использование ПЭТ при визуализации молочной железы, является низкий уровень обнаружения маленьких опухолей и неинвазивного рака.
Протоковый рак in situ у 49-летней женщины. А: на УЗИ определяется гипоэхогенное объемное образование размером 2,5 см с нечеткими краями, расположенное в верхних отделах левой молочной железы (отмечено стрелками). В: на ПЭТ-КТ скане не выявлено признаков повышенного захвата ФДГ в левой молочной железе. При оперативном вмешательстве подтвердился неинвазивный протоковый рак.
Тем не менее, метод играет важную роль для некоторых групп пациенток, например, с плотными молочными железами либо с наличием имплантов. Позитронно-эмиссионная томография используется для определения множественности опухолевого поражения; для выявления локализации первичной опухоли у пациенток с метастазами, когда маммография неинформативна; а также у тех пациенток, которым противопоказана биопсия. ПЭТ-КТ имеет потенциальные преимущества перед изолированной ПЭТ при оценке поражений малого размера, в которых может быть выявлен пониженный захват ФДГ вследствие эффекта частичного объема при ПЭТ, так как гиперметаболизм глюкозы может быть характерен и для патологических, и для нормальных анатомических структур.
Инвазивный рак молочной железы у 57-летней женщины. А: на скрининговой рентгенограмме левой молочной железы в косой медиолатеральной проекции определяется объемное образование со спикулообразными краями, размером около 1,1 см (отмечено стрелкой). В: при ПЭТ обнаружен очаг слабо выраженного гиперметаболизма ФДГ (стандартизированный уровень накопления = 1,2) в левой молочной железе. Очаг поражения сложно обнаружить в результате эффекта частичного объема. С: на ПЭТ-КТ определяется очаг гиперметаболизма ФДГ на ограниченном участке (отмечен стрелкой) в левой молочной железе.
Вторая задача метода — это обнаружение метастазов рака молочной железы в лимфатических узлах. Метастатическое поражение подмышечных лимфоузлов является важным фактором, определяющим прогноз. У пациенток, страдающих раком молочной железы, при вторичном поражении четырех и большего количества лимфоузлов подмышечной группы, имеется значительно более высокий риск рецидива. Сообщается о чувствительности ПЭТ при визуализации подмышечных лимфоузлов у пациенток с раком молочной железы в пределах 79-94%, и специфичности 86-92%. При ПЭТ-КТ можно точно определить местоположение и отличить друг от друга лимфатические узлы, вторично пораженные опухолью, и реактивно измененные (незлокачественные) лимфоузлы, в то время как на КТ будут обнаруживаться лишь множественные увеличенные лимфоузлы подмышечной группы без четких дифференциальных признаков.
Метастазы в подмышечные лимфатические узлы у 45-летней женщины с инвазивным протоковым раком молочной железы. А: на ПЭТ визуализируется очаг гиперметаболизма ФДГ в правой железе (черная стрелка) и в подмышечной области (белая стрелка). В: на КТ определяются два увеличенных подмышечных лимфоузла справа (отмечены стрелками). С: ПЭТ-КТ позволяет определить точную локализацию лимфоузлов, вторично пораженных опухолью (белая стрелка, стандартизированный уровень накопления РФП = 9,9), визуализируется также реактивно измененный лимфоузел (черная стрелка). Среди 21 лимфоуза, удаленного во время операции, метастазы были выявлены только в одном.
Метастазы рака молочной железы во внутригрудные или медиастинальные лимфоузлы часто клинически ничем себя не проявляют. Количество обнаруживаемых патологических изменений со стороны внутригрудных или медиастинальных узлов (у пациенток с метастатическим либо рецидивным раком молочной железы) при ПЭТ почти в два раза больше по сравнению с традиционной КТ. Кроме того, ПЭТ-КТ выглядит более применимой по сравнению с КТ для оценки внутригрудных лимфатических узлов и лимфоузлов средостения, поскольку возможности КТ в обнаружении метастазов в лимфоузлы малого размера довольно ограничены.
Метастазы в лимфоузлы средостения у женщины, 10 месяцев назад перенесшей модифицированную радикальную левостороннюю мастэктомию. А: на ПЭТ определяются множественные участки гиперметаболизма РФП в верхних отделах грудной клетки слева. В: на КТ визуализируется небольшой участок мягкотканной плотности в переднем средостении (отмечен стрелкой). В: на ПЭТ-КТ обнаружено, что мяготканный участок в переднем средостении, выявленный при КТ, соотносится с зоной гиперметаболизма ФДГ, что позволяет предположить метастазы во внутригрудные лимфатические узлы.
Рак молочной железы часто дает отдаленные метастазы в легкие, печень и кости. Преимуществом ПЭТ всего тела перед традиционными методами диагностики, такими как рентгенография органов грудной клетки, сцинтиграфия скелета и УЗИ органов брюшной полости, является возможность обнаружения отдаленных метастазов в различных областях тела и органах во время одного исследования. Было обнаружено (Moon et al.), что ПЭТ всего тела обладает высокой диагностической точностью в отношении пациенток, у которых имеется подозрение на рецидив рака или на метастатическое поражение. На основании количества обнаруженных очагов чувствительность метода в обнаружении отдаленных метастазов составила 85%, а специфичность 79%.
Множественные отдаленные метастазы у 44-летней пациентки, страдающей раком обеих желез. А: на ПЭТ определяются множественные зоны гиперметаболизма ФДГ в грудной клетке и брюшной полости. B, C: на ПЭТ обнаружены также зоны гиперметаболизма ФДГ в обеих молочных железах (отмечены белыми стрелками на томограмме B), в лимфоузлах средостения (отмечены черными стрелками на томограмме B), и во внутренних органах (отмечены стрелками на томограмме C).
В исследовании (Cook et al.) было обнаружено, что ПЭТ превосходит сцинтиграфию скелета при выявлении остеолитических метастазов рака молочной железы. И, наоборот, остеобластические метастазы характеризуются низкой метаболической активностью и часто не обнаруживаются посредством ПЭТ. Однако ПЭТ-КТ позволяет преодолеть это ограничение: остеобластические метастазы, даже если они не видны на ПЭТ, будут визуализироваться на КТ-сканах.
Метастазы в кости у 64-летней женщины, которой была выполнена правосторонняя модифицированная радикальная мастэктомия 36 месяцев назад. A: при сцинтиграфии скелета обнаруживаются очаги гиперфиксации ФДГ в первом ребре справа и седьмом ребре слева (стрелки), которые, скорее всего, связаны с метастатическим поражением ребер. B: на ПЭТ-КТ не определяется гиперметаболизма ФДГ в седьмом ребре слева (стрелка). C: на КТ определяется остеобластическое поражение седьмого ребра слева (стрелка).
Для лечения пациенток, у которых опухоль имеет большой размер, либо наблюдается ее локальное распространение, используется неоадъювантная химиотерапия с целью уменьшения стадии первичной опухоли перед оперативным вмешательством и устранения метастазов. Кроме того, в нескольких исследованиях было продемонстрировано, что выживаемость пациенток с резистентными опухолями может увеличиваться при использовании альтернативной химиотерапии и (или) при удлинении курсов химиотерапии. Так как химиотерапия имеет побочные эффекты, необходимо как можно скорее выделить пациенток, которые не получают эффекта от применяемого лечения.
В настоящее время лучевые методы диагностики часто используются для определения ответа на терапию путем оценки изменений размеров опухоли. Тем не менее, последовательные измерения размера опухоли во многих случаях не позволяют сделать вывод о наличии раннего ответа. Эффективность ПЭТ при оценке ответа на терапию была подтверждена для различных типов новообразований. В исследовании (Smith et al.) было показано, что средняя редукция захвата ФДГ после первого курса химиотерапии была в большей степени выражена в очагах, для которых макроскопически был обнаружен частичный или полный ответ, или полный ответ при микроскопическом исследовании, по сравнению с резистентными поражениями при гистопатологическом исследованиях. По данным (Rose et al.) после единственного курса химиотерапии при помощи позитронно-эмиссионной томографии было возможно спрогнозировать полный ответ на терапию при патогистологическом исследовании, чувствительность при этом составляла 90%, а специфичность 74%. Если принять степень снижения захвата ФДГ меньше 55% от первоначального значения за пороговое значение, свидетельствующее о наличии реакции на лечение, изменения на ПЭТ у всех респондентов в данном исследовании были корректны и подтвердились патогистологически (100% чувствительность и 85% специфичность).
Изображения иллюстрируют контроль химиотерапии у 35-летней пациентки, страдающей раком молочной железы с метастазами в кости. A-C: на ПЭТ, выполненной изначально (A, B) и ПЭТ-КТ (C) определяется в значительной степени выраженный гиперметаболизм ФДГ в обоих молочных железах и во многих позвонках. D-F: на контрольной ПЭТ (D, E) и ПЭТ-КТ (F), выполненных спустя три курса химиотерапии, определяется существенное снижение гиперметаболизма ФДГ в обоих молочных железах и позвонках.
ПЭТ-КТ также играет роль для лучевой терапии, т. к. позволяет точно оценить распространенность опухоли.
Раннее распознавание рецидива опухоли является важным моментом, улучшающим выживаемость, поскольку подталкивает клиницистов к использованию различных способов лечения. Однако отличить истинный рецидив от постоперационных и лучевых изменений сложно при использовании лишь традиционных методов лучевой диагностики. При ограниченном, регионарном рецидиве преимущественно поражается молочная железа, кожа, подмышечные и надключичные лимфоузлы, а также грудная стенка.
Было обнаружено, что чувствительность и специфичность ПЭТ при обнаружении рецидива составляет 84% и 78% соответственно, в то время как чувствительность и специфичность традиционных методов исследования 63% и 61% соответственно. Предполагается, что ПЭТ является более эффективным методом оценки рецидива рака молочной железы по сравнению с традиционными методами визуализации в плане обнаружения изменений всего тела. Данные КТ, полученные при ПЭТ-КТ, позволяют установить соответствие анатомических структур и очагов гиперметаболизма ФДГ.
Локальный рецидив опухоли у 74-летней женщины, которой была выполнена модифицированная правосторонняя радикальная мастэктомия 8 лет назад. А: на УЗИ выявлено объемное образование овоидной формы, 1,4 см, с усиленным кровотоком, расположенный в правой грудной мышце в зоне мастэктомии. B, C: на ПЭТ определяется ограниченный очаг гиперметаболизма ФДГ (стандартизированный уровень накопления = 3,3) (стрелки) в правой половине грудной клетки. D: на ПЭТ-КТ определяется очаг гиперметаболизма ФДГ (стрелка) в правой грудной мышце, в то время как при использовании только ПЭТ определение точной локализации очага является затруднительным.
В ряде случаев для повышения достоверности оценки результатов ПЭТ-КТ рекомендуется получить второе мнение специализированного радиолога. Это бывает необходимо при сомнительных или неоднозначных результатах первичного прочтения снимков. Второе мнение по ПЭТ-КТ помогает решить следующие задачи: снижение риска врачебной ошибки, более достоверная оценка первичной опухоли, уточнение стадии заболевания, достоверное исключение признаков метастатического поражения костей, печени или легких. Кроме того, в результате такой консультации онколог получает более подробное описание исследования, что помогает ему выбрать наиболее подходящий протокол лечения.
ПЭТ/КТ играет важную роль в диагностике рака молочной железы, которая заключается в обнаружении и определении местоположения метастазов, контроле лечения и раннем выявлении рецидивов. Тем не менее, ограничивающим фактором ПЭТ/КТ в выявлении рака молочной железы является недостаточная способность обнаруживать опухоли малого размера.
Василий Вишняков, врач-радиолог
При подготовке текста использованы материалы:
источник
Радионуклидная диагностика – современный способ тщательного изучения состояния организма человека. Применение радионуклидной диагностики в онкологии позволяет определить степень распространения и уровень активности раковых клеток. С помощью данного метода составляется наиболее действенная схема лечения, а также предотвращаются рецидивы заболевания.
После того как человеку вводится меченое вещество, называемое радиофармпрепаратом, оно начинает перемещаться внутри организма. Распределение препарата напрямую зависит от кровотока, скорости метаболических процессов и степени функциональности органов.
При помощи специального оборудования врач имеет возможность отслеживать перемещение вещества и его излучение, что позволяет выявить любые патологии в организме.
Главный принцип радионуклидной диагностики – накопление и распределение радиоактивного вещества внутри человеческого тела с их дальнейшей регистрацией на оборудовании с высокой чувствительностью.
Минимальная лучевая нагрузка, малая вероятность негативных последствий вкупе с получением достоверной картины функционального состояния органов – ещё один важный принцип радионуклидной диагностики.
В лаборатории радионуклидной диагностики врач получает изображения статического характера исследуемого органа. Они отображают области с аномальным количеством введённого вещества. Это даёт информацию о расположении органа относительно других органов, кровеносных сосудов и нервов. Кроме того, на изображениях видны: форма, размер, наличие очага патологии, степень функционирования.
Радионуклидная диагностика – исследование, дающее менее чёткую картинку, в сравнении с ультразвуковым и рентгенологическим обследованием, она имеет меньшее разрешение. Но методы радионуклидной диагностики направлены на изучение не анатомических и морфологических особенностей органов, а на анализ их функциональности, нарушения которой проявляются намного раньше видимых изменений. За счёт этого преимущества выявляются заболевания на самой ранней стадии, эффективно отслеживается динамика их развития.
В диагностических и терапевтических целях пациенту вводится вещество (нуклид), подобранное таким образом, чтобы при минимальном облучении получить всю возможную информацию. К сравнению, однократное действие радионуклида на пациента практически в 100 раз меньше, чем при стандартном рентгенологическом исследовании.
Кроме того, нуклиды быстро распределяются по организму и выводятся из него за короткий промежуток времени, что также в разы снижает действие облучения.
Радиофармпрепараты, используемые в медицине, не содержат токсических веществ, которые после распада оставляют в организме вредные примеси.
Исследование осуществляется двумя способами:
- In vitro. В организм человека не вводятся радиофармпрепараты. С точки зрения безопасности этот метод наиболее оптимальный, т. к. для проведения диагностического исследования у пациента берут кровь или другой биоматериал. Человек не получает даже минимальной дозы облучения, поэтому способ in vitro подходит всем онкобольным.
- In vivo. Радиофармпрепараты вводятся в организм человека.
Существуют следующие пути введения радиоактивных веществ:
- энтеральный – нуклиды попадают в кровь из кишечника; чаще всего применяется при радионуклидной диагностике щитовидной железы;
- внутривенный – используется для обследования большинства органов;
- подкожный – важен при оценке функциональности лимфоузлов и сосудов, также препарат может быть введён непосредственно в лимфатические узлы;
- ингаляционный – нужен для визуализации вентиляции лёгких и кровообращения в головном мозге;
- внутримышечный – незаменим при оценке кровообращения;
- спинно-мозговой – препарат вводится непосредственно в канал для его обследования;
- внутриартериальный.
Существуют следующие виды радионуклидной диагностики:
Сцинтиграфия — метод, используемый в радионуклидной диагностике чаще всего. Он даёт возможность визуализировать орган и степень накопления препарата в нём, что позволяет оценить его функциональность и своевременно выявить патологический процесс.
Данный способ диагностики осуществляется с помощью гамма-камеры. Основной принцип её работы – регистрация излучения радиофармпрепарата при помощи йодида натрия. Этот компонент в виде кристалла большого размера (примерно 60 см в диаметре) чутко реагирует на излучение вещества. Перемещение препарата проецируется на кристалл в виде вспышек света, которые далее попадают на фотоумножитель, преобразовывающий их в электрические импульсы. С помощью регистрации этих импульсов создаётся изображение, показывающее распределение радионуклида. Гамма-камеры позволяют получать как аналоговые, так и цифровые изображения.
Метод сцинтиграфии предполагает введение меченого вещества внутривенно, за исключением тех случаев, когда необходимо обследование лёгких. Для их сцинтиграфии выбирается ингаляционный путь введения препарата.
Метод сканирования позволяет получить двухмерное изображение распределения радионуклида. Детектор сканера улавливает и регистрирует излучения, они при помощи специального блока преобразуются в штрихи, которые наносятся на обычную бумагу. Они называются сканограммой. О распределении препарата врач судит, исходя из вида штрихов.
Существует также метод цветного сканирования, когда цвет штрихов зависит от излучения, испускаемого радиофармпрепаратом.
Максимальная достоверность данного метода достигается при полной неподвижности пациента. Если это условие не соблюдается, сканер представляет искажённую картину.
Если цель диагностики – обнаружение метастазов, не выявленных клиническими исследованиями, применяется метод профильного сканирования. Его суть заключается в следующем: датчики профильного сканера перемещаются над исследуемой частью тела. В результате на бумаге появляются не штрихи, а кривая линия, показывающая накопление препарата по направлению перемещения датчиков.
На сегодняшний день метод сканирования всё реже находит применение на практике. Это обусловлено тем, что он требует больше времени, чем сцинтиграфия, с помощью которой информация предоставляется за короткий промежуток времени.
Чтобы тщательно изучить степень функционирования органа, применяют радиометрию.
Она подразделяется на виды:
- лабораторная – у пациента осуществляется забор биоматериала (кровь, моча, кал и пр.), после чего его изучают на предмет уровня накопления радионуклида;
- медицинская (клиническая) – с её помощью возможно изучить как все системы человеческого организма сразу, так и отдельный орган.
Для лабораторного исследования применяется радиометр. После того как пробирка с биологическим материалом устанавливается у счётчика, радиометр выдаёт на бумаге результат, обработанный микрокомпьютером. Главное достоинство лабораторного метода – точные расчёты, не требующие доработки врачом.
Медицинская радиометрия подразумевает введение радиоактивного вещества внутрь. Датчик радиометра фиксирует степень излучения над диагностируемой частью тела. Информация выдаётся на приборе в виде числового значения зарегистрированных импульсов. Полученный результат оценивается в процентах.
Если необходимо провести радионуклидную диагностику всего тела, используют несколько детекторов. Перемещаясь вдоль тела, они дают информацию о степени функционирования сразу всех систем и органов.
Недостатком радиометрии является то, что она не даёт информацию о кровотоке в исследуемом органе, вентиляции лёгких и пр., т. е. о быстропротекающих процессах в организме.
Чтобы зарегистрировать скорость перемещения радиофармпрепарата, используют метод радиографии. Динамика изменения излучения фиксируется детекторами и переносится на бумагу в виде кривой линии.
Главное достоинство радиографии – простота диагностики. Но в то же время не представляется возможным расположить детекторы строго на границах исследуемого органа. С помощью радиографа не осуществляется визуализация органа, поэтому интерпретация результатов может быть затруднена.
Наряду со сцинтиграфией, широкое применение на практике находят томографические направления радионуклидной диагностики:
- ОФЭКТ (однофотонная эмиссионная компьютерная томография);
- ПЭТ (позитронная эмиссионная томография).
Метод ОФЭКТ чаще всего используется в кардиологии и неврологии. Его суть заключается в следующем: вокруг человека вращаются стандартные гамма-камеры, улавливающие излучения с разных позиций. Благодаря этому реконструируется объемное изображение, показывающее распределение радиоактивного вещества.
Метод ПЭТ является уникальным способом диагностики, появившимся недавно. Основное его достоинство – выявление заболевания на ранней стадии, уже тогда, когда это ещё невозможно при обследовании стандартными методами.
В процессе диагностики врач имеет возможность визуализировать не только размер и форму органов, но и их метаболизм и степень функционирования.
Чаще всего ПЭТ применяется в онкологии для своевременного обнаружения злокачественного процесса и наблюдения за его развитием.
Метод позитронной томографии основан на фиксировании реакции, имеющей название аннигиляция. Она представляет собой взаимодействие позитронов и электронов, испускаемых радионуклидами. Вокруг человека размещаются детекторы, улавливающие аннигиляцию. Данный способ настолько чувствителен, что с его помощью могут отслеживаться даже мыслительные процессы!
В ходе обследования происходит точная количественная оценка накопления радиофармпрепарата, что позволяет выявить самое начало опухолевого процесса и составить максимально эффективную противораковую схему лечения. С помощью ПЭТ возможно обследование как отдельного органа, так и всего тела.
Также этот метод эффективен при диагностике состояния головного мозга, когда у пациента отмечается потеря памяти неясного генеза. В сжатые сроки подтверждается или исключается рак мозга, обнаружение которого затруднено на самом раннем этапе обычными способами.
Главный недостаток ПЭТ – необходимость использования дорогостоящих радионуклидов.
Отделение радионуклидной диагностики оснащено передовым оборудованием. С его помощью существенно улучшается качество обследования онкобольных, которое при применении стандартных методов не даёт чёткой картины, например:
- радионуклидная диагностика печени позволяет установить, возможна ли резекция органа на начальной стадии рака;
- исследование лёгких отражает уникальную картину изменения опухоли, своевременно выявляет метастазы;
- при раке толстой кишки данный метод позволяет предотвратить рецидивы и исключить наличие отдалённых метастазов у пациентов, у которых уровень онкомаркеров остаётся повышенным после хирургического вмешательства;
- радионуклидная диагностика почек выявляет точную локализацию метастазов в тех случаях, когда это затруднено при компьютерной и магнитно-резонансной томографии;
- при лимфоме наиболее достоверно определяется стадия заболевания и оценивается степень эффективности лечения;
- обследование больных меланомой позволяет определить уровень развития злокачественного процесса, исключить или подтвердить наличие отдалённых метастазов и рецидивов;
- радионуклидная диагностика щитовидной железы позволяет лучше визуализировать размер ракового узла, его активность по отношению к окружающим тканям;
- эффективно оценивается распространение процесса при злокачественных образованиях органов головы; это позволяет составить наиболее подходящую схему лечения;
- диагностика при раке молочной железы даёт возможность спрогнозировать распространение опухоли, выявить рецидивы и своевременно оценить эффективность назначенного лечения.
Необходимо соблюдать определённые правила подготовки перед диагностикой щитовидной железы и лёгких. Остальные виды обследования не требуют какой-либо подготовки.
Перед радионуклидной диагностикой щитовидной железы:
- за 2 месяца до процедуры исключить все препараты, содержащие йод и пищу, им богатую;
- не принимать L-тироксин и его аналоги как минимум за 3 недели.
Перед радионуклидной диагностикой лёгких:
- минимум за 6 часов исключить приём пищи;
- не курить перед обследованием;
- во избежание получения искажённых результатов не принимать за 30 дней лекарства: антибиотики, адсорбенты, радиофармпрепараты, лекарственные средства на основе висмута, противоязвенные препараты;
- если пациент проходил процедуру эндоскопии, диагностика возможна через 7 дней после неё.
Радионуклидная диагностика проводится исключительно в медицинском учреждении под наблюдением высококлассных специалистов. Перед процедурой нужно отключить мобильный телефон.
Методика радионуклидной диагностики заключается в следующем: пациенту вводится радиофармпрепарат, после чего он размещается на диагностическом оборудовании. Длительность процесса получения информации – минимум 30 минут, продолжительность напрямую зависит от вида патологии и стадии её развития. После завершения процедуры в ближайшие сутки рекомендовано обильное питьё.
Радионуклидная диагностика – уникальный способ обследования, позволяющий выявить на ранней стадии не только онкологические заболевания, но и любые другие патологии. Информативность и безопасность – главные достоинства метода. При минимальном облучении врач получает точную картину функционирования всех органов и систем.
источник
Остеосцинтиграфия в онкологии (радионуклидная диагностика) — один из самых востребованных методов радиоизотопного исследования применительно к онкологическим больным. Сканирование скелета при онкологических заболеваниях производится на современном диагностическом оборудовании, которое представлено в виде гамма-камеры и дополнительных диагностических устройств.
Метод позволят получить очень четкое изображение костной системы и выявить те патологические изменения, которые произошли в результате болезни. К таким изменениям относятся первичные опухоли костной ткани, либо метастазы злокачественных опухолей в других локализациях (опухоли молочной железы, предстательной железы, легких, щитовидной железы).
Процедура остеосцинтиграфии заключается во введении специального вещества (радиофармпрепаратов), которое накапливается в определенных органах и тканях, имитируя процессы, происходящие в организме. Например, образование и выведение желчи или мочи. В состав этих препаратов входит радиоактивная метка, излучения которой регистрируются детекторами гамма-камеры. Далее компьютер формирует плоское или объемное изображение. Обработав это изображение, получают графики, индексы и показатели, отражающие работу органов.
Посмотрите информационное видео про кабинет радиодиагностики в Онкологическом Диспансере в г. Москва:
Все, что нужно знать о процедуре остеосцинтиграфии, представляем на картинке:
Остеосцинтиграфия — классический метод радионуклидной диагностики с возможностью визуализации всего тела за одно высокочувствительное исследование.
Порядка 30-40% больных, умерших от рака легких и предстательной железы, имели множественные метастазы в костях. Главная задача специалистов сводится к своевременному выявлению таких метастазов при проведении остеосцинтиграфии перед подготовкой к хирургическому вмешательству и лучевой терапии.
Если у больных уже имеется болевой синдром, следует ускорить этап проведения радионуклидной диагностики в целях проверки онкологии костей.
Основные задачи исследования:
- диагностика (скрининг) костей на наличие онкологии;
- диагностика доброкачественных изменений;
- определение функционального состояния органов и систем;
- определение степени распространенности опухолевого процесса.
Выполнение поставленных задач помогает специалистам определиться с тактикой лечения, объемами хирургического вмешательства и последующей лучевой терапией. Кроме того, за одно исследование представляется возможным ответить на все вопросы обследуемых пациентов.
Своевременная диагностика способна определить пути лимфооттока от опухоли к здоровым тканям, которые могут быть вовремя прооперированы.
Главное отличительное свойство данного метода — это функциональность. Применительно к онкологии, сцинтиграфия дает возможность определить патологические процессы в клетках опухоли, когда анатомические и морфологические изменения еще не видны и не могут быть обнаружены с помощью общепринятых методов лучевой диагностики (рентген скелета при онкологии, КТ).
Исследование достаточно безопасно для пациентов. За одну процедуру можно оценить не только состояние костей, органов грудной и брюшной полостей, но и патологические изменения лимфатических узлов и молочных желез. Тем самым возможно не упустить время пациента и предоставить ему возможность как можно раньше начать противоопухолевое лечение.
Современное и успешное лечение рака молочной железы немыслимо без метода радионуклидной диагностики.
Сканирование молочной железы дает возможность диагностировать опухоли размерами менее 1 см. Главные преимущества этого метода — это выявление масштабов распространенности опухолевого процесса и оценка эффективности противоопухолевого лечения.
Современные методы лучевой диагностики позволяют оценить не только форму, размеры и строение внутренних органов, но и их функциональное состояние. Определение функций и есть главная заслуга остеосцинтиграфии.
Изображения костной системы, получаемые в результате остеосцинтиграфии, очень четкие и наглядные. Ни один другой метод не может так обширно показать изменения в скелете, как метод остеосцинтиграфии.
Выявить костные метастазы при сканировании костей возможно на ранних сроках возникновения злокачественных изменений. Исследование позволяет зафиксировать патологию на несколько месяцев раньше по сравнению с рентгеном костей скелета при раке. Компьютерно-томографическое исследование так же уступает остеосцинтиграфии по своим функциональным возможностям. Радионуклидная диагностика охватывает весь скелет, не выделяя отдельные области, в то время как при компьютерной томографии, как правило, исследуется лишь одна область.
При этом, если с помощью КТ обследовать весь скелет в целом, лучевая нагрузка будет в 10 раз больше, чем при остеосцинтиграфии.
Ядерная медицина объединяет все диагностические и терапевтические вмешательства, связанные с введением в организм радионуклидов. Позволяет на молекулярном уровне оценивать физиологические изменения, происходящие в организме.
В ряде случаев, болевого симптома может не быть даже при обширном метастазировании костной системы, а стандартные снимки рентгенографии показывают патологические изменения только на поздней стадии заболевания. Поэтому, при быстрорастущих опухолях и смешанных поражениях радионуклидному исследованию нет равных.
Сцинтиграфия костей имеет очень большое значение при выборе препаратов и оценке их эффективности на каждом этапе лечения онкологического заболевания. Данный метод применяется как в онкологии, так и в ортопедии.
Радионуклидная диагностика характеризуется объективностью и имеет очень большое прогностическое значение. Процедура отличается невысокой стоимостью и возможностью динамического наблюдения.
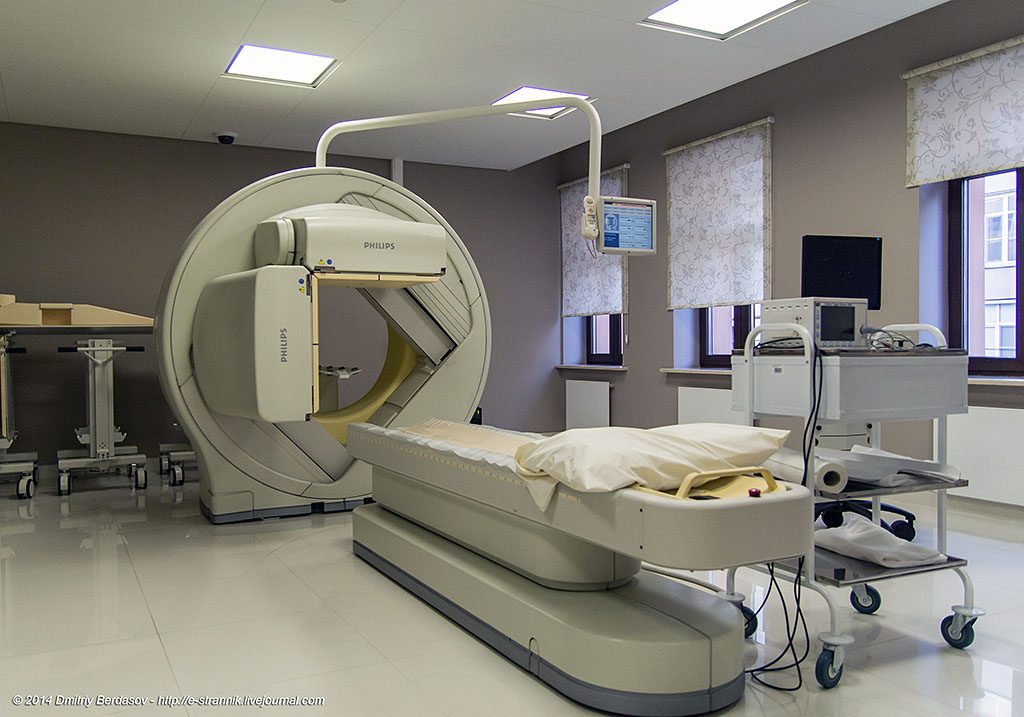
После введения контрастного вещества, на мониторе отражается пространственно-временное распределение радиофармпрепаратов в клетках, тканях и органах обследуемого человека.
Основными инструментами для сцинтиграфического исследования являются:
- гамма-камера, состоящая из блоков отслеживания, предназначенных для улавливания гамма-излучений;
- место для пациента (ложе);
- био-синхронизатор;
- экран;
- компьютер для принятия данных исследования;
- компьютер, обрабатывающий изображение.
Для проведения остеосцинтиграфии в большинстве случаев не требуется специальной подготовки. Обследование не обременительно для детей и физически слабых граждан. Пациенту не нужно раздеваться и испытывать чувства голода. Требуется лишь снять одежду с металлическими элементами. Некоторые пациенты отзываются об этом исследовании как о достаточно приятной процедуре, поскольку обследуемый пребывает в покое около 20 минут.
Остеосцинтиграфия не вредна и не вызывает каких-либо болевых ощущений.
При сцинтиграфии в качестве радиоактивной метки используется технетрил (короткоживущий радионуклид с периодом полураспада 6 часов и низкой энергией радиоактивного излучения). Препарат практически полностью выводится из организма в течение суток. Исследование планируется таким образом, чтобы минимизировать лучевую нагрузку. Так, при одном исследовании она не превышает 1-го миллизиверта.
Вопрос о безопасном проведении сканирования беременных женщин является открытым, так как ответ на него неоднозначен. По некоторым данным, беременность не является абсолютным противопоказанием к проведению исследования. Однако, ряд специалистов не готовы взять на себя ответственность по утверждению факта безопасности данной процедуры.
Вопрос назначения сцинтиграфии беременным женщинам рассматривается сугубо индивидуально, исходя из клинического состояния пациентки.
Ни ранний возраст, ни общее тяжелое физическое состояние не являются абсолютными противопоказаниями к проведению сцинтиграфии. Внутривенное введение радиофармпрепаратов не превышает по объему 1 мл, не вызывает аллергических реакций и является химически безопасным для пациента. Для детей и беременных женщин возможно проведение сцинтиграфии без применения определенных видов медикаментов.
Основные показания для проведения остеосцинтиграфии описаны на картинке:
Сцинтиграфия является незаменимым исследованием, когда стоит вопрос об определении жизнеспособности органов. Например, показатель функционального резерва почки невозможно получить ни одним из существующих методов. При этом, в ряде случаев метод настолько чувствителен, что позволяет диагностировать изменения на ранних клинических стадиях.
Очень информативны радионуклидные исследования при врожденных патологиях позвоночника, хронических воспалительных заболеваниях почек, печени, при определении кровоснабжения легких и сердца. В исследовании костной системы остеосцинтиграфия применяется для поиска костных метастазов и очагов остеомиелита. Для пациентов с эндокринной патологией проводится сканирование простаты, щитовидной и паращитовидной желез.
Сцинтиграфия дает важную клиническую информацию для планирования методов лечения при любых новообразованиях.
Как проходит процедура сцинтиграфии и в чем ее важность, рассказывается в следующем видеорепортаже:
источник
«Результаты УЗИ молочных желез выявили образование, подозрительное на онкологию», «результаты маммографии не позволяют однозначно исключить наличие злокачественного образования», «биопсия показала наличие раковых изменений в молочной железе и требуется расширенное обследование». Это лишь немногие из самых страшных слов, которые женщина может услышать от своего врача.
Молочные железы состоят из трех основных типов тканей — жировой, соединительной и железистой. Раком молочной железы (РМЖ) называют злокачественные опухоли, развивающиеся именно из клеток железистой ткани. Вопреки расхожему мнению, РМЖ заболевают как женщины, так и мужчины, однако у женщин он встречается примерно в 100 раз чаще.
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными.
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
«Молекулярно-генетический портрет» опухоли имеет важное значение при выборе оптимального лечения.
Чаще всего опухоли молочных желёз развиваются из клеток молочных протоков — в этом случае врачи говорят о протоковом раке молочной железы или протоковой карциноме. Довольно часто злокачественные опухоли вырастают из клеток долек молочной железы, этот тип рака называют инвазивной лобулярной карциномой (инвазивный рак молочной железы). Стоит отметить, что рост опухоли возможен и из других клеток железистой ткани.
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Довольно часто на ранних стадиях рак молочной железы протекает бессимптомно. Но в ряде случаев признаки, указывающие на наличие заболевания, все же есть, и их можно заметить.
В первую очередь, к симптомам, которые должны насторожить, относят уплотнения в молочных железах, рядом с ними или в подмышечной впадине. В 9 случаях из 10 уплотнения бывают доброкачественными, однако установить это наверняка можно только на осмотре у маммолога.
К симптомам рака молочной железы относят:
- Отвердение кожи
- Участок втяжения кожи
- Эрозия кожи
- Покраснение кожи
- Выделения из соска
- Деформация молочной железы по типу ряби
- Припухлость кожи
- Увеличенные в размерах вены
- Втяжение соска
- Нарушение симметрии молочных желез
- Симптом лимонной корки
- Пальпируемый узел внутри молочной железы.
При появлении указанных симптомов, а также любых других изменений в молочных железах (например, необычных или болезненных ощущений) нужно немедленно проконсультироваться с маммологом.
В Европейской клинике ведёт консультативный приём и выполняет операции известный российский хирург-маммолог, доктор медицинских наук Сергей Михайлович Портной (автор более 300 печатных работ, член правления Российского общества онкомаммологов, автор трех патентов на изобретения).
Сергей Михайлович выполняет весь объем оперативных вмешательств на молочной железе, включая органосохраняющие и реконструктивные пластические операции.
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц, по окончании менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:
Для подтверждения или исключения диагноза в первую очередь проводится мануальное обследование груди. Затем, при наличии подозрений или в качестве скрининговой процедуры, может быть назначена маммография, рентгенологическое исследование молочных желез. Как правило, женщинам до 35 лет ее выполнение не рекомендуется, в молодости ткань молочных желез особенно чувствительна к радиоактивному облучению.
Ультразвуковое исследование (УЗИ) молочных желез позволяет оценить структуру их ткани и отличить, например, опухоль от кисты, наполненной жидкостью.
Если результаты маммографии или УЗИ указывают на наличие новообразований в молочной железе, врач, как правило, назначает биопсию, лабораторное исследование образца тканей из молочной железы. Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой, что также влияет на схему лечения.
При необходимости могут использоваться и другие диагностические методы, например, магнитно-резонансная томография (МРТ).
После постановки диагноза основной задачей лечащего врача является определение стадии онкологического заболевания, то есть размера опухоли, ее расположения, наличия метастазов и агрессивности. От этих факторов зависит прогноз лечения и подбор оптимальных методов терапии. Как правило, для уточнения стадии проводятся анализы крови, маммография другой молочной железы, сканирование костей, а также компьютерная или позитронно-эмиссионная томография. В некоторых случаях определить стадию опухоли можно только при проведении операции.
Стратегия лечения рака молочной железы зависит от многих факторов — типа рака, стадии, чувствительности клеток опухоли к гормонам, а также общего состояния здоровья пациентки.
Основной метод лечения рака груди — хирургическая операция. Если болезнь удалось диагностировать на ранней стадии, хирург может выполнить лампэктомию, удаление тканей опухоли и небольшой части окружающей ее здоровой ткани. При более крупных опухолях молочная железа удаляется целиком (такая операция называется мастэктомией), равно как и ближайшие к ней лимфатические узлы. Если по оценке врача риск развития рака во второй молочной железе достаточно высок, пациентке может быть рекомендовано удаление обеих молочных желез сразу.
Чтобы разобраться, распространились ли раковые клетки в лимфатические узлы, и определиться с объемом хирургического вмешательства, может быть проведена сентинель-биопсия, или биопсия сторожевого лимфоузла. Во время операции в опухоль вводят радиофармпрепарат или флуоресцентный краситель — это помогает визуализировать лимфоузел, который первым принимает лимфу от ткани молочной железы. Его удаляют и проводят гистологическое исследование. Если в сторожевом лимфоузле не обнаруживают опухолевых клеток, можно ограничиться удалением очага в молочной железе. В противном случае показано иссечение регионарных лимфоузлов.
Лучевую терапию (то есть воздействие на опухоль ионизирующим излучением) при раке молочной железы, как правило, используют после проведения хирургической операции. Терапия проводится с целью уничтожения раковых клеток, которые могли остаться в организме.
Химиотерапия, то есть использование препаратов, убивающих раковые клетки, может проводиться после операции по удалению опухоли, как и лучевая терапия. В некоторых случаях химиотерапию проводят до оперативного лечения для того, чтобы уменьшить размер слишком крупной для удаления опухоли.
В Европейской клинике для лечения рака молочной железы применяются наиболее современные, оригинальные европейские и американские химиопрепараты. У нас есть возможность составить «молекулярный отпечаток» опухоли, подобрать на основании его анализа наиболее эффективные и безопасные комбинации лекарств.
Для лечения рака молочной железы, чувствительного к гормонам, используют гормональную терапию — к ней относится несколько разных методов, останавливающих выработку гормонов в организме или блокирующих их поступление к опухоли. Гормональная терапия позволяет снизить вероятность рецидива опухоли, а также, в случае выявления неоперабельной опухоли, помогает контролировать ее рост.
Для лечения рака молочной железы применяют также таргетную терапию — препараты, поступающие непосредственно к тканям опухоли и минимально воздействующие на здоровые клетки организма. Таргетную терапию используют либо отдельно, либо в комбинации с другими методами лечения — в зависимости от того, какая схема лучше всего подойдет пациенту.
Если рак молочной железы диагностирован на ранних стадиях (0-I), пятилетняя выживаемость приближается к 100%. То есть, можно сказать, что удается вылечить практически всех женщин. Далее, в зависимости от стадии, прогноз относительно пятилетней выживаемости ухудшается:
- На II стадии — 93%.
- На III стадии — 72%.
- На IV стадии — 22%.
Совокупность имеющихся в арсенале онкологов методов лечения рака молочной железы позволяет в большинстве случаев добиться ремиссии заболевания или, как минимум, продлить жизнь с сохранением ее качества. Однако следует помнить, что эффективность лечения в целом напрямую зависит от того, было ли лечение начато своевременно, то есть на ранних стадиях заболевания.
Максимальная эффективность противоопухолевого лечения достигается только в том случае, если оно проводится в соответствии с международными протоколами, при этом учитываются индивидуальные особенности каждого пациента. Именно так назначают лечение онкологи Европейской клиники.
источник