Для лечения любой разновидности рака молочной железы могут применяться хирургические методы лечения (при операбельном процессе), химиотерапия и лучевая терапия, показания к применению каждого из этих методов определяет лечащий врач в зависимости от стадии опухолевого процесса, его разновидности и агрессивности, а также ряда индивидуальных особенностей каждой пациентки. Тем не менее, помимо указанных методов лечения, в зависимости от индивидуальных особенностей опухоли, применяются и другие методы лечения, позволяющие оказывать избирательное воздействие на злокачественные клетки [1, 2].
Прогресс в области лечения рака молочной железы продемонстрировал, что данное заболевание является крайне разнородным (гетерогенным), и в настоящее время было убедительно доказано, что под термином «рак молочной железы» объединено множество разных по своей природе и естественному течению заболеваний. Различные виды рака молочной железы по-разному реагируют на лечение и, соответственно, требуют различных подходов к терапии. На данный момент выделено несколько основных вариантов этой злокачественной опухоли и на сегодняшний день при выявлении рака молочной железы в обязательном порядке определяют и «молекулярный подтип» опухоли.
Для того, чтобы определить какой именно подтип рака молочной железы имеется у пациентки проводят биопсию опухоли, которая подразумевает забор при помощи специальной иглы небольшого количества опухолевой ткани. Сама процедура наиболее часто проводится под местной анестезией (обезболиванием), подобной той, которую используют стоматологи. После получение материала, опухолевую ткань отправляют на исследование в патоморфологическую лабораторию, где проводится иммуногистохимическое исследование, а также, при необходимости – дополнительные методы исследований.
Врач-патоморфолог, который является специалистом по изучению образцов опухолей, проводит процедуры выявления в опухоли потенциальных мишеней, которые могут быть использованы для наиболее эффективного лечения рака молочной железы. В ходе изучения образца опухолевой ткани в ней определяется наличие выработки (экспрессии) рецепторов женских половых гормонов, эстрогена и прогестерона, а также гиперэкспрессии белка HER2 и скорости, с которой делятся опухолевые клетки.
Эстроген и прогестерон – гормоны, которые регулируют многие процессы в женском организме, они выполняют важную роль в формировании женского организма в процессе полового созревания, а также в регуляции менструального цикла, беременности и процессе деторождении. Если по результатам анализа в опухолевых клетках выявляется выработка (экспрессия) рецепторов этих гормонов, говорят о гормонопозитивном раке молочной железы, если не выявляется – о гормононегативном раке. Рост опухолевых клеток при раке молочной железы может быть зависим от наличия этих гормонов в организме (подробнее про рецепторы эстрогена и прогестерона, а также их роль в лечении рака молочной железы).
HER2 – особый белок, играющий важную роль в процессах регуляции процессов деления клеток. Если опухолевые клетки вырабатывают этот белок в очень больших количествах (т.е. отмечается его гиперэкспрессия(, это приводит к резкому повышению скорости их роста и размножения. Примерно в 25% случаев развития рака молочной железы в опухолевых клетках обнаруживается гиперэкспрессия этого белка. Изначально HER2-позитивный рак молочной железы был одним из наиболее агрессивных разновидностей этого заболевания, к счастью, в настоящее время разработано множество препаратов, подавляющих его активность и позволяющих эффективно лечить данный вариант рака молочной железы (подробнее про HER2 и препараты на него воздействующие).
Кроме того, для того, чтобы понять насколько агрессивными и быстрорастущими являются клетки выявленной опухоли, проводится определение скорости их деления. Для её оценки применяется определение так называемого индекса Ki-67. Ki-67 – белок, который вырабатывают клетки в процессе деления, соответственно определив в каком количестве клеток в образце присутствует этот белок, можно понять, сколько клеток находится в состоянии активного деления.
Индекс Ki-67 измеряется в процентах (%), например, если он равен 0%, то ни одна из клеток опухоли в образце не находится в состоянии деления и опухоль растет очень медленно, если Ki-67 равен 100%, это означает, что все клетки опухоли находятся в состоянии активного деления, что является свидетельством быстрого роста опухоли. Опухоли с Ki-67 20% — как быстрорастущие. Индекс Ki-67 может снижаться в процессе лечения, что иногда используются для оценки эффективности лечения.
В зависимости от сочетания наличия выработки в опухоли рецепторов эстрогена, прогестерона, белка HER2, а также скорости деления клеток выделяют несколько подтипов рака молочной железы [3]:
- люминальный А;
- люминальный В;
- HER-2-положительный подтип;
- тройной негативный подтип.
К люминальным подтипам (люминальный А или люминальный В) относят опухоли, которые вырабатывают рецепторы эстрогена и/или прогестерона. Опухоли этой группы развиваются из клеток, которые в норме покрывают внутренние слои протоков и долек молочной железы. Так как рост клеток этих опухолей зависит от эстрогена и/или прогестерона, для лечения этих разновидностей рака молочной железы, помимо химиотерапии, активно применяется гормонотерапия, направленная на лишение опухолевых клеток доступа к гормонам, способствующих их росту. К люминальному А подтипу относятся медленно делящиеся опухоли, вырабатывающие рецепторы эстрогена и прогестерона (или только эстрогена), не вырабатывающие HER2 и имеющие индекс Ki-67 20%), но сохраняющие зависимость от влияния женских половых гормонов, эстрогена или прогестерона относятся к люминальному B подтипу. Такие опухоли так же могут быть HER2-положительными. Для лечения злокачественных опухолей молочной железы, относящихся к люминальному В подтипу, используется эндокринотерапия, химиотерапия, а также, в случае HER2-положительных опухолей – так называемая «таргетная» терапия с использование анти-HER2-препаратов, например трастузумаба.
С клинической точки зрения, опухоли, относящиеся к люминальным подтипам, являются наиболее благоприятными в плане прогноза, их своевременное лечение позволяет свести к минимуму риск развития рецидива заболевания, в случае лечения поздних стадий заболевания современные методы терапии позволяют достичь длительного контроля над болезнью.
К HER2-обогащенному подтипу относятся опухоли, которые не экспрессируют рецепторы эстрогена и прогестерона, но в большом количестве вырабатывают белок HER2. Для лечения этого подтипа рака молочной железы используется химиотерапия в сочетании с анти-HER2 препаратами.
Опухоли, в которых отсутствует экспрессия рецепторов эстрогена и прогестерона, а также не выявляется гиперэкспрессия белка HER2, относятся к так называемому тройному негативному раку молочной железы. Соответственно, рост клеток опухолей, которые относятся к этому подтипу, не зависит от стимулирующего влияния женских половых гормонов и белка HER2, по этой причине для их лечения не применяется ни гормонотерапия, ни анти-HER2 препараты. Они характеризуются агрессивным течением и, как правило, высоким значением индекса Ki-67. Тем не менее, этот вариант опухоли наиболее чувствителен к химиотерапии, во многих случаях на фоне её проведения можно достичь полной гибели всех злокачественных клеток. На долю этой разновидности рака молочной железы приходится 10-20% случаев. Подробнее про эту разновидность опухоли — в нашем материале.
источник
Эндокринотерапия (гормонотерапия) – разновидность противоопухолевого лечения, при котором применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. В основу разработки этого метода легло открытие факта, что клетки некоторых злокачественных новообразований не способны расти независимо от внешних условий. Процессы их роста зависят от наличия в крови или окружающих тканях гормонально активных веществ (гормоны). Ярким примером, служит рак молочной железы, во многих случаях которого для роста клеток необходимо наличие в крови эстрогенов и/или прогестерона. Соответственно, лишив опухолевые клетки «подпитки» этими гормонами, можно остановить их рост и даже добиться полного или частичного исчезновения опухоли.
Гормоны — биологически активные вещества, оказывающие регулирующее влияния на процессы обмена веществ, а также физиологических функций организма, включая процессы деления клеток. К гормонам относятся очень различающиеся друг от друга по структуре вещества. Они регулируют практически все процессы в организме, включая обмен веществ, рост, взросление и старение, половое созревание и т.д. Вопреки широко распространенному заблуждению, применение не всех гормонов вызывает увеличение массы тела и быстрый набор веса. Таким побочным эффектом характеризуются только глюкокортикостероиды и их производные (например, дексаметазон, преднизолон, метилпреднизолон и т.д.). Вещества, которые используются для лечения онкологических заболеваний, как правило, не вызывают увеличения веса.
Главное преимущество эндокринотерапии — её избирательное воздействие на ткани, которые зависимы от наличия «целевого» гормона, а также низкая токсичность проводимого лечения. Недостатки этого метода являются следствием его преимуществ — не все опухоли зависимы от наличия каких-либо гормонов, соответственно в случае такой зависимости назначение гормонотерапии будет неэффективно. Кроме того, возможно развитие симптомов снижения концентрации определенных гормонов, например симптомы менопаузы у женщин, получающих некоторые виды эндокринотерапии по поводу рака молочной железы. К гормонозависимым опухолям относят рак предстательной железы, некоторые виды рак молочной железы, рака тела матки и яичников. В данном разделе рассказывается о гормонотерапии на примере опухолей, чек рост может зависить от наличия рецепторов эстрогена и прогестерона.
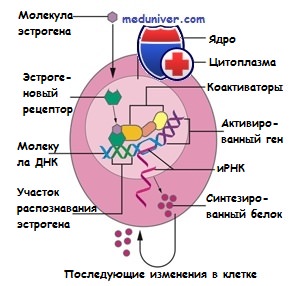
На поверхности практически всех клеток организма содержатся специальные белки, которые позволяют клеткам улавливать сигналы из окружающей среды. Эти белки являются своеобразными «глазами и ушами» клеток и играют роль детекторов: они получают «сигналы» от определенных веществ в крови и передают их клеткам. Такие белки получили название «рецепторы». Эти сигналы способны заставлять клетки активно делиться, в этом случае рецепторы выпускают в качестве «спускового крючка» в процессе деления клеток. В случае, если в крови появляется вещество, которое может взаимодействовать с рецептором (т.е. вещество, подходящее к рецептору как «ключ к замку»), запускается механизм деления клеток. Таким образом регулируется процесс деления многих нормальных клеток в организме, но опухолевые клетки способы активно использовать сигналы от рецепторов для своего роста.
Как было сказано выше, рецепторы есть на поверхности всех клеток в организме. При проведени гормонотерапии имеет значение один из видов рецепторов – гормональные рецепторы эстрогена и прогестерона. Эстроген и прогестерон часто называют «женскими гормонами», они выполняют важную роль в формировании женского организма в процессе полового созревания, а также в регуляции менструального цикла, беременности и процессе деторождении. Наиболее активно эти гормоны вырабатываются в женском организме во время менструального периода (т.е. с момента первой менструации до их окончания). Однако, даже после менопаузы в женском организме продолжают вырабатываться эти гормоны, хотя и в гораздо меньшем количестве. Примечательно, что у мужчин также они также образутся, но в значительно меньшем количестве, чем у женщин. При соединении с гормональными рецепторами эстроген и/или прогестерон стимулируют рост клеток молочной железы, а также играют важную роль в процессе обновления эндометрия (ткань, выстилающая внутреннюю полость матки).
Так как на опухолевых клетках тоже могут содержаться рецепторы гормонов, их рост может зависить от влияния эстрогена и прогестерона. Выработка (экспрессия) этих рецепторов отмечается на в клетках рака молочной железы в большинстве случаев развития этого заболевания. В случае наличия экспрессии рецепторов гормонов раковые клетки реагируют на сигналы, поступающие от этих гормонов, и используют их для выживания и размножения. В случаях, когда выживание раковой клетки зависит от влияния гормонов, если убрать эти гормоны или заблокировать их действия, у раковых клеток становится меньше шансов на выживание и размножение. Именно этот принцип и лег в основу гормонотерапии опухолей.
Как было сказано выше, гормонотерапия действует только на те опухолевые клетки, чье выживание зависит от наличия на них рецепторов гормонов. До начала лечения важно знать, имеют ли клетки рака эти рецепторы. В настоящее время разработаны методы, которые позволяют «увидеть» рецепторы различных гормонов. Во многих лабораториях используется метод окрашивания, при котором гормональные рецепторы становятся видны в образце ткани рака. Этот тест называется «иммуногистохимическое исследование» или иммуногистохимия (ИГХ) (подробнее про этот вид исследований и другие виды исследований опухолевой ткани). Врач-патологоанатом (или патоморфолог) произведет анализ кусочка опухолевой ткани и оценит наличие в ней экспрессии рецепторов. В случае если они есть – с большой долей вероятности пациентка получит преимущество от проведения гормонотерапии, если их нет – её назначение нецелесообразно, так как нет «точки приложения» лечения.
После проведения исследования врач-патологоанатом составит письменное заключение, отражающее его результаты. В случае рака молочной железы наиболее часто проводится одновременное определение наличия в опухолевой ткани рецепторов эстрогена, прогестерона, гиперэкспрессии (повышения выработки) белка HER2-neu, а также оценка скорости деления опухолевых клеток (индекс Ki-67). Не все лаборатории одинаковым образом анализируют результаты исследования, и они не обязаны выдавать результаты единым образом. Так что вы можете столкнуться с любыми из перечисленных результатов: Июнь 2019
источник
Часть опухолей молочной железы состоит из клеток, для которых характерно присутствие рецепторов эстрогенов и других стероидных гормонов, включая прогестоген. Эти рецепторы находятся как в ядре, так и в цитоплазме клеток. Они обнаружены в 65% опухолей, возникающих в период постменопаузы. В то же время лишь 30% опухолей, развивающихся в пременопаузе и связанных с геном BRCA1, обычно не содержат рецепторов эстрогенов и прогестерона (PR).
Однако эти рецепторы присутствуют в опухолях, связанных с геном BRCA2. Гормональная зависимость некоторых опухолей подтверждается клиническими наблюдениями при изменении в организме гормонального фона. В настоящее время показано, что наличие рецепторов эстрогенов (ER) в опухолевых клетках коррелирует с чувствительностью индивидуальной опухоли к гормонам. Это позволяет прогнозировать ее чувствительность к гормональным препаратам, что имеет важное клиническое значение.
Например, пациенткам, у которых обнаружена ER-отрицательная опухоль, можно не удалять яичники. Не совсем ясно, отражает ли статус ER фундаментальные различия между «отрицательным» и «положительным» раком молочной железы, или существует непрерывный переход от опухолей с резко положительной характеристикой ER к опухолям, в которых уровень ER практически не определяется. Современные данные свидетельствуют в пользу второго предположения.
При этом к положительным обычно относят опухоли, значение ER для которых находится выше определенного уровня, обычно составляющего 5 фмоль/мг цитоплазматического белка, или 25 фмоль/мг ядерной ДНК.
Наличие эстрогеновых рецепторов характерно для хорошо дифференцированных опухолей (особенно трубчатого, дольчатого, лобулярного или сосочкового типа), а также для опухолей с микроскопическими признаками эластоза. Согласно клиническим наблюдениям, медленно растущие опухоли в основном являются ER-положительными. Первичная опухоль и ее метастазы обладают близкими значениями ER, хотя от положительных опухолей иногда наблюдаются ER-отрицательные метастазы. Обратная картина встречается редко.
Насколько успешно измерения ER позволяют прогнозировать чувствительность опухолей к гормонам? Лишь 5-7% ER-отрицательных опухолей проявляют чувствительность к гормонам. Напротив, гормональной чувствительностью характеризуются 55% ER-положительных опухолей. Хотя больных с такими опухолями можно лечить гормональными препаратами, уровень ER нельзя считать достаточно надежным показателем.
Однако существует клиническая закономерность, выявленная эмпирически: опухоли с высоким значением ER в 90% случаев являются гормонально зависимыми. Наряду с этим показано, что опухоли с высокими значениями PR, более чем в 80% случаев также чувствительны к гормонам.
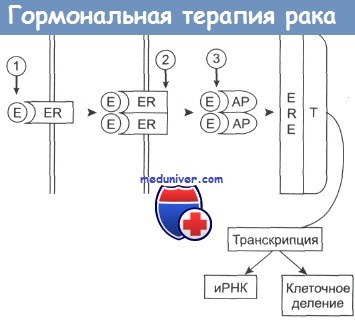
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.
источник
Экспрессия рецептора эстрогена связана с восстановительной способностью ДНК при раке молочной железы
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: JM. Выполнены эксперименты: LM WV ME CO. Проанализированы данные: ES LM JM JD. Используемые реагенты / материалы / инструменты анализа: JM ES DA. Написал документ: JM ES PC. Администрированное письменное информированное согласие и эпидемиологический вопросник: WV. Полученные образцы крови для измерения уровней DRC: WV.
Эстроген-рецептор-позитивные (ER +) опухоли используют комплексную сигнализацию, которая участвует в перекрестных помехах с множественными путями через геномную и негеномную регуляцию. Более глубокое понимание этих путей важно для развития улучшенных биомаркеров, которые могут лучше определять выбор лечения, риск рецидива и прогрессирование рака. Недостатки в способности репарации ДНК (ДРК) являются признаком рака молочной железы (БК); поэтому в этой работе мы проверили, влияет ли сигнализация ER на DRC. Мы проанализировали связь между положительной реакцией ER (активация рецептора%) и DRC у пациентов в 270 г. до н.э., а затем еще стратифицировали наш анализ по статусу рецептора HER2. Наши результаты показывают, что среди HER2-отрицательных вероятность наличия низких значений DRC среди женщин ER составляет 1,92 (95% ДИ: 1,03, 3,57) раз больше вероятности наличия низких значений DRC среди женщин ER +, даже приспосабливаясь к различным потенциальным смущениям (p 0,05).
Результаты показывают, что вероятность наличия DRC ниже 1,6% среди женщин с ER-опухолями составляет 2,23 (95% ДИ: 1,13, 4,68) раз, когда вероятность того, что DRM ниже 1,6% среди женщин ER +. После корректировки для различных потенциальных факторов, этот избыточный риск был статистически значимым (p 0,05). Когда мы оценили допущение пропорциональных коэффициентов ординальной логистической модели, результаты были незначительными (p> 0,05); следовательно, только один OR может быть оценен без зависимости от точки отсечки. Таким образом, результаты указывают на то, что вероятность наличия низких значений ДРК среди женщин ER составляет 1,92 (95% ДИ: 1,03, 3,57) по сравнению с вероятностью наличия низких значений ДСБ среди женщин ER +, даже приспосабливаясь к различным потенциальным конфессионалам; эта избыточная вероятность была статистически значимой (р 0,05).
Мы обнаружили, что уровни DRC и ER связаны и что эта ассоциация модифицируется статусом рецептора HER2 у женщин, у которых опухоли BC HER2-. Эта ассоциация предполагает, что уровни DRC и ER связаны между собой: по мере увеличения уровней DRC уровни ER также увеличиваются, и наоборот. Хотя в предыдущих исследованиях установлено, что дефектный фенотип восстановления ДНК обычно встречается у женщин с БК [38-40], насколько нам известно, это первое исследование, в котором показано, что статус ER связан с дефектным фенотипом восстановления ДНК. Наше предыдущее исследование (Matta et al., 2012), использующее конструкцию case control с 824 женщинами, показало полезность уровня DRC в качестве меры риска БК. На каждую процентную единицу снижения ДРК на 64% больше вероятность наличия БК. Таким образом, тонкие различия в ДРК у женщин с БК, разделенные на четыре группы, представленные на рис. 1, дают дополнительные доказательства того, как ДРК связано с риском БК. Например, две группы с самым низким DRC (ER- / HER2-, ER + / HER2-) представляли 76% исследовательской группы, состоящей из 270 женщин. Гены для репарации ДНК, особенно те, которые участвуют в восстановлении основания, могут оказать значительное влияние на специфическую выживаемость рака молочной железы, вызванную эстрогенами (BCSS), как недавно показали Abdel-Fatah et al. (2014). Они изучили 1406 женщин с ER положительными ранними стадиями БК с 20-летними клиническими наблюдениями. Многомерная модель пропорциональных рисков Кокса использовалась для расчета прогностического индекса восстановления ДНК и коррелировала с клинико-патологическими переменными и результатами выживания. Ключевые белковые восстановительные белки, включая XRCC1, APE1, SMUG1 и FEN1, были независимо связаны с бедной BCSS [36].
Большинство ER + опухолей молочной железы классифицируются как просвет [13-15,41]. Luminal A характеризуется ER + / PR + / HER2- / низким Ki-67 [42] и обычно хорошо реагирует на эндокринную терапию [28]. Напротив, Luminal B является либо HER2 +, либо HER2-, но ER + / PR + / высокий Ki-67 [42]; такие опухоли сложны диагностически и терапевтически [28]. Люминальные опухоли считаются более дифференцированными, ленивыми и чувствительными к эндокринной терапии, тогда как опухоли Luminal B более агрессивны и устойчивы к эндокринной терапии [43]. В самом деле, анализ биопсий Lips в 2012 году из 211 первичных опухолей первичной опухоли ER + / HER2 не мог определить подгруппу, которая, скорее всего, выиграет от неоадъювантной терапии, а тем более прогнозирует хемочувствительность или результат лечения. Биопсии тех же пациентов, перенесших после лечения, но до операции, были одинаково не раскрыты [41].
Несмотря на сегодняшнюю доступность комплексных анализов генной сигнатуры (см. Обзор Issa et al., 2014), и наши растущие знания о том, какие гены дисрегулируются в BC и как, информация не всегда приводила к увеличению клинической полезности или лучшим прогностическим инструментам [44]. Исследование Сантарпии в 2013 году по профилю экспрессии 145-гена, чтобы попытаться охарактеризовать подгруппы ER + / HER2, дало интересную, но неубедительную информацию [37]. Но проблемы существуют даже с генами, которые были изучены глубоко в течение многих лет. Например, EGFR усиливается во многих БК, и его перекрестные помехи с сигнализацией ER хорошо установлены. Тем не менее, крупные рандомизированные исследования пациентов, не принимавших лечение ER + / HER-пациентов, лучше не реагировали на лечение, когда ингибитор передачи EGFR был связан с ингибитором ароматазы [41]. Аналогичные результаты наблюдались в исследованиях с использованием ингибитора рецептора фактора роста фибробластов [41]. Руководящие принципы ASCO 2014 года подтверждают этот пробел в знаниях и отмечают, что для продвинутых ER + / HER2-BC не существует оптимального лечения первой или второй линии [8]. В совокупности это подчеркивает необходимость лучшей молекулярной классификации [19,23,41,45], а ER + / HER2 — опухоли молочной железы могут быть «канарейкой в угольной шахте», указывая на более эффективную прогностическую модель: комбинацию рецепторных анализов и ДРК. Несмотря на то, что исследования сделали большие успехи в молекулярной характеристике путей восстановления ДНК — и усилия по картированию NER и двум другим путям были присуждены Нобелевские премии по химии в 2015 году — наши знания по-прежнему остаются неполными. Из-за этого мы предлагаем, чтобы комбинация данных молекулярных сигнатур, включая прогностический индекс восстановления ДНК, недавно разработанный Abdel-Fatah et al. (2014), с репарацией ДНК-фенотипических данных могут обеспечить более точные диагностические и терапевтические решения [36].
У здоровых людей сигналы ER обычно снижают уровень ответа на повреждение ДНК (DDR) [46], одновременно стимулируя пролиферацию [46,47]. Семьдесят процентов активности ЭР регулируется сильно регулируемой генетикой, которая контролирует влияние ЭР [23]. Тем не менее, дисрегуляция ER-сигналов дает фенотип повышенной пролиферации или уменьшенного апоптоза [35]. Устойчивая сигнализация ER позволяет накопить повреждение ДНК низкого уровня, событие, зарегистрированное на ранней стадии опухолевого генеза [48].
ER-активация приводит к ответам на транскрипцию как в генах, так и без элементов ответа на эстроген. Кроме того, активация ER может вызывать нетранскрипционные клеточные ответы, все из которых способствуют пролиферации и выживаемости клеток [21, 49]. Это различие указывает на традиционную (каноническую) геномную сигнализацию в ядре, а также связанную с плазмой мембрану (неканоническую) сигнализацию. Первый включает ER-связывание непосредственно с родственным лигандом в промоторной области гена. В последнем ER «привязывает» к «первостепенным факторам», которые позволяют ER влиять на пути, которые в конечном итоге воздействуют на последующие целевые факторы транскрипции (такие как взаимодействия ER с VEGF и AP-1) [21]. Оба вида деятельности приводят к измененной экспрессии генов, и оба они могут приводить к точечным мутациям и неконтролируемой клеточной пролиферации, несмотря на то, что первые являются геномными, а последние не являются [45]. Что еще более важно, устойчивая передача сигналов ER может привести к большей экспрессии генов, связанных с пролиферацией, которые могут полагаться меньше на экспрессию традиционных ER-генов, но больше на альтернативные пути активации и роста опухоли [28].
Наше обнаружение того, что женщины с отрицательными опухолями BC и ER имеют более низкие значения DRC среди HER2, кажется, сначала интуитивным. Однако этот молекулярный ответ может быть ранним событием в опухолегенезе — возможно, попытка ER попытаться вызвать восстановление ДНК, чтобы компенсировать увеличение ошибок репликации раннего мутагенеза.
Это ставит вопрос о том, какой фактор (ы) мог бы модулировать эту ассоциацию и как это могло повлиять на варианты лечения? Если бы такие факторы могли быть определены, можно было бы разработать более эффективные панели биомаркеров и терапевтические режимы. Хотя анализ DRC в настоящее время используется в основном как метод оценки риска BC [38], его комбинация с статусом рецептора гормонов, как описано здесь, может расширить его применение.
Несмотря на разнообразие анализов генной сигнатуры, доступных сегодня, анализ 2014 [50] показывает, что даже самый всесторонний анализ не является экономически эффективным для определения оптимальной адъювантной терапии или результатов для ER + BCs [50]. Новые комбинации молекулярных маркеров, таких как DRC + статус рецепторов гормонов, могут позволить лучшую дифференциацию опухоли в пределах одного и того же молекулярного подтипа и привести к более эффективному лечению.
Грудные клетки с повреждением ДНК, вызванным эстрогеном, могут либо задержать ответ на повреждение / ремонт, либо могут способствовать выживанию клеток за счет ремонта [51]. Итак, почему эта связь DRC / ER будет обнаруживаться только в ER + / HER2-субпопуляции — это мучительный вопрос.
ER оказывает влияние практически на каждый путь восстановления ДНК [46,48,52-54]. Хотя прямые доказательства некоторых из этих путей разрежены, дисфункция и снижение регуляции пути NER являются заметными и хорошо документированными в БК [38-40]. Аномальная экспрессия двух белков NER (RPA, датчика повреждений и PCNA, фактор прогрессирования) связана с опухолями ER + / HER2-груди [37].
Два стержня для влияния ER на пути восстановления ДНК могут быть p53 и PI3K. ER, по-видимому, имеет двунаправленную связь инь-ян с p53, которая влияет на многие пути восстановления. Но больше доказательств того, как ER может сдвинуть сигнализацию восстановления, похоже, связано с путём PI3K — супермагистрали для сигнализации выживания [26,55,56]. Гиперактивация пути PI3K-Akt-mTOR распространена в BC [57]. Деструктивная экспрессия рецепторов фактора роста, включая ER, может активировать путь Ras / Raf / MEK / ERK, Ras / PI3K / PTEN / Akt / mTOR и другие сигнальные пути, создавая самоподдерживающуюся петлю обратной связи непрерывной сигнализации [58], что может привести к резистентности к гормональной терапии [59]. S1 Fig изображает наше видение того, как эстроген влияет на восстановление ДНК.
Насколько нам известно, мы первыми исследовали отношения между DRC и ER таким образом. Кроме того, мы считаем, что мы первыми изучили, как статус HER2 влияет на отношения DRC / ER. Этот новый подход имеет большую потенциальную полезность для персонализированной медицины. Например, при появлении ER в качестве источника резорбированного восстановления ДНК; имеет смысл включить тестирование на фенотип восстановления ДНК вместе с тестированием статуса гормонального рецептора. Основываясь на наших результатах, наше предложение, использующее эти два типа тестирования в сочетании, может обеспечить дополнительную молекулярную характеристику опухолей молочной железы — с возможной информацией о лучших вариантах лечения, особенно в более клинически сложных БК, включая, помимо прочего, ER + / HER2-случаи , Наше исследование имеет надежный размер и мощность выборки [38]; результаты были согласованы после корректировки различных источников изменчивости (состояние менопаузы, история ВС и статуса HER2) в модели порядковой логистической регрессии.
Неоднородность опухолей ER +, их неравный ответ на терапию антиэстрогенами и способность ER влиять на экспрессию генов в совокупности указывают на необходимость более полной молекулярной характеристики опухолей BC. В BC добавление теста для DRC на подпись генома позволяет идентифицировать дефектный фенотип восстановления ДНК и может увеличить нашу способность прогнозировать, какие опухоли Luminal B, вероятно, будут более агрессивными. Это позволяет выбирать лучшие режимы лечения, особенно для диагностических и терапевтически сложных молекулярных подтипов BC, таких как ER + / HER2-. Наши данные показывают ранее необнаруженную, тонкую разницу в опухолях ER +, что также может помочь объяснить отсутствие корреляции между конечными точками среди некоторых клинических испытаний для этих опухолей. Доступность одноцепочечных и одномолекулярных анализов создает у нас захватывающую возможность лучшего молекулярного профилирования.
Исследование было одобрено Управлением по исследованию университета Университета Понсе (IRB № 120207-JM). Пациенты для этого исследования были отобраны из нашего более крупного исследования BC (1 181 пациент и контрольных пациентов, набранных в 2006-2012 гг.), Который был ранее описан [38,60,61]. К случаям, выбранным для этого исследования, были женщины с первичным диагнозом БК и были набраны из гинекологических и онкологических клиник в Пуэрто-Рико.
Критериями включения были пациенты, у которых: (1) были недавно диагностированы гистопатологически с первичной БК, (2) были наихудшими (не получали химиотерапию, переливание крови или лучевую терапию) и (3) имели сообщения о патологии, которые включали информацию о гормональных рецепторах. Мы получили формы согласия, которые позволили нам опросить участников, получить образцы крови и просмотреть их отчеты о патологии. Среди случаев 344 женщины имели право участвовать в исследовании; однако только 270 имели полную информацию о статусе гормонального рецептора. Поэтому наша заключительная исследовательская группа насчитывала 270 случаев до н.э.
Анализ реактивации клеток-хозяев (HCR) с репортерным геном люциферазы, который мы использовали для измерения уровней DRC в лимфоцитах, был описан в ранее опубликованных молекулярно-эпидемиологических исследованиях рака [40,62-68]. Ранее мы опубликовали данные об изменчивости, стабильности трансфекции плазмид и различиях между криоконсервированными и свежими образцами крови для HCR [38]. Этот анализ измеряет общий DRC трансфицированных лимфоцитов. Результаты отражают общую восстановительную способность клеток-хозяев, хотя HCR в основном обнаруживает активность пути восстановления нуклеотидного удаления (NER) [38].
Мы использовали образцы периферической крови для получения лимфоцитов, которые были отделены, очищены и выращены из каждого образца пациента [38]. Эти клетки использовали в качестве суррогатных маркеров общего DRC пациентов [69,70]. Приблизительно 30 мл периферической крови получали от каждого участника и хранили в гепаринизированных пробирках. Затем лимфоциты выделяли методом градиента Ficoll и суспендировали в 2 мл замораживающей среды, содержащей 10% диметилсульфоксида, 40% среды RPMI 1640, 50% фетальной бычьей сыворотки и 1% антибиотика / антимикотика. Аликвоты хранили в морозильнике -80 ° C в течение 1-3 недель. Затем лимфоциты оттаивали партиями 5-7 образцов для анализа HCR (подробности см. Ниже). Периоды сбора были примерно одинаковыми для пациентов и женщин без БК, поскольку набор был проведен одновременно.
HCR проводили на лимфоцитах периферической крови для измерения DRC in vivo, как описано в предыдущих исследованиях [38,40,60,61,71]. Покойный доктор Лоуренс Гроссман (Школа общественного здравоохранения имени Джона Хопкинса, Балтимор, MD) предоставил люциферазную плазмиду для анализа HCR и протокол для его использования. Экспрессирующий вектор плазмидной экспрессии (pCMVluc) из 4863 пар оснований был генно-инженерным, чтобы содержать репортерный ген бактериальной люциферазы, который отсутствует в клетке млекопитающего. Ген был поврежден ультрафиолетовым излучением С (254 нм) контролируемым, количественным образом (кривая зависимости доза), так что уровень его экспрессии был прямым измерением восстановительной способности клетки млекопитающего-хозяина. Плазмидную конструкцию, содержащую ген люциферазы (LUC), облучали при 0, 350 и 700 Дж / м2, используя 254-нм UVC-лампу (38). Эта конструкция плазмиды и ее валидация были описаны ранее [72]. Контролируемое количественное УФ-облучение вызывало кривую доза-реакция, так что уровень ее экспрессии был прямым измерением ремонтной способности клетки-хозяина-хозяина. После трансфекции в лимфоциты повреждение восстановительной-транскрипционной блокировки вводилось экзогенно на чужеродную ДНК; затем общий DRC измеряли с помощью HCR [71]. Этот подход измерил незатронутый фенотип, который отражает присущий клеткам ДРК, измеряемый главным образом с точки зрения их активности NER [71]. Сохранение постоянной времени для завершения восстановления лимфоцитов зеркальным отражением настоящего клеточного процесса [70].
Для расчета DRC, не поврежденную плазмидную ДНК сравнивали с восстановлением поврежденной in vitro плазмидной ДНК; результаты были выражены как процент остаточной экспрессии репортерного гена люциферазы (% люциферазной активности в единицах люминесценции). Количество экспрессии гена отражало DRC, выраженное в процентах. Подробное описание анализа, включая разделение ДРС на третичные, содержится в Matta et al. 2012 [38]. Это исследование основывается на 17-летнем опыте нашей лаборатории по проведению HCR-анализа для измерения DRC и его проверки чувствительности, специфичности и полезности в качестве меры риска БК [38].
Мы проанализировали медицинские данные пациентов для сбора данных о статусе рецептора эстрогена (ER), прогестерона (PR) и рецептора 2 эпидермального фактора роста человека (HER2). Десять частных лабораторий в Пуэрто-Рико провели анализ статуса рецептора на биопсии фиксированных опухолей у пациентов с использованием методов иммуногистохимии (IHC) в ASCO (Американское общество клинической онкологии) и CAP (коллегия американских патологов) [10,73]. Анализ ER и PR включал процент клеток с положительным окрашиванием, интенсивность окрашивания (слабый, умеренный или сильный), а интерпретация («положительный рецептор» означала ≥1% инвазивных опухолевых клеток, окрашенных положительно для ER / PR »; отрицательный рецептор «означал 0,05).
Для оценки взаимосвязи между DRC и статусом ER была использована порядковая модель логистической регрессии (OLRM) [74]. OLRM является расширением модели логистической регрессии, которая применяется к дихотомическим зависимым переменным, что позволяет использовать более двух (упорядоченных) категорий ответов. Чтобы применить эту модель к нашему анализу, ДРК классифицировали в разных группах, используя в качестве точек отсечения наблюдаемые ТРЦ (1,6%, 1,6-3,2%,> 3,2%). Выражение этой модели выглядит следующим образом:
logP≤kP> к = β0k-βEk * ЭР + ΣβiCi
где P≤k указывает на преобладание женщин с DRC равным или ниже tertile k, P> k указывает на преобладание женщин с DRC выше tertile k, βEk указывает коэффициент, связанный с ER, когда используется kT-DRC tertile, ER является фиктивные переменные для указания статуса ER (+, -) и βi указывает коэффициент, связанный с каждой потенциальной смешающей переменной, Ci. Эта модель дает оценку величины ассоциации (ORER-vs.ER + (≤k)) между DRC и ER в разных точках отсечения DRC следующим образом:
ORER-vs.ER + (≤k) = eβ ^ Е.К. ± 1.96SE (β ^ Е.К.)
где SE (β ^ EK) указывает стандартную ошибку β ^ EK. Однако, если выполняется предположение о пропорциональных коэффициентах (ORER-vs.ER + (≤1.6) = ORER-vs.ER + (≤3.2)), то оценивается только один OR без зависимости от точки отсечения DRC. Наши данные показали, что это предположение было выполнено (p> 0,1); поэтому была указана только одна оценка ОР.
Эстроген может оказывать разнообразное действие на опухолевые клетки, некоторые из которых могут включать сигнализацию восстановления ДНК специально среди опухолей HER2 (-). (A) В каноническом пути ER связывается с промоторными областями генов, участвующих в прогрессировании клеточного цикла. (B) Неканонические пути включают в себя множество других сигнальных каскадов, таких как p53, mTOR и ERK, что также может привести к увеличению пролиферации. Оба этих пути могут привести к низким уровням повреждения ДНК, которые могут «включить» механизмы восстановления ДНК (оцененные в этом исследовании в циркулирующих лимфоцитах пациентов).
Щелкните здесь для получения дополнительных данных.
Особая благодарность г-же Лане Кристиан (CreateWrite Inc.) за ее выдающуюся помощь в редактировании рукописи и ее критический анализ рукописи. Боб Ричи (PHSU) помог в форматировании рукописей. Авторы хотели бы поблагодарить доктора Джеймса Робба за критический обзор этой рукописи и за ценные отзывы от доктора Тимоти Ребекка из Университета Пенсильвании. Мы также признательны за поддержку: доктора Диего Е. Завала Зегарры, доктора Гильермо Тортолеро Луны, Найди Переса-Риоса, М.С. и Карлоса Р. Торреса-Цинтрона, MPH из Центрального реестра рака Пуэрто-Рико за помощь и доступ к отчеты о патологии участников.
Репаративная способность ДНК
нуклеотидный иссечный ремонт
Модель регрессионной логистической регрессии
источник
Автореферат и диссертация по медицине (14.00.46) на тему: Роль рецепторов эстрогенов, прогестерона, андрогенов, онкобелка HER-2, антигена Ki-67 в прогнозе рака молочной железы
Автореферат диссертации по медицине на тему Роль рецепторов эстрогенов, прогестерона, андрогенов, онкобелка HER-2, антигена Ki-67 в прогнозе рака молочной железы
АНИКЕЕВА Наталья Валерьевна
РОЛЬ РЕЦЕПТОРОВ ЭСТРОГЕНОВ, ПРОГЕСТЕРОНА, АНДРОГЕНОВ, ОНКОБЕЛКА НЕК-2, АНТИГЕНА Кл-67 В ПРОГНОЗЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
14.00,46 — клиническая лабораторная диагностика 14.00.14 — онкология
Автореферат диссертации на соискание ученой степени кандидата биологических наук
Работа выполнена в лаборатории морфологических исследований отдела морфологии и клеточной патологии сектора клинического лабораторно-диагностического Федерального государственного учреждения здравоохранения «Всероссийский центр экстренной и радиационной медицины» МЧС России
доктор биологических наук Кравцов Вячеслав Юрьевич кандидат медицинских наук Эллиниди Вера Николаевна
доктор биологических наук профессор Слозина Наталья Михайловна член-корреспондент РАЕН.
доктор медицинских наук профессор Пожарисский Казимир Марианович
Ведущая организация: Санкт-Петербургский государственный медицинский университет им. И.П. Павлова
Защита состоится «25» мая 2006 в 13 часов на заседании диссертационного совета Д 205.001.01 Федерального государственного учреждения здравоохранения «Всероссийский центр экстренной и радиационной медицины» МЧС России по адресу: 194044, Санкт-Петербург, ул. Лебедева, 4/2.
С диссертацией можно ознакомиться в библиотеке Федерального государственного учреждения здравоохранения «Всероссийский центр экстренной и радиационной медицины» МЧС России.
Ученый секретарь \ кандидат медицинских наук
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Рак молочной железы (РМЖ) — серьезная медицинская и социальная проблема для большинства развитых стран мира: Несмотря на значительные достижения последней четверти XX века в понимании биологии и клиники заболевания, а также кардинальные изменения в подходе к лечению, проблема продолжает оставаться высокоактуальной.
К настоящему моменту сообщается более чем о ста факторах прогноза, дающих представление о биологическом поведении опухоли, а для предсказания клинического течения опухолевого процесса и исхода при РМЖ большое значение придается маркерам, выявляемым иммуногистохимическим методом [Пожарисский К.М., Леепман Б.Е., 2000].
Одними из первых вошедших в практику клеточных маркеров были рецепторы эстрогенов (РЭ) и прогестерона (РП), роль которых в генезе гормонозависимых опухолей доказана большим количеством исследований [Сергеев П.В., 1994; Семиглазов В.Ф. и соавт., 1992]. Определение РЭ и РП в ткани опухоли сейчас рассматривается как обязательное условие для успешного гормонального лечения РМЖ [АИгес! В.С. е1 а1., 1998; Бернштейн Л.М., 2000; Семиглазов В.Ф., 2001]. При метастатических поражениях степень реакции на гормональную терапию также существенно зависит от наличия РЭ и РП в опухоли: ее эффективность составляет около 10 % при РЭ-отрицательных опухолях, примерно 50 % при РЭ-положительных опухолях и около 75 % при опухолях, содержащих одновременно РЭ и РП. Тем не менее, известны случаи резистентности к гормонотерапии больных с РЭ- и РП-положительными РМЖ, поэтому гормонально-рецепторный статус опухоли оказывается не всегда достаточным показателем гормональной чувствительности РМЖ [Летягин В.П., 2004]. Вопрос о прогностическом значении выявления РП в РМЖ, несмотря на большое количество исследований, до сих пор остается открытым.
Исследования последних лет выявили, что злокачественные опухоли молочной железы в 50 % случаев содержат рецепторы андрогенов (РА) [5еНт А.й. е1 а1., 2002]. Однако их роль в течении опухолевого процесса пока неясна. Предполагается, что в дополнение к рецепторам эстрогенов и прогестерона, рецепторы андрогенов могут быть важны в контроле за ростом РМЖ [Вгуз М. « а1., 2002], а также в более тщательном отборе пациентов для проведения адекватной гормональной терапии [¿а^Ьагш N. е1 а1., 1997].
Не вызывает сомнения тот факт, что эстрадиол индуцирует синтез факторов роста [Бернштейн Л.М., 1998, 2000], рецепторы которых, например рецептор эпидермального
фактора роста, имеют сходство с некоторыми онкобелками [Носов Д.А., 2002]. В их число входит мембранный гликопротеид HER-2 [Wang D.,1993], являющийся членом семейства тирозинкиназных рецепторов и одним из самых перспективных маркеров для предсказания возникновения рецидивов заболевания, появления метастазов, резистентности к химио- и гормонотерапии РМЖ [Slamon D. et al, 2001; Пожарисский K.M., Леенман Е.Е.Г2002; Хансон К.П., 2002; Семиглазов В.Ф., 2001].
Ведущим фактором в механизме злокачественной трансформации клеток и в биологическом поведении уже возникших опухолей является их пролиферативная активность. Для выявления особенностей пролиферации клеток злокачественных опухолей человека широко используется антиген Ki-67, экспрессирующийся практически во всех фазах митотического цикла и отражающий величину пролиферативного пула [Пожарисский K.M., ЛеенМан Е.Е., 2000].
До сегодняшнего дня значимость отдельных вышеперечисленных маркеров, выявляемых иммуногистохимическим методом, остается недоказанной, кроме того, на сегодняшний день согласованного мнения о прогностической роли экспрессии рецепторов эстрогенов, прогестерона и, особенно, андрогенов, Ki-67, онкобелка HER-2 и сочетания этих факторов нет.
Цель исследования. Комплексное изучение содержания и уровня экспрессии рецепторов эстрогенов, прогестерона, андрогенов, экспрессии онкобелка HER-2 (с-егЪВ2) и антигена Ki-67 и определение диагностической значимости этих маркеров, выявляемых иммуногистохимическим методом, для прогноза клинического течения рака молочной железы.
Задачи исследования. Для достижения цели были поставлены следующие задачи:
1. Изучить содержание и уровень экспрессии рецепторов андрогенов с одновременным определением содержания и уровня экспрессии рецепторов эстрогенов й рецепторов прогестерона в клетках рака молочной железы.
2. Изучить клинико-морфологические особенности течения рака молочной железы с различными гормонально-рецепторными фенотипами опухоли.
3. Определить уровень экспрессии онкобелка HER-2 в клетках рака молочной железы с различными гормонально-рецепторными фенотипами.
4. Определить уровень экспрессии антигена Ki-67 в клетках рака молочной железы с различными гормонально-рецепторными фенотипами.
Основные положении, выносимые на защиту:
1. В клетках рака молочной рецепторы эстрогенов выявляются в 48 % случаев, рецепторы прогестерона — в 43 % случаев, рецепторы андрогенов — в 47 %
2. В клетках рака молочной железы рецепторы андрогенов выявляются в 69 % опухолей, содержащих рецепторы эстрогенов и прогестерона, и в 11% опухолей, не содержащих рецепторы эстрогенов и прогестерона.
3. Основными гормонально-рецепторными фенотипами рака молочной железы являются те, в которых отмечается одновременная экспрессия рецепторов эстрогенов, прогестерона и андрогенов или одновременное отсутствие рецепторов стероидных гормонов.
4. Опухоли, не содержащие рецепторы эстрогенов и прогестерона, а также содержащие только рецепторы прогестерона характеризуются более злокачественным клиническим течением.
Научная новизна. Впервые проведено комплексное изучение клинико-лабораторных характеристик клеток рака молочной железы: содержания и уровня экспрессии рецепторов эстрогенов, прогестерона, андрогенов, онкобелка НЕЯ-2, антигена Кл-67 с применением высокочувствительного и специфичного иммуногистохимического метода.
Впервые отмечено, что опухоли, не содержащие рецепторы эстрогенов и прогестерона, а также имеющие только рецепторы прогестерона, характеризуются более агрессивным клиническим течением.
Впервые одновременно с рецепторами эстрогенов и прогестерона определили содержание и уровень экспрессии рецепторов андрогенов в клетках рака молочной железы, что позволило выделить дополнительную группу пациентов с опухолями, не содержащими рецепторы эстрогенов и прогестерона и имеющими рецепторы андрогенов.
Комплексный подход к изучению рака молочной железы с определением совокупности клеточных маркеров, выявляемых иммуногистохимическим методом, и сравнение их с клинико-морфологическими критериями прогноза клинического течения опухоли позволили выделить важную роль содержания и уровня экспрессии рецепторов прогестерона. Снижение уровня экспрессии рецепторов прогестерона в клетках рака молочной железы является важным предсказательным фактором низкой эффективности противоопухолевой гормональной терапии и может рассматриваться как показатель неблагоприятного прогноза клинического течения рака молочной железы.
Практическая значимость работы. Предложена программа комплексного лабораторного иммуногистохимического исследования клеток рака молочной железы, включающая определение содержания и уровня экспрессии рецепторов стероидных гормонов: эстрогенов, прогестерона, андрогенов, онкобелка НЕЯ-2 и антигена Кь67 для
формирования прогноза клинического течения рака молочной железы и отбора групп пациентов для проведения адекватной гормональной и химиотерапии.
Выделены группы пациентов с опухолевыми фенотипами, обладающими неблагоприятными прогностическими и предсказательными характеристиками.
При отсутствии в клетках рака молочной железы рецепторов эстрогенов и рецепторов прогестерона рекомендуется дополнительное количественное определение рецепторов андрогенов чувствительным и высокоспецифичным иммуногистохимическим методом, что позволит в случае выявления в опухоли рецепторов андрогенов, выделить группу пациентов для дальнейшего клинического обследования и наблюдения с целью решения вопроса о выборе гормональной противоопухолевой терапии.
Апробация работы. Результаты исследования изложены в виде стендового доклада на Международной конференции в г. Иркутске (сентябрь 2003 г.); на IV Конгрессе по аутоиммунитету «КК-клетки (СБ5б, СИ 16) и экспрессия антигена Кь67 в раке молочной железы с различным гормонально-рецепторным статусом» (г. Будапешт, ноябрь 2004 г.); на Международном конгрессе по РМЖ (г. Брюссель, январь 2006 г.).
Объем и структура диссертации. Диссертация состоит из введения, обзора литературы, главы «Материалы и методы исследования», трех глав собственных исследований и их обсуждения, выводов, практических рекомендаций, списка использованной литературы. Диссертация изложена на 137 страницах машинописного текста и иллюстрирована 31 таблицей и 24 рисунками. Список литературы содержит 24 отечественных и 108 иностранных источников литературы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика обследуемой группы пациентов. При выполнении настоящего исследования в обследуемую группу были включены 344 пациента Ленинградского и Псковского областных онкологических диспансеров, которым в период с июля 2002 г. по декабрь 2004 г. был поставлен диагноз РМЖ.
Всем пациентам’ . проводилось комплексное обследование в условиях вышеперечисленных лечебных учреждений: осмотр врача-онколога, выполнение рентгенографического и ультразвукового исследований молочных желез. Для выяснения характера новообразования молочной железы выполнялось цитологическое исследование (тонкоигольная аспирационная биопсия) и гистологическое исследование (трепан-биопсия или операционный материал).
Приготовление парафиновых блоков, срезов, окрашивание препаратов гематоксилином-эозином по стандартной методике и последующая верификация диагноза
проводились специалистами’ патолого-анатомических лабораторий этих лечебных учреждений с последующим пересмотром гистологических препаратов и подтверждением диагноза РМЖ в лаборатории морфологических исследований ВЦЭРМа МЧС России.
Иммуногистохимическое определение содержания рецепторов эстрогенов, рецепторов прогестерона и апдрогенов, онкобелка HER-2, антигена Ki-67 в клетках рака молочной железы. В. работе применялся одноэтапный авидин-биотиновый иммуногистохимический метод визуализации антигенов (протокол фирмы «Novocastra»), В качестве первых антител использовались антитела фирмы «Novocastra» (Великобритания) и фирмы «DAKO» (Дания), в качестве системы визуализации — АВС-Kit (universal) фирмы «Novocastra». Для выявления цветового окрашивания результата реакции применялся DAB фирмы «Pharmingen».
Гистологические срезы помещались на предварительно обработанные раствором адгезива (NCL-BOND, фирмы «Novocastra», Великобритания) предметные стекла. Для высокотемпературной демаскировки антигенов применялся 0,01М цитратный буфер с рН 6,0. Стекла со срезами кипятились в скороварке под высоким давлением в течение 2 минут. Для блокирования эндогенной пероксидазы использовали свежеприготовленный 3%-й раствор перекиси водорода. После инкубации с нормальной неиммунной сывороткой на срезы наносили первые (специфические) антитела. Использовали антитела к РЭ — RTU-ER-6F1 l(«Novocastra»); к РП — RTU-PGR-312 («Novocastra»); к РА — AR441, в разведении 1:200 («DAKO»); антитела к антигену Ki-67 — RTU-Ki-67-MMl («Novocastra»); поликлональные кроличьи антитела к онкобелку c-erbB2 (HER-2) — А0485 («DAKO»), В качестве системы визуализации использовали ABC-kit («Novocastra»). Пероксидазу хрена, с помощью которой метились молекулы авидина, выявляли при помощи диамиобензидина. Проявление реакции контролировали под микроскопом. Затем препараты переводились в постоянные путем заключения в канадский бальзам (фирма «БиоВитрум»),
Анализ результатов проводили при помощи микроскопа DM LS2. фирмы «Leica». Использовали объектив с увеличением 10 или 20 и окуляр с увеличением 10.
Для оценки экспрессии рецепторов эстрогенов, прогестерона и андрогенов использовалась система Histochemical score (Hscore). При оценке иммуногистохимического окрашивания по способу HScore [McClelland R.A. et al., 1991] подсчитывали число ядер с разной интенсивностью окраски на 500 опухолевых клеток и окончательные результаты рассчитывали по формуле:
HScore = 1 x процент слабоокрашенных клеток +
2 х процент умеренноокрашенных клеток +
3 х процент сильноокрашенных клеток.
Экспрессию онкобелка HER-2 оценивали в соответствии с правилами HercepTest ™ (фирма «DAKO») в баллах от 0 до 3+.
Для оценки уровня экспрессии антигена Ki-67 подсчитывалось количество (%) положительно окрашенных ядер клеток независимо от интенсивности их окрашивания.
Статистическую обработку полученных результатов проводили с помощью пакета программ Statistica 5.0 for Windows 2000. Использовались корреляционный анализ по Спирмену и тест Манна-Уитни.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Морфологические, клинические и прогностические характеристики рака молочной железы в обследованной группе пациентов.
У подавляющего большинства пациентов (у 280 из 344), отмечался инвазивный протоковый РМЖ, что составило 81,3 %. Соотношение различных гистологических форм РМЖ не противоречило аналогичным данным ВОЗ [WHO, 2003]. При проведении сравнительного анализа между различными гистологическим формами рака молочной железы не выявлено достоверно значимых различий по следующим показателям: среднему возрасту пациента, размерам опухоли, наличию метастатического поражения лимфатических узлов, количеству пораженных метастазами лимфатических узлов (р>0,05; тест Манна-Уитни).
Практически с одинаковой частотой РМЖ обнаруживался в правой.(48,9 %) и левой (51,1 %) молочных железах.
Средний возраст пациентов составил 55±7,6 лет.
Коэффициент корреляции по Спирмену между показателями «средний возраст пациентов» и «степень злокачественности» составил г = — 0,89 (р 0,05).
Представленные результаты в целом не противоречат данным литературы о взаимосвязи между степенью злокачественности РМЖ, возрастом пациента, размерами опухоли, наличием метастазов в регионарные лимфатические узлы, количеством лимфатических узлов, пораженных метастазами [Волченко H.H., Франк Г.А., 2000]. Это позволяет рассматривать обследуемую группу пациентов как адекватную для анализа проведенных иммуногистохимических исследований.
Иммуногистохимическое определение содержания рецепторов эстрогенов и прогестерона в клетках рака молочной железы. Иммуногистохимическое определение содержания и уровня экспрессии РЭ и РП проведено в опухолях 344 пациентов с диагнозом РМЖ.
РЭ обнаружены в 48 % (в 164 из 344) случаев и отсутствовали в 52 % (в 180 из 344) случаев РМЖ.
Средний возраст пациентов с РЭ-положительными РМЖ составил 58,1 ±9,1 лет.
Корреляционный анализ по Спирмену в выборке (п = 344) обследованных пациентов с РМЖ показал, что возраст достоверно положительно коррелировал с уровнем экспрессии (HScore) РЭ (г = 0,3; р 0,05).
Наличие метастазов в регионарные лимфатические узлы отмечалось у 59 % пациентов с РЭ-отрицательными РМЖ, у 53 % пациентов с РЭ-слабоположительными опухолями и в 42 % случаев РМЖ с РЭ-положительным фенотипом. Наоборот, отсутствие метастазов в лимфатических узлах наблюдалось в 41 % случаев РЭ-отрицательных РМЖ, в 47 % случаев РЭ-слабоположительных РМЖ и в 58% случаев РЭ-положительных РМЖ. Таким образом, метастатическое поражение лимфатических узлов достоверно чаще отмечалось в группе пациентов с РЭ-отрицательными РМЖ (59 %), чем в группе пациентов с РЭ-положительными опухолями (42 %) (р 0,05).
Средний уровень экспрессии РП составил 154,7 балла по шкале Шсоге при размахе изменчивости от 40 до 300. В зависимости от уровня экспрессии все РП-содержащие
опухоли были разделены на три группы: с отрицательной (менее 10 баллов), со слабоположительной (от И до 99 баллов) и положительной (более 100 баллов) экспрессией РП. Выделенные по уровню экспрессии РП группы пациентов с помощью теста Манна-Уитни сравнивали между собой по следующим показателям: степени злокачественности РМЖ, возрасту пациента, размерам опухоли, наличию метастазов и множественности поражения лимфатических узлов, количеству пораженных метастазами лимфатических узлов. Эти группы пациентов достоверно не различались между собой по всем перечисленным показателям (р>0,05).
В обследуемой нами выборке пациентов (п. = 344) выявлена положительная корреляция между уровнями экспрессии РЭиРП (г = 0,6; р 0,05), а также между средним возрастом пациентов с РА-положительными и РП-положительными РМЖ (р >0,05).
Уровень экспрессии РА в среднем составил 46,36 баллов по шкале Шсоге при размахе изменчивости от 20 до 200, что оказалось достоверно ниже уровня экспрессии РЭ (202,4 баллов по шкале НЭсоге) (р 0,05, тест Манна-Уитни). Между уровнем экспрессии РА и возрастом пациентов какие-либо корреляции не выявлены (г = 0,07; р>0,05). Опухоли с фенотипами РА+ и РА- не различались между собой по размерам (р > 0,05).
Выделенные по уровню экспрессии РА группы пациентов сравнивали между собой по следующим показателям: степени злокачественности РМЖ, возрасту пациента, размерам опухоли, наличию или отсутствию метастазов в лимфатических узлах, множественности метастатического поражения (>1 лимфатического узла), количеству
пораженных метастазами лимфатических узлов. Различия между группами пациентов по этим показателям оказались статистически недостоверными (р>0,05; тест Манна-Уитни,).
Корреляционный анализ по Спирмепу выявил, что уровень экспрессии (Щсоге) РА прямо пропорционально коррелировал с уровнем экспрессии (НБсоге) РЭ (г = 0,46; р 0,05, тест Манна-Уитни).
При сравнении выделенных четырех групп фенотпов РМЖ выявилось, что опухоли с более высоким уровнем злокачественности достоверно чаще встречались среди опухолей с фенотипом РЭ-РП-, чем с фенотипом РЭ+РП+ (р 0,05).
У пациентов с опухолевыми фенотипами HER-2 (3+) и (2+) в отличие от пациентов с опухолевыми фенотипами ШЖ-2 (0) и (1+) достоверно чаще встречались множественные метастазы в лимфатических .узлах в сравнении с единичными метастатическими поражениями лимфатических узлов (р 0,05). Вместе с тем, по уровню экспрессии РП были выявлены достоверные различия между обследуемыми группами пациентов с различными НЕЯ-2 фенотипами РМЖ. Стоит отметить тот факт, что опухоли с максимальной экспрессией НЕК-2 (3+) характеризуются достоверно пониженным уровнем экспрессии РП (р 67 не зависел от возраста пациентов (корреляционный анализ по Спирмену, г = — 0,01; р> 0,05).
Распределение гистологических форм РМЖ не отличало данную обследуемую группу пациентов от других обследуемых групп.
Уровень экспрессии антигена К1-67 прямо пропорционально коррелировал со степенью злокачественности РМЖ (коэффициент корреляции по Спирмену г = 0,5; р 67) клеток РМЖ с фенотипом РЭ-РП- был статистически достоверно выше, чем в клетках РМЖ с фенотипом РЭ+РП+ (р 0,05).
В зависимости от уровня экспрессии РЭ, РП и РА в клетках РМЖ пациенты были разделены на группы с отрицательной, слабоположительной и положительной экспрессией рецепторов стероидных гормонов. Статистически достоверных различий по индексу Кьб7 между РМЖ со слабоположительной экспрессией РЭ и РА, положительной экспрессией РЭ и РА, а также с РЭ- и РА-отрицательными опухолями пе выявлено (р>0,05). В то же время уровень экспрессии антигена Кь67 в клетках РМЖ со слабоположительными РП оказался достоверно выше, чем в опухолях с другим уровнем экспрессии РП (р Аникеева, Наталья Валерьевна :: 2006 :: Санкт-Петербург
1.1 .Эпидемиология и клинико-морфологическая характеристика рака молочной железы.
1.2. Гормональная (эстрогенная) гипотеза развития рака молочной железы.
1.3.Рецепторы стероидных гормонов и их роль в развитии рака молочной железы, клинико-прогностическое значение.
1.4. Экспрессия рецепторов HER-2 в клетках рака молочной железы.
1.5. Маркер пролиферативной активности Ki-67 в клетках рака молочной железы.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ.
2.1. Характеристика обследуемой группы пациентов.
2.2. Иммуногистохимическое определение рецепторов эстрогенов, прогестерона, андрогенов, онкобелка HER-2, антигена Kiв клетках рака молочной железы.
Глава 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ.
3.1. Морфологические, клинические и прогностические характеристики рака молочной железы в обследованной группе пациентов.
3.2. Иммуногистохимическое определение содержания рецепторов эстрогенов и прогестерона в клетках рака молочной железы.
3.3. Иммуногистохимическое определение содержания рецепторов андрогенов в клетках рака молочной железы.
3.4. Содержание и экспрессия рецепторов андрогенов в клетках рака молочной железы с различными РЭ/РП-фенотипами.
3.5. Иммуногистохимическое определение экспрессии онкобелка HER-2 в клетках рака молочной железы.
3.6. Иммуногистохимическое определение экспрессии антигена Kiв клетках рака молочной железы.
Введение диссертации по теме «Клиническая лабораторная диагностика», Аникеева, Наталья Валерьевна, автореферат
Рак молочной железы (РМЖ) является серьезной медицинской и социальной проблемой для большинства развитых стран мира. Несмотря на значительные достижения последней четверти века в понимании биологии и клиники заболевания, а также кардинальные изменения в подходе к лечению, проблема продолжает оставаться высокоактуальной.
К настоящему моменту сообщается более чем о ста факторах прогноза, дающих представление о биологическом поведении опухоли, а для предсказания клинического течения опухолевого процесса и исхода при РМЖ большое значение придается иммуногистохимическим маркерам [Пожарисский К.М., Леенман Е.Е., 2000].
Одними из первых вошедших в практику клеточных маркеров были рецепторы эстрогенов (РЭ) и прогестерона (РП), роль которых в генезе гормонозависимых опухолей доказана большим количеством исследований [Семиглазов В.Ф. и соавт., 1992]. Определение РЭ и РП в ткани опухоли сейчас рассматривается как обязательное условие для его успешного гормонального лечения РМЖ [Allred D.C. et al., 1998; Бернштейн Л.М., 2000; Семиглазов В.Ф., 2001]. Степень реакции на гормональную терапию также существенно зависит от наличия РЭ и РП в опухоли: ее эффективность составляет около 10 % при РЭ-отрицательных опухолях, примерно 50 % при РЭ-положительных опухолях и около 75 % при опухолях, содержащих одновременно РЭ и РП. Тем не менее, известны случаи резистентности к гормональной терапии больных с РЭ- и РП-положительными опухолями, поэтому гормонально-рецепторный статус опухоли оказывается не всегда достаточным показателем гормональной чувствительности РМЖ [Летягин В.П., 2004].
Исследования последних лет выявили, что злокачественные опухоли молочной железы в 50 % случаев содержат рецепторы андрогенов [Selim
A.G. et al., 2002], однако их роль в течении опухолевого процесса пока неясна. Предполагается, что в дополнение к рецепторам эстрогенов и прогестерона, рецепторы андрогенов могут быть важны в контроле за ростом РМЖ [Brys М. et al., 2002], а также в более тщательном отборе пациентов для проведения адекватной гормональной терапии [Zarghami N. et al., 1997].
Не вызывает сомнения тот факт, что эстрадиол индуцирует синтез факторов роста [Бернштейн JI.M., 1998; 2000], рецепторы которых, например, рецептор эпидермального фактора роста, имеют сходство с некоторыми онкобелками. В их число входит мембранный гликопротеид HER-2 [Wang D., 1993], являющийся членом семейства тирозинкиназных рецепторов и одним из самых перспективных маркеров для предсказания возникновения рецидивов заболевания, появления метастазов, резистентности к химио- и гормонотерапии РМЖ [Slamon D. et al, 2001; Пожарисский К.М., Леенман Е.Е., 2000; Хансон К.П., 2002].
Ведущим фактором в механизме злокачественной трансформации клеток, в биологическом поведении уже возникших опухолей является их пролиферативная активность. Для выявления особенностей пролиферации клеток злокачественных опухолей человека широко используется антиген Ki-67, экспрессирующийся практически во всех фазах митотического цикла и отражающий величину пролиферативного пула [Пожарисский К.М., Леенман Е.Е., 2000].
До сегодняшнего дня значимость отдельных вышеперечисленных маркеров, выявляемых иммуногистохимическим методом, остается недоказанной, кроме того, на сегодняшний день согласованного мнения о прогностической роли экспрессии рецепторов эстрогенов, прогестерона и, особенно, андрогенов, антигена Ki-67, онкобелка HER-2 и сочетания этих факторов нет.
Комплексное изучение содержания и уровня экспрессии рецепторов эстрогенов, прогестерона, андрогенов, экспрессии онкобелка HER-2 (с-егЬВ2) и антигена Ki-67 и определение диагностической значимости этих маркеров, выявляемых иммуногистохимическим методом, для прогноза клинического течения рака молочной железы. Задачи исследования
Для достижения цели были поставлены следующие задачи:
1. Изучить содержание и уровень экспрессии рецепторов андрогенов с одновременным определением содержания и уровня экспрессии рецепторов эстрогенов и рецепторов прогестерона в клетках рака молочной железы.
2. Изучить клинико-морфологические особенности течения рака молочной железы с различными гормонально-рецепторными фенотипами опухоли.
3. Определить экспрессию онкобелка HER-2 в клетках рака молочной железы с различными гормонально-рецепторными фенотипами.
4. Определить уровень экспрессии антигена Ki-67 в клетках рака молочной железы с различными гормонально-рецепторными фенотипами.
Основные положения, выносимые на защиту:
1. В клетках рака молочной рецепторы эстрогенов выявляются в 48 % случаев, рецепторы прогестерона — в 43 % случаев, рецепторы андрогенов — в 47 % случаев.
2. В клетках рака молочной железы рецепторы андрогенов выявляются в 69 % опухолей, содержащих рецепторы эстрогенов и прогестерона, и в 11% опухолей, не содержащих рецепторы эстрогенов и прогестерона.
3. Основными гормонально-рецепторными фенотипами рака молочной железы являются те, в которых отмечается одновременная экспрессия рецепторов эстрогенов, прогестерона и андрогенов или одновременное отсутствие рецепторов стероидных гормонов.
4. Опухоли, не содержащие рецепторы эстрогенов и прогестерона, а также содержащие только рецепторы прогестерона, характеризуются более злокачественным клиническим течением. Научная новизна
Впервые проведено комплексное изучение клинико-лабораторных характеристик клеток рака молочной железы: содержания и уровня экспрессии рецепторов эстрогенов, прогестерона, андрогенов, онкобелка HER-2, антигена Ki-67 с применением высокочувствительного и специфичного иммуногистохимического метода.
Впервые отмечено, что опухоли, не содержащие рецепторы эстрогенов и прогестерона, а также имеющие только рецепторы прогестерона, характеризуются более агрессивным клиническим течением.
Впервые одновременно с рецепторами эстрогенов и прогестерона определили содержание и уровень экспрессии рецепторов андрогенов в клетках рака молочной железы, что позволило выделить дополнительную группу пациентов с опухолями, не содержащими рецепторы эстрогенов и прогестерона и имеющими рецепторы андрогенов.
Комплексный подход к изучению рака молочной железы с определением совокупности клеточных маркеров, выявляемых иммуногистохимическим методом, и сравнение их с клинико-морфологическими критериями прогноза клинического течения опухоли позволил выделить важную роль наличия и уровня экспрессии рецепторов прогестерона. Снижение уровня экспрессии рецепторов прогестерона в клетках рака молочной железы является важным предсказательным фактором низкой эффективности противоопухолевой гормональной терапии и может рассматриваться как показатель неблагоприятного прогноза клинического течения рака молочной железы.
Практическая значимость работы
Предложена программа комплексного лабораторного иммуногистохимического исследования клеток рака молочной железы, включающая определение содержания и уровня экспрессии рецепторов стероидных гормонов: эстрогенов, прогестерона, андрогенов, онкобелка HER-2 и антигена Ki-67, для формирования прогноза клинического течения рака молочной железы и отбора групп пациентов для проведения адекватной гормональной и химиотерапии.
Выделены группы пациентов с опухолевыми фенотипами, обладающими неблагоприятными прогностическими и предсказательными характеристиками.
При отсутствии в клетках рака молочной железы рецепторов эстрогенов и рецепторов прогестерона рекомендуется дополнительное количественное определение рецепторов андрогенов чувствительным и высокоспецифичным иммуногистохимическим методом, что позволит в случае выявления в опухоли рецепторов андрогенов, выделить группу пациентов для дальнейшего клинического обследования и наблюдения с целью решения вопроса о выборе гормональной противоопухолевой терапии.
Результаты исследования изложены в виде стендового доклада на Международной конференции в г. Иркутске (сентябрь 2003 г.); на IV Конгрессе по аутоиммунитету «NK-клетки (CD56, CD 16) и экспрессия антигена Ki-67 в раке молочной железы с различным гормонально-рецепторным статусом» (г. Будапешт, ноябрь 2004 г.); на
Международном конгрессе по РМЖ (г. Брюссель, январь 2006 г.).
источник