Рак, в том числе и молочной железы, встречался у людей с доисторических времен. Сохранившиеся реликвии, древние кости и палеонтологические останки свидетельствуют о том, что рак распространен повсеместно и может поражать все живое: как растения, так и животных. В скелетах динозавров мезозойского периода выявляются злокачественные опухоли костей.
Признаки рака обнаружены в мумиях из египетских пирамид, в этрусских могильниках и в древних захоронениях Перу, Китая. Археологические раскопки древних курганов и изучение костей из могильников на территории России (Красноярский край, европейская часть) доказывают, что народности, населявшие эти районы, страдали раком молочной железы и других органов.
Наиболее ранним документом, относящимся к истории медицины, является древний хирургический папирус Эдвина Смифа, относящийся к временам Египетских пирамид (2,5 — — 3 тыс. лет до н. э.). Хотя достоверно неизвестно имя автора, текст приписывается врачу древнего мира Имхотепу. В папирусе описаны 8 случаев рака молочной железы. Опухоли делятся на холодные (выпуклые) с отеком молочной железы и воспалительные, скорее всего абсцессы. Для лечения последних рекомендуется коагуляция или применение огненной дрели. При обнаружении холодной опухоли никакого лечения не рекомендовалось.
Из кодекса Хаммурапи (2250 лет до н. э.) мы узнаем, что медицинская профессия была широко развитой в древнем Вавилоне, тщательно регламентированной и регулируемой законом. За лечение опухолей, ран и абсцессов с помощью бронзового ланцета устанавливалась плата законом в размере 10 серебряных шекелей с зажиточных пациентов и 2 или 5 шекелей с бедных людей и слуг. Если в результате действия доктора пациент погибал или терял глаз, ему отсекали руку (при лечении зажиточного пациента) или возвращались деньги, если это касалось раба. Сама плата за лечение представляется относительно высокой, так как ежегодная рента за жилище среднего класса равнялась 5 серебряным шекелям, а ежедневный заработок ремесленников — всего 1/5 шекеля.
Древнегреческий историк Геродот (500 лет до н. э.) за 100 лет до Гиппократа повествует предание о принцессе Атосса, страдавшей раком молочной железы. Она обратилась за помощью к знаменитому врачу Демоседесу ( 525 г . до н. э.) лишь тогда, когда опухоль достигла больших размеров и начала ее беспокоить. Из-за ложной скромности принцесса не жаловалась, пока опухоль была небольших размеров. Этот случай показывает отношение женщины к своим молочным железам в тот очень ранний период истории. Тип лечения рака молочной железы не указывается. Принцесса была излечена, однако историк полагает, что у нее, возможно, не было злокачественной опухоли.
Прославленный врач Гиппократ (400 лет до н. э.) также немного упоминает о раке молочной железы. Он указывает, что лучше не производить лечения при «глубокорасполагающихся» опухолях, так как оно может ускорить гибель пациента, а отказ от лечения может продлить жизнь. Средняя продолжительность жизни в те времена была около 18 лет. Поэтому неудивительно, что рак молочной железы упоминаются не так часто.
Знаменитый врач Гален (131 — — 200 гг.), возможно, первый предложил хирургическое лечение рака молочной железы с сохранением большой грудной мышцы. Он же и узаконил термин «рак», описав форму опухоли, похожую на краба. Гален был приверженцем «гуморальной» теории рака груди и других органов, вызываемого, по его мнению, «черной желчью»,- теории, доминировавшей в медицине на протяжении целого тысячелетия.
В течение многих столетий врачи описывали подобные случаи в своей практике с тем же печальным заключением. Никаких сдвигов в лечении онкологии молочной железы не происходило до тех пор, пока в XVII-м веке врачи не добились лучшего понимания работы кровеносной и лимфатической систем организма и не смогли понять, что он распространяется (метастазирует) по лимфатическим путям и в первую очередь поражает ближайшие — подмышечные — лимфатические узлы.
Французский хирург Жан-Луи Петит (1674-1750) и вскоре после него шотландский хирург Бенджамин Белл (1749-1806) были первыми, кто догадался удалять при раке молочной железы не только саму грудь, но и ближайшие лимфатические узлы и подлежащую грудную мышцу.
Их успешная работа была подхвачена Уильямом Стюардом Холстедом, который в 1882 году ввёл в широкую медицинскую практику технически усовершенствованный вариант этой операции, которую он назвал «радикальной мастэктомией». Операция стала настолько популярной при раке молочной железы, что даже получила название по имени её изобретателя — «мастэктомия Холстеда» или «мастэктомия по Холстеду».
источник
Начало изучения причин возникновения злокачественных, опухолей и попытки их лечения относятся к очень глубокой древности.
Однако о раке молочной железы, даже в золотой век греческой и римской культуры, написано весьма мало. Не оставил также на эту тему солидного трактата и столь «плодовитый» автор того времени — Гиппократ.
Четкое описание клинической картины рака молочной железы и операции при нем дали греческие врачи Гален (второе столетие нашей эры) и Леонидес из Александрии. Следует заметить, что Леонидес был первым автором, описавшим симптом втяжения соска при раке молочной железы; он же предостерегал своих современников от операции при запущенных формах рака. Такое же предостережение делал и весьма авторитетный римский ученый Цельз (первое столетие нашей эры). Однако, несмотря на эти высказывания, создается впечатление, что героические операции по поводу запущенного рака молочной железы производились. Бесперспективность этого направления раньше всего поняли греческие врачи.
Неутешительные результаты оперативного лечения пели к поискам других методов лечения. Стали проводить выжигание пораженного органа раскаленным железом или горячим маслом. Эту методику широко применяли арабы, но хорошо владели указанным видом лечения египтяне, греки и римляне. Поиски новых методов чаще всего вели к периодическому увлечению консервативными мероприятиями, подчас наивными, в виде приложения к заболевшей молочной железе металлов, минералов, овощей, животных.
В более близкие к нам времена, вплоть до XVI века, в лечение рака молочной железы не было внесено чего-либо полезного.
Удивительно, что в XVI веке, когда работали и публиковали свои труды Ambrois Pare (1510—1590), Andreas Vesalius (1514—1564), Fabricius (1537-1619), могли появляться столь наивные методы, как предложение немецкого врача Leonard Fuchs (1501 — 1566), который советовал давить пораженную молочную железу свинцовыми пластинками.
Медики того времени смотрели на рак молочной железы как на местный процесс, а поэтому и предлагаемые ими методы лечения были направлены на первичный очаг. Следует, однако, оговориться, что Pare уже тогда понимал, что существует связь первичного очага с одноименной подмышечной областью.
Эту мысль развил в XVIII веке выдающийся хирург Henri Francois de Dran (1685—1770). He признавая гуморальной теории Галена в происхождении опухолей, Dran считал, что рак молочной железы только в начальном периоде является местным процессом, а в дальнейшем поражает регионарные лимфатические узлы. По этим соображениям он предлагал раннюю операцию, подчеркивая, что больные с пораженными лимфатическими узлами имеют меньше шансов на успех.
Dran при операции по поводу рака молочной железы с выраженными регионарными метастазами удалял также и лимфатический аппарат подмышечной впадины. Следует добавить, что Dran дал четкое описание регионарного метастазирования при раке молочной железы.
Сторонником расширения оперативного вмешательства при раке молочной железы был также Petit (1674— 1750). Он вместе с широким удалением первичного очага удалял и подмышечные лимфатические узлы.
Несмотря на высказывания столь авторитетных хирургов того времени о необходимости расширения оперативного вмешательства при раке молочной железы, сдвигов в лечении не последовало. И это не удивительно, так как плохие отдаленные результаты оперативного лечения рака молочной железы, несмотря на некоторое расширение оперативного вмешательства, не воодушевляли хирургов встать на этот более радикальный путь еще и вследствие высокой смертности от сепсиса, шока и других осложнений, зависящих от инфекции и тогдашнего примитивного обезболивания.
Кроме того, не следует забывать и о том, что такие авторитетные ученые, как Paget, Liston, Velpeau, не были единодушны с хирургами, призывавшими к расширению оперативного вмешательства при раке молочной железы.
В лечении рака молочной железы наблюдались тогда периоды подъема, которые затем сменялись глубокой депрессией. Но все же время от времени в эту проблему вливалась новая струя. Так, в 1867 г. лондонский хирург Moor на основании изучения причин послеоперационных рецидивов при раке молочной железы пропагандировал радикальную операцию в полном смысле этого слова. Три года спустя его поддержал Lister.
Однако, несмотря на высокую технику, хирургическую смелость многих поколений хирургов, настоящий прогресс в хирургии вообще и в частности в хирургии рака молочной железы наступил лишь после полного развития патологической анатомии, удовлетворительных методов остановки кровотечения, обезболивания, антисептики и, наконец, асептики.
Во второй половине XIX столетия вопрос о необходимости более радикального оперирования при раке молочной железы был также поднят группой немецких хирургов.
Так, в 1875 г. Volkmann призывал к удалению всей молочной железы вместе с кожей, грудной фасцией и частью большой грудной мышцы. Оперируя таким образом 38 больных с далеко зашедшим раком, он не наблюдал рецидивов в течение 3 лет у 14% больных. При этом Volkmann подчеркивал также необходимость удаления всей молочной железы и при незапущенных формах рака.
В разработке рационального оперирования рака молочной железы принимали участие тогда также Waldeyer, Billroth, Winiwarter, Heidenhein.
Наиболее обстоятельной явилась работа Heidenhein (1889), основанная на микроскопическом исследовании. Этот автор, исходя из положения, что задний отдел молочной железы имеет интимное отношение к грудной фасции и что ему при раке молочной железы удалось установить частое поражение ретромаммарного лимфатического аппарата, рекомендовал при опухолях, не спаянных с грудной стенкой, удалять грудную фасцию вместе с поверхностным слоем большой грудной мышцы. Что же касается полного удаления последней, то Heidenhein советовал это лишь в тех случаях, когда имеется прорастание опухолью мышцы, другими словами, при очень далеко зашедшем процессе. Выдвигая компромиссное решение, Heidenhein исходил из ошибочного положения, считая, что большая грудная мышца вовлекается в процесс позже, главным образом когда опухоль распространяется на нее вследствие инфильтративного роста или путем метастазирования. Такой неправильный взгляд Heidenhein высказал, несмотря на свои исследования, установившие раннее вовлечение в процесс грудной фасции и в случаях небольшого распространения рака молочной железы, не спаянного с грудной стенкой. Все же его высказывания, хотя ошибочные, внесли определенный сдвиг в оперативное лечение рака этой локализации.
Обоснованием для удаления большой и малой грудных мышц послужили и дальнейшем исследования Rotter, который установил, что даже при незапущенном раке молочной железы, когда сохранена еще ее подвижность, в известном проценте случаев на задней поверхности большой грудной мышцы встречаются небольшие лимфатические узлы, явно вовлеченные в процесс.
Однако наибольшую заслугу в разработке принципов радикального оперирования при раке молочной железы следует приписать американскому хирургу Halsted (1852—1922), идея которого родилась на почве высказываний и предложений, сделанных в течение предыдущих лет рядом видных ученых.
Разработку своего метода Halsted начал в 1882 г., но первая публикация была им сделана в 1894 г., когда он привел результаты 50 операций и подчеркнул необходимость удаления вместе с молочной железой большой грудной мышцы и всех подозрительных тканей единым блоком.
Его трехлетние результаты операций превзошли все ожидания. Рациональное расширение оперативного вмешательства дало, по данным Halsted, 57% стойких выздоровлений, в то время как, по данным Billroth и Volkmann, процент стойких выздоровлений колебался от 4 до 11%.
В другой работе, опубликованной и 1898 г., Halsted рекомендовал с целью радикализма удаление малой грудной мышцы, надключичных лимфатических узлов, а для закрытия кожного дефекта — немедленную пересадку кожи.
В далеко зашедших случаях Halsled иссекал верхний отдел апоневроза прямой мышцы живота, фасцию зубчатой, подлопаточной мышцы, а также край фасции широкой мышцы спины.
Подытожив в 1907 г. весь свой клинический материал, включающий 232 операции, при которых удаление надключичных лимфатических узлов было сделано в 113 случаях, Halsted пришел к выводу, что удаление надключичных лимфатических узлов не улучшает отдаленных результатов.
Приоритет предложения радикальной мастэктомии при раке молочной железы бесспорно принадлежит Halsted. Однако необходимо указать, что в том же 1894 г., когда он опубликовал свои наблюдения и принципы радикальной мастэктомии, американец Meyer изложил перед Нью-Йоркской медицинской академией подобные же взгляды.
Метод Meyer отличался от метода Halsted лишь направлением кожного разреза и иссечением не только большой, по и малой грудной мышцы, удаление которой было предложено Halsted лишь в 1898 г. Кроме того, Meyer не удалял надключичных лимфатических узлов. К моменту своего доклада Meyer оперировал по такому методу за 3 года всего 6 больных.
Оставляя приоритет за Halsted, необходимо подчеркнуть, что как Halsted, так и Meyer независимо друг от друга обратили внимание хирургов на принципиальные детали радикальной мастэктомии и этим самым внесли ту существенную поправку, которая в дальнейшем способствовала спасению сотен тысяч женщин, страдающих раком молочной железы.
После опубликования данных Halsted метод радикального оперирования при раке молочной железы стал завоевывать за рубежом все больше и больше сторонников. Что же касается нашей страны, то, как указывает А. Резвяков, метод Холстеда Мейера был встречен без большого энтузиазма.
В конце XIX и даже в начале XX века продолжали оперировать по методу Фолькмана — Винивартера, несмотря на то что Н. И. Студенский еще в 1888 г. призывал к операции, сходной по идее с операцией Холстеда.
Метод Фолькмана — Винивартера диктовал оставление большой грудной мышцы, снимали лишь поверхностную грудную фасцию. Лимфатические узлы удаляли только в подмышечной зоне, лимфатический аппарат подключичной области оставался нетронутым. Понятно, что столь нерадикальное вмешательство не могло давать стойких результатов излечения. Местные рецидивы наблюдались в 45%, причем у многих больных уже в течение первого месяца после операции (П. А. Резвяков). Остается непонятным, почему представители отечественной хирургии в деле лечения рака молочной железы придерживались прежних взглядов столь продолжительное время.
Вышедшая в 1908 г. диссертация о раке молочной железы П. А. Резвякова, надо полагать, внесла в этот вопрос много нового. О необходимости радикальной операции при раке молочной железы имеются также высказывания в диссертации Н. Бушмакина, опубликованной в 1910 г.
Эти годы можно считать для нашей страны рубежом перехода к радикальному оперированию рака молочной железы.
Правда, в монографии В. Л. Боголюбова (1912) опять было выдвинуто компромиссное решение об удалении грудных мышц: «М. pect. maj. в своей грудной части должен быть удален. В случаях, где на задней поверхности m. pect. maj. имеются раковые узелки, должен быть также удален и m. pect. min. И только в самых начальных случаях процесса, пожалуй, можно ограничиться удалением поверхностного слоя m-li pect. maj.».
Высказывания В. Л. Боголюбова, относящиеся к 1912 г., надо полагать, базировались больше на собственных умозаключениях, чем на основании уже накопившегося к тому времени значительного числа наблюдений, иллюстрировавших преимущества радикальной операции.
Все же радикальная операция при раке молочной железы стала постепенно завоевывать право гражданстваи приобретать все большее количество сторонников. Необходимость удалении молочной железы вместе с грудными мышцами и регионарным лимфатическим аппаратом была, наконец, осознана.
Правда, столь крупный представитель отечественной хирургии, как С. П. Федоров, даже в своих лекциях по хирургии, изданных в 1928 г., указывал, что он далеко не во всех случаях рака молочной железы иссекает большую грудную мышцу. По этому поводу он писал: «Грудную мышцы я иссекаю только в тех случаях, когда грудная железа оказывается сращенной с апоневрозом, ибо в таких случаях можно ожидать, что имеется поражение лимфатических путей, проникающих из апоневроза в мышцу». Надо полагать, что С. П. Федоров в ту пору был единственным сторонником подобной операции при раке молочной железы.
Большая заслуга в пропаганде радикализма и абластического выполнения операции по поводу рака вообще и в частности при раке молочной железы принадлежит Н. П. Петрову и П. Л. Герцену. Ими была внесена предельная ясность в вопрос определения операбильности и неоперабильности при онкологических заболеваниях.
В технику радикальной мастэктомии, описанной Halsted в 1891 и 1894 гг., различные авторы вносили некоторые изменения, предлагали различные варианты кожного разреза, но наиболее существенное добавление к этой операции сделал в 1951 г. Urban. Основываясь на работах Handley и Thackray, указавших на наличие метастазов в парастернальных лимфатических узлах при расположении опухоли в центральной и медиальной части молочной железы, Urban предложил так называемую сверхрадикальную мастэктомию, которая заключается в удалении при этой операции также и парастернальных лимфатических узлов.
Открытие в конце прошлого столетия лучей Рентгена и радия способствовало новому направлению в лечении злокачественных опухолей.
После внедрения лучевой терапии в медицинскую практику появилось стремление испытать этот вид лечения при раке молочной железы как метод, заменяющий оперативное вмешательство.
Начиная с 1910 г. стали появляться сообщения о возможности излечения рака молочной железы с помощью рентгеновых лучей. Однако это были единичные сообщения.
Статистические данные, собранные Perthes и Werner, основанные на значительном клиническом материале, показали, что оперативный метод имеет свои преимущества. Так, по данным Perthes, даже при раке молочной железы I стадии лучевое лечение давало лишь 21,4% выздоровления.
В дальнейшем рентгеновы лучи по предложению Anschutz были использованы с профилактической целью как дополнительный метод к оперативному лечению рака молочной железы. Anschutz в 1927 г. сообщил, что после того, как он стал проводить послеоперационную рентгенотерапию, результаты улучшились на 19%. Из 105 больных 5 лет прожили без рецидива 55%, а в другой серии, в которой облучение больным не проводилось, этот процент был равен 36.
Статистические сведения Lane-Claypon, Anschutz, А. М. Заблудовского, С. Р. Френкеля и других свидетельствовали, что сочетание операции с профилактической рентгенотерапией имеет определенные преимущества.
Однако, несмотря па эти сообщения, большинство хирургов в 20-х годах отдавало предпочтение оперативному лечению рака молочной железы. Этому, конечно, способствовали разноречивые данные о результатах лечения, чаще всего связанные с плохой статистической обработкой материала, а также значительные различия в методах лучевой терапии, касающиеся ритма облучения.
В специализированных учреждениях комбинированный метод по сравнению с чисто хирургическим лечением давал более высокий процент стойкого выздоровления.
Помимо данных о значении послеоперационного профилактического облучения, в последующие годы были накоплены убедительные наблюдения по пред- и послеоперационной рентгенотерапии в сочетании с радикальной мастэктомией.
Появились также работы о преимуществах предоперационной рентгенотерапии запущенных форм рака молочной железы через свинцовую решетку, позволяющей попытать выносливость кожи и доводить при небольших полях суммарную дозу до 18 000—24 000 г (в воздухе). Помимо рентгеновых лучей, для лечения злокачественных опухолей было использовано бета- и гамма-излучение естественных радиоактивных веществ. Что касается гамма-излучения закрытых радиоактивных веществ, то основные методы их применения разрабатывались и совершенствовались в последние 50 лет.
После открытия искусственной радиоактивности появилась возможность получения новых радиоактивных изотопов, что позволило применять не только естественные радиоактивные вещества — радий и радий-мезоторий, но и новые изотопы в качестве внешнего и внутреннего облучения в виде открытых и закрытых радиоактивных веществ.
Так, в настоящее время при раке молочной железы для предоперационной лучевой обработки применяют внутритканевое введение коллоидного золота Аu198.
Создание длиннофокусной телегамма-установки ГУТ-Со-400 с источником Со60 в 400 г-экв. радия позволило при раке молочной железы проводить предоперационное облучение.
Проводимая ранее предоперационная телегамматерапия на близкофокусной телегамма-установке с тубусом диаметром 5 см (ГУТ-Со-20) не могла обеспечить равномерного облучения. Поэтому этот вид терапии проводился редко, главным образом у больных с начальными формами рака молочной железы и небольшим размером органа.
И последние годы аппаратура и техника облучения достигли высокого совершенства. Накопились значительные данные о биологическом действии рентгеновых и гамма-лучей, доказавших их высокую эффективность в лечении злокачественных опухолей. В настоящее время имеется большой клинический материал, иллюстрирующий преимущества комбинированных методов лечения рака молочной железы.
Внутритканевая гамматерапия с помощью радиоактивных игл, так называемый радиохирургический метод лечения первичного рака молочной железы, была применена впервые английским онкологом Keynes в 1926 г.
Правда, еще в 20-х годах при раке молочной железы проводили внедрение игл с эманацией радия в сочетании с рентгенотерапией, но как метод, полностью заменяющий комбинированное лечение.
Успехи экспериментальной эндокринологии и биохимии внесли много нового как в вопросы лечения, так и профилактики рака молочной железы.
Перестройка гормонального баланса организма женщины при некоторых формах рака молочной железы и рецидивах теперь может проводиться не только с помощью лучевого или хирургического выключения функции яичников, но и путем назначения соответствующих гормонов.
Уже имеется значительное число наблюдений по гормональной перестройке при запущенных формах рака молочной железы с помощью оперативного удаления надпочечников, гипофиза в сочетании с лучевым или хирургическим выключением функции яичников. Проводится также гормонопрофилактика после комбинированного лечения, применяется химиотерапия рака молочной железы.
Благодаря прогрессу наших знаний в вопросах этиологии и патогенеза рака молочной железы, а также возможности широкого проведения комбинированного лечении мы в настоящее время спасаем или продлеваем жизнь большему количеству больных, чем два десятилетия назад.
В 1949 г. McWhirter выдвинул положение о необходимости сужения оперативного вмешательства до простой аблации молочной железы с последующей массивной рентгенотерапией.
В противоположность ему в 1951 г. Urban предложил при радикальной мастэктомии удалять не только подмышечные, подключичные и подлопаточные лимфатические узлы, но и парастернальные, назвав эту операцию сверхрадикальной мастэктомией.
Dahl-Iversen пошел еще дальше, рекомендуя дополнять операцию Urban удалением надключичных, а Wangensteen — и медиастинальных лимфатических узлов.
И, наконец, появились противники всякого оперативною вмешательства, предлагающие при операбильном раке молочной железы проводить рентгенотерапию в сочетании с гормонотерапией (Baclesse).
источник
Диагноз рака молочной железы является травматичным.
Но сегодня, с коэффициентами выживания до 98%, есть больше оснований, чем когда-либо быть оптимистичным.
В свое время рак молочной железы можно было диагностировать только тогда, когда опухоль была достаточно большой, чтобы видеть или чувствовать.
Теперь его можно распознать — и вылечить — намного раньше, часто до появления каких-либо симптомов.
Важные достижения в области рака молочной железы, диагностики и лечения включают:
- Маммография
- Хирургические улучшения
- Излучение
- Химиотерапия
- Препараты, ограничивающие эстроген
- Генетическое тестирование
- Целенаправленная молекулярная терапия
За последние два десятилетия медицинские достижения помогли революционизировать наше понимание рака.
Достижения в диагностике рака молочной железы
С 1950-х годов достижения в области маммографии кредитуются за повышение 5-летней выживаемости при локализованном раке молочной железы, который не распространился с места его происхождения) с 80% до 98%. Сегодня метод маммографии дает наилучшие результаты, на самых ранних стадиях.
На протяжении многих лет для обнаружения использовались следующие методы:
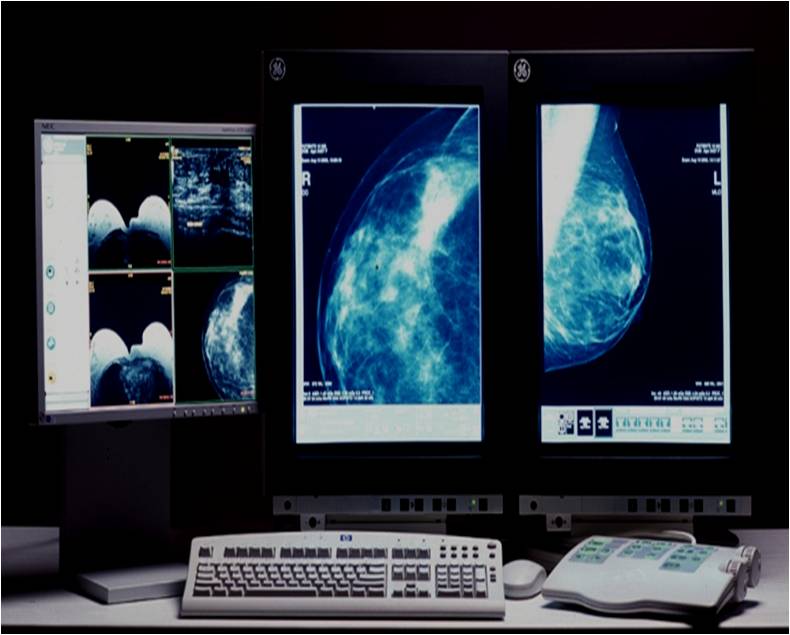
Стандартная маммография — после 1967 года диагностическая маммография завоевала популярность благодаря внедрению оборудования специально для рентгенографии молочных желез. В то время целью маммографии, как и на сегодняшний день для МРТ, был дальнейший анализ аномалий, которые уже были выявлены. Скрининговые маммограммы — теперь рекомендуется для всех женщин возраст которых от 40ка лет и старше — начались в 1980-х годах.
Цифровая маммография. Цифровая маммография появилась в начале 1990-х годов и предложила более подробные изображения и более удобное хранение для будущих сравнений, но она по-прежнему недоступна во многих областях, особенно за пределами городов и крупных учебных больниц. Исследования показывают, что цифровая маммография в основном помогает женщинам моложе 50 лет, у которых есть периоды, а также у женщинам с плотной грудной клеткой. Ткань с относительно небольшим количеством жира может скрыть аномалии в стандартных маммограммах. Для большинства женщин цифровая точность не является более точной, чем обычная маммография, но она примерно в четыре раза дороже и менее подвержена страхованию.
Трехмерная маммография — новая технология, одобренная FDA в 2011 году, трехмерная маммография может дать более четкие изображения с надеждой определить больше видов рака и сократить количество повторяющихся маммограмм в два раза.
Ультразвук — в конце 1970-х годов врачи начали использовать ультразвук, чтобы определить, была ли уже обнаруженная киста твердой или жидкой, что помогло диагностировать рак и рецидивы рака.
МРТ — основательно заработало с 2007 года. Американское онкологическое общество (ACS) рекомендовало ежегодные МРТ для женщин, у которых высокий риск рака груди, но процедура дорогая и доступна только в крупных городах. Ни ультразвук, ни МРТ не могут обнаружить микрокальцификацию, которая иногда является единственным признаком раннего рака. Другой недостаток заключается в том, что МРТ не всегда может отличить рак от доброкачественных (нераспространенных) аномалий, что приводит к большему количеству биопсий — процедуры, используемой для удаления образца ткани (тканей) из подозрительной опухоли.
Клинические обследования груди и самообследования — ACS ранее поощрял ежегодный клинический осмотр груди врачом вместе с самообследованием груди (BSEs). В 2015 году они обновили руководящие принципы, заявив, что больше не рекомендуют клиническое обследование при скрининге рака груди женщинам среднего риска в любом возрасте.
За прошедшие годы были использованы следующие методы лечения:
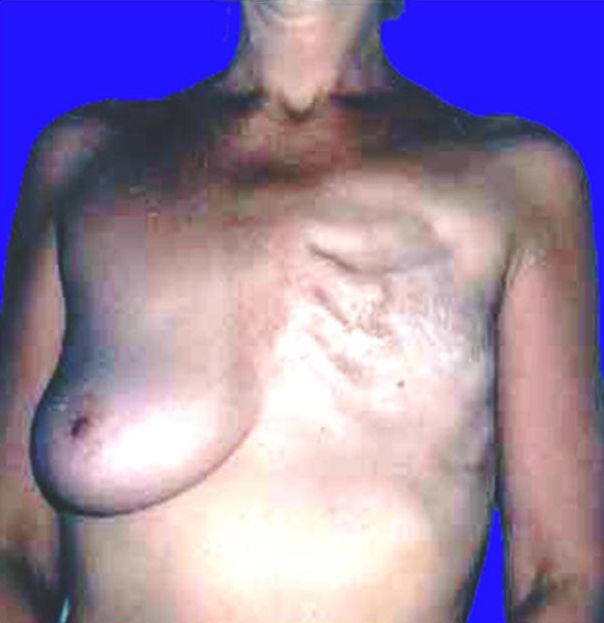
Хирургические подходы — радикальные мастэктомии — удаление груди, мышц грудной клетки и подмышечных лимфатических узлов — иногда выполнялись еще в XIX веке. В конце 1940-х годов появилась модифицированная радикальная мастэктомия. В 1970-ых, более ограниченный хирургический выбор вошел в использование, сосредотачиваясь на удалении опухоли и небольшого количества окружающей ткани — обычно упоминаемой как «люмпэктомия.» В 1985 году люмпэктомия в сочетании с лучевой терапией оказалась столь же эффективной, как мастэктомия с точки зрения показателей выживаемости, но привела к более высоким локальным показателям рецидивов рака молочных желез.
Радиация. В начале XX века врачи впервые использовали радиацию для уменьшения раковых опухолей.
Химиотерапия — введенная в 1940-х годах, может уменьшить размер опухоли до операции, предотвратить повторение впоследствии и лечить рак, который имеет метастазы, то есть может распространяться за пределы своего первоначального местоположения. Хотя она по-прежнему вызывает побочные эффекты, включая тошноту, истощение и токсичность костного мозга, сегодня химиотерапия гораздо менее суровая, чем в прошлые годы.
Следующие фармацевтические подходы были использованы:
Селективные модификаторы эстрогеновых рецепторов (SERMs) — SERM, такие как Nolvadex (тамоксифен), борются с раковыми заболеваниями, которым необходим эстроген, чтобы расти, ограничивая способность эстрогена проникать в раковую клетку. Было обнаружено, что у женщин высокого риска тамоксифен снижает рецидив и развитие инвазивного рака молочной железы на 50%, если принимать его в течение 5 лет. Тамоксифен представляет собой риск нефатального рака матки; Риск, однако, очень мал. Evista (ралоксифен), похожее лекарство, хотя менее эффективное средство, но в связи с ним не было обнаружено, что оно имеет связанный риск развития рака матки. Ралоксифен не считается заменой Тамоксифена и предназначен только для тех, у кого положительный рак молочной железы с эстрогеном.
Ингибиторы ароматазы. Для женщин в постклимактерическом периоде ингибиторы ароматазы — класс препаратов, который включает Arimidex (анастрозол), Aromasin (экземестан) и Femara (летрозол) — работают путем снижения эстрогена, доступного для раковых клеток, и, как было обнаружено, он более эффективен, чем тамоксифен у женщин постменопаузального возраста и у которых имеется положительный эстроген-рак молочной железы.
Целевая гормональная терапия — Герцептин (трастузумаб) является целевой терапией, которая специфически связывается с конкретной формой рака груди. Он разрушает раковые клетки и затрагивает очень мало здоровых тканей. Герцептин в сочетании с химиотерапией сокращает рецидив HER2 / neu-положительного рака молочной железы на 50%.
Сегодня мы знаем, что здоровое питание, регулярные физические нагрузки, снижение веса и отказ от алкоголя могут помочь женщинам снизить риск рака груди.
Для некоторых женщин выбор образа жизни может быть недостаточным. В конце 1990-х годов наука подтвердила, что определенные варианты (мутации) генов BRCA1 и BRCA2 вызывают до 80% -нового увеличения риска рака груди. Некоторые женщины, которые обнаруживают, что подвергаются высокому риску, принимают решительный шаг, удаляя их груди, а иногда и их яичники, чтобы избежать болезни.
Эксперты согласны с тем, что генетика является следующей границей. Будущие стратегии могут включать генетическое тестирование, чтобы индивидуализировать лечение пациентов и даже методы восстановления или замены вредных генов до того, как произойдет рак молочной железы. Тем не менее, стремительно расширяющиеся медицинские знания могут также вызвать у женщин чувство переполнения, когда они борются с практическими решениями относительно лечения.
Важно помнить, что вы не одиноки. Сегодня выжившие люди, страдающие раком молочной железы, являются мощной силой в нашем обществе благодаря их растущему количеству и наглядности благодаря таким событиям, как Национальная годовая гонка для лечения Сьюзан Г. Комен. Кроме того, группы поддержки рака молочной железы, онлайн-сообщества и другие разработки предлагают якорь женщинам с диагнозом этой болезни.
источник
По распространенности рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний. Он поражает ежегодно 1 млн. 600 тыс. женщин в мире и свыше 66 тыс. в Российской Федерации.
В ближайшие 20 лет во всех странах прогнозируется почти двукратное увеличение заболеваемости женщин раком груди, что объясняется увеличением продолжительности жизни и улучшением методов диагностики.
За последние годы, благодаря более раннему выявлению опухолей, смертность от рака груди у женщин снижается. В развитых странах, где применяется маммографический скрининг населения, этот показатель снизился на 30–50%.
Рак молочной железы – это не единообразное заболевание. При лечении клиницисты учитывают принадлежность опухоли к конкретному подтипу. Генетическое тестирование и иммуногистохимический метод, позволяют надежно определить биологические подтипы РМЖ. Эти подтипы сами по себе включают многие факторы риска и предсказывающие признаки, что позволяет выбрать наиболее эффективную терапию для больного.
Доказанное с помощью молекулярно-генетического анализа и иммуногистохимического исследования патогенетическое разнообразие РМЖ позволяет индивидуализировать лечение.
Увеличение выживаемости при раке молочной железы связано не только с широкомасштабным внедрением маммографического скрининга, но и адекватным использованием системных видов лечения.
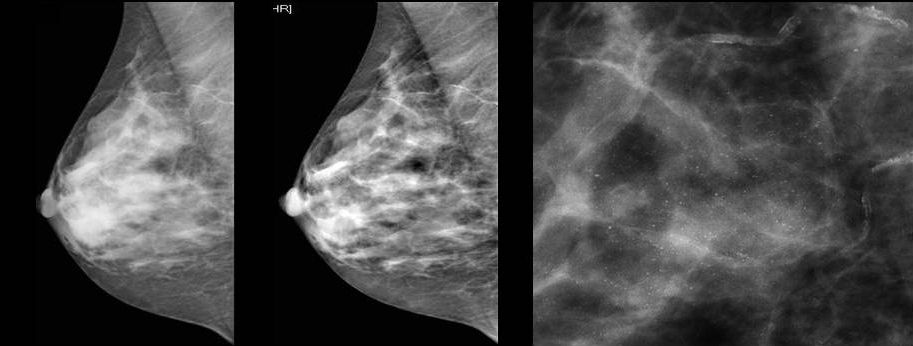
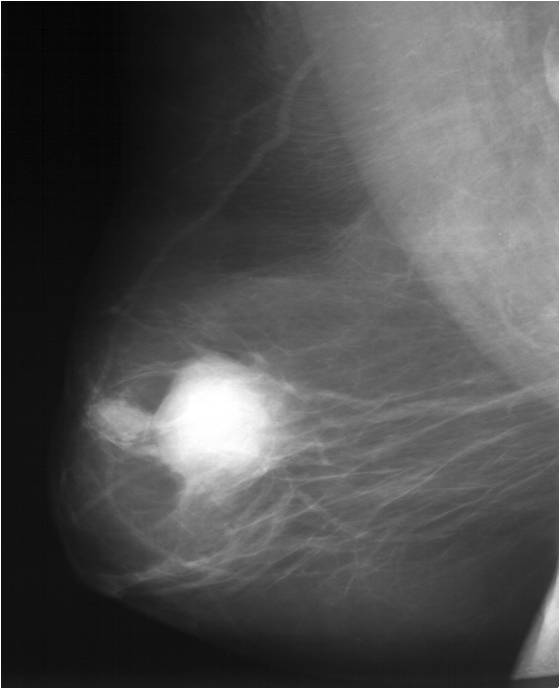
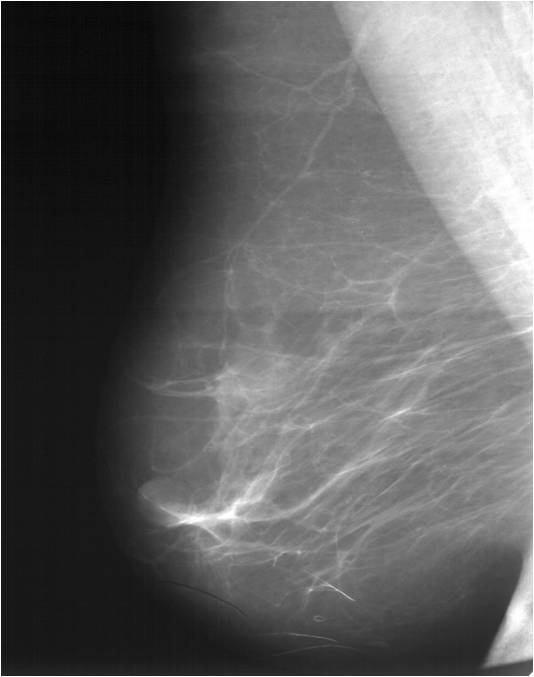
Для выявления злокачественных опухолей молочной железы существует определенный алгоритм диагностики, и его первичный элемент — маммографический скрининг. Чувствительность этого метода диагностики для опухолей от 2 мм до 5 мм составляет около 85%. Маммографическое исследование выполняют в двух проекциях.
Молодым женщинам с плотным строением молочной железы необходимо включение в программу наблюдения методов УЗИ и МРТ.
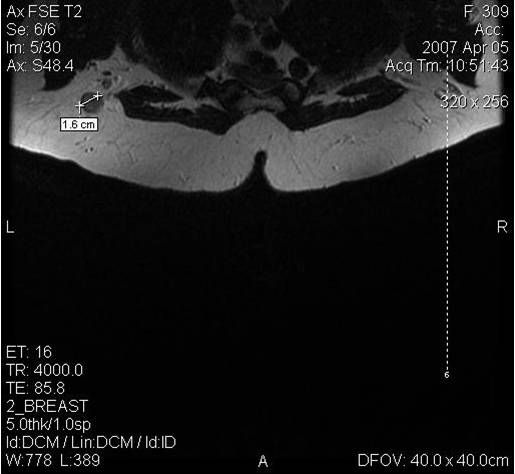
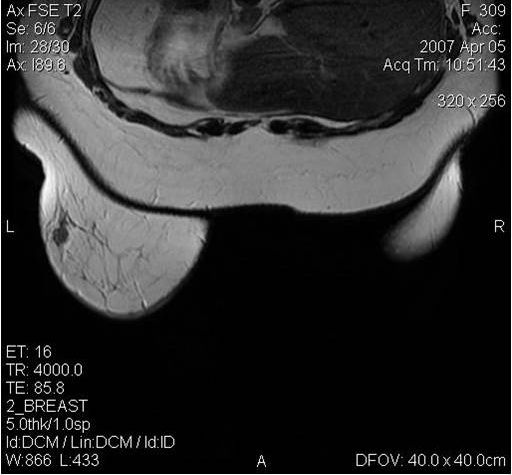
Поскольку традиционный маммографический скрининг у женщин до 40 лет малоэффективен, для скрининга может понадобиться альтернативная методика — МРТ. Современная контрастная магнитно-резонансная томография — высокочувствительный метод диагностики заболеваний молочной железы.
МРТ-диагностика рака молочной железы
У женщин с мутациями BRCA1 или BRCA2 при проведении МРТ возможно диагностировать рак молочной железы на самых ранних стадиях.
При ряде показаний женщинам назначается биопсия молочной железы под контролем УЗИ. Это исследование позволяет прицельно брать биологический материал для гистологического исследования, определения уровня экспрессии стероидных гормонов и статуса Her-2.
Известно множество факторов, повышающих риск возникновения рака молочной железы. На некоторые из них повлиять невозможно:
- семейная история по РМЖ,
- раннее менархе (начало месячных),
- позднее наступление менопаузы.
В то же время существуют и модифицируемые факторы, такие как:
- избыточный вес в постменопаузе,
- использование заместительной гормонотерапии,
- потребление алкоголя,
- курение
Стратегические шаги, направленные на снижение риска возникновения РМЖ включают контроль веса и борьбу с ожирением, регулярную физическую активность, уменьшение потребления алкоголя.
Большинство факторов риска рака молочной железы связано с действием гормонов на ткань молочной железы (раннее менархе, позднее наступление менопаузы, ожирение, применение гормональных препаратов). Считается, что именно женские половые гормоны, стимулируют процессы клеточного роста и повышают риски повреждения ДНК, что может привести к развитию злокачественного новообразования.
Только 5–10% случаев рака молочной железы обусловлены унаследованными мутантными генами BRCA. Но при этом, среди носителей мутаций риск возникновения заболевания может достигать 80%.
Чем младше возраст выявления первичного заболевания рака груди, тем выше вероятность заболеть контралатеральным раком, т.е. противоположной молочной железы.
Семейная история с наличием заболеваний раком молочной железы у кровных родственников, даже без ассоциации с мутациями BRCA, также повышает риск возникновения РМЖ.
Ожирение
Различными исследованиями доказано существование связи между заболеваемостью первичным РМЖ в постменопаузе и ожирением. Есть подтверждение связи между избыточным весом и низкой выживаемостью при всевозможных видах РМЖ.
Алкоголь
Алкоголь — также установленный фактор риска возникновения первичного РМЖ. Достоверность его отрицательного воздействия на пациентов, перенесших рак молочной железы, убедительна, так как он влияет на увеличение количества циркулирующих эстрогенов.
Только врач может оценить значимость различных симптомов. Однако каждой женщине необходимо знать, при каких симптомах надо обращаться к маммологу:
- «Образование», уплотнения, узел, инфильтрат, опухоль, «шарик» — что-то подобные этому вы обнаружили. Это еще не повод решить, что у вас РМЖ, но повод показаться специалисту.
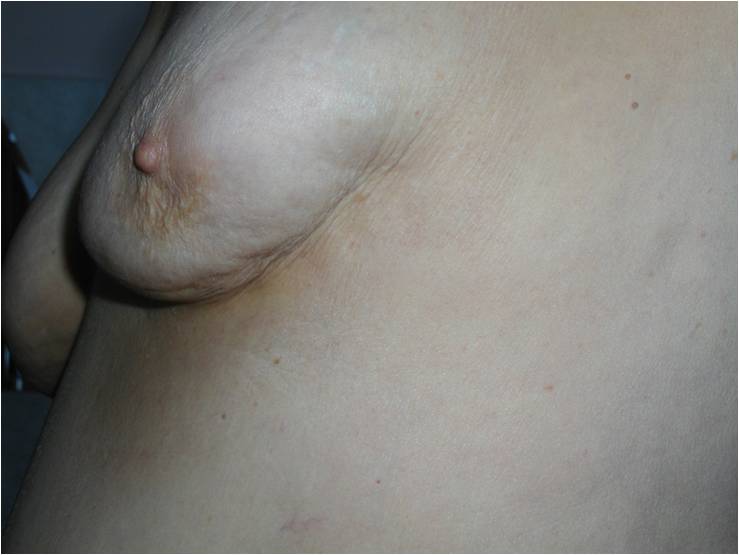
- Деформация контура молочной железы, ареолы или соска (втяжение кожи или наоборот выбухание)
- Втяжение соска; особенно, если появилось недавно
- Выделение крови из соска
- Отек кожи всей молочной железы или ее локального участка
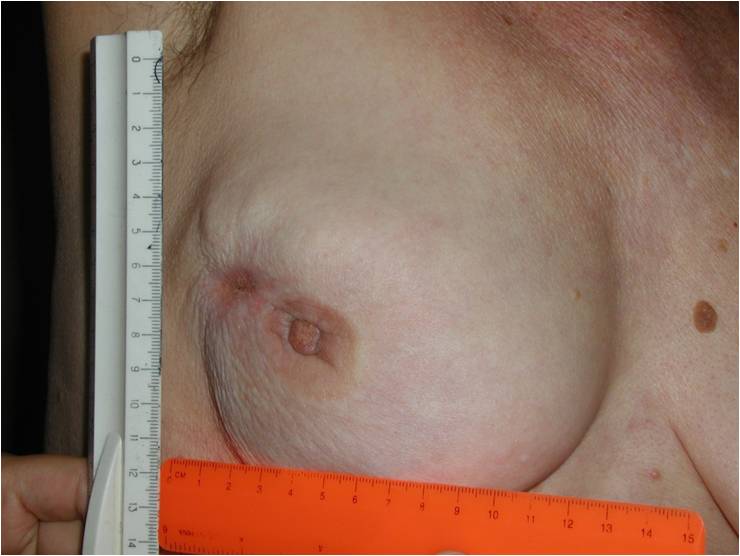
- Появление раздражения, мокнутые «ранки», язвочки, корочки на соске или ареоле
- Изъязвления (длительные, без видимой причины) на коже груди
- Дискомфорт в подмышечной области и обнаружение лимфоузлов ( «шариков» ) в подмышечной области
- Изменение цвета кожи молочной железы — покраснение, повышение температуры кожи в этой области.
Все эти симптомы могут быть проявлениями различных заболеваний (их насчитывается несколько десятков), возможно, не злокачественной природы. Однако, это может решить только специалист по заболеваниям молочной железы.
Признаки и симптомы рака молочной железы
0 стадия
Это стадия, когда не выявлена первичная опухоль, или она не может быть оценена, а также в случае неинвазивного рака молочной железы (что означает опухоль не выходит за границы своего появления, так называемый рак in situ).
1 стадия
Раковые клетки в этой стадии инвазируют или прорастают в соседние ткани. Опухолевый узел не более 2 см, лимфоузлы при этой стадии не поражены.
2 стадия
В этой стадии опухолевый узел превышает 2см и может достигать до 5см. При этой стадии могут быть поражены лимфоузлы, но поражение лимфоузлов носит одиночный характер, они не спаяны друг с другом и находятся на той же стороне, что и опухоль. В случае поражения лимфоузлов размер опухоли может быть и менее 2см.
3 стадия
Инвазивный рак, более 5 см или с явным и значительным поражением лимфатических узлов. При этом лимфоузлы могут быть спаяны между собой.
4 стадия
На этой стадии опухоль прорастает в кожу груди, грудную стенку либо во внутренние грудные лимфатические узлы. Она может быть любых размеров.
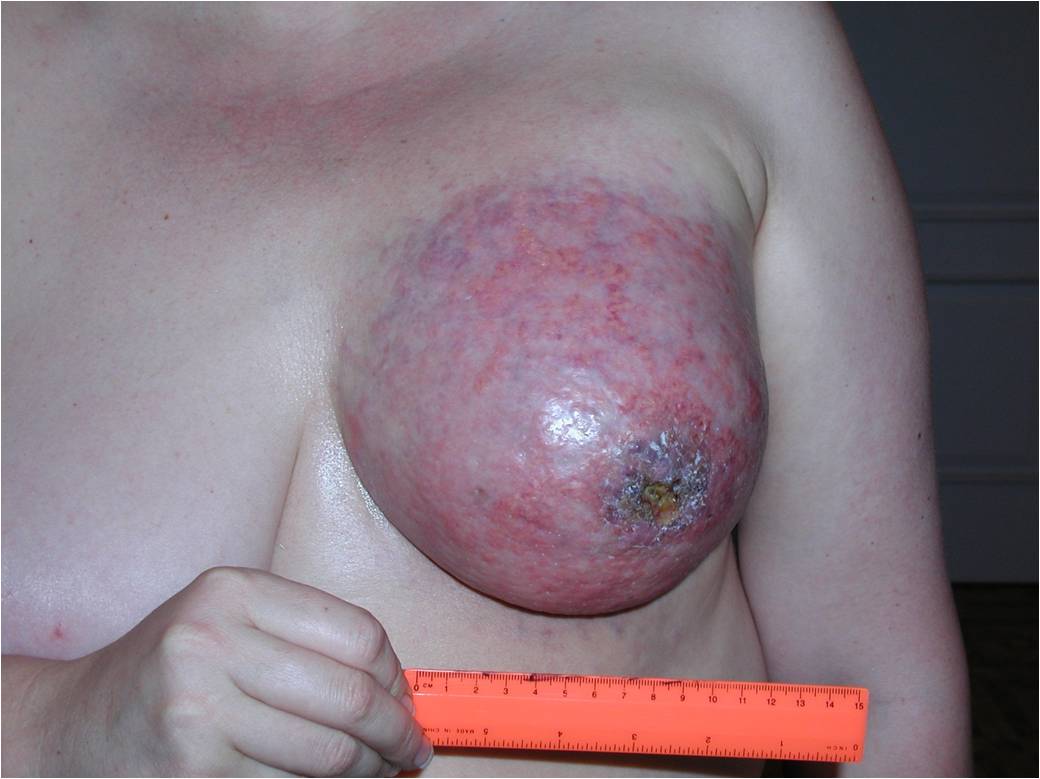
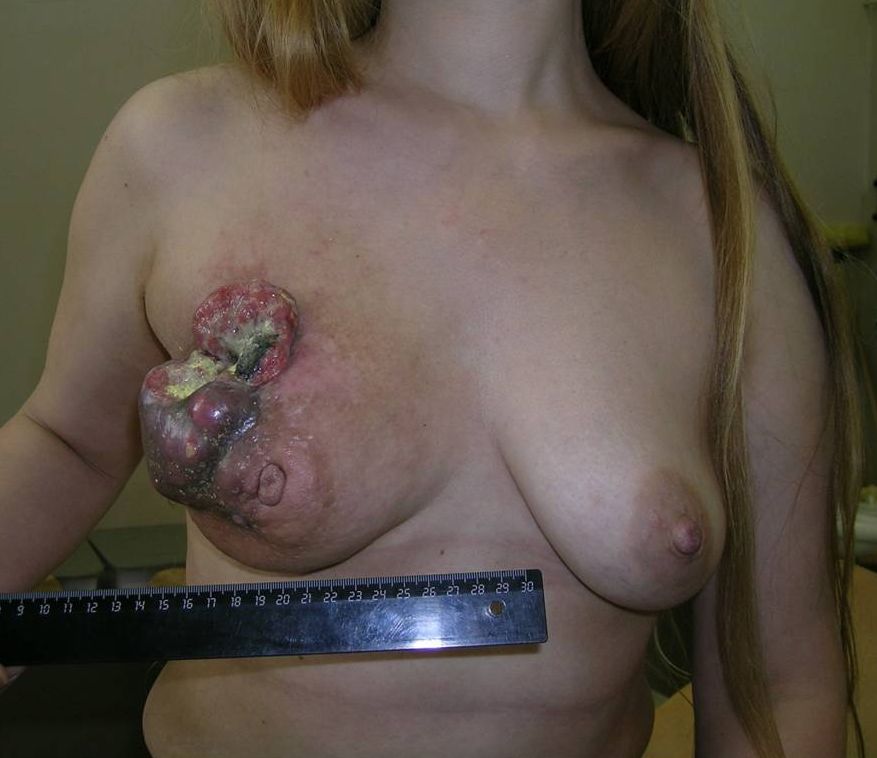
К 4 стадии рака молочной железы относится воспалительный рак, он встречается до 10 % всех случаев. Симптомы воспалительной формы рака груди это покраснение кожных покровов, железа становится теплой, отмечается увеличение и/или уплотнение части либо всей молочной железы. Кожа приобретает вид апельсиновой корки. Эту форму рака надо дифференцировать с воспалением молочной железы – маститом.
Также при 4 стадии опухоль может распространяться за пределы грудной клетки, в подмышечную область, внутренние грудные лимфатические узлы. Возможны метастазы в надключичные лимфатические узлы, а также в легкие, печень, кости или головной мозг.
Как выглядит рак груди в разных стадиях:
Хирургическая операция — основной метод лечения при опухолях груди, и от качества его проведения во многом зависит исход заболевания. По данным некоторых штатов Индии, в которых по религиозным мотивам не проводится хирургическое лечение, показатели заболеваемости практически равняются показателям смертности. Обычно смертность от РМЖ в два — четыре раза уступает заболеваемости.
Однако, после хирургического лечения чаще всего следует лучевое. Местное лечение без послеоперационной лучевой терапии часто приводит к локально-регионарным рецидивам заболевания. Дело в том, что после завершения хирургической операции невозможно исключить существования скрытых отдаленных метастазов. Даже у больных с опухолями менее 1 см в диаметре в 10% случаев возможен рецидив заболевания.
Локализация отдаленных метастазов при РМЖ
Сейчас во всем мире наблюдается тенденция к сокращению объема хирургического вмешательства без потери эффективности. Хирургическое и лучевое лечение РМЖ развивается и совершенствуется в направлении органосохранения.
Благодаря внедрению маммографического скрининга, резко возросло число больных с ранней стадией заболевания, когда лимфоузлы не поражены метастазами. В этом случае «классическое» удаление всех уровней лимфоузлов было бы избыточной калечащей процедурой. На помощь хирургам пришел метод биопсии сигнальных (сторожевых) лимфатических узлов.
Поскольку, метастазы в подмышечных лимфоузлах появляются последовательно от первого ко второму, затем к третьему уровню, то достаточно определить наличие метастазов именно в первом лимфоузле. Его назвали «сигнальным»: если сигнальный лимфатический узел не содержит метастазов, то другие лимфоузлы также не метастатические.
Благодаря этому органосохраняющему методу, тысячи пациенток избежали избыточной полной хирургической диссекции, удаление раковой опухоли не привело к удалению груди.
Последние результаты клинических испытаний, в том числе и при участии НИИ онкологии им. Н.Н. Петрова, подтвердили безопасность отказа от полной подмышечной диссекции. Биопсия сигнальных (сторожевых) лимфатических узлов постепенно вытесняет подмышечную диссекцию как стандартную процедуру стадирования РМЖ.
Концепция биопсии сигнальных лимфатических узлов приобретает все большее признание и введена для многих локализаций опухолей в стандарты хирургического лечения Европейской Организацией по Изучению и Лечению Рака (EORTC).
Химиотерапия, наряду с хирургическим вмешательством, является одним из основных методов терапии рака. Послеоперационная химиотерапия улучшает результаты хирургического лечения, как и прогноз заболевания.
Ранее решение о назначении химиотерапии основывалось на двух факторах:
- стадия заболевания
- состояние регионарных лимфоузлов.
Благодаря многочисленным исследованиям ученых изменяются представления о биологии рака молочной железы, и выбор режимов химиотерапии значительно расширяется. И сегодня химиотерапевтическое лечение назначают даже при отсутствии метастазов в лимфоузлах, если небольшие по размеру опухоли обладают агрессивными биологическими характеристиками.
Люминальный А рак
При люминальном А раке избегают назначать проведение химиотерапии, особенно при негативных лимфоузлах, и применяют одну эндокринотерапию.
Люминальный В рак
Люминальные В опухоли характеризуются высокой агрессивностью. В этом случае чаще всего будет назначена химиотерапия, а выбор лечения основывается на оценке риска развития рецидива.
HER2-позитивный рак молочной железы
Лечение HER2-позитивного рака молочной железы основано на применении стандартных схем химиотерапии – трастузумаб и ХТ, основанная на антрациклинах и таксанах. Однако, только небольшой процент пациентов выигрывает от лечения, но все подвержены связанной с этим токсичностью.
Трижды негативный РМЖ
Трижды негативный рак молочной железы обычно ассоциируется с плохим прогнозом. Из-за редкой встречаемости особых типов РМЖ нет достаточных данных о роли адъювантной химиотерапии.
Химиотерапия при РМЖ у очень молодых женщин
Рак молочной железы в молодом возрасте обычно протекает агрессивно, часто встречаются гормонорезистеные и HER2-позитивные опухоли с иными свойствами, чем у более пожилых женщин. Для таких пациенток, моложе 35 лет, адъювантная полихимиотерапия почти всегда является необходимым методом лечения.
Химиотерапия пожилых пациенток
У пожилых пациенток (старше 65 лет) при решении вопроса о назначении адъювантной химиотерапии обязательно учитываются общее состояние организма и наличие сопутствующих хронических заболеваний.
В идеале пожилые пациенты должны подвергаться гериатрической оценке для определения их «пригодности» к адъювантому лечению. Потенциальный эффект лечения должен быть сбалансирован с теми рисками для организма, которые несет химиотерапия. Врач определяет наиболее эффективный и при этом наиболее безопасный специфический режим, основываясь на подтипе опухоли и индивидуальных характеристиках пациента.
Гормонотерапия
Молодые женщины с гормоноположительным раком молочной железы сохраняют риск рецидива заболевания на протяжении по крайней мере 15 лет после первичного заболевания. Онкологи должны определить, кто из пациентов нуждается в долгосрочной адъювантной терапии тамоксифеном или ингибиторами ароматазы.
Неоадъюватная (предоперационная) терапия
Неоадъюватная терапия занимает ведущую роль в лечении женщин с неоперабельным раком молочной железы, а также имеет важное значение при операбельных опухолях, когда выполняются органосохраняющие операции.
Эффект неоадъювантного лечения ДО (слева) и ПОСЛЕ (справа)
Лучевое лечение после проведенного хирургического вмешательства играет важную роль в терапии рака молочной железы и прогнозе заболевания. В НМИЦ онкологии им. Н.Н. Петрова было проведено исследование роли лучевой терапии после органосохраняющих операций (секторальная резекция с аксиллярной лимфоаденэктомией) у пациенток с минимальным РМЖ.
Анализ десятилетней безрецидивной выживаемости доказал более высокую эффективность лечения в группе больных, где применялась послеоперационная лучевая терапия.
Использование лекарственных препаратов для снижения риска заболевания называется химиопрофилактикой. На сегодняшний день одобренными препаратами для профилактики рака молочной железы являются тамоксифен и ралоксифен.
Тамоксифен может использоваться как пременопаузальными, так и постменопаузальными женщинами. Прием тамоксифена приводит к снижению риска РМЖ на 38% на более чем 10 летний период. Наиболее распространенными нежелательными явлениями на фоне приема препарата являются приливы.
В настоящее время клинические исследования изучают роль другого класса препаратов – ингибиторов ароматазы для оценки эффектов снижения риска РМЖ, которые сегодня используются только для лечения РМЖ. Предварительные результаты оказываются многообещающими. Ингибиторы ароматазы действуют только у женщин с нефункционирующими яичниками.
Профилактические хирургические операции по удалению молочных желез проводятся только в одном случае – если женщина является носителем мутаций в генах BRCA1 и BRCA2, известных как «синдром Анджелины Джоли». Мировой практикой доказано, что при удалении ткани обеих молочных желез риски РМЖ снижаются более чем на 90%. Такие операции выполняются в клиниках США и Израиля. В Европе подход к этому вопросу более консервативный.
В НМИЦ онкологии им. Н.Н. Петрова при проведении хирургического лечения женщинам с мутациями BRCA1 предлагается профилактическое удаление и реконструкция молочной железы.
Историческая справка. Четкие описание клинической картины рака молочной железы дали греческие врачи Гален и Леонидес из Александрии. Леонидес впервые описал симптом втяжения соска и предостерегал от операции при запущенных формах. Такие же предостережения делал римский ученый Цельз. Помимо оперативных методов египтяне, арабы, греки, и римляне применяли выжигание пораженного органа раскаленным железом или горячим маслом. В XVIII веке Генри де Дран считал, что только в начальной стадии рак яваляется местным процессом, в последующем поражаются регионарные лимфатические узлы. В связи с этим он считал, что ранная операция может дать хорошие результаты, при регионарном метастазировании необходимо удалять лимфатические. В 1875 г. Фолькман предлагает удалять всю молочную железу вместе с кожей , грудной фасцией и частью большой грудной мышцы. В 1894 г. американский хирург Холстед опубликовал результаты 50 операций оп методике, которая вошла в прочный арсенал современного оперативного лечения. В том же 1894 г. американец Мейер предложил аналогичную операцию, по которой в отличие от Холстеда удалял и малую грудную мышцу, которую Холстед стал удалять в 1898 году. Данный вид лечения у нас стали пропогандировать в своих работах Б.А.Резвяков (1908), Н. Бушмакин (1910) и В.Л.Боголюбов (1912). В 1951 г. Урбан предложил сверхрадикальную мастэктомию, т.е. с дополнительным удалением парастернальных лимфатических узлов. Современное применение лучевой и химио- и гормонотерапии дало новое направление в лечении рака молочной железы в запущенных стадиях, т.е. комбинированные и комплексные методы лечения.
Статистика, эпидемиологшия. Рак молочной железы занимает одно из первых мест в общей структуре заболеваемости злокачественными опухолями среди женщин. Так в США 5% всех женщин заболевают раком молочной железы и не менее 2% погибают от этого заболевания. В Англии и Уэльсе — 3 из ТОО женщин, достигшие 40 летнего возраста находятся под угрозой смерти от рака молочной железы.
Существуют большие различия в частаоте рака молочной железы в разных странах. По сравнению со странами с высокой смертностью от этого заболевания /Англия, Уэльс, Дания, США) цифры смертности в Японии 6 раз ниже. Это по-видимому связано с обычными в Японии ранними браками, высокой деторождаемостью, длительной лактацией.
За 1998 год в РФ от рака молочной железы погибло 21,2 тыс. женщин, что составила 16% всех смертей от злокачественных опухолей у женщин 26,9 (на I00000 жителей) и занимает 1 место среди причин смертности от злокачественных новообразований.
В РС(Я) за последние 10 — 15 лет РМЖ в структуре заболеваемости злокачественными новообразованиями в целом у женщин прочно занимал I место (в 1998 г. — 25,4 на 100000).
При изучении эпидемиологии РМЖ следует обратить внимание на такие моменты, как половая жизнь, деторождаемость, искусственное прерывание беременности или предохранение от неё, заболевание половых органов, вскармливание детей грудью и др. Так, сред лиц, заболевших РМЖ. больше незамужних, начавших половую жизнь позже, чаще прибегающих в абортам, имеющих меньшее число беременностей, родов, лактации; заболевание часто поражает живущих в городе, нежели жителей сельской местности и поражает преимущественно лиц в возрасте 40-50 лет. Предрасполагающим факторам относятся повышение эстрогенной активности яичников. Но при этом необходимо учесть, что первоначально может страдать не только функция яичников, но и надпочечников, гипофиза или гипоталамуса. В плане вирусного происхождения этот вопрос решен в эксперименте у линейных мышей — «фактор молока», где обнаружен вирус Биттнера. У человека это доказать не удалось. Значение наследственности также еще окончательно не выяснено, хотя имеются наблюдения о семейной предрасположенности к данному заболеванию.
Предопухолевые заболевания молочной железы. Они могут иметь различный характер, но объединяются под общим названием мастопатии или фиброаденоматоза, но их еще называют масталгия, мастоплазия, мастодиния, болезнь Реклю, болезнь Минца, болезнь Шиммельбуша и др. В эксперименте было доказано, что независимо от прочих моментов развитию опухоли предшествует последовательная цепь изменений в железистых дольках. Вначале образуется гиперплазия железистых долек, отек и разрастание внутридольковой соединительной ткани. Затем развиваются мелкие кисты, наступает расширение одних протоков, сдавление других разрастающейся соединительной тканью. Эпителий кист начинает пролиферировать, появляется атипия пролиферирующего эпителия, прорвы основной мембраны, врастание эпителия в строму, увеличение числа митозов, т.е. наступает раковая трансформация клеток.
Диффузная форма мастопатии. Является более ранней формой заболевания. Первоначально появляются боли м/ж за несколько дней до менструации. В последующем боли принимают выраженный характер с иррадиацей в лопатку, руку. Объективно отмечается незначительное диффузное уплотнение молочной железы. После начала менструации эти явления исчезают. Чаще эта форма мастопатии встречается у молодых женщин. При прогрессировании заболевания боли уменьшаются, но зато более четко при пальпации определяются участки уплотнения, не имеющего четких границ, в виде тяжей, мелкой зернистости, огрубения железистых долек. При надавливании из соска могут появиться различные выделения. Болезненные уплотнения и выделения из сосков усиливаются в предменструальном периоде и уменьшаются с началом менструаций.
Узловая форма мастопатии. Эта форма встречается в возрасте старше 30 лет и часто является исходом диффузной формы мастопатии. Узловые уплотнения могут быть одиночными или множественными в одной или обеих молочных железах. Узловые уплотнения более четко определяются при исследовании в вертикальном положении. Кромечетких уплотнений могут сохраняться признаки диффузной мастопатии. В зависимости от преобладания изменений в соединительной ткани и эпителия гистологически различают следующие формы мастопатии:фиброзную, фиброзно-кистозную и железистую.
Внутрипротоковая папиллома или кровоточащая молочная железа. Разновидность узловой формы мастопатии, когда процесс локализуется в крупных молочных протоках. Пальпаторно это образование в ряде случаев определить довольно сложно. Основной симптом — при надавливании этого участка из соска выделяется кровянистоеили бурое содержимое. Для уточнения диагноза можно использовать констрастную маммаграфию.
Фиброаденомы молочной железы. Встречаются в более молодом возрасте, иногда у молодых девушек. Они могут быть одиночные или множественные в одной или обеих молочных железах, часто сочетаются с мастопатией. При пальпации фиброаденома определяется как четко ограниченное плотное округлое образование с гладко и поверхностью, свободно перемещающееся в ткани молочной железы. Реже она имеет крупнобугристую поверхность, фиброаденома плотнее мастопатичного узла. Размеры: от микроскопически до нескольких сантиметров в диаметре, захватывающих почти полностью молочную железу. Фиброаденома малигнизирует реже чем мастопатии − 1-1,5 %.
Лечение. Необходимо выявить фон, на котором развилась мастопатия: гинекологические заболевания, функциональные расстройства нервной системы и т.д. В ряде случаев лечение основных расстройств приводит к ликвидации мастопатии. При начальных стадиях мастопатии допустимо применениелегких физиотерапевтических процедур: ионофорез с йодистым калием или новокаином, ретромаммарная новокаиновая блокада, легкие тепловые процедуры.
Во всех случаях мастопатии больным необходимо нормализовать половую жизнь, иметь беременность и роды с правильным вскармливанием ребенка грудью не менее одного года. Лечение витаминами рассчитано на улучшение функции печени с целью инактивации избытка эстрогенов. Применяются витамины А, В и Е, в течение 1-2 мес. иногда повторно.Лечение микродозами йодистого калия направлено на нормализацию лютеиновой функции яичников. Применяется 0,25 % раствор йодистого калия по 1-2 ч/л I раз в день.Препарат применяется в межменструальный период не менее I г.
Лечение андрогенами применяется при безуспешности предыдущих методов и направлено на снижение эстрогенной активности яичников. Применяется 5 % раствор тестостеронпропионата или неодрол по 0,5 мг (25 мг) в течение нескольких межменструальных периодов. Можно применять метилтестостерон или метиландростендиол в таблетках (под язык) по 25 мг ежедневно (2 таблетки 2-3 раза в день метилтестостерона или 0,5 табл. 2 раза в день метиландростендиола) У некоторых больных развивается вирилизация.
При узелковой мастопатии и фиброаденомах производят секторальную резекцию молочной железы с экспресс биопсией.
Патологическая анатомия. Макроскопически узловая форма имеет в определенной степени четкие границы. На разрезе поверхность опухоли западает с сохранением острого края «симптом сыра» и мелкие желтоватые вкрапления, очаги некрозов в отличие от мастопатии и фиброаденомы, при которых поверхность разреза резко выбухает. При диффузной форме опухоль не имеет четких границ, на разрезе серовато-розового цвета с желтоватыми вкраплениями, с очагами кровоизлияний и некрозов.
Гистологическая структура рака молочной железы зависит от преобладания элементов стромы — скиррозный ракили клеточных элементов — мозговидный рак; от структуры разрастающихся раковых клеток: солидные, железистые, фиброзные, крупно- и мелкоальвеолярные, тубулярные, папиллярные, внутрипротоковые и пр.; от степени анаплазии или метаплазии железистого эпителия: малодифференцированный — мелко- и крупноклеточный рак; дифференцированный рак из метаплазированного эпителия — плоскоклеточные формы, рак Педжета, коллоидный или слизистый рак.
Meтасгазирование. Характерно раннее метастазирование.
Регионарное метастазирование происходит в подмышечные, подлопаточные, подключичные, надключичные и парастернальные лимфатические узлы. В зависимости от локализации опухоли происходит преимущественное метастазирование с соответствующую группу лимфатических узлов (парастернальных, подмышечных и т.д.).
Отдаленное метастазирование происходит гематогенным путем. Из костей наиболее часто поражаются тела позвонков, тазовые кости, проксимальные эпифезы бедренных костей, ребра, черепа, грудина. Метастазирование также происходит в легкие, плевру, яичники, печень, кожу и т.д. В 60-80% метастазы появляются впервые 2-3 года после начала лечения.
Классификация.
По Международной классификации при определении стадии заболевания учитывается степень распространения процесса в молочной железе, регионарных лимфатических узлах и наличие отдаленных метастазов.
Т1 — опухоль не более 2 см, отсутствуют поражения кожи, соска (исключая болезнь Педжета) и фиксации к грудной стенке.
Т2 — опухоль размером 2-5см, наличие ограниченного втяжения или морщинистости кожи, ретракция соска или субареолярное расположение опухоли, болезнь Педжета, распространяющаяся за пределы соска.
Т3 — опухоль размером 5-10 см или поражение кожи в той или иной форме — сращение с опухолью, изъязвление, инфильтрация, симптом лимонной корки или фиксация к грудной мышце.
Т4— опухоль более 10 см или поражение кожи в той или иной форме, превосходящее размеры опухоли, но в пределах молочной железы, или фиксация молочной железы к грудной стенке.
N — подмышечные лимфоузлы не прощупываются. N1 — прощупываются плотные смещаемые подмышечные узлы. N2 — подмышечные лимфатические узлы больших размеров, спаянные, ограниченно подвижны.
N3 — односторонние надключичные или подключичные лимфатические узлы или отек руки.
M — отдаленные метастазы отсутствуют. M1 — отдаленные метастазы; поражение кожи за пределами молочной железы, метастазы лимфатических узлах противоположной стороны, метастазы в другой (Т1NM), метастазы костях, легких, плевре, печени и других органах, выявляемые клинически или при рентгенологическом исследовании.
В нашей стране наряду с классификацией ТNМ пользуются отечественной клинической классификацией по стадиям.
Стадия I. Опухоль небольших размеров (менее 3 см в наибольшем диаметре), располагающаяся в толще молочной железы, без перехода на окружающую клетчатку и покровы и без гистологически установленного поражения регионарной лимфатической системы (Т1NM).
Стадия II. а) Опухоль, не превышающая 5 см в наибольшем диаметре, переходящая с ткани молочной железы на клетчатку, наличие симптома спаивания с кожей (симптом морщинистости), но без поражения лимфатических систем (Т1NM).
б) опухоль того же размера и вида или меньших размеров, но с поражением одиночных подмышечных лимфатических узлов первого этапа (Т1-2N1-2M).
Стадия III. а) опухоль, превышающая 5 см в диаметре, с прорастанием или изъязвлением кожного покрова или проникающая в подлежащие фасциально-мышечные слои, но без регионарных метастазов (Т3NM).
б) опухоли любого размера с множественными подмышечными, подключичными и подлопаточными метастазами (Т3N1-2M). в) опухоль любого размера с матастазами в надключичные лимфатические узлы или с выявленными парастернальными метастазами (Т1-3N3M).
Стадия 1У. Распространенное поражение молочной железы с диссеминацией в коже или обширным изъявлением. Опухоли любого размера, плотно фиксированные к грудной стенке, с метастазами в регионарные лимфатические узлы или безних. Опухоли молочной железы с отдаленными метастазами (Т4NM, Т1-3N0-3M0-1)
Клиническая картина рака м/ж зависит от формы рака и степени распространенности,
В зависимости от формы различают: 1) узловой рак, характеризующийся плотным опухолевидным образованием в молочной железе. Правая и левая молочная железы поражаются почти одинаково. Опухоль чаще располагается в верхненаружном квадранте (50%) и реже в нижневнутреннем. Одновременное развитие рака в обеих железах наблюдается редко. Скорость роста опухоли зависит от степени ее биологической активности. Быстрый рост наблюдается у молодых женщин, особенно в период беременности, после родов и абортов (активная деятельность эндокринных органов);
2)диффузный рак, характеризуется быстрым распространением опухали в регионарные лимфатические узлы, и также в отдаленные органы. Различают следующие разновидности диффузного рака:
а) отечно-инфильтративная форма рака не имеет четких границ и инфильтрирует ткани м/ж на большом ее протяжении, за пределами опухоли отмечается лимфостаз (симптом «лимонной корки»1;
б) маститоподобная форма — молочная железа увеличена в размерах, фиксирована к грудной стенке, кожа слегка гиперемирована, отмечается небольшое повышение кожной температуры, в отдельных участках развиваются очаги некроза, присоединяется вторичная инфекция;
в) рожистоподобный или эрезепилоидный рак — распространение опухоли помимо основного очага идет по лимфатическим путям внутрикожно по самой молочной железе и на грудной стенке в виде розоватых очагов (раковый лимфангиот).
г) панцирная форма — происходит раковая инфильтрация не только ткани м/ж, но и подкожной клетчатки и кожи, молочная железа сдавливается, уменьшается в размерах, фиксируется к грудной стенке, на поверхности кожи появляются экскориации, мелкие изъявления, покрытые корками.
В прогностическом отношении диффузные формы рака мало благоприятны.
3. Редкие формы: а) болезнь Педжета — опухоль появляется внутри соска, первые признаки — утолщение соска, поверхностные экскориации, плотно сияющие корочки, в последующим процесс распространяется на ареолу и в глубь молочной железы б) рак выводных протоков (цистокарцинома) развивается первичноиз мелких протоков или вторично из цистаденомы; камедокарцинома (угреподобная карицинома) берет начало в мелких и средних протоках, образуя большие очаги клеточных скоплений с очагами некроза в центре. Внутрипротоковый рак образуется из папилломы — клинически характеризуется центрально или под соском расположенной опухолью, кровотечением из соска; в) коллоидный раквстречается в пожилом возрасте, растет медленно, имеет низкую злокачественность, имеет форму лепешки с вогнутой задней поверхностью, не спаянной с грудной стенкой, на ощупь бугристая, опухоль может быть повернута под углом 45°, в последующем изъязвляется.
Для рака молочной железы I и II стадии характерны следующие клинические признаки: I) наличие четко определяемого, плотной консистенции, ограниченно подвижного, безболезненного опухолевого узла в молочной железе;
2) наличие кожных симптомов (морщинистостьили втяжение кожи над опухолью при захватывании или сдавлении кожи);
3) утолщение соска и складки ареолы, где определено наличие опухоли (симптом Краузе);
4) наличие одиночных подвижных лимфатических узелков в подмышечной впадине на стороне поражения;
При раке молочной железы III и IV ст. появляются следующие признаки:
1) опухлевой узел больших размеров, плотной консистенции, с участками размягчения, ограниченной подвижности или наличие инфильтрации (диффузная форма);
2) появление симптомов «площадки», «лимонной корочки», «умбиликации»;
3) втяжение соска или деформация молочной железы;
4) изъзвление или прорастание кожи опухолью;
5) боли в молочной железе и отек руки;
6) пакеты малоподвижных регионарных лимфатических узелков и отдаленные метастазы.
Диагностические методы.I)Пальпацияв положении стоя и лежа: вначале кончиками пальцев, потом ладонью, определяют локализацию опухоли, ее консистенцию, состояние регионарных лимфатических узлов; симптом Кенига — встав сзади от больной, прижать ладонью участок с опухолыо, раковые опухоли и фиброаденома сохраняют свою форму и консистенцию, мастопатические узлы становятся меньше, мягче или совсем скрываются в ткани молочной железы.
2) Маммография. При контрасиной маммографии в выводное отверстие на соске вводят 40% р
р сергозина, а также в паренхиму м/жили реторомаммарно воздух или кислород. При бесконтрастной проводят обычный боковой снимок молочной железы. При раковой опухоли определяется тень без четких контуров, с отходящими в ткань железы лучами, при мастопарии — диффузное, тяжистое затемнение с просветлениями (кисты), при фиброаденомах — четко очерченное затемнение.
3) Чрезгрудинная флебография, при введении кардиотраста в нижний отдел грудины можно судить о состоянии парастернальных лимфатических узлов.
4) Инфракрасное «фотографирование» позволяет судить о состоянии поверхностной венозной сети, при раке она более выражена.
5) Трансиллюминация — в темной комнате через м/ж пропускают узкий пучок света, можно увидеть контуры опухоли или кистозные образования.
6) Аспирационная биопсия и цитологическое исследование. Позволяет выявить наличие раковых или атипичных клеток, цитологическому исследованию можно подвергнуть выделения из соска и соскоб с поверхностной язвы.
7) Биопсия проводится по типу секторальной резекции молочной железы с фасцией большой грудной мышцы, отступя 3-4 см от опухоли. Опухоль подвергается срочному гистологическому исследованию.
Дата добавления: 2017-11-04 ; просмотров: 526 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник