В нашей клинике вы можете пройти анализ на выявление мутаций в генах BRCA1 и BRCA2 — данная процедура позволяет диагностировать высокую степень риска рака молочной железы .
Лечение РМЖ на различных стадиях
- У пациенток с операбельной опухолью (I-II стадий) лечение обычно начинается с операции.
- Пациенткам с первично иноперабельной опухолью (III стадии) необходимо проведение на первом этапе химиотерапии или сочетания химиотерапии с лучевой терапией или гормонотерапии. Операция становится возможной при успешном лечении.
- Пациенткам с диссеминированной опухолью (при наличии метастазов в других органах, IV стадии) предлагается проведение лекарственного лечения или сочетания лекарственного лечения с лучевой терапией, а в некоторых случаях – с операцией.
Сергей Михайлович Портной «Методы лечения рака молочной железы».
Рассмотрим основные положения местного и общего лечения не диссеминированного рака. Кратко анализируя эволюцию методов хирургического лечения рака молочной железы на протяжении ХХ века, можно выделить две противоположные тенденции:
- тенденцию к расширению объема операции,
- тенденцию к сокращению объема оперативного вмешательства.
Первая связана со стремлением к повышению радикализма за счет широкого удаления пораженных опухолью тканей и тканей, где такое поражение может быть. Для рака молочной железы характерно распространение по протокам и по лимфатическим сосудам, как в пределах молочной железы, так и за ее пределы в лимфатические узлы. Такое распространение при небольших, казалось бы, ограниченных опухолях, может быть выявлено только при микроскопии удаленной ткани, ни рентгенологически, ни при пальпации оно не выявляется. После лечения, ограниченного только удалением опухоли, закономерно возникали рецидивы рака в молочной железе или в ближайших лимфатических узлах. Именно с этим связано широкое применение операций, при которых полностью удаляется молочная железа и жировая клетчатка, в которой находятся ближайшие лимфатические узлы (радикальная мастэктомия).
Потеря молочной железы после радикального лечения по поводу рака представляет не только физический недостаток, но и является, прежде всего, серьезной психической травмой. Желание удалить опухоль и сохранить молочную железу выразилось в исторически более ранних операциях, так как радикальная мастэктомия была альтернативой таким операциям. Вместе с тем, органосохраняющее лечение, не худшее по результатам, чем радикальная мастэктомия, было разработано сравнительно недавно.
Современное представление о возможности сохранения молочной железы основано на представлении о том, что РМЖ даже 1 стадии к моменту его выявления уже имеет существенную вероятность наличия отдаленных гематогенных микрометастазов и проведение операции самого максимального объема не снижает риска реализации микрометастазов в клинически проявляемые метастазы (B.Fisher). К настоящему времени проведено большое количество рандомизированных исследований, сравнивающих, с одной стороны органосохраняющие операции в сочетании с лучевой терапией и радикальную мастэктомию с другой стороны.
Многолетние наблюдения за тысячами больных показали равноценность выживаемости и, следовательно, — адекватность органосохраняющего лечения. В то же время, органосохраняющие операции не могут применяться при всех формах роста и на всех этапах развития рака молочной железы.
Показаниями к органосохраняющим операциям являются:
- небольшой размер опухоли (не более 3-4 см),
- один очаг опухоли,
- отсутствие распространения опухоли на кожу.
Предположительно существующее микроскопическое распространение опухоли по лимфатическим сосудам и протокам в пределах молочной железы подавляется обязательным последующим облучением.
Объединение современных возможностей онкологии и пластической хирургии позволило разработать целую серию новых одномоментных операций, при которых онкологический этап операции (радикальная мастэктомия, органосохраняющая операция) дополняется реконструкцией молочной железы.
Облучение молочной железы после органосохраняющих операций позволяет добиться такой же низкой частоты развития местных рецидивов, как и после радикальной мастэктомии. Важно отметить, что проведение правильного органосохраняющего лечения не повышает риск развития отдаленных метастазов, вероятность и скорость их появления остается такой же, как и после радикальной мастэктомии. Пресечь или затормозить этот процесс может только системное профилактическое лечение.
Предполагается, что у значительной части больных на раннем этапе развития рака происходит рассеивание опухолевых клеток током крови по тканям организма. Здесь они могут погибнуть, но, если первичная опухоль не удалена, им на смену придут следующие партии клеток, которые могут сформировать микроскопические колонии.
Современные методы выявления метастазов рака молочной железы не идеальны, с их помощью можно выявить очаг поражения тогда, когда он достиг, по крайней мере, 0,5 см в диаметре. После удаления первичной опухоли дальнейшее поведение микрометастазов определяет судьбу больной:
- Если микрометастазов вообще нет или они настолько малы, что их развитие блокируется естественными силами организма, наступает длительное излечение.
- Если микрометастазы малы и растут медленно, рецидив болезни может развиться через десятки лет.
- Наконец, если микрометастазы относительно крупные и быстро растут, они быстро проявят себя.
При раке молочной железы наибольшую опасность представляют микрометастазы опухоли, вероятно, рассеянные по всему организму уже к моменту первого обращения к врачу. Естественно, что чем больше местное распространение опухоли (ее размер, вовлечение в опухолевый процесс регионарных лимфатических узлов, кожи молочной железы, грудной стенки), тем больше вероятность существования микрометастазов. Именно поэтому при местно-распространенном РМЖ (III стадии) часто лечение начинается не с местных воздействий на первичную опухоль, а с общего воздействия, чаще всего — с химиотерапии. Значение лекарственного лечения, предпринимаемого после радикальных операций, также чрезвычайно велико для уничтожения микрометастазов и повышения вероятности длительного выздоровления больных. Причем, чем больше стадия болезни, тем хуже прогноз и тем больше оснований к проведению профилактического системного лечения.
Химиотерапия и эндокринная терапия
Под химиопрепаратами понимаются вещества природного или синтетического происхождения, обладающие способностями убивать опухолевые клетки. Обычно они вводятся в определенных сочетаниях, позволяющих рассчитывать на успех в 50 — 70% случаев. Химиотерапия обычно проводится за несколько (от 4 до 16) курсов, с интервалами отдыха.
Из средств эндокринного лечения наибольшее применение нашли хирургическое удаление яичников, лекарственное выключение функции яичников, а также препараты, являющиеся гормонами, антигормонами, или ингибиторами образования гормонов. Эти лекарства обычно принимаются длительно и непрерывно, цель их применения — препятствовать стимуляции опухолевого роста собственными гормонами организма. Рецепторы эстрогенов (РЭ) и рецепторы прогестерона (РП) – белковые молекулы в клетках опухоли, воспринимающие воздействие соответствующих женских половых гормонов. Наличие этих молекул говорит о гормональной зависимости опухоли и о возможности снижения вероятности рецидива болезни при проведении гормонотерапии.
Рецептор эпидермального фактора роста 2 типа (HER2) – белковая молекула в опухолевой клетке, воспринимающая стимулирующее действие соответствующего фактора роста. Присутствие этого рецептора, с одной стороны, говорит об очень высокой агрессивности опухоли. С другой стороны, это позволяет применять высокоэффективные средства, по своему механизму действия являющиеся антителами к HER2.
Каким образом планировать компоненты профилактического лечения у каждой конкретной больной?
Хорошо аргументированные ответы содержатся в рекомендациях Международной конференции по адъювантной терапии рака молочной железы в Сан-Галлене (2015-2017 гг.). По современным рекомендациям, практически все больные инвазивным раком молочной железы после операции нуждаются в проведении профилактического лекарственного лечения.
Для составления индивидуального прогноза и выбора лечения больной принимаются во внимание:
- возраст,
- размер опухоли,
- степень злокачественности опухоли,
- наличие опухолевых клеток в перитуморальных сосудах,
- экспрессия РЭ, РП, HER2 и Ki67,
- наличие метастазов в лимфатических узлах.
Решение вопроса о предоперационной и послеоперационной лекарственной терапии решается консультантами-химиотерапевтами так же, как и вопрос о лучевой терапии решается консультантами лучевыми терапевтами.
Особенности лечения наследственного РМЖ
Органосохраняющие операции у больных наследственным раком молочной железы имеют значение для лечения существующей на данный момент болезни, но они не защищают от развития последующих опухолей.
В одном из наблюдений сообщается, что частота вторых раков молочной железы у таких больных составила:
- в оперированной молочной железе – 49%,
- в противоположной молочной железе – 42%.
Эти результаты резко отличаются от результатов таких операций в общей популяции, где частота местных рецидивов может составлять 5-10%.
Выполнение двусторонней мастэктомии у женщин носителей мутаций BRCA1 или BRCA2 при раке одной молочной железы более оправдано, такая операция уносит ткань-мишень, в которой могут формироваться новые опухоли; то есть операция имеет и лечебный, и профилактический смысл.
Тактика лечения наследственного РМЖ основывается на анализе общепринятых для РМЖ характеристик:
- возраста,
- соматического состояния,
- репродуктивного статуса,
- распространённости опухоли, её молекулярно-биологического портрета,
- пожеланий пациентки.
Особенностью тактики является возможность проведения одновременных мер по профилактике второго рака. В частности, при планировании хирургического лечения следует иметь ввиду, что, чем больше оставляется железистой ткани, тем больше вероятность развития второй опухоли как в ипсилатеральной, так и в контралатеральной молочной железе.
Отказ от органосохраняющей операции в пользу мастэктомии на стороне болезни и выполнение контралатеральной профилактической мастэктомии снижает вероятность развития второго РМЖ на 90-100%!
Лечение больных наследственным РМЖ направлено на решение следующих задач:
- непосредственное лечение имеющегося заболевания (РМЖ),
- профилактика второго РМЖ,
- профилактика рака яичников (при мутациях генов BRCA1 и BRCA2).
Обширные профилактические операции могут быть непереносимы по соматическому состоянию или по психологической неготовности пациентки. Решение второй и третьей задач может осуществляться одновременно с проведением лечения первичного заболевания или быть отсрочено.
источник
Условно радикальным называют лечение, требующее длительной реабилитации и имеющее достаточно высокую эффективность. К таким методам относят:
Лучевую терапию. Радиационное облучение применяют исключительно в качестве дополнения к операции. Во время процедуры уничтожаются раковые клетки непосредственно на месте опухоли. Главная задача такой терапии — исключить рецидивы после операции.
В зависимости от цели, лучевая терапия при раке молочной железы бывает
- · Радикальная, при которой достигается полная резорбция опухоли и излечение больного.
- · Паллиативная применяется при распространенном процессе, когда добиться полного излечения невозможно. Под действием лечения можно лишь продлить жизнь больного, уменьшив страдания.
- · Симптоматическое облучение применяется для устранения наиболее тяжелых симптомов рака, в первую очередь, болевого синдрома, который не поддается купированию наркотическими обезболивающими препаратами.
В зависимости от цели, облучению могут подвергаться следующие зоны:
- · Молочная железа (пораженная сторона)
- · Регионарные лимфатические узлы (на стороне поражения)
- · Надключичные и подключичные лимфоузлы с захватом кивательной (грудинно-ключично-сосцевидной) мышцы
Будучи генетически разнородным заболеванием, имеющим множество форм клинического течения, рак груди считается одним из наиболее сложных заболеваний при выборе рационального лечения, когда приходится учитывать множество факторов, каждый из которых может быть решающим не только в прогнозе заболевания, но и в судьбе пациентки.
Лучевая терапия при раке груди — часть комплексного лечения, и в качестве средства монотерапии в настоящее время не используется. Она может сочетаться с другими методами (операция, гормонотерапия, химиотерапия). С уменьшением объема хирургического лечения при органосохраняющих операциях роль лучевой терапии возрастает.
Выбор схемы комплексного лечения определяется следующими факторами:
- · Распространенностью ракового процесса,
- · Гистологическим строением новообразования,
- · Характера роста опухоли.
Химиотерапия. Подразумевает под собой прием химических препаратов, оказывающих негативное воздействие на раковые клетки. Это яды и токсины, которые имеют побочное действие и вместе с клетками опухоли уничтожают и клетки крови и тканей организма, которые могут быть чувствительны к тому или иному препарату. Выпускаются химиопрепараты в форме таблеток или растворов для внутривенного переливания. Химиотерапия проводится периодически, в несколько этапов. Применяются и до, и после операции, иногда заменяют собой хирургическое вмешательство. После химиотерапии организм может восстановиться в течение нескольких месяцев.
Разделяют несколько видов химиотерапии при раке груди:
- · адъювантную (неадъювантную);
- · лечебную.
Адъювантную (профилактическую) химиотерапию проводят после хирургического вмешательства на грудной железе для воздействия на скрытые очаги опухоли в других органах. Неадъювантная химиотерапия назначается до операции; она позволяет узнать, чувствительны ли новообразования к воздействию препаратами. Минусы неадъювантной: затягивание с оперативным вмешательством, сложности с определением гистологического типа новообразования.
Лечебная химиотерапия при раке груди проводится ещё до оперативного вмешательства с целью уменьшения размера локализированного новообразования. В отдельных случаях такая мера позволяет вместо мастэктомии (полного удаления молочной железы) обойтись всего лишь люмпэктомией (удалением поражённой части молочной железы и небольшого объёма здорового участка). Также этот вид химиотерапии проводят для уменьшения отдалённых метастазов.
Таргетная терапия. Направлена на блокировку гена HER2, если его активность вызывает рост раковой опухоли. Препараты позволяют замедлить рост опухоли или предотвратить рецидив после операции.
Иммунотерапия. Метод задействует собственные защитные механизмы организма пациента. Стимулируя иммунитет, препараты помогают в ликвидации раковых клеток. Сама по себе иммунотерапия недостаточно эффективна, поэтому ее используют только в сочетании с другими методами (например, с химическими препаратами.)
Онкология молочной железы, лечение которой было проведено только условно радикальными методами, чаще всего возникает снова, даже если результат оказался удачным. На данный момент эти методы используют в большинстве случаев как вспомогательные. Также с помощью химио- и лучевой терапии можно задержать рост метастаз.
источник
Посмотреть более подробную информацию о симптомах и диагностике.
Тактика и методы лечения рака груди зависит от индивидуальных особенностей новообразования и пациентки. Как правило, используется комплексный подход, при котором применяются различные методы и способы, среди которых:
- хирургический;
- дистанционная и контактная лучевая терапия;
- стереотаксическая радиохирургия (система Кибернож);
- химиотерапия;
- гормональная терапия.
Выбор оптимальных методов лечения молочной железы и их комбинация определяется лечащим врачом после консультации с лучевым терапевтом и хирургом, при необходимости – с другими профильными специалистами.
На этом этапе лечение требуется не всегда. Так, например, если опухолевые клетки обнаруживаются в дольках молочной железы (карцинома lcis), в некоторых случаях врач может принять решение о систематическом наблюдении.
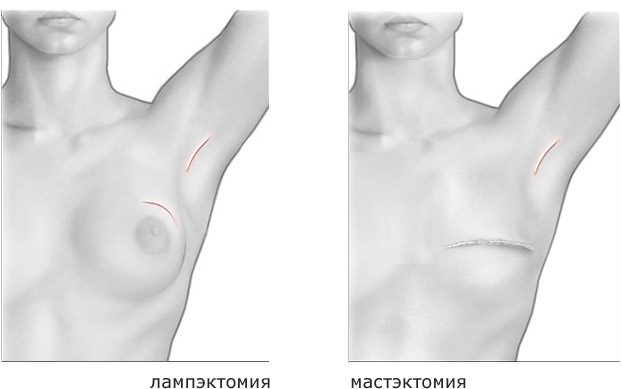
Если же диагностирован протоковый рак груди, необходимо оперативное воздействие. Чаще всего при этом проводится органосохраняющая операция по удалению новообразования с частью окружающих тканей молочной железы (лампэктомия), альтернативой которой может стать радиохирургия (системы Кибер-нож и TrueBeam). Вопрос о применении других методов: химиотерапии, целевой (таргетной) терапии, гормональной и лучевой терапии при раке груди решается в индивидуальном порядке.
Лечение рака молочной железы на 1 стадии обязательно показано вне зависимости от локализации новообразования. Заболевание на данной стадии имеет большие шансы на полное излечение. Прогноз положительный, стойка ремиссия в 96.5 % случаев в пятилетнем периоде.
- На первой стадии также обычно существует возможность сохранить орган при проведении хирургической операции с частичным удалением близлежащих к новообразованию тканей. Для устранения психологического дискомфорта после такой операции впоследствии может быть проведена пластическая операция – реконструкция груди.
- После удаления опухоли с сохранением молочной железы, дополнительное лечение рака молочной железы на 1 стадии с проведением лучевой терапии или радиохирургии посредством Кибер-ножа значительно увеличивает шансы на полную ремиссию заболевания.
- Для закрепления эффекта радикальное удаление опухоли может быть дополнено химиотерапией, гормонотерапией, целевой терапией и ЛТ.
Прогноз благоприятный, в большинстве случаев удается достичь стойкой ремиссии. На второй стадии важным фактором является распространенность опухоли на лимфоузлы.
- Как правило при хирургическом методе выполняется операция по полному удалению груди (мастэктомия). В некоторых случаях может быть принято решение о щадящей органосохраняющей операции (лампэктомия), однако при этом может потребоваться удаление не только части молочной железы, но и пораженных лимфоузлов в подмышечной области.
- Как правило, хирургическое вмешательство дополняется лучевой терапией, которая может проводиться до операции (для уменьшения злокачественного новообразования) и в послеоперационный период (для предупреждения рецидива болезни).
- При лечении рака молочной железы 2 стадии, в схему также включаются другие методы терапии. Некоторым женщинам с гормонозависимыми опухолями показано удаление яичников или прием препаратов, угнетающих их деятельность.
В зависимости от типа онкологии и выбранной схемы терапии, прогноз на выздоровление при лечении рака молочной железы 3 стадии относительно оптимистичный. Как правило, используется комплексный подход, при этом на первое место выходит химиотерапия. Радикальная операция по удалению груди и лимфоузлов также может оказаться эффективной. Лучевая терапия входит в большинство стандартных схем, остальные методы выбираются по показаниям.
На сегодня, к сожалению, полное излечение на этой стадии маловероятно. Однако грамотный подбор методов терапии с учетом особенностей первичной опухоли и метастазов в другие органы позволяет существенно облегчить состояние женщины, улучшить качество и увеличить продолжительность ее жизни. При современных подходах к лечению 5 летняя выживаемость достигается у 22 процентов пациенток с 4 стадией рака.
Последствия после проведения терапии онкологических заболеваний зависят от ее специфики и объема. После проведения радикальных операций с полным удалением органа возникают эстетические проблемы, которые впоследствии могут быть устранены с помощью маммопластики. Операция с удалением части органа и последующей лучевой терапией позволяет свести к минимуму объем эстетической коррекции. Локальное удаление очага на стадии Tis с последующим курсом лучевой и медикаментозной терапии исключает необходимость последующей пластики груди.
После хирургической операции женщину могут беспокоить:
- болевые ощущения и онемение в области шва, в руке, подмышечной и подлопаточной зоне;
- преходящее чувство дискомфорта, снижение тонуса мышц спины и шеи.
После курса лучевой терапии возможно появление:
- чувства усталости;
- отсутствия аппетита;
- преходящих кожных реакций на действие излучения;
- отсроченных осложнений (в редких случаях).
Химиотерапия иногда сопровождается временной аллопецией (выпадением волос). Интенсивные курсы химиотерапии могут вызывать нарушения в работе органов и систем, требующие медицинской коррекции.
После гормонотерапии возможно нарушение гормонального баланса.
При отсутствии осложнений при лечении рака груди после хирургической операции больная находится в стационаре, в среднем, 21 день. За рубежом сроки госпитализации гораздо меньше: в Израиле — 2 дня госпитализации, в Германии 5-6 дней.
Если в качестве радикального метода применяется радиохирургия, восстановление обычно проходит в домашних условиях. При применении других методов длительной госпитализации также, как правило, не требуется. Полный курс восстановления занимает от 4 до 6 месяцев.
Если вам требуется второе мнение для уточнения диагноза или плана лечения, отправьте нам заявку и документы для консультации, или запишитесь на очную консультацию по телефону.
Научная степень: кандидат медицинских наук
Специализация: онколог , гематолог , химиотерапевт
Место работы: «Клиника амбулаторной онкологии и гематологии»
Работал в ведущих онкоцентрах США и Великобритании. Стажировался по медицинскому менеджменту в Канаде, Германии, Сингапуре. Автор ряда публикаций, участвует в научных программах в качестве главного исследователя. Приглашенный эксперт тематических радио- и теле-эфиров на ТВ-каналах «Дождь», «Мир», «РБК» и др., радио «Свобода», «Эхо Москвы», «Маяк» и др. Публикует статьи и дает интервью журналистам популярных изданий «АИФ», «Женское здоровье» и др.
источник
Жизнь после рака молочной железы есть, но это другая жизнь, потому что испытания меняют женщину и её взгляды. Многие стараются забыть, что с ними случилось, и, наверное, для них это единственно правильный выход. Другие, наоборот, победу над раком считают началом лучшей новой жизни. И болезнь, и тяжелое лечение не проходят без последствий, и не просто научиться жить с ними.
Без операции только химиотерапией и облучением невозможно навсегда вылечить рак, но можно на некоторое время приостановить его развитие, как правило, на два-три года и редко дольше. Поэтому хирургический этап следует рассматривать как благо, не взирая на его часто невосполнимые последствия.
Сохраняющая репродуктивный орган резекция деформирует грудь, что усугубляет обязательная лучевая терапия. Надо быть готовой к тому, что рубцовые постлучевые изменения с течением времени будут усиливаться.
Основная цель частичного удаления груди — снижение степени лимфостаза руки, для этого онкологи отказались от повсеместного удаления подмышечных лимфоузлов при отсутствии в них метастазов, отдав предпочтение предварительной биопсии сторожевого узла во время операции.
При груди большого размера возникнет необходимость в операции на здоровой железе — эстетической, то есть выполняемой для «красоты» и симметричной нагрузки позвоночника. Но это не обязательно, потому что сегодня предлагается масса способов завуалировать потерю «части себя» от любопытных взглядов.
Профилактическая химиотерапия после операции проводится не во всех случаях: от неё отказываются при крошеной опухоли 1 стадии у пожилых женщин с благоприятными биологическими характеристиками. При высокой гормональной зависимости — тип, А люминальный предпочтение отдаётся профилактической гормонотерапии, а ХТ не проводится.
Нет необходимости в адъювантной ХТ при полном курсе дооперационного лекарственного лечения, которое проводится при 3 стадии заболевания. Тем не менее, в большинстве случаев для подавления циркулирующих в кровеносном русле раковых клеток и предотвращения метастазирования в будущем проводится химиотерапия, причём начинается лечение сразу же по заживлении послеоперационной раны и до облучения.
Стандартной комбинации лекарств нет, множество комбинаций доказало свою результативность, поэтому лечение подбирается строго индивидуально. Клинические исследования показали, что улучшение отдалённых результатов достигается обязательным использованием доксорубицина и таксанов.
Сколько проживет женщина после выявления заболевания, определить непросто, поскольку прогноз зависит не столько от размера опухоли, сколько от потенциала агрессивности, заложенного в раковые клетки.
При 1 стадии выживаемость максимально высокая — 80% пациенток переживает 5 лет, при 3 стадии — вдвое меньше, но из прошедших радикальное лечение вне зависимости от стадии почти 60% проживёт дольше пятилетки.
Тем не менее, ни один онколог не возьмется сказать, сколько и как будет жить его пациентка, потому что всё очень и очень индивидуально и даже компьютерные программы не в состоянии рассчитать индивидуальный прогноз. Недавний мета-анализ большого числа статей с несколькими миллионами пациенток показал, что точный расчёт длительности жизни отдельной пациентки пока за гранью научного понимания.
Несомненно, что качество терапии — оптимальный подбор лекарств, соблюдение правильной дозы и интервалов между введениями способствуют увеличению жизни пациентки.
Сегодня в клинике «Медицина 24/7» подбирают комбинацию цитостатиков с учетом чувствительности раковых клеток, индивидуальные программы поддержания хорошего самочувствия и своевременное купирование токсичности помогают «продержаться» на необходимой дозе препарата и не сбиться на увеличение перерыва между введениями.
В англоязычной онкологической литературе термин «рецидив» часто обозначает любое проявление заболевания после радикального лечения, и метастазирование тоже. Отечественные специалисты под рецидивом обычно понимают повторное образование карциномы в зоне послеоперационного рубца.
Вероятность рецидива — развития опухоли на прежнем месте снижается применением лучевой терапии и качественным исполнением хирургического этапа. Длительные наблюдения показали, что частота рецидива в рубце после резекции практически аналогична таковой после мастэктомии, что стало поводом для расширения показаний к органосохраняющим вмешательствам.
В предотвращении рецидива большую роль играет искусство хирурга-онколога, правильно определяющего объём вмешательства и качественно его выполняющего, а также соблюдение стандартов облучения.
Вероятность метастазирования растёт параллельно с размером опухоли и числом поражённых метастазами лимфатических узлов.
В большинстве случаев смерть после лечения РМЖ обусловлена именно метастазированием. Особенно неблагоприятны в прогностическом отношении метастазы во внутренние органы, множественные и поражение злокачественным процессом нескольких систем органов и тканей, к примеру, легких, печени и кожи. Единичные и солитарный — единственный метастаз имеют неплохую перспективу на стабилизацию и даже регрессию при хорошей чувствительности к лекарствам.
Адекватный подбор химиотерапии на этом этапе жизни — главное, потому что лекарственное лечение единственно возможное, но в некоторых случаях его можно дополнить лучевой терапией и даже малоинвазивными инновационными вмешательствами.
Комплексное лечение метастазов — стандартный подход клиники «Медицина 24/7», позволяющий повысить качество и продолжительность жизни наших пациенток.
Реабилитационные мероприятия начинаются уже во время операции, потому что основная суть органосохраняющей резекции и биопсии сторожевого лимфоузла — максимальное сохранение функции руки. Когда не удаётся избежать удаления лимфатических узлов вместе с клетчаткой из подмышечной, а тем более, подключичной и подлопаточной областей, высока вероятность развития лимфостаза руки.
Дополнительная лучевая терапия, к сожалению, также способствует нарушению оттока лимфы, что проявляется не только увеличением размера верхней конечности, но и снижением её двигательных возможностей. Дополняют неприятности и рубцовые изменения тканей, усиливаемые использованием цитостатиков, повышающих чувствительность мягких тканей к облучению.
Фактически после радикального лечения формируется синдром комбинированного лечения РМЖ, составные части которого послеоперационные рубцы, усиливающие локальный застой лимфы постлучевые изменения, нарушение оттока венозной крови как последствие повреждения вен цитостатиками.
Помогает восстановлению работоспособности лечебная физкультура и подбор компрессионного белья, аппаратные способы купирования лимфостаза и фармакологические средства.
Спектр терапевтических возможностей широк, а специалисты «Медицина 24/7» подберут оптимальный для каждой пациентки.
Нет спасающей от рака диеты, но питание важно для поддержания защитных сил организма и восстановления после лечения. Налегание на солёненькое может стать пусковым моментом для развития лимфостаза, а острая пища осложнится спазмами кишечника, не восстановившего слизистую после химиотерапии.
Разорвать порочный круг можно и в одиночку, сев на диету, но проще и эффективнее сделать это с помощью специалиста-нутрициолога.
В клинике «Медицина 24/7» подберут оптимальный и очень индивидуальный режим питания, учитывающий последствия тяжелого лечения, вероятность развития неблагоприятных состояний и поддерживающего организм в борьбе со злокачественной опухолью.
Юля К., 27 лет была прооперирована в федеральном центре по поводу рака молочной железы IIB стадии — сделана частичная резекция правой молочной железы с удалением подмышечных лимфоузлов. После операции провели полный курс лучевой терапии и 6 курсов ХТ. Профилактическую гормональную терапию начала, но из-за усиления менструаций и частых приливов прекратила принимать тамоксифен примерно через 3 месяца.
Через полтора года после завершения лечения в верхней части рубца заметила уплотнение около сантиметра в диаметре. При обследовании был заподозрен рецидив. В онкодиспансере предложили полное удаление правой груди с последующей многокурсовой химиотерапией. Молодая женщина на мастэктомию не согласилась и обратилась в «Медицина 24/7».
При обследовании метастазов не найдено, биопсия узла в верхней трети послеоперационного рубца показала наличие клеток рака. В плановом порядке выполнена подкожная мастэктомия с одновременной реконструкцией имплантатом. В удалённой рецидивной опухоли размером 0.8 см обнаружено высокое содержание рецепторов эстрогенов и прогестинов при отрицательном HER-2.
В связи с сохранной менструальной функцией проводится профилактическое лечение антиэстрогенами под наблюдением гинеколога и с коррекцией нежелательных явлений. Самочувствие хорошее, контрольное обследование через год после повторной операции не выявило метастазов.
источник
Лечение рака груди в современной медицине имеет хорошие результаты, и смертность от этого заболевания снижается. Однако у некоторых пациенток после выполнения мастэктомии или других вариантов операции развивается рецидив рака молочной железы — возвращение признаков опухоли после ее лечения.
Различают 3 типа такого состояния:
p, blockquote 4,0,0,0,0 —>
- Местный
Он возникает, когда опухолевые клетки через некоторое время снова появляются на первоначальном месте злокачественного новообразования. Такое состояние рассматривается не как распространение рака, а как признак недостаточности первичного лечения. Даже после мастэктомии на груди остаются части жировой и кожной ткани, что делает возможным рецидив рака молочной железы в послеоперационном рубце, хотя это случается редко.
Более высокий риск рецидивирования имеют женщины, которым были проведены органосохраняющие операции, например, лампэктомия, или только облучение.
p, blockquote 6,0,0,0,0 —>
- Региональный
Это более тяжелое состояние, указывающее на распространение опухолевых клеток по лимфатическим путям через подмышечные лимфоузлы в грудные мышцы, ткани под ребрами и грудиной, во внутригрудные, шейные и надключичные лимфатические узлы. Последние две из указанных локализаций вновь возникшего патологического процесса, как правило, указывают на более агрессивную форму злокачественного процесса.
Частота рецидивов, проявляющихся региональным распространением опухолевых клеток, довольно велика и составляет от 2 до 5% случаев злокачественных образований молочной железы.
p, blockquote 8,0,0,0,0 —>
- Отдаленный
Под этим термином подразумевается появление метастазов в других органах. При этом вероятность излечения значительно снижается.
Из опухолевого очага раковые клетки попадают в подмышечные лимфоузлы. В 65-75% случаев отдаленного рецидивирования они распространяются из лимфоузлов в кости. В более редких случаях возникают метастазы в легкие, печень, мозг или другие органы.
В некоторых случаях спустя долгое время после излечения первичного очага рак груди возникает снова, но в другой железе. При этом он имеет иное гистологическое строение и другие характеристики. Такие пациентки рассматриваются как впервые заболевшие.
В первые 5 лет, прошедших после мастэктомии без использования дополнительных методов лечения лишь у 60% женщин не появляется новых признаков заболевания. Если проведена только операция, вероятность рецидива рака молочной железы максимальна в первые 2 года после нее и составляет почти 10%.
Исследователи изучили данные историй болезни почти 37000 пациенток и выяснили, что чаще всего развиваются рецидивы при 1 стадии онкозаболевания, так как в этом случае нередко не применяется радикальная операция, а также последующее лечение гормональными средствами.
Общая частота рецидивирования и смертность продолжает оставаться на высоком уровне в течение 10 лет, причем значительный процент случаев происходит в первые 5 лет после лечения. Если у пациентки не были вовлечены подмышечные лимфоузлы (1-я стадия), но она не получала гормональную терапию, вероятность возвращения болезни в течение 10 лет после операции составляет 32%. При поражении лимфоузлов (2-я стадия) этот риск увеличивается уже до 50% при условии только хирургического лечения.
В отличие от других форм рака, злокачественная опухоль молочных желез не считается вылеченной, если в течение ближайших 5-ти лет не появилось новых признаков патологического процесса. Рецидив может возникнуть и через 10, и через 20 лет после первоначального диагноза, однако такая вероятность со временем снижается.
Рецидивирующее течение при новообразованиях груди возникает в том случае, если клетки первичной опухоли сохраняются в этой области или других участках тела. Позднее они вновь начинают делиться и образуют злокачественный очаг.
Химиотерапия, облучение или гормональные препараты, применяемые после первичной диагностики рака, используются для уничтожения возможно оставшихся после операции злокачественных клеток. Однако в некоторых случаях такое лечение оказывается неэффективным.
Иногда оставшиеся раковые клетки годами находятся в неактивном состоянии. Затем они начинают вновь расти и распространяться.
Причины рецидива рака молочной железы неясны, но замечена связь такого состояния с различными характеристиками опухоли. Выявлен ряд общих факторов, которые могут помочь предсказать вероятность возобновления заболевания.
p, blockquote 23,0,0,0,0 —>
- Вовлечение лимфатических узлов
Распространение опухоли в подмышечные и иные лимфоузлы при первичном диагнозе, большое количество пораженных лимфатических узлов. Если лимфоузлы не были вовлечены, это означает благоприятный исход для пациентки.
p, blockquote 24,0,0,0,0 —>
- Размер опухоли
Чем больше размер исходного новообразования, тем выше риск рецидивирования. Особенно часто в таких случаях возникает рецидив после частичного удаления железы и связанных с ней лимфоузлов.
p, blockquote 25,0,0,0,0 —>
- Степень дифференцировки
Это оценка опухолевых клеток под микроскопом. Имеется 3 основных характеристики, определяющих злокачественность рака груди: скорость деления клеток, их гистологический тип (протоковая карцинома более агрессивна, чем тубулярная опухоль), изменение размера и формы клеток. Если образование отнесено к III классу (низкодифференцированный рак), частота рецидивирования выше, чем при дифференцированном новообразовании.
p, blockquote 26,0,0,0,0 —>
- Статус HER2/neu
Этот ген контролирует образование белка, способствующего росту раковых клеток. При обнаружении такого протеина необходим более тщательный контроль после операции для раннего выявления предраковых изменений в оставшихся клетках и своевременного лечения.
Пациенткам с высоким уровнем HER2/neu требуется иммунотерапия препаратом трастузумаб (Герцептин), часто в сочетании с дополнительной химиотерапией. Герцептин назначается также при неэффективности химиопрепаратов или гормональных средств.
p, blockquote 28,0,0,0,0 —>
- Сосудистая инвазия
Наличие опухолевых клеток в сосудах опухоли повышает риск рецидивирования.
p, blockquote 29,0,0,0,0 —>
- Статус гормональных рецепторов
Если опухоль имеет рецепторы к эстрогену (ER+) или прогестерону (PgR+), риск рецидивирования на фоне дополнительной терапии ниже.
p, blockquote 30,0,0,0,0 —>
- Индекс пролиферации
Это важный прогностический фактор. Белок Ki-67 образуется при делении клеток. Повышение его концентрации ассоциировано с более высокой частотой рецидивирования и сокращением продолжительности жизни.
Эксперты международной группы по изучению рака груди установили, что при положительном ER- или PgR-статусе пациентка может быть отнесена к группе низкого риска по рецидивированию при соблюдении следующих условий:
p, blockquote 34,0,0,0,0 —>
- рак не распространился на лимфоузлы;
- опухоль меньше 2 см в диаметре;
- ядра раковых клеток небольшого размера, мало изменены по цвету и другим характеристикам по сравнению с нормальными (высокодифференцированные опухоли);
- отсутствует инвазия опухоли в кровеносные сосуды;
- отсутствует ген Her2/neu.
Даже для небольших опухолей, отнесенных к категории самого низкого риска, при отсутствии дополнительной терапии 10-летний риск рецидивирования составляет 12%.
Эксперты предлагают относить пациенток к таким категориям риска:
Полностью обезопасить пациентку от этого современная медицина не в состоянии.
Тем не менее, многие исследования показали, что профилактика рецидива может осуществляться с помощью дополнительной гормональной терапии. Она уменьшает вероятность возвращения заболевания по крайней мере на 30% и существенно повышает показатели долгосрочной выживаемости.
Для дополнительной (адъювантной) гормонотерапии используются антиэстрогены (Тамоксифен) и ингибиторы ароматазы (летрозол, анастрозол и экземестан). Преимущество отдается последней группе препаратов. Они назначаются после операции.
Чтобы не допустить повторного развития онкозаболевания, после хирургического вмешательства также должна быть проведена современная химиотерапия.
Любая пациентка, перенесшая операцию по поводу злокачественного образования груди, должна знать, как проявляется рецидив, и вовремя обращаться в таком случае к онкологу. Нужно помнить, что его симптомы могут возникнуть через много лет, когда женщина уже снята с диспансерного учета.
Признаки рецидива зависят от типа рака молочной железы.
Местный рецидив
Опухоль появляется в той же области, что и первоначально. Если была проведена лампэктомия, злокачественные клетки могут распространиться в оставшейся ткани железы. После мастэктомии новообразование может появиться в области рубца.
p, blockquote 49,0,0,0,0 —>
- неравномерная плотность железы или образование в ней «шишек»;
- изменения кожи на груди, ее воспаление, покраснение;
- выделения из соска;
- появление одного или нескольких безболезненных узелков под кожей в области рубца;
- возникновение области утолщенной кожи рядом с рубцом после мастэктомии.
Региональный рецидив
При этом раковые клетки размножаются в ближайших лимфатических узлах. Проявляется это как образование уплотнения («шишки») или отека в области под мышкой, над ключицей или на шее.
Отдаленные метастазы
Раковые клетки развиваются в других органах – костях, легких, печени, мозге. Наиболее частые признаки:
p, blockquote 53,0,0,0,0 —>
- упорная постоянная не поддающаяся лечению боль в костях, спине;
- постоянный кашель;
- одышка, затрудненное дыхание;
- потеря аппетита, снижение веса;
- сильная головная боль;
- судорожные припадки и другие.
Врач может заподозрить рецидивирование на основании клинических симптомов, данных физического обследования или маммографии. При этом дополнительно назначаются такие исследования:
p, blockquote 56,0,0,0,0 —>
- Визуализирующие, то есть позволяющие «увидеть» опухоль или метастазы: магнитно-резонансная, компьютерная, позитронно-эмиссионная томография, рентгенография, радиоизотопное сканирование.
- Биопсия с последующим гистологическим анализом: она необходима для определения, является ли новая опухоль рецидивом или другим случаем заболевания, а также для выявления чувствительности к гормональной или таргетной терапии.
Его варианты зависят от многих факторов, включающих размер опухоли, ее гормональный статус, ранее перенесенные вмешательства, общее состояние организма, а также цели лечения и предпочтения пациентки.
При местном рецидивировании требуется хирургическое лечение. Так как оно обычно возникает после органосохраняющей операции, пациентке выполняется удаление всей железы. После ранее выполненной мастэктомии проводится удаление опухоли с частью окружающих здоровых тканей. Также иссекаются подмышечные лимфоузлы.
Облучение рекомендуется лишь в том случае, если оно не проводилась ранее. Назначается химио- и гормональная терапия.
Лечение регионального рецидивирования комбинированное. Оно включает удаление опухолевого очага, пораженных лимфоузлов, облучение, химиотерапию, использование гормональных препаратов.
При лечении отдаленных метастазов хирургические операции обычно не используются, так как опухолевые очаги появляются сразу в нескольких органах. Используется химиотерапия, облучение или гормонотерапия. Цель такого вмешательства – продлить жизнь пациентке и ослабить проявления болезни.
На этой стадии рекомендуется часто оценивать эффективность лечения и влияние его на качество жизни женщины. В это время пациентка должна больше заботиться о себе:
p, blockquote 63,0,0,0,0 —>
- правильно питаться;
- достаточно отдыхать;
- получать эмоциональную поддержку от близких;
- спланировать действия в случае ухудшения здоровья.
В какой-то момент врач может рекомендовать пребывание в хосписе. Цель этого – сделать жизнь пациентки как можно более комфортной, а медицинский уход за ней – наиболее квалифицированным.
Новое направление в лечении рецидивирования рака груди – таргетная терапия. Она может применяться при любой распространенности опухолевого процесса и хорошо комбинируется с химиопрепаратами. Таргетные средства направлены только против опухолевых клеток, не повреждая здоровые. Научные достижения привели к появлению нескольких видов таргетных препаратов.
Препарат Герцептин применяемый при таргентной терапии рака молочной железы
От 20 до 30% всех случаев новообразований груди сопровождаются присутствием гена HER2, обеспечивающим быстрый рост злокачественных клеток. Поэтому были разработаны специальные препараты, направленные против этого механизма опухолевого роста:
p, blockquote 66,0,0,0,0 —>
- Герцептин (трастузумаб) – препарат, который распознает и связывается с HER2-позитивными (раковыми) клетками. Его эффекты включают подавление клеточного роста и их гибель. При рецидивирующем течении рака Герцептин может быть использован как монопрепарат или в комбинации с химиотерапией даже при отдаленных метастазах. Даже в виде монотерапии он позволяет излечить до 15% рецидивов HER2-положительных опухолей.
- Тайкерб (лапатиниб) применяется в комплексной терапии и профилактике HER2-положительного метастатического рака груди. В сочетании с химиотерапевтическим препаратом Кселода (капецитабин) он увеличивает время до развития рецидива опухоли.
- Авастин (бевацизумаб) – препарат нового типа, подавляющий образование в опухоли новых кровеносных сосудов. Злокачественные клетки перестают получать нужное количество кислорода и питательных веществ и погибают. Доказан положительный эффект этого препарата при любом типе рецидивирования рака груди при сочетании его с химиотерапевтическими средствами. Плюсом этого средства является возможность его применения при HER2-негативных опухолях.
Перечисленные ниже способы терапии рецидивирующего рака груди пока проходят стадию клинических испытаний. Активно идут исследования в таких направлениях:
p, blockquote 67,0,0,0,0 —>
- действие ингибиторов эпидермального фактора роста (аналогов Герцептина);
- новые химиотерапевтические препараты;
- фотодинамическая терапия.
Предсказать исход заболевания довольно сложно. Он зависит как от характеристик вновь образовавшегося очага, так и от состояния организма, возраста пациентки, сопутствующих заболеваний и многих других факторов.
Наиболее благоприятен для пациенток прогноз при локальном рецидиве рака молочной железы. При полноценной терапии и отсутствии поражения лимфоузлов в течение ближайших 5-ти лет после повторной операции живут как минимум 60% больных.
Выживаемость при рецидиве рака молочной железы с отдаленными метастазами обычно составляет не более 3 лет.
Этот калькулятор риска рецидивирующего течения определяет его вероятность на основе степени злокачественности опухоли и вовлечения лимфатических узлов.
Степень злокачественности:
p, blockquote 74,0,0,0,0 —>
- I – 6 баллов;
- II – 12 баллов;
- III – 18 баллов.
Вовлечение лимфоузлов:
p, blockquote 75,0,0,0,0 —>
- Нет – 6 баллов;
- Есть – 12 баллов.
Инвазия в кровеносные или лимфатические сосуды:
p, blockquote 76,0,0,0,0 —>
- Нет – 4 балла;
- Есть – 8 баллов.
При сложении полученных баллов получается условная величина, которая позволяет определить примерный риск:
Разумеется, подобный подсчет не является абсолютно точным. Однако он помогает убедиться в необходимости тщательного наблюдения у онколога даже после проведенного лечения по поводу первичной опухоли.
О возможностях ранней диагностики и выявления предрасположенности к раку груди, читайте в статье: «Онкомаркеры рака молочной железы».
p, blockquote 80,0,0,0,0 —> p, blockquote 81,0,0,0,1 —>
источник
Срок возникновения локальных рецидивов (ЛР) (время от радикально выполненной операции до возникновения рецидивной опухоли) является важным прогностическим фактором для больных раком молочной железы (РМЖ).
Около 75% всех ЛР возникают в первые 5 лет после перенесенной операции, хотя в литературе описаны уникальные случаи возникновения поздних локальных рецидивов в области грудной стенки у пациенток, перенесших мастэктомию: у 77-летней пациентки спустя 23 года и у 90-летней женщины спустя 40 лет после перенесенной операции.
Использование возможностей современного морфологического исследования опухолей позволило подтвердить развитие именно ЛР первичной опухоли.
По нашим данным (архив РОНЦ им. Н.Н. Блохина РАМН), максимальный срок возникновения рецидива составляет 18 лет.
В 1978 г. по поводу рака правой молочной железы T2N1M0 больной в возрасте 32 лет выполнена радикальная мастэктомия (РМЭ) (по Пейти), в адъювантном режиме проведена химиотерапия тиосроссрамидом в дозе 120 мг.
Спустя 18 лет после операции у больной появилось опухолевидное уплотнение в средней трети послеоперационного рубца. При дообследовании [маммография и ультрозвуковое исследование (УЗИ) левой молочной железы, рентгенография органов грудной клетки, УЗИ органов брюшной полости и малого таза, сцинтиграфия скелета] какой-либо другой опухолевой патологии у больной не выявлено.
По данным УЗИ: в средней трети послеоперационного рубца определяется опухолевый узел округлой формы с нечеткими контурами, размером 1,2х0,9 см, с инвазией в межреберье (рис. 7).
Рис. 7. УЗ-картина ЛР в области послеоперационного рубца с инвазией опухоли в межреберье.
С целью верификации диагноза выполнена пункция опухолевого узла. Цитологическое заключение — рак; при сравнении пунктатов цитограммы первичной опухоли и локальных рецидивов идентичны.
Больной проведена лучевая терапия на область послеоперационного рубца и регионарные зоны метастазирования, разовая очаговая доза (РОД) 2 Гр, суммарная очаговая доза (СОД) 50 Гр, с полным эффектом. С учетом рецепторного статуса опухоли (опухоль экспрессирует рецепторы эстрогена (РЭ)+рецепторы прогестерона (РП)+) рекомендован прием тамоксифена 20 мг/сут. Больная прослежена в течение 2 лет — признаки прогрессирования заболевания отсутствуют.
В мировой литературе выделены понятия раннего и позднего ЛР РМЖ. Понятие «ранний локальный рецидив» различно у разных авторов — от 2 до 4 лет после операции; развитие рецидива в эти сроки ассоциировано с повышенным риском отдаленного метастазирования и смерти от прогрессирования болезни. Различия в показателях общей выживаемости среди пациенток с ранними и поздними рецидивами представлены в табл. 9.
Таблица 9. Показатели общей выживаемости у больных с ранними и поздними ЛР рака молочной железы
| Число больных | Срок возникновения локальных рецидивов РМЖ, мес после операции | Общая выживаемость больных при рецидивах, % | |||
| ранний | поздний | ранний | поздний | ||
| A. Courdi и соавт. | 180 | До 36 | Позже 60 | 55,8 | 79,5 |
| J. Fodor | 68 | До 24 | Позже 24 | 25 | 72 |
| A. Neri и соавт. | 46 | До 24 | Позже 24 | 10 | 87,5 |
Авторы подчеркивают, что срок возникновения ЛР коррелирует с такими факторами, как: пременопаузальный статус, размер опухоли более 2 см, степень злокачественности опухоли, наличие лимфоваскулярной инвазии, отрицательный статус рецептором эстрогена и мультицентричность роста опухоли.
Кроме того, выявлена корреляция раннего срока возникновения рецидива с поражением аксиллярных лимфатических узлов, а также низкой степенью дифференцировки и РЭ(-)-статусом первичной опухоли, что определяет более неблагоприятный прогноз у этих больных.
Ранние рецидивы после операции у больных раком молочной железы представляют особый клинический интерес. С одной стороны, ранние рецидивы после операций всегда вызывают сомнение в отношении радикальности выполненного хирургического вмешательства.
С другой стороны, возникновение рецидива в ранние сроки после операции на фоне проводимой адъювантной терапии может являться показателем устойчивости опухолевых клеток к проводимому лекарственному и лучевому лечению, что требует пересмотра режимов стандартной терапии и выработки индивидуального, нередко нестандартного лечебного подхода.
Мы изучили срок возникновения ЛР как самостоятельный прогностический фактор у 116 пациенток с первично-операбельным РМЖ (T1-3N0-1 стадии), получивших лечение в РОНЦ им. Н.Н. Блохина РАМН с 1990 по 2006 г. ЛР возникли в срок от 4 мес до 10 лет после радикальной операции (мастэктомии в модификации по Маддену или радикальной резекции молочной железы со стандартной аксиллярной лимфаденэктомией).
Среднее время возникновения локальных рецидивов составило 41,4±2,6 мес (от 4 мес до 10 лет). Максимальный риск возникновения ЛР нами отмечен на 2-м году после операции (29,3%) и минимальный — на 7-м году (1,7%). В срок до 5 лет реализовалось большинство ЛР (79,3%; рис. 8).
Рис. 8. Частота возникновения ЛР в различные сроки после операции.
По сроку возникновения локальных рецидивов мы разделили пациенток на 3 условные группы: группу раннего ЛР (рецидив возник в срок до 30 мес после операции) — 54 случая, 46,6%; промежуточную группу (рецидив от 30 до 60 мес после операции) — 38 больных, 32,8%; группу позднего локального рецидива (спустя 60 мес после операции) — 24 пациентки, 20,6% (рис. 9).
Рис. 9. Распределение больных по сроку возникновения ЛР РМЖ.
Такое распределение пациенток было неслучайным. Нами выполнен многофакторный статистический анализ, на основании которого выявлено принципиальное сходство (по факторам риска возникновения рецидивов, клинико-морфологическим проявлениям и прогнозу заболевания) характеристик пациенток со сроком возникновения ЛР до 30 мес; аналогичные данные получены и для пациенток со сроком возникновения ЛР спустя 60 мес. Это послужило основанием для предпринятого деления больных.
Для выполнения однофакторного статистического анализа мы использовали пакет прикладных программ STATISTICA 6; непараметрические данные в зависимости от количества наблюдений анализировали с использованием теста хи-квадрат или точного критерия Фишера.
Различия считались статистически достоверными при р 0,05) срока возникновения рецидива и таких показателей, как внутрипротоковый компонент, мультицентричность опухоли, лимфоидная инфильтрация стромы опухоли, локализация опухоли, сторона поражения, степень злокачественности опухоли и наличие поражения регионарных лимфатических узлов.
При многофакторном анализе (по методу Байеса с анализом 60 признаков) выделены факторы, обладающие максимальной прогностической значимостью для риска возникновения раннего локального рецидива: рецепторный статус первичной опухоли и тактика лечения.
Рецепторный статус первичной опухоли имеет важное прогностическое значение для срока возникновения ЛР. Мы выявили отчетливое преобладание рецептороотрицательных опухолей у пациенток с ЛР: РЭ(-)-опухоли у 56,4%, РП(-)-опухоли имели 55% больных, более четверти всех пациенток имели РЭ(-)РП(-)-опухоли, РЭ(+)РП(+)-опухоли были диагностированы только у 16% больных. Такая высокая частота рецептороотрицательных опухолей нехарактерна для общей группы пациенток с первично-операбельным РМЖ.
Кроме того, при РЭ(+)РП(+)-статусе первичной опухоли среднее время возникновения рецидива составляет 53,9 мес, доля ранних рецидивов минимальна — 37,5%; у больных с рецептороотрицательными опухолями среднее время возникновения рецидива короче на 14 мес (39,8 мес), доля ранних рецидивов значительно выше — 59,3%, р
План лечения составляют с учётом стадии опухолевого процесса, морфологической структуры опухоли, возраста больной, сопутствующих заболеваний, общего состояния пациентки. Применяют следующие методы лечения: хирургический, комбинированный (сочетание операции с лучевой или лекарственной терапией) и ком.
По данным многочисленных публикаций, этиология и патогенез РМЖ сложны и определяются сочетанием многих факторов. Гормональная регуляция функции молочных желез значительно сложнее, чем эндометрия. Помимо эстрогенов и прогесторона, развитие молочных желез в пубертатном периоде, их функция во время бер.
источник
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Архив — Протоколы диагностики и лечения Министерства здравоохранения Республики Казахстан (2006, устар.)
Рак молочной железы (РМЖ) – это злокачественное заболевание молочной железы.
Длительность лечения (дней): 15
Получить консультацию по медтуризму
Получить консультацию по медтуризму
Проведение адъювантной химиотерапии и лучевой терапии после удаления рака молочной железы (РМЖ) в ранних стадиях снижает частоту его рецидивирования и повышает выживаемость.
Применение антиэстрогенных препаратов (например, тамоксифена) удлиняет период ремиссии при эстрогензависимом метастазирующем РМЖ. При неэффективности тамоксифена применяются гормональные препараты второго ряда, например, селективные ингибиторы ароматазы, подавляющие превращение андрогенов в эстрогены.
Аминоглутетимид, анастрозол и летрозол относятся к нестероидным ингибиторам ароматазы, а форместан и экземестан — к стероидным.
Анастрозол, форместан, экземестан и летрозол — селективные ингибиторы ароматазы.
Аминоглутетимид также подавляет выработку стероидов в надпочечниках.
Применеие всех этих препаратов способствует подавлению синтеза эстрогенов.
Новые нестероидные (торемифен, идоксифен, ралоксифен) и стероидные (фаслодекс) антиэстрогены по сравнению с тамоксифеном реже вызывают развитие отдаленных побочных эффектов.
Применение прогестинов (медроксипрогестерон, мегестрол) столь же эффективно как и применение тамоксифена.
Если рецидив опухолевого процесса возникает после стандартной химиотерапии, ответная реакция на препараты второго ряда обычно слабая. Применение
цитостатиков, в частности таксанов (паклитаксел, доксетаксел) и полусинтетических алколоидов винка (винорелбин) более эффективна, особенно при резистентности к антрациклинам.
Применение бифосфонатов (памидронат, клодронат) в сочетании со стандартной противоопухолевой терапией у больных с метастазами РМЖ в костную ткань снижает риск развития осложнений, связанных с ее поражением.
Рекомендации по применению химиопрепаратов при метастатическом РМЖ
1.Таксаны:
1.1 Пациентам, которые ранее не получали антрациклины, наряду с назначением одного антрациклина (доксорубицин или эпирубицин) или антациклина в стандартной комбинации предлагаются следущие опции:
— лечение одним доцетакселом 100 мг/м 2 1 раз в каждые 3 недели;
— доцетаксел или паситаксел в комбинации с доксорубицином.
1.2 Пациентам, которые ранее не получали антрациклины, но имеют к ним противопоказания рекомендуется лечение одним доцетакселом 100 мг/м 2 1 раз в каждые 3 недели.
1.3 Пациентам, ранее получавшим антрациклины как вспомогательную терапию и имеющим резистентность к ним, рекомендуется:
— доцетаксел (100 мг/м 2 1 раз каждые 3 недели) или паклитаксел (175 мг/м 2 более 3 раз каждые 3 недели);
— комбинация доцетаксела и капецитабина является терапевтическим выбором; из-за токсичности комбинации, капецитабин в данной комбинации назначается в 75% от полной дозы. Данная комбинация назначается больным более молодого возраста и с хорошим клиническим статусом.
2. Капецитабин:
2.1 Для пациентов моложе 70 лет с хорошим клиническим статусом и без сопутствующих заболеваний, имеющим резистентность к антрациклину и получавшим ранее антрациклины как вспомогательную терапию, комбинация доцетаксела и капецитабина является терапевтическим выбором. Стартовая доза 950 мг/м 2 дважды ежедневно: капецитабин (75% от полной дозы в день) от 1 до 14 дня плюс доцетаксел 75 мг/м 2 в/в в день от 1 до 21 дня цикла.
2.2 Пациентам, получавшим ранее антрациклины и/или таксаны, капецитабин назначается один — 1250 мг/м 2 дважды ежедневно от 1 до 14 дня из 21-дневного цикла.
3. Бисфосфонаты: пациентам, которые плохо переносят пероральное применение памидроната и клодроната (тошнота, рвота, эзофагит), назначается памидронат в/в, альтернатива памидронату — золедронат в/в. Внутривенное применение клодроната исследовано недостаточно.
4. Ингибиторы ароматаз: терапия первой линии – анастрозол и летрозол (превосходят тамоксифен в лечебном ответе при РМЖ у женщин в постменопаузальном периоде). Тамоксифен остается наиболее приемлемой альтернативой.
Схемы комбинированной химиотерапии (при метастазирующем РМЖ)
Классическая схема ЦМФ: циклофосфамид (по 100 мг/м 2 перорально с 1-го по 14 день), метотрексат (по 400мг/м 2 в/в на 1-й и 8-й дни) и 5-фторурацил (по 600 мг/м 2 в/в 1-й и 8- дни) каждые 4 недели, в зависимости от ответной реакции число курсов может достигать 6.
Схема ЦАФ: циклофосфамид (по 500 мг/м 2 в/в), какой-либо из антрациклинов, например, доксорубицин (по 50 мг/м 2 в/в) и 5-фторурацил (по 500 мг/м 2 в/в) каждые 3 недели, в зависимости от ответной реакции на лечение число курсов может достигать 6.
Схема ФЭЦ: 5-фторурацил, эрубицин и циклофосфамид каждые 3 недели, в зависимости от ответной реакции на лечение число курсов может достигать 6.
Схема ФАЦ: 5-фторурацил, антрациклины (эрубицин и доксорубицин) и циклофосфамид каждые 3 недели, в зависимости от ответной реакции на лечение число курсов может достигать 6.
Схемы комбинированной химиотерапии (при неметастазирующем РМЖ), включающие антрациклины, несколько более эффективны, чем схема комбинированного применения циклофосфамида, метотрексата и 5-фторурацила (ЦМФ).
Сочетанное применение тамоксифена и комбинированной химиотерапии (в/в введение 2 цитостатиков или более, каждые 3-4 недели в течение 4-6 мес. (по схеме ЦМФ) повышает выживаемость.
Адъювантная химиотерапия наиболее эффективна у более молодых больных. После удаления РМЖ на ранних стадиях у больных моложе 50 лет подавление функции яичников повышает отдаленную выживаемость. Применение схем, включающих антрациклины (акларубицин, даунорубуцин, доксорубицин, эпирубицин, идарубицин), снижает частоту рецидивирования РМЖ и статистически значимо повышает пятилетнюю выживаемость. Длительная (до 5 лет) адъювантная терапия тамоксифеном снижает риск рецидивирования опухоли и смерти больных с эстрогензависимым РМЖ. 5-летний курс терапии тамоксифеном (не более 5 лет) эффективнее более коротких курсов.
Миланская схема — сначала назначается один из антрациклинов, а затем терапию продолжают по классической схеме ЦМФ.
Классическая схема ЦМФ – комбинированное применение циклофосфамида, метотрексата и 5-фторурацила.
Схема ФАЦ – комбинированное применение 5-фторурацила, адриомицина (доксорубицина) и циклофосфамида.
Для лечения и профилактики возникновения микоза при проведении химиотерапии показан итраконазол оральный раствор 400 мг\сут. в течение 10 дней.
Далее представлены алгоритмы послеоперационного лечения рака молочной железы.
Лечение рака молочной железы. Основной алгоритм лечения
Лечение рака молочной железы. Стадия I. Алгоритм послеоперационного лечения
Лечение рака молочной железы.Стадии II или III. Алгоритм послеоперационного лечения
Лечение рака молочной железы. Стадия 0. Алгоритм постоперационного лечения
Перечень основных медикаментов:
1. Поливидон 400 мл во флаконе
2. *Аскорбиновая кислота 50 мг, 100 мг, 500 мг табл.; 5%, 10% 2 мл, 5 мл амп.
3. *Декстроза 5% 400 мл во флаконах
4. Натрия хлорид порошок для приготовления перорального раствора (для подготовки к диагностическим исследованиям и хирургическим вмешательствам)
5. Гозерелин 3,6 мг табл.
6. *Метотрексат 2,5 мг табл.
7. *Циклофосфамид драже 50 мг; порошок для приготовления инъекционного раствора 200 мг, 500 мг во флаконе
8. *Доксорубицин порошок лиофилизированный 10 мг, 50 мг во флаконе
9. *Цисплатин порошок лиофилизированный во флаконе 10 мг, 25 мг, 50 мг
10. *Винкристин порошок лиофилизированный для инъекций 1 мг во флаконе
11. *Этопозид капсула 50 мг, 100 мг; раствор для инъекций 100 мг/5 мл
12. *Эпирубицин порошок для приготовления инъекционного раствора с растворителем во флаконе 10 мг, 50 мг
13. *Тамоксифен таблетка 10 мг, 20 мг
14. *Итраконазол оральный раствор 150 мл – 10 мг\мл.
Перечень дополнительных медикаментов: нет
Критерии перевода на следующий этап: отсутствие локальных и отдаленных (метастазов) признаков опухолевого процесса, отсутствие побочных эффектов лечения.
* – препараты, входящие в список основных (жизненно важных) лекарственных средств
источник