Для лечения любой разновидности рака молочной железы могут применяться хирургические методы лечения (при операбельном процессе), химиотерапия и лучевая терапия, показания к применению каждого из этих методов определяет лечащий врач в зависимости от стадии опухолевого процесса, его разновидности и агрессивности, а также ряда индивидуальных особенностей каждой пациентки. Тем не менее, помимо указанных методов лечения, в зависимости от индивидуальных особенностей опухоли, применяются и другие методы лечения, позволяющие оказывать избирательное воздействие на злокачественные клетки [1, 2].
Прогресс в области лечения рака молочной железы продемонстрировал, что данное заболевание является крайне разнородным (гетерогенным), и в настоящее время было убедительно доказано, что под термином «рак молочной железы» объединено множество разных по своей природе и естественному течению заболеваний. Различные виды рака молочной железы по-разному реагируют на лечение и, соответственно, требуют различных подходов к терапии. На данный момент выделено несколько основных вариантов этой злокачественной опухоли и на сегодняшний день при выявлении рака молочной железы в обязательном порядке определяют и «молекулярный подтип» опухоли.
Для того, чтобы определить какой именно подтип рака молочной железы имеется у пациентки проводят биопсию опухоли, которая подразумевает забор при помощи специальной иглы небольшого количества опухолевой ткани. Сама процедура наиболее часто проводится под местной анестезией (обезболиванием), подобной той, которую используют стоматологи. После получение материала, опухолевую ткань отправляют на исследование в патоморфологическую лабораторию, где проводится иммуногистохимическое исследование, а также, при необходимости – дополнительные методы исследований.
Врач-патоморфолог, который является специалистом по изучению образцов опухолей, проводит процедуры выявления в опухоли потенциальных мишеней, которые могут быть использованы для наиболее эффективного лечения рака молочной железы. В ходе изучения образца опухолевой ткани в ней определяется наличие выработки (экспрессии) рецепторов женских половых гормонов, эстрогена и прогестерона, а также гиперэкспрессии белка HER2 и скорости, с которой делятся опухолевые клетки.
Эстроген и прогестерон – гормоны, которые регулируют многие процессы в женском организме, они выполняют важную роль в формировании женского организма в процессе полового созревания, а также в регуляции менструального цикла, беременности и процессе деторождении. Если по результатам анализа в опухолевых клетках выявляется выработка (экспрессия) рецепторов этих гормонов, говорят о гормонопозитивном раке молочной железы, если не выявляется – о гормононегативном раке. Рост опухолевых клеток при раке молочной железы может быть зависим от наличия этих гормонов в организме (подробнее про рецепторы эстрогена и прогестерона, а также их роль в лечении рака молочной железы).
HER2 – особый белок, играющий важную роль в процессах регуляции процессов деления клеток. Если опухолевые клетки вырабатывают этот белок в очень больших количествах (т.е. отмечается его гиперэкспрессия(, это приводит к резкому повышению скорости их роста и размножения. Примерно в 25% случаев развития рака молочной железы в опухолевых клетках обнаруживается гиперэкспрессия этого белка. Изначально HER2-позитивный рак молочной железы был одним из наиболее агрессивных разновидностей этого заболевания, к счастью, в настоящее время разработано множество препаратов, подавляющих его активность и позволяющих эффективно лечить данный вариант рака молочной железы (подробнее про HER2 и препараты на него воздействующие).
Кроме того, для того, чтобы понять насколько агрессивными и быстрорастущими являются клетки выявленной опухоли, проводится определение скорости их деления. Для её оценки применяется определение так называемого индекса Ki-67. Ki-67 – белок, который вырабатывают клетки в процессе деления, соответственно определив в каком количестве клеток в образце присутствует этот белок, можно понять, сколько клеток находится в состоянии активного деления.
Индекс Ki-67 измеряется в процентах (%), например, если он равен 0%, то ни одна из клеток опухоли в образце не находится в состоянии деления и опухоль растет очень медленно, если Ki-67 равен 100%, это означает, что все клетки опухоли находятся в состоянии активного деления, что является свидетельством быстрого роста опухоли. Опухоли с Ki-67 20% — как быстрорастущие. Индекс Ki-67 может снижаться в процессе лечения, что иногда используются для оценки эффективности лечения.
В зависимости от сочетания наличия выработки в опухоли рецепторов эстрогена, прогестерона, белка HER2, а также скорости деления клеток выделяют несколько подтипов рака молочной железы [3]:
- люминальный А;
- люминальный В;
- HER-2-положительный подтип;
- тройной негативный подтип.
К люминальным подтипам (люминальный А или люминальный В) относят опухоли, которые вырабатывают рецепторы эстрогена и/или прогестерона. Опухоли этой группы развиваются из клеток, которые в норме покрывают внутренние слои протоков и долек молочной железы. Так как рост клеток этих опухолей зависит от эстрогена и/или прогестерона, для лечения этих разновидностей рака молочной железы, помимо химиотерапии, активно применяется гормонотерапия, направленная на лишение опухолевых клеток доступа к гормонам, способствующих их росту. К люминальному А подтипу относятся медленно делящиеся опухоли, вырабатывающие рецепторы эстрогена и прогестерона (или только эстрогена), не вырабатывающие HER2 и имеющие индекс Ki-67 20%), но сохраняющие зависимость от влияния женских половых гормонов, эстрогена или прогестерона относятся к люминальному B подтипу. Такие опухоли так же могут быть HER2-положительными. Для лечения злокачественных опухолей молочной железы, относящихся к люминальному В подтипу, используется эндокринотерапия, химиотерапия, а также, в случае HER2-положительных опухолей – так называемая «таргетная» терапия с использование анти-HER2-препаратов, например трастузумаба.
С клинической точки зрения, опухоли, относящиеся к люминальным подтипам, являются наиболее благоприятными в плане прогноза, их своевременное лечение позволяет свести к минимуму риск развития рецидива заболевания, в случае лечения поздних стадий заболевания современные методы терапии позволяют достичь длительного контроля над болезнью.
К HER2-обогащенному подтипу относятся опухоли, которые не экспрессируют рецепторы эстрогена и прогестерона, но в большом количестве вырабатывают белок HER2. Для лечения этого подтипа рака молочной железы используется химиотерапия в сочетании с анти-HER2 препаратами.
Опухоли, в которых отсутствует экспрессия рецепторов эстрогена и прогестерона, а также не выявляется гиперэкспрессия белка HER2, относятся к так называемому тройному негативному раку молочной железы. Соответственно, рост клеток опухолей, которые относятся к этому подтипу, не зависит от стимулирующего влияния женских половых гормонов и белка HER2, по этой причине для их лечения не применяется ни гормонотерапия, ни анти-HER2 препараты. Они характеризуются агрессивным течением и, как правило, высоким значением индекса Ki-67. Тем не менее, этот вариант опухоли наиболее чувствителен к химиотерапии, во многих случаях на фоне её проведения можно достичь полной гибели всех злокачественных клеток. На долю этой разновидности рака молочной железы приходится 10-20% случаев. Подробнее про эту разновидность опухоли — в нашем материале.
источник
Рак молочной железы — это один из самых распространенных видов онкологических заболеваний среди женщин репродуктивного возраста. Примерно в 70-80 % случаях злокачественная опухоль является гормонозависимой. Данный факт вызывает тревогу относительно того, что повышенная подверженность гормону эстроген может способствовать развитию и распространению онкологических образований.
Гормон эстроген обычно ассоциируется с репродуктивными функциями у женщин, однако он играет важную роль в здоровье костной ткани, сердца и кровеносной системы, регулирует эмоциональное состояние и поведение, способствует сжиганию жира и т. д.
Эстроген является жизненно важным гормоном, но его чрезмерное количество в организме может существенно повысить риск развития различных заболеваний, в том числе онкологических.
К группе риска относятся женщины с ранним наступлением первой менструации и поздней менопаузой, забеременевшие первый раз в позднем возрасте, не кормящие грудью. Все они имеют переизбыток данного гормона в организме на протяжении многих лет. У всех этих женщин риск заболеть раком груди значительно выше, чем у остальной части населения женского пола.
Эстроген производится в яичниках на протяжении всего репродуктивного периода, затем, с наступлением менопаузы, источником его секреции становятся жировая ткань и надпочечники. Уменьшить уровень эстрогена можно путем снижения функционирования органов, которые его производят (например, яичников), или блокировки чувствительных к нему рецепторов. По данному принципу построено лечение гормонозависимых опухолей молочной железы, то есть когда опухоль содержит большое количество рецепторов к эстрогену. В таких случаях применяют препараты, препятствующие контакту гормона с данными рецепторами, и таким образом происходит подавление развития новообразования.
Повышению уровня эстрогена могут способствовать прием противозачаточных препаратов, заместительная гормональная терапия (после наступления менопаузы) и лечение бесплодия. Кроме того, гормон может поступать в организм через пищу, чистящие средства и даже косметику — в них могут содержаться молекулы, очень похожие на эстроген, которые выполняют в организме его функции.
В последние годы обнаружен еще один возможный источник повышенного содержания эстрогена, а именно — способ, с помощью которого избыток гормона выводится из организма.
После завершения своей функции гормон распадается и выводится из организма. Основную роль здесь играет печень, в которой происходит его метаболизм. Существует три способа метаболизма эстрогена в организме, при каждом из них образуются разные продукты распада.
Первый способ — OH 2 — является самым безопасным, он связан с низкой эстрогенной активностью и канцерогенным действием.
Два других способа — OH 4 и OH 16 — менее желательны, так как при них происходит доминантное действие эстрогена, что повышает риск развития онкологических заболеваний.
У женщин с диагнозом «рак молочной железы» практически всегда преобладают последние способы переработки эстрогена, что можно наблюдать в анализах мочи. Таким образом, важно, чтобы большей частью метаболизм данного гормона происходил первым способом. Женщины, у которых преобладает первый путь метаболизма эстрогена, имеют на 40% меньший риск заболеть раком молочной железы.
К счастью, во многих случаях изменение питания и образа жизни, а также употребление лекарственных трав и пищевых добавок может значительно повлиять на путь метаболизма эстрогена. По результатам последних исследований, у женщин, употреблявших в течение всего одного месяца соответствующие лекарственные травы и фитовещества, которые были выделены из брокколи, преобладал первый путь вывода эстрогена из организма!
Продукты, богатые пищевыми волокнами, которые находятся в овощах, фруктах, крупах и цельных бобовых. Они способствуют лучшей работе кишечника, который также играет важную роль в выводе эстрогена.
Овощи из семейства крестоцветных, такие как брокколи, капуста и цветная капуста. Кроме пищевых волокон, они содержат индолы — фитовещества, способствующие лучшему распаду эстрогена. Так как они очень чувствительны к высоким температурам, овощи рекомендуется готовить на пару. С целью достижения лучшего клинического эффекта можно использовать индолы в виде пищевых добавок (I3C и DIM), влияние которых на рак молочной железы научно доказано.
Семена свежего молотого льна. Рекомендуется добавлять 1-2 столовых ложек молотых семян льна в воду, йогурт или другие негорячие блюда. В семенах льна содержится омега-3, которая катализирует энзим, ответственный за лучшую переработку эстрогена.
Зерна сои, тофу и соевые продукты также способствуют правильному выводу эстрогена. Ранее считалось, что данные продукты противопоказаны женщинам, страдающим раком молочной железы из-за фитоэстрогенов — растительных эстрогенов, похожих по своей структуре на эстрогены, содержащиеся в организме человека. Результаты многочисленных исследований последних лет показали, что регулярное употребление сои снижает риск рецидива заболеваний. Обратите внимание, что речь идет о сое, а не о соевых переработанных продуктах, таких как шницели, от потребления которых следует воздержаться.
Лекарственные травы. Розмарин, куркум, чертополох, пожитник также полезны для стимуляции правильного метаболизма эстрогена. Их можно использовать при приготовлении пищи, добавлять в чай или готовить травяные растворы. Однако перед их употреблением следует сначала обратиться за консультацией к специалисту, который объяснит, как, в каких количествах и по какой схеме лучше всего использовать данные лекарственные растения в качестве травяных добавок.
Необходимо избегать избыточного употребления сладкого, продуктов, содержащих животные жиры, а также алкоголь в больших количествах. Малоподвижный образ жизни и избыточный вес признаны факторами, способствующими повышению риска развития рака молочной железы, не исключающими его рецидив.
Таким образом, здоровый образ жизни, полноценное, сбалансированное питание и правильно подобранные пищевые добавки могут значительно снизить риск заболеть раком молочной железы.
источник
Часть опухолей молочной железы состоит из клеток, для которых характерно присутствие рецепторов эстрогенов и других стероидных гормонов, включая прогестоген. Эти рецепторы находятся как в ядре, так и в цитоплазме клеток. Они обнаружены в 65% опухолей, возникающих в период постменопаузы. В то же время лишь 30% опухолей, развивающихся в пременопаузе и связанных с геном BRCA1, обычно не содержат рецепторов эстрогенов и прогестерона (PR).
Однако эти рецепторы присутствуют в опухолях, связанных с геном BRCA2. Гормональная зависимость некоторых опухолей подтверждается клиническими наблюдениями при изменении в организме гормонального фона. В настоящее время показано, что наличие рецепторов эстрогенов (ER) в опухолевых клетках коррелирует с чувствительностью индивидуальной опухоли к гормонам. Это позволяет прогнозировать ее чувствительность к гормональным препаратам, что имеет важное клиническое значение.
Например, пациенткам, у которых обнаружена ER-отрицательная опухоль, можно не удалять яичники. Не совсем ясно, отражает ли статус ER фундаментальные различия между «отрицательным» и «положительным» раком молочной железы, или существует непрерывный переход от опухолей с резко положительной характеристикой ER к опухолям, в которых уровень ER практически не определяется. Современные данные свидетельствуют в пользу второго предположения.
При этом к положительным обычно относят опухоли, значение ER для которых находится выше определенного уровня, обычно составляющего 5 фмоль/мг цитоплазматического белка, или 25 фмоль/мг ядерной ДНК.
Наличие эстрогеновых рецепторов характерно для хорошо дифференцированных опухолей (особенно трубчатого, дольчатого, лобулярного или сосочкового типа), а также для опухолей с микроскопическими признаками эластоза. Согласно клиническим наблюдениям, медленно растущие опухоли в основном являются ER-положительными. Первичная опухоль и ее метастазы обладают близкими значениями ER, хотя от положительных опухолей иногда наблюдаются ER-отрицательные метастазы. Обратная картина встречается редко.
Насколько успешно измерения ER позволяют прогнозировать чувствительность опухолей к гормонам? Лишь 5-7% ER-отрицательных опухолей проявляют чувствительность к гормонам. Напротив, гормональной чувствительностью характеризуются 55% ER-положительных опухолей. Хотя больных с такими опухолями можно лечить гормональными препаратами, уровень ER нельзя считать достаточно надежным показателем.
Однако существует клиническая закономерность, выявленная эмпирически: опухоли с высоким значением ER в 90% случаев являются гормонально зависимыми. Наряду с этим показано, что опухоли с высокими значениями PR, более чем в 80% случаев также чувствительны к гормонам.
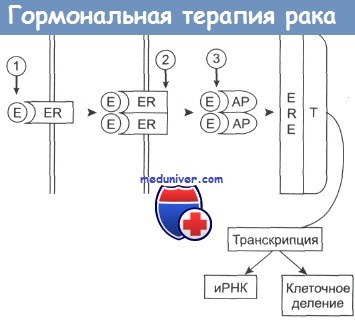
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.
источник
Молочная железа у женщин является гормонозависимым органом. Основными гормонами, которые влияют на ее работу, считаются прогестерон, эстроген и пролактин. В норме эти вещества всегда присутствуют в организме. Когда развивается РМЖ (рак молочных желез), метод лечения определяет то, сохранились ли в груди рецепторы к гормонам. Если да, то действовать на опухоль, угнетая ее рост, можно соответствующими препаратами.
Гормоны – это биологически активные вещества, которые отвечают за деление клеток, нормализацию других жизненно важных процессов. Практически все процессы жизнедеятельности зависят от нормальной выработки этих веществ.
На поверхности всех клеток организма находятся специальные белки, которые получают «сигналы», они называются рецепторами. Если в крови появляется вещество, которое может вступить во взаимодействие с этими белками на поверхности, начинается их соединение. Такие специальные белки считаются самыми чувствительными частицами в организме.
Значение рецепторов эстрогена, прогестерона и НЕR-2 белка в клетках рака молочной железы, и методы их определения
В кровотоке женского организма все время присутствуют:
- Эстрогены – 3 вида
- Прогестероны – 5 видов
Сколько их содержится в данный момент, зависит от того, какой сейчас период менструального цикла. Эти гормоны взаимодействуют со специальными структурами на поверхности клеток молочных желез.
Развитие онкологии подразумевает рост опухоли, клетки которой мутировали – изменились. Некоторые из них полностью преобразовались, в других же остались рецепторы гормонов. Когда к таким клеткам попадает эстроген и прогестерон, они делятся особенно интенсивно, затем проникают в кровь и лимфу. При онкологии это означает появление метастазов.
Рецепторы прогестерона при раке молочной железы, как и эстрогена, являются основанием для назначения гормональной терапии. Цель этого метода лечения – максимально уменьшить действие гормонов на опухоль, тем самым остановив ее рост и деление патогенных клеток.
Чаще всего гормональная терапия назначается после проведения операции по удалению раковой опухоли. Ее цель заключается в перестраховке, чтобы предотвратить губительное действие раковых клеток, которые могли остаться в организме.
Располагаются эти чувствительные частицы во многих частях тела – жировой ткани, лимфоузлах, молочных железах. Все эти ткани имеют подходящую для жизнедеятельности гормонов структуру. Основными функциями эстрогена и прогестерона являются:
- поддержание гормонального баланса в организме
- нормальная работа репродуктивной системы
- регулирование менструального цикла
- поддерживание в нормальном состоянии кожи, волос (их называют «гормонами красоты»)
- поддержание работы центральной нервной системы
- другие
В таблице ниже приведены допустимые показатели нормы прогестерона и эстрогена в разные периоды менструального цикла женщины:
Чтобы определить количество прогестерона и эстрогена, назначается анализ крови. А чтобы определить наличие рецепторов эстрогена и прогестерона при раке молочной железы, требуется иммуногистохимическое исследование. Для его проведения берут кусочек опухоли, заливают в парафин. Затем в лаборатории происходит изучение взятого материала.
Если иммуногистохимическое исследование подтвердило наличие рецепторов половых гормонов на участке груди, пораженном злокачественными процессами, это означает, что необходимо выбирать средства гормонотерапии. В противном случае рост ракового образования будет увеличиваться, появятся метастазы, затрагивающие другие органы.
Однако положительные данные исследования являются не единственным основанием для прогноза на выздоровление. Если стадия рака вторая и выше, появились метастазы, поражены лимфоузлы, успех терапии уменьшается.
Эстроген-рецепторы относятся к группе ядерных, делятся на две формы: α и β. Рецепторы к нему, как и к прогестерону, играют важную роль в формировании злокачественной опухоли. Они представляют собой белковые структуры, которые размещаются по поверхности новообразования.
При естественном выделении новых половых гормонов происходит их соединение и взаимодействием с рецепторами, которые расположены возле раковой опухоли. Последствием становится интенсивное развитие и прогрессирование роста онкологии. По статистике, рецепторы к половым гормонам встречаются в такой частоте:
- 75% — эстроген-позитивные
- 65% — эстроген-позитивные, восприимчивы также к прогестерону
- 10% — эстроген-позитивные, но абсолютно прогестерон-негативные (эстрогенозависимые)
- 5% — прогестерон-позитивные, но абсолютно эстроген-негативные (прогестеронзависимые)
- 25% — не содержат рецепторы, восприимчивые к гормонам
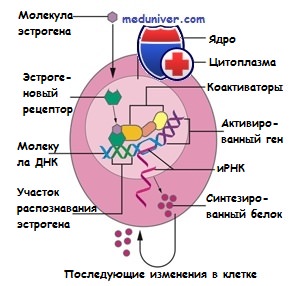
Две формы эстроген-рецептора α и β исследованы по-разному. Функция эстрогена типа β научно полностью не определена. Тип α исследован подробно, относится к группе лиганд-активированных ядерных структур. Принцип действия эстрогена такой:
- проникает в молочную железу и другие ткани
- транспортируется в ядро
- соединяется с эстрогеновыми рецепторами
- взаимодействует с ДНК и клеточными белками
- осуществляет синтез белков
Промотор гена прогестерона содержит в составе частицы, зависимые от эстрогена, поэтому считается, что роль последнего при формировании злокачественных опухолей больше. В связи с этим эстрогенозависимый рак молочной железы встречается чаще, чем прогестеронозависимый. Принцип действия прогестерон-рецепторов аналогичен эстрогеновым. Соединяясь с гормоном, они взаимодействуют, результатом чего оказывается модуляция экспрессии и синтез белков.
Результаты исследований применяются лечащим врачом-онкологом для подбора терапии рака. В основном прогноз на выздоровление положительный, если опухоль оказалась гормонозависимой, определена на ранней стадии, метастазов нет.
Если принимается решение о назначении гормональной терапии, на основании показателей количества рецепторов, определяется ее вид. Выделяют такие основные виды:
- адъювантная – ее продолжительность составляет 5-10 лет, иногда назначается пожизненно
- неоадъювантная – длится 3-6 месяцев, чаще всего применяется перед хирургическим вмешательством
- лечебная – назначается на ранних стадиях онкологии, вместо операции
Чтобы остановить выработку эстрогена и прогестерона и прекратить их соединение с соответствующими рецепторами, назначаются препараты, которые:
- снижают уровень эстрогена
- останавливают взаимодействие с уже имеющимися в организме гормонами
Основными группами таких лекарственных средств являются:
- Модуляторы рецепторов. Изначально применялся Тамоксифен – лекарственный препарат, компоненты которого привязывались к эстрогену, блокируя проникновение к ним самого гормона. Сегодня применяются такие аналоги Тамиксифена, как Ралоксифен, Торемифен.
- Блокаторы рецепторов. Эта группа препаратов направляет свое действие на разрушение рецепторов опухоли. В результате в них не просто не проникает гормон, а они вовсе перестают функционировать. Эффективное средство этой группы – Фаслодекс.
- Ингибиторы ароматазы. Признаны наиболее эффективной группой средств гормонотерапии, которые способствуют не только угнетению рецепторов, но и разрушению раковой опухоли. Одним из наиболее эффективным ингибиторов ароматазы признан Летрозол.
- Прогестины. Обычно назначаются, если препараты предыдущих групп оказались неэффективными. Оказывают мощное действие на выработку гормонов, блокируют рецепторы, но вызывают ряд побочных действий.
Таким образом, определение рецепторов прогестерона и эстрогена является основанием для назначения гормонотерапии. Рак молочной железы – опасное для жизни женщины заболевание, поэтому затягивать с выбором лечения нельзя. После проведения специальных исследований, лечащий врач решает, как будет применяться гормонотерапия – вместо операции или в дополнение к ней.
источник
РП+ — рецептороположительный по рецепторам прогестерона, РП>=10,0 фмоль/мг белка.
РП- — рецептороотрицательный по рецепторам прогестерона, РП РЭ>=10,0 фмоль/мг белка.
РЭ- — рецептороотрицательный по рецепторам эстрогенов, РЭ
Определение цитоплазматических РЭ в опухолевой ткани при РМЖ было предложено в качестве метода оценки гормональной зависимости опухоли и предсказания эффективности эндокринной терапии McGuire W.L. в 1975 г. (119). Дополнительное определение уровня РП повышало точность предсказания эффективности терапии диссеминированного РМЖ (135), кроме того было обнаружено влияние уровней РЭ и РП на прогноз болезни (149, 120, 130, 234).
86% диплоидных опухолей были РЭ+, среди анеуплоидных этот процент был статистически значимо ниже -73% (р 108 фмоль/мг оказался таким же плохим, как и у больных с уровнем РЭ 100 фмоль/мг белка эффект наблюдался в 61% случаев (209). Противоречивые результаты по влиянию уровня РП на эффект тамоксифена у больных диссеминированным РМЖ были получены W.R.Bezwoda с соавт. (73), с одной стороны получены существенные различия в частоте эффекта: при РП- опухолях — 24%, при РП+ — 55%; с другой стороны, при многофакторном анализе оказалось, что только уровень РЭ был существенным показателем, предсказывающим эффект эндокринной терапии.
Может ли быть уровень РЭ или РП показателем, предсказывающим эффективность адъювантной химиотерапии? Этот вопрос был поставлен впервые в 1978 г. Lippman M.E. с соавт. (163), обнаружившими, что у больных диссеминированным РМЖ с РЭ- опухолями эффективность комбинированной химиотерапии выше, чем у больных с РЭ+ опухолями. В 80-х годах ответ был отрицательным и основывался, преимущественно, на том, что частота эффекта химиотерапии при диссеминированном раке больных с РЭ- опухолями и РЭ+ опухолями была одинаковой (132, 141).
Petru E. с соавт. (198) было показано преимущество в выживаемости больных с РЭ+ опухолями, получавших химиотерапию, включающую антрациклины, перед больными с РЭ- опухолями. При проведении неоадъювантной химиотерапии (FAC или эпирубицин + циклофосфан) наибольший непосредственный эффект наблюдался у больных с РП- опухолями, уровень РЭ не имел значения (164).
Проведение адъювантной химиотерапии (FEC) больным, находящимся в менопаузе, оказалось наиболее эффективным у больных с РП- опухолями (183).
10.2. Общий анализ величин РЭ и РП.
Исходный уровень РЭ изучен в первичных опухолях у 1648 больных, исходный уровень РП — в первичных опухолях 1597 больных РМЖ I, II и III стадий. Все больные получали лечение в клиниках ОНЦ РАМН, гистологические исследования производились в лаборатории патоморфологии ОНЦ. Определение уровней РЭ и РП производилось в лаборатории клинической биохимии ОНЦ радиолигандным методом с использованием активированного угля, покрытого декстраном (5). Опухоли, содержащие рецепторы со значениями равными или превышающими 10,0 фмоль/мг белка, расценивались как рецептороположительные, а опухоли с уровнем рецепторов от 0 до 9,9 фмоль/мг белка расценивались как рецептороотрицательные.
Таблица 16. Влияние репродуктивного статуса на уровень РЭ.
Средний уровень РЭ в фмоль/мг белка (M+\-m)
Диапазон РЭ в фмоль/мг белка
Данные о средних уровнях РЭ, диапазоне колебаний величин РЭ и частоте рецепторонегативных опухолей в зависимости от репродуктивного статуса больных представлены в таблице 16. У больных, находящихся в естественной менопаузе, средний уровень РЭ статистически значимо выше, чем у больных репродуктивного периода (р
Средний уровень РЭ в фмоль/мг белка (M+\-m)
Фолликулиновая фаза (2-10 дни)
Таблица 18. Влияние репродуктивного статуса на уровень РП.
Средний уровень РП в фмоль/мг белка (M+\-m)
Диапазон РП в фмоль/мг белка
Данные о средних уровнях РП, диапазоне колебаний величин РП и частоте рецепторонегативных опухолей в зависимости от репродуктивного статуса больных представлены в таблице 18. У больных, находящихся в естественной менопаузе, средний уровень РП статистически значимо ниже, чем у больных репродуктивного периода (р
Средний уровень РП в фмоль/мг белка (M+\-m)
Фолликулиновая фаза (2-10 дни)
Таблица 20. Влияние времени года в момент операции на уровень РЭ у больных репродуктивного периода.
Средний уровень РЭ в фмоль/мг белка (М*+/-m)
Частота РЭ- опухолей в процентах
Примечание: * — статистически значимы различия средних величин при сравнении 1 и 3 (р
Средний уровень РЭ в фмоль/мг белка (М+/-m)
Частота РЭ- опухолей в процентах
Примечание: статистически значимы различия средних величин при сравнении 3 и 4 (р
Средний уровень РП в фмоль/мг белка(М+/-m)
Частота РП- опухолей в процентах
Примечание: различия статистически не значимы.
Таблица 23. Влияние времени года в момент операции на уровень РП у больных, находящихся в естественной менопаузе.
Средний уровень РП в фмоль/мг белка(М+/-m)
Частота РП- опухолей в процентах
Примечание: различия статистически не значимы.
Средние величины уровней РП не зависели от времени года как у больных репродуктивного периода, так и у больных, находящихся в менопаузе (смотри таблицы 22 и 23).
В таблицах 24 и 25 приведены средние величины уровней РЭ в зависимости от вариаций критерия “Т” у больных репродуктивного периода и у больных, находящихся в естественной менопаузе, соответственно. Статистически значимых различий средних уровней РЭ в зависимости от значений “Т” не обнаружено ни у больных репродуктивного периода, ни у больных в менопаузе, хотя прослеживаются тенденции к снижению средних величин РЭ и к повышению частоты РЭ- опухолей с нарастанием показателя “Т” от Т1а к Т4.
Таблица 24. Уровень РЭ в зависимости от показателя “Т” у больных репродуктивного периода.
Средний уровень РЭ в фмоль/мг белка (М+/-m)
Таблица 25. Уровень РЭ в зависимости от показателя “Т” у больных, находящихся в менопаузе.
Средний уровень РЭ в фмоль/мг белка (М+/-m)
Средние величины уровней РП в зависимости от вариаций критерия “Т” у больных репродуктивного периода и у больных, находящихся в естественной менопаузе представлены в таблицах 26 и 27 соответственно. Прослеживаются тенденции к снижению средних величин РП и повышению частоты РП- опухолей с нарастанием показателя “Т” от Т1с к Т4, различия средних величин РП у больных, имеющих Т1с и Т2, статистически значимы как у больных репродуктивного периода, так и у больных, находящихся в менопаузе.
Таблица 26. Уровень РП в зависимости от показателя “Т” у больных репродуктивного периода.
Средний уровень РП в фмоль/мг белка (М+/-m)
Таблица 27. Уровень РП в зависимости от показателя “Т” у больных, находящихся в менопаузе.
Средний уровень РП в фмоль/мг белка (М+/-m)
Анализу возможных связей между критерием N и уровнями РЭ и РП посвящены таблицы 28 и 29. Очевидна тенденция к снижению средних уровней РЭ и к повышению частоты РЭ- опухолей с повышением показателя “N” от “N0” до “N2”, эта тенденция прослеживается как у больных репродуктивного периода, так и у больных, находящихся в менопаузе. У больных репродуктивного периода с N2 средний уровень РЭ статистически значимо ниже, чем таковые у больных с N0 и N1, р
Средний уровень РЭ в фмоль/мг белка (М+/-m)
Прослеживается также тенденция к снижению средних уровней РП и к повышению частоты РП-негативных опухолей с повышением показателя “N” от “N0” до “N2”, эта тенденция прослеживается как у больных репродуктивного периода, так и у больных, находящихся в менопаузе. У больных, находящихся в менопаузе с N2, средний уровень РП статистически значимо ниже, чем таковые у больных с N0 и N1, р
Средний уровень РП в фмоль/мг белка (М+/-m)
Гистологическая форма инвазивного рака незначительно влияет на уровень РЭ в опухоли, отсутствуют статистически значимые различия при сравнении средних уровней РЭ между самыми частыми формами РМЖ —
Таблица 30. Уровень РЭ в зависимости от гистологической формы рака.
Средний уровень РЭ в фмоль/мг белка (М+/-m)
протоковым и дольковым (смотри таблицу 30). В то же время для медуллярного рака характерны пониженное среднее значение уровня РЭ и высокая частота РЭ- опухолей, по сравнению со всеми другими гистологическими формами РМЖ, р
Средний уровень РП в фмоль/мг белка (М+/-m)
Для долькового рака характерны более высокие средние величины РП чем для протокового рака, слизистого рака и медуллярного рака (р
Средний уровень РЭ в фмоль/мг белка (М+/-m)
Рассмотрим влияние степени злокачественности протокового рака на величины уровней РЭ, (смотри таблицу 32). Можно отметить низкие уровни РЭ и высокую частоту РЭ- опухолей при раке 3 степени злокачественности, различия статистически значимы при сравнении со средними уровнями РЭ при раке 1 степени злокачественности и при раке 2 степени злокачественности (p
Средний уровень РП в фмоль/мг белка (М+/-m)
Средние величины РП существенно варьируют в зависимости от степени злокачественности протокового инвазивного рака (смотри таблицу 33). Можно отметить низкие уровни РП и высокую частоту РП- опухолей при раке 3 степени злокачественности, различия статистически значимы при сравнении со средними уровнями РП при раке 1 степени злокачественности и при раке 2 степени злокачественности (p
Средний уровень РЭ в фмоль/мг белка (М+/-m)
Примечание: различия статистически не значимы.
Таблица 35. Уровень РП в зависимости от наличия опухолевых клеток в кровеносных и/или лимфатических сосудах при инфильтративном раке (с исключением редких форм рака).
Средний уровень РП в фмоль/мг белка (М+/-m)
Примечание: различия статистически не значимы.
Как можно видеть из таблицы 36, для анеуплоидных не тетраплоидных опухолей характерно относительно низкое среднее содержание РЭ и относительно высокая частота РЭ- опухолей. Сходные тенденции касаются так же и уровней РП, однако различия средних величин РП в зависимости от плоидности опухоли статистически не значимы (смотри таблицу 37).
Таблица 36. Влияние плоидности опухоли на уровень РЭ.
Средний уровень РЭ в фмоль/мг белка(М+/-m)
Частота РЭ- опухолей в процентах
Примечание: статистически значимы различия средних величин при сравнении 1 и 3 (р
Средний уровень РП в фмоль/мг белка(М+/-m)
Частота РП- опухолей в процентах
3. Анеуплоидные не тетраплоидные
Примечание: различия статистически не значимы.
Грубое сравнение БРВ и ОВ всех больных РМЖ I — III стадий в зависимости от уровней РЭ представлено на графиках 139 и 140. Больные с РЭ+
опухолями имеют некоторое преимущество по отдалённым результатам перед больными с РЭ- опухолями. Несмотря на большое количество больных в сравниваемых группах (675 с РЭ- опухолями и 973 с РЭ+ опухолями), различия БРВ находятся на пределе достоверности (р=0,04921), различия ОВ более убедительны (р=0,02494). Аналогичное сравнение в зависимости от наличия или отсутствия РП в опухоли говорит о более достоверных преимуществах у больных с РП+ опухолями перед больными с РП- опухолями как по БРВ (р=0,000029), так и по ОВ (р=0,00774, смотри графики 141 и 142).
При делении всего массива больных с изученными РЭ и РП в зависимости от наличия или отсутствия рецепторов, получили 4 группы больных: 1) с РЭ-РП- опухолями — 398 больных, 2) с РЭ-РП+ опухолями — 242 больных, 3) с РЭ+РП- опухолями — 345 больных, 4) с РЭ+РП+ опухолями — 588 больных.
Показатели БРВ (график 143) были наилучшими в 4 группе больных, наихудшими — в 1 группе, максимальные различия БРВ наблюдались между этими двумя группами (р=0,00023). Кроме того, статистически значимые различия БРВ наблюдались при сравнении следующих пар групп: 1 и 2 (р=0,00427), 2 и 3 (0,03174), 3 и 4 (0,006064), то есть между группами, различающимися между собой по содержанию РП. Различия БРВ между группами, отличающимися между собой только по уровню РЭ, а именно между 1 и 3 (р=0,4052), между 2 и 4 (0,9726) были менее выражены и не были статистически значимы.
Сравнение ОВ между этими группами (график 144) показало, что выживаемость была максимальной у больных 4 группы и минимальной у больных 1 группы, различия статистически значимы, р=0,002995. Показатели ОВ 2 и 3 группы имели промежуточные значения и не отличались статистически значимо от ОВ других групп.
адъювантной системной терапии.
10.4.1. Прогностическое значение уровня РЭ.
Для оценки влияния уровня РЭ в опухоли на течение болезни сравним показатели БРВ и В больных с различными уровнями РЭ при РМЖ T1-2N0M0 и с различными гистологическими формами, не получавших никакой адъювантной терапии. Количество больных в анализируемых группах представлено на графиках 145 и 146.
Кривые БРВ и ОВ больных с РЭ- опухолями и с РЭ+ опухолями проходят идентично, не имея статистически значимых различий. Таким образом, очевидно отсутствие самостоятельного влияния уровня РЭ в опухоли на сроки появления метастазов и сроки смерти больных, эта закономерность воспроизводилась при анализе БРВ и ОВ как среди больных репродуктивного периода, так и среди больных, находящихся в менопаузе.
Однако, не исключена возможность отсутствия такой закономерности при различных гистологических формах РМЖ. С другой стороны, может оказаться значимой для прогноза болезни другая граница уровня РЭ, отличная от принятой (10,0 фмоль/мг белка). Проведем анализ БРВ и ОВ больных РМЖ T1-2N0M0, не получавших никакой адъювантной терапии, в группах с различными гистологическими формами и с более детальным дроблением по уровням РЭ в тех случаях, где число больных позволяет это сделать.
При протоковом раке, самой частой гистологической форме РМЖ, можно видеть, что кривые БРВ и ОВ больных с различными уровнями РЭ в опухоли располагаются в пределах статистической ошибки друг от друга, то есть, течение болезни у пациенток, имеющих уровень РЭ от 0 до 9,9 фмоль/мг, не отличается от течения болезни у пациенток с опухолями, уровень РЭ у которых, например, превышает 100 фмоль/мг (смотри графики 147 и 148). Отсутствуют статистически значимые различия между всеми сравниваемыми группами больных и при анализе с помощью показателя log rank.
Аналогичное отсутствие зависимости БРВ и ОВ от уровней РЭ, наблюдается при дольковом раке (различия показателей БРВ и ОВ статистически не значимы, графики 149 и 150).
Только для таких редких форм РМЖ как слизистый, папиллярный и тубулярный характерна тенденция к повышению показателей БРВ и ОВ в группе пациенток, имеющих РЭ+ опухоли, по сравнению с группой больных, имеющих РЭ- опухоли, однако различия статистически не значимы (смотри графики 151 и 152).
Для медуллярного рака характерна обратная тенденция (смотри графики 153 и 154), самые высокие показатели БРВ и ОВ наблюдались у больных с РЭ- опухолями.
Относительно небольшая группа больных РМЖ T1-4N1-2M0 по разным причинам (отказ больной, отсутствие препарата по месту жительства, рекомендации других врачей, предпочтение нетрадиционных методов лечения и т.д.) не получала адъювантной системной терапии. Течение болезни по показателям БРВ и ОВ у этих больных в зависимости от уровней РЭ при градациях: РЭ=0 фмоль/мг (20 больных), РЭ 0,1 — 9,9 фмоль/мг (26 больных) и РЭ>= 10,0 фмоль/мг (54 больных) характеризуют графики 155 и 156. Отсутствуют статистически значимые различия между всеми сравниваемыми группами как по показателям БРВ, так и по ОВ, хотя тенденция к ухудшению течения болезни у больных с РЭ=0 довольно выражена.
10.4.2. Прогностическое значение уровня РП.
БРВ и ОВ больных РМЖ T1-2N0M0 не получавших системной терапии существенно отличаются в зависимости от уровня РП: у больных с РП+ опухолями эти показатели статистически значимо выше, чем у больных с РП- опухолями (смотри графики 157 и 158). В целом, за все время наблюдений в последней группе больных рецидив болезни наблюдался в 1,3 раза чаще, чем в первой.
Рассмотрим, как эта закономерность воспроизводится при различных морфологических формах рака и имеет ли прогностическое значение более точный учет уровня РП.
При протоковом раке кривая БРВ больных с РП-опухолями проходит заметно ниже кривых БРВ больных с РП+ опухолями, различия статистически значимы при сравнении групп больных с РП- опухолями с одной стороны, и больных с РП+ опухолями, имеющими уровень РП от 10,0 до 19,9 фмоль/мг, с другой (р=0,03532). Статистически значимых различий БРВ и ОВ между группами больных, имеющих РП+ опухоли со стратификацией уровней РП (10, 0 -19,9; 20,0-29,9; 30,0-49,9; 50,0-99,9 и >=100,0 фмоль/мг белка), не наблюдалось (смотри графики 159 и 160). При дополнительном анализе не получено также различий показателей БРВ и ОВ между группами больных, имевших уровень РП=0 и уровень РП, находящийся в интервале 0,1-9,9 фмоль/мг белка.
Меньшее количество больных дольковым раком не позволяет провести столь же подробный анализ, как это сделано для больных с протоковым
раком, однако очевидна тенденция (смотри графики 161 и 162) к более высоким показателям БРВ и ОВ больных с РП+ опухолями по сравнению с больными, имеющими РП- опухоли.
Для медуллярного рака характерны обратные тенденции: группа больных с РП- опухолями отличается лучшими показателями БРВ и ОВ по сравнению с группой больных с РП+ опухолями, однако различия не значимы статистически (смотри графики 163 и 164).
У больных с другими редкими формами рака (слизистом, папиллярном и тубулярном) сохраняются общие закономерности влияния уровня РП на результаты лечения: БРВ и ОВ лучше в группе больных с РП+ опухолями (смотри графики 165 и 166).
Среди больных, имевших местно-регионарное распространение болезни T1-4N1-2M0 и не получавших адъювантной системной терапии, влияние уровней РП на течение болезни имеет характер тенденции (смотри графики 167 и 168). Больные с уровнем РП>=10,0 фмоль/мг имеют лучшие
показатели БРВ и ОВ, однако различия статистически не значимы.
10.4.3.Сочетанное использование уровней РЭ и РП для прогноза.
Все больные РМЖ T1-2N0M0 были разбиты на 4 группы в зависимости от уровней РЭ и РП: 1) РЭ-РП-, 2) РЭ-РП+, 3) РЭ+РП- и 4) РЭ+РП+. Показатели БРВ и ОВ оказались идентичными в сравниваемых парах: в 1 и 3 группах, во 2 и 4 группах, и зависели только от уровня РП: у больных с РП+ опухолями они были выше, чем у больных с РП- опухолями (смотри графики 169 и 170). Статистически значимые различия показателей БРВ наблюдались при их сравнении больных 1-й группы с больными 2-й группы (р=0,03491) и 2-й группы с 3-й группой (р=0,0183). При сравнении показателей ОВ статистически значимые различия были получены между 1-й и 2-й группами (р=0,02914) и между 1-й и 4-й группами больных (р=0,03217).
Для удобства восприятия мы повторно приводим здесь рисунок 3. Как видно из рисунка, в условиях отсутствия адъювантной терапии значимость уровня РЭ всё-таки не равна нулю, хотя она и существенно ниже, чем значимость уровня РП и других факторов прогноза.
10.5. Прогностическое значение уровней РЭ и РП при проведении адъювантной эндокринной терапии.
Прогностическое значение уровней РЭ и РП при проведении адъювантной эндокринной терапии оценивалось путём сравнения показателей БРВ и ОВ больных РМЖ T1-4N1-2M0, получавших тамоксифен (нолвадекс, зитазониум) по 20 мг в сутки в течение 2 лет в качестве самостоятельного вида адъювантной терапии. Больным репродуктивного периода эндокринная терапия начиналась с тубоварэктомии или лучевого подавления функции яичников. Из данного анализа исключались больные, получавшие помимо тамоксифена какую-либо ещё системную терапию.
10.5.1. Прогностическое значение уровня РЭ.
На графиках 171 и 172 представлены кривые БРВ и ОВ больных с местно-регионарным распространением РМЖ (T1-4N1-2M0+T3-4N0M0),
получавших эндокринную терапию тамоксифеном, в зависимости от уровня РЭ в первичной опухоли, в сравнении с группой больных, не получавших никакой адъювантной системной терапии. Градации уровня РЭ и количество больных в группах приведены на графиках.
У больных, получавших эндокринную терапию и имевших РЭ- опухоли (РЭ 0 — 9,9 фмоль/мг, 1 группа), показатели БРВ и ОВ совпадают с таковыми группы больных, не получавших адъювантной системной терапии (4 группа). Группа больных с уровнем РЭ от 10,0 до 99,9 фмоль/мг (2 группа) и группа больных с уровнем РЭ более 100 фмоль/мг (3 группа) имели более высокие показатели БРВ и ОВ по сравнению с больными 1 и 4 групп, однако различия статистически не значимы.
При подсчёте частоты рецидива болезни за всё время наблюдений оказалось, что у больных 1-й группы она была ниже в 1,1 раза, во 2-й группе — в 1,8 раза, в 3-й группе — в 2,0 раза по сравнению с 4-й группой больных. Частота смерти в 1-й группе была ниже в 1,3 раза, во 2-й группе — в 1,8 раза, в 3-й группе — в 2,6 раза.
Рассмотрим, насколько эти тенденции воспроизводятся среди больных с различным репродуктивным статусом. Сравнение течения болезни у больных c местно-регионарным распространением опухоли (T1-4N1-2M0 + T3-4N0M0) репродуктивного периода представлено на графиках 173 и 174. 1-ю группу составили 26 больных с РЭ + опухолями, не получавших никакой адъювантной терапии; 2-ю группу — 22 больные с РЭ + опухолями, получавшие тубоварэктомию или лучевое подавление функции яичников + тамоксифен. У больных, получавших эндокринную терапию отмечается выраженная тенденция к более высоким значениям, однако различия
статистически не значимы. Частота рецидива во второй группе наблюдалась в 2,5 раза реже, чем в первой группе.
У больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в естественной менопаузе возможно проведение сравнения при РЭ- опухолях и РЭ+ опухолях. Среди больных, имевших РЭ- опухоли, и леченных тамоксифеном, не отмечено повышения БРВ и ОВ по сравнению с больными, не получавшими никакой адъювантной системной терапии (смотри графики 175 и 176).
Напротив, у больных с РЭ+ опухолями применение тамоксифена сопровождалось тенденцией к повышению показателей БРВ и ОВ, снижением частоты рецидивов болезни в 1,6 раза и снижением смертей в 1,7 раза по сравнению с больными, имевшими РЭ+ опухоли и не получавшими адъювантной системной терапии (смотри графики 177 и 178).
10.5.2. Прогностическое значение уровня РП.
В зависимости от уровня РП больные РМЖ T1-4N1-2M0, получавшие тамоксифен, были разделены на 4 группы: 1) РП=0 фмоль/мг — 11 больных, 2) РП 0,1-9,9 фмоль/мг — 21 больная, 3) РП 10,0 — 99,9 фмоль/мг — 59 больных, 4) РП>=100,0 фмоль/мг — 15 больных. Пятую группу составили 102 больные с различными уровнями РП, не получавшие никакой адъювантной системной терапии.
По сравнению с 5-й группой больных у больных 1 группы отмечена тенденция к ухудшению показателей БРВ и ОВ, во 2-й, и 3-й группах наблюдалась тенденция к улучшению показателей БРВ и ОВ, в 4-й группе наблюдалось статистически значимое повышение БРВ (р=0,04395) и тенденция к повышению показателей ОВ (смотри графики 179 и 180).
Частота рецидива болезни за всё время наблюдений в 1-й группе не имела тенденции к снижению, во 2-й группе она была ниже в 1,6 раза, в 3-й — ниже в 1,7 раза и в 4-й — 2,6 раза чем у больных 5-й группы. По сравнению с 5-й группой больных частота смерти в 1-й группе была выше в 1,4 раза, во 2-й группе — в 3,2 раза ниже, в 3-й — в 1,9 раза ниже, в 4-й — в 2,5 раза ниже.
У больных репродуктивного периода с распространением опухоли, соответствующим T1-4N1-2M0 + T3-4N0M0, и РП+ статусом проведение эндокринной терапии, включающей тамоксифен, сопровождалось выраженным повышением показателей БРВ и ОВ (графики 181 и 182), снижением частоты рецидива болезни в 3,4 раза по сравнению с больными, не получавшими адъювантной системной терапии.
В группе больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в менопаузе и имевших РП- опухоли, применение тамоксифена не приводило к закономерным преимуществам в БРВ или ОВ больных по сравнению с группой больных, не получавших адъювантной системной терапии (графики 183 и 184).
У больных с РП+ опухолями приём тамоксифена давал заметную тенденцию к повышению БРВ и ОВ по сравнению с больными без системной терапии (графики 185 и 186), частота рецидива в первой группе была ниже в 1,6 раза, а смерти — в 1,9 раза по сравнению со второй группой больных.
10.5.3. Сочетанное использование уровней РЭ и РП для прогноза.
Число больных РМЖ T1-4N1-2M0, получавших тамоксифен и имевших уровень РЭ в диапазоне от 0 до 9,9 фмоль/мг, — невелико (19), поэтому оценить эффективность терапии тамоксифеном у больных с различными уровнями РП при РЭ- опухолях не представляется возможным.
У 94 больных РМЖ T1-4N1-2M0, которые получали тамоксифен, и имели РЭ+ опухоли, изучен уровень РП и возможен анализ его влияния на эффективность эндокринной адъювантной терапии. Из этого числа 10 больных имели уровень РП=0 фмоль/мг (1 группа), 16 больных — уровень РП 0,1 — 9,9 фмоль/мг (2 группа), 55 больных — уровень РП 10,0 — 99,9 фмоль/мг (3 группа) и 13 больных — уровень РП>=100,0 фмоль/мг (4 группа). Пятую группу составили 52 больные с РЭ+ опухолями и любыми уровнями РП, не получавшие никакой адъювантной системной терапии (смотри графики 187 и 188).
В 1-й группе больных наблюдалась тенденция к более низким показателям БРВ и ОВ по сравнению с больными 5-й группы, по сравнению с последними, у больных 2-й, 3-й и 4-й групп отмечались тенденции к более высоким значениям БРВ и ОВ, хотя различия не были статистически значимы.
Частота рецидива болезни в 1-й и в 5-й группах была идентична, во 2-й группе — в 1,9 раза ниже, в 3-й — в 1,7 раза ниже, в 4-й — в 3,2 раза ниже, чем в 5-й. По сравнению с частотой смерти в 5-й группе частота смерти в 1-й группе была в 1,2 раза выше, во 2-й группе — в 5,5 раза ниже, в 3-й группе — 2,1 раза ниже, в 4-й — в 2,2 раза ниже.
Сравнение течения болезни у больных c местно-регионарным распространением опухоли (T1-4N1-2M0 + T3-4N0M0) репродуктивного периода представлено на графиках 189 и 190. 1-ю группу составили 48 больных, со всеми уровнями РЭ и РП, не получавшими адъювантной системной терапии. 2-я группа представлена 15 больными с РЭ+РП+ опухолями.
Проведение эндокринной терапии, включавшей тамоксифен, приводило к статистически значимому повышению БРВ и выраженной тенденции к повышению ОВ и снижению частоты рецидивов болезни в 3,7 раза у больных 2-й группы по сравнению с больными 1-й группы.
У больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в естественной менопаузе, проведение адъювантной терапии тамоксифеном при РЭ+РП- опухолях сопровождается тенденциями к минимальному повышению показателей БРВ и ОВ по сравнению с больными, не получающими никакой адъювантной системной терапии (смотри графики 191 и 192). При РЭ+РП+ опухолях применение тамоксифена даёт тенденции к более высоким показателям БРВ и ОВ по сравнению с больными, не получающими никакой адъювантной системной терапии (различия статистически не значимы); частота рецидива болезни в этом случае снижается в 1,6 раза, а смерти — в 1,8 раза у первых по сравнению со вторыми.
Влияние уровней РЭ и РП на эффективность адъювантной химиотерапии оценивалось путём сравнения БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 или в более однородном массиве больных РМЖ T1-2N1M0 с различными уровнями РЭ и РП. Сравнивались, с одной стороны — показатели больных, получавших химиотерапию по схеме CMF, или показатели больных, получавших все анализируемые виды химиотерапии (монохимиотерапия тиофосфамидом или комбинированная химиотерапия по схеме CMF или по схемам, включающим доксорубицин) с интенсивностью дозы за 6 месяцев после операции не менее 1/2 от расчётной и не получавших эндокринной терапии; с другой стороны, — не получавших никакой адъювантной системной терапии.
10.6.1. Прогностическое значение уровня РЭ.
На графиках 193 и 194 представлено сравнение показателей БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода c РЭ- опухолями. Проведение адъювантной химиотерапии по схеме CMF привело к незначительному повышению БРВ (но не ОВ) больных по сравнению с аналогичными показателями больных, не получавших системной адъювантной терапии, различия статистически не значимы.
Проведение химиотерапии всех анализируемых видов больным РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода c РЭ- опухолями также сопровождалось тенденцией к повышению показателей БРВ, но не ОВ по сравнению с больными, не получавшими адъювантной системной терапии (смотри графики 195 и 196).
У больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода c РЭ+ опухолями в данном сравнении проведение химиотерапии по схеме
CMF не приводило к улучшению показателей БРВ и ОВ (смотри графики 197 и 198). Проведение химиотерапии всех анализируемых видов у этой категории больных не давало преимуществ в БРВ и ОВ по сравнению с больными, не получавшими никакой адъювантной терапии (смотри графики 199 и 200).
У больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в менопаузе, c РЭ- опухолями химиотерапия всех анализируемых видов не давала даже тенденции к улучшению БРВ, но сопровождалась некоторым повышением ОВ по сравнению с больными, не получавшими никакой адъювантной терапии (смотри графики 201 и 202).
При РМЖ T1-2N1M0 проведение химиотерапии по схеме CMF сопровождалось отчётливой тенденцией к повышению показателей БРВ и ОВ только у больных с РЭ+ опухолями по сравнению с больными, не получавшими адъювантного лечения (графики 203 и 204), в то время как у больных
с РЭ- опухолями различий показателей БРВ и ОВ в зависимости от проведения химиотерапии не наблюдалось (смотри графики 205 и 206).
10.6.2. Прогностическое значение уровня РП .
При сравнении показателей БРВ и ОВ больных РМЖ T1-4N0M0 + T3-4N0M0 репродуктивного периода c РП- опухолями проведение адъювантной химиотерапии по схеме CMF привело к незначительному повышению БРВ (но не ОВ) больных по сравнению с показателями БРВ больных, не получавших системной адъювантной терапии, различия статистически не значимы (смотри графики 207 и 208).
У больных РМЖ T1-4N0M0 + T3-4N0M0 репродуктивного периода c РП+ опухолями в данном сравнении проведение химиотерапии по всем анализируемым схемам не приводило к улучшению показателей БРВ и ОВ (смотри графики 209 и 210), в то время как у больных с РП- опухолями отмечалось повышение показателей БРВ (но не ОВ) по сравнению с больными, не получавшими адъювантной терапии (смотри графики 211 и 212).
У больных, находящихся в менопаузе, при степени распространенности болезни, соответствующей T1-4N1-2M0 + T3-4N0M0, и РП- статусе опухоли проведение химиотерапии (по всем анализируемым схемам) не сопровождалось даже тенденцией к повышению показателей БРВ и ОВ по сравнению с больными, не получавшими адъювантной терапии (смотри графики 213 и 214).
Напротив, при РМЖ T1-2N1M0 проведение химиотерапии по схеме CMF у больных с РП+ опухолями сопровождалось более высокими показателями БРВ и ОВ по сравнению с больными, не получавшими адъювантной системной терапии (смотри графики 215 и 216).
У больных с РП- опухолями химиотерапия не улучшала результаты лечения (смотри графики 217 и 218).
10.6.3. Сочетанное использование уровней РЭ и РП для прогноза.
На графиках 219 и 220 представлено сравнение показателей БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода в трёх группах: 1) со всеми уровнями РЭ и РП и отсутствием адъювантной системной терапии (48 больных), 2) с РЭ-РП- опухолями, получавшие химиотерапию по схеме CMF (16 больных), 3) с РЭ+РП+ опухолями, получавшие химиотерапию по схеме CMF (10 больных). Во 2-й группе больных не отмечено тенденций к повышению показателей БРВ и ОВ по сравнению с показателями 1-й группы больных. У больных 3-й группы наблюдалась тенденция к более высоким значениям БРВ по сравнению с больными 1-й группы, различия статистически не значимы.
Под химиоэндокринной терапией в настоящем анализе понималось сочетанное применение в послеоперационном периоде химиотерапии (монохимиотерапия тиофосфамидом или комбинированная химиотерапия по схеме CMF или по схемам, включающим доксорубицин) с интенсивностью дозы за 6 месяцев после операции не менее 1/2 от расчётной в сочетании с 2-летним приёмом тамоксифена по 20 мг в сутки, у больных репродуктивного периода адъювантная эндокринная терапия начиналась с оперативного удаления яичников или лучевого подавления их функции.
Влияние уровней РЭ и РП на эффективность адъювантной химиоэндокринной терапии оценивалось путём сравнения БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 с различными уровнями РЭ и РП. Сравнивались показатели больных, получавших химио-эндокринную терапию с показателями больных: а) не получавших никакой адъювантной системной терапии, b) получавших химиотерапию, с) получавших эндокринную терапию.
10.7.1. Прогностическое значение уровня РЭ.
На графиках 221 и 222 представлено сравнение показателей БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода c РЭ+ опухолями. 26 больных 1-й группы не получали адъювантной системной терапии, больные 2-й группы (22) получали только эндокринную терапию, больные 3-й группы (26) получали только химиотерапию и больным 4-й группы (15) проводилась химиоэндокринная терапия. В последней группе больных наблюдались наилучшие показатели БРВ, показатели ОВ были лучшими у больных 2-й и 4-й групп, однако все различия статистически не значимы.
У больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в менопаузе и имевших РЭ+ опухоли, число больных позволяет сравнивать 3 группы: 1) без адъювантной системной терапии (32 больные), 2) получавших только эндокринную терапия тамоксифеном (82 больные) и 3) получавших химиоэндокринную терапию (22 больные). Самые высокие показатели БРВ наблюдались у больных, получавших химиоэндокринную терапию, различия не были статистически значимыми (смотри графики 223 и 224). Показатели ОВ между группами различались незначительно.
10.7.2. Прогностическое значение уровня РП.
На графиках 225 и 226 представлено сравнение показателей БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода c РП+ опухолями. Больные 1-й группы (19) не получали адъювантной системной терапии, больные 2-й группы (18) получали только эндокринную терапию, больные 3-й группы (18) получали только химиотерапию по схеме CMF и больным 4-й группы (10) проводилась химиоэндокринная терапия, причём химиотерапия проводилась только по схеме CMF. У больных последней группы отмечена тенденция к улучшению БРВ (но не ОВ) по сравнению с больными 1-й группы, лучшими были показатели БРВ и ОВ у больных 2-й группы, однако различия не были статистически значимы.
Аналогичное сравнение БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода c РП+ опухолями со всеми анализируемыми видами химиотерапии демонстрируют графики 227 и 228. Группы 1 и 2 повторяют такие же группы предыдущей пары графиков, 3-ю группу составили 30 больных, получавших только химиотерапию по всем анализируемым схемам, 4-ю группу — больные, получавшие химиоэндокринное лечение, причём химиотерапия проводилась по всем анализируемым схемам (12 больных). БРВ и ОВ больных 4-й группы имели тенденцию к повышению по сравнению с БРВ и ОВ больных 1-й и 3-й групп, различия не были статистически значимы.
У больных, находящихся в менопаузе при степени распространенности болезни, соответствующей T1-4N1-2M0 + T3-4N0M0 и имевших РП- опухоли, проведение химиоэндокринного лечения (химиотерапия проводилась по всем анализируемым схемам), так же, как и других видов адъювантной терапии, не приводило к повышению показателей БРВ и ОВ (смотри графики 229 и 230).
Адъювантная химиоэндокринная терапия (химиотерапия проводилась по всем анализируемым схемам), больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в менопаузе, с РП+ опухолями приводит к более высоким показателям БРВ и ОВ по сравнению с больными, не получавшими адъювантной терапии или получавшими только эндокринную терапию тамоксифеном (смотри графики 231 и 232, различия статистически не значимы).
10.7.3. Сочетанное использование уровней РЭ и РП для прогноза.
На графиках 233 и 234 представлено сравнение показателей БРВ и ОВ больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в менопаузе. Проведение химиоэндокринной терапии (химиотерапия проводилась по всем анализируемым схемам) у больных с РЭ+РП+ опухолями имело преимущество по показателям БРВ и ОВ как по сравнению с больными, получав шими только эндокринную терапию, так и по сравнению с больными, не получавшими никакой адъювантной терапии (различия статистически не значимы).
В целом, при проведении адъювантной системной терапии прогностическое значение уровней РЭ и РП резко возрастает. Для удобства восприятия мы повторно приводим здесь рисунок 4. Как видно из рисунка, в условиях проведения адъювантной терапии значимость уровня РЭ уже превышает значимость гистологической формы, а значимость уровня РП приближается к значимости таких сильных факторов прогноза как число поражённых лимфатических узлов, показатели “N” и ”T” (по сравнению с относительно слабыми прогностическими значениями уровней РЭ и РП при отсутствии адъювантной терапии, смотри рисунок 3).
Для долькового рака характерен больший средний уровень РП и большая частота РП+ опухолей, чем для протокового рака.
Для медуллярного рака характерны самые низкие средние величины РЭ и РП и самые высокие частоты РЭ- и РП- опухолей по сравнению с другими морфологическими формами РМЖ.
При протоковом раке 3 степени злокачественности наблюдаются меньшие средние величины РЭ и РП и большая частота РЭ- и РП- опухолей, чем при протоковом раке 1 или 2 степеней злокачественности.
Уровень РЭ не является фактором прогноза у больных, не получающих адъювантной системной терапии.
Уровень РП в опухоли — слабый фактор прогноза, у больных с РП- опухолями риск развития рецидива болезни в 1,3 раза выше, чем у больных с РП+ опухолями при отсутствии адъювантной системной терапии, 10,0 фмоль/мг — адекватная граница рецепторопозитивности. У больных РМЖ с медуллярной морфологической формой наблюдается тенденция к обратным соотношениям: при РП- опухолях рецидив болезни наблюдается реже, чем при РП+ опухолях.
В условиях проведения адъювантной системной терапии прогностическое значение уровней РЭ и РП резко возрастает. Эндокринная терапия с применением тамоксифена больных РМЖ T1-4N1-2M0 + T3-4N0M0 сопровождается выраженной тенденцией к повышению показателей БРВ и ОВ больных с РЭ+ опухолями, у больных с РЭ- опухолями такая тенденция отсутствует. Эндокринное лечение больных РМЖ T1-4N1-2M0 + T3-4N0M0 с уровнями РП 0,1- 9,9 фмоль/мг белка и 10,0- 99,9 фмоль/мг белка сопровождается тенденциями к повышению показателей БРВ, при уровне РП>= 100,0 фмоль/мг белка наблюдается статистически значимое повышение БРВ, у больных с уровнем РП=0 отмечается тенденция к понижению БРВ по сравнению с больными, не получавшими адъювантной системной терапии и имевшими все уровни РП.
Сочетанное изучение уровней РЭ и РП показывает, что группа больных РМЖ T1-4N1-2M0 + T3-4N0M0 с РЭ+ опухолями неоднородна по реакции на эндокринную терапию, включающую тамоксифен: у больных с уровнем РП=0 отсутствует тенденция к повышению БРВ, у больных с уровнями РП 0,1- 9,9; 10,0- 99,9 и >= 100,0 фмоль/мг белка имеются тенденции к улучшению БРВ и ОВ, причём тенденции к улучшению тем больше, чем выше уровень РП. У больных с РЭ+РП+ опухолями репродуктивного периода, получавших эндокринную терапию с применением тамоксифена, наблюдалось статистически значимое повышение БРВ по сравнению с больными, не получавшими адъювантной системной терапии.
Попытка увязать эффективность адъювантной химиотерапии с уровнями РЭ и РП не приводит к статистически значимым результатам. Можно отметить противоречивые тенденции. У больных РМЖ T1-4N1-2M0 + T3-4N0M0 репродуктивного периода с РЭ- опухолями проведение адъювантной химиотерапии давало тенденции к улучшению БРВ, а у больных с РЭ+ опухолями — нет. У больных РМЖ T1-4N1-2M0 + T3-4N0M0, находящихся в менопаузе с РЭ- опухолями, проведение адъювантной химиотерапии не сопровождалось тенденциями к улучшению БРВ, больных с РЭ+ опухолями было недостаточно для анализа.
При РМЖ T1-4N1-2M0 + T3-4N0M0 у больных репродуктивного периода тенденция к улучшению БРВ от проведения адъювантной химиотерапии наблюдалась только у больных с РП- опухолями, а у больных с РП+ — нет; у больных, находящихся в менопаузе, наблюдалась противоположная тенденция: лечение имело тенденции к эффекту у больных с РП+ опухолями, у больных с РП- опухоли позитивные тенденции от лечения отсутствовали.
Эффективность химиоэндокринной адъювантной терапии зависит от уровней РЭ и РП. У больных с РП- опухолями химиоэндокринная терапия не сопровождалась тенденциями к улучшению показателей БРВ и ОВ по сравнению с больными, не получавшими адъювантной терапии. Создаётся впечатление о суммации эффекта химиотерапии и эндокринной терапии у больных РМЖ с РЭ+ и РП+ опухолями.
источник




