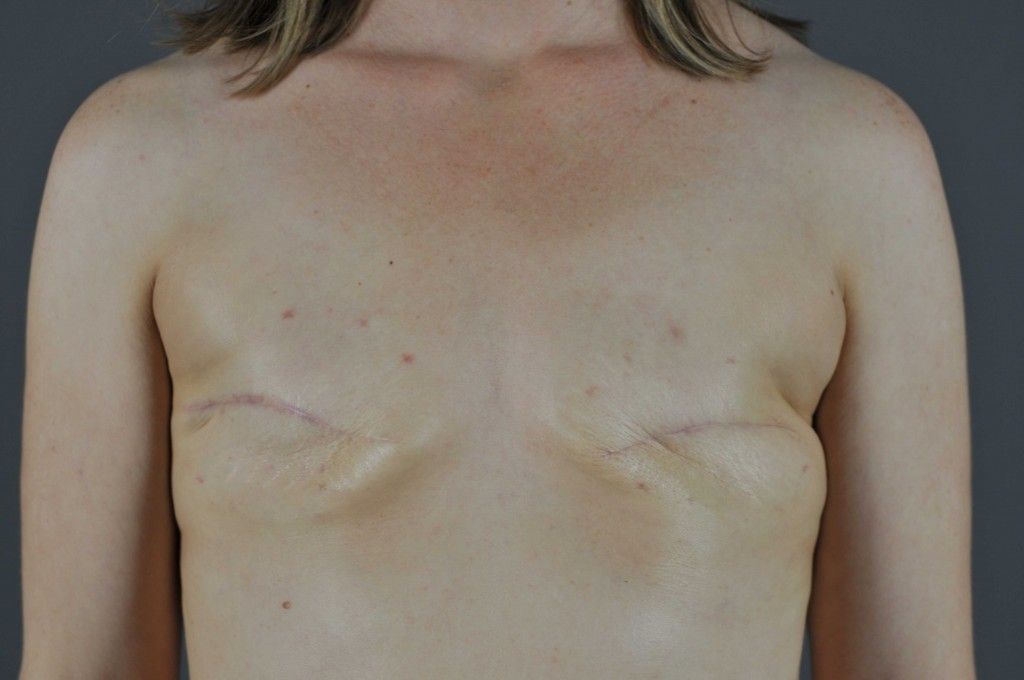
Лечение рака молочной железы заключается в удалении массива злокачественных клеток, которая могла быть до этого уменьшена в размерах с помощью лучевой терапии или специальных препаратов (химиотерапия и гормонотерапия), с последующей профилактикой рассевания злокачественных клеток по кровеносному или лимфатическому руслу.
К сожалению, как химиотерапия, так и облучение различными изотопами, необходимые для профилактики рецидивирования и метастазирования карциномы, являются токсичными для организма методами. Улучшить их переносимость можно, если дополнять лечение препаратами, не действующими на здоровые клетки. На это рассчитана появившаяся не так давно методика – таргетная терапия рака молочной железы.
К 90-м годам двадцатого века ученые открыли и изучили большинство ключевых механизмов, регулирующих деление и выживаемость раковых клеток. Стало известно, что на их поверхности имеются особые рецепторы, сигнал от которых «включает» специфические ферменты и химические вещества, и таким образом карцинома постоянно растет, обходит иммунную защиту и может метастазировать.
Структур подобного строения в здоровых клетках нет. То есть, если организовать «адресную доставку» конкретно к опухолевым составляющим, можно остановить прогрессирование карциномы. Именно в этом и состоит суть таргетной терапии («таргет» в переводе с английского означает «мишень»).
Подобный вид лечения рака молочной железы является особым подвидом медикаментозной терапии, и может применяться как вместе с препаратами для «классической» химиотерапии, так и без них. Таргетная терапия не предполагает отказ от лучевой терапии или операции.
Большинство препаратов, применяемых для таргет-лечения, не уничтожают клетки карциномы молочной железы. Они подавляют механизмы, благодаря которым:
p, blockquote 9,0,0,0,0 —>
- или отдается команда к их делению;
- или ранее блокировалась их дифференцировка, из-за чего опухоль была менее дифференцированной, то есть – более быстро делящейся и злокачественной.
Препараты для таргетной терапии при раке молочной железы позволяют длительно сдерживать рост опухоли или уменьшить массу находящихся в ней клеток. Такой перевод рака из крайне агрессивного и непредсказуемого состояния в хоть и злокачественное, но вялотекущее заболевание, является целью не худшей, чем полное излечение.
Агенты таргет-терапии, одобренные для лечения маммарной карциномы, разделяют на три больших группы:
p, blockquote 12,0,0,0,0 —>
- Средства, направленные на определенные «таргеты»-мишени. Это, например, антиэстрогены или анти-HER2-средства: Герцептин, Лапатиниб.
- Препараты, которые должны ухудшить условия существования опухоли. Это, к примеру, антиангиогенные средства (ангиогенез – это развитие новых сосудов, в частности, внутри опухоли).
- Лекарства, подавляющие передачу сигнала внутри массы раковых клеток. Большинство таргет-агентов еще проходят фазы клинических исследований.
Большинство данных препаратов относятся к классу моноклональных антител. Это молекулы, идентичные тем, которые образуются при вторжении в организм чужеродного агента.
Применение подобного лечения:
p, blockquote 16,0,0,0,0 —>
- оптимально на ранних стадиях патологии, но также приносит хорошие результаты таргетная терапия, проводимая при раке молочной железы с метастазами;
- возможно, когда противопоказана химиотерапия;
- позволяет избежать коррекции уровня гемоглобина;
- обладает минимальными побочными действиями;
- в сочетании со стандартными видами терапии санкционирует значительное снижение риска появления подобной же опухоли после ее удаления и облучения ложа;
- увеличивает процент выживаемости.
HER2 расшифровывается как рецептор 2 типа к молекуле под названием «человеческий ростовой эпидермальный фактор». Особенностью такого рецептора (вещество белковой структуры, расположенное на опухолевых клетках) является способность распознавать большинство сигналов от молекул-активаторов роста. Когда подобных рецепторов появляется много (это наблюдается в около 30% случаев рака молочной железы), это значительно ухудшает выживаемость и чаще вызывает рецидивы, если применять только стандартные терапевтические методы.
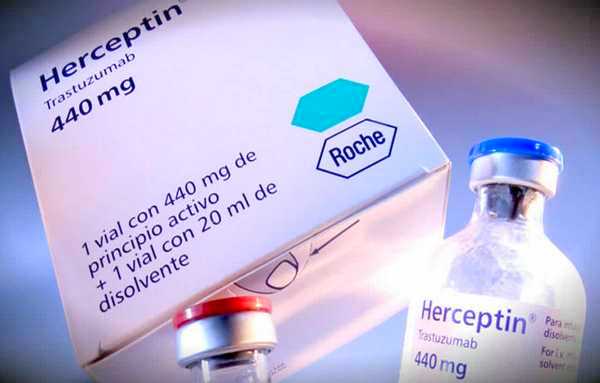
Выходом является применение блокаторов HER2- фактора. Основным из них является трастузумаб (Герцептин). Такие лекарственные средства, заблокировав сигналы рака к делению, останавливают его прогрессию.
Механизмы, по которым работает этот препарат, остаются неизвестными. Можно только предположить, что опухолевые клетки гибнут из-за того, что средство действует подобно антителу.
Таргетная терапия рака молочной железы Герцептином эффективна и при метастатическом раке, и при большом количестве HER2- рецепторов. Препарат дает лучшие результаты при использовании у ранее нелеченных больных – 35%, тогда как эффективность его применения у женщин, получавших до этого химиотерапию – 15% (данные приведены для монотерапии). Он может быть использован как самостоятельно, так и в комбинации с другими препаратами.
Для терапии рака груди Герцептин используется уже много лет. Полученные за это время данные свидетельствуют, что он требует длительного применения: до достижения ремиссии онкопатологии его применяют в комбинации с 1-2 цитостатиками (препаратами для химиотерапии), позже женщины должны получать трастузумаб в виде монотерапии. Даже если на фоне применения Герцептина неоперированный рак прогрессирует, отменять препарат не стоит, так как он повышает выживаемость: получавшие его женщины при прогрессировании прожили (в среднем) еще 20,1 месяцев, тогда как те, кому его отменили – всего 13,4 месяца.
Герцептин эффективен для лечения HER2-позитивного рака на любых его стадиях. Он увеличивает выживаемость при этом крайне агрессивном опухолевом процессе на 40%.
Применение трастузумаба после радикальной операции, когда признаков метастазов нет, но возможные микрометастазы уничтожить нужно, одобрено FDA с 2006 года. Наилучший эффект его достигается, если он применяется совместно с таксан-содержащей терапией. Сейчас ведутся исследования, какая продолжительность применения данного препарата для таргетной терапии оптимальнее: 9 недель, 6 месяцев или год.
Герцептин эффективен и перед проведением радикального вмешательства и радиотерапии для сокращения объема операции. До его введения в неоадъювантную терапию ремиссия достигала 23-34%, а в случае HER2-позитивного рака – 10-15%. С применением трастузумаба частота достижения лечебной морфологической ремиссии составила 43-54%.
p, blockquote 27,0,0,0,0 —>
- уменьшает размеры метастазов;
- позволяет сохранять достаточное качество жизни при неоперабельной опухоли;
- уничтожает те единичные опухолевые клетки, которые успели распространиться за пределы груди;
- не ингибирует иммунные силы организма;
- вдвое снижает вероятность развития рецидива после удаления опухоли;
- интактен для желудочно-кишечного тракта;
- только изредка может гриппоподобные симптомы;
- с большой осторожностью применяется у женщин с заболеваниями сердца.
К сожалению, некоторые типы маммарных карцином могут быть резистентны к Герцептину изначально, или эта нечувствительность может выработаться в процессе лечения. Это объясняется или появлением других путей, по которым опухоль начинает обмениваться сигналами, или изменением HER2-рецепторов, на которые действует препарат. В случае резистентности эффективным является дополнение таргетной терапии Лапатинибом. Это молекула, которая блокирует сразу несколько путей стимуляции клетки рака, помогает преодолеть резистентность к трастузумабу (это было доказано).
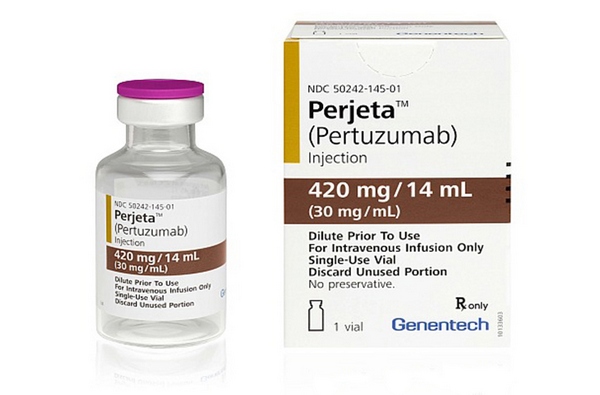
Это новый блокатор HER2-рецепторов, блокирующий несколько путей передачи сигналов роста, проходящих через эти рецепторы. Доказано, что пертузумаб может быть применен в случае неэффективности приема Герцептина, но оптимальный результат достигается при одновременном применении этих двух средств. К тому же, такая терапия хорошо переносится, не производит токсичного действия на сердце.
Это средство представляет собой смесь Герцептина с производным другого препарата – Мэйтензина. Оно совмещает анти-HER2-воздействие и одновременную доставку токсичного для раковой клетки вещества непосредственно к ней.
Плюсом таргетной терапии Trastuzumab-DM1 является его эффективность в монотерапии, без препаратов для классической химиотерапии, что улучшает переносимость.
В настоящее время сравнивается эффективность этого средства с комбинациями других таргетных препаратов, применяемых в случае, когда при мспользовании Герцептина наблюдается прогрессирование рака.
Еще в 1971 году было доказано, что сосуды, образующиеся внутри опухоли и обеспечивающие ее питание, стимулируют ее рост и обеспечивают метастазирование, прорастание в соседние ткани. Получается, что образуется «порочный круг»: новые сосуды вызывают опухолевый рост, а это, в свою очередь, приводит к появлению новых сосудов.
Во время изучения этого феномена найдена молекула, выделяемая внутренней оболочкой этих «новых сосудов». Она названа VEGF – эндотелиальный ростовой фактор. После данного открытия учеными было начато изобретение препаратов, блокирующих VEGF, тем более, что этот фактор, в отличие от HER2, имеется практически в любом типе маммарного рака.
Анти-VEGF-терапия на сегодняшний день доказала свою эффективность, но она меньше, чем у Герцептина и подобных лекарств. Используется, в основном, препарат Бевацизумаб, являющийся моноклональным антителом. Уже через полгода применения Бевацизумаба плотность сосудов в опухоли значительно уменьшается, но после его отмены уже с третьей недели отмечается повторное усиление неоангиогенеза. В результате, сделаны выводы о необходимости более длительного применения подобной терапии.
Исследования анти-VEGF-препаратов продолжаются.
Не каждый рак груди имеет HER- и VEGF-рецепторы. Выделяют также крайне агрессивные типы карциномы. Это:
p, blockquote 41,0,0,0,0 —>
- трижды негативный рак – нечувствительный к Герцептину, эстрогенам и прогестеронам, встречающийся в 10-20% случаев;
- BRCA1-ассоцированный тип, отличающийся высокой степенью злокачественности при отсутствии рецепторов к эстрогенам, прогестерону.
Пока на эти виды карцином действуют только препараты для классической химиотерапии, но ведутся разработки ингибиторов PARP (полиАТФ-рибозно-полимеразные). Сама PARP восстанавливает разрывы цепочек ДНК в опухолевых клетках, что позволяет раку развиваться дальше. Если ее заблокировать, разрывы генома не восстанавливаются, возникает генетическая нестабильность карциномы, и она гибнет.
На данный момент анти-PARP-препарат Инипариб проходит клинические испытания, но первые их результаты обнадеживают: уменьшилась скорость прогрессирования высокозлокачественных карином, увеличилась выживаемость.
Таким образом, таргетная терапии в лечении рака молочной железы – это та «соломинка», которая позволяет поддерживать лучшее качество жизни как женщин с метастатическими опухолями, так и излечить неинвазивный рак железы, обнаруженный на ранних стадиях.
p, blockquote 44,0,0,0,0 —> p, blockquote 45,0,0,0,1 —>
Исследования, проводимые в этой области, позволяют рассчитывать, что вскоре женщины с высокозлокачественными типами данной опухоли также смогут надеяться на увеличение продолжительности жизни и улучшение ее качества. На сегодняшний день трудность заключается в недостаточности достоверных онкобиомаркеров, которые бы позволили изобрести новые виды агентов для таргетной терапии.
источник
Таргетная терапия рака молочной железы, или целевая терапия – это медицинская разработка последних двух десятилетий, возможности которой в лечении этого опасного заболевания все еще изучаются. Суть этого подхода заключается в применении препаратов, которые оказывают не общее токсическое действие на клеточные структуры, а проявляют точечную активность только лишь в отношении злокачественно перерожденных клеток.
В этом состоит принципиальное отличие таргетного лечения от традиционной химической или лучевой терапии при раке молочной железы. Целевое действие на молекулярные механизмы опухолевых клеток, приводящее к их гибели, существенно увеличивает эффективность терапии и имеет намного меньший риск развития серьезных осложнений.
Первый таргетный препарат был зарегистрирован еще в 1990 году, и с тех пор их количество уже превысило полтора десятка. На сегодня это лечение может быть использовано в качестве самостоятельной терапии. Но наиболее часто таргетная терапия рака молочной железы является составляющей частью комплексных подходов при раке молочной железы.
Целевые препараты применяются как до, так и после операционных вмешательств, а также дополняются традиционной химиотерапией (по назначению врача также может дополняться препаратами при химиотерапии рака молочной железы) или лучевыми воздействиями. И, благодаря их использованию, становится возможным существенно снизить и радиационную нагрузку на организм пациента, и дозировку обычных препаратов.
Да, как и при любой другой лечебной методике здесь имеется риск развития побочных эффектов. Преимущество при этом заключается в том, что таргетная терапия рака молочной железы переносится абсолютным большинством пациентов намного легче, чем другие способы воздействий на опухоль. Те серьезные осложнения (нарушения кроветворения, потеря волос, мукозидные патологии и т.д.), которые характерны для лечения препаратами платины, при таргетных воздействиях встречаются не более чем у 5% больных.
Среди побочных действий целевой терапии чаще всего встречаются ознобы или лихорадки, которые могут быть быстро купированы приемом обычных противовоспалительных нестероидных средств. Наиболее серьезным осложнением таргетного лечения являются нарушения деятельности сердечно-сосудистой системы. Поэтому такую терапию можно назначать только после тщательного обследования пациента.
Выбор фармакологических средств при этом лечении основан на том, какие именно молекулярные структуры имеются у клеток опухоли каждого конкретного пациента. Перед назначением препарата для лечения рака груди в Израиле в клинике Onco Breast Unit обязательно проводится иммуногистохимическое исследование образцов опухолевой ткани, полученных в ходе биопсии сторожевого лимфоузла, либо другого вида биопсии. Выявив молекулярные «мишени» для таргетной терапии рака молочной железы, наши врачи подбирают соответствующее лекарственное средство и в индивидуальном порядке определяют его дозировку. Если Вам назначили терапию, но Вы не уверены в правильности ее назначения у нас вы можете заказать услугу «Второе мнение» и получить консультацию израильского врача с международной репутацией.
В данную группу препаратов входят:
- Nolvadex (Tamoxifen®)
- Faslodex (Fulvestrant®)
- Herceptin (Trastuzumab®)
- Perjeta (Pertuzumab®)
Этот класс препаратов для таргетной терапии рака молочной железы был внедрен в клиническую практику самым первым. Многие опухоли груди являются эстроген-зависимыми, то есть, их рост напрямую стимулируется данным гормоном. Селективные блокаторы необратимо (то есть, навсегда) связываются с эстрогеновыми рецепторами на поверхности клеток опухоли, что в результате приводит к их гибели. Такое лечение применяется у пациентов, имеющих ER-позитивные (с наличием большого числа эстрогеновых рецепторов) опухоли.
В данную группу препаратов входит:
Такие препараты воздействуют не на саму опухоль, а на окружающую ее сосудистую сеть, которая снабжает ее кислородом и питательными веществами. Они не позволяют сосудам разрастаться, что в итоге приводит к замедлению всех процессов в опухолевых клетках и, в дальнейшем, к их гибели.
В данную группу препаратов входят:
- Erbitux (Cetuximab®)
- Vectibix (Panitumumab®)
- Kadcyla (Trastuzumab emtansine®)
Их воздействие основано на связывании с рецепторами к ЭФР-2, которые находятся на поверхности опухолевых клеток. Нормальная работа этих рецепторов необходима для размножения клеток, а их блокирование вызывает, соответственно торможение прогрессирования всей опухоли.
В данную группу препаратов входят:
- Lynparza (Olaparib®)
- Gemzar (Gemcitabine®)
PARP-белок является частью системы, которая поддерживает функционирование поврежденной ДНК в опухолевых клетках. Подавляя активность этого вещества, данный класс препаратов вызывает апоптоз (гибель) раковых клеток. Блокаторы PARP-белка используются в случаях, когда на поверхности злокачественных клеток не выявляется наличие рецепторов к эстрогену, ЭФР-2 и т.д.
Одним из видов лечения рака молочной железы являются ингибиторы ароматазы.
Ароматаза — цитохром Р450-зависимый фермент в организме человека, который превращает андрогены, синтезируемые в коре надпочечников, в эстрогены. Ароматаза содержится в различных тканях и органах, включая жировую ткань, скелетные мышцы, печень, яичники, а также в ткани опухоли молочной железы.
Ингибиторы ароматазы при раке молочной железы назначают только женщинам в пост-менопаузе. Обусловлено это тем, что при нормальной работе яичников вырабатывается слишком много ароматазы и подавить ее активность до достижения клинического эффекта фармакологическими воздействиями практически невозможно.
Наиболее часто применяют анастразол, летрозол и экземестан.
Эти препараты оказывают положительный эффект на организм женщины с раком молочной железы, так как они подавляют образование эстрогенов в клетках опухолевой ткани, где их концентрация превышает уровень в плазме крови в 10-20 раз.
Ингибиторы ароматазы обладают более продолжительным эффектом и приводят к существенно меньшему числу серьезных побочных эффектов. Это приводит к стабилизации заболевания, снижая риск прогрессирования и неуспешного лечения.
В данную группу препаратов входят:
- Aromasin (Exemestane®)
- Femara (Letrozole®)
- Arimidex (Anastrozole®)
- Ibrance (Palbociclib®)
Данный фермент является основным метаболитом, который необходим для синтеза эстрогенов в организме человека. Соответственно, этот класс препаратов также предназначен для лечения ER-позитивных опухолей. Блокирование активности ароматазы приводит к существенному снижению выработки эстрогенов, а это, в свою очередь, отрицательно влияет на злокачественные клетки, для которых эстроген служит стимулятором роста и размножения.
Таким образом, ингибиторы ароматазы при раке молочной железы обладают несомненным потенциалом в лечении и рекомендуются онкологами.
источник
Инновационная технология лечения злокачественных опухолей — таргетная терапия — возникла почти полвека назад, когда ещё не было термина «таргетная», не было понимания противоопухолевого механизма действия и даже не совсем ясно представляли молекулярные характеристики рака, через которые реализуется лечебный эффект лекарств.
Первыми проводниками таргетной терапии в онкологии, буквально «удара по конкретной цели», стали гормональные препараты, успешно убивавшие клетки рака молочной железы. Четверть века назад стали понимать подоплёку механизмов противоопухолевого действия, но не сами механизмы, и полтора десятилетия назад появился термин «таргетная терапия».
Сегодня поиск лекарственных средств идёт целенаправленно и в клинической практике уже используются три варианта таргетного воздействия:
- Действие на определённые клеточные мишени, в числе которых рецепторы половых гормонов, гены и внутриклеточные ферменты;
- Повреждение обеспечивающих нормальную жизнедеятельность раковой опухоли внеклеточных структур, например, питающих опухоль сосудов;
- Выключение передачи внутриклеточных биохимических сигналов, которые позволяют раку жить и размножаться, в цепочке биохимических реакций — сигнального пути.
Таргетная терапия входит в лекарственное противоопухолевое лечение, но постепенно отделяется от понятия химиотерапии, поскольку механизм действия иной, но результат общий — уничтожение рака. Лекарства эти применяются только вместе с цитостатиками и усиливают их эффективность.
Нельзя утверждать, что препараты таргетной терапии не дают осложнений, потому что не повреждают здоровые клетки, воздействуя только злокачественные. Действительно, в нормальных клетках нет генов, на которые они влияют, и концентрация «целевого продукта» выше, тем не менее клеточную биохимию они нарушают, отчего развиваются своеобразные побочные эффекты.
Можно выделить следующие преимущества таргетных препаратов:
- Они могут быть эффективны против рака, который слабо отвечает на химиотерапию. Если химиопрепараты перестают помогать, и раковые клетки обладают определенными молекулярно-генетическими свойствами, таргетная терапия становится основным видом лечения.
- Таргетные препараты не атакуют, как химиопрепараты, все быстро делящиеся клетки без разбора. У них есть конкретная «мишень». Они действуют более прицельно, поэтому вызывают меньше побочных эффектов.
- Таргетные препараты, будучи добавлены к курсу химиотерапии, могут существенно повысить эффективность лечения.
- Зачастую таргетные препараты помогают лечить запущенный рак как временно хроническое заболевание, подарить пациенту недели, месяцы, а иногда и годы жизни.
В настоящее время существует довольно много разных таргетных препаратов. Одни уже давно внедрены в клиническую практику, другие недавно закончили или все еще проходят испытания. В зависимости от эффектов, их можно разделить, на несколько групп:
- В каждой клетке человека работают так называемые сигнальные пути — каскады химических реакций, итогом которых является то или иное событие. Таргетные препараты могут блокировать звенья в сигнальных путях, отвечающих за размножение клеток.
- Некоторые препараты изменяют важные белки таким образом, что клетка погибает.
- Злокачественная опухоль активно растет и распространяется по организму, поэтому ей нужно много кислорода и питательных веществ. Раковые клетки выделяют вещества, которые стимулируют ангиогенез — рост новых сосудов. Существуют таргетные препараты, которые могут их заблокировать.
- Воздействуя на некоторые молекулы, можно активировать иммунитет, заставить его распознавать и убивать раковые клетки.
- Есть таргетные препараты, которые вводят в раковые клетки токсины (при этом не затрагивая здоровые клетки), уничтожающие их.
Для того чтобы разобраться, будет ли эффективна таргетная терапия у конкретного пациента, необходимо провести молекулярно-генетический анализ клеток опухоли. Это поможет понять, есть ли в раковых клетках «мишень», против которой направлен тот или иной таргетный препарат. Зачастую врач назначает таргетную терапию при метастазах, при раке IV стадии, если другие препараты оказались неэффективны, если, несмотря на лечение, опухоль продолжает расти и распространяться по организму.
Рак молочной железы первым подвергся таргетной терапии в виде антигормонального препарата тамоксифена из группы антиэстрогенов. Внутри ядра клетки молочной железы находится гормональный рецептор, который соединяется с циркулирующими в крови половыми гормонами. Образовавшийся в результате слияния комплекс «рецептор+гормон» даёт импульс для дальнейшей клеточной жизнедеятельности: росту, размножению, изменению функций, то есть несёт в себе программу дальнейшей жизни (см. клинические исследования).
Гормональные препараты, созданные для лечения рака молочной железы, весьма похожи на настоящие гормоны, но несут в себе не программу жизни рака, а программу его смерти, и гормональный рецептор активно выбирает не родной гормон, а лекарство. Сегодня наряду с тамоксифеном используются антиэстрогены торемифен (фарестон) и фульвестрант (фазлодекс).
Вторую группу таргетных гормональных средств составляют ингибиторы фермента ароматазы, превращающего один вид полового гормона в другой. Ароматаза находится в жировой клетчатке и синтезируется яичниками, выключение её с помощью лекарственного препарата нарушает синтез гормона, в котором нуждаются раковые клетки.
Чувствительность к химиотерапии можно предсказать по наличию специфического гена HER-2/neu — гена множественной лекарственной резистентности. Обнаружение этого гена говорит о том, что опухоль может не реагировать на присутствие лекарства-убийцы.
Раковая клетка пытается избежать гибели несколькими способами, одновременно включая механизмы:
- быстрого выведения химиопрепаратов в межклеточное пространство;
- обезвреживая цитостатик специальными белками;
- быстро восстанавливая повреждения;
- изменяя мишень для препарата, предлагая ему похожий белок, не имеющий принципиального значения для дальнейшей жизнедеятельности;
- изменяя роль ключевых генов, контролирующих клеточный апоптоз (гибель), которые больше не могут запустить фатальные изменения.
Найден ключевой ген рака молочной железы, получивший название HER 2, и заставляющий рецепторы на клеточной поверхности избыточно активно захватывать факторы клеточного роста, что приводит к неуправляемому делению. В некоторых случаях ген амплифицируется, то есть образует в ДНК не одну, а целый пучок генетических копий.
Блокирует ген HER 2 препарат герцептин (трастузамаб). Сам по себе герцептин не убивает рак, а «снимает» с него устойчивость к лекарствам, поэтому применяется вместе с химиопрепаратами. Замечена связь герцептина с иммунными защитниками, при большой концентрации в раке Т-лимфоцитов активность герцептина снижается.
Помогает работе герцептина ещё один таргетный препарат перьета (пертузумаб) — белок, синтезируемый иммунными клетками, или моноклональное антитело. Перьета на поверхности раковой клетки соединяется с определённом рецептором, не позволяя фактору роста проникнуть внутрь и активировать ген HER2. Перьета вводится вместе с герцептином и химиопрепаратом доцетакселом.
Аналогично герцептину работает лапатиниб (тайверб), применяемый во второй очереди после герцептина с перьетой.
Таргетные препараты при немелкоклеточном раке легкого могут применяться в сочетании с химиопрепаратами или самостоятельно. Применяются препараты, которые блокируют ангиогенез (рамицирумаб, бевацизумаб), мутантные белки, заставляющие раковые клетки размножаться: EGFR (афатиниб, эрлотиниб, гефитиниб), ALK (бригатиниб, алектиниб, церитиниб, кризотиниб), BRAF (траметиниб, дабрафениб).
Исследования показывают, что примерно в половине всех меланом клетки имеют мутацию в гене BRAF. Из-за этого в них образуется одноименный мутантный белок, и они быстро размножаются. В таких случаях эффективны таргетные препараты из группы ингибиторов BRAF: дабрафениб, вемурафениб.
В тандеме с геном BRAF работает ген MEK. Если в нем обнаружена мутация, врач может назначить ингибиторы MEK: кобиметиниб и траметиниб.
Некоторые меланомы (на участках кожи, на которые постоянно воздействуют солнечные лучи, на ладонях и подошвах, слизистых оболочках, под ногтями) имеют мутацию в гене C-KIT. При этом могут помочь препараты иматиниб и нилотиниб.
На поздних стадиях рака поджелудочной железы некоторым пациентам назначают химиотерапию в сочетании с эрлотинибом, таргетным препаратом, который блокирует рецептор эпидермального фактора роста (EGRF).
При раке толстой и прямой кишки применяются три группы таргетных препаратов:
- Ингибиторы фактор роста эндотелия сосудов (VEGF), белка, который вырабатывается раковыми клетками и стимулирует ангиогенез: рамуцирумаб, бевацизумаб.
- Ингибиторы рецепторов эпидермального фактора роста, которые находятся на поверхности раковых клеток и, находясь в активном состоянии, заставляют их размножаться: панитумумаб, цетуксимаб.
- Ингибиторы киназы — белка-фермента, который выполняет разные функции, в том числе стимулирует клеточный рост: регорафениб.
Примерно в 1 из 5 случаев в клетках злокачественных опухолей желудка содержится повышенное количество белка HER2/neu (или только HER2), который стимулирует их размножение. В таких случаях применяют таргетный препарат трастузумаб (Герцептин). Также при раке желудка применяют ингибитор ангиогенеза рамуцирумаб (Цирамза).
- Таргетные препараты, которые блокируют ангиогенез: бевацизумаб.
- Таргетные препараты, которые блокируют белки-тирозинкиназы: сорафениб, сунитиниб, пазопаниб, акситиниб, кабозантиниб, ленватиниб.
- Таргетные препараты, которые блокируют белок mTOR: темсиролимус, эверолимус.
Я нашла клинику по принципу применения таргетной терапии. Искала тщательно и выяснила, что у Европейской клиники самый большой опыт её применения для лечения меланомы. Меня приняли очень быстро, подтвердили диагноз и по гистологическому исследованию назначили дабрафениб, так как есть браф-мутация. Сейчас прохожу второй курс. Побочные эффекты есть, но не такие, как при обычной химии. Судя по динамике, всё хорошо, и вполне можно ожидать хорошего исхода. Доктору Пылёву доверяю полностью. Считаю, что с клиникой и врачами мне очень повезло.
Стоимость 1 курса таргетной терапии — от 150 тыс. руб.
В Европейской клинике не ограничиваются химиотерапией, а при всех известных злокачественных заболеваниях используют весь спектр противоопухолевых средств, в том числе и инновационную таргетную терапию. Специальные программы помогают лучшей переносимости лечения и улучшению результатов противоопухолевой терапии.
источник
Одна из самых распространенных болезней среди женщин — онкология молочной железы. В России, примерно, каждая 7 барышня в своей жизни сталкивается с этим заболеванием.
Существует три типа традиционного лечения этого заболевания:
- хирургическое вмешательство
- лучевое воздействие
- химиотерапия
При лечении одним из классических методов происходит воздействие не только на раковые клетки, но и на здоровую ткань:
- В случае операции, в основном, удаляют только пораженный участок. В некоторых случаях проводится мастэктомия — хирургическая операция, при которой молочную железу удаляют полностью.
- При лучевом способе лечения помимо очага заболевания рентгеновское излучение проходит через кожу, мышцы, легкие.
- При химиотерапии пресекается размножение злокачественных клеток, но приводит к частичной гибели клеток печени, сердца.
Если вовремя обнаружить онкологию груди и начать лечение, в 80% — 90% случаев есть надежда на благополучное избавление от рака. Таргетная терапия при раке молочной железы точечно воздействует на очаги возникновения заболевания – об этом подробнее.
Медицина не стоит на месте и уверенно шагает вперед. На протяжении последних лет двадцати начали лечение именно препаратами точечного воздействия. Данные препараты вызывают остановку развития образования, а затем и гибель раковых клеток, не задевая здоровые ткани. Не имеют значительных побочных явлений.
Таргетные препараты можно принимать отдельно, либо в комплексе. Когда есть необходимость прибегнуть к таргетной терапии:
- при последних стадиях рака
- когда пациентка находится в тяжелом состоянии
- если операция может ухудшить положение пациентки
- при высоком риске возникновения метастаз
- если выявлен быстрый рост и размножение раковых клеток
Медикаменты направленного воздействия будут эффективны против рака, если не помогает химиотерапия. В таком случае это самый лучший способ в борьбе с раком груди. Лекарство атакуют только зараженные клетки, не принося вреда здоровым клеткам. Если данное лечение сочетать с химиотерапией, повышается вероятность успеха в процессе лечения. В частности, таргетные препараты действенны в случае запущенного рака.
- оптимально при ранних стадиях развития опухоли, либо при наличии немногочисленных метастаз
- рекомендована в случаях, когда противопоказана химиотерапия
- не нарушает уровень гемоглобина
- самые минимальные побочные действия
- при сочетании с другими видами и способами лечения значительно снижает вероятность метастаз
- во много раз повышается процент выживаемости пациентки
Таргетная терапия при РМЖ во многом положительно влияет на будущее восстановление организма от болезни.
Осложнения, конечно, бывают при любых способах лечения, даже при таком щадящем, как таргетная терапия. Преимущество таргетной терапии в том, что она легче переносится пациентками. В отличие от иных видов воздействия на рак молочной железы, при данном курсе не будет потери (частичной или полной) волос, нарушения кроветворения, как это происходит при химиотерапии.
Самым серьезным нежелательным последствием таргетной терапии может быть нарушение сердечно-сосудистой системы. Поэтому перед этим способом лечения необходимо пройти обследование, которое позволит сделать соответствующее заключение врача кардиолога. Оно потребуется при назначении курса лечения.
Лекарственные препараты создаются таким образом, чтобы подавлять негативное отклонение ДНК и, чтобы был эффект «застывания» появления новых образований заболевания.
Данные лекарства блокируют опухоль, что не дает возможности увеличиться очагу, и напрочь тормозит проявление новых метастаз.
В медицине все лекарственные средства назначаются в соответствии со сложностью заболевания, а также с индивидуальной реакцией организма на те, или иные составляющие препаратов. Как работают препараты таргетной терапии:
- контролируют набор генов, которые делятся и могут привести к размножению раковых клеток
- осуществляют контроль апоптоза или гибель клеток
- блокируют гормоны в онкологических клетках
- закрывают доступ к здоровым органам, для избежания новообразований
Конечно, данные препараты могут распознать здоровые и больные клетки. Действие медикаментов направлено на уничтожение уже существующих и вновь зарождающихся раковых клеток, без вреда для здоровой ткани.
Преимущества таргетной терапии:
- препараты выпускаются в виде таблеток
- вызывают минимальные побочные воздействия
- имеют повышенную эффективность
- терапия сочетается с другими методами лечения
- таргетные лекарства можно принимать на дому, без обязательной госпитализации
- от приема препаратов женщина не теряет работоспособность, чувствует себя хорошо
- данная терапия может применяться для замедления роста метастаз, а может окончательно истребить остатки пораженных клеток
- самая высокая цена среди всех способов лечения, цена одного курса около трех тысяч долларов
- необходимо обследование генетиков для подбора правильного средства
- ограниченно воздействует на рак легкого, почек, меланому кожи
В настоящее время, создано множество препаратов для борьбы с раком груди у женщин. Можно выявить несколько сценариев борьбы с раком таргетными препаратами:
- Некоторые из медикаментов изменяют белковый состав, вследствие чего рак погибает.
- Злокачественные опухоли увеличиваются или метастазируют в другие органы. Данные препараты блокируют распространение.
- Существуют препараты, которые вводят в больные клетки, уничтожая их полностью.
Герцептин в качестве препарата достаточно эффективен для лечения, так называемого, позитивного рака на любых его стадиях развития. Если все же рак прогрессирует, не стоит отменять курс лечения этим препаратом, он повышает выживаемость здоровых клеток для борьбы с зараженными. Лекарство можно применять само по себе, а можно в комплексе с другими способами борьбы с раком груди.
Какое влияние оказывает Герцептин:
- уменьшает величину метастаз
- продлевает пациентке жизнь, если опухоль оказывается неоперабельной
- уничтожает всевозможные единичные злокачественные клетки, которые выходят даже за пределы самой груди
- не влияет на иммунные силы женщины
- в два раза снижает вероятность рецидива после процедуры по удалению онкологических клеток
- не оказывает пагубного влияния на желудочно-кишечный тракт
- осторожность необходима пациенткам с нарушением сердечно-сосудистой системы
Назначают, если Герцептина оказался неэффективен, либо в комплексе двух препаратов. Комплекс двух препаратов не влияет на работу сердца. Оказывает те же действия на организм, что и Герцептин.
Авастит — один из наиболее эффективных медикаментов. Механизм действия лекарства способствует уменьшению раковых опухолей. Это приводит чаще всего к гибели рака груди. Назначается при раке груди, почек, легких.
Таргетные препараты при раке молочных желез способствуют излечиваю недуга у женщин. Отзывов о каждом из них, а также о самой терапии очень много. Можно ознакомиться с каждым. Проходить курс лечения можно только под присмотром врача.
источник
Таргетная терапия (от английского слова the target – мишень) – системная терапия направленная против опухоли, отдаленных микрометастазов или метастазов. Некоторые авторы называют ее иммунотерапией или биологической терапией рака.
Таргетная терапия основана на действии моноклональных антител, которые специфически связываются с особыми рецепторами на поверхности раковой клетки. Эти антитела аналогичны обычным человеческим антителам, которые в продуцируют B-лимфоциты. Однако B-лимфоциты не продуцируют антитела против молекулярных рецепторов расположенных на раковой клетке. Препараты моноклональных антител (monoclonal antibody – MAB) являются сверх-высокотехнологичными современными лекарствами.
Таргетная терапия может применяться как в комплексном радикальном лечении рака груди (адъювантный режим), так и в лечении метастатической болезни (лечебный режим)
Опухоль – заболевание генетического аппарата клетки. Как правило, для проявления злокачественных свойств, в геноме клетки должно случиться минимум 4 структурных поломки. Существуют как общие изменения в генах, провоцирующие появление опухоли, так и индивидуальные, характерные только для определенных видов опухолей. Для рака груди характера следующая «поломка»: установлено, что у женщин, страдающих раком молочной железы, может произойти активация гена HER2, из-за чего на поверхности опухолевых клеток увеличивается количество рецепторов HER2. Подобное явление было замечено разными исследователями у 15–30% больных раком молочной железы.
В норме рецепторов HER2/neu на поверхности эпителиальной клетки около 20 тыс. На клетках рака молочной железы их количество может увеличиваться в 100 и более раз (это явление называется гиперэкспрессией). В случае гиперэкспрессии рецепторы HER2 на мембране нарушают нормальный клеточный цикл и вынуждают клетки бесконтрольно делиться.
Все специалисты, занимающиеся проблемой рака молочной железы, отмечают необходимость определения уровня рецепторов HER2/neu в опухоли для прогноза течения заболевания и эффективности химиотерапии. Важность этого теста обусловлена и тем, что при всех других благоприятных условиях, таких как небольшой размер опухоли, отсутствие метастазов в лимфатические узлы, чувствительность опухоли к гормональному лечению, гиперэкспрессия HER2/neu делает прогноз менее благоприятным. И это является сигналом к еще более внимательному подходу в выборе терапии.
В настоящее время широко применяется в клинической практике препарат, обладающий способностью блокировать отрицательное влияние гиперэкспрессии HER2/neu – герцептин (трастузумаб). Он представляет собой моноклональное антитело, которое специфически связывается с рецептором HER2/neu на поверхности раковой клетки и блокирует его.
Ведутся активные исследования целой группы таких лекарств. Многие ученые полагают, что за этими средствами будущее онкологии.

Существует множество методик определения как активности гена, несущего информацию о рецепторе HER2/neu, так и количества самих рецепторов на поверхности клетки.
Основной – иммуногистохимический метод, техника которого заключается в специфическом окрашивании клеточной стенки с гиперэкспрессией HER2/neu. Преимущества этого метода – простота выполнения и невысокая стоимость, а также возможность проведения исследования даже через несколько лет после операции. Операционный материал фиксируется в формалине и может длительное время сохраняться в парафиновых блоках для последующих исследований. Оборотная сторона этого метода – возможные ошибки, так как метод субъективный и требует наличия опытного персонала, выполняющего не менее 300 подобных исследований в год.
Второй метод, также признанный стандартным, — это так называемый метод FISH-гибридизации, показывающий количество генов в ядре опухолевой клетки, участвующих в производстве рецептора HER2/neu. Если происходит увеличение этих генов (явление, называемое амплификация), то вероятность гиперэкспрессии очень высока. Преимущества метода – очень высокая чувствительность и меньшая зависимость от квалификации персонала. Отрицательная сторона – дороговизна и необходимость наличия сложного оборудования.
По вышеназванным причинам первый метод является основным, а второй используется для принятия решения в спорных случаях.
Сегодня необходимость определения статуса HER2/neu не подлежит сомнению.
источник

Стоимость таргетной терапии рака молочной железы в Израиле от 1 000$.
Наша организация, медицинский сервис «Tlv.Hospital», предлагает организацию проведения таргетной терапии в Израиле – приемлемая стоимость, лечение у лучших врачей, безупречная организация в кратчайшие сроки, бытовое сопровождение, дополнительные услуги.
Рассмотрим основные препараты таргетной терапии, используемые в Израиле при лечении рака груди.
Примерно у 1 из 5 пациенток, больных раком груди, на поверхности злокачественных клеток слишком много белка — HER2/neu (или просто HER2), способствующего их росту. Такой вид онкологии, как правило, быстро растет и распространяется более агрессивно, если лечение не проводится. Был разработан ряд препаратов, нацеленных против HER2/neu.
Ни одно из данных лекарств не является безопасным во время беременности, поскольку способно причинить вред или даже привести к смерти плода. При проведении таргетной терапии рака молочной железы женщинам, не достигшим периода менопаузы, необходимо использовать эффективные противозачаточные средства.
Трастузумаб (Герцептин) – один из препаратов, известный как моноклональные антитела, техногенная версия специфического белка иммунной системы. Он прикрепляется к белку HER2 и может помочь замедлить рост раковых клеток со слишком большим количеством данного вещества. Более того, герцептин также стимулирует иммунную систему более эффективно бороться с онкологией.
Прием препарата осуществляется внутривенно, как правило, один раз в неделю или в большей дозе — каждые 3 недели.
Трастузумаб часто используется в качестве адъювантной терапии (после операции) HER2-положительного рака груди для снижения риска возврата заболевания. Сначала проводят совместное лечение с химиотерапией, а затем отдельно, в общей сложности в течение года. Герцептин также может назначаться до операции в качестве неоадъювантной терапии.
Кроме того, трастузумаб применяется для лечения рецидива болезни, а также в случае роста опухоли во время терапии. Комбинация химиопрепаратов и герцептина работает лучше, чем отдельно химиотерапевтическое лечение. Если рак прогрессирует, часто продолжают лечение трастузумабом, а химиотерапию меняют.
По сравнению с химиопрепаратами, побочные эффекты герцептина проявляются в относительно легкой форме. Эти нежелательные проявления встречаются редко и могут включать лихорадку и озноб, головную боль, слабость, кашель, тошноту, рвоту и диарею. Обычно они незначительны.
Более серьезным побочным эффектом считается повреждение сердца, которое приводит к возникновению так называемой застойной сердечной недостаточности. Для большинства (но не для всех) женщин, данный симптом носит временный характер и проходит после прекращения приема лекарственного средства. Риск этих побочных эффектов возрастает, когда трастузумаб сочетают с определенными химиопрепаратами, такими как Доксорубицин (Адриамицин) и Эпирубицин (Ellence). По этой причине работу сердца регулярно проверяют во время лечения. Основными симптомами застойной сердечной недостаточности являются одышка, отеки ног и сильная усталость. При возникновении этих признаков пациентка обязательно должна сообщить врачу.
Адо-трастузумаб эмтансин является одним из препаратов категории конъюгатов антитело-лекарств, состоящий из того же моноклонального антитела, найденного в герцептине, и химиопрепарата, известного как DM-1. В этом типе лекарственного средства антитело действует как прибор наведения, доставляя химиотерапевтический препарат непосредственно к злокачественным клеткам.
Kadcyla применяют для лечения распространенного рака груди, в виде инъекций каждые 3 недели. Общие побочные эффекты включают усталость, тошноту, боли в мышцах и в костях, низкое количество тромбоцитов, головную боль и запор. Возможны более серьезные нежелательные явления, такие как тяжелые аллергические реакции, повреждения печени и сердца, проблемы с легкими.
Как трастузумаба, пертузумаб представляет собой моноклональное антитело, которое прикрепляется к HER2 белку. Этот препарат могут назначать вместе с доцетакселом (Таксотер) и трастузумабом для лечения распространенного рака груди, а также на начальных стадиях заболевания в качестве неоадъювантной терапии (до операции).
Пертузумаб вводят внутривенно каждые 3 недели. К общим побочным эффектам относят диарею, выпадение волос, тошноту, усталость, сыпь и низкое число белых клеток крови (иногда с лихорадкой).
При заболеваниях сердца пертузумаб не применяют, поскольку он может ослабить орган. Врачи в Израиле изучают состояние сердца, прежде чем назначить этот препарат, каждые несколько месяцев во время терапии пертузумабом они контролируют и проверяют состояние сердечной мышцы.

Результаты одного исследования показали большую эффективность применения лапатиниба наряду с трастузумабом при метастатическом раке груди по сравнению с одним приемом лапатиниба.
К наиболее распространенным побочным эффектам этого препарата относят диарею, тошноту, рвоту, сыпь и ладонно-подошвенный синдром. Диарея является распространенным нежелательным явлением лечения и может быть очень серьезным, так что важно сообщать врачу о любых изменения, связанных с работой кишечника.
В редких случаях лапатиниб способен вызвать проблемы с печенью или снижение функции сердца (что может привести к одышке), но симптомы, как правило, уходят, как только лечение заканчивается.
Эверолимус является одним из видов таргетной терапии, который блокирует белок mTOR. Данный белок координирует синтез на рибосомах многих белков, в том числе, связанных с размножением и ростом клетки. Избыточная активация функции mTOR провоцирует бесконтрольное деление клеток – то есть превращение их в злокачественные. Блокируя белок, можно предотвратить рост раковых клеток. Эверолимус способен также остановить развитие новых кровеносных сосудов в опухоли, что ограничит ее рост. В лечение рака груди эверолимус повышает эффективность гормональной терапии.
Эверолимус — это таблетки, которые нужно принимать один раз в день.
Этот препарат одобрен для лечения распространенного гормонально-позитивного, HER2-негативного рака груди у женщин постклимактерического возраста. Его назначают вместе с Экземестаном (Aromasin), если опухоль выросла в то время, когда проводили лечение летрозолом или анастрозолом.
Общие побочные эффекты этого препарата включают язвы в полости рта, диарею, тошноту, усталость, слабость, низкие показатели крови, одышку и кашель. Эверолимус может также увеличить уровень липидов в крови (холестерин и триглицериды) и сахара. Поэтому, пока принимается препарат, врачи делают анализы крови с целью контроля состояния организма. Эверолимус также способен увеличить риск серьезных инфекций.
Afinitor изучают с целью применения на ранней стадии рака молочной железы, с другими препаратами гормональной терапии и в комбинации с разными методами лечения.
Опухоль должна создавать и развивать новые кровеносные сосуды, чтобы расти. Препараты, которые нацелены на эти сосуды, эффективны против различных видов рака и были изучены при лечении онкологии груди.
Бевацизумаб представляет собой моноклональное антитело, которое назначают пациентам при диагнозе метастатический рак груди. Это антитело направлено против фактора роста эндотелия сосудов (ФРЭС), белка, который помогает опухолям создавать новые кровеносные сосуды.
Бевацизумаб применяется внутривенно, достаточно часто — в комбинации с химиотерапией.
Редкие, но потенциально серьезные побочные эффекты включают кровотечение, язвы, образующиеся в толстой кишке и требующие хирургического вмешательства, медленное заживление ран.
К более распространенным побочным эффектам относят высокое давление, усталость, тромбы, сниженное количество белых клеток крови, головные боли, язвы в полости рта, потерю аппетита и диарею. Высокое кровяное давление является очень распространенным явлением, поэтому важно, чтобы врач контролировал данный симптом в ходе лечения.
Бевацизумаб был впервые одобрен в США FDA как часть комплексной терапии метастатического рака груди в 2008 году. Данное утверждение основывалось на исследовании, в котором прием бевацизумаба с химиопрепаратом паклитаксел (Taxol) остановил рост опухоли на более длительное время, чем применение одного препарата паклитаксел.

Координационный центр Tlv.Hospital окажет помощь в организации диагностики и лечения рака груди в Израиле, в том числе таргетной терапии. Современные возможности израильской медицины гарантируют наилучший результат в лечении онкологии.
Персонализированный подход в таргетной терапии позволяет точно подобрать препараты на основе генетических тестов, которые определяют наличие той или иной мутации опухолевых клеток.
Смотрите видео об общих принципах таргетной терапии опухолей
Доктор Элла Теппер — главный врач отделения онкологии в МЦ Assuta, ведущий онколог в Израиле, специалист в сфере современных разработок (таргетной терапии) в лечении рака.
источник
Данная технология лечения рака относительно новая, ей не более 50 лет. В перевод с английского название можно истолковать как «удар по конкретной цели», то есть действие на пораженные клетки, минуя здоровые.
Этот вид терапии воздействует исключительно на пораженные клетки, минуя здоровые, вернее действие таргетной терапии в онокологии направлено непосредственно на специфические молекулы в организме, из-за которых растут и размножаются раковые клетки.
Кроме того, таргетные препараты перекрывают доступ кислорода к опухолевым тканям, что так же мешает дальнейшей жизнеспособности пораженных клеток. Благодаря этому способу лечения перестает расти не только сама опухоль, но пресекается и распространение метастазов.
На сегодняшний день существуют вариации лечения раковых опухолей при помощи таргетной терапии:
- Нарушение работы структур, поддерживающих опухолевые клетки жизнеспособными;
- Действие только на пораженные клетки, включая рецепторы, гены и различные внутриклеточные ферменты;
- Уничтожение сигнального пути для раковых клеток, что мешает их жизни и размножению.
Данный способ лечения может применяться как самостоятельно, так и в комплексе с химиотерапией для увеличения шансов на благоприятный прогноз. Таргетная терапия менее токсична, чем химическая или лучевая, но все же имеет свои побочные эффекты.
Таргетная терапия (название своё получила от английского «target» – «цель») — один из видов лечения злокачественных опухолей, получивший особенно мощное развитие в первых десятилетиях 21-го века.
Большинство таргетных препаратов не обладают способностью убивать раковые клетки, они только замедляют их рост. Полного излечения они не дают.
Большим преимуществом таргетных препаратов является то, что выпускаются они в основном в виде таблеток, которые пациент может принимать дома. Больше нет необходимости длительного лечения в стационаре, трудной и обессиливающей реабилитации – ведь таргетные препараты не оказывают влияния на функционирование здоровых клеток, поэтому они практически не имеют побочных эффектов, и таргетная терапия проходит незаметно для пациента.
Методы воздействия таргетной терапии на опухоли различной локализации несколько отличаются. Так, например, при раке молочной железы вводятся таргетные гормоны, несущие программу уничтожения раковых клеток, либо ведется терапия, убивающая гормоны, необходимые для разрастания и распространения опухоли.
При немелкоклеточном раке легкого пациенту вводятся средства, воздействующие на белки, необходимые для размножения пораженных клеток. То же самое происходит и при меланоме. Сначала выявляются типы мутации белков, а затем вводятся вещества, которые будут уничтожать такие белки.
В итоге у опухоли не остается ресурсов для жизнедеятельности, и ее развитие приостанавливается, а у пациента наступает стадия ремиссии.
К числу «мишеней», которые могут поражать таргетные препараты, можно отнести следующие:
- Мутировавшие гены, благодаря которым злокачественные клетки могут расти и делиться;
- Молекулы, несущие информацию о запрограммированной гибели клеток;
- Рецепторы к различным гормонам, находящиеся на поверхности злокачественных клеток (при опухоли груди);
- Рецепторы, отвечающие за развитие системы сосудов, необходимой для жизнедеятельности опухоли.
По химическому составу таргетные препараты можно разделит на два вида: малые молекулы и антитела.
Малые молекулы создаются синтетическим путем в лабораторных условиях. Они могут попадать внутрь пораженной клетки и там по необходимости воздействовать на бели, ДНК или РНК. Эти средства стоят дешевле, чем препараты, относящиеся к классу антител.
Антитела – это белки, которые получаются вследствие развития иммунитета у животных (в основном мышей) к отдельным видам злокачественных заболеваний. Для того, чтобы человечески организм не отторгал такой белок, с ним проводят различные генетические модификации.
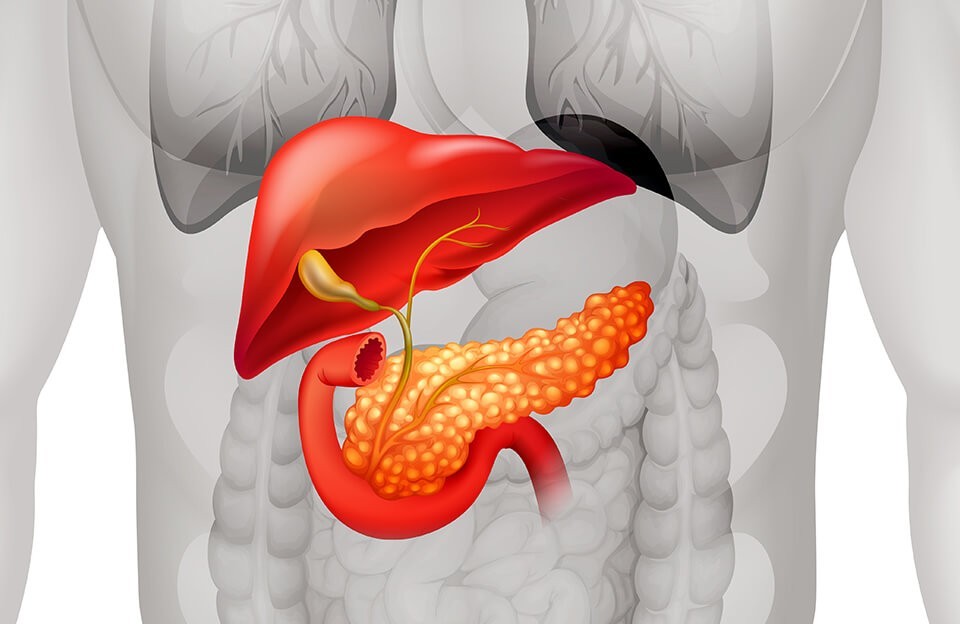
До сих пор точные причины возникновения рака поджелудочной железы неизвестны. Установлены лишь некоторые факторы, повышающие вероятность развития заболевания:
- курение
- сахарный диабет в течение длительного времени
- хронический панкреатит (воспаление поджелудочной железы)
- язвенная болезнь желудка
- уже имеющийся рак поджелудочной железы у кровных родственников
- генетические синдромы (мутация гена BRCA2, синдром Линча, семейная
атипичная множественная меланома) - ожирение.
Список медикаментов, которые используются для лечения онкологии в отечественных клиниках, не так широк, как того хотелось бы.
- «Zomera» используется для лечения метастазирования в костные ткани при любом типе исходной опухоли;
- «Авастин» — с успехом применяют для терапии рака железистой ткани груди, почки и толстой кишки;
- «Glivek» назначается для борьбы с опухолями желудка, кишечного-выводящего тракта, хроническим миелолейкозом, суперфициальной меланомой, светлоклеточным раком почки;
- «Femara» — препарат химиотерапии для лечения новообразований в молочных железах и грудине;
- «Sandostatin» — таргетная терапия меланомы, карциомы, некоторых форм акромегалии, мелкоклеточного рака легких.
Любой высокоточный препарат должен быть назначен в строгой дозировке, в соответствии с необходимой курсовой длительностью лечения. Принцип воздействия таргетных лекарств основан на фиксированном запоминании защитными силами организма информации и здоровом геноме пациента.
Именно такой подход наиболее оправдан в качестве профилактических, диагностических и лечебных мер в онкологии. Комплексная терапия, которая совмещает таргетные средства с другими путями воздействия на опухоль, позволяет больным пережить пятилетний период, без летального исхода.
Используя комбинированное лечение, онкологи справляются с такими заболеваниями, как рак желудка, молочной железы, матки, колоректальной области, кости, печени, легких, почки, поджелудочной, щитовидной и предстательной железы. А также с базалиомами, нейроэндокринными образованиями, лейкозами, меланомами и лимфомами.
Таргетная терапия используется как в комплексе с химиотерапевтическим лечением, так и самостоятельно, против тех видов опухолей, в клетках которых обнаружен белок «мишень», на который смогут воздействовать таргетные вещества. К таким видам опухолей можно отнести следующие:
- Меланома;
- Колоректальный рак;
- Метастатический рак легкого;
- Плоскоклеточные разновидности злокачественных опухолей;
- Рак желудка и поджелудочной железы;
- Развитие злокачественной опухоли груди;
- Рак почек.
И это далеко не полный список, ведь данный метод терапии достаточно новый и специалисты до сих пор продолжают исследования, а также ведут наблюдения по поводу эффективности сочетаний таргетных препаратов между собой, а так же со стандартными химиотерапевтическими средствами.
Препараты для таргетной терапии при раке молочной железы позволяют длительно сдерживать рост опухоли или уменьшить массу находящихся в ней клеток. Такой перевод рака из крайне агрессивного и непредсказуемого состояния в хоть и злокачественное, но вялотекущее заболевание, является целью не худшей, чем полное излечение.
Агенты таргет-терапии, одобренные для лечения маммарной карциномы, разделяют на три больших группы:
- Средства, направленные на определенные «таргеты»-мишени. Это, например, антиэстрогены или анти-HER2-средства: Герцептин, Лапатиниб.
- Препараты, которые должны ухудшить условия существования опухоли. Это, к примеру, антиангиогенные средства (ангиогенез – это развитие новых сосудов, в частности, внутри опухоли).
- Лекарства, подавляющие передачу сигнала внутри массы раковых клеток. Большинство таргет-агентов еще проходят фазы клинических исследований.
Большинство данных препаратов относятся к классу моноклональных антител. Это молекулы, идентичные тем, которые образуются при вторжении в организм чужеродного агента.
Выделяют два основных вида:
- Аденокарцинома (экзокринный рак) составляет большую часть всех случаев злокачественных новообразований поджелудочной железы.
- Эндокринный рак растет из нейроэндокринных (гормонопродуцирующих) клеток, его еще называют раком островковых клеток или нейроэндокринной опухолью.
В МКБ-10 рак поджелудочной железы имеет код С25, с дополнительными кодами младшего уровня, устанавливаемыми в зависимости от локализации в разных отделах (например С25.0 — рак головки ПЖЖ, С25.1 — рак тела ПЖЖ); отдельный код есть у рака ПЖЖ, выходящего за границы одной локализации.
Куда метастазирует рак поджелудочной железы?
Для этой злокачественной опухоли характерно быстрое распространение на близлежащие области. ПЖЖ окружена сразу несколькими важными структурами брюшной полости, что делает распространение раковых клеток быстрым. Опухоль даже на ранних стадиях часто прорастает в печень, желчный пузырь, кишечник, брюшину.
Стадии заболевания устанавливают для выбора оптимальной тактики лечения.
- 1 стадия. Рак ограничен пределами поджелудочной железы и может быть
полностью удален хирургическим путем. Размер опухоли не превышает 2 см. - 2 стадия. Опухоль поражает близлежащие органы и лимфатические узлы, но все
еще может быть полностью удалена хирургическим путем. - 3 стадия. Опухоль прорастает в крупные кровеносные сосуды вокруг нее и затрагивает лимфатические узлы, и ее удаление при операции возможно не во всех случаях.
- 4 стадия. Есть метастазы в органы брюшной полости, брюшину. Хирургическим способом опухоль удалить невозможно.
Симптомы зависят от места расположения очага раковых клеток и от степени вовлеченности ткани железы.
На ранних стадиях рак себя никак не проявляет, затем пациент может заметить:
- желтуху
- потемнение мочи и осветление кала
- боль в верхней или средней трети живота и спины
- потерю аппетита
- снижение веса без видимых причин
- общую слабость, утомляемость
- склонность к тромбообразованию.
При появлении нескольких подобных симптомов лучше сразу обратиться к врачу.
При раке поджелудочной железы с метастазами в печень отмечают также чувство переполнения желудка после еды (даже если было съедено небольшое количество пищи), зуд кожи, боль в правом подреберье.
Современные клиники Израиля уделяют огромное внимание этапу диагностики раковых новообразований поджелудочной. Определить вид заболевания и все его особенности помогает сверхточная аппаратура и применение уникальных методик исследования. Комплексное обследование пациента включает следующие методики:
- Осмотр и консультация врача;
- Лабораторные исследования;
- УЗИ (в том числе эндоскопическое УЗИ);
- Компьютерная томография;
- МРТ;
- Биопсия;
- Лапароскопия.
При необходимости врач имеет возможность назначить дополнительные тесты и обследования. И только после получения достоверных данных назначается курс лечения рака поджелудочной железы. Консультационный центр Tlv.
Инструментальные обследования могут включать:
- ультразвуковое исследование органов брюшной полости
- компьютерную томографию (КТ)
- магнитно-резонансную томографию (МРТ)
- позитронно-эмиссионную томографию (ПЭТ). Это более точный и современный метод, который позволяет обнаружить очаги поражения малого размера.
Показывает ли УЗИ поджелудочной железы признаки рака? Так как поджелудочная железа
прикрыта тонким кишечником, печенью с желчным пузырем, селезенкой, орган
достаточно сложно визуализировать и признаки опухоли видны не всегда. Также на
УЗИ не видны образования маленького размера. Поэтому при подозрении на
злокачественное образование врач может назначить: - Эндолюминальную эндоскопическую сонографию. При этом методе ультразвуковой датчик вводят в кишечник для получения более детальных снимков железы.
- Эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ), при которой специальный краситель вводят в протоки желчного пузыря и поджелудочной железы, а затем делают рентгеновские снимки, на которых можно обнаружить опухоль.
- Лапароскопию — введение в брюшную полость оптической системы для осмотра внутренних органов.
- Цитологию перитонеальной жидкости, когда исследуют образец выпота в брюшной полости.
Для окончательного диагноза часто делают биопсию поджелудочной железы с последующим изучением полученного фрагмента под микроскопом.
Наличие в крови онкомаркера CA 19-9 в настоящее время не считают достоверным диагностическим признаком, но изменение его уровня может указывать на эффективность проводимого лечения. Биохимический анализ крови позволяет выявить повышение или снижение уровня билирубина.
После прохождения необходимых обследований врач прописывает индивидуальную программу лечения каждому пациенту. Для борьбы с онкологией поджелудочной железы внедряются самые современные методики лечения и прогрессивное медицинское оборудование.
- Хирургическое лечение.
- Химиотерапия.
- Радиотерапия.
Курс лечения будет зависеть от стадии рака поджелудочной железы, размера опухоли, ее местоположения и прочих характеристик. Также принимается во внимание возраст пациента, его физическое здоровье и т.д.
- Хирургическое лечение раковых опухолей, локализующихся в поджелудочной железе, считается самым эффективным. Чаще всего применяется операция Уиппла (подразумевает удаление головки железы). Обязательное условие проведения операции – хорошее здоровье и средняя возрастная категория. В случае, когда данная операция невозможна, проводится хирургическое лечение, которое облегчает симптомы болезни.
Химиотерапия обычно применяется до или после оперативного вмешательства. До операции противораковые медикаменты позволяют существенно уменьшить размер злокачественной опухоли в поджелудочной железе. После операции лекарства применяются для того, чтоб уничтожить клетки рака, оставшиеся в организме. Также химиотерапия применяется для борьбы с метастазами . При необходимости, противораковые препараты используется в комплексе с лучевой терапией.
Таргетная терапия иногда применяется при данном диагнозе. Задействуют препараты, направленные на определенные молекулы (белки), расположенные на поверхности злокачественных клеток. Эти молекулы передают сигналы клеткам, запуская их рост и деление.
Таргетная терапия может быть рекомендована в качестве первичного лечения распространенного и рецидивного рака поджелудочной железы. Ее часто назначают вместе с цитостатическими средствами.
В процессе планирования таргетной терапии – выбора препаратов, доз и графика – принимаются во внимание особенности организма каждого пациента. Кроме того, могут быть рекомендованы иные виды терапии рака поджелудочной железы.
Слово «таргет» переводится с английского как «мишень». А суть самого способа – точечно атаковать опухоль, сделав клетки новообразования уязвимыми и ослабленными. Главный принцип работы таргетных препаратов: получение антител к выявленному типу рака, генетическое запоминание болезни и выявление белковых связей, ответственных за репликацию и прогресс развития опухоли.
Такой подход нельзя рассматривать в рамках иммунотерапии, поскольку все препараты с такими характеристиками разительно отличаются от вакцин, направленных на усиление противоопухолевого иммунитета. При вакцинации ответ дают только злокачественные опухоли в легких формах I и II стадии, а химиотерапия позволяет воздействовать на метастазирующие образования III и IV фазы.
Таргетная терапия основана на достижениях молекулярной биохимии и генетики, ученые уже установили принципы, которые являются основополагающими при образовании, росте и прогрессировании раковой опухоли.
Высокоагрессивные заболевания, к которым, без сомнения, относятся все типы рака – должны излечиваться не на симптомном, а на генетическом уровне. Агрессивность рака можно успешно снизить, если научить человеческий организм вырабатывать рекомбинантные антитела, блокирующие опасный и мутирующий ген. Именно в этом и состоит суть воздействия таргетных средств.
Эти препараты менее токсичны, чем классические средства, которые использует химиотерапия. Поэтому могут применяться в тех случаях, когда крайне истощенному раком больному остальные лекарственные средства противопоказаны.
Отсутствие негативных последствий позволит избежать лишней нагрузки в виде сопутствующих стимулирующих воздействий. А также от лечения, направленного на повышение и поддерживание стабильного уровня гемоглобина.
Самолечение подобными препаратами недопустимо! Средства таргетной терапии должны назначаться специалистом подконтрольно, а в ходе курса пациент обязан несколько раз пройти дополнительные обследования, помогающие адаптировать дозу основного действующего вещества.
Основная задача лечения — это полное удаление всех раковых клеток в железе и окружающих тканях. Если это невозможно, то нужно предотвратить рост опухоли, ее распространение и тем самым уменьшить симптомы. Выбор метода зависит от стадии заболевания и состояния пациента.
- Операция Уиппла: убирают головку поджелудочной железы, фрагмент желудка, желчный пузырь, желчные протоки и участок тонкого кишечника. Оставшейся части поджелудочной железы достаточно для производства инсулина и пищеварительных ферментов.
- Тотальная панкреатэктомия с резекцией всей железы, участков желудка, тонкой кишки, общего желчного протока, селезенки, желчного пузыря и регионарных лимфоузлов.
- Дистальная резекция, когда удаляют тело и хвост ПЖЖ, селезенку.
- Регионарная терапия, с введением лекарства непосредственно в железу.
- Системная терапия с введением препаратов, убивающих раковые клетки в мышцу или вену. Применяемые препараты: гемцитабин, паклитаксел, 5-фторурацил, иринотекан, оксалиплатин, капецитабин, цисплатин, доцетаксел.
Используют два вида лучевой терапии:
- Внутренняя терапия, когда радиоактивное вещество доставляется в ткань опухоли с помощью катетеров или игл.
- Лечение с помощью внешнего излучения, генерируемого специальными установками.
Синтезированные вещества, например, ниволумаб, ипилимумаб, пембролизумаб, демцизумаб стимулируют собственную иммунную систему бороться с раковыми клетками. Большая часть этих препаратов только проходят клинические испытания для лечения рака ПЖЖ.
После хирургической операции необходимо адекватно обезболить пациента, наладить работу желудочно-кишечного тракта, так как любая операция на органах брюшной полости вызывает временное нарушение функции кишечника.
Это означает, что нужно соблюдать диету (следовательно, есть ограничения в приеме пищи). В раннем послеоперационном периоде сначала разрешают немного пить, затем постепенно переходят на полужидкую пищу..
Постепенно больному начинает больше двигаться и заниматься физкультурой не менее 30 минут в день.
Как правило, после удаления опухоли проводят 6-месячный курс химиотерапии. Хороший контакт с врачом, точное следование плану лечения необходимы для успешного восстановления после операции. Очень важно своевременно получить психологическую поддержку.
Нет никаких научных данных об эффективности нетрадиционных методов при раке ПЖЖ.
То, что некоторые противоопухолевые препараты синтезированы из растений (например, доцетаксел получают из Тиса ягодного (Táxus baccáta), не говорит о возможности лечения травами. В лекарственных средствах содержание растительных компонентов стандартизировано, что позволяет рассчитать правильную дозировку и минимизировать побочные эффекты.
Информация носит справочный характер, не предназначена для самостоятельной диагностики и лечения. Имеются противопоказания. Необходима консультация специалиста.
Онкологические заболевания являются одной из самых серьезных проблем современной медицины. Среди женщин особенно часто распространена опухоль молочной железы. Это заболевание подразумевает формирование в груди очага раковых клеток, которые начинают активно делиться, формируя злокачественные новообразования. Чаще всего патологические образования в молочных железах относятся к типу «карциномы».
Карциномы формируются в участках организма, где есть эпителиальная ткань. Новообразования могут располагаться в молочных протоках, в отделах, образующих молоко, а также в участках, где отсутствует железистая ткань. Карциномы со временем могут распространяться по всему организму в виде развившихся метастазов.
Рак груди – не только женская проблема. Есть случаи данного заболевания и у мужчин, однако, мужчины редко подозревают у себя эту болезнь и часто обращаются за помощью слишком поздно.
Поскольку рак груди провоцируют различные факторы, то это заболевание распространяется все больше. Несмотря на усилия врачей и ученых, лечение рака молочной железы все еще является трудным делом.
Удастся ли вылечить карциному – зависит от многих обстоятельств. На это влияют индивидуальные особенности организма пациентки, течение заболевания, но самым основным аспектом является стадия развития рака.
На начальных стадиях удается достаточно успешно лечить данную патологию, но этого нельзя сказать о запущенных случаях. На последней стадии болезни врачам приходится бороться за продление жизни больного, а вот возможности полного излечения почти нет.
Поэтому так важно своевременно обнаружить болезнь, чтобы лечение рака груди было успешным.
Лечение рака молочной железы проводится с помощью разных методов. Обычно эти методы используют в сочетании друг с другом, в зависимости от картины болезни. Основные методы лечения рака молочной железы таковы:
- Оперативный метод.
- Химиотерапия.
- Радиотерапия.
- Гормонотерапия.
- Таргетная терапия.
Каждый из способов лечения карцином имеет свои особенности, и прежде чем остановить выбор на одном из них, врач должен провести полную диагностику и удостовериться в его целесообразности.
Онкологическая клиника в Москве ¦ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ ¦ Лечение рака молочной железы таргетной терапией
ERBB2 (HER2 или HER2/neu) -это мутировавший ген, который способствует росту злокачественной опухоли. Он является представителем семейства рецепторов эпидермального фактора роста. Данный ген контролирует и стимулирует рост белка, расположенного на поверхности клеток молочной железы.
Каждая здоровая клетка содержит 2 копии гена HER2. Иногда в ее составе находится избыточное количество гена, поэтому организм вырабатывает слишком много белка HER2. Такое состояние называется гиперэкспрессией HER2.
Трастузумаб специально разработан для связывания дополнительных белков HER2 и остановки роста опухоли у женщин с HER2-положительным раком молочной железы. Препарат также способствует стимуляции работы иммунитета. Его назначают внутривенно или в виде подкожной инъекции. Могут применять в следующих случаях:
- В комбинации с цитостатиками в качестве адъювантного лечения после операции у женщин с высокой степенью риска метастатической опухоли. Его дают в одно время с химиотерапией или после нее. Лечение может быть продолжено в течение года после завершения химиотерапии.
- Используется в качестве монотерапии метастатической опухоли. Прием осуществляется, пока болезнь прогрессирует.
Лечение данным препаратом таргетной терапии при раке молочной железы проводится амбулаторно, как правило, три раза в неделю. Первое вливание занимает 90 минут, последующие дозы порядка 30. Если это инъекции, то от 2 до 5 минут. В течение 2 часов (при первой дозе – 6) пациентка пребывает в клинике.
Если проводиться лечение первичного рака, то трастузумаб принимается на протяжении года, если вторичного, то пока будет держать заболевание под контролем.
К распространенным побочным эффектам относят диарею, тошноту, гриппоподобные симптомы, к реже встречаемым – рвоту, одышку, головную боль, головокружение, проблемы с сердцем.
Пертузумаб (Perjeta ®) — еще один препарат, нацеленный на белки HER2. Применяется с трастузумабом и таксанами (доцетаксел) при терапии метастатического HER2-положительного рака груди, а также местно-распространенного, когда опухоль проникла в ткани и лимфатические узлы под грудину, вокруг груди и шеи – не возможности удалить ее хирургическим путем.
Его могут назначать пациенткам, которые не получили до этого терапию против белков HER2 или цитостатического лечения. Прием трастузумаба и пертузумаба может продолжаться до тех пор, пока держит под контролем заболевание.
Вводиться внутривенно, как правило, в руку или ногу. Лечение данным средством таргетной терапии при раке молочной железы осуществляется амбулаторно на протяжении 3-х недель. Обычно процесс занимает от 30 до 60 минут или дольше, если дается с другими препаратами.
Среди потенциальных нежелательных последствий приема пертузумаба отмечают утрату аппетита, диарею, тошноту, сыпь на коже, воспаления в полости рта, усталость, фебрильную нейтропению (критическое снижение нейтрофилов), анемию, затрудненное дыхание, сухость или зуд кожи, истончение или выпадение волос.
Трастузумаб эмтанзин (Trastuzumab emtansine) состоит из трастузумаба и эмтанзина (DM1), не так давно разработанных противораковых лекарств. Медикамент вводят внутривенно. Показанием является HER2-положительный РМЖ с метастазами при отсутствии предварительного лечения трастузумабом или таксанами, отдельно или в комплексе.
Lapatinib (Tykerb) – один из группы противоопухолевых препаратов, называемых ингибиторами тирозинкиназы, останавливающий рост и деление клеток. Lapatinib известен как двойной ингибитор киназы, потому что нацелен против HER2 и HER1 рецепторов. Он работает внутри раковых клеток, блокируя сигналы для их роста.
Препарат назначается только пациенткам с высоким уровнем HER2. Согласно статистике, рак молочной железы с HER2-положительным статусом встречается лишь у 20% больных РМЖ.
Его принимают перорально, за час до еды или через час после нее. Лапатиниб может предписываться в комбинации со следующими лекарственными средствами для лечения метастатической опухоли с HER2-положительным статусом:
- Капецитабином (Кселодой) при неэффективности трастузумаба или других видов цитостатиков.
- Летрозолом (Femara) – данная схема назначается пациенткам в период постменопаузы при эстроген-положительной распространенной опухоли с HER2-положительным статусом. Это препарат гормональной терапии.
Поскольку Lapatinib воздействует только на раковые клетки, побочных эффектов меньше, чем после химиотерапии. Их количество увеличивается, если подключают гормональную терапию или лечение цитостатиками.
Лучевая терапия использует лучи высокой энергии или их частицы, чтобы разрушить опухолевые клетки. В некоторых случаях радиотерапию применяют в лечении рака поджелудочной железы в Израиле, однако реже, чем оперативное вмешательство или лечение цитостатическими средствами.
Облучение могут назначить в тот же период времени, что и химиотерапию – иначе этот метод именуют химиолучевой терапией. Некоторые цитостатики повышают эффективность радиотерапии.
Лучевую терапию при раке поджелудочной железы рекомендуют в следующих ситуациях:
- В качестве базового метода, часто в виде химиолучевой терапии при опухолях местно-распространенного характера.
- Для устранения патологических сегментов, которые остались после оперативного вмешательства или лечения цитостатиками, а также для снижения вероятности возврата заболевания.
- Чтобы ослабить боль и уменьшить симптомы метастатического рака (за счет уменьшения опухоли снижается давление, вызывающее боль). Паллиативная радиотерапия дается в меньших дозах. Обычно назначают короткие курсы лечения, реже вызывающие побочные эффекты.
- В качестве химиолучевой терапии перед хирургическим вмешательством, чтобы уменьшить объем опухоли.
Радиотерапия тщательно планируется с целью обеспечить максимально эффективный результат. Процессом планирования занимается радиационный онколог, это занимает несколько визитов.
Данное заболевание обычно лечат с помощью дистанционного или внешнего облучения. Ускоритель направляет излучение через кожный покров к опухоли и некоторым тканям, окружающим ее. Терапия предполагает ежедневные процедуры, занимающие 10-15 минут, на протяжении пяти – шести недель.
Этот метод обычно рекомендуют при опухолях поджелудочной железы местно-распространенного характера. В большинстве случаев применяют 5-фторурацил ( 5-фу).
Лучевая терапия рака поджелудочной железы может вызвать определенные негативные последствия, такие как усталость, диарею, рвоту. Обычно эти симптомы имеют среднюю степень выраженности и зависят от длительности и дозы лечения.
Во-первых, химические препараты регулируют рост раковых клеток. При направленном воздействии на пораженные клетки, эти лекарства разрушают сложные процессы на биохимическом уровне. Происходит подконтрольная регуляция жизненного цикла клетки, благодаря угнетению ее основных функций. Таким образом, таргетные средства блокируют деление раковой клетки.
Во-вторых, препараты снижают способность новообразования развиваться и поражать новые области. Для полноценного роста опухоли необходим постоянный приток крови, и для этих целей образование, в ходе своего роста, формирует целый ряд видоизмененных кровеносных сосудов, таким образом, снабжая себя необходимым объемом крови.
Вещества, входящие в состав улучшенной химиотерапии, препятствуют созданию таких сосудов. Отличные результаты при лечении различного типа рака почки и легких по этому принципу — показали препараты «Талидомид» и «Авастин».
В-третьих, такая химиотерапия напрямую воздействует на регуляторные процессы в иммунной системе человека. Они помогают нашему иммунитету своевременно распознать клетки рака, которые, как известно, продуцируются из ранее здоровых, привычных системе, макрофагов.
Таргетные средства подстегивают защитные функции и обозначают чуждые органам и тканям образования, благодаря чему иммунная система может заметить опасность на ранних сроках заболевания. В данном случае химиотерапия выступает своего рода прививкой, когда больному намеренно вводят малые дозы мертвых или ослабленных раковых клеток.
Иммунитет реагирует на эту вакцинацию и воспринимает опухоль, например, рак легких, как чужеродное вторжение. А значит, учится различать здоровые состояния клеток от мутировавших под воздействием рака.
Высокоэффективность таргетных препаратов признана онкологами с мировым именем. Специализированные клиники успешно лечат при помощи химиотерапии рак легких, молочных желез, различные типы меланомы, яичников, простаты, кишечника, печени и почки.
Каждое из лекарств этого направления постоянно находится в стадии улучшения, что позволяет воздействовать на рак согласно не только его типу и форме, но и стадии. Исследования в этом направлении финансируются из многочисленных институтских фондов, потому что экспериментальные средства дают большой процент выживаемости даже в случае рецидива.
У данного способа лечения есть свои преимущества и недостатки. К плюсам таргетных препаратов можно отнести следующие:
- Повышают эффективность при использовании совместно с химиотерапевтическим лечением;
- Практически не задевают своим воздействием здоровые клетки, что снижает количество негативных эффектов;
- Работают даже при запущенных формах рака, увеличивая срок жизни на месяцы, недели, а иногда и годы;
- Форма выпуска большинства средств – таблетки, что позволяет не травмировать дополнительно организм пациента;
- Действуют даже на те злокачественные клетки, которые нечувствительны или мало чувствительны к химическим препаратам.
| Наименование услуги | Стоимость |
| Консультация врача-химиотерапевта | Цена: 5 150 рублей |
| Проведение интратекальной химиотерапии | Цена: 15 450 рублей |
| МРТ головного мозга | Цена от 8 900 рублей |
| Химиотерапия | Цена от 50 000 рублей |
| Комплексная программа ухода за онкологическими больными и ХОСПИС | Цена от 9 690 рублей в сутки |
| Программа онкодиагностики желудочно-кишечного тракта | Цена от 30 900 рублей |
| Программа онкодиагностики легких | Цена от 10 250 рублей |
| Программа онкодиагностики мочевыделительной системы | Цена от 15 500 рублей |
| Программа онкодиагностики «женское здоровье» | Цена от 15 100 рублей |
| Программа онкодиагностики «мужское здоровье» | Цена от 10 150 рублей |
Для проведения таргетной терапии используются различные препараты в зависимости от строения и локализации опухоли.
Использование данного препарата увеличивает выживаемости практически вполовину, а также снижает вероятность рецидивов. Наиболее эффективно применение препарата в комплексе с химиотерапией.
Применяется при лечении злокачественных опухолей желудочно-кишечного тракта, а также для борьбы с хроническим миелолейкозом.
Данный препарат используется при лечении Неходжкинских лимфом.
Наиболее часто назначается при лечении метастатических и обширных опухолей молочной железы, особенно, если пациент до этого уже получал химиотерапевтическое лечение. Кроме того, препарат может использоваться для лечения опухолей мозга с метастазами.
В основном используется в комплексе с химиотерапевтическим лечением, значительно повышая его эффективность. Особенно при опухолях легких, почек, молочной железы, толстой кишки и головного мозга.
Данное лекарство мешает разрастаться сосудам, которые необходимы для существования злокачественной опухоли. Таким образом, рак перестает расти, а со временем и вовсе переходит в стадию ремиссии.
Применяется для борьбы с раком почек. Благодаря данному препарату опухоль перестает расти, а общее самочувствие пациента улучшается.
В основном применяется при злокачественных опухолях легких, если стандартная химиотерапия не подействовала. Препарат устраняет такие симптомы, как боль в груди, кашель и одышка. Кроме того, его применение значительно снижает темпы разрастания опухоли, благотворно отражается на самочувствии пациентов и увеличивает продолжительность жизни.
Данное лекарство также вполне успешно используется при лечении меланомы, рака почек с метастазами, опухолях печени, поджелудочной железы, пищевода и не только.
В большинстве случаев способствует уменьшению опухоли. Чаще всего используется при лечении женщин, больных раком легких, которые до этого не курили. Нередко применяется в комплексе с другими препаратами для химиотерапии.
Пока на эти виды карцином действуют только препараты для классической химиотерапии, но ведутся разработки ингибиторов PARP (полиАТФ-рибозно-полимеразные). Сама PARP восстанавливает разрывы цепочек ДНК в опухолевых клетках, что позволяет раку развиваться дальше.
На данный момент анти-PARP-препарат Инипариб проходит клинические испытания, но первые их результаты обнадеживают: уменьшилась скорость прогрессирования высокозлокачественных карином, увеличилась выживаемость.
Таким образом, таргетная терапии в лечении рака молочной железы – это та «соломинка», которая позволяет поддерживать лучшее качество жизни как женщин с метастатическими опухолями, так и излечить неинвазивный рак железы, обнаруженный на ранних стадиях.
Исследования, проводимые в этой области, позволяют рассчитывать, что вскоре женщины с высокозлокачественными типами данной опухоли также смогут надеяться на увеличение продолжительности жизни и улучшение ее качества.
- рецепторы к эпидермальному фактору роста;
- рецепторы к фактору роста сосудов;
- сигнальные белки клеток;
- молекулы, регулирующие апоптоз (прим.: апоптоз — генетически запрограммированная гибель клетки «от старости»);
- гены, отвечающие за рост и развитие раковых клеток;
- выключение ряда генов опухолевой клетки.
Также все препараты можно разделить на две большие группы: малые молекулы и антитела.
Антитела, в силу своего большого молекулярного веса, не могут проникнуть через мембрану опухолевой клетки, поэтому они взаимодействуют в основном с рецепторами на мембранах.
Малые молекулы, за счёт своего маленького веса, могут проникать внутрь клетки и обладают широким спектром мишеней. Также они способны проникать через гематоэнцефаличекий барьер, в нервную ткань, что даёт возможность лечить метастазы в ней.
Тирозинкиназы – специфические ферменты, одни из главных звеньев в цепи передачи внутриклеточного сигнала. Они бывают двух видов: рецепторные и внутриклеточные. Рецепторные имеют часть, которая находится на мембране клетки, внутриклеточные – нет.
К ингибиторам относятся, например, Акситиниб (злокачественные новообразования почки), Гефитиниб (местнораспространённый немелкоклеточный рак лёгкого), Иматиниб (хронический миелоидный лейкоз), Тарметиниб (злокачественная меланома кожи) и т.д.
Так как тирозинкиназы работают не только в опухолевых, но и в нормальных клетках – препараты не лишены токсических побочных эффектов.
Ярким примером является Винтафолид – низкомолекулярный конъюгат, тропный к рецепторам фолиевой кислоты.
Фолаты необходимы для процессов транскрипции ДНК. Так как в опухолевой клетке деление ДНК проходит активно, она экспрессирует (синтезирует и выводит из цитоплазмы на поверхность) на своей мембране много рецепторов к фолатам, чтобы захватить как можно больше вещества.
Винтафолид связывается с рецептором к фолиевой кислоте, захватывается клеткой путём эндоцитоза (прим.: эндоцитоз — процесс захвата клеткой молекул из внешней среды с помощью пузырьков — везикул) и дальше начинает действовать уже внутри клетки, останавливая её рост и вызывая апоптоз.
Целью молекулы являются быстрорастущие клетки рака яичника, немелкоклеточного рака лёгкого, молочной железы, толстого кишечника и почек.
На данном этапе проводятся клинические испытания при лечении рака яичников у женщин, результаты которых успешны.
- примером таких киназ служат киназа BRAF, которая является участником сигнального пути Ras-Raf-MAPK, контролирующего клеточную пролиферацию, дифференцировку и апоптоз. В злокачественных опухолях часто обнаруживаются мутации гена BRAF-киназ, например, в случае метастатического колоректального рака, меланомы или папиллярного рака щитовидной железы.
Примером препарата может быть Вемурафениб, вызывающий апоптоз клеток меланомы. Он активен только против клеток, линия которых имеет мутацию в опредёленном гене.
Но, к сожалению, клетки злокачественных новообразований могут приспосабливаться и мутировать, формируя обходные пути для получения энергии, выживания и роста опухоли.
Препараты моноклональных антител чаще всего получены рекомбинантным способом и представляют собой антитела, вырабатываемые клонами одной плазматической клетки. Препараты, например, Ритуксимаб (используется в лечении неходжскинской лимфомы), Ипилимумаб (лечение меланомы), Трастузумаб (рак молочной железы) успешно применяются в клинической практике.
Протеинкиназа, относящаяся к семейству белков эпидермального фактора роста. Все белки семейства состоят из трёх частей – внеклеточной, внутримембранной и внутриклеточной. Мишенью таргетных препаратов является внеклеточная его часть.
Повышается экспрессия этого белка на клетках рака молочной железы. Также этот белок могут производить в большом количестве клетки рака яичников, желудка, матки.Взаимодействие молекулы с этим рецептором запускает каскад внутриклеточных реакций, дающий клетке энергию для синтеза своего белка и размножения.
Препараты, например, Герцептин, направлены на блокаду этого белка на мембране опухолевой клетки, что ведет к её энергетическому голоданию и гибели.
Герцептин или Трастузумаб, представляет собой порошок для приготовления растворов, содержащий рекомбинантные антитела, которые взаимодействуют с внеклеточной частью рецептора HER2. Опухолевые клетки производят слишком много таких рецепторов, Герцептин направлен на их блокирование и торможение роста злокачественных клеток. Используется при лечении рака молочной железы.
Это также моноклональные антитела, блокирующие рецептор HER2. Он действует немного по-другому – блокирует передачу внутриклеточного сигнала к росту клетки. Опухолевая клетка не получает энергии и питательных веществ, останавливается в росте и развитии и подвергается разрушению.
Трастузумаб эмтазин – международное непатентованное название препарата. Его молекула состоит из двух частей: одна – трастузумаб – описана выше. Другая – производное ингибитора полимеризации тубулина DM1, вызывает остановку деления опухолевой клетки и её гибель.
Этот препарат за счёт своего сложного строения более специфичен (прим.: специфичность — свойство белковых молекул или иных веществ взаимодействовать только друг с другом). Компонент DM1 работает только в тех клетках, с которыми связался Трастузумаб, то есть, в клетках опухоли. Здоровые клетки в гораздо меньшей степени подвергаются цитостатическому эффекту.
К сожалению, как химиотерапия, так и облучение различными изотопами, необходимые для профилактики рецидивирования и метастазирования карциномы, являются токсичными для организма методами. Улучшить их переносимость можно, если дополнять лечение препаратами, не действующими на здоровые клетки. На это рассчитана появившаяся не так давно методика – таргетная терапия рака молочной железы.
К 90-м годам двадцатого века ученые открыли и изучили большинство ключевых механизмов, регулирующих деление и выживаемость раковых клеток. Стало известно, что на их поверхности имеются особые рецепторы, сигнал от которых «включает» специфические ферменты и химические вещества, и таким образом карцинома постоянно растет, обходит иммунную защиту и может метастазировать.
- остановка роста злокачественного новообразования, переход заболевания в хроническую стадию. Рост новообразования замедляется, и пациент может прожить ещё несколько лет или десятки лет без снижения качества жизни;
- тяжёлое состояние пациента, делающее невозможным применение стандартных схем лечения с помощью химиопрепаратов и лучевой терапии;
- снижение агрессивности лучевой терапии и химиотерапии при комбинированном лечении. Применение таргетных препаратов при некоторых локализациях злокачественных новообразований позволяет уменьшить лучевую нагрузку на пациента.
Подобный вид лечения рака молочной железы является особым подвидом медикаментозной терапии, и может применяться как вместе с препаратами для «классической» химиотерапии, так и без них. Таргетная терапия не предполагает отказ от лучевой терапии или операции.
Большинство препаратов, применяемых для таргет-лечения, не уничтожают клетки карциномы молочной железы. Они подавляют механизмы, благодаря которым:
- или отдается команда к их делению;
- или ранее блокировалась их дифференцировка, из-за чего опухоль была менее дифференцированной, то есть – более быстро делящейся и злокачественной.
Решение о том, можно ли в каждом конкретном случае заболевания использовать таргетные препараты принимает специалист. Это зависит от строения клеток опухоли, ее локализации, общего состояния пациента и ряда других факторов.
В основном лечение таргетными веществами назначается в следующих случаях:
- Когда в лечении нуждается пациент пожилого возраста или находящийся в тяжелом состоянии. То есть, в таких ситуациях, когда лечение при помощи химиотерапии противопоказано;
- При необходимости стабилизировать процесс развития злокачественной опухоли и трансформировать его из активного в хронический;
- Для профилактики рецидивов рака, а так же, чтобы остановить распространение метастазов;
- Параллельно с лучевой или химиотерапией, чтобы снизить нагрузку от этих, более токсичных для организма, методов лечения.
Для того, чтобы выяснить целесообразность использования таргетной терапии, проводится молекулярно-генетический анализ злокачественных клеток. Это необходимо, для того, чтобы выяснить, есть ли в клетках то, что может быть целью для применения терапии.
Чаще всего данный метод лечения назначается, если химиотерапия не помогла (то есть рост опухоли так и не остановился), при наличии большого количества метастазов или при 4 стадии развития ракового заболевания.
Противопоказания для таргетной терапии похожи на те, которые выдвигаются для химиотерапевтического лечения, с той лишь разницей, что в данном случае вреда пациенту будет нанесено меньше, поэтому таргетная терапия и является хорошим выходом для ослабленных больных.
Таргетная, как и химиотерапия не применяется в следующих случаях:
- Периоды беременности и лактации;
- Детский возраст, вплоть до 18 лет, так как безопасность и эффективность таргетной терапии при применении для детей до сих пор не доказана;
- Повышенная чувствительность к различным компонентам таргетных препаратов.
- Желтуха возникает, когда опухоль блокирует желчные протоки и пигмент билирубин, содержащийся в желчи, всасывается в кровь в большом количестве. При этом происходит окрашивание кожи, белков глаз в желтый цвет. Моча становится темной, а кал, наоборот, — светлым. Болей в животе при желтухе обычно нет. Для ее устранения проводят стентирование, т.е. помещение в проток пластиковой или металлической трубки, по которой желчь выводится в кишечник. Иногда вместо стента при операции формируют новый проток для отхождения желчи в кишечник.
- Боли при раке поджелудочной железы возникают из-за поражения опухолью нервных окончаний. Для купирования боли применяют обезболивающие препараты, иногда может помочь лучевая терапия; в тяжелых случаях проводят блокаду нервов чревного сплетения.
- Тонкокишечная непроходимость возникает, когда опухоль врастает или сдавливает снаружи кишку (и, следовательно, движение пищи по ней нарушается или полностью останавливается). В этих случаях в тонкую кишку вставляют стент, препятствующий ее блоку или
проводят операцию, при которой формируют обходной путь для пищевой массы, соединяя желудок с участком кишки, расположенным ниже опухоли. - Потеря веса связана с недостаточной выработкой панкреатического сока, нарушением всасывания питательных веществ, а также с тошнотой, рвотой. В этом случае может помочь дробное питание малыми порциями, прием ферментов.
- Рецидив рака поджелудочной железы.
Шансы на выздоровление зависят от:
- расположения опухоли и возможности ее полного удаления
- степени прорастания атипичных клеток в близлежащие органы
- наличия отдаленных метастазов
- общего состояния здоровья.
Экзокринный рак плохо лечится, прогноз пятилетней выживаемости составляет 6%.
Продолжительность жизни при раке поджелудочной железы 4 стадии зависит от устойчивости опухоли к химиотерапии и облучению. В этом случае проводят лечение, улучшающие качество жизни, которое может включать:
- обезболивание
- хирургическую или лучевую билиарную декомпрессию
- нормализацию моторики желудка
- психологическую помощь.
Пациентам достаточно сложно поддерживать вес, так как аппетит снижен от болезни и от препаратов для ее лечения, а недостаток пищеварительных ферментов нарушает переваривание пищи. Кроме того, раковые клетки вырабатывают вещества, разрушающие мышечную и жировую ткань, что может привести к истощению. Диета подразумевает:
- Отказ от жареной, жирной пищи. В качестве источника жиров можно использовать растительное масло (оливковое, рапсовое, арахисовое) масло, орехи и авокадо;
- Дробный прием пищи до 6-8 раз в день;
- Употребление не менее 2 порций фруктов или овощей в день.
Рекомендуют выпивать не менее 6 стаканов жидкости в день.
источник