В структуре онкологической заболеваемости среди женского населения рак молочной железы (РМЖ) занимает первое место. Заболеваемость в нашей стране — неравномерная. В Московской области выявлены наиболее высокие показатели, достигающие 20,07 на 100 000 населения, что в 2 раза выше по сравнению со среднероссийскими, составляющими 10,7. В Петербурге среди женщин данная патология также занимает первое место и составляет 17,4% от всех вновь выявленных больных с опухолями. При такой распространенности даже небольшие проценты осложнений являются значительными цифрами. Неизбежно увеличивается и число послеоперационных осложнений. Отмечается неуклонный рост числа больных и увеличение показателей смертности [1].
Это определяет стратегию борьбы с данной патологией, которая ориентирована на сокращение смертности, увеличение безрецидивного периода и улучшения качества жизни пациенток. Основным этапом лечения РМЖ является хирургический метод, особенно при начальных стадиях заболевания [2].
Больные с онкологией всегда относились к группе повышенного риска развития осложнений. Это связано с исходной иммуносупрессией, обусловленной наличием самого опухолевого процесса, и проведением химиолучевого лечения.
Самое большое количество пациенток РМЖ наблюдается в постменопаузу — это самый опасный возрастной период, потому что на этом фоне происходит снижение адаптационных возможностей и устойчивости эндокринной системы женщины. Данные женщины в возрастном интервале 40-60 лет имеют, как правило, не одно хроническое заболевание, а сочетание двух и трех. К часто встречающимся относились заболевания органов кровообращения, имевшие место у 12,3% лиц, артериальная гипертензия – у 50,7%, сахарный диабет – у 9,6% [3].
Маят В.С. и соавт. (1975) считали, что послеоперационное осложнение – это новое патологическое состояние, которое не характерно для нормального течения послеоперационного периода и не является следствием прогрессирования основного заболевания. С тех пор лучшего определения осложнений не найдено. Частота их развития является ключевым параметром при оценке эффективности любой медицинской процедуры [4].
Именно поэтому «последствия» операций очень важно систематизировать, и такие попытки предпринимались издавна.
Уже давно разработаны различные шкалы и прогностические системы в ургентной хирургии: шкала Ренсона, SOFA, APACH и другие. Позднее появились шкалы и для онкологов: MPM forcancer patients, MPM (Mortality Probability Model), EUROSCORE (cardiac surgery), POSSUM (Physiologic and Operative Severity Score for the enumeration of Mortality and Morbidity), SAPS и другие. Главное в них – попытка точной оценки степени тяжести состояния больного, имеющая цифровой эквивалент. В дальнейшем накопленный опыт позволил исследователям переходить к индивидуальному прогнозу, потому что он точнее определяет стратегию и тактику ведения пациента. Он включал в себя и клинические, и биохимические, и цито-гистологические, и прочие особенности патологии и был напрямую зависим от факторов риска, только оценка их значимости оставалась непростой задачей.
P.A. Clavien и соавт. (1992) предложили общую классификацию периоперационных осложнений. Однако в ней оценка последствий хирургических вмешательств остается ограниченной в связи с отсутствием консенсуса об определении осложнений и распределении их по степени тяжести [5].
В 2004 г. эта классификация была пересмотрена D. Dindo и соавт. [6]. Дискуссия на данную тему продолжается до сих пор. Последний пересмотр был произведен в 2010 г., когда появилась «Accordion» — классификация тяжести хирургических осложнений, описанная Porembka M.R. et al. (2010) [7]. Она в значительной степени универсальна для общей, гастроинтестинальной, сердечно-сосудистой, торакальной хирургии, урологии. Но в ней имеются «ограничения» для применения в некоторых «узких» областях хирургии [8]. В таковые попали и некоторые направления онкологии.
Данные больные всегда относились к группе повышенного риска в отношении развития осложнений, например послеоперационной инфекции в связи с исходной иммуно- и миелосупрессией, обусловленной наличием самого опухолевого процесса и проведением химиолучевого лечения [9; 10].
15-35% онкологических больных имеют клинически выраженные, часто очень тяжелые, последствия в виде тромбоэмболических осложнений. При этом пациенты с развившимися тромбоэмболиями имеют смертность в 2-3 раза выше по сравнению с такими же больными, но без тромбозов [11].
Среди них злокачественные новообразования молочной железы составляют самую сложную и значительную часть данной группы: они давно являются ведущей причиной смерти женщин в возрасте от 35 до 54 лет [12; 13].
Это заставило некоторых исследователей [14; 15] провести анализ последствий хирургических вмешательств с учетом возможных факторов риска, в том числе таких, как ожирение, сахарный диабет, курение, предоперационная лучевая терапия. Но вектор анализа постепенно сместился в сторону глубокого изучения самих онкологических изменений в молочной железе и их влияний на организм женщины. Одни [16; 17] обращали внимание на запущенность. Многие другие – на роль возрастных особенностей [18; 19].
Предпосылки развития осложнений после операций на молочной железе следует искать по нескольким направлениям: первое – это особенности самого заболевания, по поводу которого выполняется операция, второе – характер и объем хирургического вмешательства, а третье – общие изменения гомеостаза у данных пациенток.
Радикальная мастэктомия (РМЭ) по J.I. Madden (1965) считается классикой оперативных пособий при РМЖ. Технические особенности такой операции явно предрасполагают к местным осложнениям: их проводят исключительно с одномоментной подключично-подмышечно-подлопаточной лимфаденэктомией. При этом происходит значительное накопление жидкости при отслаивании кожных лоскутов от грудной клетки, что вызывает дискомфорт у пациенток и увеличивает продолжительность пребывания в стационаре в связи с необходимостью выполнять многократные пункции. Развитие рубцового процесса в области подмышечной вены в дальнейшем может привести еще и к развитию отека верхней конечности.
В последние годы все чаще говорят об органосохраняющей хирургии молочной железы. Это стало возможным благодаря развитию теоретических представлений о характере заболевания, совершенствованию методов адъювантного лечения. В настоящее время, помимо лечебных задач, большое значение приобретает достижение оптимального эстетического результата. Такой подход особенно эффективен при ранних стадиях болезни.
Органосохраняющие операции подразделяются на 3 группы. В первую группу входят туморэктомия, лампэктомия, секторальная резекция молочной железы. Вторая группа — это резекция, предусматривающая удаление от 1/8 до 2/3 железы, квадрантэктомия, характеризующаяся удалением 1/4 части железы, гемимаммэктомия, когда удаляется 1/2 железы. Третью группу составила субтотальная резекция, когда удаляется 75-90% ткани железы вместе с подмышечными, подключичными и подлопаточными лимфоузлами [20; 21].
М. Gosset et al. (2016), V. Strnad et al. (2016) [22; 23] выполняли органосохраняющие операции в сочетании с лучевой терапией на ранних стадиях заболевания РМЖ и получили те же показатели общей и безрецидивной выживаемости, что и при выполнении просто РМЭ.
Современные требования к органосохраняющим операциям заключаются не только в сохранении органа, но еще и в получении хорошего косметического эффекта. А такие результаты получаются путем внедрения пластического компонента в стандартные технологии органосохраняющих операций. В настоящее время для восстановления молочной железы используются различные методы с использованием кожно-мышечных, кожно-подкожных, мышечных лоскутов, экспандеров/имплантатов и их комбинаций. Тем не менее реконструктивно-пластические операции аутотканями могут сопровождаться большим числом осложнений (капсулярные контрактуры, лимфорея, серомы, воспалительные процессы (20-29%)), требующих повторных оперативных вмешательств [24].
Реконструкция молочной железы проводится как одномоментно, так и в отсроченном периоде. Оптимальные сроки проведения отсроченной реконструктивно-пластической операции — 6-12 месяцев после РМЭ при условии завершения адъювантной терапии [25]. Лучевая терапия увеличивает риск развития послеоперационных осложнений у больных, которым была выполнена отсроченная реконструктивно-пластическая операция, особенно с установкой имплантатов. Нельзя не отметить, что риск хирургических осложнений при отсроченных реконструктивно-пластических операциях, выполняемых после РМЭ через 6-12 месяцев, ниже, чем при РМЭ с одномоментной реконструкцией [26].
А.Д. Закиряходжаев и соавт. (2015), проанализировали результаты лечения 31 пациентки после РМЭ. Отсроченные реконструктивно-пластические операции с использованием TRAM-лоскута (поперечный кожно-мышечный лоскут передней брюшной стенки на основе прямой мышцы живота) были выполнены 22 пациенткам, в 10 случаях дополнительно устанавливался эндопротез для придания необходимого объема сформированной молочной железе. Осложнения отмечались у 8 (25,8%) больных. Наибольшее количество осложнений наблюдалось при реконструкции молочной железы TRAM-лоскутом: 6 (27,3%) случаев из 22. Самым грозным осложнением был окклюзивный тромбоз нижней надчревной артерии перемещенного TRAM-лоскута с развитием его краевого некроза. Краевые некрозы перемещенного TRAM-лоскута отмечались у 4 больных, в 1 случае был зафиксирован диастаз краев раны на передней брюшной стенке при реконструкции, у 1 больной — гематома послеоперационной раны, и у 1 пациентки — инфицирование ложа эндопротеза [27].
К.П. Лактионов и соавт. (2006) проанализировали результаты лечения у 271 больной РМЖ, которым были выполнены реконструктивно-пластические операции поперечным ректоабдоминальным лоскутом после радикального лечения. В структуре осложнений I этапа пластики молочной железы доля отторжений трансплантата составила 2,9%, краевой некроз перемещенного поперечного ректоабдоминального лоскута отмечался в 4,4% наблюдений, в 3,3% наблюдений произошло расхождение краев раны на передней брюшной стенке. Неблагоприятные исходы, вплоть до некроза кожи, смещения импланта, и капсулярной контрактуры, наблюдались до 14% пациентов [28].
По данным ряда авторов [29; 30], у 30-48% больных после РМЭ развиваются различные местные осложнения в виде лимфореи, расхождений швов, некроза кожных лоскутов, гематомы, раневой инфекции. Частота таких образований колеблется в очень широком диапазоне: от 3 до 85%. Серома или лимфоцеле являются самыми ранними и распространенными осложнениями после РМЭ. Лимфорея в среднем продолжается до 8-14 дней, но у ряда больных сохраняется значительно дольше — 30-60 дней.
Скопление жидкости в ране после РМЭ приводит к инфицированию раны, частота которого колеблется от 1 до 26%, некрозу кожи — у 0,5%, расхождению краев раны у 0,3% пациентов, нагноению раны — в 1,9% случаев, и даже общим осложнениям в виде септицемии [31].
Позднее обильная лимфорея приводит к грубому и хаотичному разрастанию рубцовой соединительной ткани в областях лимфаденэктомии и участках отсепарованных кожных лоскутов, что способствует развитию «постмастэктомического» синдрома [32].
Для профилактики местных послеоперационных осложнений: лимфореи и сером, широко использовали дренажи, стеганый шов. Некоторые авторы для этих целей вводили клей на раневую поверхность, считали, что гармонический скальпель может снизить число сером, интраоперационную кровопотерю и раневые осложнения. Однако все это не решило проблему, поскольку не было прогностических тестов, позволяющих заранее формировать тактические действия по предупреждению нежелательных последствий хирургического вмешательства [33].
Профилактика некроза кожи после тотальной мастэктомии и немедленной реконструкции молочной железы с экспандерами также имеет большое значение, так как может привести к инфицированию раны и повторному оперативному вмешательству [34].
Эти послеоперационные осложнения ведут к отсрочке адъювантной терапии. Проведенная в предоперационном периоде лучевая или полихимиотерапия еще более ухудшают течение раневого процесса, и процент осложнений увеличивается еще в 2-3 раза [35].
У 13-58% оперированных больных РМЖ наблюдались отеки верхних конечностей [36]. Причины их возникновения опять же связаны с обязательной широкой подмышечной лимфодиссекцией [37]. При этом у пациенток возникает боль в поврежденном плече и руке, ограничение движений, снижение мышечной силы и функциональных возможностей верхней конечности. Прогрессирование лимфатического отека усиливает эти симптомы [38].
Такие осложнения, как некроз краев раны, лимфэдема верхней конечности, длительное заживление раны, контрактура верхней конечности, инфекционные осложнения, развиваются, как правило, на фоне сером послеоперационной раны [39].
Общие осложнения иногда называют «трагическими или катастрофичными случайностями», как правило, возникают на неблагоприятном фоне сопутствующих заболеваний и возрастных изменений. Они связаны с тромбогеморрагическим синдромом не в молочной железе, а в других органах и системах.
Тромбоэмболические осложнения наблюдаются у 1-8% больных РМЖ. Риск развития ТЭЛА у лиц с местно-распространенным процессом в молочной железе еще выше, он составляет 4,5%, а в случае его генерализации — 17,5% [40].
Патогенетические механизмы, обусловливающие тромботическое осложнение у больных со злокачественными новообразованиями, включают комплекс взаимодействия опухоли, больного и системы гемостаза.
Тромбофилии, ведущие к инфаркту миокарда, тромбоэмболиям легочной артерии, инсультам и т.д., – очень серьезная, хотя и редко встречающаяся проблема при хирургическом лечении РМЖ. Нарушения в системе гемостаза у онкологических больных, в том числе и при РМЖ, усугубляются в условиях химиотерапии, что создает реальные предпосылки для развития тромботических и геморрагических осложнений на дальнейших этапах специального лечения [41].
У женщин с РМЖ в 3-4 раза увеличен риск венозной тромбоэмболии по сравнению с женщинами аналогичного возраста без рака. Частота возникновения венозных тромбозов при РМЖ составляет 2-8% [42].
Тромбоз, как правило, поражает нижние конечности, однако у пациентов, перенесших РМЭ с лимфодиссекцией, тромбоэмболические осложнения в верхних конечностях также являются частыми [43].
Таким образом, возникновение местных осложнений РМЭ в основном связывают с объемом операции и лимфодиссекции, которые сопровождаются выраженной диффузной кровоточивостью и лимфореей, а общих – с тромбофилией, возникающей на фоне возраста и сопутствующих заболеваний. Причины и механизмы их развития изучены недостаточно, не систематизированы и описаны фрагментарно.
Резюмируя, можно сказать, что характерная черта РМЖ — это гетерогенность. Поэтому и возникают трудности систематизации осложнений после хирургического лечения. Два фактора развития РМЖ и они же — факторы развития послеоперационных осложнений совпадают и имеют высокую прогностическую значимость: возраст (постменопаузальный период), а также сопутствующие заболевания.
источник
Венозные тромбоэмболические осложнения могут предшествовать диагнозу злокачественной опухоли женских половых органов или быть результатом противоопухолевого лечения, особенно хирургического и химиотерапевтического.
Большинство женщин со злокачественными новообразованиями половых органов имеют несколько факторов риска, которые увеличивают вероятность венозной тромбоэмболии (ВТЭ) во время терапии.
Причины венозной тромбоэмболии (ВТЭ) были впервые описаны Вирховым в 1858 г., к ним относятся повышенная свертываемость крови, замедление венозного кровотока и повреждение эндотелия. Кроме повышенного риска венозной тромбоэмболии (ВТЭ) вследствие злокачественного новообразования имеются и другие факторы риска, которые включают пожилой возраст пациентки, обширное оперативное вмешательство, принадлежность не к белой расе, тромбоз глубоких вен (ТГВ) или тромбоэмболия легочной артерии (ТЭЛА) в анамнезе, отек нижних конечностей или варикозное расширение вен, ожирение (избыточная масса тела), использование ранее ЛТ, а также повышенная свертываемость крови: фактор V Лейден, беременность и применение пероральных контрацептивов, эстрогенов или тамоксифена.
Интраоперационными факторами, связанными с послеоперационным тромбозом глубоких вен (ТГВ), служат увеличение времени анестезии, повышенная кровопотеря и необходимость в трансфузии во время операции. Важно установить эти факторы риска, чтобы обеспечить соответствующую профилактику венозного тромбоза. Основные принципы определения степени риска ВТЭ представлены в таблице ниже.

Тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА), хотя и предотвратимы, считаются тяжелыми осложнениями у женщин со злокачественными новообразованиями половых органов, особенно у перенесших операцию. Проблема профилактики ВТЭ очень важна для онкогинекологов, т. к. 40 % всех летальных исходов после хирургических вмешательств непосредственно связаны с ТЭЛА, что представляется самой частой причиной смерти после операции у больных РЭ или РШМ.
Профилактические мероприятия значительно снижают частоту тромбоза глубоких вен (ТГВ) у женщин со злокачественными опухолями половых органов. В некоторых исследованиях, включавших достаточное количество больных, показано снижение частоты фатальной ТЭЛА.
Метод профилактики должен быть эффективным, без значительных побочных эффектов, быть удобным для больной и медицинского персонала, быть приемлемым для большинства больных и дешевым.
Доступные профилактические методы можно разделить на лекарственные средства, которые снижают повышенную свертываемость крови, и механические методы, которые уменьшают застой в сосудах и могут усилить фибринолиз. Ключом к успешному использованию профилактических методов служит понимание того, что женщины со злокачественным новообразованием половых органов относятся к группе высокого риска и для достижения максимального успеха необходимы более интенсивные профилактические мероприятия.
источник
Тромбоэмболия легочной артерии – окклюзия легочной артерии или ее ветвей тромботическими массами, приводящая к жизнеугрожающим нарушениям легочной и системной гемодинамики. Классическими признаками ТЭЛА служат боли за грудиной, удушье, цианоз лица и шеи, коллапс, тахикардия. Для подтверждения диагноза тромбоэмболии легочной артерии и дифференциальной диагностики с другими схожими по симптоматике состояниями проводится ЭКГ, рентгенография легких, ЭхоКГ, сцинтиграфия легких, ангиопульмонография. Лечение ТЭЛА предполагает проведение тромболитической и инфузионной терапии, ингаляций кислорода; при неэффективности – тромбоэмболэктомии из легочной артерии.
Тромбоэмболия легочной артерии (ТЭЛА) — внезапная закупорка ветвей или ствола легочной артерии тромбом (эмболом), образовавшимся в правом желудочке или предсердии сердца, венозном русле большого круга кровообращения и принесенным с током крови. В результате ТЭЛА прекращается кровоснабжение легочной ткани. Развитие ТЭЛА происходит часто стремительно и может привести к гибели больного.
От ТЭЛА умирает 0,1% населения земного шара ежегодно. Около 90% больным, умершим от ТЭЛА, во время не был установлен правильный диагноз, и не было проведено необходимое лечение. Среди причин смерти населения от сердечно-сосудистой заболеваний ТЭЛА стоит на третьем месте после ИБС и инсульта. ТЭЛА может приводить к летальному исходу при некардиологической патологии, возникая после операций, полученных травм, родов. При своевременном оптимальном лечении ТЭЛА наблюдается высокий показатель снижения уровня смертности до 2 – 8%.
Наиболее частыми причинами развития ТЭЛА служат:
- тромбоз глубоких вен (ТГВ) голени (в 70 – 90% случаев), часто сопровождающийся тромбофлебитом. Может иметь место тромбоз одновременно глубоких и поверхностных вен голени
- тромбоз нижней полой вены и ее притоков
- сердечно-сосудистые заболевания, предрасполагающие к появлению тромбов и эмболий в легочной артерии (ИБС, активная фаза ревматизма с наличием митрального стеноза и мерцательной аритмии, гипертоническая болезнь, инфекционный эндокардит, кардиомиопатии и неревматические миокардиты)
- септический генерализованный процесс
- онкологические заболевания (чаще рак поджелудочной железы, желудка, легких)
- тромбофилия (повышенное внутрисосудистое тромбообразование при нарушении системы регуляции гемостаза)
- антифосфолипидный синдром — образование антител к фосфолипидам тромбоцитов, клеток эндотелия и нервной ткани (аутоиммунные реакции); проявляется повышенной склонностью к тромбозам различных локализаций.
Факторы риска тромбозов вен и ТЭЛА — это:
- длительное состояние обездвиженности (постельный режим, частые и продолжительные авиаперелеты, поездки, парез конечностей), хроническая сердечно-сосудистая и дыхательная недостаточность, сопровождаются замедлением тока крови и венозным застоем.
- прием большого количества диуретиков (массовая потеря воды приводит к дегидратации, повышению гематокрита и вязкости крови);
- злокачественные новообразования — некоторые виды гемобластозов, истинная полицитемия (большое содержание в крови эритроцитов и тромбоцитов приводит к их гиперагрегации и образованию тромбов);
- длительный прием некоторых лекарственных препаратов (оральные контрацептивы, заместительная гормональная терапия) повышает свертываемость крови;
- варикозная болезнь (при варикозном расширении вен нижних конечностей создаются условия для застоя венозной крови и образования тромбов);
- нарушения обмена веществ, гемостаза (гиперлипидпротеинемия, ожирение, сахарный диабет, тромбофилия);
- хирургические операции и внутрисосудистые инвазивные процедуры (например, центральный катетер в крупной вене);
- артериальная гипертензия, застойная сердечная недостаточность, инсульты, инфаркты;
- травмы спинного мозга, переломы крупных костей;
- химиотерапия;
- беременность, роды, послеродовый период;
- курение, пожилой возраст и др.
В зависимости от локализации тромбоэмболического процесса различают следующие варианты ТЭЛА:
- массивная (тромб локализуется в главном стволе или основных ветвях легочной артерии)
- эмболия сегментарных или долевых ветвей легочной артерии
- эмболия мелких ветвей легочной артерии (чаще двусторонняя)
В зависимости от объема отключенного артериального кровотока при ТЭЛА выделяют формы:
- малую (поражены менее 25% легочных сосудов) — сопровождается одышкой, правый желудочек функционирует нормально
- субмассивную (субмаксимальную — объем пораженных сосудов легких от 30 до 50%), при которой у пациента отмечается одышка, нормальное артериальное давление, правожелудочковая недостаточность мало выражена
- массивную (объем отключенного легочного кровотока более 50%) — наблюдается потеря сознания, гипотония, тахикардия, кардиогенный шок, легочная гипертензия, острая правожелудочковая недостаточность
- смертельную (объем отключенного кровотока в легких более 75%).
ТЭЛА может протекать в тяжелой, среднетяжелой или легкой форме.
Клиническое течение ТЭЛА может быть:
- острейшим (молниеносным), когда наблюдается моментальная и полная закупорка тромбом главного ствола или обеих основных ветвей легочной артерии. Развивается острая дыхательная недостаточность, остановка дыхания, коллапс, фибрилляция желудочков. Летальный исход наступает за несколько минут, инфаркт легких не успевает развиться.
- острым, при котором отмечается быстро нарастающая обтурация основных ветвей легочной артерии и части долевых или сегментарных. Начинается внезапно, бурно прогрессирует, развиваются симптомы дыхательной, сердечной и церебральной недостаточности. Продолжается максимально 3 – 5 дней, осложняется развитием инфаркта легких.
- подострым (затяжным) с тромбозом крупных и средних ветвей легочной артерии и развитием множественных инфарктов легких. Продолжается несколько недель, медленно прогрессирует, сопровождаясь нарастанием дыхательной и правожелудочковой недостаточности. Могут возникать повторные тромбоэмболии с обострением симптомов, при которых нередко наступает смертельный исход.
- хроническим (рецидивирующим), сопровождающимся рецидивирующими тромбозами долевых, сегментарных ветвей легочной артерии. Проявляется повторными инфарктами легких или повторными плевритами (чаще двусторонними), а также постепенно нарастающей гипертензией малого круга кровообращения и развитием правожелудочковой недостаточности. Часто развивается в послеоперационном периоде, на фоне уже имеющихся онкологических заболеваний, сердечно-сосудистых патологий.
Симптоматика ТЭЛА зависит от количества и размера тромбированных легочных артерий, скорости развития тромбоэмболии, степени возникших нарушений кровоснабжения легочной ткани, исходного состояния пациента. При ТЭЛА наблюдается широкий диапазон клинических состояний: от практически бессимптомного течения до внезапной смерти.
Клинические проявления ТЭЛА неспецифические, они могут наблюдаться при других легочных и сердечно-сосудистых заболеваниях, их главным отличием служит резкое, внезапное начало при отсутствии других видимых причин данного состояния (сердечно-сосудистой недостаточности, инфаркта миокарда, пневмонии и др.). Для ТЭЛА в классическом варианте характерен ряд синдромов:
- острая сосудистая недостаточность. Отмечается падение артериального давления (коллапс, циркуляторный шок), тахикардия. Частота сердечных сокращений может достигать более 100 уд. в минуту.
- острая коронарная недостаточность (у 15-25% больных). Проявляется внезапными сильными болями за грудиной различного характера, продолжительностью от нескольких минут до нескольких часов, мерцательной аритмией, экстрасистолией.
- острое легочное сердце. Обусловлено массивной или субмассивной ТЭЛА; проявляется тахикардией, набуханием (пульсацией) шейных вен, положительным венным пульсом. Отеки при остром легочном сердце не развиваются.
- острая цереброваскулярная недостаточность. Возникают общемозговые или очаговые нарушения, церебральная гипоксия, при тяжелой форме — отек мозга, мозговые кровоизлияния. Проявляется головокружением, шумом в ушах, глубоким обмороком с судорогами, рвотой, брадикардией или коматозным состоянием. Могут наблюдаться психомоторное возбуждение, гемипарезы, полиневриты, менингиальные симптомы.
- острая дыхательная недостаточность проявляется одышкой (от ощущения нехватки воздуха до очень выраженных проявлений). Число дыханий более 30-40 в минуту, отмечается цианоз, кожные покровы пепельно-серые, бледные.
- умеренный бронхоспастический синдром сопровождается сухими свистящими хрипами.
- инфаркт легкого, инфарктная пневмония развивается на 1 – 3 сутки после ТЭЛА. Появляются жалобы на одышку, кашель, боли в грудной клетке со стороны поражения, усиливающиеся при дыхании; кровохарканье, повышение температуры тела. Становятся слышны мелкопузырчатые влажные хрипы, шум трения плевры. У пациентов с тяжелой сердечной недостаточностью наблюдаются значительные выпоты в плевральную полость.
3. Лихорадочный синдром — субфебрильная, фебрильная температура тела. Связан с воспалительными процессами в легких и плевре. Длительность лихорадки составляет от 2 до 12 дней.
4. Абдоминальный синдром обусловлен острым, болезненным набуханием печени (в сочетании с парезом кишечника, раздражением брюшины, икотой). Проявляется острой болью в правом подреберье, отрыжкой, рвотой.
5. Иммунологический синдром (пульмонит, рецидивирующий плеврит, уртикароподобная сыпь на коже, эозинофилия, появление в крови циркулирующих иммунных комплексов) развивается на 2-3 неделе заболевания.
Острая ТЭЛА может служить причиной остановки сердца и внезапной смерти. При срабатывании компенсаторных механизмов пациент сразу не погибает, но при отсутствии лечения очень быстро прогрессируют вторичные гемодинамические нарушения. Имеющиеся у пациента кардиоваскулярные заболевания значительно снижают компенсаторные возможности сердечно-сосудистой системы и ухудшают прогноз.
В диагностике ТЭЛА главная задача – установить местонахождение тромбов в легочных сосудах, оценить степень поражения и выраженность нарушений гемодинамики, выявить источник тромбоэмболии для предупреждения рецидивов.
Сложность диагностики ТЭЛА диктует необходимость нахождения таких пациентов в специально оборудованных сосудистых отделениях, владеющих максимально широкими возможностями для проведения специальных исследований и лечения. Всем пациентам с подозрением на ТЭЛА проводят следующие обследования:
- тщательный сбор анамнеза, оценку факторов риска ТГВ/ТЭЛА и клинической симптоматики
- общий и биохимический анализы крови, мочи, исследование газового состава крови, коагулограмму и исследование Д-димера в плазме крови (метод диагностики венозных тромбов)
- ЭКГ в динамике (для исключения инфаркта миокарда, перикардита, сердечной недостаточности)
- рентгенографию легких (для исключения пневмоторакса, первичной пневмонии, опухолей, переломов ребер, плеврита)
- эхокардиографию (для выявления повышенного давления в легочной артерии, перегрузок правых отделов сердца, тромбов в полостях сердца)
- сцинтиграфию легких (нарушение перфузии крови через легочную ткань говорит об уменьшении или отсутствии кровотока вследствие ТЭЛА)
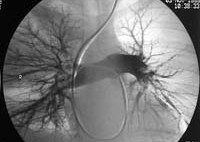
- ангиопульмонографию (для точного определения локализации и размеров тромба)
- УЗДГ вен нижних конечностей, контрастную флебографию (для выявления источника тромбоэмболии)
Пациентов с тромбоэмболией помещают в реанимационное отделение. В неотложном состоянии пациенту проводятся реанимационные мероприятия в полном объеме. Дальнейшее лечение ТЭЛА направлено на нормализацию легочного кровообращения, профилактику хронической легочной гипертензии.
С целью предупреждения рецидивов ТЭЛА необходимо соблюдение строгого постельного режима. Для поддержания оксигенации проводится постоянная ингаляция кислорода. Осуществляется массивная инфузионная терапия для снижения вязкости крови и поддержания АД.
В раннем периоде показано назначение тромболитической терапии с целью максимально быстрого растворения тромба и восстановления кровотока в легочной артерии. В дальнейшем для предупреждения рецидивов ТЭЛА проводится гепаринотерапия. При явлениях инфаркт-пневмонии назначается антибактериальная терапия.
В случаях развития массивной ТЭЛА и неэффективности тромболизиса сосудистыми хирургами проводится хирургическая тромбоэмболэктомия (удаление тромба). Как альтернативу эмболэктомии используют катетерную фрагментацию тромбоэмбола. При рецидивирующих ТЭЛА практикуется постановка специального фильтра в ветви легочной артерии, нижнюю полую вену.
При раннем оказании полного объема помощи пациентам прогноз для жизни благоприятный. При выраженных сердечно-сосудистых и дыхательных нарушениях на фоне обширной ТЭЛА летальность превышает 30%. Половина рецидивов ТЭЛА развивается у пациентов, не получавших антикоагулянты. Своевременная, правильно проведенная антикоагулянтная терапия вдвое снижает риск рецидивов ТЭЛА. Для предупреждения тромбоэмболии необходимы ранняя диагностика и лечение тромбофлебита, назначение непрямых антикоагулянтов пациентам из групп риска.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
ТЭЛА — закрытие просвета основного ствола или ветвей легочной артерии эмболом (тромбом), которое ведет к резкому уменьшению кровотока в легких.

Послеоперационные тромбоэмболии у онкологических больных развиваются в 5 раз чаще, чем у больных общехирургического профиля.

Оперативные вмешательства у онкологических больных провоцируют возникновение тромба независимо от локализации опухоли и объема операции. В настоящее время доказана целесообразность профилактики тромбоза глубоких вен у больных, подвергаемых хирургическому лечению.
Вероятность венозных тромбозов зависит от нозологических форм опухолей. У больных раком лёгкого тромбозы обнаруживают в 28% случаев, при раке желудка, толстой кишки и поджелудочной железы их частота составляет 17, 16 и 18% соответственно. При раке предстательной железы, раке матки и яичников венозные тромбы отмечены в 7% случаев. Послеоперационные тромбозы глубоких вен нижних конечностей и таза выявляют у 60-70% оперированных больных, и в 70% случаев тромбоз протекает бессимптомно.

При тромбозе глубоких вен после операции выявляют нарастающий отек конечности, плотность при пальпации икроножных мышц и болезненность по ходу поражённых вен, однако возможно и бессимптомное течение.
Клинически ТЭЛА следует заподозрить при внезапном появлении одышки, болей в грудной клетке, гипоксемии, тахикардии и снижении АД вплоть до шока ТЭЛА характеризуют как тяжелую при наличии артериальной гипотонии или шока средней тяжести (при ультразвуковых признаках снижения сократительной способности правого желудочка) и нетяжелую.
Тромбоз глубоких вен классифицируют на проксимальный (выше подколенной ямки) и дистальный (ниже подколенной ямки).


Определение уровня О-димера в крови. Проведенные исследования показали, что у больных с ТЭЛА содержание D-димера возрастает в 10-15 раз по сравнению с больными без тромботических осложнений. Наиболее высокую концентрацию D-димера (12-15 мкг/мл) наблюдают у больных с массивной тромбоэмболией, у пациентов с тромбозом уровень D-димера составляет 3,8-6,5 мкг/мл.
Рентгенография грудной клетки, ЭКГ и ЭхоКГ при ТЭЛА малоинформативны.
Ультразвуковая допплерография сосудов нижних конечностей проводится 1 раз в 3-4 дня после операции у больных с хронической венозной недостаточностью. Метод обладает средней чувствительностью, особенно при дистальном тромбозе глубоких вен (30-50%).
Вентиляционно-перфузионная сцинтиграфия легких — неинвазивный, достаточно информативный (90%) метод диагностики ТЭЛА.
УЗИ вен нижних конечностей проводят в предоперационный период при:
- отёке голени или всей нижней конечности,
- болях в икроножной мышце при ходьбе,
- наличии варикозных узлов,
- болезненности при пальпации сосудистого пучка нижней конечности,
- ТЭЛА и тромбоз глубоких вен в анамнезе,
- ожирении,
- недостаточности кровообращения.
При выявлении тромбоза глубоких вен показано внедрение кава-фильтра до операции.
В качестве медикаментозного лечения показана антитромботическая и тромболитическая терапия.
Антитромботическая терапия — основа патогенетической фармакотерапии тромбоза глубоких вен, которая уменьшает его последствия, предотвращает дальнейшее прогрессирование и развитие осложнений. Показано назначение антикоагулянтов прямого и непрямого действия.
В качестве антикоагулянтов прямого действия назначают НФГ или НМГ.
- НФГ назначают при лечении венозных тромбозов в первоначальной дозе 5000 ЕД в/в или п/к, последующие введения осуществляют в/в капельно до 30 000 ЕД в сутки, дозу препарата контролируют преимущественно определением АЧТВ. При неосложненном венозном тромбозе терапию НФГ продолжают 5 сут. Применение препарата в течение 10-14 сут у больных с ТГВ и ТЭЛА стало обычным в клинической практике в США. В европейских странах длительность терапии гепарином натрия короче и составляет 4-5 сут. В России рекомендуют вводить гепарин натрия не менее 7 сут по схеме: НФГ в/в болюсом по 3000-5000 ЕД, затем п/к по 250 ЕД/кг, 2 раза в сутки, всего 5-7 дней. Дозу препарата подбирают следующим образом НФГ в/в болюсом по 80 ЕД/кг, затем в/в инфузионно по 18 ЕД/кгхч), но не менее 1250 ЕД/ч, 5-7 сут. Дозировать препарат необходимо таким образом, чтобы АЧТВ в 1,5-2,5 раза превышало нормальное его значение для лаборатории данного лечебного учреждения. В период подбора дозы АЧТВ определяют каждые 6 ч, при устойчивых терапевтических значениях показателя — 1 раз в сутки. Необходимо учесть, что потребность в гепарине выше в первые несколько суток после возникновения тромбоза.
- Применение НМГ не требует лабораторного контроля, однако при лечении тяжелой ТЭЛА предпочтение следует отдать НФГ, так как эффективность НМГ до конца не изучена. Препараты НМГ далтепарин натрий, надропарин кальций, эноксапарин натрий. Далтепарин натрий вводят под кожу живота по 200 анти-Ха МЕ/кг, максимально 18 000 анти-Ха МЕ 1 раз в сутки, при повышенном риске кровотечений по 100 анти-Ха МЕ/кг 2 раза в сутки, 5-7 сут. Надропарин кальций под кожу живота по 86 анти-Ха МЕ/кг 2 раза в сутки или 171 анти-Ха МЕ/кг, максимально 17 100 анти-Ха ME раз в сутки, 5-7 сут Эноксапарин натрий под кожу живота 150 анти-Ха МЕ/кг (1,5 мг/кг, максимально 180 мг) 1 раз в сутки или по 100 анти-Ха МЕ/кг (1 мг/кг) 2 раза в сутки, 5-7 сут.
- Антикоагулянты непрямого действия широко применяют при лечении тромбоза глубоких вен и ТЭЛА. Как правило, препараты назначают после стабилизации процесса с помощью гепаринов и одновременно с началом гепаринотерапии или в ближайшие дни, дозу подбирают по уровню МНО, целевые значения которого составляют 2,0-3,0. Предпочтение отдают антикоагулянтам непрямого действия кумаринового ряда (варфарин, аценокумарол) из-за лучших фармакокинетических свойств и более предсказуемого антикоагулянтного эффекта. Аценокумарол назначают внутрь по 2-4 мг в сутки (начальная доза), а поддерживающую дозу подбирают индивидуально под контролем МНО. Варфарин принимают внутрь по 2,5-5,0 мг/сут (начальная доза), поддерживающую дозу подбирают аналогично. Гепарины отменяют не ранее чем через 4 сут после начала приема антикоагулянтов непрямого действия и только при сохранении терапевтических значений МНО в течение двух последовательных дней. Длительность применения антикоагулянтов непрямого действия не менее 3-6 мес.
В настоящее время нет очевидных доказательств преимущества тромболитической терапии перед применением гепарина натрия. Проведение тромболитической терапии при тромбозе глубоких вен практически невозможно из-за крайне высокой опасности геморрагических осложнений в ближайшем послеоперационном периоде. Подобный риск оправдан лишь в случаях угрозы жизни больного при массивной ТЭЛА. Тромболитические ЛС показаны пациентам с тяжелой ТЭЛА и артериальной гипотонией, шоком, рефрактерной гипоксемией или правожелудочковой недостаточностью. Тромболитическая терапия ускоряет процесс восстановления проходимости окклюзированной легочной артерии, уменьшения выраженности лёгочной гипертензии и постнагрузки на правый желудочек по сравнению с эффектом введения гепарина натрия. Однако убедительных доказательств того, что быстрое улучшение гемодинамических показателей улучшает клинические исходы при тяжёлой ТЭЛА, нет. Остаётся неясным, оправдан ли при этом более высокий риск развития геморрагических осложнений. Период эффективного применения тромболитической терапии составляет 14 с после появления её симптомов. Стрептокиназу и урокиназу применяют в качестве монотерапии. Введение алтеплазы сочетают с применением гепарина натрия, её можно назначить (или возобновить введение) после окончания тромболизиса, когда протромбиновое время или АЧТВ станут меньше, чем удвоенное нормальное значение. Назначают одно из следующих средств:
- алтеплаза в/в инфузионно по 100 мг в течение 2 ч,
- стрептокиназа в/в инфузионно по 250 000 ЕД в течение 30 мин, затем со скоростью 100 000 ЕД/ч в течение 24 ч,
- урокиназа в/в инфузионно по 4400 МЕ/кгхч) за 10 мин, затем со скоростью 4400 МЕ/кгхч) в течение 12-24 ч.
В специализированных ангиохирургических отделениях выполняют тромбэктомию в случаях сегментарного тромбоза бедренных, подвздошных и нижней полой вен. Радикальный характер вмешательства на магистральных венах устраняет опасность массивной ТЭЛА и улучшает отдалённый прогноз венозного тромбоза.
Вместе с тем тяжесть состояния больных, обусловленная характером и объемом первичного хирургического вмешательства и сопутствующими заболеваниями, позволяет прибегать к этой процедуре в весьма ограниченном числе случаев. Вот почему возникновение тромбов в бедренных, подвздошных или нижней полой венах заставляет помимо антикоагулянтной терапии прибегать к парциальной окклюзии нижней полой вены. Метод выбора у послеоперационного контингента больных — имплантация кава-фильтра. При невозможности проведения этого вмешательства у пациентов, которым предстоит операция на брюшной полости, она может быть начата с пликации нижней полой вены механическим швом.
Для определения показаний к применению профилактических мероприятий хирургических больных разделяют на группы риска. Согласно материалам 6-й Согласительной конференции по антитромботическому лечению Американской коллегии торакальных хирургов (2001 г), онкологические больные имеют наивысший риск развития тромбоэмболических осложнений. В отсутствие профилактики после операций тромбоз развивается у 40-50% онкологических больных, из них у 10-20% наблюдают проксимальный тромбоз, который в 4-10% случаев осложнён ТЭЛА, смертельной в 0,2-5% случаев. Профилактика тромботических осложнений необходима на всех этапах хирургического лечения.
Для предотвращения послеоперационного тромбоза глубоких вен (ТГВ) используют различные физические (механические) и фармакологические средства:
- Механические средства ускоряют венозный кровоток, что препятствует застою крови в венах нижних конечностей и тромбообразованию, к ним относят «ножную педаль», эластическую и прерывистую компрессии.
- Эластическая компрессия нижних конечностей специальными эластическими гольфами или чулками.
- Прерывистая пневмокомпрессия ног с помощью специального компрессора и манжет.
- «Ножная педаль» обеспечивает пассивное сокращение икроножных мышц во время и после операции.
- Фармакологические средства поддерживают АЧТВ между инъекциями на уровне, который превышает значение АЧТВ для лаборатории данного лечебного учреждения в 1,5 раза. Для профилактики операционных тромбозов показаны антикоагулянты, антибиотики и препараты, действующие на тромбоцитарное звено гемостаза.
Антикоагулянты прямого действия назначают до операции и продолжают введение в ближайшем послеоперационном периоде (7-14 сут), однако при осложненном течении может потребоваться более длительная фармакотерапия (в течение не менее 1 мес). Гепарин натрия не назначают в дооперационный и ранний послеоперационный периоды при операциях по поводу рака пищевода, опухоли гепатопанкреатодуоденальной зоны и экстирпации прямой кишки с предоперационным облучением и т. п. Профилактическую терапию гепаринами до операции не используют у больных с предполагаемой массивной кровопотерей при оперативном вмешательстве или обширной хирургической поверхностью и обильной секрецией из травмированных тканей. Применение гепарина натрия в низких дозах снижает риск развития послеоперационного тромбоза глубоких вен примерно на 2/3, а ТЭЛА — в 2 раза.
- Гепарин натрий п/к по 5000 ЕД за 2 ч до операции, затем 2-3 раза в сутки, в послеоперационный период дозу корректируют в зависимости от АЧТВ.
- Далтепарин натрий п/к по 2500 анти-Ха международных единиц (МЕ) за 12 ч до операции и через 12 ч после нее или 5000 анти-Ха МЕ за 12 ч до, затем 5000 анти-Ха МЕ 1 раз в сутки.
- Надропарин кальций п/к по 38 анти-Ха МЕ за 12 ч до операции, через 12 ч после нее и затем 57 анти-Ха МЕ 1 раз в сутки.
- Эноксапарин натрий п/к 4000 анти-Ха МЕ 40 мг за 12 ч до операции, затем 1 раз в сутки.
- Ацетилсалициловая кислота — не препарат выбора для профилактики тромбоза глубоких вен, однако есть достоверные данные, что применение ЛС в течение 2 нед после операции снижает частоту развития ТГВ с 34 до 25%.
- Декстран — полимер глюкозы, который уменьшает вязкость крови и оказывает антитромбоцитарное действие.
- Инфузии реополиглюкина по 400 мл ежедневно с пентоксифиллином в течение 5-7 сут после операции или других средств, воздействующих на тромбоцитарное звено гемостаза (клопидогрел, дипиридамол и др ), у больных указанных нозологических групп эффективны в сочетании с механическими средствами.
При обострении тромбоза поверхностных варикозных вен до операции показано проведение курса антибактериальной и антикоагулянтной терапии.
В отсутствие лечения летальность от ТЭЛА достигает 25-30%, при назначении антикоагулянтов она снижается до 8%, риск возникновения повторной тромбоэмболии наиболее высок в первые 4-6 нед ТЭЛА способна привести к смерти от шока и выраженной дыхательной недостаточности. Отдаленные последствия — хроническая легочная гипертензия и дыхательная недостаточность.

источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Рассмотрены вопросы патогенеза тромбоэмболии легочной артерии (ТЭЛА) и ее наиболее частой причины – тромбоза глубоких вен ног (ТГВ). Детально описаны методы диагностики этих состояний. Приведены рекомендации по лечению и профилактике ТЭЛА и ТГВ.
Рассмотрены вопросы патогенеза тромбоэмболии легочной артерии (ТЭЛА) и ее наиболее частой причины – тромбоза глубоких вен ног (ТГВ). Детально описаны методы диагностики этих состояний. Приведены рекомендации по лечению и профилактике ТЭЛА и ТГВ.
The paper deals with the pathogenesis of pulmonary thromboembolism and its most common cause-deep vein thrombosis of the leg. It details diagnostic methods for these conditions and gives recommendations for their treatment and prevention.
В.Б. Яковлев,
д.м.н., кафедра кардиологии Государственного института усовершенствования врачей МО РФ
V.B.Yakovlev, Dr. Sci., Department of Cardiology, State Institute for Postgraduate of Physicians, Ministry of Defense of the Russian Federation, Moscow
Т ромбоэмболия легочной артерии (ТЭЛА) – одно из наиболее распространенных и грозных осложнений многих заболеваний послеоперационного и послеродового периодов, неблагоприятно влияющее на их течение и исход.
Практическая значимость проблемы ТЭЛА в настоящее время определяется, во-первых, явным нарастанием частоты легочных эмболий при самых разнообразных заболеваниях; во-вторых , значительным увеличением частоты послеоперационных и посттравматических эмболий, чаще возникающих при сложных хирургических вмешательствах; в-третьих, тем обстоятельством, что ТЭЛА становится третьей по частоте причиной смерти в высокоразвитых странах, уступая только сердечно-сосудистым заболеваниям и злокачественным новообразованиям.
Актуальность проблемы ТЭЛА обусловлена не только тяжестью течения заболевания и высокой летальностью, но и трудностями своевременной диагностики этого осложнения из-за полиморфизма развивающихся клинических синдромов. По данным многочисленных патологоанатомических исследований (П.К. Пермяков, 1991; G. Stevanovic и соавт., 1986), в 50 – 80% случаев ТЭЛА не диагностируется вообще, а во многих случаях ставится лишь предположительный диагноз. Многие больные умирают в первые часы от начала заболевания, не получая адекватного лечения. При этом летальность среди нелеченных пациентов достигает 40%, тогда как при проведении своевременной терапии она не превышает 10% (К. Grosser, 198 0).
Схема 1. Патофизиология ТЭЛА
Частота и этиология ТЭЛА
В большинстве случаев причиной развития ТЭЛА является тромбоз глубоких вен ног (ТГВ). ТГВ – распространенное заболевание, ежегодная частота его возникновения составляет 100 на 100 000 населения [1]. Он занимает третье место среди сердечно-сосудистых заболеваний после ИБС и инсульта головного мозга. Венозный тромбоз, выявляемый методами радиометрии с фибриногеном, меченным 125I, и флебографии, при инфаркте миокарда диагностируется у 5 – 20% больных, инсульте головного мозга – у 60 – 70%, заболеваниях внутренних органов – у 10 – 15%, после ортопедических операций – у 50 – 75%, простатэктомии – у 40%, в абдоминальной и торакальной хирургии – у 30% пациентов [2].
Несвоевременное выявление и недостаточно эффективное лечение венозного тромбоза повышает риск развития ТЭЛА. Наиболее частой причиной ТЭЛА являются отрыв венозного тромба и закупорка им части или всего русла легочной артерии.
По данным патологоанатомического исследования 749 умерших с ТЭЛА, основным источником эмболии был тромбоз в системе нижней полой вены (83,6%), при этом в 68,1% случаев он локализовался в бедренной, подвздошной и нижней полой венах [3]. Значительно реже (3,4%) имел место тромбоз в полостях правого сердца и в системе верхней полой вены. В 13% случаев источник ТЭЛА установить не удалось. В структуре заболеваний, осложнившихся развитием ТЭЛА, наибольшую долю составляли злокачественные новообразования (29,9%), сердечно-сосудистые (28,8%) и цереброваскулярные (26,6%) заболевания. В целом частота ТЭЛА среди всех умерших составила 7,2%.
Таблица 1. Частота (в %) клинических симптомов у больных с различной локализацией легочной эмболии
При тромбозе подвздошно-бедренного сегмента риск ТЭЛА составляет 40 – 50%, при тромбозе вен голеней – 1 – 5% [4].
В условиях многопрофильного клинического стационара ТЭЛА ежегодно наблюдается у 15 – 20 из 1000 лечившихся больных, включая подвергавшихся оперативным вмешательствам (A. Sasahara и соавт., 1993).
Факторами риска возникновения ТГВ и ТЭЛА являются пожилой и старческий возраст, гиподинамия, иммобилизация, хирургические операции, злокачественные новообразования, хроническая сердечная недостаточность, варикозное расширение вен ног, ТГВ и ТЭЛА в анамнезе, беременность и роды, травмы, использование оральных контрацептивов, гепарин-индуцированная тромбоцитопения , ожирение, некоторые заболевания (болезнь Крона, эритремия, нефротический синдром, системная красная волчанка, пароксизмальная ночная гемоглобинурия), наследственные факторы (гомоцистинурия, дефицит антитромбина III, протеинов С и S, дисфибриногенемия).
Патогенез ТГВ
Патогенез тромбоза связан с тремя основными факторами (триада Вирхова) – повреждением сосудистой стенки, нарушением кровотока (стаз) и изменением свертывающих свойств крови.
Начальным этапом тромбогенеза в большинстве случаев является нарушение целостности интимы сосуда. “Обнаженный” субэндотелиальный коллаген – мощный стимулятор адгезии тромбоцитов, из которых высвобождается ряд биологически активных веществ (АДФ, серотонин, фактор 3, тромбопластин и др.), что способствует их агрегации и запуску коагуляционного каскада с участием всех факторов свертывания крови. Конечным результатом этого процесса является образование тромбина, превращающего фибриноген в фибрин. Это приводит к формированию фибрин-тромбоцитарного тромба, который частично или полностью закрывает просвет сосуда. Вслед за этим происходит процесс разрушения венозного тромба (фибринолиз, организация тромботических масс), продолжающийся в течение 7 – 10 дней. Этот период является наиболее угрожающим в плане развития тромбоэмболии.
Таблица 2. Частота (в %) изменений на ЭКГ при ТЭЛА в зависимости от локализации эмболии
При любой локализации тромбоза в системе нижней полой вены (НПВ) исходной точкой тромботического процесса являются вены, дренирующие мышцы голени. Распространение тромботического процесса с поверхностных и глубоких вен голеней на бедренную вену происходит через большую подкожную вену бедра либо через коммуникационные вены. Такой тромб первоначально имеет меньший диаметр, чем просвет бедренной вены. Он не обтурирует вену и приобретает характер “флотирующего” тромба, длина которого может достигать 15 – 20 см. В этот период флотирующий тромб не дает клинической картины подвздошно-бедренного тромбоза, так как кровоток в этих венах сохранен. Однако в данной стадии процесса имеется высокая степень вероятности эмболии. При этом частота ТЭЛА составляет 12,5%, а летальность – до 5%.
При первичном тромботическом процессе в глубоких венах голеней и развитии восходящего тромбоза наиболее опасен момент перехода тромбоза с глубоких вен голеней на подколенную вену, так как диаметр тромба меньше подколенной вены, что создает условия для ТЭЛА. “Флотирующие” тромбы в системе НПВ являются основной причиной массивной ТЭЛА, причем наиболее часто такой тромб локализуется в илеокавальном сегменте (76,9%), реже – в подколенно-бедренном сегменте (23,1%).
Первичный тромботический процесс может локализоваться в общей, наружной или внутренней подвздошных венах; этому могут способствовать повреждение сосудистой стенки, спайки и перегородки в этих венах, нарушающие кровоток.
Патогенез ТЭЛА
Тромбоэмболия приводит к полной или частичной окклюзии ветвей легочных артерий, которая вызывает респираторные и гемодинамические нарушения (схема 1). В результате окклюзии ветвей легочной артерии появляется неперфузируемый, но вентилируемый участок легочной ткани (“мертвое пространство”), происходит спадение респираторных отделов легкого и в зоне поражения развивается бронхиальная обструкция. Одновременно снижается выработка альвеолярного сурфактанта, что также способствует развитию ателектаза легочной ткани, который появляется уже к исходу 1 – 2-х суток после прекращения легочного кровотока. Возникает артериальная гипоксемия.
Уменьшение емкости легочного артериального русла приводит к повышению сосудистого сопротивления, развитию гипертензии в малом круге кровообращения и острой правожелудочковой недостаточности. Поскольку лишь выключение из активного кровотока более 50% сосудистого русла приводит к значимому повышению давления в легочной артерии, то считают, что в развитии гемодинамических нарушений наряду с механической закупоркой легочной артерии существенную роль играют рефлекторные и гуморальные механизмы вазоконстрикции, обусловленные выделением из тромбоцитов серотонина, тромбоксана, гистамина. Участие гуморальных механизмов объясняет нередко наблюдаемое несоответствие между тяжестью сердечно-сосудистых расстройств и объемом эмболической окклюзии легочных сосудов.
В 10 – 30% случаев течение ТЭЛА осложняется развитием инфаркта легкого. Поскольку легочная ткань обеспечивается кислородом через систему легочных, бронхиальных артерий и воздухоносные пути, то наряду с эмболической окклюзией ветвей легочной артерии для развития инфаркта легкого необходимыми условиями являются снижение кровотока в бронхиальных артериях и/или нарушение бронхиальной проходимости. Поэтому наиболее часто инфаркт легкого наблюдается при ТЭЛА, осложняющей течение застойной сердечной недостаточности, митрального стеноза, хронических обструктивных заболеваний легких.
Большинство “свежих” тромбоэмболов в сосудистом русле легких подвергаются лизису и организации. Лизис эмболов начинается с первых дней болезни и продолжается в течение 10 – 14 сут. С восстановлением капиллярного кровотока увеличивается продукция сурфактанта и происходит обратное развитие ателектазов легочной ткани.
Диагностика ТЭЛА
Своевременная прижизненная диагностика ТЭЛА нередко представляет значительные трудности. Краеугольным камнем диагностики является настороженность врача, опирающаяся на оценку факторов риска развития ТЭЛА и клинических симптомов, отражающих ее наличие. Кроме установления диагноза ТЭЛА, принципиально важно получить информацию о локализации, характере и объеме эмболического поражения, состоянии гемодинамики в большом и малом круге кровообращения, а также об источнике эмболизации.
Тщательно собранный анамнез и проведенное физикальное обследование определяют объем лабораторно-инструментальных исследований, которые можно разделить на две группы:
– обязательные исследования, которые проводятся всем больным с подозрением на ТЭЛА (регистрация ЭКГ, рентгенография органов грудной клетки, эхокардиография, перфузионная сцинтиграфия легких, ультразвуковая допплерография магистральных вен ног);
– исследования по показаниям (ангиопульмонография, илеокаваграфия, измерение давления в полостях правого сердца и легочной артерии).
Клинические проявления ТЭЛА
Клиническая картина и течение ТЭЛА в значительной степени определяются числом и калибром обтурированных легочных сосудов, темпами развития эмболического процесса и степенью возникающих при этом гемодинамических расстройств (табл. 1) .
Внезапно возникающая, нередко необъяснимая одышка – наиболее характерный симптом ТЭЛА. Одышка носит инспираторный характер, “тихая”; ортопноэ не наблюдается. Столь же постоянно, как и одышка, отмечается тахикардия с частотой сердечных сокращений более 100 в минуту. Наблюдается бледность кожных покровов, которые приобретают пепельный оттенок, выраженный цианоз чаще имеет место при массивной ТЭЛА.
Болевой синдром встречается в нескольких вариантах. При эмболии основного ствола легочной артерии нередко возникают раздирающие загрудинные боли, обусловленные тем, что эмбол раздражает нервные окончания, заложенные в стенке легочной артерии. Иногда боли могут напоминать таковые при стенокардии, что связывают с резким уменьшением коронарного кровотока вследствие снижения ударного и минутного объемов сердца. При инфаркте легкого отмечаются острые боли в грудной клетке, усиливающиеся при дыхании и кашле. Могут наблюдаться резкие боли в правом подреберье, сочетающиеся с парезом кишечника, икотой, симптомами раздражения брюшины, связанные с острым набуханием печени при правожелудочковой недостаточности или с развитием массивного инфаркта правого легкого.
Синдром острого легочного сердца проявляется набуханием шейных вен, патологической пульсацией в эпигастральной области. Во втором межреберье слева от грудины выслушиваются акцент II тона и систолический шум над мечевидным отростком или в четвертом межреберье у левого края грудины отмечается ритм галопа. При этом значительно повышено центральное венозное давление (ЦВД). Артериальная гипотензия (транзиторная или стойкая) – характерный признак ТЭЛА, обусловленный эмболической блокадой легочного кровотока, приводящей к резкому уменьшению притока крови к левой половине сердца. Выраженная артериальная гипотензия, как правило, свидетельствует о наличии массивной ТЭЛА.
Кровохарканье наблюдается у 30 % больных с ТЭЛА и обусловлено инфарктом легкого, для которого характерны боли в грудной клетке, повышение температуры тела, появление плеврального выпота.
При массивной ТЭЛА могут наблюдаться церебральные нарушения (обморок, судороги, рвота, кома), в основе которых лежит гипоксия головного мозга.
Иногда ТЭЛА осложняется острой почечной недостаточностью, в патогенезе которой ведущая роль принадлежит резкому снижению АД в сочетании с констрикцией прегломерулярных сосудов, что приводит к снижению фильтрационного давления в клубочках.
Ни один из перечисленных выше симптомов не является патогномоничным для ТЭЛА. В то же время отсутствие таких симптомов, как одышка, тахипноэ, тахикардия, боли в грудной клетке, ставит под сомнение диагноз ТЭЛА. Значение этих симптомов существенно возрастает при обнаружении признаков ТГВ.
Инфаркт легкого развивается преимущественно при тромбоэмболии долевых и сегментарных ветвей легочной артерии. Его развитие зависит не только от калибра обтурированного сосуда, но и от состояния коллатерального кровообращения, бронхолегочного аппарата. Формирование инфаркта легкого обычно начинается на 2 – 3 сутки после эмболизации, а полное его развитие происходит за 1 – 3 нед.
Клиническими признаками легочного инфаркта являются боли в грудной клетке, кровохарканье, одышка, тахикардия, крепитация, влажные хрипы над соответствующим участком легкого, повышение температуры тела.
Боль в соответствующей половине грудной клетки появляется на 2 – 3-й день после тромбоэмболии. Она обусловлена реактивным плевритом над инфарцированным участком легкого, усиливается при глубоком дыхании, кашле, иногда при надавливании на соответствующие межреберные промежутки. По мере разрешения фибринозного плеврита или накопления в плевральной полости выпота боль исчезает. При вовлечении в процесс диафрагмальной плевры может наблюдаться псевдосимптоматика острого живота.
Кровохарканье при инфаркте легкого появляется у 10 – 56 % больных. Возникает на 2 – 3 сутки после легочной эмболии, т.е. в период формирования инфаркта легкого. В большинстве случаев оно скудное, продолжается несколько дней (иногда до 2 – 4 нед).
Повышение температуры тела, как правило, наблюдается с 1 – 2-го дня болезни, сохраняется несколько дней (реже – 1 – 3 нед). Температура тела субфебрильная, при развитии инфарктной пневмонии повышается до 38,5 – 39 о С.
Притупление перкуторного звука, усиление голосового дрожания, влажные хрипы и крепитация отмечаются только при обширных инфарктах легкого и инфарктных пневмониях. В период формирования инфаркта легкого появляется шум трения плевры, который выслушивается в течение нескольких часов или дней и исчезает по мере разрешения фибринозного плеврита или накопления в полости плевры экссудата.
Экссудативный плеврит развивается у половины больных инфарктом легкого. Серозный или геморрагический экссудат имеет небольшой объем. Большие выпоты в плевральную полость наблюдаются лишь у больных с тяжелой сердечной недостаточностью. Иногда развивается стойкий экссудативный плеврит, который способствует затяжному течению заболевания.
Иногда инфаркт легкого осложняется образованием каверны вследствие секвестрации некротического очага. Обширная полость распада может образоваться в течение нескольких дней. Процессу распада в зоне инфаркта способствуют предшествующие поражения легких и добавочная бронхогенная инфекция, большие размеры инфаркта. В редких случаях инфаркт легкого может осложняться развитием абсцедирующей пневмонии, эмпиемы плевры и спонтанного пневмоторакса.
Диагностика инфаркта легкого в типичных случаях не вызывает больших трудностей. Однако если эпизод одышки, боли в грудной клетке, тахикардии был недооценен, кровохарканье не развилось, отсутствуют и мало выражены проявления легочно-плеврального синдрома, то распознавание инфаркта легкого может быть затруднено.
Рецидивирующая ТЭЛА
Рецидивирующее течение заболевания наблюдается у 9,4 – 34,6% больных с ТЭЛА. Число рецидивов тромбоэмболии у 1 больного может составлять от 2 до 18 – 20, причем большинство из них носит характер микроэмболии. У трети больных с массивной ТЭЛА ее развитию предшествуют эмболии ветвей легочной артерии.
Рецидивирующие легочные эмболии чаще всего возникают на фоне сердечно-сосудистых заболеваний, протекающих с нарушениями ритма и сердечной недостаточностью, злокачественных новообразований, а также после операций на органах брюшной полости.
В большинстве случаев рецидивирующие ТЭЛА не имеют ярких клинических проявлений, протекают латентно, под маской других заболеваний, что создает значительные диагностические трудности, особенно если врачу не удается своевременно выявить факторы риска.
Рецидивирующее течение ТЭЛА приводит к развитию пневмосклероза, эмфиземы легких, прогрессирующей легочной гипертензии, правожелудочковой сердечной недостаточности. Очередной рецидив заболевания может привести больного к внезапной смерти от массивной эмболии.
Рецидивы ТЭЛА могут протекать под маской других заболеваний и проявляться следующим образом: повторными “пневмониями” неясной этиологии, часть которых протекает как плевропневмония; быстропреходящими (в течение 2 – 3 сут) сухими плевритами, экссудативным плевритом, особенно с геморрагическим выпотом; повторными немотивированными обмороками, коллапсами, нередко сочетающимися с ощущением нехватки воздуха и тахикардией; внезапно возникающим чувством сдавления в груди, протекающим с затруднением дыхания и последующим повышением температуры тела; “беспричинной” лихорадкой, не поддающейся антибактериальной терапии; пароксизмальной одышкой с ощущением нехватки воздуха и тахикардией; появлением или прогрессированием сердечной недостаточности, резистентной к лечению; появлением и прогрессированием симптомов подострого или хронического легочного сердца при отсутствии анамнестических указаний на хронические заболевания бронхолегочного аппарата.
Таблица 3.Частота (в %) рентгенологических изменений при ТЭЛА различной локализации
источник