Опухоль молочной железы с метастазами соответствует IV стадии. В таких случаях основным видом лечения, как правило, становится системная терапия химиопрепаратами, гормональными препаратами, таргетными препаратами и их комбинациями. В некоторых случаях показаны местные виды лечения, такие как хирургическое вмешательство, лучевая терапия. Но их цель в данном случае – не ремиссия, а профилактика и лечение симптомов, улучшение состояния женщины, продление жизни.
Метастазы могут присутствовать изначально или возникнуть после наступления ремиссии. Чаще всего рак молочной железы метастазирует в лимфатические узлы, легкие, печень, кости, головной мозг.
Опухолевые клетки при раке груди могут обладать различными молекулярно-генетическими характеристиками, от этого зависит программа лечения. Например, раковые клетки могут иметь на своей поверхности большое количество рецепторов к эстрогенам, прогестерону, HER2. Если на поверхности клеток нет ни одного из трех видов рецепторов, рак называется тройным негативным.
Логично предположить, что метастазы должны иметь тот же молекулярный статус, что и первичная опухоль. Но при возникновении метастатических очагов после ремиссии так бывает не всегда. Например, опухоль может быть HER2-позитивной, а впоследствии трансформироваться в тройную негативную. Это сказывается на прогнозе, заставляет применять другие противоопухолевые препараты.
Определить молекулярно-генетические характеристики клеток в метастатических очагах помогает биопсия.
В зависимости от гормонального и HER2-статуса опухоли, при раке молочной железы IV стадии назначают следующие виды лечения:
При HER2-позитивных опухолях чаще всего назначают трастузумаб (Герцептин) – таргетный препарат, который блокирует рецептор HER2, в сочетании с химиопрепаратами или гормональными препаратами. Также могут быть назначены другие таргетные препараты, блокирующие HER2:
- Пертузумаб (Перьета).
- Трастузумаб эмтанзин (Кадсила). В этом препарате трастузумаб конъюгирован с химиопрепаратом эмтанзином и обеспечивает его прицельную доставку к опухолевым клеткам.
При гормонально-позитивных опухолях (ER- и PR-позитивных, соответственно, имеющих рецепторы к эстрогенам и прогестерону), как правило, назначают гормональные препараты: ингибиторы ароматазы или тамоксифен. Обычно у женщин репродуктивного возраста, у которых еще не наступила менопауза, применяют тамоксифен. Если метастатический рак приводит к выраженным симптомам, лечение начинают с химиотерапии, так как для достижения эффекта от гормональных препаратов требуется много времени.
Гормональные препараты могут быть назначены в сочетании с таргетными препаратами:
- Паблоциклиб (Ибранса) блокирует циклинзависимые киназы – ферменты, которые участвуют в сигнальном пути, активирующем деление клеток.
- Рибоциклиб (Кискали) также блокирует циклинзависимые киназы, применяется при гормонально-позитивном и HER2-негативном раке молочной железы в сочетании с ингибиторами ароматазы.
- Абемациклиб (Верзенио) – блокатор циклинзависимых киназ, который применяется при прогрессировании рака после курса гормональной терапии.
- Эверолимус (Афинитор) блокирует ферменты-протеинкиназы и ингибирует сигнальный путь, который приводит к делению клеток.
При HER2-негативных опухолях назначают химиотерапию, если рак является гормонально-позитивным – гормональные препараты. После курса химиотерапии может быть назначен олапариб (Линпарза) – таргетный препарат, который блокирует ферменты PARP, необходимые для восстановления поврежденной ДНК в опухолевых клетках.
При гормонально-негативных опухолях применяют химиопрепараты, так как гормональная терапия в таких случаях неэффективна.
Лечение продолжают до тех пор, пока опухоль реагирует на него, либо пока не возникли серьезные побочные эффекты, из-за которых прием препаратов приходится прекращать.
Если препараты, которые были эффективны ранее, перестали работать, лечение на этом не заканчивается. Врач может подобрать другие препараты. Дальнейший план терапии составляют исходя из предыдущей схемы лечения, возраста и состояния здоровья женщины, характеристик опухоли:
- При неэффективности гормональной терапии можно назначить другие гормональные препараты, дополнить их таргетными препаратами. Если не помогает ни один гормональный препарат, остается химиотерапия.
- При неэффективности химиотерапии можно сменить химиопрепарат – вариантов достаточно много. Каждый раз, когда опухоль перестает реагировать на химиопрепарат, повышается вероятность того, что она не будет реагировать и на новое лечение.
- При неэффективности ингибиторов рецепторовHER2 можно назначить другой таргетный препарат из той же группы, в том числе в сочетании с химиопрепаратами.
Если все методы лечения исчерпаны, небольшая надежда все еще остается: иногда у пациентов есть возможность принять участие в клинических испытаниях. Во время них исследуют новые препараты, и возможно, они окажутся эффективны и смогут продлить жизнь.
Иногда хирургия и лучевая терапия при метастатическом раке помогают справиться с симптомами и улучшить состояние женщины. Показания к их назначению:
- Если опухоль проросла в кожу, привела к изъязвлению и образованию открытой раны.
- Если метастазов немного, и они могут быть удалены хирургически или другими методами.
- Если костные метастазы создают риск патологических переломов.
- Если опухоль распространяется на спинной мозг.
- Если опухоль приводит к сильным болям.
В некоторых случаях при метастазах в печени можно провести радиочастотную аблацию: ввести в узел тонкий электрод в виде иглы и разрушить опухоль электрическим током высокой частоты. Применяют интраартериальную химиотерапию, химиоэмболизацию – процедуру, во время которой в печеночную артерию вводят химиопрепарат вместе с эмболами – микроскопическими частицами, которые перекрывают просвет сосуда и лишают опухолевый узел притока крови.
источник
Недостаточная активность программ раннего выявления рака молочной железы и малая информированность населения приводят к тому, что в России часто заболевание диагностируется, когда процесс приобретает местно-распространенный или метастатический характер. К сожалению, на сегодняшний день метастатический рак молочной железы (МРМЖ) по-прежнему остается неизлечимым заболеванием. Средняя продолжительность жизни с момента выявления метастазов составляет 2—3,5 года, 25—35% пациенток живут более 5 лет и только 10% — свыше 10 лет. Поэтому основной задачей лечения диссеминированных форм рака молочной железы являются продление жизни и максимально длительное сохранение ее качества. Как нам кажется, современные подходы к лечению позволили значительно продвинуться в сторону реализации этих целей.
На сегодняшний день достигнут значительный прогресс в молекулярной биологии и развитии биотехнологий. Это позволило установить механизмы контроля клеточного деления и клеточной смерти, выявить белки, участвующие в канцерогенезе, благодаря чему специалисты получили дополнительную информацию о поведении опухоли, включая скорость ее роста, способность к инвазии и метастазированию, устойчивость к химиопрепаратам. За последнее десятилетие внедрены в практику новые эффективные цитостатики и разработаны новые режимы терапии. Все это дало возможность прогнозирования течения болезни и выбора обоснованной, индивидуализированной терапии рака молочной железы. Если еще 15 лет назад средняя продолжительность жизни при МРМЖ составляла 12-24 мес, то к 2005 г. она увеличилась до 24-32 мес. Широкий выбор цитостатиков и режимов химиотерапии позволил эффективно проводить не только I, но и II, III и т.д. линии лечения, что значительно увеличило период до появления симптомов заболевания, приводящих к ухудшению качества жизни.
Достигнутые успехи позволяют на сегодняшний день рассматривать МРМЖ как хроническую болезнь, протекающую с периодическими обострениями, требующими того или иного вида лечения, и медленным постепенным ухудшением от обострения к обострению.
Понятие « метастатический/рецидивный (диссеминированный, распространенный) рак молочной железы » объединяет первично-метастатический рак молочной железы и прогрессирование заболевания после ранее проведенного радикального лечения (местные рецидивы и/или развитие отдаленных метастазов).
Подходы к лечению больных МРМЖ несколько различаются. Так, пациенты только с местным рецидивом в первую очередь подлежат хирургическому лечению — мастэктомии в случае ранее выполненной сохранной операции или иссечению рецидива в случае ранее выполненной мастэктомии. После хирургического этапа необходимо по возможности провести лучевую терапию на область имевшегося рецидива и назначить системную эндокрино- или химиотерапию. При системном метастатическом поражении, первичном или после ранее проведенного радикального лечения основным, а зачастую и единственным методом лечения является системная противоопухолевая терапия.При выборе I линии системного лечения МРМЖ следует придерживаться индивидуального подхода с учетом биологических особенностей опухоли, целью которого является достижение максимальной эффективности при минимальной токсичности терапии.
Учитывая, что одной из основных задач, стоящих перед врачом при терапии МРМЖ, является сохранение качества жизни, предпочтение отдается препаратам и режимам с наименьшей токсичностью. Снижение токсичности — одна из приоритетных задач, так как при лечении хронических заболеваний проводимая терапия не должна сама по себе значительно ухудшать качество жизни пациента. Поэтому при наличии показаний предпочтительной I линией терапии в настоящее время считается эндокринотерапия.Обязательным условием для использования в качестве I линии эндокринотерапии является положительный уровень рецепторов эстрогена (РЭ+) и/или прогестерона (РП+) в опухоли. Учитывая, что эффект эндокринотерапии обычно развивается медленнее, ее проведение возможно при условии, что проявления болезни непосредственно не угрожают жизни пациента и/или не требуют достижения быстрого эффекта — метастазы в кости, и/или мягкие ткани, и/или лимфатические узлы. Также к этой группе можно отнести и больных с асимптоматичным висцеральным поражением, например метастазами в легкие и единичными небольшими метастазами в печень. Следует помнить, что непосредственная эффективность I линии эндокринотерапии не уступает таковой при использовании химиопрепаратов, а в некоторых случаях даже может превышать ее (что обусловлено меньшей чувствительностью некоторых рецепторпозитивных опухолей к химиотерапии).
Выбор препаратов для гормонотерапии основывается на менструальном статусе больной (пременопауза, постменопауза), адьювантной гормонотерапии в анамнезе и длительности периода между ее окончанием и прогрессированием заболевания.
На основании данных, полученных в большом числе исследований, было показано, что для женщин в постменопаузе, которые ранее не получали антиэстрогены или их прием был завершен более 12 мес назад, в I линии терапии МРМЖ могут быть назначены как тамоксифен, так и ингибиторы ароматазы (анастрозол или летрозол). Хотя следует отметить, что в большинстве исследований было показано преимущество назначения в подобной ситуации ингибиторов ароматазы. У больных, которые в течение последних 12 мес получали антиэстрогены (например, в качестве адьювантной терапии), предпочтительной I линией терапии МРМЖ будут селективные ингибиторы ароматазы [1—7].
Для женщин в пременопаузе, которые в течение последних 12 мес получали антиэстрогены, предпочтительным считается выключение функции яичников (хирургическим, лучевым или медикаментозным методом) с дальнейшим назначением ингибиторов ароматазы или других препаратов эндокринотерапии II линии. Для больных в пременопаузе, ранее не получавших антиэстрогены, по-прежнему оптимальным выбором I линии эндокринотерапии являются антиэстрогены с выключением функции яичников или без него [8].Назначение эндокринотерапии в качестве I линии МРМЖ (с учетом вышеперечисленных рекомендаций) позволяет не только добиться непосредственного эффекта (сокращение размеров опухоли), но и, что, на наш взгляд, более важно, длительное время сохранять удовлетворительное качество жизни (не испытывая побочных эффектов химиотерапии) при адекватном контроле над болезнью.
При прогрессировании болезни на фоне эндокринотерапии I линии выбор дальнейшей тактики лечения зависит от длительности эффекта на фоне терапии I линии и выраженности прогрессирования.При появлении симптоматичных висцеральных метастазов или прогрессировании менее чем через 6 мес (по данным некоторых авторов, менее чем через 4 мес) после начала эндокринотерапии I линии требуется назначение химиотерапии.
В случае, если выраженность прогрессирования невелика, рекомендуется продолжать гормонотерапию с использованием препаратов, ранее не применявшихся у данной больной. У больных в постменопаузе возможно назначение в качестве II линии эндокринотерапии селективных нестероидных ингибиторов ароматазы (анастрозол или летрозол), стероидных ингибиторов ароматазы (экземестан), истинного антиэстрогена (фулвестрант). Возможно назначение и прогестинов, андрогенов или эстрогенов, однако в связи с большим количеством побочных эффектов данные препараты используются редко. Для женщин в пременопаузе обязательными считаются выключение функции яичников любым из имеющихся методов (если это не было выполнено ранее) и дальнейшее ведение их как постменопаузальных.
Ингибиторы ароматазы уже достаточно давно используются в России и не требуют дополнительного описания, в связи с чем мы более подробно остановимся на недавно зарегистрированном препарате фазлодексе (фулвестрант). Фулвестрант представляет собой новый антиэстроген, относящийся к группе SERD (selective estrogen receptor down-regulator). В отличие от ранее использовавшихся антиэстрогенов (тамоксифен и др.), фазлодекс не только связывает, блокирует, но и разрушает рецепторы эстрогенов. Кроме того, препарат не имеет агонистических эстрогеновых эффектов и способен отложить развитие резистентности.
При сравнительном изучении фазлодекса и тамоксифена в I линии эндокринотерапии у больных МРМЖ с РЭ+ и/или РП+ или неизвестными рецепторами была показана сходная их эффективность. Не было выявлено различий в частоте достижения объективного эффекта (полная ремиссия — ПР + частичная ремиссия —ЧР + стабилизация > 6 мес): 57,1% в группе фазлодекса и 62,7% в группе тамоксифена. Среднее время до прогрессирования составило 8,2 и 8,3 мес соответственно (данные приведены для группы больных с известными положительными уровнями РЭ/РП) [9].
В исследовании J.F. Robertson и соавт. [10] было показано, что лечебный эффект фазлодекса и тамоксифена сохраняется при их перекрестном применении: объективный эффект (ПР + ЧР + стабилизация > 6 мес) при терапии фазлодексом после прогрессирования на тамоксифене был достигнут у 56,8% больных, а при терапии тамоксифеном после прогрессирования на фазлодексе — у 65,8% больных.При сравнительном изучении эффективности фазлодекса и аримидекса во II линии эндокринотерапии (после прогрессирования на фоне терапии тамоксифеном) не было отмечено значимых различий в частоте достижения ПР + ЧР (19,2% при терапии фазлодексом против 16,5% при терапии аримидексом), ПР + ЧР + стабилизация > 6 мес (43,5% против 40,8% соответственно), времени до прогрессирования (5,5 мес в группе фазлодекса и 4,1 мес в группе аримидекса) и общей выживаемости. Также было показано, что время до значительной регрессии опухоли не различалось в двух терапевтических группах: при терапии фазлодексом оно составило 3,1 мес, а при терапии аримидексом — 2,9 мес. При дополнительном анализе было показано, что при достижении эффекта у больных, получавших фазлодекс, отмечалось более длительное время до прогрессирования по сравнению с больными, получавшими аримидекс (различия статистически достоверны; р 6 мес) в группе фазлодекса была несколько выше, чем в 3 группах летрозола и экземестана: 43,5; 34,5 и 37,4% соответственно. Среднее время до прогрессирования у больных, получавших фазлодекс и летрозол, было одинаковым (5,5 и 5,6 мес соответственно) и существенно больше по сравнению с группой, получавшей экземестан (4,7 мес) [12]. Проведенные исследования показали хорошую переносимость фазлодекса. Наиболее часто встречающимися побочными явлениями были приливы (примерно у 20% больных) и различные диспепсические явления (примерно у 40% больных). Тромбоэмболические осложнения отмечались редко (менее чем у 5% больных), артралгии — лишь у 5% больных (значительно реже по сравнению с аримидексом). Местные реакции в области инъекции наблюдались у 7% больных после 1-й инъекции и лишь у 1% при последующих введениях.
Полученные результаты показали, что применение фазлодекса позволяет увеличить время до начала химиотерапии и сохранить хорошее качество жизни больных. Способ, режим применения (внутримышечное введение 5 мл готового раствора 1 раз в месяц) и хорошая переносимость фазлодекса позволяют больным не помнить о болезни ежедневно, что наблюдается при приеме таблетированных препаратов. В настоящее время устоявшееся мнение о том, что I линией лечения МРМЖ должна быть химиотерапия, кардинально изменилось. Для большинства больных с рецепторпозитивными опухолями истинной I линией лечения (а зачастую II и III линией) должна быть гормонотерапия, полностью отвечающая представлениям о наиболее адекватном лечении этого заболевания.
Кому показана химиотерапия в качестве I линии? В первую очередь больным, чьи опухоли не имеют РЭ и/или РП. Больным, у которых, несмотря на положительный уровень РЭ/РП, наблюдаются бурное прогрессирование болезни или симптоматичные висцеральные метастазы, также необходимо проводить химиотерапию + препараты направленного действия (эндокринотерапия этой группе больных может быть назначена только в сочетании с химиотерапией или при достижении длительной ремиссии на фоне химиотерапии).Также назначение химиотерапии показано пациентам, исчерпавшим возможности эндокринотерапии (прогрессирование после нескольких линий успешной эндокринотерапии).
Выбор препаратов для I линии химиотерапии МРМЖ является сложной задачей. Он зависит от множества факторов, к наиболее важным из которых следует отнести Her-2-статус опухоли, общее состояние больной (статус по ECOG), распространенность процесса.Не решенной до конца является и проблема выбора между монотерапией и комбинацией цитостатиков. Так, ряд исследователей демонстрируют преимущества комбинаций химиопрепаратов, в то время как другие показывают увеличение общей выживаемости при последовательном назначении химиопрепаратов в монотерапии.
Согласно рекомендациям NCCN 2005 г. в качестве монотерапии могут использоваться следующие препараты: доксорубицин, эпирубицин, липосомальный доксорубицин, капецитабин, винорелбин, гемцитабин, таксаны паклитаксел и доцетаксел, а также новая форма альбуминсвязанного паклитаксела абраксан.Согласно рекомендациям Европейской организации по исследованию и лечению рака для принятия решения о выборе I линии химиотерапии МРМЖ необходимыми являются сведения об использовании антрациклинов в адъювантном режиме. Если антрациклины не применялись, то лечение больных можно начинать с монотерапии антрациклинами или антрациклинсодержащих режимов (доксорубицин или эпирубицин, доксорубицин/эпирубицин + циклофосфамид + 5-фтору-рацил, доксорубицин + доцетаксел/паклитаксел). Однако использование антрациклинов связано с риском развития кардиотоксичности, а также резистентности к химиопрепаратам, и тенденцией последних лет стало изучение в качестве I линии терапии МРМЖ комбинаций, не содержащих антрациклинов.
Такие препараты, как гемцитабин (гемзар), капецитабин (кселода), винорелбин (навельбин), привлекают особое внимание врачей в связи с благоприятным токсическим профилем, что позволяет более успешно решать одну из главных задач при лечении МРМЖ — сохранение качества жизни.У 23—42% больных МРМЖ гемцитабин в качестве монотерапии позволяет получить ремиссии при использовании его даже в качестве II—III линии лечения. Хорошая переносимость гемцитабина делает его привлекательным для изучения в комбинации с другими цитостатическими агентами. Первые результаты, полученные при изучении комбинации гемцитабина с доцетакселом, винорелбином, капецитабином в исследованиях II фазы, дали основание для проведения в настоящее время больших много-центровых рандомизированных исследований III фазы при МРМЖ в I линии лечения. На основании уже завершенных исследований гемцитабин в комбинации с паклитакселом рекомендован в качестве I линии лечения МРМЖ [13].
Капецитабин — пероральный фторпиримидин, представляющий собой пролекарство, которое в процессе метаболизма под действием тимидинфосфорилазы непосредственно в опухолевой клетке превращается в активный метаболит — 5-фторурацил. Известно, что активность тимидинфосфорилазы в клетках рака молочной железы значительно выше, чем в клетках большинства нормальных тканей организма.
При сопоставлении эффективности капецитабина с «золотым стандартом» II линии лечения МРМЖ, резистентного к антрациклинам, — паклитакселом было показано преимущество капецитабина в отношении непосредственной эффективности (36 и 26%) при сопоставимой длительности ремиссии (3 и 3,1 мес) и общей выживаемости (7,6 и 9,4 мес соответственно). Следует отметить, что в группе капецитабина оказался более благоприятным токсический профиль. Применение капецитабина чаще приводило к улучшению качества жизни больных в процессе лечения [14].В предклинических исследованиях было показано, что доцетаксел повышает активность тимидинфосфорилазы в опухолевых клетках, следовательно, способен повысить эффективность капецитабина. В исследованиях II и III фазы было показано преимущество комбинации капецитабина с доцетакселом перед монотерапией доцетакселом во II линии лечения в отношении как непосредственной эффективности (42 и 30% соответственно), так и среднего времени до прогрессирования (6,1 и 4,2 мес; р=0,0001) и общей выживаемости (14,5 и 11,5 мес) [15]. Комбинация капецитабина с доцетакселом рекомендована в качестве стандарта II линии лечения больных МРМЖ (при резистентности к антрациклинам). В настоящее время капецитабин также разрешен для самостоятельного применения у пациентов с МРМЖ при резистентности к антрациклинам и таксанам (III линия лечения), причем даже в этой ситуации удается добиться успеха у 29% больных, а длительность ремиссии составляет 4,6 мес [16].
Интересными представляются результаты, полученные при сравнении эффективности капецитабина и комбинации CMF (циклофосфан + метотрексат + 5-фторурацил) в I линии химиотерапии МРМЖ у пожилых (старше 55 лет) больных. Медиана возраста больных составила 70 лет. Длительность ремиссии и общая выживаемость между группами существенно не различались, однако лечебный эффект в группе монотерапии капецитабином составил 30%, в то время как в группе CMF — всего 16%. Таким образом, монотерапия пероральным препаратом оказалась более эффективной, чем комбинированная терапия, требующая внутривенных введений. Это важно, учитывая возрастную группу больных, включенных в исследование, и возможность амбулаторного ведения этих пациентов [17].
Эффективность винорелбина в монотерапии МРМЖ достаточно высока и составляет, по данным разных авторов, 41—60% в I линии и 25—40% во II линии. Являясь высокоэффективным и малотоксичным препаратом, винорелбин нашел широкое применение в лечении прежде всего пожилых больных, а также больных, которым противопоказаны антрациклины.Из множества возможных комбинаций с другими цитостатиками наиболее интересной и многообещающей является комбинация винорелбина с капе- в цитабином.В I линии лечения МРМЖ даже у пожилых пациентов (средний возраст старше 65 лет) при незначительной токсичности (преимущественно гематологической) данная комбинация позволяет добиться непосредственного эффекта у 48—53% при среднем времени до прогрессирования 4,5—5,3 мес [18].Эта же комбинация (винорелбин + капецитабин ) во II линии химиотерапии МРМЖ у резистентных к антрациклинам больных позволила добиться эффекта у 52—55%, время до прогрессирования составило 8 мес, а общая выживаемость этих больных — 19,2 мес [19]. Данная комбинация вызывает дополнительный интерес в связи с тем, что в ближайшее время будет зарегистрирована пероральная форма винорелбина, что даст возможность проведения полностью пероральной, а значит, амбулаторной химиотерапии с высокой непосредственной эффективностью.
Как было сказано выше, в настоящее время Her-2-статус является важнейшим фактором привыборе адекватного режима I линии терапии МРМЖ. Это обусловлено данными новейших исследований, свидетельствующими о возможности улучшения отдаленных результатов лечения больных с Her-2-позитивными опухолями при использовании целевой терапии трастузумабом.
Учитывая, что гиперэкспрессия Her-2/neu в ткани рака молочной железы сочетается с более частой резистентностью к химиотерапии и эндокринотерапии, снижением выживаемости, определение Her-2-статуса стало обязательным у всех больных раком молочной железы. Определение гиперэкспрессии Her-2/neu должно проводиться иммуногистохимическим (ИГХ) и/или FISH-методом (флюоресцентная in situ гибридизация). Кандидатами для терапии герцептином являются больные, оцененные по данным ИГХ-метода как 3+ или FISH+ больные. При оценке опухоли по данным ИГХ-метода как 2+ необходимо подтверждение гиперэкспрессии Her-2/neu FISH-методом.
Герцептин (трастузумаб) — моноклональные антитела, которые с высокой степенью избирательности связываются с внеклеточной частью рецептора Her-2/neu, при этом подавляется пролиферация опухолевых клеток, гиперэкспрессирующих Her-2/neu. Кроме прямого антипролиферативного действия герцептин способен вызывать уничтожение опухолевых клеток за счет реакции антителозависимой клеточной цитотоксичности. Герцептин является ярким представителем класса целевых препаратов (target thera-3), так как воздействует на мишень, являющуюся критической для опухолевых клеток и безразличную для большинства нормальных клеток организма.При МРМЖ герцептин эффективен как в монотерапии (в I линии лечения эффективность до 22—26%, длительность ремиссии до 10 мес, во II линии — 15—22% и до 9 мес соответственно), так и в комбинации с цитостатическими агентами. Использование герцептина позволяет увеличить время до прогрессирования и общую выживаемость больных с гиперэкспрессией Her-2/neu, а также преодолеть резистентность опухоли к цитостатическим препаратам [20, 21].При сопоставлении эффективности герцептина с паклитакселом во II линии лечения МРМЖ отмечена равноценная непосредственная эффективность (17 и 18% соответственно), однако продолжительность ремиссии при использовании герцептина в 2 раза выше таковой при терапии паклитакселом (9 и 4,5 мес соответственно).
Учитывая полученные данные о достоверном увеличении кардиотоксичности при использовании герцептина в комбинации с антрациклинами (доксорубицин или эпирубицин), эти комбинации в настоящее время не рекомендованы для применения.При сравнительном изучении комбинации герцептина с паклитакселом и монотерапии паклитакселом было показано достоверное увеличение и непосредственной эффективности (49 и 17%), и времени до прогрессирования (7 и 3 мес), и, что наиболее важно, общей выживаемости (25 и 18 мес соответственно; р В какой стране проходить лечение рака молочно.
источник
Ежегодно в феврале весь мир отмечает День борьбы с онкологическими заболеваниями, который призван информировать общество о позитивных сдвигах в лечении злокачественных новообразований. Самые масштабные достижения ученые показывают в терапии рака молочной железы, который сегодня излечим в 95% случаев при условии раннего выявления заболевания и адекватного лечения. А появление инновационных таргетных препаратов Бейодайм и Кадсила впервые даёт шанс перевести даже метастатическую форму РМЖ в разряд хронических болезней, при общей выживаемости пациентов более 5 лет. Эти препараты открывают перед российскими докторами новые пути для лечения больных HER2-положительным раком молочной железы.
Сегодня рак молочной железы является самым частым злокачественным новообразованием среди женщин. Каждый год врачи выявляют около 1,7 миллиона новых случаев, более 500 тысяч женщин в мире умирают от этой болезни, из них 23 тысячи – в России. Это означает, что каждые 22 секунды одна из женщин узнает о своем страшном диагнозе, а каждые 5 минут три пациентки погибают от него. Одна из наиболее неблагоприятных форм РМЖ – HER2-положительный рак молочной железы, который встречается примерно в 20-25% случаев и характеризуется агрессивным течением, высоким риском метастазирования и низкими показателями выживаемости.
Рецептор HER2 – это особый белок, имеющийся в аномально больших количествах на внешней поверхности клеток опухоли. Первым таргетным анти-HER2-препаратом стал Герцептин (трастузумаб), который более 15 лет назад произвел настоящую революцию в лечении одной из наиболее агрессивных разновидностей рака молочной железы. В отличие от классических цитотоксических препаратов, Герцептин воздействует на конкретные мишени в клетках опухоли и представляет собой целенаправленное лечение. Введение в практику этого таргетного препарата полностью изменило возможности лекарственной терапии данного заболевания.
Однако дальнейшие исследования ученых привели к еще большему усовершенствованию существующих методов лечения. И если совсем недавно пациентки как с ранним, так и с метастатическим HER2-положительным раком молочной железы имели неблагоприятный прогноз, то за последние 15 лет, благодаря таргетным препаратам, выживаемость улучшилась настолько, что теперь результаты терапии женщин с HER2-положительной формой заболевания превосходят результаты лечения менее агрессивных типов РМЖ. Уже вошедший в рутинную практику врачей Герцептин и два новых препарата Бейодайм и Кадсила полностью меняют течение HER2-положительного РМЖ, давая шанс перевести заболевание в разряд хронических и максимально сохранить качество жизни пациенток.
«Появление двух новых препаратов – Бейодайма и Кадсилы – это большое событие и для врачебного сообщества, и для пациентов. Можно с уверенностью сказать, что тот успех, которого мы достигли в лечении HER2-положительного рака молочной железы, сегодня не сопоставим ни с чем, – прокомментировала Вера Горбунова, д.м.н., проф., зав. отделением химиотерапии РОНЦ им. Н.Н. Блохина РАМН. – Многие женщины, боясь услышать страшный диагноз, не идут к врачу, теряя драгоценное время. Теперь, благодаря инновационным препаратам Бейодайму и Кадсиле, мы можем контролировать даже метастатический рак молочной железы, но нужно помнить, что залогом успешного лечения любого вида рака является ранняя диагностика».
Бейодайм – это комбинация Перьеты и Герцептина, механизмы действия которых дополняют друг друга, обеспечивая более полную блокаду HER2-сигнальных путей, чья активация ведет к росту опухоли. Перьета в комбинации с Герцептином и доцетакселом на 15,7 месяцев увеличивает общую выживаемость пациенток с метастатическим HER2-положительным раком молочной железы, ранее не получавших лечения по поводу метастатического заболевания. Средняя продолжительность жизни пациенток после начала терапии Перьетой составила почти 5 лет (56,5 месяца), что в настоящий момент является беспрецедентным результатом. Однако, несмотря на значительные успехи в лечении метастатического HER2-положительного РМЖ, актуальной остается проблема прогрессирования заболевания. Возможно, её решением является применение инновационного препарата Кадсила.
Кадсила – третий таргетный препарат, разработанный компанией Рош для лечения HER2-положительного рака молочной железы. Кадсила представляет собой лекарственное средство нового класса – конъюгатов моноклонального антитела и химиопрепарата. Кадсила показана пациентам, которые ранее уже получали Герцептин и химиотерапию. Применение Кадсилы у этой группы пациентов позволяет увеличить выживаемость без прогрессирования на 50% по сравнению со стандартной терапией и достичь медианы общей выживаемости почти в 31 месяц. Важно, что для Кадсилы не характерны побочные эффекты, свойственные обычной системной химиотерапии. Механизм действия Кадсилы направлен на безопасность терапии и сохранение качества жизни, так как химиотерапевтический агент доставляется непосредственно в злокачественные клетки, что предупреждает повреждение здоровых тканей. Подобная структура препарата представляет собой технологический прорыв среди средств для лечения злокачественных новообразований.
«Идея создать конъюгат Герцептина и химиопрепарата просто гениальна. Прицельная доставка препарата сразу в опухолевую ткань даёт очень высокую эффективность лечения, при этом нет токсичности, – прокомментировала Светлана Хохлова, к.м.н., старший научный сотрудник отделения химиотерапии РОНЦ им. Н.Н. Блохина РАМН. – Мы следили за обновляющимися данными клинических исследований Кадсилы, как ни за одним другим препаратом, и очень ждали его появления».
Препараты уже зарегистрированы в России и планируются к выходу на отечественный рынок весной 2015 года. Рустам Галеев, медицинский директор компании Рош в России, выразил надежду, что Бейодайм и Кадсила, благодаря их включению в льготные списки, станут доступны российским пациентам в той же мере, как доступны инновационные препараты пациентам во всех развитых странах. Так, например, Американское общество клинических онкологов (ASCO) включило последовательное применение данных препаратов в свои рекомендации в качестве стандарта лечения HER2-положительного рака молочной железы. Препараты входят в стандарты NCCN (Национальной Онкологической Сети) и рекомендованы панелью Европейского общества медицинской онкологии (ESMO) для лечения этой формы рака.
«Мировые рекомендации свидетельствуют о том, что это наиболее эффективное лечение метастатического HER2-позитивного рака молочной железы на сегодняшний день», – отметила профессор Вера Горбунова.
«Государство должно обеспечить такое лечение, по возможности, всем больным. Сделать доступными современные медицинские достижения для всех граждан, – добавил Михаил Личиницер, д.м.н., академик РАН, проф., заместитель директора РОНЦ им. Н.Н. Блохина РАМН. – Всё лечение онкологическим пациентам должно быть бесплатным, обеспечиваться государством, покрываться страховыми компаниями, как это происходит во всем мире».
источник
В большинстве случаев обследования больных с локализованными опухолями врач приходит к выводу, что болезнь носит преимущественно системный характер, и метастазы разовьются позже. Обнаружение многочисленных метастазов, часто спустя годы после проведения мастэктомии, а также в течение многолетнего наблюдения за больными подтверждает этот вывод.
По данным классических исследований Бринкли и Хейбитл, общая выживаемость больных раком молочной железы через 25 лет после лечения составляет только 20%. Даже среди пациенток, которым мастэктомия была сделана своевременно («ранние» операбельные случаи), выживаемость составляет лишь 30%.
Обычно появление метастазов приводит к смертельному исходу в пределах трех лет, хотя в случаях, когда лечение оказывается эффективным, пациентки могут жить дольше. Вероятность метастазирования опухоли сильно зависит от степени вовлечения подмышечных лимфатических узлов в патологический процесс, что определяется при гистологическом анализе образцов, взятых во время операции.
Существует взаимосвязь между количеством пораженных подмышечных лимфатических узлов и вероятностью распространения метастазов.
Со времени проведения первой операции терапевтической овариэктомии, проведенной Битсоном в 1896 г., стало очевидно, что при изменении гормонального статуса организма в случаях распространенного опухолевого процесса, по крайней мере для одной трети пациенток достигается симптоматический эффект.
Использовались различные методы: удаление яичников или их облучение (иногда называемое «создание искусственной менопаузы»), лечение эстрогенами, антиэстрогенами и антагонистами гонадотропин-рилизинг-гормона (например, гозерелином). Этот гормон регулирует секрецию лютеинизирующего гормона (LHRH).
Также применяли анаболические стероиды, глюкокортикоиды и прогестерон, проводили удаление надпочечников или гипофиза и назначали ингибиторы ароматазы (анастрозол или летрозол).
Стандартный подход основан на менструальном статусе пациентки. Для большинства больных с метастазирующими опухолями в пременопаузе и перименопаузе используется хирургическое удаление яичников или их облучение. Однако с появлением антагонистов гонадотропин-рилизинг-гормона эти процедуры стали применять реже.
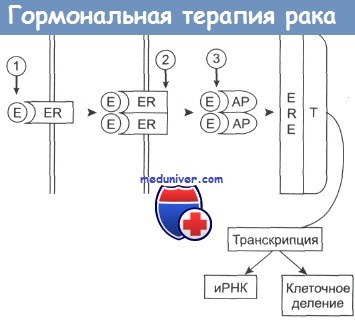
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.
Антагонисты обеспечивают стойкое снижение уровня эстрогенов и вызывают у пациентки состояние менопаузы, которое длится в продолжении примерно двух месяцев с начала применения гозерелина. Препарат назначается ежемесячно в виде внутримышечных инъекций. Вместе с тем в качестве альтернативы снова стал популярным такой хирургический метод, как лапароскопическое удаление яичников.
Это достаточно безопасная и несложная операция, после которой пациентка на одну ночь остается в стационаре. Следует отметить, что перед операцией больные проходят тщательный отбор по критерию гормональной чувствительности опухоли, и тем, для кого не предполагается проявление лечебного эффекта, операция не проводится.
Для пациенток с опухолью в постменопаузе широко применяется тамоксифен, поскольку он практически не проявляет побочных эффектов. Препарат действует как антиэстроген, но, вероятно, оказывает и прямой цитотоксический эффект. В течение почти 20 лет тамоксифен использовался в качестве стандартного препарата адъювантной терапии.
Тамоксифен назначается перорально в ежедневной стандартной дозе 20 мг. Он обладает медленным кумулятивным действием. Побочные эффекты редки, однако могут наблюдаться приливы, тошнота, гиперкальциемия, тромбоцитопения, удержание жидкости и расстройство менструального цикла. После приема препарата большинство пациенток прибавляют 1-2 фунта в весе и некоторые отмечают ухудшение состояния кожи, волос и ногтей.
Гораздо более существенный эффект получен при назначении гормонотерапии пациенткам с гормонально зависимыми опухолями, в то время как при лечении гормонально независимых опухолей благоприятный эффект наблюдался лишь в редких случаях. Прогноз в случаях гормонально зависимых и независимых опухолей отличается. Для больных с гормонально-зависимыми опухолями характерен более длительный безрецидивный период и большая выживаемость.
Совместное определение показателей ER и PR обеспечивает более точный прогноз в отношении чувствительности опухоли к гормонотерапии, чем это оказывается возможным при оперировании только показателем ER. Больные с PR-положительными опухолями также характеризуются более длительным безболезненным периодом.
На эффективность гормонотерапии сильно влияет характер распространения метастазов. Костные метастазы проявляют некоторую чувствительность к гормонам, хотя после лечения пациентки живут в среднем около 12-15 месяцев. Тем не менее некоторые больные с гормоночувствительными опухолями и с костными метастазами живут дольше, иногда несколько лет.
В большинстве случаев, при рецидиве опухоли, развившейся в пременопаузе, применяется гозерин (или его аналоги) или лапароскопическая овариэктомия (или облучение яичников). Эти меры эффективны для гормонально чувствительных опухолей. При опухолях в периоде постменопаузы обычно назначают тамоксифен, если пациентки раньше не получали этот препарат в качестве средства адъювантной терапии.
В любом случае можно ожидать, что выживаемость больных составит по крайней мере 30%. Экзогенные гормоны назначают до тех пор, пока не наступит эффект. В дальнейшем гормональную терапию продолжают только тем пациенткам, у которых проявился эффект первичного лечения. Предложены новые противоопухолевые препараты, относящиеся к группе ингибиторов ароматазы.
К числу их относится анастрозол, который блокирует биосинтез предшественников эстрогенов и их последующие превращения в тканях. Анастрозол действует при пероральном применении. Он хорошо переносится больными, так же как и другие родственные соединения, благодаря чему эти препараты быстро заняли место тамоксифена, который оказался неэффективным в лечении пациенток с гормонозависимыми опухолями, развивающимися в период постменопаузы. Рекомендуемая ежедневная доза препарата составляет 1 мг.
Если после первичного лечения возникает рецидив, то назначают другие препараты, например анаболические стероиды, прогестогены и глюкокортикоиды. Анаболические стероиды более эффективны у пациенток с опухолями, развившимися в постменопаузе, и, по-видимому, их особенно необходимо применять в случаях обнаружения костных метастазов.
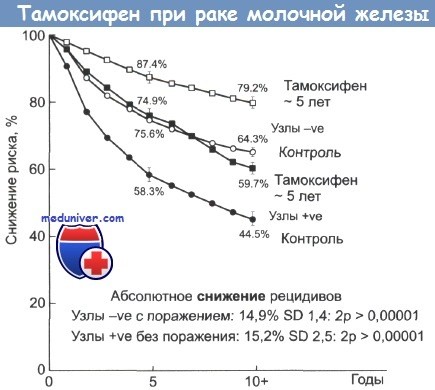
Светлые значки — пациентки без признаков поражения лимфатических узлов; затемненные значки — пациентки с признаками поражения лимфоузлов.
Благоприятный эффект достигается примерно у 20% пациенток, однако недостатком применения стероидов является вирилизация. Удобным для применения является нандролон деканоат (Deca-Durabolin), который назначается в виде внутримышечных инъекций в дозе 50-100 мг каждые 3-4 недели. Если гормонотерапия раньше давала положительные результаты, то можно применять прогестогены. Наиболее часто используется ацетат медроксипрогестерона (МРА, Provera), который обычно назначают перорально в дозе 100 мг три раза в день.
Однако его применение ограничено из-за развития побочного эффекта — прибавления в весе. Такой же эффективностью обладает другое производное прогестерона — мегестрол-ацетат (Megace).
Широко обсуждается вопрос выбора метода лечения первого рецидива опухоли. Следует в этом случае использовать гормональный метод или же химиотерапию с использованием цитотостатиков? Если принимать во внимание количественные показатели, то выбирать надо между гормонотерапией (эффективна в 30% случаев) и комбинационной химиотерапией (эффективность которой в два раза выше). Однако это упрощенное решение вопроса, ответить на который на самом деле сложно.
Реакция опухоли на гормоны обычно носит более продолжительный характер, и у пациентки наблюдаются минимальные токсические проявления. При химиотерапии развивается более кратковременный эффект, который сопровождается токсическими и психологическими осложнениями. Большинство клиницистов в Великобритании в качестве средства первичного лечения предпочитают использовать гормональную терапию. Выбор облегчается все более широким применением метода анализа состояния рецепторов эстрогенов: гормональная терапия должна проводиться только среди пациенток с ER-положительными опухолями. Недавно предложен препарат фульвестрант (Faslodex), подавляющий функции рецепторов эстрогенов. Он может применяться у пациенток с гормоноустойчивыми опухолями, которые развились в постменопаузе. Одним из основных преимуществ этого препарата, по сравнению с агонистом эстрогенов, тамоксифеном, является отсутствие побочных эффектов. Он также не опустошает пул эстрогенов в женском организме, что происходит при применении ингибиторов ароматазы.
источник
Как правило, распространенный (метастатический) рак груди дает метастазы в костную ткань, легкие, печень и головной мозг. Также при раке груди возможно появление метастаз в любом другом органе. При наличии биологических факторов рака молочной железы, указывающих на возможное распространение заболевания, перед принятием решения о проводимой терапии проводятся подробные исследования на распространенность рака.
Онкологическая клиника Дократес оснащена всем возможным оборудованием и технологиями для проведения исследований на наличие метастазирования рака груди. Мы используем самые современные методы: ПЭТ-КТ с радиоизотопами, МРТ, ОФЭКТ (остеосцинтиграфия), КТ и пр. При возникновении подозрения на распространение заболевания разнопрофильные врачи клиники вместе решают какие именно исследования подходят в конкретном случае.
Необходимость в проведении обследований на распространенность рака груди определяется по: свойствам удаленного при операции образования, распространением рака в подмышечные лимфоузлы, и симптомами болезни.
Традиционным методом диагностирования распространения рака груди является компьютерная томография всего тела. В определенных случаях ее дополняют МРТ исследованием. В клинике Дократес поимо этих обследований доступен новейший чувствительный метод ПЭТ-КТ обследование с изотопом Naf и FDG. Обследования назначаются индивидуально. Исследование ПЭТ-КТ с Naf пришло на смену сцинтиграфии скелета. Изотоп Naf позволяет специалистам увидеть метастазы в костной ткани.
При необходимости из метастаз берется фрагмент ткани для определения злокачественность и биологических подтипов рака. В процессе метастазирования рака подтип заболевания может меняться, что влияет на выбор лечения. Например, в сторону лечения гормонального или HER-2 позитивного рака.
Лечение метастатического рака молочной железы всегда планируется индивидуально. Выбор терапии и ожидаемый ответ на лечение зависят от биологических характеристик опухоли, ранее полученного лечения, предыдущих результатов лечения, наличия у пациентки побочного воздействия на лечение, общего самочувствия, симптоматики и наличия других возможных заболеваний. Важнейшими биологическими факторами, влияющими на выбор лечения являются: наличие эстрогена и прогестерона (гормональный статус) и проявление рецепторов HER-2.
При лечении метастатического рака груди применяется медикаментозное лечение и лучевая терапия и иногда хирургическое лечение. За последние годы в лечении рака груди появились новые, эффективные препараты направленного действия. При лечении распространенного рака груди важно оценивать соотношение воздействия лечения и побочных реакций на лечение.
Лишь у небольшого процента финских пациенток метастатический рак груди выявляется на начальном этапе. У части пациенток рак молочной железы может появиться позже повторно и в форме распространенного рака груди. Рак груди, вышедший за пределы подмышечных лимфоузлов, по мнению врачей является неизлечимым, но современное эффективное лечение позволяет получать положительный ответ на лечение в течение нескольких лет. Смысл такой терапии – остановить прогрессирование заболевания и снизить скорость распространения, поэтому и возможные симптомы рака уменьшаются.
В случаях, когда речь идет о распространенном раке груди, важно сразу после уточнения диагноза обсудить с лечащим онкологом все возможные варианты лечения. Опытные специалисты нашей клиники объясняют пациенткам какие существуют виды лечения и какие из них подходят конкретной пациентке. Все данные основаны на надежных клинических исследованиях. После обсуждения с пациенткой всех нюансов ситуации составляется индивидуальный план лечения.
При уточнении распространения рака в клинике Дократес проводятся радиоизотопные исследования. Диагностика проводится командой высококвалифицированных специалистов: специализирующимся на онкологии радиологом и профессором радиоизотопной медицины. Лечащие врачи имеют возможность в любой момент обсудить диагностические результаты со специалистами отделения диагностики.
источник
• Рак молочной железы с метастазами остается неизлечимым, однако направленная таргетная терапия увеличивает продолжительность жизни.
• Анализ экспрессии рецепторов эстрогена, прогестерона и HER2/neu имеет ключевое значение для выбора оптимальной терапии.
• Пациенток, у которых наблюдается чрезмерная экспрессия опухолью HER2/neu, следует лечить либо только трастузумабом, либо в сочетании с химиотерапией.
• У женщин в предменопаузе, страдающих раком с метастазами, имеющим рецепторы к гормонам, следует рассмотреть необходимость лечения тамоксифеном вместе с овариоэктомией или агонистами рилизинг-гормона лютеинизирующего гормона (РГЛГ) для комбинированной гормональной блокады либо без таковых.
• Пациенток в периоде постменопаузы, страдающих метастатическим раком молочной железы, имеющим рецепторы гормонов, следует лечить тамоксифеном или ингибиторами ароматазы.
• Пациенткам с положительными рецепторами гормонов в опухолях при висцеральном кризе или угрозе сдавления спинного мозга, вероятно, сначала потребуется химиотерапия.
• Непрерывное участие в клинических испытаниях, оценивающих новые препараты, является важным вкладом в развитие методов лечения, увеличения продолжительности жизни и уменьшения выраженности симптомов.
Рак молочной железы является наиболее распространенным типом рака у женщин. Тогда как заболеваемость раком молочной железы продолжает увеличиваться, летальность в настоящее время снижается отчасти благодаря раннему выявлению и совершенствованию методов лечения. У большинства женщин заболевание проявляется в возрасте старше 50 лет.
Основными местами метастазирования являются кости, головной мозг, печень и легкие. Рак молочной железы с метастазами остается неизлечимым. Однако успешное распознавание путей развития и прогрессирования рака молочной железы и внедрение в практику множества новых цитотоксических препаратов, а также целевых методов лечения не только увеличивает продолжительность жизни пациенток, но улучшает и качество жизни.
У пациенток, страдающих раком молочной железы с метастазами, не наблюдается типичной клинической картины. Клинические симптомы могут отсутствовать на фоне изменений в лабораторных анализах, например повышения концентрации опухолевых маркеров, или метастазирование опухоли может проявляться симптоматикой, обусловленной специфической локализацией метастазов.
У некоторых пациенток метастазы могут проявляться менее ясной симптоматикой, например общей слабостью, повышенной утомляемостью и снижением массы тела. У других метастазирование обнаруживают во время обычных клинических осмотров, при запланированных или проводимых по другим показаниям рентгенологических исследованиях.
Несмотря на согласованные попытки раннего выявления, до сих пор у некоторых пациенток метастазирование удается выявить только на стадии клинических проявлений.
Как только возникает подозрение на метастазирование, следует подвергнуть биопсии как минимум одно место локализации метастазов для получения гистологического подтверждения метастатического поражения, а также переоценки состояния опухоли по эстрогеновым рецепторам (ЭР), прогестероновым рецепторам (ПР) и HER2/neu, поскольку ситуация с рецепторами часто отличается от состояния первичной опухоли. Полученная информация может сузить или расширить терапевтические возможности. У пациенток с метастазами в кости биопсия может быть более затруднительной.
Одиночные метастазы всегда следует подвергать биопсии, особенно при изолированных метастазах в легкие. У пациенток с курением в анамнезе примерно 50% таких поражений могут представлять собой рак легкого, который может быть радикально излечен хирургически. Следует провести анализ лейкоцитарной формулы и обычный биохимический анализ крови.
Эти анализы отражают резерв красного костного мозга и функциональное состояние органов, что позволит оценить любое ухудшение функций и необходимость изменений в лечении. Пациенток необходимо подвергать исследованиям в рамках установления стадии опухоли не только для определения распространенности метастатического поражения, но также для оценки ответа на лечение.
Такие исследования включают контрастную компьютерную томографию (КТ) органов грудной клетки и брюшной полости, а также в зависимости от симптоматики и органов малого таза. Учитывая частое выявление склеротических и литических поражений костей, в список исследований необходимо включить сцинтиграфию костей.
В то время как фтордезоксиглюкоза(ФДГ)—позитронно-эмиссионная томография (ПЭТ) демонстрирует свою значимость при нескольких солидных злокачественных опухолях, применение ФДГ-ПЭТ при раке молочной железы является спорным из-за ограниченной предсказуемости. Кроме того, ПЭТ-КТ может не позволить правильно оценить размер опухоли. Следует рассмотреть необходимость проведения МРТ головного мозга из-за распространенности бессимптомных метастазов в ЦНС (10-15%).
Исследования опухолевых маркеров, например карциноэмбрионального антигена (КЭА) 15-3, могут рассматриваться как дополнение к методам наблюдения за ответом на лечение. Однако просто повышение концентрации этих опухолевых маркеров не должно быть определяющим в установлении диагноза метастазирования или основанием для скорейшего начала цитотоксической терапии.
В 1896 г. Битсон (Beatson) наблюдал регрессию рака молочной железы у женщин, подвергшихся удалению яичников. Это положило начало долгой истории успешных исследований различных манипуляций с гормонами как метода лечения гормонально-чувствительного рака молочных желез. Метод применим, однако, только у женщин в периоде предменопаузы.
Поскольку у большинства женщин метастазирование при раке молочных желез диагностируется в возрасте старше 50 лет, эффекта можно добиться только у небольшого числа пациенток. Примерно 50 лет назад было продемонстрировано, что удаление надпочечников также приводит к регрессии, однако данный подход более эффективен у женщин в периоде постменопаузы.
Устранение действия эстрогенов хирургическим путем значительно вытеснено из практики химическими методами либо путем модуляции, либо путем уменьшения экспрессии эстрогеновых рецепторов по механизму отрицательной обратной связи под влиянием селективных модуляторов эстрогеновых рецепторов (СМЭР) или селективных регуляторов эстрогеновых рецепторов по механизму отрицательной обратной связи (СРЭРМООС) и путем блокады превращения эстрогена из предшественников с помощью ингибиторов ароматазы (ИА).
Также эффективны и другие средства, например синтетический прогестерон (мегестрола ацетат или мегасе), андрогены и даже применение высоких доз эстрогенов. Однако из-за нежелательных побочных эффектов их применяют реже или используют на поздней стадии рака.
Основной вариант лечения у женщин в предменопаузе, страдающих опухолями, имеющими рецепторы к эстрогенам или прогестерону, — тамоксифен (рис. 7.1).
Рис. 7.1. Лечение метастатического рака молочной железы
Тамоксифен (нольвадекс) — селективный модулятор эстрогеновых рецепторов для приема внутрь. СМЭР действуют путем конкуренции с эстрогеном за эстрогеновые рецепторы. Из-за различной регуляции коактиваторов и ко-ингибиторов эффекты селективных модуляторов эстрогеновых рецепторов тканеспецифичны, и в некоторых тканях могут быть проэстрогенными и антиэстрогенными в других, что объясняет наблюдаемые побочные эффекты.
Назначение тамоксифена демонстрирует частоту ответа, варьирующую в пределах 16-56%, продолжительность ответа 12-18 месяцев и снижение летальности, обусловленной раком молочной железы. Побочные эффекты тамоксифена включают приливы, тромбоз глубоких вен, тромбоэмболию легочной артерии, инсульт и рак эндометрия, но также препарат способен оказывать защитное действие в отношении костей.
Из-за протромботических эффектов тамоксифена настоятельно рекомендуется отказ от курения, а пациенток следует предупредить о необходимости избегать длительных периодов отсутствия физической активности, особенно при авиаперелетах.
У многих пациенток развивается устойчивость к препарату. Тамоксифен следует отменять при появлении признаков прогрессирования опухоли. Если препарат продолжают принимать — продемонстрировано, что тамоксифен способен оказывать агонистический эффект в месте своего действия, приводя к прогрессированию опухоли. Кроме того, после отмены тамоксифена во время прогрессирования опухоли у некоторых пациенток наблюдается регрессия опухоли.
У женщин в периоде предменопаузы яичники больше других источников высвобождают в кровь эстрогены. Двусторонняя овариоэктомия является приемлемым методом подавления эстрогенов в этой группе пациенток. Абляцию яичников можно дополнить их облучением или применением агонистов рилизинг-гормона лютеинизирующего гормона (РГЛГ-агонисты), которые часто назначают в виде инъекций раз или три раза в месяц.
Комбинированный анализ нескольких малочисленных исследований показал, что применение тамоксифена в сочетании с абляцией яичников приводит к увеличению — по сравнению с пациентками, получающими либо только тамоксифен, либо только абляцию — безрецидивной и общей продолжительности жизни.
Менопауза — прекращение менструальных циклов на протяжении 6-12 месяцев. Однако к более молодым женщинам, получающим химиотерапию, это определение следует применять с осторожностью. Вызванная химиотерапией аменорея может быть обратимой в течение нескольких месяцев или даже лет после завершения химиотерапии. Особо следует учитывать возможность такой ситуации при лечении пациенток препаратами, которые эффективны только в условиях низкой концентрации эстрогенов, например ИА.
В течение многих лет тамоксифен был наиболее предпочтительным методом лечения женщин в периоде постменопаузы, страдающих ЭР и/или ПР-положительным раком молочной железы. Ситуация изменилась с внедрением в клиническую практику селективных ингибиторов ароматазы. После прекращения функциональной активности яичников надпочечники становятся основным эндогенным источником эстрогенов.
Хирургическое удаление надпочечников является эффективным методом, однако влияние на глюко- и минералокортикоидные гормоны, оказываемое при этом, несет значимые побочные эффекты. Внедрение в практику перорального препарата аминоглютетимида (который на момент публикации данной книги не был одобрен к применению по этому показанию Food and Drug Administration) было одним из первых успешных нехирургических методов блокады продукции эстрогенов.
Однако аминоглютетимид является неселективным и блокирует ранний этап образования стероидов — превращение холестерина в дельта-5-прегнено-лон, блокируя таким образом синтез всех стероидов надпочечников, включая глюкокортикоиды, минералокортикоиды и эстроген.
Аминоглютетимид в настоящее время замещается селективными ИА, которые блокируют превращение андрогенных предшественников в эстрогены (андростендиона — в эстрадиол и тестостерона — в эстрон). В отличие от хирургического подхода, ингибиторы ароматазы также блокируют превращение эстрогенов в других местах, включая молочную железу, жировую ткань, печень, мышцы и головной мозг.
Наиболее часто используемые при метастазах ИА являются обратимыми нестероидными ингибиторов ароматазы: анастрозол (аримидекс) и летрозол (фемара); и необратимыми стероидными ИА: эксеместан (аромазин). Все три сравнивались с тамоксифеном в крупных рандомизированных исследованиях III фазы.
В большинстве исследований ингибиторов ароматазы показали себя улучшающими частоту ответа, безопухолевую продолжительность жизни и/или время до прогрессирования опухоли. Однако ни в одном из этих исследований не было показано улучшения общей продолжительности жизни для ИА, по сравнению с тамоксифеном, при назначении в рамках первоочередной терапии (рис. 7.1 и табл. 7.1).
Таблица 7.1. Ингибиторы ароматазы в сравнении стамоксифеном при метастатическом раке молочной железы
11,1 против 5,6 месяцев p: 0,005
10,25 против 6,5 месяцев p а
продолжитель-
ность жизни
(О ‘Shaughnessy)
и др., 2002
75 мг/м 2 вместе
с капецитабином
1,250 мг/м 2
два раза в сутки
в сравнении
с доцетакселом
по 100 мг/м 2
30%
р : 0,006
4,2 месяцев
р : 0,0001
11,5 месяцев
р : 0,0126
и др., 2004
с гемцитабином
в сравнении
с паклитакселом
22,10%
р б
с трастузумабом
в сравнении
с изолированным
применением
химиотерапии
32%
р а ВДП — время до прогрессирования; ПЖБП — продолжительность жизни без прогрессирования.
б Химиотерапия — адриамицин и циклофосфамид или паклитаксел. Адриамицин не следует сочетать с трастузумабом из-за развития застойной сердечной недостаточности.
В основном испытании III фазы частота ответа для сочетания химиотерапии на основе антрациклинов и трастузумаба составила 50% против 23% для изолированного применения антрациклинов; время до прогрессирования составило 7,4 против 4,6 месяцев, а общая продолжительность жизни 25,1 против 20,3 месяцев.
Несмотря на данные многообещающие результаты, эти два препарата не следует сочетать из-за чрезмерного токсического действия на сердце. При сочетании трастузумаба с таксанами, доцетакселом или паклитакселом почти удваивается частота ответа и время до прогрессирования, по сравнению с изолированным применением химиотерапии, в то же время общая продолжительность жизни увеличивалась на 3,7-5,7 месяцев без чрезмерного токсического влияния на сердце.
Использование тройной терапии паклитакселом и трастузумабом вместе с карбоплатином (который не разрешен к применению с этой целью Food and Drug Administration на момент публикации) дает частоту ответа 52%, в то время как винорелбин (который также не был разрешен к применению с этой целью Food and Drug Administration на момент публикации) и трастузумаб имели частоту ответа до 75%.
У пациенток, подвергающихся интенсивной терапии, частота ответа для трастузумаба в сочетании с другими цитотоксическими препаратами, например капецитабином, гемцитабином и липосомальной формой доксорубицина (который также не был разрешен к применению с этой целью Food and Drug Administration на момент публикации), составила 53%, 37% и 58% соответственно. Данные препараты служат дополнительным терапевтическим вариантом у этой группы пациенток.
Несмотря на отсутствие рандомизированных исследований, отдельно посвященных данному вопросу, многие врачи и пациентки предпочитают прекратить прием трастузумаба в случае прогрессирования опухоли после одного цикла лечения.
Несколько других препаратов, точкой приложения действия которых является HER1/neu, исследуются и проходят различные стадии клинической разработки. Эти препараты включают лапатиниб, HKI-272 и другие.
В отличие от моноклональных антител (трастузумаба) лапатиниб (тикерб) и HKI-272 (который не разрешен к применению с этой целью Food and Drug Administration на момент публикации) являются инигибитором киназ для приема внутрь, которые действуют не только на HER2/neu, но также и на рецептор erbB1. В декабре 2006 г. в New England Journal of Medicine (NEJM, Медицинский журнал Новой Англии) были опубликованы данные из испытания III фазы, проведенного Гейером и др. (Geyer), в котором оценивали применение лапатиниба с капецитабином в сравнении с изолированным применением капецитабина.
В исследование включались пациентки с HER2/neu-положительным раком молочной железы на поздней стадии или с метастазами, ранее получившие лечение. Сочетание двух препаратов сопровождалось улучшением продолжительности жизни без прогрессирования опухоли. Только у немногих пациенток обнаруживались кардиальные побочные эффекты, однако они были обратимы у всех пациенток.
Существуют конфликтующие данные по применению гормональной терапии в сочетании с трастузумабом у пациенток с HER2/neu и ЭР-положительным метастатическим раком молочной железы.
Ряд данных указывает на то, что чрезмерная экспрессия HER2/neu может вызвать устойчивость к гормональной терапии у пациенток, страдающих ЭР-положительными опухолями. К настоящему времени отсутствуют ясные данные в пользу комбинированного применения трастузумаба и антигормональной терапии у пациенток с метастатическим раком молочной железы.
В то время как тамоксифен считается менее эффективным у пациенток с чрезмерной экспрессией HER2/neu, ингибиторы ароматазы демонстрируют эффективность, и возможность их назначения следует рассматривать. В настоящее время выполняется клиническое испытание IV фазы, проводимое с целью оценки комбинации летрозола и трастузумаба.
В других клинических исследованиях оценивают применение трастузумаба в сочетании с другими ингибиторами семейства erbB-киназ, а также в качестве дополнения к лапатинибу.
В качестве монотерапии для лечения метастатического рака молочной железы используют многие цитотоксические препараты, включая антрациклины, таксаны и алкилирующие агенты (табл. 7.3).
Таблица 7.3. Отдельные препараты, демонстрирующие активность при раке молочной железы
