Классификация рака молочной железы осуществляется ВОЗ по системе TNM, на основании которой определяется стадия рака молочной железы 1, 2, 3 или 4 стадии. Также для постановки диагноза и выбора тактики лечения используются классификации по МКБ 10, по гистологии, скорости роста опухоли, определения группы риска для операции.
С50 Злокачественное заболевание молочной железы.
С50.0 Сосок и ареола.
С50.1 Центральная часть молочной железы.
С50.2 Верхневнутренний квадрант.
С50.3 Нижневнутренний квадрант.
С50.4 Верхненаружный квадрант.
С50.5 Нижненаружный квадрант.
С50.6 Подмышечная область.
С50.8 Распространение более чем на одну из вышеуказанных зон.
С50.9 Локализация неуточнённая.
D05.0 Дольковая карцинома in situ.
D05.1 Внутрипротоковая карцинома in situ.
На данный момент используют гистологическую классификацию ВОЗ от 1984 года.
• внутрипротоковый (интраканаликулярный) рак in situ;
• дольковый (лобулярный) рак in situ.
• другие формы (папиллярный, плоскоклеточный, ювенильный, веретеноклеточный, псевдосаркоматозный и др.).
Наиболее часто диагностирующиеся гистологические формы рака — это: плоскоклеточный рак;
болезнь Педжета (разновидность особая плоскоклеточного рака в зоне соска железы); аденокарцинома (железистая опухоль). Наиболее благоприятный прогноз по течению и лечению имеют: рак тубулярный, слизистый, медуллярный и аденокистозный.
Если паталогический процесс не распространяется за пределы одного протока или дольки, то рак называют неинфильтрирующим. Если опухоль распространяется на лежащие вокруг дольки, то его называют инфильтрирующим. Инфильтрирующий рак является наиболее чаще выявляемой формой (протоковая форма 50-70% случаев и дольковая форма — в 20%).
Более подробно о лечение и прогнозе рака молочной железы читайте на нашем сайте.
Скорость роста опухоли молочной железы определяется с помощью лучевых методов диагностики, скорость роста рака дает понять насколько злокачественный процесс.
— Быстро растущий рак (общая масса опухолевых клеток становится в 2 раза больше за 3 месяца).
— Средняя скорость роста (увеличение массы вдвое происходит в течение года).
— Медленно растущий (увеличение опухоли в 2 раза происходит более чем за год).
Т — определение первичного опухолевого узла.
Тх – недостаточно данных для оценки первичной опухоли.
То – первичная опухоль не определяется.
Tis (DCIS) – преинвазивная карцинома (протоковый рак in situ).
Tis (LCIS) – неинфильтрирующая внутрипротоковая или дольковая карцинома (дольковый рак in situ).
Tis (Paget’s) – рак Педжета соска молочной железы при отсутствии опухоли в молочной железе.
Т1 – Опухоль ≤ 2см в наибольшем измерении.
Т1mic — микроинвазивный рак (≤ 0,1 см в наибольшем измерении).
Т4 – опухоль любого размера с прямым распространением на кожу или грудную стенку (фасции, мышцы, кости).
— Т4a: опухоль прорастает в грудную стенку, но не врастает в грудные мышцы;
— Т4b: опухоль с изъязвлением кожи и/или отёком (включая симптом апельсиновой корки) и/или метастазы в коже одноимённой молочной железы;
— Т4d: Первично-отёчная форма рака, воспалительный рак молочной железы (без первичного очага).
Оценивают локализацию поражённых регионарных лимфатических узлов и распространённость опухолевого процесса при помощи пальпации, УЗИ, КТ, МРТ, ПЭТ) и патологоанатомически (по результатам гистологического исследования лимфатических узлов после операции).
Nx – недостаточно данных для оценки состояния регионарных лимфатических узлов.
No – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – метастазы в смещаемых подмышечных лимфатических узлах или лимфатическом узле на стороне поражения.
N2 – метастазы в подмышечных лимфатических узлах, фиксированных друг с другом, на стороне поражения, или клинически определяемые (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии) метастазы во внутренних лимфатических узлах молочной железы на стороне поражения при отсутствии клинически определяемых метастазов в подмышечных лимфатических узлах:
— N2a – метастазы в подмышечных лимфатических узлах на стороне поражения, фиксированных друг к другу, или другим структурам (кожа, грудная стенка)
— N2b – метастазы, определяемые только клинически (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии), во внутренних лимфатических узлах молочной железы при отсутствии клинически определяемых метастазов в подмышечных лимфатических узлах на стороне поражения;
N3 – метастазы в подключичных лимфатических узлах на стороне поражения с/без метастазов в подмышечных лимфатических узлах, или клинически определяемые метастазы (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии) во внутренних лимфатических узлах молочной железы на стороне поражения при наличии метастазов в подмышечных лимфатических узлах или метастазы в надключичных лимфатических узлах на стороне поражения с/без метастазов в подмышечных или внутренних лимфатических узлах молочной железы:
— N3a: метастазы в подключичных лимфатических узлах на стороне поражения;
— N3b: метастазы во внутренних лимфатических узлах молочной железы на стороне поражения;
— N3c: метастазы в надключичных лимфатических узлах на стороне поражения.
рNx – недостаточно данных для оценки состояния регионарных лимфатических узлов (узлы удалены ранее, или не удалены для патологоанатомического исследования).
рNo – нет гистологических признаков поражения метастазами регионарных лимфатических узлов, на изолированные опухолевые клетки дополнительных исследований не проводилось.
При наличии в регионарных лимфатических узлах только изолированных опухолевых клеток – данный случай классифицируется как No. Единичные опухолевые клетки в виде небольших скоплений (не более 0,2 мм в наибольшем измерении) обычно диагностируется иммуногистохимически или молекулярными методами. Изолированные опухолевые клетки, как правило, не проявляют метастатическую активность (пролиферация или стромальная реакция)
рNo(I-): нет гистологических признаков поражения метастазами регионарных лимфатических узлов; отрицательные результаты иммуногистохимического исследования.
рNo(I+): нет гистологических признаков поражения метастазами регионарных лимфатических узлов; положительные результаты ИГХ при отсутствии скоплений опухолевых клеток более 0,2 мм в наибольшем измерении по данным ИГХ
рNo(mol-): нет гистологических признаков поражения метастазами регионарных лимфатических узлов; отрицательные результаты молекулярных методов исследования.
рNo(mol+): нет гистологических признаков поражения метастазами регионарных лимфатических узлов; положительные результаты молекулярных методов исследования.
рN1 – метастазы в 1 – 3 подмышечных лимфатических узлах на стороне поражения и/или во внутренних лимфатических узлах молочной железы на стороне поражения с микроскопическими метастазами, определяемые при иссечении сторожевого лимфатического узла, но не выявленные клинически (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии):
— рN1mi: микрометастазы (> 0,2 мм, но 2 мм;
— N2b – клинически определяемые метастазы (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии), во внутренних лимфатических узлах молочной железы на стороне поражения, при отсутствии метастазов в подмышечных лимфатических узлах.
рN3 – метастазы в 10 и более подмышечных лимфатических узлах на стороне поражения; или метастазы в подключичных лимфатических узлах на стороне поражения; или клинически определяемые (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии) метастазы во внутренних лимфатических узлах молочной железы на стороне поражения при наличии одного и более поражённого метастазами подмышечных лимфатических узлов; или поражении более 3 подмышечных лимфатических узлов с клинически негативными, но микроскопически доказанными метастазами во внутренних лимфатических узлах молочной железы; или метастазы в надключичных узлах на стороне поражения:
— рN3a: метастазы в 10 и более подмышечных лимфатических узлах, один из которых > 2 мм или метастазы в подключичных лимфатических узлах на стороне поражения;
— рN3b: клинически определяемые (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии) метастазы во внутренних лимфатических узлах молочной железы на стороне поражения при наличии одного и более поражённого метастазами подмышечных лимфатических узлов; или поражении более 3 подмышечных лимфатических узлов и внутренних лимфатических узлов с клинически негативными (при осмотре, УЗИ, КТ, МРТ, ПЭТ, но не при лимфосцинтиграфии), но микроскопически доказанными метастазами во внутренних лимфатических узлах молочной железы при стенцинальной биопсии;
— рN3c: метастазы в надключичных лимфатических узлах на стороне поражения.
Мх – недостаточно данных для оценки наличия отдаленных метастазов
Мо – нет признаков отдаленных метастазов.
М1 – имеются отдаленные метастазы, в том числе поражение кожи за пределами железы, в надключичных лимфатических узлах.
На основании системы TNM определяют стадии рака молочной железы. В зависимости от стадии выбирают тактику лечения. Стадии рака молочной железы представлены в таблице.
источник
Вопрос о первично-множественных злокачественных опухолях становится все более актуальным’. Число первично-множественных новообразований растет. Особенно часты множественные гормонозависимые опухоли у женщин [10, 68].
Среди факторов, предрасполагающих к развитию полинео- плазии, необходимо отметить эндокринно-метаболические нарушения (расстройства жирового и углеводного обмена), закономерно возникающие по мере старения и обозначенные как синдром канкрофилии [10, 29, 30], генетические дефекты, роль которых установлена в отношении синдрома МЭН [19, 25, 35], а также возможный отсроченный канцерогенный эффект лучевого и комбинированного лечения первой опухоли (см. главу 11).
В последние годы внимание исследователей привлекают синдром множественных эндокринных неоплазий. Синдром МЭН-11 включает медуллярный рак щитовидной железы, феохромо- цитому и опухоли или гиперплазию паратиреоидных желез (см. главу 14). Но если сочетание медуллярного рака щитовидной железы с другими злокачественными опухолями явление закономерное, то при других дифференцированных тиреоидных кар
циномах подобное сочетание наблюдается сравнительно редко [47, 79].
По данным литературы, частота первично-множественных злокачественных опухолей с локализацией одной из них в щитовидной железе колеблется от 0,62% до 17% [68]. Следует отметить, что большинство авторов сообщают только факт сочетания рака щитовидной железы со злокачественными опухолями другой локализации, но не делают попытки объяснить этот факт.
Среди 1089 больных, которые лечились по поводу рака щитовидной железы, у 70 (6,4%) были синхронные или метахронные злокачественные опухоли другой локализации. Первично-множественные опухоли наблюдались у 65 из 849 женщин (7,6%) и у 5 из 240 мужчин (2,0%) в возрасте от 8 до 80 лет. Анализ этой группы больных позволяет выявить некоторые закономерности возникновения первично-множественных опухолей, по крайней мере в части случаев.
Наиболее частым было сочетание рака щитовидной и молочной желез. Такая комбинация злокачественных новообразований наблюдалась у 33 из 65 (50%) женщин с первично-множественными опухолями. Аналогичные данные приводятся в литературе. Е. Коп и соавт. [145] обобщили материал Соппесйси! Титог Ке§18!гу и установили, что среди 1487 больных раком щитовидной железы вторая опухоль развилась у 97 (8,5%) пациентов, в том числе у 34 (3,5%) больных был рак молочной железы. Таким образом, у больных раком щитовидной железы наиболее частой второй опухолью был рак молочной железы. Из 36 542 больных раком молочной железы вторая опухоль развилась у 3147 (8,6%) пациенток, в том числе рак щитовидной железы у 24 (менее 1%). Авторы приходят к выводу, что, независимо от последовательности развития опухолей (рак молочной железы — рак щитовидной железы — рак молочной железы), наибольший риск развития второй карциномы у женщин старше 40 лет.
Подобное сочетание злокачественных опухолей, несомненно, не является случайным. По мнению ряда исследователей, при злокачественных опухолях молочной и щитовидной желез возможны сходные эндокринно-метаболические нарушения, что объясняется прежде всего общей регуляцией этих органов [10, 29]. Известно, что тиреотропин и пролактин имеют общий рилизинг- гормон. Выявлена линейная зависимость между концентрацией тиреотропина и пролактина. Поэтому можно представить себе, что нарушение центрального звена регуляции создает благоприятный фон для развития опухолей щитовидной и молочной желез.
А. ^ое8е^ (1954) впервые отметил связь между раком молочной железы и тенденцией к гипотиреозу.
Нарушение функции щитовидной железы играет особенно важную роль в патогенезе рака молочной железы у молодых женщин (до 35 лет). Эта зависимость настолько характерна, что выделена особая патогенетическая форма рака молочной железы — тиреоидная форма [10].
Как показали наши наблюдения, у оперированных по поводу рака щитовидной железы больных (особенно в старшей возрастной группе) заместительная терапия тиреоидными гормонами не всегда позволяет снизить концентрацию ТТГ в крови. Стойкий высокий уровень ТТГ и пролактина является неблагоприятным фактором, который может сыграть определенную роль в развитии рака молочной железы.
Анализ сведений о больных, страдавших первично-множественным раком щитовидной и молочной желез, показывает, что группа эта очень неоднородна. В зависимости от последовательности выявления опухолей обеих локализаций, можно выделить два варианта:
1) синхронные первично-множественные опухоли (9 больных — 27%);
2) метахронные первично-множественные опухоли (24 больных — 73%).
У 9 больных первой опухолью был рак щитовидной железы, а у 24 — молочной железы.
Почти все больные, оперированные по поводу синхронно развившихся карцином щитовидной и молочной желез, были в глубокой менопаузе. Средний возраст их составил 60 лет. Только одна больная в этой группе была в возрасте 42 лет. Таким образом, практически все женщины с синхронными карциномами щитовидной и молочной желез находились в том возрасте, который рассматривается как фактор риска в отношении опухолей обеих локализаций.
При метахронном развитии новообразований интервал между выявлением первой и последующих опухолей колебался от 5 до
24 лет. Средний возраст женщин, у которых первой опухолью был рак молочной железы, составил 47 лет, а в группе первоначально леченных по поводу рака щитовидной железы — 49 лет.
Обращает на себя внимание тот факт, что у 7 из 24 больных, впервые обратившихся в НИИ онкологии по поводу рака молочной железы, в комплекс лечебных мероприятий входила лучевая терапия (с облучением надключичных зон). Естественно считать, что рак щитовидной железы, развившийся у этих пациенток в отдаленные сроки после лечения по поводу карциномы молочной железы (через И, 16 и 24 года), является радиоиндуцированным.
Вторым по частоте было сочетание рака щитовидной железы с опухолями репродуктивных органов (табл. 8).
Как видно из табл. 8, опухоли репродуктивных органов наблюдались у 18 (27,6%) из 65 женщин с первично-множественными карциномами. У 10 из этих женщин первая опухоль локализовалась в щитовидной железе. Только 20% больных этой группы к моменту выявления первой злокачественной опухоли были в возрасте до 40 лет, а остальные 80% пациенток находились в менопаузе, т. е. в том возрасте, для которого характерно учащение опухолей репродуктивных органов всех локализаций.
У 8 больных возникновению рака щитовидной железы предшествовала лучевая терапия, проводившаяся по поводу опухолей головы и шеи (рак нижней губы, носоглотки, злокачественная лим- фома). Если прибавить к этой группе 7 больных, получавших лучевую терапию по поводу рака молочной железы, то всего было 15 (23%) радиоиндуцированных злокачественных опухолей щитовидной железы.
| Таблица 8 Опухоли репродуктивных органов у больных раком щитовидной железы
|
К сожалению, у большинства больных лучевая терапия проводилась в других лечебных учреждениях, и мы не всегда располагаем сведениями о режиме и суммарной дозе облучения. Однако известно, что эпителий щитовидной железы чрезвычайно чувствителен к ионизирующей радиации, а диапазон доз, способных индуцировать опухоль, очень велик (см. главу 11). По данным Ю. И. Москалева и В. Л. Стрельцовой [61], дозы от 0,065 до 12,5 Гр способны индуцировать опухоль щитовидной железы. Поэтому сам факт облучения области головы и шеи позволяет говорить о возможности развития индуцированной карциномы щитовидной железы.
Особенно примечателен тот факт, что все 5 мужчин с первично-множественными опухолями имели метахронные радиоиндуцированные карциномы щитовидной железы и в прошлом подвергались лучевой терапии по поводу рака нижней губы (3 больных), лимфогранулематоза и астроцитомы головного мозга. Интервал между лучевой терапией по поводу опухолей головы и шеи и операцией по поводу рака щитовидной железы колебался от 5 до 30 лет и составил в среднем 16,5 лет.
К радиоиндуцированным новообразованиям мы отнесли и 2 наблюдения рака пищевода у женщин, перенесших экстирпацию щитовидной железы с последующей лучевой терапией, которая осложнилась тяжелым лучевым эзофагитом и лейкопенией. У них соответственно через 7 и 5 лет после лечения развилась картина рака пищевода. Обе больные погибли. На аутопсии признаков рецидива рака щитовидной железы не обнаружено. Возможность развития рака пищевода и рака щитовидной железы у больных, подвергшихся облучению области шеи, описана в литературе.
Наконец, последнюю группу составили всего 4 женщины, у которых вторая опухоль развилась вне репродуктивной системы: рак толстой кишки (1); меланома кожи (1); злокачественная лимфома (1); рак желудка (1).
Оценивая в целом группу женщин с первично-множественными злокачественными опухолями, можно отметить следующее. У 78,4% пациенток было сочетание опухолей гормонопродуцирующих или гормонозависимых органов. Это позволяет рассматривать больных, страдающих или излеченных от опухоли одного из этих органов, как группу риска в отношении опухоли другой локализации в той же системе органов.
Наиболее неблагоприятным прогностическим моментом в отношении возможности развития рака щитовидной железы у ранее леченных по поводу опухолей женщин является облучение области головы и шеи.
Вероятность первичномножественных опухолей эндокринно-зависимых органов выше у больных старшей возрастной группы. Это обстоятельство можно объяснить с позиции «гипоталамической концепции» В. М. Дильмана [29]. По мнению В. М. Дильмана, повышение порога чувствительности гипоталамо-гипофизарного комплекса к регулирующему действию периферических эндокринных желез является одной из причин возрастного патологического состояния, включающего развитие злокачественных опухолей. Яркой иллюстрацией этой мысли может быть следующее наблюдение.
Больная М., 33 лет, поступила в НИИ онкологии им. проф. Н. Н. Петрова в августе 1967 г. по поводу опухоли левой молочной железы. 12.08.67 г. произведена левосторонняя мастэктомия по Холстеду. Гистологическое заключение: скиррозиый рак. Через год обнаружен узел в левой доле щитовидной железы, который расценивался как аденома. 15.11.68 г. выполнена левосторонняя гемитиреоидэктомия. Гистологическое заключение: солидный рак с амилоидозом стромы. После операции начата гормонотерапия тиреоидином.
При очередном осмотре в январе 1971 г. обнаружены плотные увеличенные лимфатические узлы на боковой поверхности шеи слева. 04.03.71 г. произведена радикальная шейная лимфаденэктомия. Гистологическое заключение: метастазы солидного рака с амилоидозом стромы.
В июне 1978 г. больная заметила втяжеиие правого соска. Осмотрена в поликлинике НИИ онкологии, диагностирована карцинома правой молочной железы. После предоперационного курса лучевой терапии (суммарная очаговая доза 20 Гр) 12.07.78 г. произведена радикальная правосторонняя мастэктомия по Холстеду. Гистологическое заключение: скиррозиый рак. После операции получила 2 курса химиотерапии.
Летом 1982 г. появились кровянистые выделения из влагалища. Диагностирована карцинома тела матки. 13.08.82 г. произведена экстирпация матки с придатками. Гистологическое заключение: аде- нокарципома без метастазов в лимфатических узлах. После операции начата гормонотерапия прогестипами (оксипрогестерона кап- роиат).
Таким образом, на протяжении 15 лет у больной развились ме- тахронный билатеральный рак молочных желез, рак щитовидной железы и карцинома эндометрия. Все эти опухоли являются эн- докринозависимыми. Следовательно, в данном конкретном наблюдении есть все основания полагать, что в основе возникновения множественных метахронно развившихся злокачественных новообразований лежат какие-то общие эндокринно-метаболические нарушения.
Примечательно также удивительно благоприятное клиническое течение множественных карцином, каждая из которых может быть источником генерализации процесса. Это наблюдение свидетельствует также о том, как важно своевременно диагностировать множественные метахронные опухоли и проводить их адекватное лечение.
Абсолютное большинство больных с первично-множественными опухолями имели высокодифференцированный рак щитовидной железы. Среди радиоиндуцированных опухолей высокодиф-ференцированные карциномы составили 80% (табл. 9).
Как отмечено выше, нами выделено 3 патогенетических варианта папиллярного рака щитовидной железы, отличающиеся темпом роста и прогнозом. В анализируемой группе больных не было ни одного случая метастатического варианта опухоли. Этот факт примечателен, поскольку метастатический вариант папиллярного рака самый благоприятный в прогностическом отношении и наблюдается преимущественно у молодых женщин. В 76% наблюдений было локальный вариант опухоли, прогностически наименее благоприятный, чаще наблюдающийся у женщин старше 40 лет.
| Таблица 9 Морфологическое строение опухолей щитовидной железы у больных с первично-множественными злокачественными новообразованиями
|
Вопрос о прогнозе при первично-множественных новообразованиях представляет большой интерес с теоретических позиций и с чисто практической точки зрения. Существует мнение о том, что множественность опухолей не является отягощающим фактором и результаты лечения их не хуже, чем при аналогичных солитарных новообразованиях [68]. Оценить результаты лечения множественных злокачественных опухолей бывает непросто. Тот факт, что между лечением первой злокачественной опухоли и распознаванием последующих новообразований проходит 15-20 лет, убедительно свидетельствует об успешном лечении первой опухоли. В таких случаях судьба больного зависит от характера и стадии второго и последующих новообразований. Результаты же лечения этих вторичных опухолей определяются, в первую очередь, их своевременной диагностикой.
У 47% женщин с первично-множественными опухолями первым новообразованием был дифференцированный рак щитовидной железы. Из этих больных б умерли от генерализации второй злокачественной опухоли. Надо заметить, что неблагоприятный результат лечения второй злокачественной опухоли в ряде случаев связан не столько с ее фатальным течением, сколько с неправильной трактовкой имеющихся клинических симптомов и поздней диагностикой. Так, обеим больным, у которых развился радиоиндуцированный рак пищевода, при жизни не был поставлен правильный диагноз. Все клинические проявления расценивались как рецидив рака щитовидной железы с прорастанием стенки пищевода.
К сожалению, клинические проявления, связанные с ростом новой опухоли, часто расцениваются врачом как проявления прогрессирования первого новообразования (рецидив или метастазы). Естественно, что в таких случаях часто назначается только симптоматическая терапия или неадекватное противоопухолевое лечение и упускается время для выполнения радикального оперативного вмешательства. Убедительным примером является следующее наблюдение.
Больная К., 30 лет. В январе 1970 г. диагностирован лимфогранулематоз (смешанноклеточпый вариант), IV 6 стадия. В онкологическом диспансере по месту жительства больной проведен курс рентгенотерапии (суммарная очаговая доза на левую шейно-над- ключиную область 34 Гр, левую подмышечную — 34 Гр) и курс химиотерапии. В июне 1970 г. госпитализирована в НИИ онкологии. Проведен курс полихимиотерапии с хорошим эффектом. В августе 1973 г. проведен профилактический курс химиотерапии. До 1985 г. — стойкая ремиссия.
В феврале 1985 г. больная заметила узел на шее слева, в верхней трети. В онкологическом диспансере этот узел расценен как рецидив заболевания. Проведен курс лучевой терапии (телегамма- терапия). Получила на боковую поверхность шеи справа 30,15 Гр и слева — 40, 15 Гр. Начат курс химиотерапии, который пришлось прекратить из-за лейкопении. Эффекта от проведенной терапии не получено.
В ноябре 1985 г. с предположительным диагнозом «рецидив лимфогранулематоза» госпитализирована в НИИ онкологии. Состояние удовлетворительное. Справа кпереди от грудиноключич-но- сосцевидпой мышцы определяется плотный гладкий узел 3×2 см. Щитовидная железа небольшая, в проекции верхнего полюса левой доли неотчетливо определяется уплотнение (около 0,5 см). Другие группы периферических лимфатических узлов не определяются. Высказано предположение о том, что у больной радиоин- дуцироваиный рак щитовидной железы с метастазами в лимфатические узлы шеи слева. Пункционная биопсия лимфатического узла подтвердила этот диагноз. 6.11.85 г. произведена субтотальная резекция щитовидной железы (оставлен верхний полюс правой доли) и фасциалыю-футлярное иссечение клетчатки шеи слева. Гистологическое заключение: папиллярный рак щитовидной железы с метастазами в лимфоузлах шеи.
Это наблюдение поучительно. После длительной ремиссии у больной появился единственный узел на шее и не было никаких других признаков рецидива лимфогранулематоза. Локализация и консистенция узла были не характерны для системного процесса. В такой ситуации, несомненно, было ошибкой начинать повторный курс лучевой терапии и химиотерапию, не имея морфологической верификации процесса.
Таким образом, данные литературы и наши наблюдения убедительно свидетельствуют об увеличении числа первично-множественных опухолей с локализацией одной из них в щитовидной железе. Этот рост происходит, прежде всего, за счет множественных гормонозависимых опухолей у женщин и за счет радиоин-дуцированных карцином. Патогенетический подход к изучению первично-множественных злокачественных опухолей позволяет более осмысленно подходить к формированию «групп риска» возникновения эндокриннозависимых и индуцированных ново
образований и существенно меняет представление об организации диспансерного наблюдения за онкологическими больными, подвергнутыми радикальному лечению (111 клиническая группа). В задачу такого наблюдения входит не только оценка проведенного лечения (диагностика и лечение рецидива и метастазов, а также поздних послеоперационных и лучевых осложнений), но и целенаправленное выявление метахронных опухолей, возможность возникновения и локализацию которых часто можно прогнозировать. Так, например, больные раком молочной железы, злокачественными лимфомами, опухолями ЛОР-органов, лечение которых включало облучение области шеи, надключичных областей, представляют собой группу риска в отношении рака щитовидной железы. В процессе диспансерного наблюдения за этими больными необходимо учитывать возможность развития радиоинду- цированного рака щитовидной железы.
В группе больных, у которых злокачественная опухоль возникла на фоне выраженных расстройств гомеостатической эндокринной регуляции (синдром канкрофилии), в процессе диспансерного наблюдения возможна попытка коррекции этих метаболических нарушений с целью профилактики развития полинеоплазий. Первые результаты такой метаболической реабилитации весьма обнадеживают [30].
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Эффективность лечения, продолжительность жизни и её полноценность во многом зависят от гистологической структуры опухолевого образования – то есть, от формы рака молочной железы. Характеристика ракового очага является вторым фактором успешного прогноза заболевания после степени запущенности процесса и его первичности.
Клинические симптомы рака могут отличаться или быть одинаковыми, однако от формы рака напрямую зависит дальнейшее развитие болезни и её исход.

Отечная форма рака грудной железы – это одна из разновидностей диффузной опухоли, которая отмечается в 2-5% случаев всех раковых опухолей молочных желез. Отечная форма отличается неблагоприятным прогнозом: выжить на протяжении пяти лет удается лишь 15-50% больных.
Выделяют первичный и вторичный вариант отечной формы. Для заболевания характерно стремительное клиническое развитие, когда уже на начальных этапах наблюдается значительное увеличение размеров и отечность пораженной железы, покраснение кожных покровов и типичная «лимонная корка». Местно повышается температура, грудь уплотняется. В первичном варианте патологии отсутствует четкий пальпируемый раковый узел, который ярко выражен при вторичном течении.
После того как в железе начинается отечная стадия, рак принимает агрессивный характер и стремительно развивается, отдавая массовые метастазы.
Отечная форма может проявляться при разных гистологических видах опухолей:
- при инфильтрующем протоковом раке;
- при дольковом раке;
- при медуллярном раке;
- при слизистом раке и пр.
Часто в такой опухоли наблюдаются преимущественно пролиферирующие лимфатические эндотелиальные клетки.

Инфильтративная форма рака молочной железы имеет и другое название – инвазивная. Данная форма имеет несколько типов:
- инфильтративная форма протокового рака (очаг распространяется с молочных протоков в жировую ткань);
- инфильтративная форма долькового рака (опухоль берет свое начало с дольковых железистых участков);
- прединфильтративная форма протокового рака (процесс способен трансформироваться в инвазивную форму при неадекватном лечении).
В чем заключаются особенности инфильтративной формы?
Инфильтрация распространяется на значительную часть грудной железы, при этом четкие границы процесса проследить нельзя. Зачастую о патологии говорит увеличение одной из желез, мраморный окрас кожи на ней, присутствие характерной «лимонной корочки».
Как и в предыдущем варианте, существует разделение на первичную и вторичную подкатегорию: без опухолевого узла, и с пальпируемым четким уплотнением.
Основными признаками инфильтративной формы являются:
- неправильная форма железы, её увеличение в размерах;
- втяжение соска или ближайшей к нему кожи;
- появление спаянного с тканями неподвижного узла (ограниченного уплотнения) до 10 см в диаметре.
Первичная инфильтративная форма чаще встречается у пациенток после 40-летнего возраста, а вторичная может быть обнаружена вне зависимости от возрастной категории.
Отечно-инфильтративная форма представляет собой сочетание двух предыдущих форм. Истинная, или первичная злокачественная патология заключается в диффузном распространении ракового процесса в тканях железы, а вторичная – в появлении четко-пальпируемого узлового образования, сопровождающегося отечностью кожных покровов.
Отечно-инфильтративная форма рака молочной железы может отличаться от локальной опухоли не только масштабом поражения, но и крайне негативным прогнозом. Особенно это касается первичного типа опухоли, так как такой рак обычно выявляется на поздних стадиях, когда процесс уже выходит за пределы молочной железы.
В большинстве случаев отечно-инфильтративная форма рака диагностируется у пациенток в молодом возрасте, иногда даже во время беременности или грудного кормления. При осмотре прощупывается уплотнение, не имеющее четких границ, и распространяющееся на значительный участок железы. Отечность тканей при этом выражена, что объясняется ущемлением лимфатических сосудов небольшими метастазами или непосредственно самой опухолью.
Узловая форма раковой опухоли встречается чаще других форм. Для неё характерно формирование в железе уплотнения в виде узла разных размеров. Чаще всего поражаются верхне-наружные квадранты груди.
Типичные признаки данной формы обычно следующие:
- появление прощупываемого плотного узелка в тканях органа, без явных границ, с ограничением подвижности;
- выявление необъяснимой морщинистости кожи, либо слишком гладкая кожа (по типу площадки), либо втянутость кожных покровов над пораженным участком;
- прощупывание уплотненных лимфатических узлов в подмышечной зоне со стороны пораженной груди.
Реже первым признаком злокачественного процесса могут стать выделения из млечных протоков.
С нарастанием злокачественного процесса клиническая картина расширяется:
- появляется «лимонная корка» признак диффузной отечности;
- изменяется околососковая область, сосок становится плоским;
- железа визуально деформируется;
- увеличиваются и уплотняются лимфоузлы в области подмышек;
- распространяются метастазы, появляется соответствующая пораженным органам симптоматика.
Рожистоподобный рак – это наиболее агрессивная форма рака молочной железы, которая отличается стремительным распространением, молниеносным течением и непредсказуемостью. Такая опухоль имеет особую склонность к рецидивам, быстро и массово распространяет метастазы, вне зависимости от используемых методов лечения.
Рожистоподобная форма раковой опухоли проявляется следующими клиническими признаками:
- резко возникающее покраснение кожных покровов на молочной железе;
- возможное распространение покраснения за пределами пораженной железы;
- покраснение напоминает рожистое воспаление (отсюда и термин рожистоподобной формы) – пятно с «рваными» зубчатовидными границами;
- иногда резко повышается температура тела.
Зачастую такой рак действительно ошибочно принимают за рожистый воспалительный процесс и назначают неправильное лечение с применением физиотерапии и противовоспалительных препаратов. В таких случаях теряется драгоценное время, и состояние пациента стабильно ухудшается. Поэтому очень важно правильно проводить дифференциальную диагностику заболевания.
Второе название рожистоподобного рака – воспалительная форма рака молочной железы. Это достаточно редкий вид раковой опухоли, доля которого составляет не более 3% от всех злокачественных заболеваний молочных желез. Обычно его обнаруживают только после проведения маммографии или ультразвукового исследования.
Что представляет собой маститоподобная форма рака молочной железы? И здесь название говорит само за себя: такая раковая опухоль обладает всеми признаками мастита, и часто ошибочно принимается за воспалительный процесс.
Клиническая картина маститоподобного рака следующая:
- пораженная молочная железа заметно увеличивается;
- при прощупывании ощущается плотность (натянутость) тканей;
- кожные покровы на месте поражения становятся выраженно красными;
- местная температура повышается;
- присоединяется инфекция, что ещё больше напоминает признаки мастита.
Общая температура тела также повышается: налицо все признаки воспалительного процесса и интоксикации организма.
Далее отечность железы распространяется на верхнюю конечность и околоключичную зону. При отсутствии адекватной терапии могут появляться изъязвления на коже.
Если через 2 недели после лечения обычного мастита не наблюдается положительной динамики, то можно заподозрить маститоподобный рак: для дифференциации рекомендуется провести дополнительные методы диагностики, такие как рентген, УЗИ, гистологическое исследование.
Диффузная форма рака может включать в себя как отечную форму, так и воспалительную рожистоподобную и маститоподобную формы. Сущность заболевания определена в его названии – от латинского «diffusum, diffundo» (распределенный, расплывчатый, не имеющий четких границ). Такая опухоль прорастает в виде разлитого инфильтрата, который поражает железистый орган по всем направлениям – то есть, не имеет четкой направленности процесса.
Уплотненный или эластично-плотный инфильтрат зачастую охватывает несколько секторов, либо значительную часть грудной железы. Вследствие возникновения механического препятствия в виде опухоли нарушается естественный отток лимфы, что приводит к увеличению и значительной деформации органа. В близлежащих зонах скопления лимфоузлов наблюдается распространение метастазов.
Диффузная форма протекает остро, с быстрым метастазированием.
Как вы уже убедились, различные формы рака молочной железы могут иметь разные клинические проявления. При этом течение заболевания во многом зависит от гормонального фона в организме. Например, в молодом возрасте, и особенно во время беременности и грудного кормления рак развивается быстро, со скорым метастазированием. А в пожилом возрасте опухоль способна существовать на протяжении нескольких лет, не распространяясь в другие органы.

источник
Рак молочной железы — самая распространенная злокачественная опухоль у женщин. Заболеваемость и смертность от рака молочной железы за последние десятилетия продолжают возрастать. В мире ежегодно регистрируется более 1 миллиона случаев рака молочной железы. В России наиболее высокая заболеваемость отмечена в Москве, Санкт-Петербурге, в Северо-Западном регионе страны.
Возникновение рака молочной железы связывают с нарушением функции органов, продуцирующих и участвующих в метаболизме гормонов — яичников, надпочечников, щитовидной железы, гипофиза, гипоталамической системы.
Установлена высокая заболеваемость раком молочной железы в регионах, где женщины рожают редко, имеют поздние роды, делают много абортов, рано прерывают лактацию. Поздние первые роды приводят к резкому повышению уровня эстрадиола, что может стимулировать развитие рака. Считается, что при ранней первой беременности резко увеличивается уровень эстриола, тормозящий канцерогенное действие эстрадиола и эстрона. При лактации женщина также защищена от высокой эстрогенной активности этого периода. К факторам, влияющим на возникновение рака молочных желез, относят дисгормональные расстройства функции яичников на фоне острых и хронических воспалительных заболеваний. Значительно повышается риск заболевания при наличии рака молочной железы у кровных родственников. Имеют значение экзогенные факторы, под действием которых протоонкогены в нормальных клетках превращаются в активные онкогены. К таким факторам относят ионизирующую радиацию, химические канцерогены.
К предраковым заболеваниям относят мастопатию или дисплазию, в основе которых лежат нарушения гормонального статуса. Рак молочной железы, по данным гистологического исследования операционного материала, почти у половины пациенток сочетается с фиброаденоматозом.
Клиника рака молочной железы чаще всего заключается в появлении уплотнения в молочной железе. Отек железы или верхней конечности относятся к поздним симптомам, свидетельствующим о значительном местном или регионарном распространении процесса. Около 85% злокачественных опухолей молочной железы обнаруживаются самими заболевшими, 10% РМЖ выявляются при профилактических осмотрах, 5% — при профилактических маммографических исследованиях.
Молочная железа делится на следующие анатомические части:
3) верхневнутренний квадрант;
4) нижневнутренний квадрант;
5) верхненаружный квадрант;
Путями оттока лимфы от молочной железы являются подмышечный, подключичный, парастернальный, межреберный, позадигрудинный, перекрестный, а также путь Героты. Главное значение имеет подмышечный путь (до 97% лимфы оттекает от молочной железы по подмышечным лимфатическим коллекторам); дополнительную роль играют подключичный, парастернальный и другие пути оттока. Опухоли наружных локализаций дают регионарные метастазы преимущественно в подмышечные и подключичные лимфоузлы. При центральном и внутреннем расположении повышается частота метастазов в парастернальные лимфоузлы. Новообразования, расположенные в нижних отделах молочной железы, часто метастазируют в печень. Отдаленные метастазы РМЖ могут возникать в любых тканях и органах, но чаще всего поражают кости, легкие и печень.
Регионарные лимфатические узлы.
1. Подмышечные (на стороне поражения) интерпекторальные (лимфатические узлы Роттера) и лимфатические узлы, располагающиеся вдоль аксил-лярной вены и ее притоков, подразделяются на следующие уровни:
1) уровень I (нижние подмышечные): лимфатические узлы, расположенные латерально по отношению к боковой границе малой грудной мышцы;
2) уровень II (средние подмышечные): лимфатические узлы, расположенные между медиальным и латеральным краем малой грудной мышцы, и ин-трапекторальные (лимфатические узлы Роттера);
3) уровень III (апикальные подмышечные): лимфатические узлы, расположенные медиально по отношению к медиальному краю малой грудной мышцы, исключая подключичные.
Интрамаммарные лимфатические узлы кодируются как аксиллярные (подмышечные).
2. Подключичные на стороне поражения.
3. Внутренние лимфатические узлы молочной железы (на стороне пора-ения) располагающиеся в эндоторакальной фасции и межреберных про-ранствах вдоль края грудины.
4. Надключичные на стороне поражения.
Любые другие лимфатические узлы, пораженные метастазами, включая ейные или контралатеральные внутренние лимфатические узлы молочной елезы, обозначают как отдаленные метастазы Ml.
ВОЗ в 2003 году была принята Международная гистологическая класси-икация опухолей молочной железы. В классификацию включены эпители-иьные опухоли молочной железы, миоэпителиальные нарушения, мезенхи-альные и фиброэпителиальные опухоли, опухоли соска, злокачественные имфомы молочной железы, метастатические опухоли, опухоли мужской зуд ной железы.
Эпителиальные опухоли, в свою очередь, подразделяются на инфильтри-ующие раки, предраковые изменения, включающие дольковые и протоко-ые неоплазии, внутри-протоковые папиллярные нарушения и доброкачест-енные эпителиальные пролифератив-ные нарушения. Инфильтрирующий ротоковый рак молочной железы является наиболее распространенной юрмой, встречается в 80% случаев всех инфильтрирующих раков молоч-юй железы. Имеются различные системы градации степени злокачествен-юсти опухолей.
Кроме гистологического варианта строения, для оценки прогноза те-ения заболевания и чувствительности к гормональному лечению опре-;еляют уровень рецепторов стероидных гормонов (эстрогенов, прогес-еронов и др.), через которые происходит действие гормонов на клетки щухоли.
По типу роста различают узловую и диффузную формы рака молочной келезы. Диффузная форма отличается быстрым ростом и плохим прогно-юм. Диффузная форма подразделяется на диффузно-инфильтративную, >течную, отечно-инфильтративную, панцирную, инфламматорную (ро-кеподобный и маститоподобный рак). На прогноз влияют скорость роста эпухоли, локализация в молочной железе, степень дифференцировки, ста-шя, число пораженных лимфатических узлов. Наличие метастазов в лимфатических узлах надключичной области является признаком генерализации процесса.
Патогенетическая классификация выделяет следующие четыре основные формы рака молочной железы [Семиглазов В. Ф., 1979].
1. Тиреоидная — встречается у женщин в возрасте до 35 лет с патологией щитовидной железы, чаще с гипотиреозом, ожирением, поздним наступлением менструаций. Эта форма гормонорезистентного рака наблюдается у 4—5 % больных.
2. Яичниковая — встречается у женщин 30—50 лет с повышенной эстро-генизацией, ранним началом менструального цикла, нарушением функции яичников с воспалительными и гиперпластическими процессами, мастопатией, наличием в анамнезе рака молочной железы у кровных родственников. Эта форма болезни отличается неблагоприятным течением, встречается у 40—45 % больных.
3. Надпочечниковая, или гипертензионно-надпочечниковая — выявляется у женщин 50—60 лет с типичными симптомами нарушения стероидной функции надпочечников, с наличием гипертонической болезни, атеросклероза, сахарного диабета, поздним наступлением менопаузы. Встречается у 35—40 % больных. Прогноз такой формы относится к неблагоприятным, чувствительность к гормонотерапии улучшает результаты.
4. Инволютивная — диагностируется у женщин старше 60 лет, находящихся в глубокой менопаузе, с поздними первыми и последними родами. В семейном анамнезе встречаются опухоли женских половых органов и толстой кишки. Такая форма болезни наблюдается у 6—8 % больных, обладает относительно благоприятным течением.
TNM Клиническая классификация Т — Первичная опухоль
Тх — Недостаточно данных для оценки первичной опухоли
ТО — Первичная опухоль не определяется
Tis — Преинвазивная карцинома (Carcinoma in situ)
Tis (DCIS) — Интрадуктальная карцинома in situ
Tis (LCIS) — Лобулярная карцинома in situ
Tis (Paget) — Болезнь Педжета соска без наличия опухолевого узла Примечание. Болезнь Педжета, при которой пальпируется опухолевой узел, классифицируется по его размерам.
Т1 — Опухоль до 2 см в наибольшем измерении Tl mic (микроинвазия) — До 0,1 см в наибольшем измерении Пр и мечание. Микроинвазия — распространение опухолевых клеток через базальную мембрану в прилегающие ткани фокусом не более 0,1 см в наибольшем измерении. При наличии множественных фокусов классификацию проводят по наибольшему измерению. Нельзя использовать сумму фокусов. Наличие множественных фокусов должно быть отмечено так же, как это делается при множественных инвазивных карциномах.
Т1А — До 0,5 см в наибольшем измерении
Т1В — До 1 см в наибольшем измерении
Т1С — До 2 см в наибольшем измерении
Т2 — Опухоль до 5 см в наибольшем измерении
ТЗ — Опухоль более 5 см в наибольшем измерении
Т4 — Опухоль любого размера с прямым распространением на грудную стенку или кожу так, как описано в Т4А—T4D
Примечание. Грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу, но без грудных мышц.
Т4А — Распространение на грудную стенку
Т4В — Отек (включая «лимонную корочку») или изъязвление кожи молочной железы, или сателлиты в коже железы Т4С — Признаки, перечисленные в 4А и Т4В
T4D — Воспалительная форма рака
Примечание. Воспал ител ьная форма рака молоч ной железы характеризуется диффуз-м утолщением кожи с плотными краями обычно без подлежащей пальпируемой массы, ни биопсия кожи отрицательна и нет локализованной опухолевой массы, при патологи-:кой классификации употребляется категория рТХ, а при клинической — T4D. При оцен-категории рТ определяется инвазивный компонент. Втяжение кожи, ретракция соска и другие кожные изменения, за исключением относящихся к Т4В и T4D, могут оцени-гься как Tl, Т2 и ТЗ, не влияя на классификацию.
N — Регионарные лимфатические узлы
NX — Недостаточно данных для оценки состояния регионарных л имфа-;ческих узлов
N0 — Нет признаков поражения метастазами регионарных лимфатичес-IX узлов
N1 — Метастазы в смещаемых (ом) подмышечных (ом) лимфатических м) узлах (е) на стороне поражения
N2 — Метастазы в подмышечныхлимфатическихузлах, фиксированные >угс другом, или клинически определяемые метастазы во внутреннихлим-атических узлах молочной железы на стороне поражения при отсутствии тинически определяемых метастазов в подмышечных лимфатических уз-IX на стороне поражения
N2A — Метастазы в подмышечных лимфатических узлах, фиксирован-ых друг к другу или к другим структурам
N2B — Метастазы, определяемые только клинически, во внутренних эмфатических узлах при отсутствии клинически определяемых метаста-)в в подмышечных лимфатических узлах
N3 — Метастазы в подключичных лимфатических узлах с/без метастазе в подмышечных лимфатических узлах, или клинически определяемые етастазы во внутренних лимфатических узлах молочной железы на сторо-е поражения при наличии метастазов в подмышечных лимфатических узах, или метастазы в надключичных лимфатических узлах на стороне по-ажения с/без метастазов в подмышечных или внутреннихлимфатических злах молочной железы
N3A — Метастазы в подключичных лимфатических узлах
N3B — Метастазы во внутренних лимфатических узлах молочной железы а стороне поражения
N3C — Метастазы в надключичных лимфатических узлах
Примечание. «Клинически определяемые» означает выявление метастазов в лимфатических узлах при физикальном осмотре или методах визуализации (исключая сцин-играфию).
MX — Недостаточно данных для определения отдаленных метастазов МО — Нет признаков отдаленных метастазов Ml — Имеются отдаленные метастазы
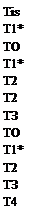
Стадия О Стадия I Стадия ПА
| Стадия Стадия Стадия |
| IIIB IIIC IV |
N0 N0 N1 N1 N0 N1 N0 N2 N2 N2
МО МО МО МО МО МО МО МО МО МО МО МО МО Ml
Примечание. *Т1 включаетTlmic.
При раке молочной железы используют весь арсенал современной онкологии: хирургическое лечение, лучевую терапию, химио-, гормоно- и иммунотерапию, а также различные сочетания этих методов. Все лечебные мероприятия, используемые при раке молочной железы, разделяются на мес-тно-регионарные (операция, лучевая терапия) и системные воздействия (химиотерапия, гормонотерапия, иммунотерапия).
Объем оперативного вмешательства различен. Существуют варианты операций — от наиболее типичной и общепринятой радикальной мастэкто-мии по Холстеду (одномоментное удаление единым блоком всей молочной железы с большой и малой грудными мышцами, подмышечной, подключичной и подлопаточной клетчаткой в пределах анатомических футляров) до радикальной секторальной резекции, относящейся к органосохраняю-щим операциям.
Хирургический метод в качестве самостоятельного может радикально излечивать больных только при начальных формах неинвазивной карциномы insitul (TINOMO)h IIA(T2N0M0) стадий. При выполнении радикальной резекции после тщательного изучения гистологического материала устанавливают показания к послеоперационной лучевой терапии. Облучение оставшейся части молочной железы проводят при обнаружении неблагоприятных прогностических факторов: наличие долькового или внутрипротокового рака в первичной опухоли, очаги рака in situ в окружающих тканях и дисп-лазия эпителия III степени.
В ГУ РОНЦ имени Н. Н. Блохина РАМН при органосохраняющем лечении узлового РМЖ используют сочетание фотонного и протонного облучения. Облучению подвергали молочную железу, первичную опухоль, регионарные зоны; гипофиз облучали узкими пучками протонов как альтернативу хирургическому вмешательству с целью сохранения органа, а также у женщин, отказывающихся от операции или имеющих противопоказания к ней.
Лучевая терапия при лечении больных раком молочной железы, приме-шется в виде пред- или послеоперационного облучения, а также самостоя-ельно (см. рис. 38 на цв. вклейке). Предоперационное облучение преследует несколько целей: уменьшить объем опухоли, перевести ее в операбельную [юрму, уничтожить пролиферирующие клетки опухоли и снизить вероятность диссеминации опухолевых клеток во время операции.
Предоперационная лучевая терапия рекомендуется во всех операбельных лучаях, кроме начальных стадий Т1—T2N0M0 с размерами опухоли не бо-iee 3 см. Показаниями к предоперационному облучению являются:
— размеры опухоли более Зсм в диаметре;
— наличие явных регионарных метастазов;
— фиксация опухоли к коже или грудной клетке;
В тех случаях, когда предоперационное облучение планировалось с целью геревода опухоли в разряд резектабельных, но после окончания облучения итерация все же оказывалась невыполнимой, лучевая терапия становится амостоятельным методом с доведением доз до уровня радикальных. В дальнейшем лечение дополняют химиотерапевтическим и/или гормональным юздействием.
При предоперационном облучении одновременному лучевому воздейс-вию подвергаются молочная железа и зоны регионарного метастазирова-
1ия. Облучение проводят на источниках высоких энергий. Используют ста-ические и подвижные методики, поля сложной конфигурации, свинцовые
шоки и т. п. Суммарные очаговые дозы составляют 40—50 Гр, подведенные а 4—5 нед. Существуют различные варианты предоперационного дистан-
шонного облучения с подведением суммарных доз, эквивалентных 40—50
«р, подведенных методом классического фракционирования.
1. При локализации опухоли в наружных квадрантах проводят концент-шрованное облучение, при котором на молочную железу ежедневно в тече-ше 5—6 дней подводят по 5 Гр, а на зоны регионарного метастазирования подмышечно-подключичную область) — по 4 Гр. Через 1—3 дня осущест-шяют операцию. Надключичную и парастернальную зоны облучают через 0—14 дней после операции, подводя на каждую область методом классического фракционирования 44—46 Гр.
2. Вариантом концентрированного предоперационного воздействия яв-[яется однократное облучение молочной железы и подмышечно-подклю-[ичной области в дозе 10 Гр. Операцию в этом случае также выполняется [ерез 1—3 дня.
3. При явных регионарных метастазах, центрально-медиальных локали-(ациях опухолей, размерах новообразований более Зсм все зоны облучают щновременно разовыми дозами 1,8—2,0 Грдо суммарной дозы на молочную келезу 45—50 Гр, подмышечно-подключичные области — 35—40 Гр, надклю-шчные — 45 Гр, парастернальные — 45 Гр. На явно выраженные регионар-ше метастазы дозу доводят до 55—60 Гр. Операцию в этих случаях производят через 3—4 нед после окончания облучения, обычно к этому времени выраженные лучевые реакции стихают.
4. В схемах предоперационного лечения используют также локальную гипертермию в сочетании с облучением, а также регионарную химиотерапию через катетер, установленный во внутреннюю грудную артерию. Эти воздействия сочетают с облучением, как правило, концентрированным, и используют у больных с инфильтративно-отечными опухолями, новообразованиями больших размеров и т. п.
Послеоперационное облучение выполняют у больных, лечение которых было начато с операции, несмотря на большие размеры опухоли, неблагоприятную локализацию, наличие регионарных метастазов. Такое облучение начинают на 12—14-й день после операции, в зону лучевого воздействия включают область операционного рубца и зоны регионарного метастазирования. Дозы от послеоперационного облучения при обычном фракционировании доводят на область рубца до 50—60 Гр, на регионарные области — до 45—50 Гр. Для послеоперационного лучевого воздействия на парастернальные зоны применяют также методы контактного облучения, реализуемые на аппарате типа Microselectron. Внутреннюю грудную артерию используют в качестве естественного проводника для гибкого интрастата. Создается четко отграниченное дозное поле для облучения цепочки парастернальных лимфатических узлов.
Послеоперационное облучение широко используют при проведении ор-ганосохраняющих операций у больных с ограниченными опухолями. В этих случаях применяют также гормональное и химиотерапевтическое воздействие. При правильно определенных показаниях и адекватном лечении стойкое излечение отмечается более чем у 90% этих больных.
Таким образом, лучевую терапию применяют:
1) при I (T1N0M0)h IIA(T2N0M0) стадиях рака — послеоперационное облучение при выявлении факторов риска рецидива;
2) при ПВ (Т1—2N1M0) и IIIA (T3N0M0) стадиях рака — предоперационное облучение укрупненными фракциями и послеоперационное облучение зон регионарного лимфооттока методом классического фракционирования;
3) При IIIB стадии рака (T3N1M0; Т1— 3N2M0) в плане комплексного лечения с применением химиогормональной терапии хирургического вмешательства;
4) при IIIB стадии рака (T4N2M0) у больных с инфильтративно-отеч-ной формой облучение молочной железы и зон регионарного лимфооттока проводят после массивных общих воздействий — гормонотерапии, медикаментозной и двусторонней овариэктомии и химиотерапии. В случае эффективности всего комплекса терапии проводят мастэктомию по Холстеду и повторные курсы полихимиотерапии.
Паллиативную лучевую терапию при рецидивах опухоли или при наличии отдаленных метастазов проводят на выявленные очаги до дозы 40—45 Гр.
Симптоматическое облучение часто используют для достижения быстрого анальгезирующего эффекта при костных метастазах РМЖ. При этом обычно применяют разовые дозы 4—7 Гр, а суммарные — 20—25 Гр.
ри лечении больных РМЖс метастазами в кости скелетаприменя ют дистан-шую локальную лучевуютерапию, а также внутритканевую терапию препа-ми, содержащими радионуклид стронция. При генерализованных формах Кс множественными костными метастазами в качестве паллиативного ле-1Я используют гипофизэктомию, которая может осуществляться в том чис-/чевым методом. Целесообразно проводить протонную гипофизэктомию. ювременные методы лечения позволяют получить показатели 5-летней :иваемости при I стадии рака у 96%, ПА — у 80%, ША— у 87%, IIIB — % больных.
7.6. РАК ГРУДНОЙ ЖЕЛЕЗЫ У МУЖЧИН
встречается в 100 раз реже, чем у женщин, обычно поражает мужчин зрасте старше 60 лет. В структуре онкологической заболеваемости час-1 рака грудной железы у мужчин составляет 0,1—0,3 на 100 000. Диагноз [чно бывает поздним, так как ни больной, ни врач долго не подозревают гличии злокачественной опухоли.
Факторами, способствующими развитию рака грудной железы, могут ъ изменения метаболизма половых гормонов при заболеваниях печени эчек, длительное введение экзогенных гормонов при заболеваниях пред-гельной железы, гормонпродуцирующие опухоли яичек, надпочечников, юфиза, некоторые генетические заболевания (истинный гермафроди-м, синдром Клайнфельтера), травмы и др.
Наиболее частыми гистологическими формами являются папиллярный : и слизистая карцинома. Метастазы рака грудной железы в регионарных, вным образом подмышечных, лимфатических узлах к моменту обраще-1 к врачу обнаруживаются более чем в половине случаев. Предоперационное облучение используют почти у всех больных, что свя-ю с опухолевым поражением подмышечных узлов и высокой частотой енных форм. Лечение может включать химиотерапию и гормональные [действия, втом числе не только лекарственные, но и гонад-, адренал-ипофизэктомию. Прогноз значительно хуже, чем у женщин, что во мно-\ связано с запущенностью заболевания.
Рак щитовидной железы составляет 1—3 % от всех злокачественных опухо-\ человека. Вместе с тем рак щитовидной железы — самая распространен-я опухоль органов эндокринной системы. Пик заболеваемости приходится
возраст от 40 до 60 лет, женщины болеют в 3—4 раза чаще мужчин.
В последние годы происходит неуклонный рост частоты рака щитовид-й железы, что связывают с влиянием неблагоприятных экологических 1Кторов, прежде всего радиационного. Частота рака щитовидной желе-
возросла у детей и лиц молодого возраста после взрыва атомной бомбы в Японии и после катастрофы в Чернобыле. Рак щитовидной железы нередко развивается на фоне длительно существующего, обычно узловатого зоба, однако возможно возникновение его и в неизмененной железе, редко — на фоне диффузного токсического зоба. Часто определяется многофокусное поражение щитовидной железы. Одна из форм рака щитовидной железы — медуллярный рак — часто сочетается с поражением надпочечников и околощитовидных желез, то есть развивается синдром Сипла — синдром множественной эндокринной неоплазии.
Начальный период развития опухолей щитовидной железы обычно протекает без симптомов. По мере увеличения размеров опухоли она становится доступной пальпации, а позднее — заметной на глаз. Клинические симптомы (уплотнение ткани железы, увеличение регионарных лимфатических узлов, охриплость голоса или появление триады Горнера вследствие поражения возвратного нерва и симпатического ствола опухолью или метастазами, боли, затруднение дыхания) обычно проявляются при достаточно распространенных новообразованиях. Повышенная выработка кальцитонина сопровождается поносом, болями в костях, остеопорозом.
Клиническое течение и прогноз болезни зависят главным образом от морфологической структуры опухоли. Существует четыре наиболее распространенных гистологических типа:
• папиллярная карцинома (включая фолликулярные фокусы);
• фолликулярная карцинома (включая так называемую Hurthle клеточную карциному);
• недифференцированная (анапластическая) карцинома. Папиллярный рак встречается чаще всего (в 60—75 % случаев), особенно
у молодыхлюдей, и отличается относительно медленным прогрессировани-ем и благоприятным прогнозом. Фолликулярный рак (10—15 %) наблюдается чаще у лиц старше 40 лет. В большинстве случаев выявляются папиллярно-фолликулярные формы. Медуллярный рак, возникающий из парафол-ликулярных клеток (8—10% всех злокачественных опухолей щитовидной железы), встречается во всех возрастных группах и отличается умеренной степенью злокачественности. Эта опухоль гормонально-активна, продуцирует кальцитонин. Недифференцированные, или анапластические, формы (5—12 %) чаще регистрируются у пожилых людей и относятся к наиболее злокачественным опухолям человека. Весьма злокачественно протекает и такая редкая форма опухоли, как плоскоклеточный рак. Неэпителиальные, смешанные, вторичные и неклассифицированные опухоли встречаются редко и составляют не более 3—6% всех новообразований щитовидной железы.
TNM Клиническая классификация Т — Первичная опухоль
ТХ — Недостаточно данных для оценки первичной опухоли ТО — Первичная опухоль не определяется
Т1 — Опухоль до 2см в наибольшем измерении, ограниченная тканью щитовидной железы
Дата добавления: 2016-09-26 ; просмотров: 1532 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник