Санкт-Петербург, 14 февраля. Противоопухолевая вакцина петербургского НИИ онкологии им. Петрова продлевает жизнь больным даже с агрессивными формами рака.
Пациенты с саркомой живут по восемь-десять лет, что само по себе фантастика, поскольку при таком диагнозе смертность обычно равна заболеваемости, и «сгорают» пациенты очень быстро. Но теперь на создание таких вакцин денег у государства нет.
Как рассказали в НИИ онкологии, над противоопухолевыми вакцинами они работают почти двадцать лет. За эти годы в Центре клеточных технологий НИИ были созданы 15 вакцин, из которых сегодня из-за недофинансирования применяются только две. Отметим, что НИИ онкологии специализируется на клеточной иммунотерапии меланомы, саркомы мягких тканей, рака толстого кишечника, рака почки, мочевого пузыря, молочной железы и легких. Как рассказала руководитель научного отдела онкоиммунологии и Центра клеточных технологий, доктор медицинских наук Ирина Балдуева, специалисты центра создают противопухолевые вакцины индивидуально под каждого пациента.
«Такие препараты изготавливаются специалистами нашего центра на базе собственных клеток пациента. В медицине их называют дендритными, они способны активировать иммунную систему больного, научить ее уничтожать опухоль», — рассказала И. Балдуева.
Лечение такой вакциной проводится курсами, периодичность которых устанавливает врач. Назначается иммунотерапия в тех случаях, когда возможности стандартного лечения исчерпаны.
Сегодня специалисты НИИ, пролечившие индивидуальными вакцинами более тысячи человек, могут с уверенность заявить о реальной возможности продления жизни пациентам даже с таким страшным диагнозом как саркома мягких тканей. После проведения терапии противоопухолевой вакциной последнего поколения больные с третьей-четвертой стадиями рака живут до десяти лет.
Достаточно показателен такой пример. В 2009 году в НИИ онкологии поступил мужчина 53-х лет с диагнозом хондросаркома правой голени, метастазы были обнаружены в легких и ребрах. Пациенту были проведены четыре операции, в том числе ампутация правой ноги и изолированная метастазэктомия и химиоперфузия легкого. Несмотря на активное стандартное лечение, заболевание прогрессировало и достигло IV стадии. Казалось бы, человек обречен.
Но с ноября 2011 года врачи клиники начали терапию пациента дендритно-клеточными вакцинами. После 41 введения болезнь перестала прогрессировать и сегодня не угрожает жизни пациента.
Владимир Игоревич (так зовут пациента) — инженер-механик. В настоящее время он не работает (инвалид первой группы), но самостоятельно ходит (на протезе) и ездит на автомобиле с ручным управлением.
Жительнице Ленинградской области Татьяне Константиновне поставили страшный диагноз в 48 лет. Летом 2011 года у нее обнаружили меланому кожи спины, а метастазы дошли аж до мягких тканей шеи. Женщине провели три операции, в том числе по удалению надключичных лимфоузлов. Но, несмотря на хирургические вмешательства, заболевание прогрессировало до III стадии. В 2011-2012 годах ей сделали 12 инъекций аутологичной дендритно-клеточной вакциной в сочетании с циклофосфамидом. В результате заболевание перестало прогрессировать, состояние стабилизировалось.
Сейчас Татьяна — домохозяйка, она активно занимается изготовлением различных хэнд-мейд вещей: предметов интерьера, мебели, игрушек в различных техниках, а также флористикой.
«Диагноз заставил меня заняться тем, до чего у меня давно не доходили руки», — замечает она.
Несмотря на десятки таких счастливых историй, медики утверждают, вакцина — это не панацея и не может помочь уже умирающим пациентам, ее эффективность около 40%. Для того, чтобы препарат включился в работу, необходимо время (3-4 месяца) и жизненные силы. Хотя в НИИ признаются – помогает вакцина не всем, ее эффективность около 40%.
Противоопухолевая вакцина – это огромное достижение отечественной медицины. Такие разработки всегда поддерживались государством. Но теперь денег на это нет. Сейчас этот вид лечения не подпадает под программу ВМП (высокотехнологичной помощи). Пациенты оплачивают лечение дендритными клетками из собственных средств. Бесплатно аутологичные дендритно-клеточные вакцины получают только дети.
Ученые ищут гранты и меценатов, а больные оплачивают лечение из собственного кармана. Стоимость одного введения препарата достигает 50 тыс. руб., годовой курс, включающий диагностические обследования между вакцинациями, обходится в полмиллиона. Правда, в США курс введения клеточной вакцины стоит 93 тыс. долл. (более 6 млн. руб.), но россиянам от этого не легче.
источник
Доктор медицинских наук Балдуева Ирина Александровна является основателем метода онкоиммунологии (дендритной вакцины) в РФ. Разработка и введение в клиническую практику медикаментов, стимулирующих защитную способность организма для противодействия злокачественному процессу, позволило онкоиммунологии стать одним из наиболее перспективных методов развития в области терапии онкологических заболеваний, несмотря на то, что раньше в ней сомневались даже доктора. Деятельность Балдуевой Ирины Александровны направлена на иммунотерапию меланомы, саркомы, молочной железы, легких и печени.
Иммунная защита организма действует в постоянном режиме, защищая от определённых чужеродных элементов – будь то вирус или собственные клетки тела, подвергшиеся мутации и превратившиеся в злокачественные клетки опухоли. Однако запущенный процесс онкологии, а также влияние химио-лучевой терапии приводит к тому, что иммунитет пациента существенно ослабевает, нарушаются звенья иммунной системы. Все это препятствует организму противостоять развитию опухолевого процесса.
В клинике проводится несколько тестирований противоопухолевых вакцин, созданных командой специалистов, управление и контроль за тестированием которых осуществляет Ирина Балдуева. При первом обращении пациента в онкоцентр рекомендуется проведение консультации у онкоиммунолога. Помимо этого, следует сдать определенный перечень анализов, среди которых: кровь на биохимию: печеночные пробы, ГГТ, билирубин, креатинин, расширенный иммунный статус.
Количество лимфоцитов в крови у человека играет большую роль, поскольку оно оказывает влияние на быстроту реакции организма, а также на последующую борьбу с патологией. Большее значение имеет именно численность зрелых лимфоцитов, поскольку они, в первую очередь, приступают к борьбе.
Для выяснения необходимости иммунотерапии следует пройти очную консультацию. Прием Ирина Александровна Балдуева проводит только по предварительной записи и при наличии необходимых анализов.
Основным направлением деятельности И.А. Балдуевой является изучение иммуногенности недоброкачественных опухолей и их метастазов. Для определения того, насколько эффективным может оказаться влияние иммунной системы на злокачественный процесс, и подготовки наиболее подходящей вакцины, эксперты внимательно исследуют опухолевые клетки пациента.
Размельчив полученный биологический материал при помощи специальной машины, специалисты стараются максимально подробно дать характеристику опухоли, выявив все свойства её поведения, а также факторы, которые она продуцирует. Процесс воссоздания клеток иммунной системы, способен возвратить к жизни уже ни на что не реагирующую иммунную систему.
Противораковая вакцина разрабатывается в индивидуальном порядке, за основу берутся собственные клетки крови пациента. Далее клетки вводятся в подкожно или в опухолевые ткани. Задача – восстановить работу иммунной системы, клетки которой (Т- лимфоциты), распознав врага, мгновенно приступят к уничтожению. Доктор, в свою очередь, будет наблюдать за развитием противоопухолевого иммунного ответа в организме пациента.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
источник
Онкоиммунология является достаточно новым и перспективным направлением в лечении рака. В клинике онкоиммунологии в НМИЦ им. Н.Н. Петрова в рамках этого направления успешно применяется инновационная методика – вакцинотерапия дендритными клетками. Вот уже полтора десятка лет она показывает хорошие результаты лечения при таких видах онкологических заболеваний, как кожная меланома, саркома мягких тканей, рак кишечника, а также рак почки. С 2010 года коллективом специалистов научного отдела онкоиммунологии проведено более 1580-и лечебных циклов для 203-х больных. Результаты впечатляют. Поэтому именно сейчас пришло время для определения путей более широкого использования методики и расширения спектра заболеваний, в борьбе с которыми она может применяться.
Иммунотерапия как новый подход в лечении онкологических заболеваний, была создана в Санкт-Петербурге, в НМИЦ им. онкологии Н.Н. Петрова, где в 1998-м году начала работу лаборатория онкоиммунологии. Именно на базе этой лаборатории удалось установить, что собственные иммунные клетки пациента можно «обучить» распознавать опухолевый процесс в организме.
Многие опухоли сложны в лечении именно потому, что они способны маскироваться от иммунных клеток, а порой и инактивировать их. Поэтому стандартные методы лечения рака, применяемые в клиниках: хирургия, химиотерапия, лучевая терапия, гормональная терапия – остаются без поддержки со стороны иммунной системы пациента. Однако в лаборатории онкоиммунологии был найден способ «перезапустить» иммунитет пациента, предварительно настроив его на конкретную опухоль. Для этого используются дендритные клетки из костного мозга (они всегда присутствуют в крови наряду с лейкоцитами, лимфоцитами и прочими клетками), задача которых предъявить основным защитным клеткам организма – Т-лимфоцитам – белковые молекулы, характерные для опухоли (антигены).
Процесс проходит в специальном сосуде, куда помещается подготовленная кровь, ранее взятая у пациента, а также «обломки» опухоли, выделенной из его же организма, либо антигены похожей опухоли, имеющиеся в банке НМИЦ. Дендритные клетки оседают на стенках сосуда и начинают активно поглощать (фагоцитировать) опухолевые частицы, формируя на своей поверхности специфический «обучающий сигнал». С последующим введением содержащей такие дендритные клетки суспензии в организм, Т-лимфоциты получают возможность «узнать» опухоль и начать атаковать её.
Патент на онкоиммунологический способ лечения «Иммунотерапия костно-мозговыми дендритными клетками больных солидными опухолями» зарегистрирован НИИ им. Н.Н. Петрова в 2003 г. В 2008 г. запатентована вакцина на основе дендритных клеток. В 2010 г. получено разрешение Минздрава РФ на применение этой медицинской технологии в клинической деятельности. На сегодняшний день, лечение индивидуальными противоопухолевыми вакцинами доступно только для детей; для взрослых лечение платное.
Лечение индивидуальной противоопухолевой вакциной на основе дендритных клеток пациента в клинике онкоиммунологии в Санкт-Петербурге может быть назначено пациентам, соответствующим определенным критериям включения и исключения, как взрослым, так и детям.
Хотим предупредить Вас, что, к сожалению, вакцинотерапия это не панацея. Она применяется при сОлидных опухолях (опухолях органов), в комплексе с другими методами лечения. Эффективность вакцин — стойкая ремиссия, зафиксирована у 46% пациентов, которые получали этот вид терапии.
Для того, чтобы определить возможность прохождения вакцинотерапии необходимо:
- Записаться на первичный бесплатный прием онколога НИИ онкологии им. Н.Н. Петрова.
- Врач соберет анамнез, уточнит, какие обследования необходимо сделать. Даст направление на иммунологическое и иные исследования, с результатами которых нужно записаться на прием онкоиммунолога НИИ.
В зависимости от заболевания врач первичного приема может отменить то или иное исследование из п. 1-3 стандартного списка, а также уточнить параметры исследования 4. Стандартный список см. ниже.
Обследования, результаты которых необходимо иметь на руках во время первичного приема онкоиммунолога (должны быть выполнены в течение последних 30 дней):
- МРТ головного мозга, брюшной полости и малого таза с контрастированием
Стоимость: 14000 руб. Примечание: при условии того, что делается МРТ 3-х зон одновременно и производится одно введение контрастного вещества. - КТ органов грудной клетки с контрастированием
Стоимость: 6 000 руб. - Остеосцинтиграфия
Стоимость: 5 900 руб. - Биохимический анализ крови: АлТ, АсТ, ГГТ, билирубин общий, ЛДГ, общий кальций, мочевина, мочевая кислота, креатинин, общий белок, глюкоза, железо, СРБ, ЛДГ.
Стоимость: 3380 руб. + 200 руб. забор крови. Срок выполнения: 1-2 рабочих дня. - Расширенный иммунный статус 9 параметров
Стоимость: 5100 руб. Срок выполнения: 5-14 рабочих дней. Материал: кровь.
+ 200 руб. забор крови - Клинический анализ крови развернутый (с подсчетом лейкоцитарной формулы, подсчетом тромбоцитов, описанием морфологии клеток)
Стоимость: 700 руб. + 200 руб. забор крови. Срок выполнения: 1-2 рабочих дня.
+ 200 руб. забор крови - Во время приема онкоиммунолог, как правило, назначает пациенту молекулярно-генетическое исследование. Его стоимость варьируется от 2800 до 8700 руб. (в зависимости от диагноза и показателей, которые надо проанализировать).
Срок выполнения от 14 до 30 рабочих дней. Материал: блоки, стекла (предварительно пересмотренные в лаборатории НМИЦ онкологии им. Н.Н. Петрова).
МРТ и КТ выполняются с промежутком 1 день.
Обследования после остеосцинтиграфии проводятся через 3 дня (начиная с дня, следующего за днем проведения этого обследования).
Рекомендуем Вам выполнить исследования 4 и 6 в лаборатории НМИЦ онкологии.
Внимание!! Мы ждем Вас на консультации в клинике онкоиммунологии со всеми имеющимися медицинскими документами и их ксерокопиями: эпикризами, результатами обследований и анализов за прошедшие периоды (чтобы врач мог проанализировать динамику) и пр. Обязательно возьмите с собой свою гистологию: блоки и стекла.
Запись на анализы и прием по телефону (812) 43-99-555 с 9 до 21 часа
источник
Здравствуйте. Нужны отзывы реальных людей, которые испытали эту вакцину на себе. Каковы результаты?
- Елена1952
- Пользователи
- 695 сообщений
- Пресс-секретарь Балашиха
- Администраторы
- 2 294 сообщений
- Город Балашиха
- Дарья11
- Пользователи
- 2 сообщений
Пресс-секретарь (01 Апрель 2018 — 14:43) писал:
- Дарья11
- Пользователи
- 2 сообщений
Елена1952 (29 Март 2018 — 17:42) писал:
- Елена1952
- Пользователи
- 695 сообщений
Дарья11 (13 Апрель 2018 — 21:37) писал:
- Ираида68
- Пользователи
- 554 сообщений
Дарья11 (13 Апрель 2018 — 21:36) писал:
- Виноградинка
- Пользователи
- 27 сообщений
- Ревмирович Москва-Курск
- Заблокированные
- 194 сообщений
- Город Москва-Курск
Пресс-секретарь (01 Апрель 2018 — 14:43) писал:
- Пресс-секретарь Балашиха
- Администраторы
- 2 294 сообщений
- Город Балашиха
- Ревмирович Москва-Курск
- Заблокированные
- 194 сообщений
- Город Москва-Курск
Кристина24 (29 Март 2018 — 14:31) писал:
Здравствуйте. Нужны отзывы реальных людей, которые испытали эту вакцину на себе. Каковы результаты?
источник
Не совсем. Универсального чудо-средства, которое могло бы избавить от любой опухоли раз и навсегда, по-видимому, не существует. Онкологи, выбирая способ лечения, создают сложные схемы, включающие и хирургические манипуляции, и лекарства. Перспективным компонентом комплексной противораковой терапии в последнее время стали вакцины на основе дендритных клеток. В чём их особенность?
Уничтожением злокачественных клеток занимается специальная разновидность Т-лимфоцитов. Для того чтобы ликвидировать раковую клетку, лимфоцит должен её как-то узнать. У опухолей есть специфичные молекулы-маркеры, по которым их можно отличить от здоровой ткани. Но лимфоциты сами не занимаются распознаванием «своих» и «чужих» — они ждут инструкций от дендритных клеток. Эти клетки получили такое название потому, что на определённом этапе развития они похожи на нейронные отростки-дендриты. Именно дендритные клетки определяют сомнительные молекулы, которые указывают на патологию, особым образом перерабатывают их в себе, после чего «выдают» Т-лимфоцитам готовый молекулярный признак. И теперь лимфоциты отправляются на охоту, выслеживая тех, у кого этот признак есть. Вообще говоря, такой признак называется антигеном: если не вдаваться в подробности, то антиген — это фрагмент биомолекулы (белка, липопротеина и т. д.), который могут распознавать иммунные клетки. Дендритные клетки и их «коллеги», выполняющие схожие функции, называются антиген-презентирующими клетками — на языке молекулярных взаимодействий они учат другие клетки иммунной системы распознавать чужеродные и опасные антигены.
Суть иммунотерапевтических методов в том, чтобы сделать иммунитет более чувствительным к раковым молекулам. Эти методы имеют огромный плюс по сравнению с обычной химиотерапией: во-первых, используется собственное иммунное оружие организма, а во-вторых, иммунотерапия действует адресно, не затрагивая здоровые ткани. Такие способы лечения называют таргетными (от англ. target — цель), и именно иммунологические таргетные подходы к лечению рака стали сейчас мировым трендом в онкологии.
Как можно иммунитет навести на злокачественную цель? Исходя из того, что мы только что рассказали про дендритные клетки, ответ очевиден — нужно как-то их активировать, заставить работать лучше, чтобы они энергичнее собирали молекулярные раковые признаки — антигены и показывали их Т-лимфоцитам. Разработкой и применением «дендритоклеточных» препаратов занимаются ведущие клиники мира. В 2013 году на конференции Американской ассоциации клинических онкологов, где традиционно сообщают о новейших технологиях в лечении злокачественных опухолей, данная технология была представлена как эффективный способ лечения саркомы мягких тканей. Работа с дендритными вакцинами ведётся и в России: о своих успехах в этой области специалисты из НИИ онкологии им. Н. Н. Петрова рассказали на II международном онкологическом форуме «Белые ночи», прошедшем в июне 2016 года в Санкт-Петербурге. Петербургские онкологи начали заниматься дендритными вакцинами ещё в 1998 году, но только сейчас накопленный клинический опыт позволяет врачам уверенно заявлять о том, что методика работает. При помощи вакцины специалистам удалось в ряде случаев остановить развитие опухоли и взять под контроль такие заболевания, как меланома кожи, саркома мягких тканей, хондросаркома, рак почки.
Вакцина в привычном её понимании представляет собой препарат убитых или сильно ослабленных микробов, который вводят здоровым людям для того, чтобы сделать их невосприимчивыми к конкретной инфекции. Вакцина из дендритных клеток работает иначе. Её используют, когда болезнь уже давно началась, а вакцинный препарат изготавливается под определённого пациента и не может быть использован для кого-то другого.
«В лабораторных условиях дендритные клетки получают из моноцитов, — рассказывает руководитель отдела онкоиммунологии и Центра клеточных технологий НИИ онкологии им. Н. Н. Петрова доктор медицинских наук Ирина Александровна Балдуева. — В присутствии определённых сигнальных белков, управляющих клеточным размножением и развитием, моноциты могут дифференцироваться либо в фагоциты, либо в дендритные клетки, отвечающие за противоопухолевый иммунитет. К настоящему времени в институте разработали 15 вакцин, но до стадии зарегистрированной технологии пока дошла только одна — та, что создана на основе костномозговых клеток».
Преимущество клеток, полученных из костного мозга, в том, что они ещё не «испорчены» окружающей средой, не успели столкнуться ни с какими патогенами. Со временем врачам стало понятно, что лучше всего вакцина действует при непосредственном введении в опухоль, но только после того, как опухоль подвергли какому-то физическому воздействию, пусть и не уничтожив её, но всё-таки изрядно разрушив.
Госпитализированному пациенту в течение пяти дней вводят белковый фактор, способствующий выходу стволовых клеток из костного мозга в периферическую кровь. После этого проводится лейкаферез — так называют процедуру извлечения лейкоцитов из крови. В ходе лейкафереза отбирают молодые мононуклеары (одноядерные иммунные клетки, к которым относятся и моноциты) для их дальнейшей дифференцировки в дендритные клетки, а то, что не пригодилось, возвращают обратно в организм. Затем в течение пяти дней выделенные клетки дозревают до дендритных и готовятся стать вакциной. Перед вакцинацией пациенту вводят фотосенсибилизатор — вещество, способное передавать энергию света другим веществам, в частности кислороду. Фотосенсибилизатор проникает во все делящиеся клетки (то есть в первую очередь в раковые), и через два часа после этого больной проходит процедуру фотодинамического облучения, в ходе которой опухолевые клетки наполняются активными формами кислорода, образующимися в ходе фотохимической реакции. В итоге в клетках опухоли начинается апоптоз — запрограммированная клеточная гибель. А ещё через четыре часа пациенту вводят около 100 миллионов дендритных клеток. Такую дозу человек получает в течение пяти дней. Дендритные клетки вводят в определённый очаг болезни, но конечная цель — запустить иммунный ответ во всём организме. «Процесс приготовления вакцины одновременно и индивидуализирован и стандартизован. Для неё используют лейкаферезный материал и ткани опухоли пациента, что делает препарат строго персонифицированным, — рассказывает профессор Балдуева. — В то же время все вакцины создаются в одних и тех же условиях. Это очень тонкий, очень ответственный, скрупулёзный ручной труд, который сопровождается небольшой автоматизацией — специальные аппараты поддерживают жизнедеятельность клеток и оценивают качество материала». Одной процедуры лейкафереза достаточно для приготовления вакцины на шесть циклов лечения.
С 2010 года в НИИ онкологии им. Н. Н. Петрова провели 1585 циклов вакцинотерапии на основе дендритных клеток, 203 пациента испытали этот метод лечения на себе. Но, увы, на использование вакцины есть свои ограничения. Например, её нельзя применять при аутоиммунных расстройствах, поскольку вакцина может спровоцировать обострение; также она противопоказана при беременности и если опухоль активно метастазирует в мозг. Разные виды злокачественных заболеваний по-разному реагируют на такую терапию. Наиболее иммуногенной, то есть поддающейся лечению иммунными методами, считается меланома — очень агрессивная разновидность рака. Химиотерапия перед меланомой бессильна, а вот на иммунотерапию отвечают 8—12% пациентов, что считается хорошим показателем. Неплохих результатов при помощи вакцины врачи достигли и в лечении саркомы мягких тканей. Так, благодаря дендритным клеткам удалось спасти ногу 16-летней Сабрине из Дагестана, страдающей от синовиальной саркомы.
«Раньше считалось, что вакцина имеет такую же эффективность, что и альфа-интерферон. Сейчас есть данные, что вакцина эффективнее», — уточняет И. А. Балдуева. Протокол вакцинации, разработанный в Санкт-Петербурге, уже используют в екатеринбургском Институте клеточных технологий, а в ближайшее время этот метод лечения будет внедрён в ростовском НИИ онкологии.
Хорошие результаты в лечении рака даёт сочетание вакцинации с гипертермией, при которой температуру тела пациента специально повышают до 43,5оС. Сложно поверить, что человек может выдержать такую температуру. Тем не менее при гипертермической терапии создаются условия, когда человек выживает, в то время как клетки опухоли гибнут от теплового шока (подобные манипуляции, разумеется, проводятся только под наблюдением врачей).
Повышение температуры нарушает структуру белковых молекул, и они перестают работать так, как надо. Чтобы внутриклеточные ферменты «держали форму», клетка синтезирует специальные стрессовые молекулы, так называемые белки теплового шока (БТШ, или HSP), которые связываются с другими белками, помогая им оставаться в рабочем состоянии. По словам доктора биологических наук Ирины Владимировны Гужовой, заведующей Лабораторией защитных механизмов клетки Института цитологии РАН, в опухоли и без перегрева достаточно много белков теплового шока. Однако нагревание организма приводит к тому, что в крови пациента повышается уровень одного из таких белков — белка под названием БТШ70 (HSP70), который высвобождается не только из опухолевых, но и из здоровых клеток. Белок, вышедший из здоровых клеток, проникает в опухолевые и выталкивает из них опухолевый БТШ70 вместе с молекулами, с которыми тот взаимодействовал. Среди пептидов, связанных с опухолевым БТШ70, могут быть те, что специфичны именно для злокачественных клеток, и теперь, когда они оказались снаружи, их «видит» иммунитет. В результате происходит активация адаптивного иммунного ответа. Впрочем, детали этого процесса до конца пока непонятны.
Хотя врачи уверенно заявляют о том, что в их руках есть ещё один действенный метод борьбы против рака, многое предстоит выяснить. Например, как долго стоит продолжать вакцинацию и какая точно должна быть доза. Сначала пациент в течение двух месяцев получает четыре вакцины, потом раз в месяц, раз в три месяца и, наконец, раз в полгода. Считается, что если в течение пяти лет болезнь не возвращается, то человек излечился от рака. Но до сих пор не ясно, не вернётся ли болезнь в случае отмены вакцинации.
По словам Ирины Александровны Балдуевой, иммунологические методы лечения рака эффективны в комплексе с другими вариантами терапии, и во многих случаях сложно сказать, что же именно стало ключевым моментом на пути к выздоровлению или улучшению качества жизни пациента — вакцина или же другие средства, использованные вместе с ней. Впрочем, в онкологии главное — это результат, который достигается благодаря усилиям очень многих специалистов и конечно же самого пациента.
Когда в 1998 году петербургские онкологи начинали разрабатывать свою вакцину, они отбирали пациентов с исчерпанными медицинскими возможностями, но которые всё ещё были полны желания жить. Профессор Балдуева ставит стремление к жизни едва ли не на первое место в успехе противораковой терапии: «За годы работы мы убедились в том, что если пациента окружают близкие люди, которые о нём заботятся, то шансы на выздоровление, увеличение продолжительности жизни и улучшение её качества сильно возрастают. Иммунная и нервная системы оказывают огромное влияние друг на друга». Через руки профессора прошли сотни больных, и, как говорит она сама, важно не принимать диагноз как приговор.
Согласна с врачом и жена Анатолия Иосифовича: «Не прошло и трёх месяцев после нашего возвращения из Санкт-Петербурга, как мы пошли в горы для того, чтобы Анатолий Иосифович почувствовал, что он живой», — вспоминает Лариса Викторовна.
О том, что психологический настрой имеет огромное значение в лечении онкологических больных, знали ещё в далёкой древности. Но как самостоятельная научная дисциплина психоонкология оформилась лишь в 70-е годы прошлого века. Современная психоонкология имеет дело с двумя основными аспектами: во-первых, с психоэмоциональными реакциями пациентов и их близких, во-вторых, с теми психологическими и социальными факторами, которые способствуют как возникновению заболевания, так и выздоровлению или улучшению качества жизни. Каждая история болезни индивидуальна, но когда речь идёт об онкобольных, то здесь личная психология пациента играет особую роль, и её не заменят ни самые современные методы лечения, ни самые квалифицированные врачи.
● Моноциты — клетки иммунной системы, которые блуждают по телу и в прямом смысле поедают опасных чужаков.
● Фагоциты — иммунные клетки, которые поглощают вредные чужеродные частицы.
● Альфа-интерферон — белок с антивирусным действием, который также используют при терапии онкозаболеваний.
источник
«Мы разработали более 10 противоопухолевых клеточных продуктов, но в клиническую практику попали лишь два»
Клеточные технологии сегодня получают практическое применение в самых разных областях отечественной медицины – от косметологии до кардиологии. Но если в одних случаях клеточные продукты используются пока в экспериментальном порядке или проходят стадию клинических исследований, то в других – уже имеют статус терапевтически эффективной и одобренной регуляторами методики. Наиболее яркий пример клинического внедрения – иммунотерапия злокачественных новообразований с помощью дендритно-клеточной вакцины, созданной 20 лет назад в Санкт-Петербурге учеными НИИ (сейчас – НМИЦ) онкологии им. Н.Н. Петрова. О том, в каких обстоятельствах рождалась и отрабатывалась уникальная методика, Vademecum рассказала один из ее авторов – руководитель Центра клеточных технологий и научного отдела онкоиммунологии НМИЦ Ирина Балдуева.
– В чем суть терапии с помощью дендритно‑клеточной вакцины?
– Если объяснять упрощенно, то мы берем у пациента образец опухоли, которая уже не отвечает на другие методы лечения, выделяем опухолевые клетки и клетки крови и в лабораторных условиях модифицируем их таким образом, чтобы иммунная система начинала их распознавать, а затем вводим полученную дендритную вакцину пациенту. Дендритные клетки умеют распознавать антигены опухолевых клеток (раково‑тестикулярные антигены) и помогают иммунной системе с ними справляться.
– Как давно вы занялись этой темой?
– После медицинского училища я поступила в мединститут и параллельно работала медсестрой в хирургическом отделении. Там я часто общалась с онкологическими больными, и каждый говорил о том, как ему хочется жить – хотя бы еще несколько лет. Мне уже тогда стало ясно, что та же, например, химиотерапия помогает далеко не всем, высока вероятность прогрессирования заболевания, и надо что‑то делать, искать то, что сможет помочь этим людям. Я стала эту тему исследовать, на втором курсе института поняла, что следует сосредоточиться на иммунной системе, которая отвечает за многие изменения в организме, в том числе за борьбу с инфекционными, аутоиммунными и онкологическими заболеваниями. Так я стала изучать иммунологию. После института по распределению Минздрава я попала в НИИ онкологии им. Н.Н. Петрова. Специальности иммунолога тогда, конечно, не существовало, поэтому я занялась наукой. Параллельно работала в 31‑й городской больнице, где позже возглавила лабораторию иммунологии – там пришлось работать с клетками костного мозга, используемыми сегодня при изготовлении дендритно‑клеточных вакцин. И когда в 1998 году мне предложили войти в научную группу в НИИ онкологии в качестве иммунолога, я не раздумывая согласилась.
– Почему иммунология стала интересна НИИ онкологии?
– По экспериментальным исследованиям на лабораторных животных стало понятно, что вакцина работает. Потом‑то мы выяснили, что применение вакцины у людей сопряжено с большим количеством реакций. Опухоль уклоняется от иммунного контроля, продуцирует супрессирующие факторы, меняет свой «портрет». Во время лечения новообразование изменяется, грубо говоря, прячется от иммунитета. Тем не менее перспективы всем были очевидны. А в НИИ как раз было очень близкое по смыслу направление – отделение биотерапии и трансплантации костного мозга, которое возглавлял Владимир Михайлович Моисенко. При этом отделении и появилась наша лаборатория, сначала совсем маленькая – над вакциной работали всего три человека.
– Как в непростые 90‑е финансировались эти разработки?
– Минздрав выделял средства на научную работу института, а так как направление было признано перспективным, его постоянно поддерживали. В развитие темы вкладывал собственные средства и сам НИИ.
– А за рубежом в то время иммунотерапию изучали, практиковали?
– Из научной литературы я знала, что дендритными клетками занимаются в Париже в Онкологическом институте Густава Русси, и курирует там это направление Лоранс Зитвогель. Мы ей написали, пригласили в Петербург. Она приехала, посмотрела, дала множество дельных советов. Потом я отправилась на стажировку в ее институт. Сама Зитвогель училась в Америке, где подобные лаборатории появились заметно раньше. Она рассказывала, как трудно было организовать ее лабораторию в Париже, притом что работала она на том этапе только с дендритными клетками подопытных мышей. Первые человеческие дендритные клетки в лаборатории Зитвогель получили к 2000 году, параллельно с нами. Так что можно сказать, что в Европе НИИ им. Н.Н. Петрова был в этой тематике одним из первых, а в 2003‑2004 годах это удалось сделать коллегам из РОНЦ им. Н.Н. Блохина.
– Какие практические результаты принесли ваши исследования на сегодняшний день?
– Мы разработали более 10 противоопухолевых клеточных продуктов, но в клиническую практику попали лишь два – вакцины на основе дендритных клеток, выделяемых из костного мозга и крови. На их применение мы в свое время получили специальное разрешение Росздравнадзора. Остальные восемь мы не можем продвигать, поскольку 180‑ФЗ [федеральный закон 180‑ФЗ от 23 июня 2016 года «О биомедицинских клеточных продуктах». – Vademecum] фактически еще не работает.
– То есть дендритно‑клеточная вакцина под действие 180‑ФЗ не подпадает?
– Нет. По идее, производство и применение таких вакцин должны регулироваться отдельным законом – о минимально манипулируемом клеточном продукте. Такого документа пока нет, и неизвестно, когда он появится. Дело в том, что 180‑ФЗ распространяется на клеточные линии, которые получаются в результате размножения в лаборатории, а у нас они скорее созревают в лабораторных условиях – мы их учим распознавать опухолевые антигены. Тот самый закон, которого пока нет, должен будет распространяться на все виды трансплантации костного мозга, не подпадающей под действие 180‑ФЗ. Получается, две наши дендритные вакцины – единственные легитимно используемые у нас в стране: на их применение есть разрешение Росздравнадзора, а 180‑ФЗ на них не распространяется. Все остальные существующие в отрасли продукты (включая другие наши разработки), подпадающие под действие 180‑ФЗ, пока не зарегистрированы и применяться не могут. Причем у некоторых коллег были подобные нашим разрешения Росздравнадзора на использование клеточных технологий – в косметологии, комбустиологии, но с появлением 180‑ФЗ, пусть толком и не работающего, их применение стало невозможным.
– Как ваши вакцины работают?
– С 1998 года мы пролечили более 700 человек. Основные профили и локализации – меланома, саркома мягких тканей, рак кишечника, молочной железы, почек. Все эти новообразования являются иммуногенными. Когда уже появляются метастазы, тогда этих иммуногенных антигенов становится все больше. Так что наша вакцина рассчитана на пациентов с исчерпанными возможностями. Удается продлить их жизнь как минимум на год.
– То есть полностью излечиться с помощью дендритно‑клеточной вакцины нельзя?
– У нас есть в практике такие случаи, например, при меланоме. Есть пациенты, которые продолжают лечение в течение 10 лет – болезнь отступила, но сохранился риск, что заболевание вернется и вернется в иной форме. Бывало, пациент полностью излечился от саркомы мягких тканей, а через четыре года у него появились метастазы в головном мозге. Клетки скрылись от иммунной системы, в какой‑то момент активизировались и спровоцировали рецидив, который оказался крайне агрессивным. Именно поэтому мы не только проводим иммунотерапию, но и в целом занимаемся иммунной системой пациента. Обычно иммунитет истощен, его надо восстанавливать, чтобы у клеток появились силы отвечать на наше лечение. Это не так просто, система может заработать через месяц, а может и через два‑три.
– Есть мнение, что методики, подобные вашей, следует использовать на более ранних стадиях онкозаболеваний, не подвергая пациента лучевой и химиотерапии. Что вы по этому поводу думаете?
– Я поддерживаю это мнение. В общем‑то поэтому сегодня и происходит бум иммуноонкологии, препаратов на основе моноклональных антител, провоцирующих разрушение опухоли. Однако не у всех пациентов это работает и не всегда. Если бы пациентам сразу после радикального вмешательства назначали иммунотерапию, то была бы возможность или полного излечения или восстановления иммунной системы на длительный период, предотвращающий возвращение заболевания. Или другой вариант. Пациента пролечили стандартными методами – операция, лучевая терапия, химиотерапия, если показана, гормонотерапия – в соответствии с мировым стандартом. А потом его отправляют не «отдыхать», как говорят химиотерапевты, а к онкоиммунологам.
В нашем центре прием ведут пять таких специалистов. К нам приходит пациент, и мы определяем, что ему необходимо – можно ли сейчас подключить ему иммунотерапию. То есть мы уже на том клиническом пути, о котором вы говорите.Что является препятствием? К сожалению, и консультации, и сама иммунотерапия осуществляются только на платной основе. Пока у государства нет возможности поддерживать это направление. Хотя иммунотерапию можно было бы использовать в качестве высокотехнологичной медицинской помощи. Мы подавали наши протоколы в Минздрав, но нам ответили: надо дождаться появления закона о минимально манипулируемых клеточных продуктах. При этом иммунотерапия нисколько не дороже некоторых онкопрепаратов.
– Каково, по вашим расчетам, соотношение стоимостей этих методик?
– Например, первая линия химиотерапии при саркоме мягких тканей недорогая. А вот совокупные затраты на вторую линию химиотерапии в целом по России достигают от 0,4 до 4,1 млрд рублей в год. Такая вилка связана с разницей в цене препаратов. Вакцину близко не сравнить по стоимости – это 43 тысячи рублей за одно введение. Как правило, пациенты лечатся в течение первого года ежемесячно, второго года – раз в три месяца, и третьего – раз в полгода. А дальше уже остается только наблюдение. Мы удешевили весь процесс до минимума, отработана каждая доза. У нас даже диссертационная работа на эту тему есть.
– За счет чего курс лечения можно удешевить? Более точно рассчитывать дозы?
– Опытным путем мы стали уменьшать дозу вакцины, смотреть, при каком ее минимальном объеме сохраняется активность клеток, какие нужны для этого внешние условия. Можно сэкономить на компонентах вакцины. Например, ростовой фактор – это отдельный препарат, который сегодня уже производится и в России. Питательных, культуральных сред, факторов дифференцировки недостаточно, если их будет больше, мы сможем еще снизить стоимость курса лечения. Среды, например, мы покупаем в Германии. Хорошо бы иметь отечественный аналог. Еще одна проблема – расходные материалы из пластика: мы используем импортные изделия, потому что у нас их выпуск не налажен.
– Как пациенты вас находят? Вы вкладываетесь в продвижение?
– Нет, здесь работает так называемое сарафанное радио. Пациенты и их родственники очень много общаются друг с другом, много читают, ищут варианты. Очень многие уезжают на такое лечение за рубеж, например, в Израиль, а когда у них кончаются деньги, им говорят, что то же самое можно сделать в Санкт‑Петербурге.
– Куда, помимо Израиля, уезжают лечиться российские пациенты?
– Германия, Канада, США, Япония. Везде это очень дорого. И наша задача в том, чтобы это направление у нас не свернулось из‑за банального отсутствия госфинансирования, работающих законов и так далее.
– Недавно о планах заняться клеточными технологиями объявили сразу две российские фармкомпании – «Биокад» и «Р‑Фарм», которые планируют производить CAR‑T‑препараты. Чем эта технология отличается от вашей?
– Мы сейчас создаем собственную научную группу, которая займется разработкой CAR‑T‑терапии. Этот метод ориентирован на другие виды рака – например, на лейкозы, лимфомы. Для этих нозологий CAR‑T подходит, по предварительным данным, даже больше, чем трансплантация костного мозга с химиотерапией. Суть в том, что у опухолевых клеток есть одинаковые гены, значит можно создать антиген, CAR‑T, который их разрушит. Это доказано в эксперименте,но в клинике совсем не изучено. Проблема еще вот в чем. Когда опухоль увеличивается в размерах, «портрет» ее клеток разнообразен – в зависимости от фазы развития каждой клетки. Это как кубик Рубика. Как в этом случае быть? Выделить лимфоциты из опухоли, размножить в лаборатории и ввести обратно пациенту, предварительно уничтожив химиотерапией оставшиеся у пациента лимфоциты, поскольку какие‑то из них могут подавлять иммунный ответ. В этом случае «клонированные» в лаборатории лимфоциты будут разрушать опухоль.
Сейчас проводятся клинические исследования, в основном в США, для метастатической формы меланомы. Адепт этого направления в Америке – бывший хирург‑онколог Стив Розенберг. Он показал, что 50% пациентов, уже не отвечающих ни на какие методы лечения, реагируют на CAR‑T положительно. Объективный ответ получен у 10% пациентов. Это обнадеживает. Но не стоит забывать о том, что CAR‑T – весьма дорогой метод. «Биокад» заявлял, что создание одного индивидуального препарата может обойтись в 16 млн рублей. А чем терапия дороже, тем меньше пациентов смогут ее получить. Но в любом случае CAR‑T надо развивать, не забывая и о других видах иммунотерапии.
– И «Биокад», и «Р‑Фарм» сотрудничают по проекту CAR‑T с научными институтами – НМИЦ им. В.А. Алмазова и ПМГМУ им. И.М. Сеченова. Вам фармкомпании не предлагали поработать вместе?
– С «Биокадом» мы работаем по клиническим исследованиям иммуноонкологических препаратов. Наш продукт интересен фармкомпаниям, но они тоже неспособны объять необъятное, поэтому готовы вкладываться в разработку на паритетных началах а у нас пока такой возможности нет. Кроме того, по сравнению с CAR‑T наша технология сложнее с организационной точки зрения: чтобы работать с истощенной иммунной системой, нужно иметь свою клинику и штат врачей.
– Вы рассматриваете в перспективе создание на базе НМИЦ онкологии лаборатории полного цикла, способной обеспечивать вакцинами другие клиники?
– Конечно, такие планы есть. Но в нынешних неопределенных условиях мы пока можем только объединиться с коллегами. В ближайшее время мы организуем Ассоциацию биомедицинских клеточных продуктов, как раз призванную развивать полный цикл производства, – ради снижения стоимости вакцин и других продуктов. В Петербурге есть почти все для этого – я имею в виду предприятия, которые производят компоненты для вакцины. Для организации полного цикла нужно лицензировать производство, получить сертификат GMP, все это требует для начала нормативного обоснования, а затем финансов. Сейчас готовится Национальная программа по борьбе с онкозаболеваниями, надеюсь, и на наше направление получится изыскать средства.
– У ассоциации уже есть конкретные предложения по развитию отрасли?
– Да, мы подготовили целый пакет различных уточнений и предложений. Важно обозначить в подзаконных актах, каким образом будет осуществляться лицензирование производства, какие требования следует предъявлять к средам и самому продукту, какую подготовку должны иметь биотехнологи. Кроме того, мы предлагаем Минздраву сохранить уже существующие наработки. Важно, чтобы нас не отбросили снова на экспериментальную стадию. Проверить еще раз эффективность разработок можно, главное, чтобы в целом процесс не останавливался.
– Когда вы ожидаете принятия закона о минимально манипулируемых клеточных продуктах?
– Мы понимаем, что документ будет принят в обозримом будущем, и надеемся, что он будет более тщательно проработан, чем 180‑ФЗ. Мы в любом случае сделаем все, чтобы ему соответствовать. Но самым важным остается вопрос финансирования. Как обычно бывает? Научное учреждение разрабатывает и передает компетенции клинике или фармкомпании. Мы не против такого пути, но необходимо, чтобы разработки и их авторы достойно финансировались. Зарплаты в науке и в практической сфере кратно разнятся, и не в пользу ученых. А мы готовим специалистов не для того, чтобы они куда‑то ушли. Мы не бедствуем, зарабатываем как можем сами, также лаборатория получает дополнительные средства из бюджета Центра, но тем не менее.
источник
Лечение онкологии в нашем городе становится все более эффективным. В данный момент в лаборатории онко-иммунологии НИИ имени Петрова, выращивается уникальная вакцина на основе иммунных клеток, которая позволяет достичь стойкой ремиссии у пациентов с последними стадиями рака.
Так выглядит многократно увеличенная сцена «боевого учения» из жизни клеток. Дендритные клетки иммунной системы, поглотив опухолевый антиген, представляют его бойцам невидимого фронта: Т-лимфоцитам, которые учатся распознавать вредоносный антиген и убивать его. Чтобы запустить этот процесс в ослабленном организме онко-больного, ему вводится вакцина на основе индивидуальных дендритных клеток.
Татьяна Нехаева, старший научный сотрудник научного отдела онкоиммунологии «НИИ онкологии им. Н.Н. Петрова», кмн: «Один из компонентов вакцины — это периферическая кровь каждого пациента и для активации дендритных клеток используются антигены, которые обладают высокой иммуногенностью. Все пациенты, которые поступают к нам в хирургическое отделение и лечатся, получают операцию. Во время операции мы берем кусок опухоли, транспортируем его в отдел и из этого образца стараемся получить клеточную культуру».
С 1998-го, года организации лаборатории окноиммунологии в НИИ имени Петрова, иммунотерапию получили уже более 2000 пациентов. Основные показания: плохо поддающиеся стандартному лечению формы рака. 17-ти летней Сабрине в 2013м поставили диагноз — саркома мягких тканей. В НИИ онкологии имени Петрова приехала из Дагестана. Сабрине угрожала ампутация левой ноги, с начала этого года она получила 6 вакцин. Результат — полный регресс заболевания.
Сабрина: «У меня было 5 операций, 5 курсов химии, 30 лучевых и 6 вакцин. Вроде, хорошо себя чувствую».
Анатолий Суренко с супругой приехали на 2-й петербургский онкологический форум из Краснодара. Они уверяют: наладить информационный обмен о новых методиках с периферией – жизненная необходимость. Анатолию 76, после удаления почки обнаружились метастазы в легких и плевре. В Краснодаре врачи признали неоперабельным и дали 2 месяца. Супруга Лариса сама разыскала информацию о НИИ онкологии и повезла мужа в Петербург. Одну из первых в России операций на плевре ему провел хирург Евгений Левченко. Далее – вакцинация.
Анатолий Суренко: «При онкологии никто не может дать гарант от дальнейших метастазов и вот уже 5 лет – сначала 2 раза в месяц, потом 1 раз в месяц-год, потом каждый квартал 2 года и полтора уже раз в полгода – еще 2 раза сделать и, если все нормально, то меня отпустят».
Татьяна Протасевич в 2011-м обнаружила на плече растущую родинку. За диагнозом меланома кожи последовало 3 операции, заболевание прогрессировало до 3й стадии. В 2011-2012х годах Татьяна получила 12 вакцинаций дендритно-клеточной вакциной в сочетании с циклофосфамидом, после чего с удвоенной энергией занялась любимым досугом – дизайном интерьера в собственном доме.
Татьяна Протасевич: «Живет тот, кто хочет жить. Надо захотеть жить. Научилась замечать мелочи, радоваться мелочам. Вот была вишня недавно и засохла за зиму, думала, что с ней сделать? Повесила фонарики».
В НИИ онкологии имени Петрова есть пациенты, получающие вакцинацию с 2001-го года. Сегодня нельзя опускать руки, даже на 3й и 4й стадии онкологии, когда возможности химиотерапии исчерпаны, уверяют и врачи и их подопечные.
Ирина Балдуева, руководитель научного отделения онкоиммунологии «НИИ онкологии им. Н.Н. Петрова», доктор медицинских наук: «Разрабатываются новые комбинированные. Сочетанные методы – криохирургия, иммунотерапия, фотодинамическая терапия, технология».
Эффективность иммунотерапии дендритными клетками — более 40 процентов. Бесплатное лечение получают только дети и пациенты с саркомой, но онкологи надеются, что им удастся получить разрешение на клиническую апробацию. И тогда закупку дорогостоящих расходных материалов возьмет на себя государство, а современный метод лечения станет доступным для всех пациентов.
Анастасия Тамило, Екатерина Горбачева, Антон Голубев, Александр Высоких и Андрей Клемешов. Первый канал. Петербург.
источник
Разработка методов лечения злокачественных опухолей с помощью клеточных технологий, в частности иммунотерапии, является одним из приоритетных направлений в онкологии. В настоящее время в мире ведется более 300 клинических испытаний по использованию вакцин на основе стволовых и дендритных клеток для лечения онкологических заболеваний, из которых 232 в США и только 3 в России (согласно данным U.S. National Institutes of Health (clinicaltrials.gov). В НИИ клинической иммунологии СО РАМН (Новосибирск) разработаны и готовы к клиническим испытаниям специфические вакцины на основе активированных дендритных клеток, сенсибилизированных опухолевыми антигенами, против рака молочной железы, колоректального рака, рака простаты и яичника [1]. В НИИ онкологии им. Н.Н Петрова (С-Петербург) ведутся исследования по разработке и применению вакцин для иммунотерапии меланомы [2]. Оптимизация технологиии и стандартизация получения противоопухолевых вакцин на основе аутологичных дендритных клеток, диссертация на соискание ученой степени кандидата медицинских наук. Применение клеточных технологий для иммунотерапии онкологических заболеваний может способствовать преодолению резистентности опухоли к химиотерапии и повышению эффективности лечения больных [4, 5, 6].
Среди современных направлений в области вакцинотерапии злокачественных опухолей следует отметить расширение нозологических форм, подлежащих этому методу лечения, а также оптимизацию методов получения дендритноклеточных вакцин и протоколов их применения. Представляется значительной вероятность того, что рак шейки матки, в возникновении которого, как известно, велика роль вирусной инфекции, в частности ВПЧ высокого онкогенного риска, окажется чувствительным к иммунотерапии, например вакцинации дендритно-клеточными вакцинами.
Дендритные клетки (ДК) являются профессиональными антиген-представляющими клетками, участвующими в иммунном ответе благодаря своей способности активировать не только «наивные» CD4+ и CD8+ T-лимфоциты, но и Т-клетки памяти паракортикальных зон периферических лимфоидных органов. В связи с центральной ролью в формировании иммунных реакций изучение ДК является не только крайне важной фундаментальной, но и прикладной медико-биологической задачей. Имеющиеся в современной литературе данные свидетельствуют о значительном уменьшении количества ДК в опухолевой ткани, а также их функциональной неполноценности. В настоящее время разработаны методы получения дендритных клеток из CD34+ костномозговых миелоидных предшественников и моноцитов периферической крови.
Целью данной работы является отработка метода получения зрелых дендритных клеток из крови доноров и больных раком шейки матки для получения ДК-вакцины.
Материалы и методы исследования
Для получения фракции мононуклеарных клеток (МНК) периферической крови использовали ЭДТА-стабилизированную кровь 3-х здоровых женщин (доноров) и 3-х больных раком шейки матки (РШМ) в количестве 50 мл. Возраст доноров составлял 25, 34 и 65 лет; возраст больных 34, 36 и 39 лет.
Работу с клетками человека на всех этапах проводили в стандартных условиях стерильного модуля в ламинарно-потоковом шкафу II класса биологической защиты. Дендритные клетки получали из периферической крови с использованием стандартной процедуры [3]. В качестве ростовой среды использовали среду CellGroDC с добавлением 50 мкг/мл гентамицина, ростовых факторов и факторов дифференцировки GM-CSF (72 нг/мл) и IL-4 (20–45 нг/мл). На 3-й и 5-й день культивирования добавляли свежую порцию GM-CSF (72 нг/мл) и IL-4 (20–45 нг/мл). На 7-й день культивирования клетки из одного флакона использовали для анализа иммунофенотипа незрелых ДК на проточном цитометре. Во второй флакон добавляли ростовые факторы и факторы дифференцировки GM-CSF (72 нг/мл), IL-4 (20–45 нг/мл) и TNF-α (20 нг/мл), а также клеточный лизат культуры клеток HeLa в качестве антигенной нагрузки из расчета 3 клетки культуры HeLa на 1 дендритную клетку. Спустя 48 часов клетки снимали скрепером и после подсчета и анализа жизнеспособности в камере Горяева выполняли иммунофенотипирование зрелых ДК с помощью проточного цитометра путем выделения на графиках популяции МНК-ДК и очистки её от дебриса и лимфоцитов с помощью меток CD45, CD3, CD4, CD8, CD16+56, CD19. Оценка стадии созревания мононуклеаров производилась с помощью антител к CD1a, CD11c, CD14, CD33, CD38, CD83, CD86, HLA-DR.
Характеристика больных
Больная № 1 (34 года) 3 курса полихимиотерапии (ПХТ) в предоперационном периоде, курс дистанционной гамма-терапии (ДГТ). Операция: нервосберегающая экстирпация матки с придатками и верхней третью влагалища, тазовая лимфаденэктомия. Кровь взята в послеоперационном периоде.
Больная № 2 (36 лет) 2 курса ХТ в предоперационном периоде, курс иммунотерапии препаратом «аллокин-альфа». Операция: нервосберегающая экстирпация матки с придатками и верхней третью влагалища, тазовая лимфаденэктомия. Кровь взята в послеоперационном периоде.
Больная № 3 (39 лет) 2 курса ХТ в предоперационном периоде, курс иммунотерапии препаратом «аллокин-альфа». Кровь взята до операции.
Основными критериями отбора больных для настоящего исследования являлись степень распространения процесса, соответствующая по классификации TNM: T1в2N0-хM0, T2аN0-хM0, T2вN0-хM0 и репродуктивный возраст больных.
Критерием исключения служили: наличие метаболического синдрома; наличие отдаленных метастазов, выявленных до начала или в процессе лечения; отсутствие эффекта или прогрессирование заболевания после проведения 2 курсов неоадъювантной химиоиммунотерапии; наличие общих противопоказаний для проведения плазмафереза: критический уровень белка крови (ниже 50 г/л); наличие анемии III ст. (гемоглобин ниже 70 г/л); недренируемый очаг гнойного воспаления; инкурабельные состояния больных.
Результаты исследования и их обсуждение
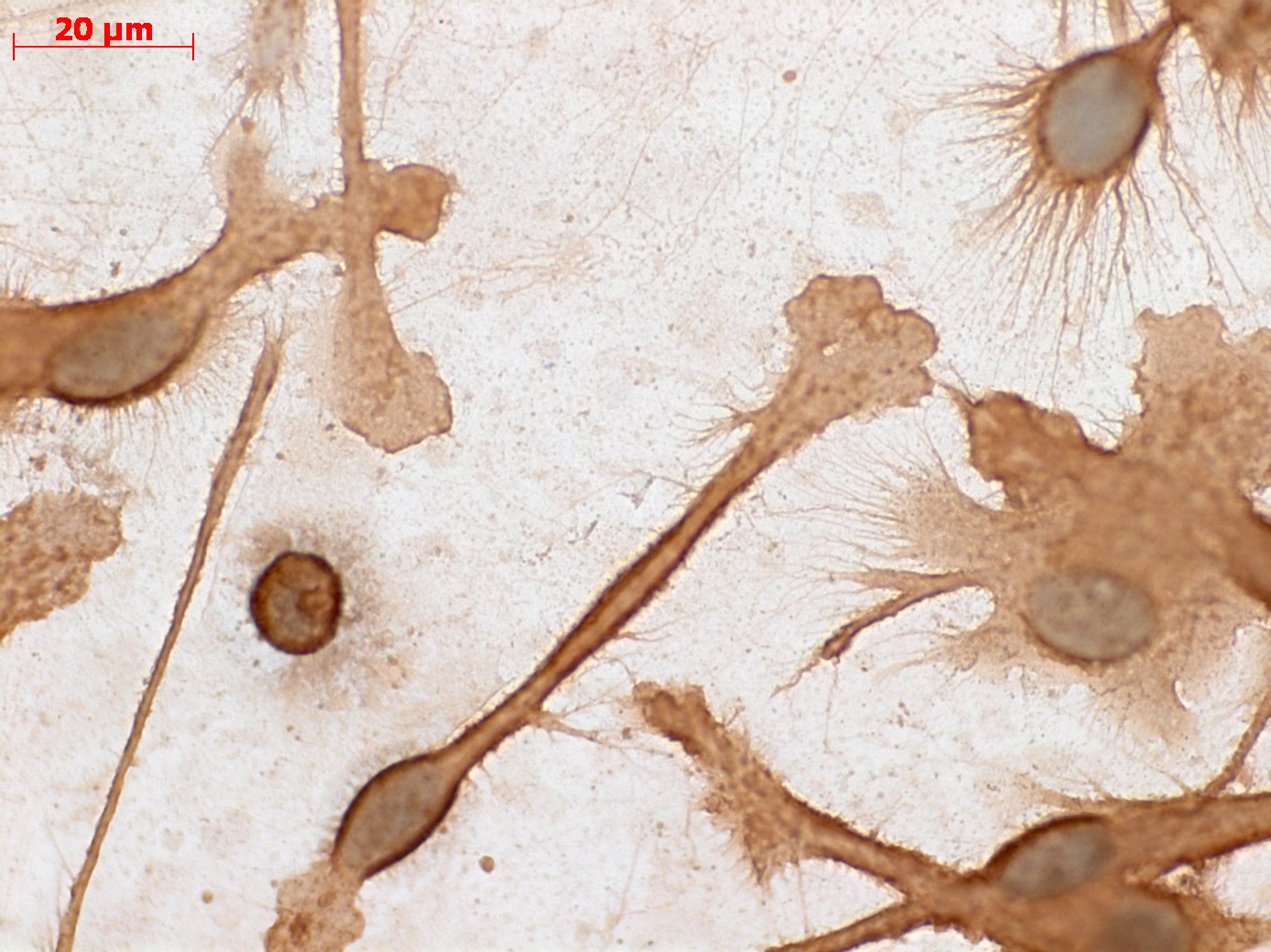
При культивировании МНК крови отмечено, что уже через 3–4 часа начинается процесс прикрепления части моноцитов к субстрату подложки флакона. В процессе адгезии к подложке происходит увеличение размеров клеток, появление единичных отростков, распластывание по субстрату подложки. Через 3 суток становится заметно, что количество прикрепившихся к субстрату МНК здоровых доноров превышает количество МНК больных, что подтверждается и количественными данными, полученными при помощи камеры Горяева (1,5∙106/мл клеток больной и 2,5∙106/мл клеток здорового донора), (рис. 1, а, б). Через 7 сут культивирования в пробе больной присутствует 0,7∙106/мл, в донорской пробе 1,18∙106/мл клеток. Снижение их количества по мере культивирования представляется закономерным, поскольку происходит гибель и отмывание лимфоцитов, после чего на пластике остаются преимущественно ДК различной степени зрелости. На 7-е сутки эксперимента клетки, растущие на подложке флакона, в основном имеют многоугольную, отростчатую и веретеновидную формы (рис. 1, в, г).
На 9-е сутки культивирования дендритных клеток в присутствии GM-CSF, IL-4 и TNF-α, а также лизата культуры HeLa (рис. 2, а, б) отмечены различия между клетками больных и доноров. Характерная для ДК отростчатая или веретеновидная форма более выражена у донорских клеток; они более крупного размера, чем клетки больных.
МНК, 3 суток культивирования, GM-CSF (72 нг/мл) и IL-4 (20-45 нг/мл). Об. х10, ок. х10
Дендритные клетки, 7-е сутки культивирования. GM-CSF (72 нг/мл), IL-4 (20-45 нг/мл) и TNF-α (20 нг/мл, лизат культуры HeLa).Об. х10, ок. х20
Рис. 1. Количественные и структурные изменения МНК больных и доноров при культивировании в течение 7 дней: А – клетки больной; Б – клетки донора
Рис. 2. Результаты заключительного этапа генерации ДК из МНК больных и доноров (9 суток культивирования, 48 часов инкубации с лизатом HeLa в присутствии факторов роста и дифференцировки). Об. х20, ок. х10
В таблице представлены результаты оценки эффективности генерации ДК из МНК 6 проб. Как видно из представленных данных, индивидуальная вариабельность результатов весьма значительна; пробы МНК различаются как по количеству выделенных, так и по проценту погибших клеток. У 2-х доноров количество ДК превышало этот показатель больных на 1–2 порядка.
Результаты эксперимента по генерации ДК из МНК доноров и больных РШМ
источник