Апокринный рак — редкое новообразование, которое состоит из клеток с обильной эозинофильной цитоплазмой, напоминающих метапластические апокринные элементы. Его часто неверно называют онкоцитарным раком или карциномой потовых желез. Эта форма составляет около 1 % всех злокачественных новообразований молочных желез. Макроскопически опухолевые узлы плотные, сероватые, с признаками инфильтративного роста. Под микроскопом апокринный рак имеет вид слизистого, долькового, тубулярного, медуллярного внутрипротокового рака, клетки которого обладают увеличенными и полиморфными ядрами с выраженными ядрышками, а также эозинофильной LUHK(PAS)- и альциан-положительной гомогенной или гранулярной цитоплазмой с вакуолизацией.
Рак с признаками эндокринного новообразования (син.: первичная карциноидная опухоль, апудома) — редкая опухоль, представленная одиночным четко отграниченным узлом диаметром 1—5 см. Иногда она имеет многоузловое строение. Под микроскопом большинство таких новообразований выглядят как инвазивный протоковый рак разной степени гистологической дифференцировки. Аргирофильные клетки находятся как внутри протоковых структур, так и в инвазивной части опухоли. Кроме того, паренхима опухоли может состоять из пластов тубулярного, слизистого, сосочкового, внутрипротокового, внутридолькового и инвазивного долькового рака. Ряд аргирофильных карцином молочных желез обладают эндокринным типом строения и напоминают карциноидные опухоли других органов.
В этом случае опухолевые клетки составляют гнезда и тяжи, разделенные полосками стромы, а также могут формировать ленты, сосочки и микрожелезы. Клетки паренхимы такого новообразования имеют мелкие размеры, нечеткие контуры, гиперхром ные округлые ялра. Они дают положительную аргирофильную реакцию по Гримелиусу и отрицательную — по Фонтана—Массону. При этом в аргирофильных клетках рака молочных желез не удается обнаружить полипептидные гормоны и биогенные амины. Поэтому опухоли с клетками, обладающими аргирофильными гранулами, не представляют собой отдельную нозологическую единицу и рассматриваются как рак с очагами эндокринной метаплазии.
Крирозный рак расценивается как высокодифференцированный вариант инвазивного протокового рака. По частоте находок эта форма занимает около 6 % случаев инвазивного рака молочных желез. Если крнброзный компонент составляет менее половины объема паренхимы опухоли, то эта опухоль трактуется как смешанный инвазивный крнброзный рак. Как и в аналогичной карциноме другой локализации, паренхима криброзного рака гистологически напоминает решето, а весь опухолевый узел обладает развитой коллагеновой стромой. В паренхиме попадаются миоэпителиальные клетки и «дырчатые» структуры, которые могут сочетаться с тубулярным компонентом. Принято думать, что крнброзный рак в чистом виде прогностически более благоприятен, чем смешанный рак (с аденоид-кистозными структурами).
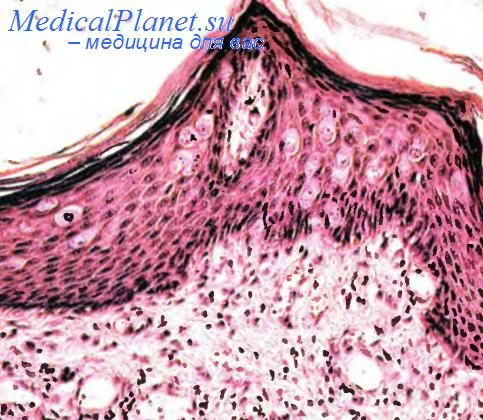
Болезнь Педжета — своеобразная и довольно редкая форма рака, представленная сочетанным поражением структур эпидермиса соска и крупных протоков молочных желез. По числу находок болезнь Педжета составляет 1 —2 % всех случаев рака молочных желез. Возраст больных 26— 88 лет. Пациенты жалуются на боли в пораженном органе, выделения из соска, иногда изъязвление на коже соска. Прогноз широко варьирует и определяется своевременностью начатого лечения и уровнем распространения процесса.
Под микроскопом при этом новообразовании в эпидермисе, преимущественно в нижних отделах сосков молочных желез, обнаруживаются крупные бледные клетки, иногда с оптически пустой цитоплазмой. Это клетки Педжета. Они располагаются поодиночке в поверхностных отделах эпидермиса с тенденцией к формированию пучков в базальных отделах. Их полиморфные крупные и часто светлые ядра содержат крупные ядрышки, а в цитоплазме может обнаруживаться небольшое количество пигмента или слизи. Изредка одиночные клетки Педжета располагаются в вакуолях. Все эти клетки дают положительные реакции на эпителиальный мембранный антиген, низкомолекулярные цитокератины и онкопротеин гена С-ERBB2 (HER2/neu). В подлежащей дерме и строме опухоли определяется лимфоидный инфильтрат. Болезнь Педжета может распространяться за пределы соска.
Почти всегда болезнь Педжета сочетается с вкутрипротоковым раком, реже с инвазивным раком молочных желез. Внутрипротоковый рак представлен комедокарцикомой, солидным раком, а инвазивный протоковый рак — низкодифференцированным солидным раком.
Болезнь Педжета следует дифференцировать от меланомы кожи и болезни Боуэна.
источник
БИФАЗНАЯ) КАРЦИНОМА
СМЕШАННАЯ ПРОТОКОВАЯ И ДОЛЬКОВАЯ
Такие карциномы характеризуются частично микроскопическими признаками инфильтрирующей дольковой карциномы, частично — инфильтрирующей протоковой. Она выявляется достаточно редко и ее необходимо отличать от случаев, когда две отдельные опухоли различного микроскопического строения существуют рядом в одной и той же молочной железе.
Иногда в опухолевом узле или в ткани молочной железы вне карциномы обнаруживаются структуры, по форме соответствующие долькам, альвеолы которых построены из атипических полиморфных раковых клеток. Такие формации не следует рассматривать как элементы долькового рака. Принято считать, что они не что иное, как результат интраканаликулярного распространения в альвеолы инфильтрирующего или неинфильтрирующего рака, и обозначаются как «канцеризация долек» (рис. 32).
Слизистый рак (муцинозный, коллоидный, желатинозный) обычно выявляется у женщин в менопаузальном периоде. Макроскопически опухолевый узел хорошо очерчен, крепитирует при пальпации. На разрезе имеет желеобразную консистенцию, тонкие фиброзные прослойки, часто видны мелкие очаги кровоизлияний. При микроскопическом исследовании видны обширные скопления слизи с «плавающими» в ней опухолевыми клетками (рис. 33). Последние, как правило, мономорфные, мелкие, формируют солидные или железистые структуры. Соотношение муцинозного и эпителиального компонентов может быть различным.
Иногда слизистый рак почти целиком состоит из муцина и тогда в препарате необходимо тщательно искать опухолевые, клетки. Слизь в таких случаях внеклеточная и представляет собой один из продуктов распада коллагеновых волокон.
Иногда в одном и том же опухолевом узле выявляются микроскопические структуры слизистого и обычного протокового инфильтрирующего рака. В этой связи выделяют, так называемые, «чистые» муцинозные карциномы и «нечистые», или «смешанные», слизистые раки, в которых сочетаются признаки того и другого микроскопических типов. Такое подразделение обусловлено различиями прогностического характера. «Чистые» слизистые раки отличаются более благоприятным прогнозом, чем протоковые инфильтрирующие карциномы. Это проявляется очень низкой частотой регионарного метастазирования «чистых» слизистых раков, которая при опухолях менее 5 см в диаметре не превышает 2-4%. В то же время необходимо помнить, что у части больных «чистым» слизистым раком отдаленные гематогенные метастазы могут быть обнаружены через 15 лет и более после начала лечения. Это свидетельствует о необходимости постоянного наблюдения за больными слизистым раком молочной железы. Больные «смешанным» слизистым раком имеют такой же прогноз, как и при инфильтрирующем протоковом раке.
Медуллярный рак обычно выявляется у женщин моложе 50 лет. При макроскопическом исследовании определяется четко очерченный опухолевой узел с ровными контурами, плотно связанный с окружающими тканями молочной железы. На разрезе узел серого цвета, часто с мелкими кровоизлияниями и очажками некроза. Консистенция опухоли мягкая, похожая на ткань мозга (старое название — «мозговик»). Микроскопическая структура опухоли представлена обширными полями крупных полиморфных клеток с большим количеством митозов. Опухоль практически не имеет соединительнотканных прослоек (рис. 34).
Постоянным микроскопическим компонентом является выраженная лимфоцитарная инфильтрация периферии опухоли. Иногда значительное количество лимфоцитов проникает вглубь опухоли, располагаясь между раковыми клетками.
Прогноз при медуллярной карциноме лучше, чем при обычном инвазивном раке. 10-летняя выживаемость при медуллярной карциноме составляет 84%, по сравнению с 63% при обычных протоковых раках. Метастазы в подмышечных лимфатических узлах выявляются часто, но обычно поражаются единичные лимфатические узлы и их локализация ограничена нижней аксиллярной группой. Прогноз особенно благоприятен при медуллярной карциноме менее 3 см в диаметре и сохраняется лучшим, чем для протоковой инфильтрирующей карциномы, даже когда имеются метастазы в регионарных лимфатических узлах.
Диагноз медуллярная карцинома должен ставиться лишь в тех случаях, когда имеются все признаки, ее характеризующие (ровные контуры опухолевого узла, массивные поля полиморфных опухолевых клеток, скудные соединительнотканные прослойки и выраженная лимфоплазмоцитарная инфильтрация). Опухоли, лишенные хотя бы одной из этих черт, следует расценивать как обычные инфильтрирующие протоковые карциномы высокой степени злокачественности.
Папиллярный инвазивный рак встречается очень редко, преимущественно у женщин в период менопаузы. При макроскопическом исследовании определяется четко очерченный деревянистой плотности серого цвета опухолевый узел, плотно спаянный с тканью молочной железы. Микроскопическое исследование показывает, что среди грубоволокнистой соединительной ткани располагаются неправильной формы и разной величины железистые полости, сформированные раковыми клетками. В просветы полостей выступают истинные сосочки, покрытые опухолевым эпителием.
Метастазирует папиллярная инвазивная карцинома редко и в метастазах в регионарные лимфатические узлы, обычно, сохраняет папиллярное строение. Прогноз инвазивного папиллярного рака значительно благоприятнее, чем при обычной протоковой инфильтрирующей карциноме. Иногда в одном и том же опухолевом узле выявляются стpyктуры инвазивного папиллярного рака и обычной протоковой карциномы (скиррозные, солидные и прочие структуры). Такие опухоли следует относить к инфильтративным протоковым раковым опухолям, так как прогноз в этих случаях не отличается от аналогичного показателя при банальной протоковой карциноме.
Редко инфильтрирующая папиллярная карцинома бывает представлена расположенными в строме железистыми полостями, имеющими правильную округлую или овальную форму и содержащими истинные сосочковые структуры, эпителий которых не имеет выраженного полиморфизма. Такие опухоли при микроскопическом исследовании бывает трудно отличить от папиллярного протокового рака in situ. Главным критерием в пользу инвазивного рака является наличие определяемого при макроскопическом исследовании плотного четко очерченного опухолевого узла.
Тубулярный рак — редкий гистологический вариант карциномы молочной железы, выявляющийся у женщин как в репродуктивном возрасте, так и менопаузальном периоде. Средний возраст таких больных около 50 лет.
Макроскопически новообразование представляет собой опухолевый узел твердой консистенции, неподвижный по отношению к окружающим тканям молочной железы. Нередко опухоль имеет звездчатую конфигурацию и похожа на протоковый инфильтрирующий рак скиррозного строения. Характерной особенностью опухолевого узла служат его небольшие размеры (1,5-2,5 см), что связано с медленным ростом карциномы.
Микроскопическая картина тубулярного рака представлена мелкими железами, расположенными на значительном расстоянии друг от друга в обильной строме. Железы не ветвятся и не анастомозируют друг с другом. Значительная часть желез имеет угловатую форму. Эпителий желез кубический или низкий цилиндрический, располагается в один ряд. Многие клетки на апикальной поверхности имеют реснички (апокриновый тип секреции). Клеточные элементы, формирующие железы, мономорфны, митотические фигуры не обнаруживаются.
Миоэпителиальные клетки не определяются; базальная мембрана отсутствует или обнаруживается в виде небольших ее фрагментов, что хорошо демонстрируется при использовании ШИК-реакции.
В просветах большинства желез не содержится продуктов секреции. В некоторых железистых структурах имеются клеточные мостики, соединяющие противоположные стенки железы (рис. 35).
В значительной части (более 2/3) тубулярных карцином в опухолевом узле или вне его определяются очаги внутридолькового или внутрипротокового рака, как правило, микропапиллярного или криброзного типа (рис. 36).
Строма опухоли обычно богата клеточными элементами. Микрокальцификаты выявляются, примерно, в половине случаев тубулярного рака. Количество их может быть разным, локализация — как в просветах железистых структур, так и в строме опухоли.
Метастазирует тубулярная карцинома редко. Метастазы, как правило, обнаруживаются лишь в подмышечных лимфатических узлах (рис. 37) и их частота не превышает 10% от числа всех оперированных по поводу этого варианта рака. При этом наличие регионарных метастазов не является фактором, отягощающим прогноз. Тубулярный рак молочной железы характеризуется достаточно благоприятным прогнозом. Частота рецидивирования и гематогенного метастазирования не превышает 4%. Иногда в тубулярном раке наблюдается сочетание со структурами обычной инфильтрирующей протоковой карциномы. Прогноз таких «смешанных» раков в значительной степени хуже, чем при чисто тубулярной карциноме. При этом преобладание тубулярного компонента делает прогноз лучше, чем при обычном, инвазивном протоковом раке.
Тубулярный рак иногда имитирует доброкачественное поражение молочной железы и, прежде всего, мелкожелезистый аденоз. Дифференциально-диагностические критерии этих процессов изложены в разделе, посвященном фиброкистозной болезни.
Аденокистозный рак (криброзный, цистаденоидный, цилиндрома) — редкая форма карциномы молочной железы, характеризующаяся очень благоприятным прогнозом. Макроскопически представляет собой опухолевый узел, не отличающийся от других форм инфильтрирующих опухолей. Как следует из названия, микроскопическое строение этой формы рака представлено кистозными формациями, заполненными криброзными («кружевными», солидными с круглыми отверстиями) разрастаниями из раковых клеток. Кисты, как правило, имеют неправильную форму. Они часто сочетаются с тубулярными структурами. Иногда кистозные формации имеют правильную округлую или овальную форму, а клетки, их образующие, мономорфны. Нередко на апикальных отделах клеток определяются реснички (рис. 38). В этом случае необходимо проводить дифференциальную диагностику между инвазивным аденокистозным раком и неинфильтрирующей протоковой карциномой криброзного строения. Наличие макроскопически определяемого плотного узла опухоли и микроскопические проявления инвазии в жировую клетчатку свидетельствуют в пользу аденокистозного рака.
Секреторный (ювенильный) рак — редкая форма карциномы молочной железы, встречающаяся, главным образом, у девочек. Крайне редко может возникать у взрослых женщин в репродуктивном периоде. При макроскопическом исследовании определяется четко очерченный опухолевый узел, обычно малых размеров. Микроскопическая картина достаточно характерна и представлена железистыми и солидными структурами, состоящими из крупных клеток с хорошо выраженной вакуолизированной цитоплазмой (рис. 39а). Значительная часть клеток имеет оптически пустую цитоплазму («гипернефроидного» вида). Просветы железистых структур заполнены эозинофильным ШИК-положительным секретом. Ядра, в основном, нормохромные с выраженными ядрышками. Нередко центральная часть узла опухоли представлена гиалинизированной стромой без раковых клеток.
Прогноз благоприятный. Регионарное и отдаленное метастазирование выявляется редко.
Апокринный рак — крайне редкая форма, образованная эпителием апокринового типа. Опухолевые клетки крупные, имеют хорошо выраженную обильную, ШИК-положительную цитоплазму, содержащую эозинофильную зернистость. Ядра светлые, с хорошо выраженными ядрышками. Опухолевые клетки формируют железисто-солидные или выстилают кистозные структуры. На апикальных концах раковых клеток нередко видны булавовидные выпячивания цитоплазмы (рис. 39б). Некоторые опухоли представляют собой пристеночный узел в пределах кисты, выстланной доброкачественным эпителием апокринового типа. В связи с редкостью наблюдений апокринного рака достоверных сведений о его прогнозе не имеется.
Рак с метаплазией представляет собой инфильтрирующий протоковый рак, при котором наблюдаются различные варианты метапластических изменений. К их числу относится эпидермоидная карцинома — исключительно редкая опухоль молочной железы, выявляемая у женщин пожилого возраста. Макроскопически не отличается от обычного протокового инфильтрирующего рака. В отдельных случаях в опухолевом узле можно увидеть центрально расположенную кисту, выполненную роговыми массами. Микроскопически опухоль представляет собой протоковый инфильтрирующий рак с очагами плоскоклеточного строения, величина которых может варьировать в широких пределах. Иногда наряду с очагами высокодифференцированного плоскоклеточного рака можно наблюдать веретеноклеточные плоскоклеточные участки, непосредственно переходящие друг в друга.
В редких случаях в низкодифференцированном протоковом раке выявляются очаги хондроидного, остеоидного и даже гигантоклеточного остеокластоподобного строения.
Судить о прогнозе метапластических карцином молочной железы не представляется возможным из-за малого количества наблюдений.
Липидсекретирующий рак также относится к числу редких гистологических вариантов карцином молочной железы. Он представлен солидными комплексами из крупных клеток с обильной вакуолизированной цитоплазмой, содержащей большое количество липидов (рис. 40), наличие которых следует подтвердить с помощью специальных методов окраски.
Описана, так называемая, карциноидная опухоль молочной железы (инвазивный протоковый рак с эндокринной дифференцировкой). Клиническая и макроскопическая картина при этой гистологической форме рака не отличается от таковой при обычных инфильтрирующих карциномах. Карциноидный синдром не отмечается даже при распространенных формах заболевания. При микроскопическом исследовании определяются солидные гнезда мелких мономорфных клеток, разделенные фиброзными прослойками, лентовидные и розеткоподобные структуры (рис. 41). Клетки этой формы рака содержат аргирофильные гранулы.
Воспалительный рак характеризуется клинической картиной мастита — болезненность, гиперемия, отек кожи молочной железы. При макроскопическом исследовании выявляется протоковый инфильтрирующий рак с выраженным распространенным карциноматозом дермальных лимфатических сосудов (рис. 42). В отдельных случаях клинически определяемая воспалительная карцинома не сопровождается проникновением опухолевых клеток в дермальные лимфатические сосуды. И, наоборот, при распространенном карциноматозе лимфатических сосудов может не быть клинических признаков воспалительной карциномы (так называемая скрытая, «оккультная» — воспалительная карцинома). Выявление комплексов раковых клеток в лимфатических сосудах дермы, вне зависимости от наличия или отсутствия воспалительной реакции, является признаком, значительно ухудшающим прогноз.
Болезнь Педжета соска наиболее часто выявляется у пожилых женшин. Средний возраст больных около 50 лет, т.е. такой же, как и при других формах рака молочной железы. Болезнь Педжета характеризуется экземоподобным поражением соска и протоковым раком молочной железы.
Первым клиническим проявлением болезни служат изменения кожи соска: отек, покраснение, мокнутие; могут появляться корочки или чешуйки, иногда поверхностное изъязвление. В дальнейшем эти изменения могут распространиться на ареолу и даже изредка на окружающую ее кожу. В отличие от экземы, которая протекает волнообразно, с обострениями и ремиссиями, при болезни Педжета ее проявления неуклонно прогрессируют и не реагируют на местное лечение.
При микроскопическом исследовании в эпидермисе соска или ареолы определяются крупные (значительно крупнее эпителия эпидермиса) клетки с выраженной эозинофильной светлой цитоплазмой (клетки Педжета). Ядра таких клеток полиморфны, иногда пикнотизированы. Эти клетки чаше располагаются в глубоких слоях эпидермиса, но могут лежать на разных его уровнях. Клетки Педжета могут лежать отдельно друг от друга, располагаться изолировано или в виде небольших скоплений (рис. 43). Они никогда не проникают в дерму. Такие клетки могут быть обнаружены в выводных протоках и придатках кожи. Иногда в цитоплазме клеток Педжета выявляются гранулы меланина — признак, который может привести к ошибочной диагностике меланомы. Вероятно, меланин перемешается в опухолевые клетки Педжета из близлежащих меланоцитов путем цитокринии.
Иммуногистохимически опухолевые клетки Педжета экспрессируют ЕМА, мембранный антиген глобул молочного жира, СЕА (при использовании поликлональных антител), кератин низкомолекулярной массы и инволюкрин.
В начальной стадии болезни эпидермис представляется мало дезорганизованным и сохраняет типичное подразделение на слои (стратификацию). В дальнейшем эпидермис расширяется, появляются акантотические тяжи. Часто возникают нарушения стратификации разной степени, вплоть до картины, соответствующей тяжелой дисплазии. Иногда появляется клеточный и ядерный полиморфизм, что в сочетании с выраженным нарушением стратификации напоминает карциному in situ.
Зависимости между количеством клеток Педжета и степенью дезорганизации эпидермиса не выявляется. Число клеток Педжета при нарастании дезорганизации эпидермиса в одних случаях может уменьшаться, в других увеличиваться.
Иногда в акантотических тяжах могут возникать полости, ограниченные одним слоем эпителиальных клеток (рис. 44), в результате чего возникают железистоподобные формации.
По мере развития болезни в дерме усиливается лимфоцитарная и плазмоклеточная инфильтрация.
Болезнь Педжета соска почти всегда сочетается с протоковым инфильтрирующим раком молочной железы.
Последний может локализоваться в любом квадранте молочной железы, исходить из средних и даже мелких протоков и не иметь видимой связи с соском или ареолой. Имеются сведения о малочисленных случаях возникновения долькового рака при болезни Педжета соска.
Столь частое сочетание болезни Педжета соска и рака молочной железы дает основание ряду авторов говорить о существовании болезни Педжета молочных желез. При этом выявляемые в эпидермисе клетки Педжета, не будучи раковыми, служат маркером расположенной в глубине ткани молочной железы карциномы. В связи с этим, при обнаружении в эпидермисе соска клеток Педжета необходима мастэктомия, даже если карцинома в молочной железе не выявляется при клиническом обследовании.
В описании макропрепарата и гистологическом заключении должна быть подробно охарактеризована карцинома молочной железы, что является основанием для дальнейшего выбора рационального метода комплексной и комбинированной терапии.
Дата добавления: 2015-05-09 ; Просмотров: 5754 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
FABP7 и HMGCS2 являются новыми маркерами белка для апокринной дифференциации, классифицирующей апокриновую рак груди
Конкурирующие интересы: авторы заявили, что конкурирующих интересов не существует.
Задуманные и разработанные эксперименты: PG JAE JMAM IG. Выполняли эксперименты: PG JAE JMAM MLT IG. Проанализированы данные: PG JAE MLT NH NK IG. Используемые реагенты / материалы / инструменты анализа: MLT NH NK VTW. Написал статью: PG JAE NK VTW MLT JMAM IG.
Апокринная карцинома груди является отличительной злокачественностью с уникальными морфологическими и молекулярными особенностями, обычно характеризующимися тем, что они являются отрицательными для рецепторов эстрогена и прогестерона и поэтому не поддаются выбору для эндокринной терапии. Несмотря на то, что они морфологически отличаются от других поражений молочной железы, в настоящее время для их диагностики в настоящее время не существует стандартных молекулярных критериев. Используя протеомику на основе геля в сочетании с масс-спектрометрией и иммуногистохимией, мы идентифицировали два новых маркера HMGCS2 и FABP7, которые классифицируют весь спектр дифференцировки акрокорона молочной железы от доброкачественной метаплазии и кист до инвазивных стадий. Экспрессия HMGCS2 и FABP7 сильно связана с апокринной дифференцировкой; их экспрессия сохраняется у большинства инвазивных апокринных карцином (IAC), демонстрирующих положительную иммунореактивность в 100% и 78% апокринных карцином, соответственно, по сравнению с неакрокинными опухолями (16,7% и 6,8%). Показано, что ядерная локализация FABP7 в опухолевых клетках связана с более агрессивными стадиями апокринных карцином. Кроме того, при добавлении в панель апокринных биомаркеров, ранее сообщенных нашей группой: 15-PGDH, HMGCR и ACSM1, вместе они обеспечивают подпись, которая может представлять собой золотой молекулярный стандарт для определения апокринового фенотипа в груди. Более того, мы показываем, что сочетание HMGCS2 со стероидным профилем (рецептор HMGCS2 + / рецептор андрогенного рецептора (AR) + / эстрогена (ER) — / прогестерон (PR)) идентифицирует IAC с большей чувствительностью (79%) по сравнению со стероидным профилем (AR + / ER- / PR-) (54%). Мы также представили подробный иммуногистохимический анализ акопных повреждений молочной железы с помощью панели антител против белков, которые соответствуют 10 генам, выбранным из опубликованных транскриптомических сигнатур, которые в настоящее время характеризуют молекулярный апокриновый подтип и показали, что, кроме меланофилина, который сверхэкспрессируется при доброкачественных апокринных поражениях, эти белки не специфичны для морфологической апокриновой дифференцировки в молочной железе.
Авторы подтверждают, что все данные, лежащие в основе выводов, полностью доступны без ограничений. Все соответствующие данные можно найти в документе и его файлах вспомогательной информации.
Апокринная карцинома груди проявляет тот же характер гистологического роста, что и инвазивная протоковая карцинома особого типа, и в настоящее время диагностируется на основании наличия характерной морфологии эпителиальных клеток апокринного типа, наблюдаемой более чем в 90% от массы опухолевых клеток. Эти опухоли представляют собой относительно редкий подтип, составляющий менее 5% всех случаев рака молочной железы [1], [2]. Недавно Dellapasqua и соавторы сообщили о частоте апокриновой карциномы 0,8% после анализа когорты 6971 пациентов с раком молочной железы [3]. Это высокое несоответствие, скорее всего, связано с отсутствием консенсуса по стандартизованным воспроизводимым диагностическим критериям, поскольку существующая классификация злокачественных новообразований в крови в США дает неточное определение апирокральной карциномы молочной железы [4], что вызвало противоречивые и неоднородные выводы в научной литературы с точки зрения точного иммуногистохимического профиля и молекулярной классификации инвазивных апокринных карцином (IAC) [1], [5], [6], [7], [8], [9]. Более того, апокринная дифференциация обнаруживается в нескольких других подтипах опухоли молочной железы, включая папиллярную, микропапиллярную, трубчатую и лобулярную карциному [9]. В дополнение к характерным морфологическим признакам, как правило, IAC обычно имеют выраженный гормональный профиль, являющийся рецептором эстрогена (ER) и рецептором прогестерона (PR), но рецептор андрогенов (AR) положительный [10]. Опять же, следует отметить, что на протяжении многих лет IACs были отмечены как положительные ER в 3,8-60% случаев, PR положительные в 4,8% -40% и AR положительные в 56-100% [1], подчеркивая изменчивость в наблюдалось наблюдение за этими опухолями. Не так много данных относительно клинических исходов этих опухолей, и результаты не достаточно убедительны из-за ограниченного количества образцов, отобранных для анализа [9]. Всестороннее исследование, опубликованное недавно, показало значительно более низкую выживаемость без болезни для чистых IAC по сравнению с инвазивной протоковой карциномой (IDC) [3].
Несколько лет назад было проведено несколько транскриптомических исследований с целью классификации этих типов злокачественности молочной железы на молекулярном уровне. В исследовании профилирования генов, проведенном Перу и соавторами, IACs сгруппированы в базальноподобный подтип карциномы молочной железы [11]. После этого Фермер и его коллеги [12] идентифицировали подмножество опухолей молочной железы, характеризующихся повышенной передачей андрогенов и отличительным профилем экспрессии, который они назвали «молекулярным апокрином», поскольку эти поражения не проявили всех признаков гистопатологии, характерных для классических апокринных карцином. Молекулярно определенные апокринные карциномы включают опухоли, которые имеют некоторые общие характеристики экспрессии с группой HER2 + (ER- / PR- / HER2 +) в классификации Стэнфорда, а также с некоторыми поражениями, которые проявляют признаки базальноподобной / тройной отрицательной группы (высокий класс поражения ER- / PR- / HER2-). Было также показано, что с помощью данных микрочипов можно разделить опухоли молочной железы на 3 основные группы по статусу стероидного гормона: просвет (ER + / AR +), базальный (ER- / AR-) и молекулярный апокрин (ER- / AR +), с определенной ассоциацией между апокринной гистологией и молекулярным апокриновым типом [13]. Наконец, исследование метаанализа, проведенное Сангой и его коллегами [14], показало, что подгруппы, описанные Фермером и Доэном, очень похожи и оба предсказывают молекулярное апокриновое подмножество в других когортах. Однако на сегодняшний день связь между молекулярной апокриновой карциномой молочной железы и гистопатологически определенными апокриновыми опухолями остается сомнительной [15].
С целью разработки молекулярных критериев для воспроизводимости категоризации IAC на уровне белка мы провели систематический протеомический анализ четко определенного набора апокринных карцином, направленных на выявление биомаркеров, которые могут характеризовать и подтипы этих поражений более подробно, а также искать цели, которые могут привести к разработке новых целевых методов лечения и химиопрепаратов [2], [16], [17], [18], [19]. Соответственно, мы идентифицировали ряд маркеров апокриновых белков, которые включают 15-PGDH и ацил-CoA-синтетазу, семейство 1-й цепи семейства ацил-CoA-синтетазы (ACSM1), которые вместе с набором категоризирующих маркеров, которые преимущественно экспрессируются (AR , CD24) или не экспрессировали (bcl-2, GATA-3) с помощью апокринных метапластических поражений при доброкачественных поражениях молочной железы, оказались специфичными как для апокриновой протоковой карциномы in situ (ADCIS), так и для IAC [2], [16], [ 17], [19], [20]. Было показано, что эта апокринная подпись однозначно идентифицирует 13 из 14 ADCIS (92,9%) и 20 из 33 (60,6%) IAC в хорошо охарактеризованном наборе апокринных карцином [2], в котором выставлено более 90% опухолевых клеток цитологические особенности, характерные для апокринных клеток [21]. Здесь мы описываем два дополнительных маркера, связывающий жирные кислоты с жирной кислотой (FABP7) и гидроксиметилглутарил (HMG) -CoA-синтазу 2 (HMGCS2), который в сочетании с маркерами в сигнальной сигнатуре белка, описанной ранее [19], позволил идентифицировать ADCIS и IAC, которые не удались которые будут обнаружены в предыдущих исследованиях. Более того, наши результаты показывают, что HMGCS2, добавленный к сигнатуре рецептора стероидного гормона (ER- / PR- / AR +), идентифицирует апокринные опухоли других подтипов рака молочной железы с большей чувствительностью по сравнению с профилем стероидных рецепторов. Мы также представили подробный анализ иммуногистохимии (IHC) набора белков, соответствующих 10 генам, выбранным из транскриптомических сигнатур, которые в настоящее время характеризуют молекулярный апокриновый подтип [12], [13], [14], [22] для оценки комплементарности эти два подхода.
Чувствительность и специфичность антител являются критическими параметрами при разработке и разработке надежных анализов на основе ИГС для анализа и валидации потенциальных биомаркеров. Чтобы определить, являются ли антитела FABP7 и HMGCS2 достаточно специфичными с точки зрения окрашивания IHC для выявления доброкачественных и злокачественных апокринных поражений [2], [16], мы использовали трехструнную стратегию, разработанную в нашей лаборатории и подробно описанную в другом месте [23]: ( i) анализ потенциальной перекрестной реактивности 2D-вестерн-блоттингом (2D-WB), (ii) валидация масс-спектрометров соответствующих пятен белка, окрашенных серебром, наложенных на 2D-WB и (iii) эксперименты IHC с блокировкой антител с соответствующим белком / эпитоп. Этот подход сочетает в себе внутреннюю чувствительность и клеточное разрешение IHC, со спецификой идентификации 2D-WB и MS, а также общую способность анализа белка протеомики на основе геля [24].
В предыдущих исследованиях мы продемонстрировали сверхэкспрессию FABP7 и HMGCS2 апокриновыми клетками по сравнению с их обычными аналогами эпителиальных клеток груди [2]. Анализ 2D-PAGE / MS / 2D-WB проводили на тканевых лизатах, полученных от шести пациентов, и результаты для одной пары апокриновых кист / нормальных эпителиев показаны на рисунке 1. Как показано, антитело против HMGCS2 обнаружило несколько линий поезда белковые пятна аналогичного Mw (около 57 кДа) (фиг. 1A и C), совместимые с множественными посттрансляционными модификациями белка [25], [26]. Идентичность этих пятен как HMGCS2 была подтверждена MS-анализом (данные не показаны). Антитело, распознающее FABP7, обнаружило одно пятно с Mw ≅15 кДа (рис. 1А и D). Никакие белковые пятна, соответствующие положениям FABP7 и HMGCS2, не были обнаружены на двумерном геле нормальной ткани груди (рисунок 1B). Результаты показывают, что HMGCS2 и FABP7 распознаются соответствующими антителами, и, самое главное, перекрестная реактивность была обнаружена ни для HMGCS2, ни для FABP7 с любым из тысяч белков, разрешенных 2D PAGE, что демонстрирует высокую специфичность для этих антител. Кроме того, чтобы исключить возможность того, что анти-FABP7 может реагировать с некоторыми близкими гомологами из семейства белков FABP [27], мы провели 2D-WB с белковыми экстрактами из нескольких трехкратно отрицательных образцов рака молочной железы, в которых мы ранее наблюдали аберрантную экспрессию из трех других членов семейства белков FABP, а именно FABP3, FABP4 и FABP5 [23]. Как видно на рисунке S1, анти-FABP7 специально распознал только одно пятно, соответствующее FABP7, и перекрестная реактивность не была обнаружена с помощью FABP3, FABP4 или FABP5. Тождества всех белковых пятен определяли с помощью масс-спектрометрического анализа (данные не показаны). Высокая специфичность обоих антител была дополнительно подтверждена экспериментами IHC с блокировкой антител с соответствующим полноразмерным рекомбинантным белком (данные не показаны). Исходя из этих результатов, можно сделать вывод, что антитела против FABP7 и HMGCS2 распознают их родственные антигены с высокой специфичностью и, таким образом, могут быть включены в панель антител, используемых в экспериментах IHC, чтобы отличить тип клеток, которые экспрессируют интересующие белки в гетерогенном клинические образцы.
(А) 2-мерный серебристый гель белкового лизата из апокриновой микроцисты, вырезанной из биопсии опухоли пациента 95 (GrI; ER + / PR + / AR + / HER21 +). Позиции FABP7 и HMGCS2, идентифицированные методом масс-спектрометрии (MS), обозначены синими стрелками. Позиции апокринной дифференциации, маркеры, 15-PGDH и ACSM1, описанные в наших предыдущих исследованиях, обозначены черными стрелками для справки. (B) 2D серебристый окрашенный гель белкового лизата из дальнего нормального (примерно на 3-4 см от массы опухоли) повреждение молочной железы, вырезанное из мастэктомии пациента 121 (GrII; ER + / PR + / AR + / HER22 +). HMGCS2 и FABP7 были идентифицированы MS и обозначены синими стрелками. Показаны позиции HMGCS2, FABP7 (синяя стрелка) и 15-PGDH, и ACSM1 (черные стрелки). Позиции HMGCS2 и FABP7 на двумерном гелевом изображении (B) расположены путем сопоставления соответствующих изображений геля с помощью программного обеспечения PDQUEST. (C и D) 2D-вестерн-блотта лизата белка из той же апокриновой микроцисты, что и в (A), развивается либо с анти-HMGCS2, либо с антителами против FABP7.
Установив строгую специфичность антител, распознающих FABP7 и HMGCS2, мы исследовали их профили экспрессии IHC на последовательных участках поражений с различными формами доброкачественной апокриновой метаплазии. Таким образом, мы оценили процент положительности / отрицательности для HMGCS2 и FABP7 в 2 наборах образцов молочной железы, а именно: незлокачественная ткань молочной железы, рассеченная из областей, прилегающих к опухолям (28 пациентов с различными типами опухолей молочной железы, таблица S1) и 13 доброкачественных апокринных микроцист, полученных после операции (таблица S2). Экспрессия цитоплазматического FABP7 и HMGCS2, а также ядерного FABP7 считалась положительной, когда мы наблюдали более 60% цитоплазматической и более 1% ядерного окрашивания, соответственно. Репрезентативные образцы IHC показаны на рисунке 2. Ячейка и цитоплазматическое окрашивание FABP7 не оценивались независимо из-за ограниченного числа образцов, представленных в каждой группе. Как видно, нормальные концевые протоковые лобулярные единицы и нормальные протоки в областях груди, прилегающих к опухоли, показали положительность для обоих белков ни в просвете, ни в базальных / миоэпителиальных клетках (рис. 2A и B и рис. 2E и F). Однако области с морфологическими признаками апокринной дифференциации проявляли спорадически положительное окрашивание мозаикой (рис. 2C и G соответственно). Наиболее заметно, что апокринные кисты проявляют высокую иммунореактивность как для HMGCS2, так и для FABP7 (рис. 2D и H соответственно). Чтобы подтвердить эти наблюдения и обосновать внутриклеточную локализацию обоих белков, мы исследовали картину экспрессии HMGCS2 и FABP7 в апокринных кистах с помощью двойной иммунофлуоресценции (рис. 3). Как и ожидалось, нормальные эпителиальные клетки молочной железы почти не проявляли признаков окрашивания либо антителом (рис. 3, левая панель). Напротив, поражения с апокринной метаплазией (рис. 3, левая панель) и апокринные кисты (правая панель) были очень положительными для обоих белков. В совокупности эти эксперименты показали преимущественную экспрессию HMGCS2 и FABP7 при доброкачественных поражениях молочной железы, подвергающихся апокринной дифференциации. Кроме того, неапорические плоские кисты (тип II), которые были обнаружены в анализируемых поражениях, были полностью отрицательными как для HMGCS2, так и для FABP7 во всех случаях (данные не показаны).
Секции FFPE нормальных грудных и доброкачественных поражений груди с апокринной дифференциацией, смежными с опухолью, окрашивались антителами против FABP7 (верхняя панель) и HMGCS2 (нижняя панель). (A) и (E) показаны серийные участки нормальной ткани молочной железы. Люминальные и базальные / миоэпителиальные клетки обозначены соответственно красной и черной стрелками. (B) и (F) показаны участки больших нормальных протоков. (C) и (G) показывают серийные разделы повреждений молочной железы с доброкачественной апокриновой дифференцировкой (апокриновый аденоз). Положительные и отрицательные просветные клетки обозначены соответственно черными и зелеными стрелками. (D) и (H) показывают серийные участки повреждений с апокринными кистами. Апокринные кисты с апикальными мордами и нормальными маленькими протоками обозначены черными и зелеными стрелками соответственно. Увеличение: x10. Представительные области для каждого окрашивания показаны с более высоким увеличением (x20). Значения отсечки для FABP7 и HMGCS2 указаны в материалах и методах.
Косвенный двухклеточный иммунофлуоресцентный анализ нормального поражения молочной железы с апокриновой метаплазией (левая панель) и секциями апокринных кист (правая панель) реагировал с FABP7 (подпанели B и F) и HMGCS2 (подпанели C и G). Разделы контрастировали с ядерным пятном DAPI (синий канал). Слияние изображений отображается на подпанелях (D) и (H) соответственно.
На основании оценки IHC мы оценили процент положительности / отрицательности обоих белков в апокринных кистах по сравнению с неакрокинными поражениями и показали, что FABP7 был положительным в 12 из 13 образцов апокринных кист и отрицателен в 22 из 28 неапоринные образцы (92,3% и 78,6% соответственно, р
Чтобы определить, являются ли FABP7 и HMGCS2 исключительно экспрессией апокринной карциномы, мы проанализировали модели экспрессии этих предполагаемых биомаркеров в наборе из 205 неакрокинских опухолей молочной железы: 42 TNBC (21%), 103 Luminal A (50,2%), 17 Luminal B (8,3%) и 43 HER2 + (20,5%), содержащихся в трех коммерчески доступных тканевых микрочипах (BRC1501, 1502 и 1503, Pantomics Inc.) (Рисунок 6, Таблица S5). Частоты положительности для HMGCS2 и FABP7 по сравнению с IAC суммированы на рисунке 6B. В общей сложности положительные результаты FABP7 были обнаружены у 14 из 205 неакроцинных карцином груди (6,79%): 8 из 42 TNBC (19,04%); 1 из 103 подтипов Luminal A (0,97%); ни у одного из 17 Luminal B (0%) и в 5 из 43 HER2 + (11,62%). HMGCS2 был выражен в 1 из 42 TNBC (2,38%); 18 из 101 Luminal A (17,8%); 4 из 17 Luminal B (23,5%) и 11 из 43 HER2 + (25,5%), в общей сложности 34 из 203 неакрокинских карциномов молочной железы (16,7%) (рисунок 6B). Точный тест Фишера подтвердил статистически значимую разницу в частотах HMGCS2 и FABP7 между IAC и Luminal A, Luminal B, HER2 + и TNBC (p
Представительные изображения секций FFPE, иммунизированных антителом против MLPH. (A) нормальные протоки, (B) доброкачественные апокринные кисты (в основном, просвечивающая мембранная иммунореактивность), (C) склерозирующий аденоз с апокринной дифференцировкой, (D) IAC, показывающий положительное иммунное окрашивание в структурах с псевдожинами (цитоплазматическая и люминальная мембранная иммунореактивность) и (E ) IAC с отрицательным иммуноокрашиванием. Увеличение: x20.
Точный диагноз акопической карциномы молочной железы остается спорным, в основном из-за довольно субъективных гистопатологических критериев и отсутствия чувствительных и специфических биомаркеров, которые могут надежно классифицировать этот подтип карциномы молочной железы. Стратегия, которую мы использовали для создания маркеров белка для категоризации ИАК и потенциально используемого в качестве целей для терапии, основана на предположении, что эти поражения возникают из апокринных клеток, которые, в свою очередь, получены из нормальных молочных эпителиальных люминальных клеток, которые подверглись апокринам метаплазия [1], т. е. переход от эпителиальных клеток груди в апокриновый тип клеток пота-железа [2], [19], [28]. Здесь мы сообщаем об анализе экспрессии двух новых предполагаемых белковых биомаркеров, FABP7 и HMGCS2, при поражении молочной железы, подвергающихся апокринной дифференциации: от доброкачественной апокриновой метаплазии до инвазивной апокринической карциномы.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Трижды негативный рак молочной железы – это патология, с агрессивным течением и опасными для жизни осложнениями. Рассмотрим особенности данного вида онкологии и прогноз.
С помощью иммуногистохимического исследования определяют основные раковые рецепторы. Анализ дает информацию о рецепторах эстрогенов (ER), чувствительности к герцептину (her2neu) и рецепторах прогестерона (PR). Большинство опухолей имеют положительный ответ на все три рецептора. Если рак не чувствителен к герцептину (ER0, PR0, her2neu 0-1), то это указывает на ТНРМЖ.
Такой рак относится к отдельной группе заболеваний, так как характеризуется агрессивным течением в сравнении с другими злокачественными поражениями молочной железы. Он имеет специфическое гистологическое строение (базальноподобная форма). В данной группе могут встречаться плоскоклеточная и апокриновая карциномы. ТНРМЖ встречается в 10-20% всех случаев рака. Патологии подвержены женщины, принимающие оральные контрацептивы, пациентки с наследственной предрасположенностью и афроамериканцы.
В большинстве случаев опухоли диагностируют на запущенных стадиях. Онкология проявляется в виде длительного воспалительного процесса. Многие наследственные формы недуга относятся к данной категории. Он имеет разные подтипы и группы, которые позволяют детальнее исследовать механизм его развития и составить эффективный план лечения. Онкология характеризуется негативным прогнозом. Но при своевременной терапии и отсутствии рецидивов в течение пяти лет, прогноз выживаемости такой же, как и при других формах злокачественного поражения молочных желез. Но в 80% случаев болезнь рецидивирует в первые 1-2 года после радикальной терапии.
Согласно медицинской статистике, трижды негативный рак молочной железы довольно распространен на территории нашей страны. Болезнь относится к гетерогенной группе опухолей.
Для диагностики патологии используют код по мкб 10, недуг относится к категории ІІ новообразования.
C50 Злокачественное новообразование молочной железы:
- C50.0 Соска и ареолы.
- C50.1 Центральной части молочной железы.
- C50.2 Верхневнутреннего квадранта молочной железы.
- C50.3 Нижневнутреннего квадранта молочной железы.
- C50.4 Верхненаружного квадранта молочной железы.
- C50.5 Нижненаружного квадранта молочной железы.
- C50.6 Подмышечной задней части молочной железы.
- C50.8 Поражение молочной железы, выходящее за пределы одной и более вышеуказанных локализаций .
- C50.9 Молочной железы неуточнённой части.
Молекулярно-генетическая классификация указывает на четыре группы рака, каждая из которых имеет индивидуальные эпидо-физиологические свойства, типичную клиническую картину и прогноз.
Этиология онкологического поражения молочных желез связана с различными изменениями в организме. Причины могут быть вызваны гормональной перестройкой – климаксом (снижается выработка эстрогенов и прогестерона, яичники переходят в пассивный режим работы), ранней менструацией или нарушениями менструального цикла. Благоприятный фон для развития болезни создает избыток половых гормонов. Беременность, лактация и абортирование, также создают гормональный всплеск, повышая риск развития патологии.
Для полноценной оценки риска учитываются самые важные факторы:
- Ранее менархе и поздняя менопауза
- Поздние первые роды и нерожавшие женщины
- Женщины старше 50 лет
- Раковые заболевания в анамнезе
- Наследственная предрасположенность
- Мутации генов BRCA-1, BRCA-2 и BRCA-3
- Атипическая гиперплазия тканей молочной железы
- Длительное применение пероральных контрацептивов
- Гормонозаместительная терапия
- Различные травмы и повреждения молочных желез
Наличие вышеуказанные факторов не является прямой угрозой рака, но существенно повышает риск его развития. Но и отсутствие данных факторов не является гарантией полного здоровья. Не стоит забывать, что различные доброкачественные поражения груди (фиброзно-кистозная мастопатия, папилломатоз внутрипротоковый, фиброаденоз) создают благоприятный фон для развития опухоли. Конституционное ожирение и облучение грудной клетки при других заболеваниях (онкология легких, поражение лимфатической системы), повышают риск недуга.
Механизм развития трижды негативного рака груди во многом зависит от спровоцировавшей его причины. Патогенез связывают с накоплением негативных клеток, вызывающих рост опухоли. Основным стимулятором роста новообразований считаются остаточные вирусные заболевания. Вирусная клетка, то есть антиген содержит информацию, которая чужда генной структуре человеческого организма. Она вызывает ответную реакцию иммунной системы – выработку антител. Если организм не может выработать антитела и вывести вредоносные клетки из организма, то их накапливание приводит к образованию опухолей.
В процессе диагностики новообразование классифицируют в зависимости от наличия HER2-рецепторов, эстрогеновых и прогестероновых. Если опухоль негативна ко всем трем рецепторам, то рак является трижды негативным. Данная форма считается очень агрессивной, с высоким риском метастазирования и негативным прогнозом выживаемости.
Клинические проявления злокачественного заболевания зависят от факторов, вызвавших недуг и индивидуальных особенностей организма больного. Симптомы трижды негативного рака молочной железы связаны со специфическим гистологическим строением.
Признаки болезни не отличаются от других форм онкологии. Прежде всего, это болезненные ощущения в груди, появление уплотнения плотной консистенции, которое на первых порах безболезненно. С прогрессированием, появляется характерное втягивание соска, выделения кровянистого или гнойного характера, деформация железы.
Рассмотрим основные клинические характеристики ТНРМЖ:
- Редкая встречаемость 10-20% от общего количества злокачественных поражений груди.
- Возраст пациентов 40-60 лет (предменопауза, менопауза).
- Наследственная предрасположенность.
- Появление опухолевидного узла плотной консистенции (безболезненный).
- Воспалительная или воспалительно-инфильтративная форма, которая приводит к ошибочной диагностике с маститом.
- По гистологическому строению опухоль представлена базалоидным раком.
- Раннее метастазирование, появление отдаленных и регионарных метастазов.
- Быстрое и агрессивное прогрессирование.
- Сложное лечение из-за низкой чувствительности к препаратам.
- Частое рецидивирование после радикальной терапии.
Данный симптоматический комплекс существенно облегчает процесс диагностики, что позволяет начать своевременное лечение патологии.
На начальных этапах развития, онкологическое поражение молочной железы никак не проявляет себя. Первые признаки смазаны, что существенно осложняет процесс диагностики и лечения. Новообразование можно заподозрить при появлении таких симптомов, как:
- Небольшое уплотнение плотной консистенции
- Деформация формы соска
- Уплотнение кожи железы из-за ухудшения оттока лимфы
- Отечность
- Выделения из соска
- Над местом поражения кожа приобретает красноватый, воспаленный оттенок
- Увеличение подмышечных лимфоузлов
На начальных порах, уплотнение подвижное и имеет небольшие размеры. Но оно быстро увеличивается и становится болезненным при пальпации. Наличие всех этих признаков позволяет заподозрить рак и пройти медицинское обследование. Очень важно своевременно отреагировать на симптоматику и обратиться за медицинской помощью.

Любая форма онкологии независимо от стадии и места локализации, наносит непоправимый вред здоровью. Последствия перенесенного заболевания очень заметны. Кожные покровы меняют свой внешний вид, из-за химиотерапии и облучения выпадают волосы, нервная система расшатана и истощена. Негативное психологическое последствие оставляет и оперативное лечение рака. Радикальная терапия накладывает отпечаток и на теле пациентке, требуя восстановительной пластики.
Последствия состоят из ряда возможных осложнений и побочных эффектов, которые возникают в процессе роста опухоли, диагностики и терапии. Распространенные осложнения трижды негативного рака груди:
- Сдавливание и разрушение здоровых тканей железы и молочных протоков из-за разрастания опухоли.
- Сильный воспалительный процесс, осложняющий процесс диагностики.
- Метастазирование в близлежащие и отдаленные органы и системы.
- Нарушение лимфооттока из-за удаления подмышечных лимфоузлов вместе с грудью.
- Выпадение волос, сухость и шелушение кожи из-за химиотерапии.

Трижды негативный рак губительно сказывается на организме пациентов. Осложнения зависят от вида выбранного лечения и тяжести онкологии. Это могут быть частые кровотечения из новообразований и воспаление окружающих тканей. Осложнения возникают и при метастазировании опухоли. Так в зоне метастазов возникают переломы костей, плевриты с накоплением жидкости, почечная и печеночная недостаточность.
Оперативное лечение также характеризуется определенными последствиями. Это воспаление послеоперационной поверхности, продолжительная лимфорея, отечность конечностей, длительное заживление раны. Отсутствие лечение или поздняя терапия сулят самыми серьезными осложнениями, которые приводят к летальному исходу. Но даже при своевременной терапии, ТНРМЖ рецидивирует в течение 1-2 лет, вызывая необратимые последствия.

Выявление онкологии основано на клинической симптоматике недуга. Диагностика состоит из нескольких методов, что позволяет достоверно распознать заболевание. Окончательный диагноз ставится только после микроскопического и иммуногистохимического исследования пораженных тканей. Поводом для исследования выступают различные уплотнения и болезненные ощущения в груди.
- Женщине проводят маммографию, то есть рентген молочных желез и при необходимости УЗИ. Это позволяет выявить малейшие изменения в тканях железы.
- На втором этапе пациентке проводят биопсию. Исследование распознает доброкачественный или злокачественный характер новообразования.
- Некоторым пациентам назначают дуктографию, которая представляет собой рентген с введением в протоки рентгеноконтрастного вещества. Данный метод позволяет выявить внутрипротоковые папилломы, которые могут перерождать в рак.
Если результаты вышеописанных методов и симптоматика указывает на онкологию, то проводятся дополнительные исследования. Прежде всего, это УЗИ подмышечных лимфатических узлов для выявления метастазов, рентген и УЗИ брюшной полости и грудной стенки для исключения отдаленного метастазирования.
Проводится исследование крови на онкомаркеры (белки, вырабатываемые опухолью). Для поражения молочной железы это Са 15.3 с пониженной диагностической ценностью. Для выявления трижды негативной формы рака назначают анализ тканей новообразования на рецепторы к гормонам – прогестерон, эстроген, Her2neu. Для своевременного распознавания патологий, рекомендуется проходить плановые осмотры и маммографию.

Диагностика любого заболевания подразумевает лабораторные исследования. Анализы необходимы для определения опухолево-ассоциированных маркеров при дифференциальной диагностике и исследовании в предоперационный период. CA15-3, CEA, Cyfra 21-1 – это маркеры, подтверждающие рак молочной железы.
Особое внимание уделяется цитологии, которую проводят при наличии патологических выделений из соска. С помощью анализов можно выявить папиллярные структуры при внутрипротоковых папилломах и злокачественные раковые клетки. Забор образца ткани для анализа может осуществляться несколькими методами, рассмотрим их:
- Тонкоигольная аспирационная биопсия – это диагностическое и лечебное мероприятие одновременно. Проводится при подозрениях на кисту и при показаниях пневмоцистографии.
- Трепан-биопсия – забор тканей выполняют специальной иглой, что позволяет получить полные гистологические сведения о характере патологии и степени дифференцировки. Для исследования непальпируемых образований, процедуру проводят под УЗИ.
- Хирургическая биопсия – проводится в том случае, если вышеописанные процедуры не подтвердили (исключили) злокачественный процесс.
Для комплексной оценки патологии используют тройной тест. Данный метод представляет собой сочетание лабораторных и инструментальных методов. Заключение делается на основании суммы балов по результатам каждого анализа.
Тонкоигольная аспирационная биопсия
- 3-4 балла – доброкачественное новообразование;
- 5 баллов – неопределенные изменения, требующие дополнительной диагностики;
- 6-9 баллов – злокачественное поражение.

Выявление базальноподобного рака молочной железы подразумевает применение различных методов. Инструментальная диагностика проводится при соответствующих клинических показаниях. Рассмотрим основные инструментальные методы:
- Маммография – используется для дифференциации рака и опухолевидных образований. С ее помощью удается выявить непальпируемые изменения в тканях груди. При отсутствии клинической симптоматики онкологии, ее проводят как скрининговое исследование.
- УЗИ, КТ, МРТ – это вспомогательные методы для обнаружения первичных опухолей, метастазов и оценки состояния лимфатических узлов и внутренних органов.
Кроме вышеописанных методов могут проводить изотопное сканирование. Это исследование необходимо для выявления субклинических метастазов на запущенных стадиях рака.
Поскольку по своей симптоматике трижды негативная онкология груди схожа с другими злокачественными поражениями, то для ее выявления используют множество различных методов. Дифференциальная диагностика проводится с такими заболеваниями, как:
- Дисгормональные нарушения – повышенная плотность, зернистость или дольчатость тканей железы. Симптомы цикличны, усиливаются перед менструацией.
- Фиброаденома – подвижное новообразование с четкими контурами. Для дифференциации с раком проводят УЗИ, тонкоигольную аспирационную биопсию.
- Субареолярный абсцесс – болезненная опухоль под ареолой с гиперемией кожи. Для подтверждения диагноза проводят биопсию и скрининговое обследование.
- Киста – новообразование, болезненно при попытках пальпации. При проведении УЗИ выявляют множественные кистозные очаги.
- Внутрипротоковая папиллома – характеризуется обильными выделениями из протока. Для дифференциации проводят дуктографию и цитологическое исследование.

Для устранения базальноподобной формы злокачественного поражения груди применяют только современные методы и технологии. Лечение трижды негативного рака молочной железы основано на результатах диагностики. Данная форма онкологии входит в отдельную группу, так как она характеризуется агрессивным течением в сравнении с другими видами рака. Такие опухоли отличаются по гистологическому строению, поэтому требуют специфического лечения.
Очень часто ТНРМЖ выявляют на последних стадиях, которые сопровождаются тяжелым воспалительным процессом. Нередко патология является наследственной, может встречаться у пациенток всех возрастов, но чаще всего у носительниц генной мутации BRCA-1 и BRCA-2.
Рассмотрим особенности терапии:
- Не существует единых стандартов лечения негативного рака. Опухоль чувствительная к химиотерапии, которую назначают после радикального удаления железы.
- Если хирургическое лечение невозможно провести, то назначают химию или облучение для уменьшения размеров новообразования.
- Чем лучше опухоль отвечает на химиолечение, тем благоприятнее прогноз на выживаемость.
Если трипл-негативный рак нечувствителен к химиотерапии, то используют новые протоколы, которые подразумевают проведение операции, применение таксанов и антрациклинов. Операция предполагает частичное удаление груди, облучение опухоли, лимфодренаж или полное удаление железы. При рецидивах проводя повторный курс, с препаратами платины (Цисплатин, Карбаплатин), таксанами и кселодами. Такой вид лечения эффективен для пациенток с генной мутацией BRCA.
При выявлении рака молочной железы, опухоль тестируют и классифицируют на основании наличия прогестерон, HER2 и эстроген рецепторов. Если новообразование негативно ко всем трем рецепторам, то это указывает на трижды негативную онкологию. Данная форма считается самой агрессивной, характеризуется высоким уровнем метастазирования и низкой выживаемостью в сравнении с другими формами рака груди.
Схемы для лечения трижды негативного рака молочной железы составляют для каждой пациентки индивидуально. То есть не существует единого стандарта лечения. Но, несмотря на плохой прогноз, рак чувствителен ко многим схемам. Терапия может состоять антрациклин- и таксансодержащих препаратов. На сегодняшний день врачи тестируют альтернативные химиотерапевтические средства: соединения платины, антиангиогенны, ингибиторы топоизомеразы.
Одна из проблем лечения трижды негативного рака в том, что он считается наиболее агрессивной формой онкологии и плохо поддается терапии. Лекарства подбираются на основании результатов лабораторной и инструментальной диагностики. Особенность патологии в том, что она не чувствительна к гормонам прогестерона и эстрогена, не имеет рецепторов HER2. Таргетная терапия, то есть препараты, действующие только на раковые клетки и не затрагивающие здоровые ткани, не используется. Именно по этой причине опухоль имеет плохой прогноз.
Международный протокол лечения ТНРМЖ указывает на эффективность применения медикаментов из группы таксанов. Такие препараты снижают риск рецидивов и улучшают прогноз. Лучшие результаты были получены при использовании препаратов по протоколу Dose-dense. Он предполагает применение цитостатических лекарств каждые две недели с постепенным добавлением медикаментов из группы таксонов по схеме 4 AC (Адриамицина и Цитоксана) + 4 Таксол (таксаны) с перерывом в 2 недели. Продолжительность такой терапии около 4 месяцев.
Если рак поразил лимфатические узлы, то к основной схеме назначают Карбоплатин или Цисплатин. Такое лечение эффективно при наличии генной мутации BRCA1. Если болезнь рецидивирует, то в схему терапии добавляют препараты, предотвращающие или замедляющие развитие клетки, то есть ингибиторы – Икземпра, Кселода, препараты платины и антиметаболиты.
Новое поколение лекарств представлено такими препаратами:
- Бевацизумаб – блокирует разрастание кровеносной сетки новообразования. Так как злокачественные клетки активно размножаются, то нуждаются в постоянном питании. Лекарство уменьшает количество кровеносных сосудов, снижая энергообеспечение тканей опухоли, что приводит к ее уничтожению. Данный препарат зарекомендовал себя в комбинации с Таксолом.
- Нексавар – применяется при положительном ответе на рецепторы фактора роста Her1. Используется только в комбинации с Цисплатином.
- Инипариб – данное средство все еще находится на стадии клинических испытаний. Но согласно исследованиям существенно увеличивает выживаемость.
- Эрибулин – относится к ингибиторам микротрубочек нетаксанового ряда. Зарекомендовал себя в лечении последних стадий ТНРМЖ. Применяется только при наличии специального врачебного разрешения, так как все еще находится на этапе исследований.
Кроме вышеописанных препаратов, для борьбы с трипл негативным раком используется такая инновация, как вакцинация. Данный метод основывается на том, что недуг проще предупредить, чем лечить. Так как очень часто данную форму патологии диагностируют на последних стадиях. Вакцинация может помочь женщинам, которые входят в группы риска. Над разработкой и испытанием вакцины Vx-001 работает компания Vaxon Biotech, которая планирует внедрить препарат к 2020 году.
Лечение злокачественных заболеваний требует комплексного подхода. Народной лечение применяется наравне с классическими методами терапии. Рассмотрим основные методы нетрадиционной терапии:
- Если есть противопоказания к хирургическому лечению, то можно использовать березовый гриб. Растение нужно натереть на терке и настоять в теплой воде 1:5 в течение 2-3 дней. Готовую настойку принимают 2-3 раза в день за 30 минут до приема пищи. Средство можно хранить в холодильнике, но не дольше 4 дней.
- Для уничтожения злокачественных клеток рекомендуется использовать прополис. Из растения готовят мази и настойки, которые замедляют рост новообразования и облегчают симптоматику рака. При использовании данного средство следует знать, если его нагреть выше 50 градусов, то оно потеряет свои лечебные свойства.
- На начальных стадиях можно использовать отвар овса. Для его приготовления стакан растения нужно смешать с литром воды и кипятить в течение 50-60 минут. Такой отвар эффективно выводит из организма токсины, которые образуются во время болезни. Лекарство снабжает ослабленный организм витаминами группы В, А, Е, РР и аминокислотами.
- Из чеснока и лука можно приготовить целебные примочки. К пораженным тканям прикладывают тканевой мешочек с измельченным чесноком и луком. Примочку лучше ставить на ночь, курс лечения 6-7 процедур.
- Для облегчения болезненной симптоматики на больную грудь прикладывают компрессы из дубовой коры. Для приготовления средства смешайте ложку измельченной коры дуба и залейте ее на ночь холодной водой. Утром прокипятите настой, остудите и снова прокипятите. Настой должен отстояться 3-4 часа, после чего из него можно делать компрессы на 20-30 минут.

Для уничтожения раковых клеток применяется множество методов, но особого внимания заслуживает травяная терапия. Лечение травами имеет минимум противопоказаний и побочных эффектов, но при этом благоприятно действует на организм. Для правильного выбора травы и схемы ее применения, необходимо учитывать такие факторы, как:
- Локализация и стадия рака, проведенное лечение.
- Наличие или отсутствие метастазов, их локализация.
- Прохождение химиотерапии или облучения.
- Общее состояние пациентки до первичной терапии и после нее.
От вышеописанных факторов зависит правильный подбор трав и результат такой терапии.
Для уничтожения раковых клеток могут использоваться ядовитые травы. Но их неправильное применение наносит существенный вред не только злокачественным клеткам, но и всему организму. Именно поэтому фитотерапевты рекомендуют применять такие настойки только под врачебным контролем.
- Болиголов – из растения готовят настойку, которая обладает выраженными обезболивающими свойствами. Для ее приготовления используют трехлитровый бутыль. Емкость должна быть заполнена на 1/3 растением и сверху залита водкой. Средство настаивают 2-3 недели, периодически встряхивая банку. В первый день выпивают стакан воды с каплей настойки, на второй две капли и так до 40 капель. После этого дозировку необходимо уменьшить, вернувшись к одной капле. Как правило, для достижения стойких результатов необходимо 2-3 полных круга.
- Аконит джунгарский – возьмите 20г корня растения и залейте 500 мл водки. Смесь нужно настаивать 14 дней, после чего хорошо процедить. Лекарство принимают за 30 минут до еды, разбавляя в стакане с водой. Схема применения схожа с вышеописанной, только концентрацию нужно доводить до 10 капель и в обратном порядке. После перерыва в 2-3 недели, курс повторяют.
- Княжик сибирский (сухой) – растение измельчают и помещают в бутылку из темного стекла, заливая доверху водкой. Смесь настаивают 15 дней в темном, прохладном месте. Готовую настойку принимают по 30-40 капель 3 раза в день, курс терапии 3 месяца.
Кроме ядовитых, для лечения применяют и более безопасные растения:
- Измельчите 500 г корней лопуха, из полученной массы хорошенько отожмите сок. Средство необходимо отстоять и слить осадок, добавить 250 г меда (гречишного) и сок 3 лимонов. Все ингредиенты хорошо перемешиваются и выливаются в сосуд из темного стекла. Средство принимают на ночь по 1 столовой ложке в течение 12 дней.
- Пару горстей молодых вишневых веточек залейте двумя литрами козьего молока. В течение 6 часов средство нужно томить на медленном огне. Лекарство принимают по ½ стакана 2-3 раза в день, между приемами пищи, курс терапии 70 дней.
- Соберите цветы картофеля и высушите их. Из растения готовят настой: 1 ложка цветков заливается 500 мл кипятка и настаивается 3-4 часа. Настой принимают по ½ стакана 3 раза в день до еды. Продолжительность терапии 3 недели.
Лечение одной из самых агрессивных форм онкологии груди довольно длительное и сложное. Гомеопатия используется как дополнительное средство терапии при трижды негативном раке. Опасность болезни в том, что раковые клетки не реагируют на стандартные схемы гормонального и HER2 лечения. Гомеопатические средства изготавливают из растительных компонентов, которые разрушительно действуют на опухоль. Из традиционных гомеопатических препаратов используются такие:
- Alumen – антипсорическое средство продолжительного действия.
- Argentum metallicum – помогает в восстановлении нормального функционирования организма.
- Arsenicum album – паллиативное средство, уменьшающее болезненную симптоматику.
- Arsenicum Iodatum – останавливает рост злокачественных клеток.
- Arsenicum Sulfuratum Flavum – устраняет болезненную симптоматику, восстанавливает нормальный внешний вид железы.
Китайское растительное лечебное средство куркумин, влияет на рост злокачественных клеток. Растение ингибирует экспрессию EGFR, эпидермального фактора роста клеток и замедляет рост опухоли. Эффективными свойствами обладают лекарства из лечебных грибов Ganoderma lucidum, Trametes versicolor и Phellinus linteus. Они снижают рост и размножение клеток и способствуют их гибели.
Хирургическое удаление раковой опухоли молочной железы относится к радикальной терапии. Оперативное лечение может осуществляться несколькими методами. Современная медицина позволяет проводить органосохраняющие операции с высокими результатами.
Рассмотрим основные виды операции:
- Лампэктомия – органосохраняющая операция, в процессе которой удаляется как новообразование, так и прилегающие к нему ткани. Проводится на первых стадиях болезни, после нее пациентке проводят лучевую терапию.
- Квадрантэктомия – в процессе операции удаляют четверть груди с опухолью и проводят облучение.
- Модифицированная радикальная мастэктомия – проводится при метастазировании опухоли в лимфатические узлы. Во время операцию удаляют новообразование и лимфоузлы.
- Сегментэктомия – иссечение опухоли и части здоровых тканей вокруг нее с последующим облучением и химиолечением.
- Радикальная мастэктомия – удаляют не только опухоль и лимфатические узлы, но и мышцы грудной клетки, которые находятся под грудью.
Оперативное лечение может стать причиной побочных эффектов и осложнений. Чаще всего это онемение кожи в области разреза, но при постепенном восстановлении нервов, чувствительность приходит в норму. В некоторых случаях есть риск инфицирования места разреза. Инфекция характеризуется признаками воспаления кожи, то есть ее покраснением, отечностью и болезненностью. В месте поражения наблюдается повышение температуры кожи. Если есть нагноение, то появляется лихорадка, озноб, повышенная потливость. Для его устранения проводится вскрытие раны, ее промывают антисептиком и дренируют. Пациентке назначают курс антибиотиков.
Для предупреждения трижды негативного рака молочной железы используется множество методов. Профилактика основана на раннем обнаружении опухоли. Ежегодно в мире регистрируется около 1 млн. случаев данной болезни. Согласно медицинской статистике 30% женщин с онкологией имеют возраст от 45 лет.
Самообследование как профилактика:
- Ежедневно внимательно осматривайте свои груди, обращая внимание на форму и их симметричность.
- Для выявления различных уплотнений, аккуратно пропальпируйте железы. Поочередно придерживая грудь одной рукой, второй по часовой стрелке прощупывайте.
- Если есть какие-либо уплотнения или припухлости, которые не исчезают после менструации, то это повод обратиться к врачу.
- Обратите внимание на соски, при наличии любых выделений, которые не связаны с лактацией, срочно обратитесь к маммологу. Внимания требует и кожа, если есть припухлости, шелушение или мокнущие участки эрозии, то это также требует врачебной помощи.
Кроме регулярного осмотра, необходимо правильно выбирать нижнее белье. Бюстгальтер не по размеру раздражает молочные железы, нарушает их анатомическое положение. Еще один важный метод профилактики рака – это правильное питание. Это связано с тем, что основная причина онкологии – это свободные радикалы.
В здоровом рационе должно быть много фруктов, овощей, зелени, каш и молочных продуктов. Не стоит забывать и про физическую активность. Регулярные занятия спортом позволяют поддерживать организм в тонусе. Физкультуру назначают как обязательный метод реабилитации после химиолечения или операции. Особое внимание предупреждению рака должны удалять женщины с семейным анамнезом.
Не чувствительный к гормональной и другой классической терапии рак, характеризуется не только агрессивным течением, но и негативным исходом. Прогноз зависит от того на какой стадии патология была обнаружена, от наличия сопутствующих заболеваний и других индивидуальных особенностей организма пациентки.
При своевременной диагностике и лечении, прогноз благоприятный, но существенно ухудшается, если рак обнаружен на последних стадиях и дал метастазы не только в регионарные лимфатические узлы, но и в отдаленные органы и системы.

Тройной негативный рак является самой тяжелой и сложной формой онкологии. Выживаемость зависит от многих факторов. У пациенток с данным диагнозом в 5 раз выше риск метастазирования в другие системы и органы в течение 5 лет, в отличие от других форм онкологии. Чаще всего злокачественные клетки распространяются на такие жизненно важные органы, как легкие и мозг.
Трижды негативный рак молочной железы имеет риск метастатического поражения и рецидивирования в течение 2-5 лет, даже после первичного радикального лечения. Для предупреждения рецидивов и метастаз, пациентке проводят лучевое облучение, радиотерапию или химиолечение. Это повышает шансы на отсутствие рецидивов в течение пяти лет с момента обнаружения болезни. Но большинство женщин с ТНРМЖ получают повторные случаи патологии и раковые опухоли в других органах.
источник
