По данным Всемирной организации здравоохранения, каждый год диагноз «рак молочной железы» слышат полтора миллиона женщин. Как и многие другие заболевания, рак груди «молодеет» — в последние десятилетия он поражает всё более молодых женщин. Диагностика рака молочной железы на ранних стадиях — залог успешного лечения. Это очень опасная болезнь, но она излечима, и методы лечения с каждым годом становятся все совершеннее.
Статистика заболеваемости раком молочной железы в нашей стране тревожная — маммологи выявляют около 50 000 новых случаев ежегодно. Средний возраст пациенток — 59 лет, но это не означает, что более молодые женщины не рискуют. Наоборот, как уже было сказано, эта болезнь все чаще поражает женщин в самом расцвете сил.
Причины развития рака молочной железы врачам пока точно неизвестны, однако очевидно, что ключевую роль здесь играют генетика и экология. Жительницы сельской местности болеют раком груди на 30% реже, чем горожанки.
Однако при диагностике рака груди на ранних стадиях прогноз благоприятный — если рак был обнаружен на первой стадии, выживаемость в течение 5 лет составляет 94%, на второй стадии — 79%.
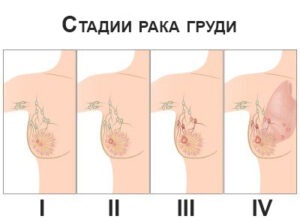
Онкологи выделяют 4 стадии рака молочной железы:
- На первой — опухоль невелика, не превышает 2 см в диаметре, метастазы отсутствуют.
- На второй стадии рака молочной железы размеры опухоли — от 2 до 5 см в диаметре. На этой стадии раковые клетки присутствуют в 4-5 лимфатических узлах.
- Третья стадия рака характеризуется большими размерами опухоли, от 5 см, при этом рак распространяется к основанию органа.
- Четвертая — опасна тем, что опухоль дает метастазы в разные органы, чаще всего — в печень, легкие, кости и головной мозг.
Рак молочной железы составляет 20-25% всех случаев онкологических заболеваний у женщин.
На сегодняшний день существует несколько методов лечения рака груди. Выбор подходящего зависит от многих факторов: размера первичной опухоли, состояния регионарных лимфатических узлов, наличия отдаленных метастазов и рецепторного статуса, то есть чувствительности к гормонам.
При хирургическом вмешательстве главная задача врача — сохранение жизни и здоровья пациентки, даже если это означает утрату молочной железы. Однако сейчас доктора стараются не только удалить опухоль, но и сохранить железу. В тех случаях, когда это невозможно, проводится протезирование груди — обычно пластику проводят через полгода после мастэктомии. Хотя, например, в Израиле реконструкцию молочной железы осуществляют в рамках одной операции: сразу после удаления.
Если размеры опухоли не превышают 25 мм, прибегают к органосохраняющей операции. Нередко удаляют несколько ближайших лимфоузлов, даже если метастазов не найдено — это позволяет предупредить рецидив болезни.
Отметим, что на вооружении у хирургов передовых в лечении онкологии стран уникальные хирургические инструменты. Например, в израильских клиниках с успехом применяется прибор Margin Probe, который, по утверждениям медиков, дает возможность удалить абсолютно все раковые клетки.
Радиотерапия, или лучевая терапия, является частью поддерживающего лечения рака молочной железы, ее назначают женщинам до или после удаления опухоли. Радиотерапия снижает вероятность рецидива рака, убивая клетки опухоли. При лучевой терапии опухоль облучается при помощи мощного рентгеновского или гамма-излучения.
Инновационная методика внутриоперационного облучения. Позволяет избежать послеоперационной радиотерапии и снизить риск рецидивов. Данная процедура проводится во время операции и избавляет женщину от послеоперационного лечения. В отличие от традиционной лучевой терапии, излучение направлено лишь на те области, в которых предположительно находятся раковые клетки. Применение метода позволяет сократить продолжительности лечения на 6 недель, уменьшив при этом риск рецидивов и нанося минимальный вред здоровым тканям.
Химиотерапия, или медикаментозное лечение рака молочной железы, применяется до, после и даже вместо хирургического лечения в тех случаях, когда оно невозможно. Химиотерапия — это введение особых токсинов, воздействующих на клетки опухоли. Курс химиотерапии может продолжаться от 3 до 6 месяцев и обычно начинается сразу же после хирургического вмешательства. Для химиотерапии применяются различные препараты — одни разрушают белки, которые контролируют развитие опухолевых клеток, другие встраиваются в генетический аппарат раковой клетки и вызывают ее гибель, третьи замедляют деление пораженных клеток.
Гормонотерапия бывает эффективна, но лишь в половине случаев, поскольку не все виды рака молочной железы чувствительны к данному лечению.
Или целевая терапия — наиболее щадящий вид лечения рака молочной железы. Препараты для таргетной терапии воздействуют только на пораженные клетки, не затрагивая здоровые, поэтому такая терапия переносится намного лучше.
- Нулевая стадия
Если диагностировать болезнь именно на этом этапе, то шансы выздороветь стремятся к 100%. Для излечения проводят лампэктомию — щадящую операцию, при которой удаляется только само новообразование и небольшая часть прилегающих тканей, хотя в некоторых случаях показано удаление всей железы с последующей пластикой. Однако такой способ лечения применяется реже. После операции показан курс химио-, таргетинговой и гормональной терапии. - Первая стадия
Прогноз также благоприятен: примерно 94–98% пациенток полностью выздоравливают после лампэктомии с последующей химио-, таргетинговой и гормональной терапией. Иногда показан курс радиотерапии. - Вторая стадия
На этой стадии опухоль уже слишком велика, и обойтись лампэктомией, скорее всего, не получится — показано полное удаление молочной железы — мастэктомия с удалением подмышечных лимфоузлов и обязательной последующей лучевой терапией. Стоит сказать, что в зарубежных клиниках, например израильских, к данному методу прибегают лишь в крайних случаях, прилагая все усилия для сохранения груди. - Третья стадия
На этой стадии образуются многочисленные метастазы. Для выздоровления необходимо удалить не только саму опухоль, но и метастазы. Обязательно проводится мастэктомия с удалением лимфоузлов и радиотерапией, а также гормонотерапия, химио- и таргетинговая терапия для уничтожения всех раковых клеток. - Четвертая стадия
Это запущенный рак груди с большим количеством метастазов. Показаны лучевая и химиотерапия, а также оперативное вмешательство, целью которого является не удаление опухоли, а ликвидация опасных для жизни осложнений, а также — в некоторых случаях — гормональная терапия. Вылечить рак полностью на этой стадии практически невозможно, но можно продлить жизнь и улучшить ее качество.
Ранняя диагностика рака груди — залог результативного лечения. В последнее время эта тема часто поднимается в СМИ, что заставляет многих женщин чаще задумываться о своем здоровье и регулярно посещать маммолога.
Конечно, для лечения рака молочной железы можно выбрать и отечественную клинику. Но, к сожалению, далеко не каждая больница располагает современным оборудованием и технологиями. Стоит признать тот факт, что оснащенность отечественных медучреждений далека от идеала, а драгоценное время отнимают огромные очереди.
Но альтернатива есть. Например, в Израиле специалисты в области онкологии добились впечатляющих успехов в борьбе с раком груди. Высококвалифицированные опытные врачи, передовое оборудование и умеренные цены делают Израиль оптимальным направлением для лечения рака.
Конечно, отмена визового режима значительно упрощает выезд в Израиль, однако самостоятельно организовать лечение все же непросто. Зачастую люди приходят в замешательство и не знают, как выбирать клинику, какие документы необходимы и как связаться с нужным специалистом. А потому некоторые клиники, например «Топ Ихилов», готовы сами заняться организацией лечения. Представители медицинского центра «Топ Ихилов» будут сопровождать пациента на всех этапах поездки: помогут с покупкой билетов, займутся решением вопросов проживания, еще до приезда пациента назначат очередь на диагностику и консультации, при необходимости забронируют операционную, организуют операцию и послеоперационное сопровождение. Это, безусловно, помогает сэкономить как время, так и средства. Также до приезда пациента представители «Топ Ихилов» составят программу с описанием и ценами всех диагностических и лечебных процедур, которые могут потребоваться. Помимо этого, сотрудники клиники окажут помощь в приобретении медикаментов, предоставят переводчика, организуют экскурсии и сделают все возможное, чтобы поездка была комфортной.
При повторных визитах будет оказана помощь в организации последующих консультаций, но также возможны скайп-консультации лечащего врача.
источник
Злокачественная опухоль молочной железы возникает за счет мутации и аномально быстрого деления клеток железистой ткани. В отличие от доброкачественного новообразования, раковая опухоль быстро растет и захватывает соседние ткани и органы. Факторами риска возникновения рака груди у женщин являются особенности физиологии (раннее половое созревание, поздняя менопауза), гормональные отклонения, связанные с вмешательством в естественные биологические процессы организма, пожилой возраст. На ранней стадии рака молочной железы лечение в 85-95% случаев оказывается успешным.
Содержание:
- Типы рака груди
- Диагностика рака
- Лечение рака груди
- Хирургическое лечение
- Химиотерапия
- Гормонотерапия
- Таргетная терапия
- Лучевая терапия
Лечение рака молочной железы во многом зависит от его типа и стадии. По месту расположения различают протоковый рак (в млечных протоках) и дольковый (в дольках железы). По направлению развития — инвазивный (прорастает в ткани) и неинвазивный (прорастает в полость протока или дольки). По количеству раковых образований — узловой (единичный) и диффузный (из нескольких узлов).
Разновидностями рака молочной железы являются:
- папиллярный — неинвазивная форма, когда опухоль не выходит за пределы млечного протока;
- медуллярный рак — опухоль большого размера, не выходящая за пределы грудной железы;
- воспалительный рак имеет те же симптомы, что и мастит (повышение температуры, покраснение кожи груди, появление комков в груди);
- при инвазивном протоковом раке (возникает в 70% случаев заболевания раком груди) протоковая опухоль образует метастазы, прорастающие в здоровую жировую и соединительную ткани железы, и распространяется на другие органы (кости, легкие, например);
- рак соска и околососковой области (прорастает в соседние ткани).
Успех лечения рака молочной железы во многом зависит от его инвазивности. С током крови и лимфы раковые клетки разносятся по организму и вызывают появление матастатических опухолей в печени и других органах. На ранних стадиях (предраковые доброкачественные образования, рак 1-2 степени) размеры опухоли невелики, лимфатические узлы она не затрагивает и за пределы железы не выходит.
На 3-5 стадии опухоль достигает 5 см и больше, поражает не только лимфатическую систему, но и другие органы тела.
Выявить уплотнение позволяет осмотр молочных желез и пальпация. Каждая женщина должна минимум 1 раз в месяц проводить самообследование груди для обнаружения изменения формы молочных желез, их асимметричного увеличения, расположения сосков. При появлении выделений из сосков, болезненных ощущений в одной или обеих молочных железах женщина должна обязательно пройти обследование у маммолога. Риск образования раковых опухолей груди повышен у женщин, имеющих заболевания эндокринной системы. Любые гормональные нарушения, связанные с заболеваниями половых органов, использованием гормональных препаратов являются провоцирующими факторами.
После обнаружения уплотнений могут быть назначены следующие виды обследования:
- УЗИ;
- дуктография;
- маммография (рентген молочной железы), в том числе и с внутривенным введением радиоактивного препарата;
- МРТ молочной железы;
- биопсия опухолевой ткани с последующим цитологическим исследованием.
С помощью этих методов устанавливается характер и размеры опухоли, стадия и степень распространения, наличие метастаз.
Основными методами лечения рака молочной железы являются:
- хирургическое удаление опухоли;
- гормонотерапия;
- лучевая терапия;
- химиотерапия;
- таргетная терапия;
- восстановительная пластическая хирургия;
- комбинированное лечение.
Радиоактивное облучение и хирургическое удаление являются способами местного лечения. Химиотерапия и другие методы лекарственной терапии — это способы системного действия, они убивают или останавливают развитие раковых клеток во всем организме.
Этот метод является основным и наиболее эффективным. Проводится частичное или полное удаление молочной железы.
Лампэктомия применяется для удаления пораженного небольшой опухолью (не более 4 см) участка молочной железы. При этом вместе с опухолью удаляются здоровые участки близлежащих тканей. После удаления проводится курс облучения или химиотерапии для уничтожения оставшихся раковых клеток и предотвращения повторного образования опухоли.
Если поражены лимфатические узлы, то производят их удаление. При неинвазивных формах рака узлы стараются сохранить, так как после их удаления у женщины развивается отек рук, ограничение движения в плечевом суставе, боли в груди.
Чтобы определить точно, поражены раком лимфоузлы или нет, во время операции обязательно проводится так называемая «биопсия сторожевого узла«. Для этого вырезается один из подмышечных лимфатических узлов, обследуется на наличие в нем раковых клеток. Если они не обнаружены, остальные лимфоузлы сохраняются. Если же раковые клетки в лимфоузле обнаруживаются, это является свидетельством высокого риска распространения заболевания в другие органы и участки тела.
Обязательно проводится исследование удаленной ткани гистологическим методом для подтверждения раковой природы новообразования.
Секторальная резекция проводится в том случае, когда уплотнение небольшое (размер опухоли обычно 1-2 см) и не распространяется за пределы молочной железы. Делается надрез, пораженный участок удаляется, накладывается внутрикожный шов.
Центральная резекция применяется при множественных внутрипротоковых папилломах. Разрез проходит через все млечные протоки, вырезается здоровая ткань на 2-3 см вокруг опухоли. После такой операции впоследствии женщина не сможет кормить ребенка грудью.
Резекция соска проводится для диагностики рака соска и ареолы вокруг него. При этом затрагивается часть млечных протоков. После заживления в будущем могут возникнуть осложнения с лактацией.
Онкопластическая резекция — это операция частичного удаления пораженной ткани и ближайших к ней здоровых участков с одновременной пластической операцией по восстановлению формы груди. Используется пересадка здоровых тканей, причем, нередко приходится оперировать и вторую грудь для восстановления симметрии сосков и идентичной формы молочных желез. После такой операции обязательно проводится лучевая терапия.
Мастэктомия. Удаляется молочная железа полностью, но лимфатические узлы не затрагиваются. Такая операция проводится при неинвазивных опухолях большого размера, наличии наследственной предрасположенности к раку груди, а также в профилактических целях. С помощью пластической операции можно восстановить железу.
Радикальная мастэктомия. Оперативное лечение рака молочной железы заключается в удалении не только ее самой, но и полном или частичном удалении соседних мышц и жировой ткани. Метод применяется при запущенных стадиях, когда множественные метастазы находятся в лимфатических узлах, пронизывающих эти ткани и мышцы. «Радикальное» удаление подразумевает полное избавление организма от раковых клеток и защиту от возникновения метастаз. Хирургическое удаление обязательно дополняется последующим радиолучевым и химиотерапевтическим лечением рака молочной железы.
Паллиативная мастэктомия. В том случае, когда метастазы уже появились или опухоль настолько обширна, что метастазы неизбежно должны появиться, проводятся операции, назначением которых является облегчение состояния пациентки. Опухоль устраняется частично для уменьшения площади поражения. При этом удаляются наиболее разрушенные или кровоточащие участки тканей. После этого применяется лекарственное лечение, помогающее снять боль, продлить жизнь.
Реконструкция молочной железы. В некоторых случаях после радикальной мастэктомии проводится восстановительная операция по косметической реконструкции молочной железы. Для этого производится пересадка мышц и жировой ткани из области спины на место удаленных грудных мышц.
В большинстве случаев рецидивов рака и появления метастаз после радикального удаления пораженных опухолью молочных желез не наблюдается (рецидив возникает примерно у 18% больных). Причем восстановительные операции не увеличивают вероятность возникновения метастаз.
На продолжительность и качество жизни после таких операций оказывают влияние стадия развития злокачественной опухоли, возраст пациентки и эффективность последующей химиотерапии. Чем больше участок поражения, тем труднее проходит заживление раны после операции. Оно осложняется у больных сахарным диабетом, у страдающих ожирением, а также у курящих женщин.
Для таких больных операции по одновременному удалению и реконструкции молочной железы не проводятся, так как восстановительная пересадка тканей удлиняет и усложняет процесс заживления. Тем самым откладывается последующее лечение методами лучевой и химиотерапии (их проводят только после полного заживления ран).
Лечение рака молочной железы с помощью лекарственных препаратов, убивающих раковые клетки. Лекарства назначаются строго индивидуально, так как выбор препарата зависит от многих факторов, среди которых тип опухоли, степень поражения, характер проведенной операции, орган, где была проведена операция.
Препараты химиотерапии являются сильнейшими аллергенами, вызывают тошноту и сильную рвоту. Они токсичны, влияют на работу сердца, печени, почек и других органов. Поэтому при выборе препаратов учитываются возраст и сопутствующие заболевания. Одновременно с приемом таких препаратов назначаются противоаллергические средства, которые должны приниматься заблаговременно.
Лечение можно проводить амбулаторно или в стационаре. Предпочтительнее проводить его в больнице под постоянным наблюдением врача. Здесь в случае появления рвоты больная может получить квалифицированную помощь, тогда как в домашних условиях ввести противорвотные средства, провести обезболивание в ночное время, как правило, труднее.
Дополнение: Для того чтобы подобрать наиболее подходящий лекарственный препарат, врач может порекомендовать больным провести исследование для определения генотипа опухоли (анализ на биомаркеры). Это позволит определить, к какому типу препаратов наиболее чувствительны клетки опухоли, уточнить индивидуальные противопоказания.
Обычно для излечения требуется 5-7 курсов химиотерапии. С учетом побочных действий и индивидуальной реакции организма проводится также лечение сопутствующих болезней, иначе провести курс полностью не удастся.
Большая часть (около 75%) всех видов злокачественных опухолей молочных желез являются гормонозависимыми. В их клетках имеются рецепторы, чувствительные к действию женских половых гормонов. Воздействуя на эти рецепторы, эстрогены и прогестероны ускоряют рост опухоли. Причем 10% из них чувствительны только к прогестерону, остальные зависят от гормонов обоих видов. Гормонозависимостью объясняется ускорение роста опухоли во время беременности или в разные фазы менструального цикла.
С помощью гормональных препаратов снижается уровень соответствующих гормонов, что приводит к уменьшению размеров опухоли или ее уничтожению. Эффективность гормонотерапии составляет от 10 до 70%.
Гормональная терапия назначается в тех случаях, когда у женщин имеется генетическая предрасположенность к раку молочной железы. Лечение проводится, если биопсия показала аномальный рост клеток какой-либо ткани при мастопатии. Это позволяет предотвратить их злокачественное перерождение.
Гормонотерапия применяется для уменьшения размеров большой опухоли перед проведением операции по ее удалению. Этот метод позволяет снизить риск повторного возникновения опухоли после операции, а также переход неинвазивной формы рака (карциномы) в инвазивную. Гормонотерапия, проведенная после комплексного оперативного, химиотерапевтического, радиолучевого лечения, позволяет защитить организм от распространения метастаз.
Этот метод отличается от химиотерапии и оперативного вмешательства тем, что применяются препараты направленного действия. Они разрушают клетки опухоли, не затрагивая здоровые. Рост опухоли обусловлен изменениями в строении молекул пораженных тканей. Таргетные препараты предотвращают подобные изменения. Этот метод еще называют молекулярной терапией. Его преимуществом является отсутствие побочных эффектов. Он применяется как для профилактики перерождения новообразований в злокачественную форму, так и для лечения метастатического рака молочной железы. Иногда его применяют в комплексе с химиотерапией или радиотерапией.
В отличие от гормонотерапии, этот метод направлен не на регулирование гормонального фона организма, а на подавление рецепторов опухоли, чувствительных к действию гормонов. Существуют препараты, подавляющие выработку ферментов, катализаторов образования эстрогенов в организме, а также стимулирующих иммунные процессы сопротивления самого организма образованию и росту раковых клеток.
Препараты выпускаются в виде таблеток. Они удобны в использовании. Лечение не требует госпитализации, эффективно даже при тяжелых формах рака. Таргетная терапия рассматривается как наиболее перспективный способ лечения рака молочной железы и других органов.
Метод радиоактивного облучения раковых опухолей позволяет на ранней стадии избавиться от них полностью, а на более поздних — существенно увеличить срок жизни пациенток. Особенно важную роль играет такое лечение при неполном удалении железы (органосохраняющих операциях).
Проводится облучение либо самой молочной железы со стороны опухоли, либо лимфатических узлов и мышц в области поражения. В зависимости от характера опухоли проводится наружное облучение или введение радиоактивного препарата в опухоль с помощью катетера.
Такое лечение рака груди не применяется при ряде заболеваний (сердечно-сосудистой недостаточности, анемии, сахарном диабете), а также не используется для лечения повторных опухолей из-за риска возникновения лучевой болезни. Использование современных методик позволяет избежать таких побочных действий, как тошнота и облысение, однако после лечения возможно появление лучевого дерматита, изъязвления кожи, а также болевых ощущений в груди, появления отека руки со стороны облучения, воспаления легкого.
Для наблюдения за ходом лечения рака молочной железы используются сцинтиграфия (рентген) костей грудной клетки и МРТ обследование. Курс облучения длится от 3-4 дней до 3-4 недель в зависимости от вида и стадии опухоли.
источник
В нашей клинике вы можете пройти анализ на выявление мутаций в генах BRCA1 и BRCA2 — данная процедура позволяет диагностировать высокую степень риска рака молочной железы .
Лечение РМЖ на различных стадиях
- У пациенток с операбельной опухолью (I-II стадий) лечение обычно начинается с операции.
- Пациенткам с первично иноперабельной опухолью (III стадии) необходимо проведение на первом этапе химиотерапии или сочетания химиотерапии с лучевой терапией или гормонотерапии. Операция становится возможной при успешном лечении.
- Пациенткам с диссеминированной опухолью (при наличии метастазов в других органах, IV стадии) предлагается проведение лекарственного лечения или сочетания лекарственного лечения с лучевой терапией, а в некоторых случаях – с операцией.
Сергей Михайлович Портной «Методы лечения рака молочной железы».
Рассмотрим основные положения местного и общего лечения не диссеминированного рака. Кратко анализируя эволюцию методов хирургического лечения рака молочной железы на протяжении ХХ века, можно выделить две противоположные тенденции:
- тенденцию к расширению объема операции,
- тенденцию к сокращению объема оперативного вмешательства.
Первая связана со стремлением к повышению радикализма за счет широкого удаления пораженных опухолью тканей и тканей, где такое поражение может быть. Для рака молочной железы характерно распространение по протокам и по лимфатическим сосудам, как в пределах молочной железы, так и за ее пределы в лимфатические узлы. Такое распространение при небольших, казалось бы, ограниченных опухолях, может быть выявлено только при микроскопии удаленной ткани, ни рентгенологически, ни при пальпации оно не выявляется. После лечения, ограниченного только удалением опухоли, закономерно возникали рецидивы рака в молочной железе или в ближайших лимфатических узлах. Именно с этим связано широкое применение операций, при которых полностью удаляется молочная железа и жировая клетчатка, в которой находятся ближайшие лимфатические узлы (радикальная мастэктомия).
Потеря молочной железы после радикального лечения по поводу рака представляет не только физический недостаток, но и является, прежде всего, серьезной психической травмой. Желание удалить опухоль и сохранить молочную железу выразилось в исторически более ранних операциях, так как радикальная мастэктомия была альтернативой таким операциям. Вместе с тем, органосохраняющее лечение, не худшее по результатам, чем радикальная мастэктомия, было разработано сравнительно недавно.
Современное представление о возможности сохранения молочной железы основано на представлении о том, что РМЖ даже 1 стадии к моменту его выявления уже имеет существенную вероятность наличия отдаленных гематогенных микрометастазов и проведение операции самого максимального объема не снижает риска реализации микрометастазов в клинически проявляемые метастазы (B.Fisher). К настоящему времени проведено большое количество рандомизированных исследований, сравнивающих, с одной стороны органосохраняющие операции в сочетании с лучевой терапией и радикальную мастэктомию с другой стороны.
Многолетние наблюдения за тысячами больных показали равноценность выживаемости и, следовательно, — адекватность органосохраняющего лечения. В то же время, органосохраняющие операции не могут применяться при всех формах роста и на всех этапах развития рака молочной железы.
Показаниями к органосохраняющим операциям являются:
- небольшой размер опухоли (не более 3-4 см),
- один очаг опухоли,
- отсутствие распространения опухоли на кожу.
Предположительно существующее микроскопическое распространение опухоли по лимфатическим сосудам и протокам в пределах молочной железы подавляется обязательным последующим облучением.
Объединение современных возможностей онкологии и пластической хирургии позволило разработать целую серию новых одномоментных операций, при которых онкологический этап операции (радикальная мастэктомия, органосохраняющая операция) дополняется реконструкцией молочной железы.
Облучение молочной железы после органосохраняющих операций позволяет добиться такой же низкой частоты развития местных рецидивов, как и после радикальной мастэктомии. Важно отметить, что проведение правильного органосохраняющего лечения не повышает риск развития отдаленных метастазов, вероятность и скорость их появления остается такой же, как и после радикальной мастэктомии. Пресечь или затормозить этот процесс может только системное профилактическое лечение.
Предполагается, что у значительной части больных на раннем этапе развития рака происходит рассеивание опухолевых клеток током крови по тканям организма. Здесь они могут погибнуть, но, если первичная опухоль не удалена, им на смену придут следующие партии клеток, которые могут сформировать микроскопические колонии.
Современные методы выявления метастазов рака молочной железы не идеальны, с их помощью можно выявить очаг поражения тогда, когда он достиг, по крайней мере, 0,5 см в диаметре. После удаления первичной опухоли дальнейшее поведение микрометастазов определяет судьбу больной:
- Если микрометастазов вообще нет или они настолько малы, что их развитие блокируется естественными силами организма, наступает длительное излечение.
- Если микрометастазы малы и растут медленно, рецидив болезни может развиться через десятки лет.
- Наконец, если микрометастазы относительно крупные и быстро растут, они быстро проявят себя.
При раке молочной железы наибольшую опасность представляют микрометастазы опухоли, вероятно, рассеянные по всему организму уже к моменту первого обращения к врачу. Естественно, что чем больше местное распространение опухоли (ее размер, вовлечение в опухолевый процесс регионарных лимфатических узлов, кожи молочной железы, грудной стенки), тем больше вероятность существования микрометастазов. Именно поэтому при местно-распространенном РМЖ (III стадии) часто лечение начинается не с местных воздействий на первичную опухоль, а с общего воздействия, чаще всего — с химиотерапии. Значение лекарственного лечения, предпринимаемого после радикальных операций, также чрезвычайно велико для уничтожения микрометастазов и повышения вероятности длительного выздоровления больных. Причем, чем больше стадия болезни, тем хуже прогноз и тем больше оснований к проведению профилактического системного лечения.
Химиотерапия и эндокринная терапия
Под химиопрепаратами понимаются вещества природного или синтетического происхождения, обладающие способностями убивать опухолевые клетки. Обычно они вводятся в определенных сочетаниях, позволяющих рассчитывать на успех в 50 — 70% случаев. Химиотерапия обычно проводится за несколько (от 4 до 16) курсов, с интервалами отдыха.
Из средств эндокринного лечения наибольшее применение нашли хирургическое удаление яичников, лекарственное выключение функции яичников, а также препараты, являющиеся гормонами, антигормонами, или ингибиторами образования гормонов. Эти лекарства обычно принимаются длительно и непрерывно, цель их применения — препятствовать стимуляции опухолевого роста собственными гормонами организма. Рецепторы эстрогенов (РЭ) и рецепторы прогестерона (РП) – белковые молекулы в клетках опухоли, воспринимающие воздействие соответствующих женских половых гормонов. Наличие этих молекул говорит о гормональной зависимости опухоли и о возможности снижения вероятности рецидива болезни при проведении гормонотерапии.
Рецептор эпидермального фактора роста 2 типа (HER2) – белковая молекула в опухолевой клетке, воспринимающая стимулирующее действие соответствующего фактора роста. Присутствие этого рецептора, с одной стороны, говорит об очень высокой агрессивности опухоли. С другой стороны, это позволяет применять высокоэффективные средства, по своему механизму действия являющиеся антителами к HER2.
Каким образом планировать компоненты профилактического лечения у каждой конкретной больной?
Хорошо аргументированные ответы содержатся в рекомендациях Международной конференции по адъювантной терапии рака молочной железы в Сан-Галлене (2015-2017 гг.). По современным рекомендациям, практически все больные инвазивным раком молочной железы после операции нуждаются в проведении профилактического лекарственного лечения.
Для составления индивидуального прогноза и выбора лечения больной принимаются во внимание:
- возраст,
- размер опухоли,
- степень злокачественности опухоли,
- наличие опухолевых клеток в перитуморальных сосудах,
- экспрессия РЭ, РП, HER2 и Ki67,
- наличие метастазов в лимфатических узлах.
Решение вопроса о предоперационной и послеоперационной лекарственной терапии решается консультантами-химиотерапевтами так же, как и вопрос о лучевой терапии решается консультантами лучевыми терапевтами.
Особенности лечения наследственного РМЖ
Органосохраняющие операции у больных наследственным раком молочной железы имеют значение для лечения существующей на данный момент болезни, но они не защищают от развития последующих опухолей.
В одном из наблюдений сообщается, что частота вторых раков молочной железы у таких больных составила:
- в оперированной молочной железе – 49%,
- в противоположной молочной железе – 42%.
Эти результаты резко отличаются от результатов таких операций в общей популяции, где частота местных рецидивов может составлять 5-10%.
Выполнение двусторонней мастэктомии у женщин носителей мутаций BRCA1 или BRCA2 при раке одной молочной железы более оправдано, такая операция уносит ткань-мишень, в которой могут формироваться новые опухоли; то есть операция имеет и лечебный, и профилактический смысл.
Тактика лечения наследственного РМЖ основывается на анализе общепринятых для РМЖ характеристик:
- возраста,
- соматического состояния,
- репродуктивного статуса,
- распространённости опухоли, её молекулярно-биологического портрета,
- пожеланий пациентки.
Особенностью тактики является возможность проведения одновременных мер по профилактике второго рака. В частности, при планировании хирургического лечения следует иметь ввиду, что, чем больше оставляется железистой ткани, тем больше вероятность развития второй опухоли как в ипсилатеральной, так и в контралатеральной молочной железе.
Отказ от органосохраняющей операции в пользу мастэктомии на стороне болезни и выполнение контралатеральной профилактической мастэктомии снижает вероятность развития второго РМЖ на 90-100%!
Лечение больных наследственным РМЖ направлено на решение следующих задач:
- непосредственное лечение имеющегося заболевания (РМЖ),
- профилактика второго РМЖ,
- профилактика рака яичников (при мутациях генов BRCA1 и BRCA2).
Обширные профилактические операции могут быть непереносимы по соматическому состоянию или по психологической неготовности пациентки. Решение второй и третьей задач может осуществляться одновременно с проведением лечения первичного заболевания или быть отсрочено.
источник
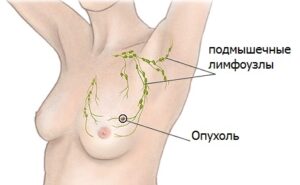
Злокачественная опухоль железистой груди довольно частое явление в современной онкологии. Среди женщин оно встречается от 8 до 11 случаев на 100 человек в возрасте от 12 лет и выше. 1% всех больных – мужчины. Они тоже могут подвергаться такой патологии.
Онкология груди стабильно занимает второе место в популяции таких болезней. Она носит летальный характер и очень опасна для человеческой жизни. Болезнь характеризуется появлением бесконтрольно делящихся клеток, которые способны инвазировать в рядом находящиеся ткани организма человека, давать метастазы. Поэтому лечение рака молочной железы – один из самых актуальных вопросов медицины.
Злокачественные новообразования женской грудной клетки – это многофакторная патология, процесс развития которой связан с изменением совокупности наследственного материала – геномы. Именно они содержат всю биологическую информацию, необходимую для поддержания и построения нормального функционирования организма. Эти клетки могут мутировать под воздействием внешних раздражителей и гормонов, которые регулируют обмен веществ и физиологические функции органов.
- генетическая предрасположенность и наследственность;
- раннее физиологическое развитие девочек и начало менструального цикла до 12-летнего возраста;
- поздняя менопауза, которая припадает на возраст за 55;
- большой вес и как результат – ожирение;
- радиоактивное излучение;
- никотиновая зависимость и злоупотребление спиртными напитками.
К симптомам относят:
- наличие уплотненных участков;
- водянистые и кровяные экскреции соска;
- трансформация контурных линий и цвета груди;
- увеличенные формы лимфатических узлов под мышками;
- болезнь Педжета – предраковое состояние, при котором поражаются соски и ткани вокруг них.
Основными методами установления диагноза становятся:
- внешний осмотр и прощупывание груди на предмет выявления затвердений;
- рентгенография или маммография;
- ультразвуковое обследование;
- биопсия – изучение изъятых больных тканей под микроскопом.
Многие женщины, проанализировав причины, обнаружив симптомы и проведя ощупывание желез, прибегают к лечению народными средствами, а именно травами, примочками, компрессами. Такие действия не имеют эффекта. Веточки рябины, настоянные на козьем молоке, не уничтожат пораженные клетки. А вот проволочка с обращением в медицинское учреждение усугубляет процесс раннего обнаружения аномалии.
Милые женщины! Помните! За долгие годы изучения этой болезни были накоплены колоссальные знания, разработаны новейшие, современные методы терапии. В лабораториях каждый день исследуются новейшие препараты. Благодаря этому онкологам удается полностью локализовать новообразование или же, как минимум, взять его протекание под строгий контроль. Основным фактором успешногоизбавления от заболевания является своевременное обращение за медицинской помощью!
- 0 степень. Небольшая по формам опухоль носит неинвазивный характер. Находится в молочной протоке или в эпителиальном слое самой железы. Не распространяется на лимфатические узлы и не проникает в соседние органы. Обнаруживается при профилактическом осмотре врачом маммологом. Явных симптомов нет. Прогноз нулевой стадии в условиях адекватной терапии – 10-летняя выживаемость в 98% случаев.
- При дуктальной форме (пораженные частички находятся в молочной протоке) предполагает мастэктомию – резекцию молочной железы, более широкое иссечение новообразования и близлежащих слоев эпителия, последующее применение радиотерапии.
- При лобулярной форме (непосредственное поражение мышечной ткани) – систематическое обследование и ведение истории заболевания врачем, рентгенография, употребление томоксифена (или ралоксифена) возрастными дамами в период менопаузы для снижения риска развития метастазов. Реже применяют билатеральную мастэктомию – полное удаление обеих желез.
- 1 степень. Опухоль по размерам достигает двух сантиметров, не распространяется в окружающие органы. 10-летняя выживаемость составляет 94%. Могут применяться органосохраняющие хирургические вмешательства – резекцию очага поражения и близлежащего эпителия с последующими радио и химиотерапиями. Еще при первой стадии применяют мастэктомию – резекцию груди. Используют герцептин, который является блокатором влияния гормонов. Применяется биопсия с целью определения ограниченности распространения раковых клеток.
- 2 степень. Имеет два вида:
- А – размеры опухоли составляют до 2 см, злокачественные клетки распространились в несколько подмышечных лимфатических узлов, или же безинвазивное новообразование до 5 см в диаметре при отсутствии метастазов.
- Б – размеры достигают 5 см и адекватные клетки уже поразили несколько лимфатических узлов. Или же если новообразование более 5 см и отсутствуют метастазы. При второй стадии процент выживаемости составляет от 65 до 85%. Лечение проводится в такой же форме, как и при первой степени поражения, но перед оперативным всешательством проводят химиотерапию.
- 3 степень. Имеет 3 вида:
- А – злокачественное новообразование менее 5 см, но имеются 5–9 инфицированных лимфатических узлов в подмышечной части и значительные по размерам узлы в грудной ткани. 10-летняя выживаемость – 60–70%.
- Б – опухоль проникла в отделы грудной клетки, поразила кожу. Происходит воспаление тканей молочной железы. 10-летняя выживаемость – 20–40%.
- В – новообразованиеь локализовалась в подмышечных и окологрудинных лимфатических узлах. 10-летняя выживаемость едва доходит до 10%.
3 стадия предполагает удаление молочных желез, химиотерапию, применение герцептина – блокатора влияния гормонов. До операции проводятся химиотерапевтические методы, после – радиотерапия.
- 4 степень. Опухоль значительных размеров уже метастазировала в близко лежащие органы. Выживаемость 10 лет – до 5%. При этой степени применяют блокаторы гормонов, или препараты, направленные на снижение работы яичников, так как эти органы содействуют выработке эстрогенов – половых гормонов, способствующих дальнейшему развитию рака. Если метастазирование обнаружено в костях, коже и мозге – назначают радиотерапию. Лечение этой стадии подразумевает снижение болевого симптома, торможение развития заболевания и максимальное продление жизни пациента.

Непосредственное лечение рака молочной железы подразумевает: хирургические операции, химиотерапию, лучевую, иммунную, и таргетную терапии.
Все лечебные мероприятия подразделяются на:
- радикальные – полная резекция первичного очага поражения и регионального разрушения поврежденных лимфатических узлов;
- цитроредуктивные – условно радикальные – уменьшение размеров и локализации опухолевых клеток, снижение риска их интоксикации;
- паллиативные – облегчение общего физического состояния, оттягивание времени смерти пациента от быстрораспадающихся опухолевых ран, от перфорации плевры.
Это разделение условное. Мероприятия, в основных случаях носят комплексный характер. В дополнение можно воспользоваться народными средствами, но должного эффекта они не приносят.
- Лампэктомия– органосохраняющее хирургическое вмешательство. Удаляется опухоль, но большая часть молочной железы остается не затронутой. Такая операция допускается на начальных стадиях заболевания. Но риск рецидивов высок. При повторных случаях грудь удаляют полностью.
- Мастэктомия – полная резекция молочной железы, малой и большой грудной мышц. Но современные методы позволяют при этом сохранить кожу груди и сосок. Это дает эффективный результат при пластике, установке имплантанта и косметической хирургии. Визуальный дефект полностью устраняется.
Современные исследования доказали, что при размерах новообразования до 4 см лампэктомия приносит такой же результат, что и полная резекция.
Женщины редко соглашаются на полное удаление груди. Но это может иметь негативные последствия. Отзывы пациенток, в конечном результате, склоняются к мастэктомии.
Органосохраняющая операция может проводиться только в том случае, когда размер новообразования не превышает 2, 5 см в диаметре. Иногда с целью снижения риска рецидивов и недопущения развития метастаз удаляют и близлежащие лимфатические узлы. Их отсутствие нарушает процесс оттока лимфы, что может привести к появлению отеков, увеличению руки в размерах и частичной неподвижности. Специальные физические упражнения способствуют восстановлению основных двигательных функций руки.
Случаи, при которых приоритетным является полное удаление молочной железы:
- наличие мультифокального поражения, когда два или более злокачественных очага находятся в разных частях железы;
- раннее применение к груди лучевой терапии;
- размер опухоли почти равен размеру груди – полное поражение раковыми клетками;
- пациентка имеет заболевание соединительной ткани – склеродермию, что не позволяет в последствие провести лучевую терапию;
- Страх женщины перед развитием послеоперационных рецидивов и метастазов.
Одновременно с хирургической терапией применяют и другие методы. Если женщина является ярой сторонницей нетрадиционной медицины, то для укрепления общего нормального функционирования организма можно воспользоваться еще и народными средствами.
Ее цель – снижение вероятности проявления рецидивов после операционного вмешательства. Терапия облучением весьма эффективно убивает губительные для организма микроскопические клетки.
- Дистанционное облучение– внешний источник внедрения лучей линейным ускорителем. Такая радиотерапия снижает шансы рецидивов, но не является панацеей в отношении продления жизни пациентов. Облучению поддаются вся молочная железа или вся грудная клетка.
- Брахитерапию – ионизирующее излучение, выпускающее медицинским ускорителем. В этом случае радиоактивное вещество транспортируется непосредственно к источнику злокачественной опухоли.
Лучевая терапия не применяется к запущенным формам рака.
Основные факторы назначения радиотерапии:
- две и более опухоли, расположены в непосредственной близости;
- множественные очаговые поражения;
- микроскопическое повреждение кровеносных сосудов и лимфатических узлов;
- поражение кожи, соска и большой грудной мышцы;
- распространение новообразования за пределы лимфатических узлов.
Обычно дозы химиотерапии достаточно высокие, что гарантирует стопроцентное уничтожение атипичных новообразований. При этом значительный вред может наноситься здоровым тканям. Поэтому рекомендуют проведение 5–7 сеансов с перерывами для восстановления нормальных клеток, способных к регенерации.
Радиотерапия имеет также побочные эффекты:
- Локальные. Формирование лучевых ожогов, повышение ломкости кровеносных сосудов, малоочаговые кровоизлияния.
- Системные. Слабость и быстрая утомляемость, рвота, тошнота, высыпание волос на фоне распада клеток, подвергающихся облучению. Меняется кроветворение, изменяется состав крови, наблюдается ломкость ногтей.
Основные из них:
- Фтораруцил;
- Эпирубицин;
- Циклофосфамид;
- Доксорубицин;
- Метотрексат.
Препараты определяются лечащим врачом в зависимости от множественных факторов. Курс повторяется каждые 4 недели.
Химиотерапия применяется в следующих случаях:
- Для предоперационного уменьшения размера злокачественного образования.
- После хирургического вмешательства с целью уничтожения патологических клеток и небольших метастазов, которые могут стать причиной роста вторичной опухоли.
- Вместо операции при неоперабельности пациента для улучшения качества жизни.
Побочные эффекты носят такой же характер, как и при лучевой терапии. Очень редко, но после применения химиотерапии известны случаи развития бесплодия и наступления ранней менопаузы. В этот период жизнедеятельность организма можно поддерживать народными средствами, которые способствуют общему укреплению иммунной системы.

Выделяют три вида иммунотерапии:
- Активная. Ее цель – повышение активности общих иммунологических реакций с помощью бактериальных вакцин, специфических и неспецифических субклеточных составляющих.
- Пассивная. Введение сыворотки от иммунизированного организма или от больных с регрессирующей опухолью.
- Адаптивная. Заключается в введении аллогенных и ксеногенных лимфоцитов, которые изменяют процентное соотношение зараженных клеток и лимфоцитов, что способствует подавлению злокачественных новообразований.
Она еще носит название биологическая. Это новое веяние в цепочке традиционной терапии раковых заболеваний. И отзывы клиентов о его применении носят перспективный характер. Такое лечение блокирует рост злокачественных новообразований с помощью целевых молекул. Препараты, используемые для этого, являются биофармацевтическими. От предыдущих методов отличается эффективностью, так как наносит наименьший вред здоровым клеткам. В ее основе лежат разработки, воздействующие на молекулярные механизмы, которые отвечают за рост и прогрессию опухоли.
Таргетная терапия нацелена на конкретные белки, гены и ткани новообразования, способствующие ее росту и размножению.
Механизм действия:
- блокировка и отключение сигналов роста и деления агрессивных клеток;
- запуск процессов, которые ведут к естественной гибели злокачественных клеток;
- доставка токсинов непосредственно в клетки с целью их уничтожения.
Такие современные методы способствуют ремиссии рака, исчезновению метастазов, продлению жизни пациентов. Поддержка иммунитета народными средствами при таком лечении не имеет противопоказания.
Лечение рака молочной железы – достаточно длительный и сложный процесс. Он отнимает много сил и энергии, как у больной женщины, так и у ее родных и близких. Поэтому так важно своевременно обнаруживать новообразования еще на ранних стадиях. И ни в коем случае, узнав страшный диагноз, не начинать самолечение народными средствами. Новейшие препараты, высокоэффективная терапия помогут высококвалифицированным докторам приложить максимум усилий, оказать поддержку и необходимую медицинскую помощь каждой женщине! Будьте всегда здоровы!
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Х имиотерапия и гормонотерапия играют существенную роль в комплексном лечении рака молочной железы практически при всех стадиях заболевания. Это объясняется особенностями данной опухоли – даже на ранних стадиях заболевания велик риск существования отдаленных микрометастазов, особенно при наличии факторов риска (поражении подмышечных лимфоузлов, отрицательных рецепторах эстрадиола и прогестерона, гиперэкспрессии Неr–2/neu и т.д.). Применение адъювантной химио– и гормонотерапии значительно улучшило результаты лечения операбельного рака молочной железы. При запущенном раке молочной железы химиотерапия и гормонотерапия являются основными методами лечения, позволяющими значительно продлить жизнь больного и улучшить ее качество. У 10–25% женщин с диссеминированным раком молочной железы возможно достижение полной регрессии опухоли с длительным безрецидивным периодом.
Адъювантная терапия рака молочной железы сегодня представляет собой систему стандартов, эффективность которых доказана в большом числе клинических исследований [1].
До настоящего времени остается четыре независимых прогностических фактора при резектабельном раке молочной железы: поражение регионарных лимфатических узлов, размер первичной опухоли, степень дифференцировки и содержание рецепторов к стероидным гормонам (к эстрогенам – РЭ и к прогестерону – РП).
Стандартами химиотерапии и эндокринной терапии являются: 4 цикла химиотерапии в режиме АЦ (адриамицин + циклофосфан) или АЦФ (адриамицин + циклофосфан + фторурацил) или 6 циклов химиотерапии по схеме ЦМФ (циклофосфан + метотрексат + фторурацил), а также тамоксифен 20 мг в день в течение 5 лет.
Первый фактор, положенный в основу назначения адъювантной терапии – поражение регионарных лимфатических узлов, разделяет всех больных на две группы.
Рак молочной железы без метастазов в регионарные лимфоузлы
Для назначения адъювантной терапии в этой группе необходимо определение групп повышенного риска. Граница для назначения адъювантной лекарственной терапии, что означает группу повышенного риска – снижение пятилетней выживаемости до 95% и менее (табл. 1).
Только в группе низкого риска пятилетняя выживаемость больных составляет более 95%. Во всех остальных группах проведение адъювантной лекарственной терапии улучшает результаты хирургического лечения.
Больным в пременопаузе с умеренным или высоким риском и положительным уровнем эстрогенных рецепторов показана химиотерапия с последующим назначением тамоксифена. При гормононезависимых опухолях показано назначение только химиотерапии.
Больным в постменопаузе с умеренным или высоким риском и положительным уровнем эстрогеновых рецепторов показан прием тамоксифена, а в группе высокого риска – комбинация химиотерапии с тамоксифеном. При отрицательном уровне рецепторов к эстрогенам показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена, а в группе высокого риска возможно дополнительное назначение химиотерапии. С уче– том возраста больных дополнительное назначение химиотерапии должно быть индивидуально обоснованным.
Рак молочной железы с метастазами в регионарные лимфоузлы
У всех больных раком молочной железы с метастазами в регионарные лимфатические узлы применение адъювантной лекарственной терапии улучшает результаты лечения.
При положительном уровне рецепторов к эстрогенам вне зависимости от менструальной функции показана комбинированная адъювантная терапия – химиотерапия и эндокринная терапия тамоксифеном.
При гормононезависимых опухолях показано применение только химиотерапии.
Всем пожилым больным (старше 70 лет) показан прием тамоксифена вне зависимости от уровня эстрогеновых рецепторов. Если уровень рецепторов к эстрогенам отрицательный, возможно дополнительное назначение химиотерапии. С учетом возраста больных дополнительное назначение химиотерапии должно быть индивидуальным.
При всей внешней простоте и схематичности назначения адъювантного лечения лишь методы, доказавшие свою эффективность в результате длительных клинических исследований, применяются для лечения больных. Оптимальная тактика адъювантной терапии постоянно совершенствуется. Совсем недавно химиотерапия рекомендовалась только больным в пременопаузе с метастазами в регионарные лимфатические узлы. В настоящее время только больным с низким риском и пожилым больным с положительными эстрогеновыми рецепторами не показано проведение химиотерапии.
При проведении адъювантной химиотерапии необходимо строго придерживаться оптимального режима (стандартных доз и интервалов между циклами). Неоправданные модификации режимов химиотерапии, несомненно, ухудшают результаты лечения.
Сегодня продолжаются исследования роли выключения функции яичников и рутинное применение данного метода адъювантного лечения нецелесообразно.
Появились данные об эффективности таксанов, как дополнительной химиотерапии к антрациклин–содержащим комбинациям у больных с неблагоприятным про– гнозом.
В связи с широкими исследованиями роли гиперэкспрессии рецептора Her2/neu наметились новые тенденции в оценке прогноза и лечения больных. Однако пока необходимо дополнительное число исследований для изменения практических рекомендаций.
Исследования по адъювантной терапии рака молочной железы интенсивно продолжаются, и можно надеяться, что в ближайшее время все больше и больше женщин будут излечиваться от рака молочной железы.
Неоадъювантная терапия – системное лечение, которое проводится до начала локального лечения (хирургического вмешательства или лучевой терапии).
Задачи неоадъювантной терапии:
- уменьшение размеров первичной опухоли и регионарных метастазов
- уменьшение объема оперативного вмешательства (радикальная резекция вместо радикальной мастэктомии)
- определение чувствительности опухоли к цитостатикам, выявление резистентных случаев с целью использования альтернативных режимов для адъювант– ной химиотерапии
- увеличение общей и безрецидивной выживаемости
- оценка новых режимов лечения по частоте полной клинической и морфологической ремиссии.
Стандартом неоадъювантной химиотерапии по результатам многоцентрового исследования NSABP B–18 признана схема АЦ, при применении которой объективный эффект составил 80%, полная морфологическая ремиссия отмечена у 15% больных.
Предполагалось, что раннее воздействие противоопухолевых лекарств на микрометастазы приведет к увеличению общей и безрецидивной выживаемости. Однако анализ 7 крупных рандомизированных исследований, в том числе NSABP B–18, включившего 1500 женщин с операбельным раком молочной железы, проведенный Wolff [2], не подтвердил эту гипотезу. Продолжительность жизни может быть увеличена только за счет рационального подхода к лечению – использования альтернативных режимов для адъювантной химиотерапии в случае низкой эффективности неоадъювантного лечения.
Продолжается поиск наиболее эффективного режима неоадъювантной химиотерапии. Особенно важным показателем является достижение полной морфологической регрессии опухоли, так как именно этот показатель статистически достоверно коррелирует с ростом общей выживаемости. С этой целью исследуются комбинации, включающие наиболее эффективные препараты, входящие в режимы неоадъювантной химиотерапии в последние годы – цисплатин, навельбин, таксаны. Некоторые авторы показали преимущество комбинаций антрациклинов и таксанов по сравнению со стандартным режимом АС. Разрабатываются новые режимы, включающие препараты, недавно вошедшие в практику химиотерапии, например, кселода и герцептин. Исследуются интенсивные режимы химиотерапии, однако пока не получено достоверных доказательств влияния интенсификации неоадъювантной химиотерапии на отдаленные результаты лечения.
Обсуждается количество курсов неоадъювантной химиотерапии. Признано, что эффект химиотерапии и частота полных регрессий опухоли зависят от количест– ва курсов лечения. Поэтому целесообразно проводить не менее 4 курсов, что безопасно для больных при условии регулярного контроля за динамикой заболевания.
У больных в менопаузе с положительными РЭ и/или РП применяется неоадъювантная гормонотерапия. Объективный эффект гормонотерапии достигает 50–70%. Для неоадъювантной гормонотерапии могут быть рекомендованы тамоксифен, анастразол, летрозол, экземестан.
Диссеминированный рак молочной железы
Для выбора метода лечения перед началом терапии необходимо оценить ряд прогностических факторов, определяющих возможный ответ заболевания на проводимое лечение. Длительный период, прошедший после лечения первичной опухоли до появления отдаленных метастазов, поражение только мягких тканей и костной системы или единичные отграниченные очаги в легких, медленный рост опухоли, удовлетворительное общее состояние больной, пожилой возраст и постменопауза, положительный уровень рецептов эстрадиола и/или прогестерона свидетельствуют о вероятно высокой чувствительности опухоли к гормонотерапии. В случае раннего появления отдаленных метастазов после лечения первичной опухоли, быстрого прогрессирования заболевания, молодого возраста больной, при множественных висцеральных метастазах, наличии лимфангоита кожи или легких лечение необходимо начинать с химиотерапии.
Эффективность гормонотерапии при положительном уровне РЭ и РП достигает 50–70%, снижается при положительных рецепторах одного вида (33%). При отрицательных РЭ и РП существует небольшой процент больных (5–10%), отвечающих на гормонотерапию. Традиционными препаратами, рекомендованными для первой линии гормонотерапии у больных в менопаузе, являются антиэстрогены – тамоксифен и торемифен. В настоящее время в I линии эндокринотерапии альтернативой тамоксифену являются антиароматазные препараты – анастрозол и летрозол. Во II линии эндокринотерапии больных раком молочной железы в менопаузе (при использовании тамоксифена в I линии) в настоящее время вместо прогестинов используются антиароматазные препараты (анастрозол, летрозол, экземестан). Применять прогестины во II линии гормонотерапии считается неэтичным.
У больных в пременопаузе гормонотерапию можно начинать с выключения функции яичников с помощью агониста гонадотропин–рилизинг гормона гипофиза – гозерелина (золадекса), а также хирургическим или лучевым методами.
Эффект гормонотерапии оценивается через 6–8 нед после начала лечения. Положительным ответом считается не только полная или частичная регрессия опухоли, но и длительная стабилизация заболевания (>=6 месяцев). Лечение продолжается до прогрессирования болезни. В случае быстрого прогрессирования болезни после гормонотерапии первой линии следует начать химиотерапию. При прогрессировании после длительного положительного эффекта на фоне первой линии гормонотерапии, а также кратковременной полной или частичной регрессии опухоли начинают гормонотерапию второй линии – ингибиторы (инактиваторы) ароматазы.
Наиболее известные ингибиторы ароматазы – аминоглютетемид (ориметен, мамомит), ингибитор ароматазы первого поколения, стероидный инактиватор ароматазы – экземестан (аромазин) и препараты третьего поколения – летрозол (фемара), анастрозол (аримидекс). Экземестан, летрозол и анастрозол менее токсичны и не требуют заместительной кортикостероидной терапии. Они эффективны и у больных, принимавших ранее аминоглютетемид: если лечение аминоглютетемидом было эффективным, частота ответа составляет 25–33%, если неэффективным – 6–12%. У пременопаузальных больных ингибиторы ароматазы назначаются только после выключения функции яичников, чтобы избежать активизации синтеза эстрогенов в функционирующих яичниках по принципу «обратной связи».
Третья линия гормонотерапии – прогестины – медроксипрогестерона ацетат (фарлутал, провера) и мегестрола ацетат (мегейс). Достаточно редко в наше время в III линии гормонотерапии используются андрогены и у женщин в постменопаузе – эстрогены.
Стандартами I линии химиотерапии рака молочной железы являются схемы: ЦМФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, метотрексат 40 мг/м 2 в/в дни 1,8, фторурацил 600 мг/м 2 в/в дни 1,8, интервал 4 нед), ЦАФ (циклофосфан 100 мг/м 2 внутрь ежедневно дни 1–14, доксорубицин 30 мг/м 2 в/в дни 1,8, фторурацил 500 мг/м 2 в/в дни 1, 8, интервал 4 недели), АЦФ (фторура– цил 500 мг/м 2 , доксорубицин 50 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), ЕЦФ (фторурацил 500 мг/м 2 , эпирубицин 100 мг/м 2 , циклофосфан 500 мг/м 2 каждые 3 нед), АЦ (доксорубицин 60 мг/м 2 , циклофосфан 600 мг/м 2 каждые 3 нед).
Большинство исследователей отдают предпочтение антрациклиновым комбинациям, учитывая более высокий противоопухолевый эффект этих комбинаций по сравнению с ЦMФ. Комбинация ЦМФ чаще используется у пожилых больных, при противопоказаниях к применению антрациклинов.
Высокую эффективность показали комбинации антрациклинов и таксанов – АТ (доксорубицин 50–60 мг/м 2 , паклитаксел 175 мг/м 2 , интервал 3 нед), ЕД (эпирубицин 100 мг/м 2 , доцетаксел 75 мг/м 2 , интервал 3 нед).
Длительность химиотерапии обычно определяется ответом опухоли: после достижения максимального эффекта проводится дополнительно 2 курса ПХТ. Затем предпочтение может быть отдано наблюдению за больным до прогрессирования. При продолжении лечения до прогрессирования увеличивается время до прогресси– рования, однако общая выживаемость не меняется, при этом снижается качество жизни больных.
Ведется поиск эффективных комбинаций для первой линии лечения диссеминированного рака молочной железы, включающих новые препараты, в частности, капецитабин (кселода). Показано, что капецитабин имеет лечебную активность, сходную с ЦМФ.
У больных, имевших прогрессирование после химиотерапии антрациклинсодержащими комбинациями, стандартом дальнейшего лечения являются таксаны (паклитаксел 175 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед, доцетаксел 100 мг/м 2 в/в со стандартной премедикацией 1 раз в 3 нед). В монотерапии у резистентных к антрациклинам больных объективный эффект составляет 41%. В последнее время все более популярным становится еженедельное введение таксанов, при этом увеличивается интенсивность лечения без увеличения токсичности. Эффективны комбинации таксанов с другими препаратами: навельбин 20 мг/м 2 в/в дни 1, 5-й + доцетаксел 75 мг/м 2 в/в со стандартной премедикацией день 1-й, интервал 3 нед; паклитаксел 175 мг/м 2 в/в со стандартной премедикацией день 1-й + фторурацил 1 г/м 2 /день в/в кап. 72–часовая инфузия дни 1, 2, 3-й, интервал 3 нед; кселода 1650 мг/м 2 дни 1–14 + паклитаксел 175 мг/м 2 (или доцетаксел 75 мг/м 2 )1 раз в 3 нед; гемцитабин 1 г/м 2 дни 1, 15-й + паклитаксел 135 мг/м 2 дни 1, 15-й, интервал 4 нед.
Для третьей и последующих линий лечения четких стандартов не разработано. Применяются комбинации препаратов, включающие навельбин, препараты платины (цисплатин, оксалиплатин), антиметаболиты (длительные инфузии фторурацила, гемцитабин, томудекс, кселода). Следует отметить высокую эффективность кселоды у больных во II (объективный ответ у 36% больных) и III (20%) линиях химиотерапии. Препарат может быть рекомендован, как альтернатива таксанам во II линии химиотерапии.
Некоторые режимы, эффективные во II–III линии лечения диссеминированного рака молочной железы: МММ – митомицин 8 мг/м 2 в/в день 1 + митоксантрон 8 мг/м 2 в/в день 1 + метотрексат 30 мг/м 2 в/в день 1; МЕП – митомицин 10 мг/м 2 в/в день 1 + цисплатин 40 мг/м 2 в/в дни 2, 7 + вепезид 100 мг/м 2 в/в дни 3 ,4, 5, интервал 4 нед; цисплатин 80 мг/м 2 в/в день 1 + кселода 2000 мг/м 2 внутрь ежедневно дни 1–14; навельбин 25 мг/м 2 в/в дни 1, 8 + митомицин 7 мг/м 2 в/в день 1, интервал 4 недели; навельбин 20 мг/м 2 в/в дни 1, 15 + цисплатин 80 мг/м 2 в/в день 1, интервал 4 нед; циклофосфан 600 мг/м 2 в/в день 1 + лейковорин 500 мг/м 2 в/в кап. в течение 2 часов + фторурацил 1,5 г/м 2 в/в постоянная 24–часовая инфузия, дни 1, 15, интервал 4 нед; навельбин 25 мг/м 2 в/в дни 1, 8 + томудекс 1 мг/м 2 в/в дни 1, 8, интервал 3 нед.
В 25–30% случаев в опухоли молочной железы отмечается гиперэкспрессия Неr–2/neu, коррелирующая с плохим прогнозом заболевания. У таких больных эф– фективен Герцептин – препарат принципиально нового механизма действия – рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором Неr–2/neu. Герцептин применяется еженедельно, первое введение – 4 мг/кг в/в, последующие – 2 мг/кг. Лечение продолжается до прогрессирования заболевания. Герцептин рекомендуется к применению у больных с гиперэкспрессией Неr–2/neu в комбинации с гормонотерапией и химиотерапией. Добавление герцептина к комбинации АС повысило частоту объективных эффектов с 42 до 60%. При резистентности к антрациклинам комбинация герцептина с таксолом была эффективна у 49% больных (при монотерапии таксолом эффект составил 17%). Изучаются комбинации герцептина с другими цитостатиками, например, с кселодой, навельбином [5].
1. Материалы шестой конференции по адъювантной терапии рака молочной железы, Сан–Галлен Швейцария, 1998 год.
2. A.C.Wolff, N.E. Davidson: Primary systemic therapy in operable breast cancer. J Clin Oncol 18:1558–1569, 2000.
3. C.А. Тюляндин: Химиотерапия диссеминированного рака молочной железы. Практическая онкология, 2, 2000.
источник