Установлено, что лишь 7 % фертильных женщин после лечения рака молочной железы (РМЖ) решаются на рождение ребенка. Некоторые авторы полагают, что иммуносупрессивное и гормональное влияние беременности повышает риск рецидива. Кроме того, женщины опасаются, что дети унаследуют предрасположенность к злокачественным новообразованиям молочной железы. Таким образом, необходимо рассмотреть два основных вопроса:
1) увеличивает ли беременность риск рецидива рака молочной железы (РМЖ);
2) возможно ли излечение от рака молочной железы (РМЖ).
У 30 % женщин моложе 40 лет и у 90 % женщин старше 40 лет после химиотерапии рака молочной железы (РМЖ) наступает аменорея. Женщинам, у которых сохраняется овуляция и есть желание иметь ребенка, рекомендуют предохраняться от беременности в течение 2 лет после лечения рака молочной железы (РМЖ), т. к. рецидивы возникают чаще всего именно в этот период.
В 1985 г. Nugent и O’Connell констатировали плохой прогноз для женщин, у которых беременность наступила в первые 2 года после диагностирования рака молочной железы (РМЖ). Многие исследователи опровергали эту зависимость. Интересно, что женщины, забеременевшие после лечения рака молочной железы (РМЖ), имеют такую же или даже лучшую выживаемость (при одинаковой стадии заболевания).
Gelber и соавт. из International Breast Cancer Study Group обследовали 94 больных, у которых беременность наступила после диагностирования ранних стадий рака молочной железы (РМЖ), и сравнили их с контрольной группой (188 небеременных женщин) по состоянию лимфоузлов, размеру опухоли, возрасту и времени постановки диагноза рака молочной железы (РМЖ). Для беременных 5- и 10-летняя выживаемость составили 92 и 86 % соответственно, в контрольной группе — 85 и 74 % соответственно.
Некоторые авторы полагают, что беременность обладает протективным свойством, другие считают, что беременность не защищает от рецидива, но, во всяком случае, не стимулирует его развитие. Таким образом, беременность безопасна для женщин, за исключением прогрессирующих ЭР-положительных опухолей. Следовательно, нет никаких мотиваций к прерыванию беременности при отсутствии рецидива рака молочной железы (РМЖ). И наоборот, если у больной имеется рецидив, в большинстве случаев необходимо прерывать беременность.
Нормальная беременность ни в коем случае не служит гарантией отсутствия рецидива в будущем. Более того, имеются сообщения о многоплодной беременности, после которой со временем развился рецидив.
Для предупреждения последующих беременностей, которые могут стать причиной гормонально обусловленного рецидива, советуют проводить хирургическую кастрацию у больных на ранних стадиях РМЖ. Овариэктомия также предупреждает развитие рецидива. Но обоснованных аргументов в пользу профилактической кастрации нет. У многих больных химиотерапия (XT) приводит к прекращению продукции яичниками гормонов.
Ранее считали, что беременность после лечения рака молочной железы (РМЖ) не оказывает отрицательного влияния на течение заболевания, поэтому некоторые авторы полагают, что последующие беременности могут обладать протектив-ными свойствами. Принцип удаления яичников на ранних стадиях РМЖ основан на том, что примерно в 1/3 случаев при рецидиве заболевания после кастрации наблюдают частичную или полную временную опухолевую регрессию.
Эти аргументы опровергаются двумя крупными клиническими исследованиями, проведенными в США, которые не выявили значительной пользы от кастрации и адъювантной терапии. В рамках National Surgical Adjuvant Breast Project было проведено рандомизированное клиническое исследование профилактической кастрации в период пременопаузы.
В это исследование было включено 129 кастрированных женщин и 70 женщин контрольной группы. После 10 лет наблюдения преимущество кастрации доказано не было.
источник
Возможно, что хоть раз в своей практике каждый практикующий гинеколог наблюдал беременных пациенток, у которых во время беременности было диагностировано онкологическое заболеваний. Первым желанием любого врача будет рекомендация избавиться от беременности и заняться самым безолагательным лечением злокачественного заболевания. Но все меняется, в том числе и подходы к наблюдению и ведению таких пациенток.
РМЖ и беременность
Вопрос — влияет ли беременность на рост опухоли молочной железы и способствует ли ее распространению — волнует каждого гинеколога. Еще в 1880 г. С. Гросс высказал мнение, что РМЖ, развивающийся на фоне беременности и лактации, отличается быстрым ростом и более выраженным злокачественным течением. С годов прошлого века в литературе начинают появляться более оптимистичные прогнозы относительно течения и отдаленных исходов заболевания у больных данной группы.
По данным зарубежным материалов, на 3000 беременностей приходится 1 случай РМЖ. По данным Т. White, основанным на наблюдении 45 881 женщин, РМЖ развивается на фоне беременности или вскоре после родов у 2,8% обследованных. По другим данным до 7,3% женщин моложе 45 лет, страдающих РМЖ, являются беременными или кормящими.
25% случаев заболевания встречается в возрасте до 45 лет, в активный репродуктивный период, а около 70% случаев РМЖ, связанных с беременностью и лактацией, отмечается в молодом возрасте (данные American Cancer Society).
На сегодняшний день научных и клинических доказательств возникновения опухоли во время беременности de novo нет. Поэтому с большей долей вероятности можно предположить, что онкологический процесс, диагностированный во время беременности, — следствие уже имеющегося скрытого опухолевого процесса в молочной железе, просто ранее не обнаруженного.
Но угроза прогрессирования заболевания во время наступления беременности всегда будет существовать. Многие гинекологи знают, что пациентки, заметившие в начале беременности лишь небольшую по размерам опухоль, через 9 месяцев при отсутствии лечения обращаются к онкологу на поздней стадии. Возможно, подъем уровня половых гормонов во время беременности стимулирует рост уже имеющейся опухоли, которая связана с естественным повышением уровня эстрогенов и прогестерона. Помимо этого, обильное кровоснабжение молочной железы стимулирует развитие опухоли.
25–35% женщин, обнаруживших узел в молочной железе, к врачу не обращаются, списывая это образование на специфические изменения молочных желез при беременности. Следствие этого — поздняя диагностика опухоли.
По частоте встречаемости во время беременности встречаются:
- Рак молочной железы — 50% всех опухолей и опухолевидных образований, выявляемых во время беременности
- Галактоцеле
- Хронический лактационный мастит
Особенностями РМЖ при беременности является быстрая инвазия в окружающие ткани, что ведет к возникновению острых и форм рака, быстрая диссеминация опухолевого процесса, метастатическое поражение лимфатических коллекторов разного уровня, вплоть до надключичных.
Гистологические варианты РМЖ, наблюдаемые у молодых женщин, не зависят от того, беременны они или нет. Наиболее часто у этих женщин наблюдается инвазивный протоковый тип (75–90% наблюдений) [5]. формы встречаются чрезвычайно редко: 1,5–4% наблюдений. Более высокая частота лимфогенных метастазов характерна для РМЖ у молодых женщин, а не для рака в сочетании с беременностью
К моменту установления диагноза средние размеры опухоли колеблются от 5–6 до 15 см, частота распространенных форм — от 72 до 85%, при этом в 20% случаев выявляются метастазы во внутренние органы.
В РОНЦ им. проблемой РМЖ у беременных занимаются с 1972 года. По данным этого учреждения из числа наблюдавшихся беременных и лактирующих женщин 21% к моменту диагностики рака признаны . В 88% процесс оказался местнораспространенным и лишь в 12% — локальным. Наиболее частыми у обследованных в этот период наблюдения оказались маститоподобная, и формы рака. К настоящему времени Центр располагает данными более чем о 200 случаях сочетания РМЖ, ассоциированного с беременностью.
Диагностика РМЖ во время беременности
- Резкое увеличение массы молочной железы во время беременности и лактации. Увеличивающаяся во время беременности молочная железа, изменение ее плотности, могут маскировать опухолевый процесс, и часто ни врач, ни сама женщина не могут представить о таком сочетании беременности и рака.
- Методом обследования женщины при обнаружении узлового образования в молочной железе является УЗИ молочной железы. В 85% случаев оно способно помочь правильно поставить диагноз и своевременно направить женщины к онкологу.
- Маммография может применяться при адекватном экранировании и защите плода в исключительных случаях, а именно если по УЗИ выявляется подозрительный на рак участок, который сливается с гипертрофированными тканями, при отсутствии возможности четко дифференцировать злокачественную опухоль.
- «Соr»-биопсии или эксцизионная биопсия, проводимая под местной анестезией.
- Выявление метастазов — МРТ.
Лечение и ведение пациенток. Необходимость прерывания беременности
Повышение количества эстрогенов в начале беременности, как и увеличение уровня гормонов желтого тела и плаценты во ее половине, стимулируют рост опухоли в молочной железе. Но, несмотря на чувствительность опухолевой ткани к гормональной стимуляции в период беременности и лактации, при сравнении сопоставимых по возрасту и стадии процесса групп больных выживаемость среди беременных и небеременных женщин оказалась одинаковой.
Прерывание беременности с последующим проведением стандартной химиотерапии не улучшает прогноз заболевания. Даже при распространенных формах болезни выборочное прерывание беременности с последующим выключением функции яичников не позволяет существенно улучшить выживаемость. Таким образом, прерывание беременности у женщины, страдающей РМЖ, не является эффективной и адекватной мерой борьбы с заболеванием.
Если же пациентка принимает решение о прерывании беременности, то планирование лечения РМЖ в дальнейшем не отличается от такового у небеременных женщин. Наличие бывшей беременности может учитываться в таком случае как один из факторов неблагоприятного прогноза.
Алгоритм ведения пациентки:
- Совместное решение врачей, пациентки и ее семьи — сохранение или прерывание беременности.
- При решении прервать беременность — лечение начинается немедленно в полном объеме после прерывания беременности.
- При решении сохранения беременности — лечение откладывается до родов. Прогноз неблагоприятный.
В настоящее время есть методики, позволяющие проводить лечение беременных женщин с минимальным влиянием на плод.
1 этап — радикальная мастэктомия. Операция и анестезиологическое пособие во всех триместрах беременности безопасны для матери и для ребенка, не приводят к преждевременным родам, самопроизвольному аборту.
2 этап — химиотерапия и лучевая терапия
Лечение РМЖ в зависимости от триместра беременности
1 триместр — высокий риск развития врожденных уродств плода (10–20%) и самопроизвольных абортов.
2 и 3 триместры — увеличивается частота преждевременных родов, миелосупрессии у матери и плода, кровотечений и инфекций, задержки роста плода, рождения мертвого плода.
Andercen Cancer Center (США) опубликовал свои данные по наблюдению за 54 пациентками с беременностью и РМЖ. Средний срок беременности составлял 22,8 недель (от 10 до 34 недель).
23 (43%) из них получали неоадъювантную ХТ и 85% пациенток амбулаторно получали ХТ по схеме PAC во 2 и 3 триместрах беременности с последующим оперативным лечением.
Оперативное лечение выполнено 56% пациенток на любом сроке беременности.
Лучевая терапия проводилась после родов.
Роды происходили в среднем на 37 неделе.
Состояние детей: Масса тела рожденных детей составляла 2964 г. в среднем.
У 1 ребенка — субарахноидальное кровоизлияние, 1 ребенок — синдром Дауна.
На момент публикации исследования (2005 год) были живы 76% пациенток.
Выводы проведенного исследования:
Оперативное лечение безопасно на любом сроке беременности, проведение химиотерапии целесообразно на 2 и 3 сроках беременности. Лучевая терапия проводится после родов.
- Доксорубицин — менее токсичен по сравнению с другими препаратами в 1 триместре беременности, и относительно безопасен в других сроках беременности. Описано много наблюдений применения доксорубицина во 2 и 3 триместрах без отрицательного влияния на плод.
- Циклофосфан — стоит вторым в ряду после доксорубицина по токсичности, наряду с которым является препаратом выбора для лечения беременных с РМЖ.
- Метотрексат и — наиболее токсичные препараты, но последний все же применяется в схеме PAC.
- Таксаны — мало доступной информации по их применению у беременных.
У беременных ЛТ не применяется ее тератогенных свойств. Пороговой повреждающей дозой для плода в I и II триместрах считается 0,1 Гр; доза от 0,1 до 0,15 Гр приводит к дефектам развития, нарушениям ЦНС, доза 0,5- 1 Гр — к задержке развития, а доза 1–2,5 Гр — к уродствам. В III триместре плод менее чувствителен к лучевым воздействиям, но, тем не менее, от лучевой терапии воздерживаются на протяжении всей беременности.
Поля облучения можно сконцентрировать на МЖ, грудной клетке, подмышечных лимфатических узлах. На протяжении первых 2х недель беременности лучевая терапия может привести к спонтанному аборту. Между 2 и 8 неделями беременности повышается риск пороков развития плода. Лучевая терапия после 8 недель беременности приводит к задержке психосоматического развития новорожденных; на протяжении жизни у них повышается риск развития онкологических заболеваний
Результаты двух рандомизированных исследований показывают, что химиотерапия и лучевая терапия будут эффективными, если проводятся в течение 7 месяцев после хирургического лечения. Если интервал более длительный, адьювантная терапия неэффективна.
Споры о целесообразности проведения профилактической кастрации у пациенток, перенесших РМЖ на фоне беременности, все еще продолжаются. Пока нет достаточных оснований утверждать, что кастрация удлиняет срок безрецидивного течения и предупреждает метастазирование. Есть также мнение, что отдаленные результаты лечения у больных РМЖ, забеременевших впоследствии, лучше, чем у больных, перенесших овариэктомию. Объяснить это можно тем, что только при длительном безрецидивном течении болезни после операции женщина может решиться на новую беременность.
Выбора метода лечения в зависимости от стадии заболевания
- При начальных стадиях (Т1abN0М0) рекомендуется модифицированная радикальная мастэктомия с сохранением обеих грудных мышц с отсроченной реконструкцией. Органосохраняющие операции, требующие послеоперационной лучевой терапии, противопоказаны в I триместре беременности. Лучевая терапия может быть отложена до послеродового периода. Адъювантная химиотерапия при раннем раке (Т1abN0М0) и благоприятных прогностических факторах не рекомендуется, поскольку выживаемость в таких случаях достигает 100%, а рецидивы опухоли не возникают.
- При неблагоприятных факторах прогноза (недифференцированные, анапластические опухоли, отрицательные гормональные рецепторы опухоли) в начальных стадиях рекомендуется (после родов) адъювантная химиотерапия. При положительных рецепторах после химиотерапии назначают антиэстрогены.
- При IIа (Т1N1М0, Т1N1М0, Т2N0М0) — IIb (Т2N1М0, Т3N0М0) стадиях — модифицированная радикальная мастэктомия с отсроченной пластикой является операцией выбора в течение всего срока беременности. При решении пациентки прервать беременность химиотерапию назначают сразу после операции. Секторальная резекция с подмышечной лимфаденэктомией и последующей лучевой терапией предусматривает необходимость прерывания беременности в I триместре. Если беременность сохраняется и на ее фоне выполняется органосохраняющая операция, лучевую терапию следует отложить до послеродового периода.
- Если пациентка информирована о возможном риске для плода и отказывается от лекарственного лечения, после операции дополнительная терапия может быть отсрочена до момента раннего родоразрешения. Тамоксифен при эстрогенположительных рецепторах назначают после завершения беременности и проведения адъювантной химиотерапии.
- При РМЖ в стадии IIIa (М0; ), IIIb (), IIIc (любая TN3M0) и при формах РМЖ, рекомендовано прерывание беременности в качестве этапа лечения. Если же пациентка обратилась к врачу в III триместре беременности и считает (как и ее семья) приоритетом здоровье плода (будущего ребенка), в этом случае лечение начинается после раннего родоразрешения.
В случае полной информированности больной обо всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах предлагается неоадъювантная терапия по схеме АС (адриамицин, циклофосфан). После окончания химиотерапии и выполнения модифицированной радикальной мастэктомии при эстрогенположительных рецепторах назначают гормонотерапию (после родов).
Если у беременной диагностируется распространенный РМЖ с (множественными) отдаленными метастазами, после беседы с родственниками пациентки приоритетной целью становится здоровье плода/ребенка. Выбор метода лечения следует определять индивидуально и предпочтительно консилиумом (хирург, химиотерапевт, специалист по лучевой терапии, психолог) с учетом распространенности опухоли и сроков беременности.
Отсутствуют отдаленные данные о судьбах и здоровье детей, родившихся от матерей с РМЖ во время беременности.
Беременность после лечения РМЖ
Вопрос о повторной беременности после перенесенного РМЖ широко обсуждается в онкологических кругах. Некоторые ученые считают, что требуется категорически запретить последующие беременности, другие считают, что минимальный интервал между лечением и последующей беременностью составляет от 6 месяцев до 5 лет.
Прогноз заболевания
Многочисленные современные исследования свидетельствуют, что в случае одинакового возраста пациенток и одинаковой стадии развития заболевания прогноз не зависит от наличия или отсутствия беременности. По данным французских авторов, разница в продолжительности жизни у пациенток с одинаковой стадией на момент установления диагноза достоверно не отличается от наличия и отсутствия беременности, а также при стадии опухоли N+ и N-. В то же время существует много работ о том, что у беременных женщин рак выявляется впервые в более запущенной стадии, чем вне беременности. Именно запоздалая диагностика объясняет, почему продолжительность жизни без метастазов и показатели пятилетней выживаемости больных хуже при сочетании РМЖ и беременности.
В литературе не описано отрицательного влияния РМЖ на состояние плода. Неизвестны также случаи передачи заболевания плоду. Описано 60 случаев метастазов РМЖ в плаценту без поражения плода. Если на протяжении первого триместра беременности пациенткам не назначалась химиотерапия, частота пороков развития плода идентична таковой в общей популяции и составляет 2–3%.
Проблема РМЖ и беременности является комплексной. Она требует коллективного участия врачей различных специальностей (рентгенологов, генетиков, , онкологов), а также разработки единой программы поэтапного обследования беременных для выявления болезни на максимально ранних сроках.
Целесообразно для решения этой проблемы включить молочных желез в план наблюдения беременной женщины (либо на этапе планирования беременности, либо в I триместре беременности).
Материал подготовила ,
Научный редактор «Академии Амбулаторной Гинекологии»
Журнал «Маммология», №1, 2005.
Газета «Новости медицины и фармации» Маммология (298), 2009
источник
Рак груди уже перестает быть приговором. Многие женщины, столкнувшиеся с этим заболеванием, успешно его побороли. При обнаружении рака молочной железы на ранней стадии его можно полностью вылечить. Однако для каждой женщины, прошедшей курс терапии, остается важным вопрос, сможет ли она выносить и родить ребенка. Ученые и врачи работают над этой проблемой, так как все больше пациенток с раком молочной железы оказываются еще в репродуктивном возрасте.
Сегодня есть все возможности для успешной борьбы с этим опасным заболеванием. Рак молочных желез является самым распространенным видом опухоли среди женщин — более 20% в общей структуре онкологической заболеваемости. Каждый год все большее количество пациенток с неутешительным диагнозом имеют успешные результаты лечения.
Но, к сожалению, данные способы лечения имеют серьезные побочные эффекты. Среди них не только ослабление иммунитета и организма в целом, но и негативное влияние на репродуктивную систему женщины. В результате пациентка становится бесплодна.
Высокотоксичные методы лечения оказывают отрицательное влияние следующим образом:
- угнетаются яйцеклетки;
- повреждается генетический материал половых клеток;
- происходит перестройка гормонального фона.
Все эти нарушения проявляются временным бесплодием, которое после терапии и некоторого срока реабилитации восстанавливается. Иногда наблюдается полная потеря репродуктивной функции. Тем более, что нарушения генетического аппарата половых клеток дают определенный риск развития страшных патологий у плода. Но степень воздействия лучевой и химиотерапии зависит от схемы лечения, размера раковой опухоли, направления и дозы облучения.
В большинстве случаев единственным безопасным способом зачать и родить здорового и полноценного малыша является криоконсервация яйцеклеток до начала противораковой терапии. Даже в случае полной потери репродуктивной способности после лечения рака молочных желез это позволит вырастить эмбрионы и выносить беременность.
Рекомендуем прочитать статью о трубно-перитонеальном бесплодии. Из нее вы узнаете о формах и причинах бесплодия, методах диагностики, консервативных и хирургических методах лечения.
А здесь подробнее о шеечном факторе бесплодия.
Узнав о диагнозе, женщина не сразу задумывается о возможности иметь детей после лечения. Но после прохождения полного обследования и назначения схемы терапии, и даже возможном благоприятном прогнозе возникает вопрос о влиянии лечения на репродуктивную систему. Врач-онколог должен предупредить о вероятных последствиях.
Если женщина планирует в будущем иметь детей, то для сохранения такой возможности нужно заморозить яйцеклетки. У такого метода есть ряд преимуществ.
- Забрать биоматериал можно в естественном цикле овуляции, не прибегая к ее стимуляции гормонами.
- Яйцеклетки еще не повреждены химио-, гормоно- или лучевой терапией.
- Дети, зачатые и рожденные путем криопротокола, ничем не отличаются в развитии от обычных детей.
- Приступить к выращиванию эмбриона и последующей трансплантации в матку можно в любое подходящее время.
- Замороженные яйцеклетки могут храниться в криоконсервации сколько потребуется, известны случаи удачной беременности после 18 лет.
Забор яйцеклеток для заморозки
Такой метод поможет стать родителями даже после страшного диагноза и борьбы с ним. Но пока не существует точных международных установок и правил, по истечению какого срока женщина может начать попытки забеременеть после излечения от рака молочной железы.
Сколько времени понадобится организму, чтобы восстановиться после лечения, ответить трудно. Кроме того, гормональная терапия может проводиться очень долго, в течение нескольких лет. Это может серьезно помешать вынашиванию здорового ребенка. В данный момент проводятся исследования, возможно ли временно прекратить гормонотерапию на период беременности, а затем возобновить.
С другой стороны, мельчайшие частицы раковой опухоли молочной железы могли быть разнесены кровотоком по организму женщины. Эти клетки могут «дремать» всю жизнь и никогда больше не дать о себе знать.
Смотрите на видео о беременности после РМЖ (сохранении фертильности, рисках для матери и плода):
Но беременность – это особенное состояние организма, когда активизируются все процессы в теле. В это время все полностью перестраивается для обеспечения жизнедеятельности матери и плода. Поэтому беременность может стать мощным провоцирующим фактором для рецидива рака молочной железы. Опасность заключается в том, что женщина может не успеть выносить ребенка, загубив две жизни.
Начинать отсчет времени, когда можно делать попытки беременности, нужно после последней терапии. В случае, если была 1 — 2 стадия РМЖ, не давшая метастазы, приступать к зачатию стоит не раньше, чем через пять лет. Если же была 3 стадия, то срок должен увеличиться до 7 — 10 лет, и после терапии должно пройти пять лет устойчивой ремиссии.
Беременность после рака груди требует внимательного наблюдения со стороны врачей. Как было сказано выше, зачатие естественным путем после курса терапии становится почти невозможным или опасным для здоровья будущего ребенка.
Таким образом, более эффективный метод – это экстракорпоральное оплодотворение после криоконсервации яйцеклеток. Данный метод хорош тем, что на организм женщины не будет оказана дополнительная нагрузка в виде гормональной поддержки. Но в некоторых случаях может случаться беременность естественным путем.
Как бы там ни было, дети, рожденные после вылеченного рака молочной железы, не имеют каких-либо патологий, не отстают в развитии, не страдают в будущем от особенных проблем со здоровьем.
В случае беременности после лечения опухоли женщина должна обязательно сообщить врачам о перенесенном заболевании. Соответственно, с определенной периодичностью следует сдавать анализы на биохимию и проводить осмотр молочных желез. В остальном ведение состояния пациентки не отличается от обычного.
Женщинам, забеременевшим после лечения рака молочных желез, важно знать следующее:
- Влияние облучения и химиотерапии на плод предугадать нельзя.
- Компоненты в составе препаратов для лечения рака молочных желез еще не имеют доскональных результатов о долгосрочном влиянии на организм. Более того, многие из них могут сохраняться в крови женщины на протяжении нескольких лет и оказать негативное воздействие на формирование и развитие плода, а также спровоцировать преждевременные роды или выкидыш.
- Риск рецидива на фоне беременности существует, но не является обязательным.
Бывают случаи, когда во время вынашивания ребенка женщина узнает о злокачественной опухоли молочной железы. Как правило, вердикт врачей одинаковый – аборт и немедленное начало лечения. Но иногда пациентка готова пожертвовать своим здоровьем ради рождения ребенка. Тогда ее интересует, сможет ли она и успеет ли выносить его. В этом случае все зависит от того, насколько рак агрессивен и какой срок беременности.
При обнаружении опухоли молочной железы на ранних сроках скорее всего придется сделать аборт. Даже если выявлен рак медленно развивающийся, на 1 — 2 стадии, химиотерапия, облучение оказывают крайне отрицательное воздействие на развитие плода. Все это приведет к выкидышу или уродствам у ребенка. В данном случае сохранение беременности невозможно.
Смотрите на видео о вынашивании беременности при раке:
Также нельзя оставлять вынашивание плода при агрессивном характере рака молочной железы. Дело в том, что женщина может не дожить до момента родов, а ребенок погибнуть.
Если же срок беременности больше 22 — 24 недель, а сама опухоль неагрессивная и пока еще на начальной стадии, то обычно ждут, когда плод достигнет возраста, при котором он уже сможет жить вне тела матери. Женщине выполняют кесарево сечение, недоношенного ребенка помещают в специальный бокс и «выращивают» до необходимого состояния, а матери начинают лечение. В этом случае грудного вскармливания быть не может однозначно.
А здесь подробнее о боровой матке для зачатия и лечения бесплодия.
Беременность после рака молочной железы вполне возможна. Сегодня существуют методики и лекарства, при помощи которых у женщин есть шанс стать матерью даже после такого страшного заболевания. Однако всегда сохраняется риск рецидива и невынашивания ребенка. К беременности после рака груди нужно подходить со всей ответственностью, соблюдая временную дистанцию.
Многие женщины считают, если не кормить грудью, то изменения после беременности будут минимальны. На самом же деле основные превращения с молочными железами происходят еще во время вынашивания малыша.
Миома матки часто обнаруживается у женщин репродуктивного возраста. Случается, что впервые о ней можно узнать только при УЗИ во время беременности или после родов.
Молочные железы станут источником питания для малыша, а к этому им необходимо быть готовыми. И если у беременной болит грудь, признак беременности не должен ее пугать.
Анатомия женской груди. Для того, чтобы оценить, как меняется женская грудь после зачатия, следует представлять себе ее нормальное строение. . Влияние гормонов при беременности на молочные железы.
источник
В современной литературе рак молочной жележы (РМЖ), возникший на фоне беременности, лактации либо в течение первого года после завершения беременности, обозначают термином «РМЖ, ассоциированный с беременностью».
Carcinoma mamma.
КОД ПО МКБ-10
C50 Злокачественное новообразование молочной железы.
В зависимости от анатомической локализации опухоли заболеванию присваивают статистический шифр.
· C50.0 Соска и ареолы.
· C50.1 Центральной части молочной железы.
· C50.2 Верхневнутреннего квадранта молочной железы.
· C50.3 Нижневнутреннего квадранта молочной железы.
· C50.4 Верхненаружного квадранта молочной железы.
· C50.5 Нижненаружного квадранта молочной железы.
· C50.6 Подмышечной задней части молочной железы.
Ежегодно в мире выявляют более 1 млн новых случаев РМЖ, прогнозируя рост числа заболевших к 2010 г. до 1,5 млн.
В России РМЖ занимает первое место по частоте среди всех злокачественных новообразований у женщин. Ежегодно регистрируют более 46 тыс. новых случаев РМЖ. Примерно 1 из 10 женщин на протяжении жизни заболевает РМЖ.
Смертность равна половине заболеваемости РМЖ. В 2002 г. в России от РМЖ умерли 22,1 тыс. женщин, что составило 16,7% среди злокачественных новообразований. Среди всех злокачественных новообразований, выявляемых при беременности, РМЖ занимает второе место по частоте после РШМ. На 3000 беременностей приходится 1 случай РМЖ. Около 3% всех наблюдений РМЖ диагностируют во время беременности. До 7,3% женщин моложе 45 лет, страдающих этим заболеванием, — беременные или кормящие.
Классификация РМЖ, ассоциированного с беременностью, не отличается от таковой у небеременных и основана на клинических проявлениях заболевания. В её основу положены восемь признаков: анатомическая локализация и размер опухоли, объём метастатического поражения лимфатических узлов, наличие отдалённых метастазов, стадия развития опухоли (как вариант комбинации её размера и объёма метастатического поражения), а также клеточный тип, гистопатологический уровень дифференцировки и тип экспрессируемых рецепторов клеток опухоли.
Клиническая классификация первичной опухоли и регионарных лимфатических узлов (Международный противораковый союз, 6-е издание. Перевод и редакция проф. Н.Н. Блинова).
Оценка размеров первичной опухоли (T):
·T0 — нет признаков первичной опухоли;
·TX — оценка первичной опухоли невозможна;
·Tis — карцинома in situ; внутрипротоковая карцинома, дольковая карцинома in situ или поражение соска (болезнь Педжета);
·T1 — опухоль 2 cм или менее в наибольшем измерении;
·T1mic — микроинвазия; опухоль 0,1 см или менее 1 см в наибольшем измерении;
·T1а — опухоль более 0,1 см, но менее 0,5 см в наибольшем измерении;
·T1b — опухоль более 0,5 см, но менее 1 см в наибольшем измерении;
·T1c — опухоль более 1 см, но менее 2 см в наибольшем измерении;
·T2 — опухоль более 2 см, но менее 5 см в наибольшем измерении;
·T3 — опухоль более 5 см в наибольшем измерении;
·T4 — опухоль любого размера, прорастающая грудную стенку и кожу;
·T4а — прорастание грудной стенки;
·T4b — отёк (включая симптом «лимонной» корки) или изъязвление кожи молочной железы;
·T4с — сочетание T4а и T4b;
·T4d — воспалительный РМЖ.
Поражение регионарных лимфатических узлов (N): NX (если лимфатические узлы нельзя исследовать по какойлибо причине), N0 (регионарные лимфатические узлы не пальпируются), N1 (метастазы в ипсилатеральные подмышечные лимфатические узлы, при этом последние подвижны), N2 (метастазы в ипсилатеральные подмышечные лимфатические узлы, которые неподвижно фиксированы друг с другом или с окружающими тканями), N3 (метастазы в надключичные и подключичные лимфатические узлы на стороне поражения, метастазы в окологрудинные лимфатические узлы на стороне поражения).
Отдалённые метастазы (М): MX (наличие отдалённых метастазов оценить невозможно), M0 (отсутствие метастазов), М1 (есть отдалённые метастазы; уточнение их локализации в конкретном органе — лёгком, костях, печени, мозге и т.д.).
Стадии РМЖ:
· 0 (ТisN0M0);
· I (Т1N0M0);
· IIA (T1N1M0,T2N0M0);
· IIB (T2N1M0,T3N0M0);
· IIIA (T1N2M0,T2N2M0,T3N1M0,T3N2M0);
· IIIB (T4N0M0,T4N1M0,T4N2M0);
· IIIC (любая Т N3M0);
· IV (любая Т любая N M1).
На заболеваемость РМЖ оказывает влияние ряд факторов.
· Факторы риска развития РМЖ, связанные с репродуктивной функцией.
— Раннее менархе, поздняя менопауза.
— Нерегулярный менструальный цикл.
— Отсутствие беременностей и родов (риск рака снижается на 7% с каждыми родами).
— Поздняя первая беременность и поздние первые роды. У женщин, имевших поздние первые роды (в возрасте старше 30 лет) или не имевших родов вообще, риск заболеть РМЖ в 2–3 раза выше, чем у родивших до 20 лет.
Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска развития РМЖ. Риск возникновения РМЖ в возрасте до 40 лет в 5,3 раза выше у женщин, родивших в возрасте старше 30 лет по сравнению с родившими до 20 лет.
— Продолжительность лактации менее 1 мес. Отсутствие лактации сопровождается увеличением риска возникновения РМЖ в 1,5 раза. Прослеживается обратная зависимость между общей длительностью лактаций и риском развития РМЖ.
· Наследственные факторы. В 5–10% наблюдений РМЖ связан с мутацией генов BRCA1 и BRCA2, что объясняет семейные случаи заболевания. Риск развития РМЖ у женщин-носителей мутантных генов чрезвычайно высок и составляет 80–95% на протяжении всей жизни. Рожавшие женщиныносители данных мутаций существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем нерожавшие. Ранний возраст первых родов в этой группе не снижает риск развития рака.
·Факторы риска, связанные с заболеваниями молочных желёз и других органов.
— Наличие пролиферативной формы фиброзно-кистозной болезни и различных доброкачественных опухолей молочных желёз (риск возникновения рака увеличивается в 2,3 раза).
— Травмы молочной железы, неоперированные лактационные маститы.
· Генитальные факторы риска.
— Рак эндометрия, рак яичников повышают риск развития РМЖ в 2 раза.
— Некомпенсированное влияние эстрогенов также повышает риск РМЖ. Для женщин, у которых естественная менопауза наступила в возрасте до 45 лет, риск развития РМЖ снижается вдвое по сравнению с теми, у кого менструации продолжаются после 54 лет. Показано достоверное снижение риска возникновения рака у женщин с хирургической кастрацией до 40 лет на 47% по сравнению с группой женщин с естественной менопаузой в 45–54 года, причём наименьшее число опухолей обнаружено при искусственной менопаузе до 35 лет.
— Приём синтетических прогестинов повышают риск развития РМЖ.
· Факторы внешней среды.
— Факторы риска внешней среды и питания (курение, алкоголь, избыточный вес).
— Ионизирующая радиация. В качестве фактора риска имеет наибольшую опасность в возрасте до 30 лет (в период от пременархе до 18 лет). Это одна из причин предпочтительного использования УЗИ, а не рентгенологического метода исследования молочных желёз у молодых женщин.
Этиологические факторы, влияющие на возникновение РМЖ на фоне сущест-вующей беременности, предположительно, не отличаются от таковых в группе небеременных пациенток.
Регуляция нормального функционирования молочной железы происходит под влиянием комплексного взаимодействия между различными гормонами.
Гормональное влияние на развитие РМЖ хорошо известно. Эстрогены и прогестерон могут выполнять роль стимуляторов роста опухоли во время беременности, если злокачественная трансформация уже произошла. Это осуществляется в результате индукции синтеза факторов роста, которые стимулируют пролиферацию эпителиальных клеток молочной железы и тормозят апоптоз (транскрипция фактора роста эндотелия сосудов индуцируется эстрогенами, что может привести к патологической неоваскуляризации); стимуляции клеточного роста за счёт отрицательной обратной связи, согласно которой эстрогены нивелируют эффекты ингибирующих факторов роста.
Известен эффект эстрогенов, вызывающих ускорение роста числа микрометастазов, — стимуляция так называемых спящих метастазов. Прогестерон также поддерживает циклическую пролиферацию молочных желёз в течение беременности, стимулируя рост эпителия. В зависимости от продолжительности воздействия прогестерон может потенциально видоизменять ответ как нормальных, так и раковых клеток молочной железы на различных уровнях.
Гипертрофия, набухание молочных желёз, изменение консистенции, усиленная васкуляризация, а также ряд возможных осложнений (мастит, галактоцеле) затрудняют осмотр и маскируют развивающуюся опухоль во время беременности и лактации.
Наиболее характерной жалобой у 95% больных бывает определение болезненных неоформленных опухолевидных масс в ткани молочной железы, часто сопровождающихся дискомфортом в области соска (болезненность, покалывание, отёчность); изменение состояния всей молочной железы в виде асимметричного набухания и уплотнения; одностороннее увеличение лимфатических узлов. Втяжение соска, наличие кожных симптомов (например, «симптом площадки»), как правило, не отмечают.
Нередко в анамнезе у заболевших раком на фоне беременности есть пролиферативная форма фиброзно-кистозной болезни, а также различные доброкачественные опухоли молочных желёз. В 45–50% случаев пациентки, ранее имевшие беременность, перенесли лечение по поводу лактационного мастита. Нередко пациентки отмечают случаи РМЖ в своей семье. При сборе анамнеза женщины указывают на длительный период наблюдения опухоли. В 82% случаев пациентки самостоятельно выявляют опухоль в I триместре. Треть заболевших на фоне беременности при первом выявлении опухоли не обращаются за врачебной помощью, а при подозрении на злокачественный процесс в 25% случаев отказываются от диагностических мероприятий. С момента появления первых симптомов до
установления диагноза врачом у беременной женщины проходит гораздо больше времени, чем в обычной ситуации (15 и 4 мес соответственно). Поздняя диагностика РМЖ в период беременности приводит к отсрочке начала лечения в среднем на 2–3,5 мес. Установлено, что 1 мес задержки в лечении увеличивает риск метастазирования в подмышечные лимфатические узлы на 0,9%, а задержка в лечении на 6 мес — на 5,1%. По этой причине к моменту установления правильного диагноза заболевание нередко находится в неоперабельной стадии.
Физиологическая гипертрофия (средний вес молочных желёз, равный приблизительно 200 г, удваивается во время беременности до 400 г), изменение консистенции, отёк, усиленная васкуляризация затрудняют осмотр. Стандартное пальпаторное исследование малоэффективно и в большинстве случаев, особенно на поздних сроках гестации, не позволяет дифференцировать опухоль.
Клинический и биохимический анализы крови больных с РМЖ, ассоциированном с беременностью, не отличаются от таковых у здоровых беременных. Изменение биохимических показателей крови, косвенно указывающих на возможное метастазирование РМЖ в кости или в печень, при беременности не характерно. Так, активность ЩФ при беременности физиологически может увеличиваться от 2 до 4 раз; АЛТ, АСТ, лактатдегидрогеназа обычно находятся на уровне, соответствующем сроку беременности. Уровень половых гормонов и пролактина у больных с РМЖ также соответствует срокам беременности.
Рентгенологическое исследование (маммография) ассоциируется с негативным влиянием на плод. Тем не менее, при адекватном экранировании и защите плода в ряде случаев этот метод диагностики можно проводить. Так, рентгенография в передней и боковой проекции воздействует на плод в дозе только 0,4–0,5 мрад (0,004–0,005 Гр) при доказанной повреждающей дозе, равной 0,05–0,1 Гр. Однако маммография при беременности существенного диагностического значения не имеет и в 25% случаев даёт ложноотрицательную картину — тень опухоли сливается с гипертрофированной железистой тканью (рис. 50-1, см. цв. вклейку). Если удалось визуализировать участок уплотнения (симптом затемнения) в двух проекциях, можно говорить об объёмном процессе. Высокоинтенсивное затемнение неправильной формы, нечёткость контура, наличие микрокальцинатов не позволяют исключить злокачественный процесс. Однако в большинстве случаев чётко определить размеры и структуру опухоли весьма затруднительно.
Рис. 50-1. Рентгенограмма молочной железы в прямой проекции. Рак молочной железы. Беременность 24 нед.
Опухоль чётко не определяется.
УЗИ (ультрасонография) — метод, наиболее рекомендуемый для диагностики рака у беременных и кормящих женщин. С помощью стандартного УЗИ возможно выполнить цветовую и энергетическую допплерографию, количественную оценку скорости кровотока в визуализируемых сосудах. В 97% случаев метод УЗИ позволяет провести дифференциальную диагностику кистозных образований с солидными (рис. 50-2, см. цв. вклейку). При сонографии РМЖ представляет собой гипоэхогенное образование (тёмносерые оттенки на экране), неправильной формы без чётких контуров, неоднородной структуры, с гиперваскуляризацией
Рис. 50-2. Сонограмма молочной железы. Пациентка, 23 года. Беременность 11 нед. Фиброаденома.
МРТ можно применять во время беременности, так как данный метод не несёт радиоактивного компонента. Тем не менее, контрастный препарат гадобутрол не рекомендуется использовать при беременности за исключением случаев крайней необходимости. В настоящее время в России МРТ молочных желёз исследуют и используют в диагностике случаев, неоднозначно интерпретируемых при маммографии и УЗИ. Оценка количественной характеристики динамического накопления контрастного вещества (интенсивное), а также качественные характеристики выявленного патологического процесса (нечёткие, тяжистые контуры) позволяют дифференцировать злокачественный процесс.
Цитологическое и гистологическое исследования пунктатов и биоптатов молочной железы — наиболее достоверные методы диагностики. Результат цитологического исследования у беременных во многом зависит от опыта работы цитолога с аналогичными случаями.
Эксцизионную биопсию, выполняемую под местной анестезией, считают «золотым стандартом» при любой неясной патологии в молочной железе. При завершённой беременности для снижения риска развития лактационного свища рекомендуют прекратить лактацию приблизительно за неделю до проведения манипуляции (каберголин). После выполнения биопсии назначают холодовое воздействие на молочные железы и их тугое бинтование. Техника «Cor- биопсии» образований в молочной железе высокоспецифична и высокочувствительна (рис. 50-3, см. цв. вклейку)
Морфологу, выполняющему исследование удалённого препарата, необходимо сообщить о наличии беременности у пациентки. «Сor-биопсия» позволяет не только получить достаточное количество материала для верификации диагноза, но и выполнить целый набор иммуногистохимических исследований для определения прогноза и тактики лечения пациентки (рецепторный статус опухоли, экспрессия гена Her2-neu, Ki-67 и т.д.). РМЖ у беременных имеет то же гистологическое строение, что и в группе небеременных. От 70 до 90% опухолей соответствует инфильтративному протоковому РМЖ. У беременных чаще наблюдают опухоль больших размеров с выраженным внутрипротоковым компонентом, метастатически изменённые регионарные лимфатические узлы, распространение раковых эмболов по лимфатическим щелям. Как правило у беременных, больных РМЖ, определяют эстроген и прогестеронотрицательные опухоли.
Рис.50-3. Аппарат-игла для проведения «Cor-биопсии».
Выявление отдаленных метастазов в печени без риска для плода может быть произведено с помощью УЗИ и МРТ.
Радиоизотопное исследование костей скелета для выявления метастазов выполняют чрезвычайно редко, поскольку данный метод исследования несёт 0,00194 Гр лучевой нагрузки на плод.
Программа скрининга подразумевает маммографическое и физикальное исследования, а также самообследование женщиной молочных желёз. У беременных наиболее рациональными, доступными и информативными методами скрининга считают самообследование молочных желёз и УЗИ. Схема ультразвукового скрининга при беременности, регламентированная приказом №457 МЗ РФ «О совершенствовании пренатальной диагностики в профилактике наследственных и врождённых заболеваний у детей» включает три обязательных исследования в 10–14, 20–24 и 32– 34 нед беременности, позволяющие своевременно диагностировать ВПР. Считают рациональным одномоментно выполнять и контрольные УЗИ молочных желёз.
Дифференциальную диагностику РМЖ у беременных и кормящих женщин следует проводить с маститом, фиброаденомой, листовидной опухолью молочной железы, галактоцеле, липомой, лимфомой, гамартомой, саркомой, туберкулёзом. Постановка диагноза «лактационный мастит» при наличии злокачественной опухоли в молочной железе — типичная ошибка в клинической практике. Кроме совпадения сроков проявления истинного лактационного мастита и РМЖ не редкостью бывает и совпадение клинической картины (рис. 50-4, 50-5, см. цв. вклейку).
Рис. 50-4. Пациентка, 21 год. Беременность 16 нед. Рак молочной железы (отёчно-инфильтративная форма).
Рис. 50-5. Пациентка, 25 лет. Беременность 24 нед. Мастит.
В последние годы всё чаще наблюдают стёртые формы воспалительных поражений молочной железы, характеризующиеся, если не полным отсутствием, то, по крайней мере, слабой выраженностью типичных клинических проявлений. Так, гнойный мастит может протекать с нормальной или субфебрильной температурой, без озноба, без выраженных изменений картины крови, при вялой воспалительной реакции. В клинике возрастает число случаев необоснованного и неадекватного применения лечебных физиотерапевтических процедур, которые стимулируют диссеминацию злокачественного процесса и приводят к быстрой инвазии в окружающие ткани, образуя так называемые острые, или диффузно-инфильтративные, формы рака.
При обнаружении опухоли и при её цитологической верификации необходимо коллегиальное обсуждение полученных диагностических данных с участием онколога и акушера. В крупных медицинских центрах на этапе постановки диагноза возможно привлечение медицинского генетика.
В диагнозе указывают локализацию опухоли (правая/левая молочная железа) и соответствие стадии по классификации ТNM. Необходимо указать наличие беременности и срок гестации в неделях.
Рак правой молочной железы T2N0M0 (IIА стадия). Беременность 23–24 нед.
Целью лечения больного с онкологическим заболеванием считают не только достижение максимально выраженного клинического эффекта, но и увеличение продолжительности и улучшение качества жизни. Определение лечебной тактики зависит прежде всего от стадии заболевания, а не от срока беременности. В том случае, когда больная отказывается от медицинской помощи и приоритетом для неё и её семьи представляется защита плода, лечение откладывают до момента родов. Как правило, прогноз у больных, выбравших этот вариант, крайне неблагоприятен.
Второй вариант подразумевает немедленное завершение беременности и проведение лечения в объёме, адекватном стадии опухолевого процесса. Дальнейшее лечение не отличается от такового у небеременных.
Третий вариант, который всё чаще применяют в мировой практике последние 20 лет — проведение лечения без прерывания беременности. При этом можно проводить как оперативные вмешательства, так и лекарственную терапию.
Лечение РМЖ подразумевает комплексный подход, включающий оперативное вмешательство, лекарственное лечение и лучевую терапию. Несмотря на то что лучевую терапию достаточно часто применяют в обычной онкологической практике, для беременных она противопоказана. Тератогенные свойства лучевой терапии, а также угроза развития онкологической патологии у ребёнка, в том числе лейкоза, заставляют воздерживаться от её применения на протяжении всей беременности. При проведении стандартного курса в суммарной дозе, равной 5000 рад (50 Гр), плод получает лучевую нагрузку в пределах от 3,9–15 рад (0,039–0,15 Гр) в I триместре и 200 рад (2 Гр) — к концу беременности. Пороговой повреждающей дозой для плода в I и II триместрах беременности считают 10 рад (0,1 Гр). Доза от 10–15 рад приводит к дефектам развития, нарушениям ЦНС, доза 50–200 рад — к задержке развития, а доза от 100–250 рад — к уродствам.
Спорными вопросами бывают безопасность и возможные побочные эффекты противоопухолевых препаратов в период беременности. Наибольший риск развития уродств у плода возникает при проведении химиотерапии в I триместре беременности — частота ВПР составляет 10–20%, возрастает частота спонтанных абортов.
Химиотерапия, проводимая во II и III триместрах беременности, также может приводить к преждевременным родам и таким осложнениям, как миелосупрессия у матери и плода, кровотечение и инфекционные заболевания, задержка роста, малая масса тела плода, рождение его мёртвым. Отдалённые результаты проведения химиотерапии во время беременности неизвестны. Решение о проведении химиотерапии возможно лишь после разъяснительной беседы с беременной и её семьёй.
В случае полной информированности больной о всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах беременности возможно назначение неоадъювантной полихимиотерапии (доксорубицин, циклофосфамид).
На современном этапе нет отдалённых данных о судьбе и здоровье детей, родившихся у женщин, подвергшихся специфическому лекарственному лечению.
Одним из наиболее действенных методов терапии РМЖ считают гормональное лечение. Однако антиэстрогенное средство тамоксифен оказывает тератогенное действие и противопоказан при беременности.
Оперативное лечение считают основным методом при РМЖ. На начальных стадиях заболевания возможно выполнение оперативного вмешательства в качестве первого этапа лечения. Радикальная мастэктомия или органосохраняющая операция, а также сопровождающее анестезиологическое пособие, не опасны для плода и, как правило, не приводят к самопроизвольному аборту. Радикальная маст-эктомия с сохранением обеих грудных мышц — наиболее рациональный хирургический объём при начальных (I, II) стадиях РМЖ в I триместре, когда больная хочет сохранить беременность. Больные, перенёсшие мастэктомию, не нуждаются в лучевой терапии. Органосохраняющие операции при сохранении беременности нежелательны, так как требуют дополнительной лучевой терапии, а её можно проводить только после завершения беременности. Необходимость выполнения аксиллярной диссекции во всех случаях определяется высокой частотой метастазов в регионарные лимфатические узлы.
При отказе больной от полного удаления молочной железы, при начальных сроках беременности органосохраняющая операция может быть дополнена полихимиотерапией, начиная со II триместра, и лучевой терапией после раннего родоразрешения.
Если диагноз поставлен в конце II триместра или позже, вариантом выбора считают радикальную резекцию с последующей дистанционной лучевой терапией после завершения беременности.
Метод лечения у больных РМЖ, ассоциированным с беременностью, определяют индивидуально с учётом срока беременности и данных о распространённости опухоли предпочтительно консилиумом с привлечением хирурга, акушера, химиотерапевта, радиолога, психолога.
Госпитализация в онкологический стационар показана в случае согласия больной на тот или иной вид лечения. При госпитализации необходимо заключение акушера о сроке беременности, объективная инструментальная оценка жизнеспособности плода, наличия или отсутствия его патологии. Акушер предоставляет заключение о противопоказании к тому или иному виду планируемого лечения.
Оценка эффективности лечения. Лечебный эффект от неоадъювантной химиотерапии определяется на основании сравнения размеров опухоли до лечения и после, наличия отека, гиперемии. Если контроль осуществляется на фоне существующей беременности, необходимо подобрать безопасные для плода методы. После окончания лечения контрольное исследование, включающее, осмотр, маммографию, рентген легких, УЗИ органов брюшной полости, радиоизотопное исследование костей, проводится через 6 месяцев. Последующее обследование — через 1 год.
При местнораспространённом РМЖ (стадии IIIA, IIIB, IIIC), при отёчноинфильтративных формах рака и при IV стадии рака, если необходимо проведение химиотерапии и больная согласна на прерывание беременности, в качестве первого этапа лечения рекомендуют прерывание беременности, причём на любом сроке (с 22–27 недель — «очень ранние» преждевременные роды). При постановке диагноза в III триместре и при решении пролонгировать беременность возможны ранние преждевременные роды в сроке 34 недель.
Профилактика основана на программах формирования здорового образа жизни и устранении факторов риска развития рака. Помимо повышения информированности женщин репродуктивного возраста о возможной злокачественной патологии молочных желёз на фоне беременности необходимо внедрять методы самообследования, а главное — инструментальное исследование молочных желёз в рамках прегравидарной подготовки. Основные профилактические меры должны быть направлены на выявление болезни на максимально ранних сроках.
Необходимо включить УЗИ молочных желёз в план наблюдения беременной либо на этапе планирования, либо в I триместре беременности.
Необходимо информировать женщин о том, что опухолевые клетки не метастазируют в ткани плода; женщина, болеющая раком, должна прекратить лактацию, что связано с необходимостью немедленно начать лечение и принимать различные лекарственные препараты. Ошибочно предположение, что будущий ребёнок женского пола непременно заболеет РМЖ, если у болеющей матери обнаружены мутации генов BRCA1 и BRCA2.
Следует объяснить, что последующая беременность не ухудшает прогноз у больных с ранней стадией РМЖ. Вопрос о беременности после проведённого лечения при сохранённой репродуктивной функции следует решать с осторожностью. Необходимо учитывать стадию заболевания, наличие или отсутствие неблагоприятных факторов прогноза. Минимальным интервалом от момента завершения лечения до планирования последующей беременности считают интервал 2–3 года.
После окончания лечения женщина должна находиться под длительным наблюдением онколога. Срок первого контрольного осмотра — через 6 мес от момента проведения лечения. Затем рекомендована явка через год.
При сравнении в рамках одинаковых стадий и возрастных групп выживаемость беременных, больных РМЖ, ассоциированным с беременностью, не отличается от таковой в группе небеременных. Тем не менее, РМЖ, ассоциированный с беременностью, имеет худший прогноз, чем в целом РМЖ, что обусловлено большей распространённостью болезни на момент постановки диагноза.
Примерные сроки нетрудоспособности
Ориентировочные сроки временной нетрудоспособности при злокачественных новообразованиях молочной железы (класс II по МКБ-10) I стадии составляют 50–75 дней, II–III стадии — 80–115 дней. Вопрос об установлении инвалидности решают после завершения оплачиваемого отпуска по беременности и родам.
источник
У женщины во время беременности может развиться или внезапно обнаружиться рак груди. Пятнадцать лет назад у врачей не было никаких сомнений: будущую мать отправляли на аборт по медицинским показаниям. Сейчас современная медицина доказала, что женщина может проходить лечение от онкологии даже во время беременности и после этого родить здорового ребенка. Об этом рассказали эксперты благотворительной программы «Женское здоровье» на круглом столе «Рак груди и репродуктивное здоровье женщины».
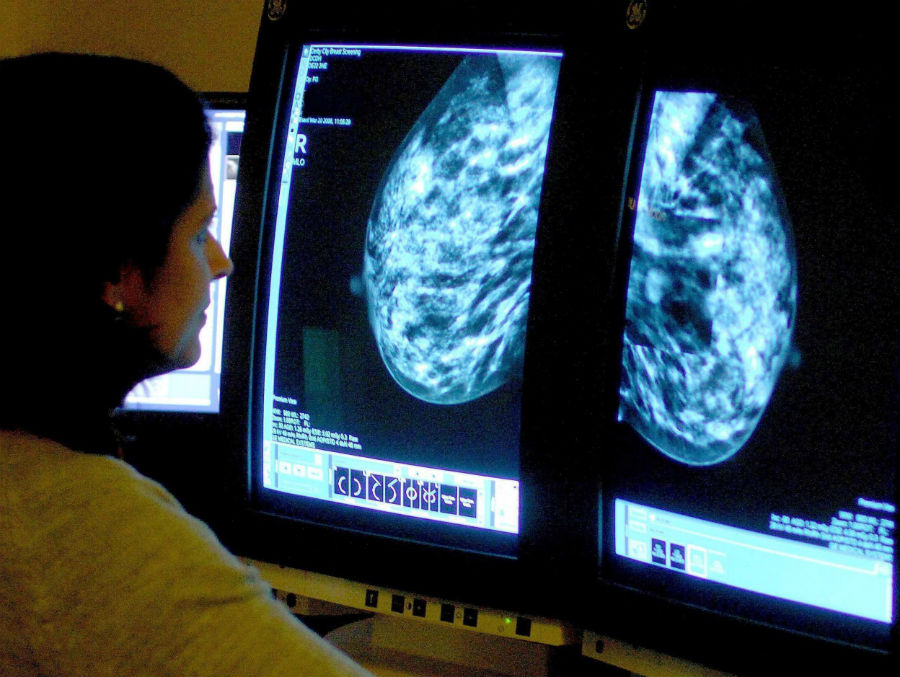
Регулярные обследования позволяют выявить рак молочной железы (РМЖ) на ранней стадии, еще до появления симптомов — и до 98% женщин выздоравливают, если его выявили вовремя и правильно лечили. Каждой женщине важно знать, относится ли она к группе высокого или среднего риска, поскольку от этого зависит, как часто она должна проходить профилактические обследования.
Женщина относится к группе высокого риска, если ее ближайшие родственники, мама или бабушка, перенесли рак груди или другие онкологические заболевания репродуктивной сферы, особенно в молодом возрасте. В этом случае врач-маммолог составит индивидуальную программу после 20 лет. Если женщина относится к группе среднего риска и ее ничего не беспокоит: нет никаких изменений в молочных железах, жалоб или симптомов, — до 40 лет нет необходимости проходить специальные обследования. Однако, как подчеркивают специалисты, при любых изменениях по сравнению с нормой следует не откладывая обращаться к врачу — гинекологу или онкологу-маммологу.
Стоит ли во время планирования беременности проходить дополнительный скрининг на рак молочной железы «для перестраховки»? Есть случаи, когда это действительно имеет смысл, но чаще всего, если пациентка регулярно проходит осмотр в положенное время, это лишнее, говорит химиотерапевт Клиники амбулаторной онкологии и гематологии Александр Аболмасов.
«Вероятность [развития рака молочной железы] существует даже после обследования. Ни у какого метода исследования нет 100%-ной гарантии: мы можем сделать исследование, которое увидит маленькое образование, но никогда не сможем сделать исследование, которое увидит клетку, десять клеток, сто клеток. Везде есть пороговая разрешающая способность, поэтому такие риски существуют», — отмечает эксперт.
Исследования показали, что беременность снижает риск развития гормонозависимого рака молочной железы. Ранние роды (до 20 лет) снижают риск возникновения РМЖ на 50%, а каждая последующая беременность — еще на 11%. Однако этот механизм срабатывает с несколькими оговорками. Во-первых, снижение риска касается только гормонозависимых видов рака, при других типах опухолей риски развития рака такие же, как без предшествующей беременности. Во-вторых, риск развития рака снижается в долгосрочной перспективе, спустя 10—15 лет после беременности. Первое время после беременности и родов риск развития рака молочной железы, наоборот, повышается — незначительно, но статистически достоверно, рассказывает Александр Аболмасов.
«Возникает закономерный вопрос, чего же тогда больше: пользы — оттого что риск когда-то потом снизится, или вреда — оттого что сейчас риск повышается? Ученые пришли к выводу, что пользы все-таки больше и эта закономерность работает тем сильнее, чем раньше наступают роды».
В России нет статистики, у скольких беременных нашли рак молочной железы, однако если ориентироваться на европейские данные, то в среднем одна из ста тысяч беременностей сопровождается раком, говорит руководитель программы «Онкология и репродукция» в центре онкологии имени Н. Н. Блохина Анастасия Пароконная. По ее наблюдениям, средний возраст заболевшей — 33-34 года, причем это может быть как первая, так и вторая, третья или даже пятая беременность у женщины.
В 2009 году российские врачи впервые провели лечение беременной женщины с раком молочной железы, и она родила здорового ребенка. Сейчас женщина, у которой обнаружили рак во время беременности, может получить лечение и сохранить ребенка, утверждают эксперты.
Лечение беременной пациентки зависит от стадии заболевания и сроков беременности. Если до родов осталось около трех недель, то ее сначала отправляют к акушерам на родоразрешение. Если же беременность на раннем сроке, а опухоль уже довольно большая, то врач, вероятнее всего, предложит ей прервать беременность. Однако чаще всего женщина узнает о раке молочной железы в середине беременности, на 23-24-й неделе, когда аборт делать уже поздно, а до родов еще далеко.
В таком случае беременность женщины должна идти под контролем ряда специалистов: акушера-гинеколога, онколога-хирурга, онколога-химиотерапевта, психолога и генетика. Беременность накладывает на врачей ограничения в диагностике (например, нельзя сделать компьютерную томографию), но в остальном схема лечения беременной женщины будет такой же, как и без нее.
В зависимости от триместра врачи могут применять разные типы лечения. Хирургия возможна в любом триместре, начиная с первого, а со второго триместра уже может проводиться химиотерапия.
Пятнадцать лет назад никто не был готов к раку во время беременности, рассказывает главврач Национального научного центра акушерства, гинекологии и перинатологии имени академика В. И. Кулакова Роман Шмаков. «Онкологи говорили пациентке: “Прервите беременность или родите — и мы начнем заниматься лечением”. Акушеры говорили: “Это онкологическое заболевание и мы наблюдать вас не будем”. Что происходило? Пациентка брала на себя ответственность за свою жизнь и за жизнь своего ребенка, при этом не получая лечения. Естественно, у нее были хуже результаты», — объясняет главврач.
Данные зарубежных онкологов показывают, что при адекватном лечении прогноз выживаемости у беременной с раком молочной железы такой же, как у небеременной. Прерывать беременность при этом не обязательно (за исключением довольно редких показаний) — более того, по наблюдениям Шмакова, аборт хуже влияет на прогноз лечения онкозаболевания.
По действующему закону Минздрава, злокачественные новообразования, требующие проведения химиотерапии, входят в перечень медицинских показаний для аборта. Анастасия Пароконная рассказала, что у российских врачей есть опыт лечения беременных пациенток с помощью химиотерапии, и сегодня ни у одной из 60 женщин не отмечено грубого порока развития плода. Осложнения у детей были связаны с ранними родами — раньше, чтобы скорее приступить к лечению, пациентку отправляли на родоразрешение с 34-й недели и дети рождались недоношенными. Сейчас врачи при адекватном лечении проводят роды не ранее 36-37-й недели.
«Тот опыт, который мы сегодня имеем, показывает, что этот вариант лечения достаточно безопасен, если его грамотно проводить с согласия пациентки, — добавила эксперт. — Мы с нашими коллегами работаем над тем, чтобы внести поправки в приказ Минздрава, который действует сегодня».
По словам главврача Романа Шмакова, если пациентка вылечилась от рака молочной железы, она может забеременеть через два года после окончания лечения, если не было рецидива. Как показывают некоторые исследования, беременность после излеченного рака позитивно сказывается на прогнозе выживаемости.
«Может быть, это восприятие самой пациентки, — предполагает врач. — Пациентке, которая столкнулась с диагнозом “рак”, как никому нужна эта беременность. Это как свет в конце туннеля после бесконечного лечения, химиотерапии, лучевой терапии. Реализация фертильной функции — это один из показателей качества жизни пациентки, и это очень важно».
Раньше женщины, которые принимали гормонотерапию при РМЖ, прерывали лечение на свой страх и риск, чтобы забеременеть и родить ребенка. Сейчас онкологи поняли, что не получится совладать с женщинами, которые очень хотят детей и сами отказываются от гормонотерапии, поэтому надо им только помогать, говорит Анастасия Пароконная. Центр онкологии имени Н. Н. Блохина принимает участие в международном исследовании, которое позволяет женщинам сделать перерыв в гормонотерапии после 1,5—2,5 лет приема на время, достаточное для беременности и родов. Это проходит в рамках исследований, к какому результату приведет прерванная терапия, пока никто не знает, отмечает эксперт.
Некоторые виды лечения рака — химио-, таргетная и лучевая терапия — влияют на состояние яичника пациентки, говорит заведующая отделением новых медицинских технологий в Медицинском радиологическом научном центре имени А. Ф. Цыба Марина Киселева. До 70% пациенток, перенесших химиотерапию, оказываются бесплодны, а лучевая терапия на малый таз приводит к полной стерилизации.
Согласно приказу Минздрава № 107н, онколог, консультируя больную репродуктивного возраста, обязан предупредить ее о том, что лечение может привести к бесплодию, и предложить сделать криоконсервацию тканей яичника, яйцеклеток или эмбрионов, чтобы впоследствии та могла родить ребенка.
Однако на практике это может быть не так: во время круглого стола пациентка пожаловалась, что сразу говорила врачу, что хочет родить ребенка после выздоровления, но о том, что у нее была возможность сделать криоконсервацию тканей, ей сказали лишь после восьмой химиотерапии.
Эксперты признают: нужно образовывать врачей, чтобы пациентки получали адекватную помощь не только в федеральных центрах, но и в регионах. Сейчас в регионах врачам проще отказать в помощи беременной с раком молочной железы или отправить ее на аборт, говорит Анастасия Пароконная. Объединенные федеральные центры онкологии разрабатывают единые рекомендации по лечению рака груди у беременных.
источник

