Тревожный диагноз – рак молочной железы становится для молодой женщины крахом всех надежд. Современные методики лечения этого заболевания, особенно при ранней диагностике, дают обнадеживающие результаты. Удаление яичников помогает справиться с болезнью, предупредить рецидивы появления опухоли.
Половой гормон эстроген, который вырабатывают яичники, в женском организме играет особую роль. Он помогает обмену веществ, участвует в работе клеток, способствует вынашиванию ребенка. Есть одна особенность – когда в молочной железе появляется опухоль, эстроген вызывает бурный рост раковых клеток. Это случается, когда повышено количество гормона в организме. Такая разновидность рака молочной железы считается гормонозависимой. Задача онкологии – остановка развития опухоли путем снижения выработки эстрогена.
Овариоэктомия – операция по удалению яичников – помогает устранить источник выработки эстрогена. Цель хирургического вмешательства – остановить процесс роста злокачественной опухоли. Исследования подтвердили – лечение при раке молочной железы таким приемом особо эффективно, когда есть противопоказания к химиотерапии, применению гормональных лекарственных препаратов. В некоторых ситуациях показано удаление матки и яичников, что приводит к бесплодию.
К сожалению, резкая остановка выработки эстрогена, вызванная удалением яичников при раке груди, приводит к осложнениям для женского организма. Служит причиной снижения качества жизни. Внезапно наступает климакс с его последствиями:
- слабостью;
- приливами;
- подавлением сексуального влечения;
- разрушением костной ткани – остеопорозом;
- увеличением массы тела;
- головокружением;
- сердцебиением;
- головными болями;
- повышением давления;
- быстрой утомляемостью.
Лечение рака груди овариоэктомией проводят пациенткам до начала менопаузы. Если есть возможность, удаление яичника не делают нерожавшим женщинам. При таком положении используют лекарственное отключение функции образования эстрогена, чтобы со временем работа органа восстановилась. Удаление яичников при раке молочной железы гормонозависимой формы дает хороший прогноз к излечению. Показаниями к удалению становятся:
- 4 стадия рака;
- профилактика возникновения рецидивов;
- мутации генов BRCA;
- риск развития метастазов;
- наследственность.
Удаление яичников у женщин не проводиться, когда пациентки находятся в возрасте постменопаузы. Во время климакса, когда овуляция прекращается, эстроген перестает вырабатываться, и смысла в операции нет. Гормонотерапия при таких обстоятельствах осуществляется медикаментозным способом. Специальные лекарства – ингибиторы ароматазы – помогают уменьшить уровень эстрогена в крови. Это приводит к излечению рака.
Основная задача, стоящая перед онкологами при гормонозависимом раке груди, – блокировать или уничтожить выработку гормона эстрогена. При этом развитии событий раковые клетки прекратят свой рост. Решение будет зависеть от возраста пациентки, степени развития заболевания, гормонального статуса опухоли. Лечение рака груди, или карциномы, ставящее целью остановить воздействие эстрогена, предполагает использование нескольких методов. Сюда относят:
- оперативное вмешательство;
- выключение функции яичников.
Чтобы определить гормональный статус новообразования, проводят специальный анализ. С его помощью выясняется, есть ли в опухоли особые вещества – рецепторы, которые вступают в контакт с гормонами и начинают бурный рост раковых клеток. Определяется кто явился провокатором этого процесса – прогестерон или эстроген. Это влияет на выбор методики. Самый благоприятный исход при раке молочных желез, когда обнаружена активность обоих гормонов.
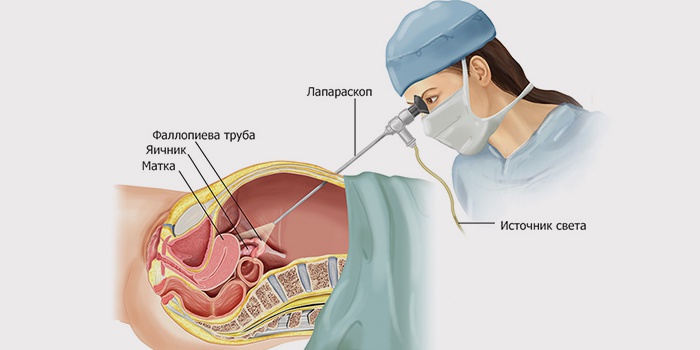
Современный способ проведения операции – лапароскопия. Для удаления яичников по такой методике делаются маленькие разрезы. Через них вводятся камера и инструменты. На экране монитора хирург наблюдает за ходом операции. Орган удаляется по частям и выводится через небольшое отверстие в брюшной стенке. При этом методе возможно использование местной анестезии, а швы остаются незаметными.
Один из хирургических методов – лапаротомическое удаление яичников. Операция производится путем разрезания передней стенки брюшной полости. При этом методе, особенно если надрез тканей выполнен вертикально, хирург имеет хороший доступ к органу. Есть возможность перевязать сосуды, чтобы избежать кровотечения. При операции используется общий наркоз, остается шрам.
Меры, направленные на выключение деятельности яичников при раке груди, кроме удаления, подразумевают использование других способов. Исключительно важно это для женщин в детородном возрасте, не имеющих потомства. Есть возможность на время отключить выработку гормона эстрогена, чтобы затем восстановить ее. Существуют два метода подавления функции:
- лучевая терапия;
- использование медикаментозных препаратов.
Применение лучевой терапии помогает без хирургического вмешательства остановить выработку гормона при помощи облучения яичников. К сожалению, при этом возможно повреждение тканей соседних органов. Использование лекарственных средств для провоцирования искусственного климакса – прерывания выработки эстрогена – более гуманный метод. Методика легко переносится, но требует длительного приема дорогостоящих препаратов.
Вместо хирургической операции, современная онкология предлагает использовать при раке груди гормонотерапию. Назначение лекарственных препаратов находится в зависимости от репродуктивного возраста женщины. Медикаменты решают разные задачи:
- селективные модуляторы способствуют блокированию выработки эстрогена;
- ингибиторы ароматазы уменьшают его содержание в крови;
- особые гормоны прекращают работу яичников.
Селективные модуляторы эффективны, когда у женщины еще не наступила менопауза. Препараты воздействуют на зараженные участки молочной железы очень избирательно. Клетки перестают получать эстроген, провоцирующий их энергичный рост. Процесс замедляется и полностью останавливается. Основной медикамент для воздействия – Тамоксифен, выпускается в таблетках, требует длительного приема.
В период постменопаузы лечение онкологического заболевания груди производят ингибиторами ароматазы. Эти медицинские средства способствуют понижению уровня эстрогена в крови. Применение на этом жизненном этапе ингибиторов ароматазы дает положительные результаты, помогает справиться с заболеванием. Хотя есть и неприятный побочный эффект – повышение хрупкости костей. Среди известных препаратов:
Отдельно стоит применение медикаментов, которые подавляют функцию яичников – искусственно вызывают климакс. Они назначаются, когда не эффективны селективные модуляторы. Препараты Золадекс, Бусерелин, применяемые в виде инъекций раз в четыре недели, прерывают связь гипофиза с яичниками. После отмены лекарства функции восстанавливаются. Еще одно средство – Фаслодекс – радикально уничтожает эстрогенные рецепторы.
Современный вид терапии, заменяющий удаление яичников – таргетное лечение. Применение препаратов исключает рост и увеличение количества раковых клеток, действуя на них точечно. При этом соседние ткани не задеваются. Таргетные препараты помогают остановить развитие раковых процессов. Их применение является профилактикой развития заболевания, при этом мала вероятность интоксикации организма. Увеличивается продолжительность жизни пациенток, больных раком груди. Популярные в онкологии препараты:
источник
Эксперты о профилактике онкозаболеваний у женщин
Вчера актриса и режиссер Анджелина Джоли опубликовала колонку в The New York Times, где рассказала о своей борьбе с угрозой рака. Вслед за двойной мастэктомией, то есть удалением обеих молочных желез, Джоли сделала операцию по удалению яичников и маточных труб. Она рассказала о процессе принятия этого непростого решения и призвала женщин внимательно относиться к своему здоровью и понять, что вовремя выявленное заболевание или его адекватная профилактика повышает шансы на долгую и счастливую жизнь. Колонка вызвала бурный резонанс в соцсетях, в том числе и отзывы отрицательного характера — Джоли обвинили в паникерстве, канцерофобии
и в пропаганде неадекватных методов лечения.
Большое количество осуждающих актрису комментариев подтвердило, что при всём прогрессе в области технологий и диагностики многие по-прежнему предпочитают не знать или не думать о потенциальной проблеме, пока гром не грянет, а информированность россиян о профилактике онкозаболеваний и способах их лечения далека от идеальной. Другая причина столь негативной реакции на удаление репродуктивной системы в подобном возрасте кроется в стигматизации подобных операций и перенесших их женщин — в детоцентричном обществе «отрезать себе всё» автоматически означает «перестать быть женщиной» и «утратить ценность» в глазах мужчин. Мы попросили хирурга-онкогинеколога, принимавшего участие в лечении мамы Анджелины Джоли, а также генетика и психотерапевта прокомментировать эту ситуацию и рассказать о новых технологиях и актуальных способах профилактики и лечения женских онкологических заболеваний, о которых надо знать всем.
Владимир Борисович Носов
хирург-онкогинеколог
nosovoncology.com
Каждая восьмая женщина в мире болеет раком груди. В России ситуация несколько хуже, потому что у нас женщины нередко пренебрежительнее относятся к ранней диагностике и врачи ее недостаточно хорошо знают, например, часто заменяют маммографию ультразвуком или вообще простым осмотром молочных желез. При раке груди, как и при любом другом виде рака, очень важно диагностировать его как можно раньше, тогда больше шансов его вылечить. Выживаемость напрямую зависит от того, на какой стадии обнаружили заболевание. Но есть, конечно, и много других нюансов. Например, некоторые опухоли являются гормоночувствительными, и в таких случаях прогноз лучше. Есть ряд опухолей, у которых нет рецепторов к гормонам, они чаще более агрессивные, хуже отвечают на химиотерапию и, соответственно, не лечатся гормональными средствами.
К счастью, существует ранняя диагностика рака груди — для большинства заболеваний ее нет. Если следовать рекомендациям врачей и после 40 лет проходить маммографию раз в год, то вероятность не умереть от рака груди значительно повышается. Женщинам от 30 лет нужно посещать маммолога и делать узи молочных желез раз в три года, причем это при условии, что у них нет особых проблем с молочными железами, там не было никаких уплотнений, новообразований и пациентки не имеют генетической предрасположенности к раку, как та же Анджелина Джоли.
Генетический риск заболеть раком груди или яичников складывается из семейной истории онкологических заболеваний. Если ваша мама, бабушки или тетки в молодом возрасте перенесли предменопаузальный рак (то есть рак молочной железы или яичников — их часто объединяют в один синдром), вы попадаете в группу риска. Шанс заболеть раком в таком случае возрастает колоссально. Конечно, бывают спорадические случаи заболевания, но есть и определенные синдромы, как в случае Анджелины Джоли, — BRCA1 и BRCA2. У носителей мутации первого типа риск заболеть раком груди в том или ином возрасте составляет 85 %, то есть это фактически каждая первая носительница.
Генетические тесты позволяют выявить, если ли мутация. Про риски выводы делают уже врачи, они смотрят на тип мутации и дальше уже всё известно. Куда важнее, чтобы гинеколог или маммолог грамотно собирал анамнез. Я всегда спрашиваю у пациенток, которые приходят с условной молочницей или дисплазией шейки матки, чем болели их родственники, какой степени родства и в каком возрасте они перенесли заболевание. Когда женщина говорит: «У меня тетка умерла от рака груди в 45 лет, у бабушки был рак яичников и у мамы опухоль, но вроде доброкачественная и ее вырезали», — врач должен понимать, что пациентку нужно проверить на носительство этих мутаций. Обычно мы тестируем женщин, чьи родственницы перенесли рак яичников или молочных желез в молодом возрасте; тех, у кого уже обнаружили рак молочной железы или яичников в возрасте до 50 лет; и женщин, которые проходят множественные биопсии по поводу образований молочной железы, вроде бы доброкачественных, но до конца непонятно. Бывает так, что у женщины очень убедительная семейная история определенных онкологических заболеваний, но по каким-то причинам мутации у нее не обнаруживается. В таких случаях мы секвенируем весь ген BRCA1 и BRCA2 и смотрим, есть ли мутация в каких-то нетипичных локусах (местах), и часто ее там находим.
Рутинно проходить генетические тесты смысла нет. Более того, если у родителей выявлена мутация, мы рекомендуем им не тестировать детей раньше, чем они не достигнут 20–25 лет. Риски онкологических заболеваний начинают расти в 30–35, так что, кроме тревожности, родителям эта информация ничего не добавит. После 20 лет по результатам мы предупреждаем: ваш риск заболеть раком до 35 лет достаточно низкий и у вас есть шанс до этого времени реализовать репродуктивную функцию в той мере, в какой вы хотите. Впрочем, и вреда от таких тестов нет, разве что финансовый: тест на самые распространенные мутации обойдется в 15–17 тысяч рублей.
Каждая четвертая носительница мутации первого типа умирает от рака яичников. Такая грустная статистика
Я девять лет проработал в США и принимал участие в лечении мамы Анджелины Джоли, когда у нее случился рецидив рака яичников. Ей тогда было 54 года, а умерла она в 56 от рака молочной железы. У нее были выявлены сразу две мутации — и первого, и второго типов. У них в семье действительно почти все женщины болеют раком груди или яичников. Всем своим пациенткам, у которых обнаруживается мутация, я долго объясняю, каковы риски. К счастью, в случаях рака молочной железы у нас есть протоколы интенсивного скрининга: мы начинаем отслеживать состояние носителей мутации гораздо раньше обычного, до 25 лет, каждый полгода чередуем маммографию и МРТ молочных желез, проводит осмотры маммолог. Если соблюдать эти условия, вполне можно повременить с удалением груди.
С яичниками всё гораздо хуже: у носителей мутации первого типа вероятность заболеть раком яичников 54 % — то есть каждая вторая женщина. К сожалению, 80 % заболевших узнают об этом, когда рак уже на третьей стадии. На этом этапе выживаемость даже при самом агрессивном лечении — 35 % в лучшем случае. То есть каждая четвертая носительница мутации первого типа умирает от рака яичников. Такая грустная статистика. По этой причине, зная, что риск возрастает в возрасте от 35 лет, я всем своим пациенткам — носительницам мутаций генов BRCA1 и BRCA2 рекомендую профилактическое удаление яичников и маточных труб лапароскопическим путем.
Такая профилактическая операция существенно снижает риск возникновения рака, но не сводит его до нуля. В 7–10 % случаев при удалении яичников мы уже обнаруживаем микроскопическую опухоль. Это значит, что мы опоздали с профилактикой и рак уже начал развиваться. Есть еще подтип рака яичников под названием первичная брюшинная карцинома — это фактически тот же рак яичников, но только он начинается не на самих яичниках, а на поверхностях брюшины. Он может возникнуть даже после удаления яичников и маточных труб у носителей мутаций. С меньшей вероятностью, но исключать этого нельзя. Мы всегда предупреждаем женщин, что они могут заболеть раком яичников, даже если яичников уже нет, как бы парадоксально это ни звучало.
Пациентки реагируют на профилактические операции по-разному. Те, у кого на глазах умирали от рака родственники, сами порой приходят и просят удалить яичники и маточные трубы. Другое дело, когда женщина лет сорока заболевает раком груди и мы выявляем у нее мутацию — в таком возрасте сложнее прощаться с яичниками, особенно если у пациентки еще нет детей. Тогда мы начинаем гонку: просим женщину по возможности быстро забеременеть и родить и после этого уже удаляем яичники. Проблема 40-летних женщин в том, что быстро забеременеть они часто не могут — овариальный резерв обычно не очень хороший к этому возрасту. На помощь приходит репродуктолог, он проводит ЭКО, получает и замораживает яйцеклетки или эмбрионы и только потом мы удаляем яичники, а женщина может выносить эту беременность уже без яичников.
В физическом плане операцию по удалению яичников пациентки переносят легко. Процедура занимает 30–40 минут. Женщина приходит в клинику в день операции за пару часов до начала и на следующий день уходит домой, если нужно — берет больничный на 3–4 дня. Психологически с этим справиться сложнее. После удаления молочных желез и яичников женщины начинают воспринимать себя по-другому, это их сильно меняет психологически. Хотя всё зависит от человека. Многие пациентки после мастэктомии сразу ставят имплантаты и живут как и раньше, наслаждаясь низким риском заболеть раком груди. С яичниками опции поставить имплантаты нет. Удаляя яичники, например в 35 лет, женщина входит в менопаузу. У нее начинается климакс, и это добавляет целый ряд физических и психологических проблем. Теоретически их можно решить или облегчить с помощью заместительной гормональной терапии (ЗГТ), но тут есть свои сложности, потому что при длительном применении ЗГТ сама по себе может спровоцировать развитие рака груди. Поэтому многие женщины отказываются от гормональной терапии и принимают какую-то форму негормональных средств, которые помогают бороться с приливами-отливами, перепадами настроения и всем остальным. Что касается сексуальной жизни, пациентки с удаленными яичниками жалуются на сухость во влагалище и иногда на снижение либидо, но зависимость последнего от наличия/отсутствия яичников пока не доказана.
Ирина ЖЕгулина
врач-генетик
atlas.ru
Анджелина Джоли сдала анализ на мутацию гена, риск развития заболевания оценили с учетом ее родословной. Думаю, она делала обследования и по ряду других показателей. Скорее всего, и на мастэктомию актриса решилась не только на основании генетического теста — конечно, тут важен комплексный подход. Спустя несколько лет Джоли перенесла операцию по удалению яичников. Такой шаг вполне понятен, потому что у женщин в естественной менопаузе риск возникновения рака яичников повышается. Для нее это была оправданная профилактическая мера с учетом мутации BRCA1-гена. Но при этом любой женщине с аналогичной мутацией не стоит тут же бежать и удалять свои репродуктивные органы, так как каждый случай индивидуален, а риски складываются не только из генетических предрасположенностей, но и биохимических изменений, онкомаркеров и других показателей.
Генетический тест достаточно пройти один раз в жизни. Техника такая: сначала сдается скрининг, и если он показывает мутацию, проводится диагностический тест, который позволяет либо подтвердить, либо опровергнуть имеющееся предположение. Сейчас в России много институтов позволяют это сделать.
Результаты генетического теста самостоятельно трактовать не нужно, так как можно начитаться литературы и форумов, впасть в ипохондрию и не дойти до врача. Назначение на поиск мутации гена BRCA1 делает специалист, и интерпретировать результаты должен именно врач-генетик. Не стоит оставлять человека один на один с полученными данными. Пациенту важно всё правильно понять. Ген BRCA1 вообще очень большой, и мутаций в нем сейчас может быть больше полутора тысяч. Чтобы разобраться, какая мутация обнаружена у человека и как она повлияет на развитие заболевания, надо провести большую работу, посмотреть все научные статьи по теме — этим занимается врач-генетик.
Выявленные риски различаются. Есть мутации, которые незначительно повышают вероятность развития болезни, они встречаются чаще всего. В таких случаях нет необходимости делать операцию, нужно внимательнее следить за своим здоровьем. Если доказано, что определенная мутация повышает риск возникновения рака до 87 % (у Джоли именно так — показательный клинический случай), то нужно принимать оперативные решения.
источник
Смертность от рака яичников стоит на 8-м месте среди причин смертности женщин от онкологических заболеваний. Из-за отсутствия свойственных только этому заболеванию симптомов, рак яичников до сих пор диагностируют довольно поздно. Что может современная медицина, с ее генетическими исследованиями и новыми препаратами, а что зависит от самих женщин, рассказывает Светлана Викторовна Хохлова, д.м.н., старший научный сотрудник отделения химиотерапии РОНЦ им. Н.Н. Блохина.
Почему большинство случаев рака яичников у женщин приходится на возраст после 50 лет? Как связан рак яичников с отсутствием беременности и грудного вскармливания? С раком груди?
На сегодняшний день выделяют несколько факторов, которые повышают риск развития рака яичников: гормональный, генетический, алиментарные факторы, к которым относится экология и питание, и социальные факторы.
Многочисленные эпидемиологические исследования показывают влияние гормональных факторов в группах пациенток, у которых либо раньше начиналась менструация, либо поздно наступала менопауза.
Прямой связи с гормональными нарушениями в организме в этих исследованиях не наблюдалось. Однако установлено, что повышенное количество эстрогенов, во-первых, участвует в развитии рака молочной железы, а во-вторых, может повысить риск развития рака яичников.
Эти гормональные нарушения связаны, в основном, с процессами овуляции. При выходе яйцеклетки из яичника в каждом менструальном цикле происходит незначительное повреждение коркового слоя яичника. Эти повреждения эпителия накапливаются и могут приводить к перерождению эпителия в рак, поэтому женщины в возрасте после 40 лет и попадают в группу риска. Также приводить к перерождению ткани в рак могут воспалительные процессы, кисты яичников, эндометриоз.
Напротив, беременность и грудное вскармливание уменьшают количество овуляций в жизни женщины, с чем и связано предположение, что материнство снижает риск развития онкологии. Это подтверждает статистика: установлено, что в странах с низкой рождаемостью (а это, как правило, развитые страны) рак яичников встречается чаще. В развивающихся странах с высокой рождаемостью риск развития рака яичников намного ниже.
Сейчас проверяются гипотезы о том, насколько повышают риск развития рака препараты, стимулирующие работу яичников, например, эстрогены. В то же время, имеются данные, что контрацептивы с эстрогенами и прогестинами уменьшают риск развития данного заболевания.
Что такое гены BRCA и как они связаны с раком яичников и раком груди? Надо ли носителям мутировавших генов на всякий случай удалять яичники, как Анджелина Джоли удалила грудь?
Наиболее важным фактором развития рака яичников последние годы считают генетический. Всевозможные повреждения ДНК происходят в организме каждую секунду и могут приводить к развитию опухоли. Однако выявлены определенные гены-супрессоры, которые блокируют опухолевый рост. К таким генам, которые участвуют в восстановлении ДНК и сдерживают развитие опухолевого процесса, как раз и относятся BRCA1 и BRCA2.
Если же в этих генах имеются мутации, то механизм, который восстанавливает поврежденные ДНК, не работает, количество мутаций в ДНК накапливается и развивается злокачественная опухоль. По имеющейся статистике, к 70 годам у 44% носителей мутированного гена развивается злокачественная опухоль яичников. А частота мутации гена BRCA среди больных раком яичников превышает 15%.
Генетические мутации BRCA1/2 наследуемы и часто встречаются в семьях, где кто-то болел или болеет раковым заболеванием. Не обязательно раком яичников или молочной железы — сейчас уже есть данные, что меланома, рак поджелудочной железы и ряд других опухолевых заболеваний в семьях также влияют на предрасположенность к развитию рака яичников. Поэтому члены таких семей должны быть на особом учете и проходить обследования.
Что касается таких решительных мер, как профилактическое удаление яичников и молочных желез, то исследования действительно показывают значительное снижение риска развития опухоли в этих случаях. Однако в нашей стране юридически данные виды операции не разрешены.
Какие есть способы ранней диагностики рака яичников? Диагностируется ли он на УЗИ?
К сожалению, скрининг для рака яичников не показал свою значимость. Ни УЗИ, ни определенные маркеры не показывают на ранних этапах данную патологию. С помощью ультразвукового исследования можно увидеть кисты, опухолевые изменения, и если есть подозрения на злокачественную опухоль, то пациентку обязательно нужно направить к онкологу и сделать анализ крови на маркер CA125.
Так что на сегодняшний день раннюю диагностику ракового заболевания может обеспечить онконастороженность самих женщин.
Действительно ли симптомы рака яичников могут напоминать расстройство желудка? Если женщина пойдет с болью в животе к гастроэнтерологу, он заподозрит неладное?
Рак яичников имеет имплантационный характер прогрессирования: метастазирование идет по серозной оболочке кишечника, желудка, печени, также появляется жидкость в брюшной полости. Поэтому часто пациентка жалуется на расстройство желудка, боли в эпигастральной области, в правом подреберье. Такие симптомы, как увеличение живота и запоры, появляются уже на 3-4-й стадии рака.
Проблема своевременной постановки диагноза заключается в отсутствии уникальных симптомов. Даже в Москве, где медицина на достаточно высоком уровне, с момента появления у женщины жалоб до первого визита к онкологу проходит от 4 месяцев до полутора лет. Все это время она может проходить обследования по месту жительства у терапевта, но правильный диагноз установлен не будет. 80% пациенток попадают к онкологу уже на 3-4-й стадии рака яичников. Единственный путь, который может изменить скорбную ситуацию — это информирование и обучение медицинских работников первичного звена.
Если опухоль обнаружена, то операция обязательна? Существуют ли варианты лекарственной терапии?
Да, основным методом лечения рака яичников является, конечно, оперативное: удаление первичной опухоли, большого сальника, всех видимых опухолевых изменений в брюшной полости.
Вне зависимости от стадии заболевания после операции пациенты проходят химиотерапию. Обойтись без химиотерапии можно только на очень ранней стадии, но из-за сложности обнаружения заболевания таких случаев мало. Часто во время операции оказывается, что стадия рака гораздо больше, чем предполагалось по данным обследования.
За многие годы большое количество всевозможных таргетных (или целевых) препаратов изучалось при раке яичников, но на сегодня из этой группы только один препарат зарегистрирован для лечения данной патологии.
С увеличением наших познаний в биологии рака ученые обнаружили, что в опухолевых клетках с мутацией гена BRCA ряд механизмов восстановления ДНК выключены. Для пациенток — носителей данных мутаций разработали препараты, которые блокируют другие механизмы восстановления ДНК, ДНК не восстанавливается, и опухолевая клетка погибает.
Это так называемые PARP-ингибиторы. Практическое применения этих препаратов показало преимущество использования их в поддерживающем режиме у пациенток с рецидивом рака яичников с мутацией гена BRCA1/2, у которых удалось достичь полного или частичного ответа на химиотерапию с применением препаратов платины. Такие препараты выводят лечение пациенток, страдающих раком яичников, на качественно новый уровень и улучшают их выживаемость.
Иммунотерапия — новое модное на сегодня направление, которое при раке яичников только изучается. Иммунная система человека очень сложная, и, к примеру, сейчас уже установлено, что рак «прячется» от иммунного ответа организма. В последние годы активно изучается группа препаратов — ингибиторов контрольных точек (checkpoint-ингибиторы), которые делают опухоль «видимой» для собственной иммунной системы, и уже сам организм человека подключается к уничтожению рака. Ингибиторы контрольных точек уже зарегистрированы в лечении меланомы и рака легкого, и нам остается лишь держать руку на пульсе современных медицинских исследований и ожидать выхода новых инновационных препаратов.
Можно ли сформулировать порядок действий для профилактики рака яичников — в каком возрасте какие обследования проходить женщине?
Профилактика рака яичников связана с уже упомянутыми факторами риска: правильное питание, своевременное лечение воспалительных процессов, обследование и лечение кист, лечение эндометриоза и других предраковых заболеваний.
Те, у кого выявлена генетическая мутация, встают на учет к генетику и проходят специальную скрининговую диагностику с раннего возраста. Мутация BRCA1/2 может проявляться и в виде рака молочной железы, и виде рака яичников, поэтому женщины группы риска должны проходить осмотр у гинеколога и маммолога регулярно с 25 лет. С 25-30 лет раз в год необходимо делать МРТ молочных желез и маммографию, с 35 лет — УЗИ яичников, малого таза и брюшной полости, а также анализ крови на определение маркера CA125.
Главным помощником женщины может быть ее собственная информированность и онконастороженность. Рекомендую каждой женщине после 30-35 лет регулярно проходить осмотр у гинеколога и проверять молочные железы.
источник
Автореферат и диссертация по медицине (14.00.14) на тему: Рак молочной железы в сочетании с опухолевыми заболеваниями матки и яичников
1.1. Некоторые особенности клинического течения диагностики лечения и прогноза первично-множественных злокачественных новообразований молочной железы, шейки матки, тела матки и яичников.
Глава II. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ.
Глава III. ПЕРВИЧНО-МНОЖЕСТВЕННЫЙ РАК МОЛОЧНОЙ
III. 1. Общая характеристика материала.
111.2. Синхронный рак молочной железы и шейки матки.
111.3. Метахронный рак молочной железы и шейки матки.
Актуальность проблемы. Среди множества проблем клинической онкологии в настоящее время одной из основных остается проблема своевременной диагностики и эффективного лечения первичной множественности L злокачественных опухолей.
Для практического врача остаются спорными и нерешенными вопросы этой проблемы. Практические врачи лечебно-профилактических учреждений общего профиля и врачи-онкологи недостаточно осведомлены о методах диагностики и лечения больных с первично-множественными злокачественными опухолями. Противоречивость публикуемых материалов по данной проблеме, большой процент врачебных ошибок и низкие показатели ранней выявляемости заболевания, особенно опухолей второй- локализации,- а также- высокий процент-смертности этой категории больных указывают на необходимость обобщения накопленных к настоящему моменту сведений. В полной мере все сказанное относится к случаям сочетанных опухолевых поражений молочной железы, матки и яичников. На наш взгляд, среди данной категории больных особо следует вьщелигатрушу жешцшг на тему «Рак молочной железы в сочетании с опухолевыми заболеваниями матки и яичников»
1. Общая и безрецидивная выживаемость больных первично — множественным раком молочной железы и шейки матки в сроки 5 ( 56,7% и 53,7%) и 10 (28,3% и 8,6%) лет достоверно хуже аналогичных показателей выживаемости больных раком молочной железы контрольной группы в сроки 5 лет (81,7% и 69,1%) и 10 (65,3% и 51,3%) лег (р по медицине, диссертация 2005 года, Лещев, Василий Васильевич
1. Абдурасулов Д.М Вопросы этиопатогенеза, эпидемиологии и клиники множественных опухолевых поражений.— Ташкент: Медицина, 1977. с 14-144
2. Абдурасулов Д.М., Никишин К.Е. -Множественные опухолевые поражения Т. 1.//Первично множественные опухоли — Ташкент: Медицина,. 1968 — 652с.
3. Артюх Г.Ф. О множественных первичных опухолях.//Клинич. медицина -1972 33 №5. с.24-29.
4. АтласШМ: Иллюстрированное руководство по TNM / pTNM -классификация злокачественных опухолей/. Пер. с англ. 4-го издания/. Под ред. В. Е. Кратенка, Е. А. Короткевича.- Минск: Белорусский центр науч. Мед. Информации, 1998.-381с., стр. 201-244.
5. Бохман Я.В., Лившиц М.А., Винокуров В.Л, и др.— Новые подходы к лечению гинекологического рака. // Первично-множественные опухоли гениталий, молочной железы и толстой кишки — СПб.: Гиппократ, 1993,- 221с.
6. Бохман Я.В. — Руководство по онкогинекологии.// Первично-множественные опухоли. Л.Медицина 1989.- 464с.
7. Бохман Я.В., Рыбин Е.П. Патогенические аспекты первично-множественных опухолей толстой кишки, тела матки, молочной железы//Гл. в кн.: Первично-множественные злокачественные опухоли. — Л. 1987.-C47-56.
8. Бохман Я.В., Мерабишвили В.М. Семиглазов В.Ф.Патогенетические подходы к профилактике и лечению гормонозависимых опухолей. -Л. Медицина, 1983.-cl 1-22.
9. Бохман Я. В., ЛютраУ. К. Рак шейки матки, Кишинев: Штиипца, -1991.-240 стр.
10. Василенко И. Я., Москалева Ю. И., Стрельцова В. Н. Канцерогенный эффект ионизирующего излучения в комбинации с химическими и другими физическими агентами // Вонр. Онкологии. — 1996 . № 2 —с. 3 14.
11. Верморкен Я. — Эпителиальный рак яичников: состояние проблемы.// Материалы второй ежегодной конференции «Современные тенденции развития лекарственной терапии опухолей». М., 1998. — стр. 85-88.
12. Винокуров В.Л., Ливший М.А., Митрохина М.В., Максимов С.Я. — Рак яичников в сочетании с другими злокачественными опухолями// Первично-множественные злокачественные оиухоли. Л. 1987г. с. 120123.
13. Вихляева Е.М., Палладии Г.А. Патогенез, клиника и лечение миомы матки. Кишинев, 1982.-300с.
14. Вишневская Е.Е., БохманЯ.В. Ошибки в онкогинекологической практике// Ошибки в диагностике первично-множественных злокачественных опухолей и метастатических поражений,- Минск: Беларусь, 1987.-237с.
15. Высоцкая И.В. Прогностическое значение опухолевых маркеров РЭА, СА-15-3,МСА, ферритина, ТПА и ПТГ при раке молочной железы.//Автореф. дисс на соиск. учен степ. канд. мед. наук, М.,1993 С19-21.
16. Габуния М.С., Братик А.В., Олимпиева С.П. — Факторы риска развития доброкачественных заболеваний молочной железы на фоне гинекологических заболеваний. Маммология №2: с. 21-30, 1998.
17. Ганина К.П., Коханевич Е.В., Винокур M.J1. Диагностика предопухолевых и опухолевых процессов шейки матки. — Киев: Наукова думка, 1984 .с.48-51
18. Ганцев Ш.Х., Мерабишвили В.М., Куликов Е.П. и др. -Распространенность и риск возникновения первично-множественных опухолей по материалам популярного канцер-регистра. Рос. Онкол. Ж. №5: 4-7,199&
19. Годорожа Н.М. — Аспекты профилактики рака молочной железы: Автореф. Дисс на соиск. ученой степ.д-ра мед. наук, Киев, 1991г.с16-21.
20. Гумилевская Е.П. О первично-множественных злокачественных опухолях// Вопр. Онкологии.-1966 № 9- с84-88
21. Дарьялова СЛ., Чиссов В.И. Диагностика и лечение злокачественных опухолей. Москва, 1993г., стр.238-250.
22. Давыдов М. И., Аксель Е. М, — Злокачественные новообразования в России и странах СНГ в 2000г., Москва, 2001г.
23. Двойрин В.В., Аксель Е.М., Трапезников Н.Н. Статистика злокачественных новообразований в России и некоторых других странах СНГ в 1994 г. — М., 1995.
24. Демидов В.П., Островцев Л.Д. — Первично-множественный рак молочной железы. Рос. Онкол. Ж. № 5: 21-26, 1998.
25. ДильманВ.М. Эндокринологическая онкология. М.; Медицина, 1983г. C149-167
26. Железнов Б.И., Стружаков А.Н. Генитальный эндометриоз. -М.,1985г.-160 с.
27. Злокачественные новообразования в России в 1998 г. (заболеваемость и смертность). /Под ред. Акад. В.И. Чисова, проф. В.В. Старинского, канд. Мед. Наук Л.В. Ременкик. М., 1999. стр. 284.
28. Иванов В.М. Рак молочной железы у больных пожилого и старческого возраста.// Автореферат диссертации на соискание учепоий степени доктора мед. паук., М.Д993. с 18-20.
29. Имянитов Е.Н., Хансон К.П. Молекулярные аспекты патогенеза первично-множественных опухолей // Рос. Онкол. Ж. — 1998. — №5. стр. 47-51.
30. Косгромина К.Н. Современное состояние и перспективы развития лучевой терапии гинекологического рака// Мед.радиол.-2001 .T.46,№ 1. С.48-51.
31. Кузьмина З.В., Бассалык Л.С. Муравьева Н.И. Цитоплазматические рецепторы стероидных гормонов в опухолях больных раком эндометрия//Акуш. и.гинек.-1998.-№4.с29-32.
32. Куликов Е.П., Лебедев A.M., Антонова Т.П. и др. Анализ заболеваемости и результаты лечения первично-множественных злокачественных опухолей. — Рос. Онкол. Ж. №5: 39-41, 1998.
33. Летягин В.П., Высоцкая И.В. Первичный рак молочной железы(диагностика, лечение, прогноз).М.,1996, 160.
34. Летягин В.П., Высоцкая И.В., Легков А.А. Лечение доброкачественных и злокачественных заболеваний молочных желез. М., 1997.С23-29.
35. Максимов С.Я. Возможности современного выявления первично-множественного рака тела матки и молочной железы: Автореф.дисс. на соиск. ученой степ. канд. мед. паук. — Л., 1990.cr.9-I9
36. Международная гистологическая классификация опухолей.Второе издание ВОЗ, «Женева», 1984.
37. Мельников Р. А., Рыбин Е.П., Бохман Я.В. //Первично-множественные злокачественные опухоли. Л., 1987.-стр. 120-123.
38. Новикова Е.Г., Антошечкина Е.Т. В кн.: Ошибки в клинической онкологии., иод ред. В.И. Чиссова, А.Х. Трахтенберга — М.: Медицина, 1993г. -С.442-451, 426-441.
39. Новикова Е.Г. Диагностика предраковых заболеваний и начальных форм рака шейки матки. Заболевания шейки матки,влагалиша и вульвы (клинические лекции).М.,Медпресс 1999;с153-9.
40. Новикова Е.Г., ЧулковаО.В., Беляева И.Г. Особенности первично-множественных опухолей репродуктивной системы у женщин.Росс.Онкол.Журнал №5 1998. С. 18-21.
41. Огнерубов Н.А., Летягин В.П., Подцубная И.В. с соав. Рак молочной железы: неоадъювантная химиолучевая терапия. — Воронеж, 1996.с64
42. ПорхановаН.В. Рецидивы серозного рака яичников(факторы прогноза и диагностика).Дисс. канд. мед. наук. М.,1999. стр47-84.
43. Сельчук В.Ю. Первично-множественные опухоли (клиника, лечение и закономерности развития). — Автореферат диссертации на соискание ученой степени докторской дисертации. Москва, 1994.
44. Сидорова И.С., Караулов А.В., Курашвили Ю.Б.//Вестн. Российской Ассоциации акушеров-гинекологов-1998.-№4.-С.87-88.
45. Слинчак С.М. Множественные злокачественные опухоли. Киев: Здоровья-1968-191с.
46. Толокиов Б.О. Современная комплексная диагностика и лечение больных хориокарциномой матки .Онкогинекология Т2 №2 с.49-50.
47. Тюляндин С. А. — Рак Яичников: Вчера, сегодня, завтра.// Материалы конференции «Современные тенденции развития лекарственно терапии опухолей». М., 1997. — стр. 66-70.
48. Ханов A.M. Эпидемиология, факторы риска и оптимизации диагностики первично-множественных злокачественных опухолей: Автореф.дис. на соискание уч. ст. канд. мед. наук. — М., 1994.
49. Харитонова Т.В. Опухоли яичников: клинические проблемы. Русский медицинский журнал Том 6, № 10 1998 с667-676
50. Холин В.В. Оценка результатов лучевого и комбинированного лечения рака шейки матки //Мед.радиолог.-1978.-№8.-С. 75-78.
51. Цель Е. А. Первично-множественные злокачественные опухоли: Автореф. дисс. на соиск. учен. степ. канд. мед. наук.-М., 1947.-18 с.
52. ЧекаловаМ.А. Ультразвуковая диагностика злокачественных заболеваний тела матки. Автореф. на соискание учен, степени, д-ра. мед. наук. М.,1999
53. Чиссов В.И., Трахтенберг А.Х., Первично-множественные злокачественные опухоли, Москва, «Медицина», 2000г.Гл.11.с.251-273.
54. Ягунова JI.B. К вопросу о сочетании рака молочной железы и карциномы других локаштзаши1//Х1фургия.-1968 №1-с86-89.
55. Adamopoulos D.A.,Loraine J.A., Dove G.A.Endocrinological studies inwomen approaching the menopause// J. of Obstetr. And Gynaecol/ of the
56. British Commonwealth.-1971.-vol. 78.-p.62-79.
57. Anaslassiades O., Lakovou E., Slravridou N. el al. Multi-centricily in breast cancer. A study of 366 cases// Amer. J.clin.path. 1993. — Vol.99, N 3. -P.238 -243.
58. Bertelsen K.,Jakobsen A., Stroyer J. et al. A prospective randomized comparison of 6 ad 12 cycles of cyclophosphamide,adi iamycin and cisplatin in advanced epithelial ovarian cancer :a Danish Study Group trial (DACOVA). Gyn Oncol 1993; 49:30-6
59. Billrot С.A.T. Die algemeine Chirurgie, Pathologie und Therapie.-Berlin: G.Reimer.- I889.-P. 908/
60. Bonle J., Jde P., LillelG., Wynanls P. //Gynecol. Oncol.-1981.-Vol.l 1.-Р.140-161/
61. Blatt J., Olshon A., Gula M. J. et al. Second malignancies in very-long term survivors of childhood cancer// Amer.J. Med.-1992.-Vol.93,Nl-P.57-60.
62. Bokhman J.B., Maximov S.J. Relative risk of development and active detection of primary multiple endometrial, breast and ovaria cancer // Eur. J. Gynaecol.Oncol.-1993.-Yol. 14,N2.-P. 114-118.
63. Buist M.R., Golding R.P., Burger C.W. et al.//Gynecol.Oncol.-1994.-Vol.52.-№ 2.-P. 191-198.
64. Caldas C., Ponder B.A.J. Cancer genes and molecular oncology in the clinic//Lancet.- 1997.-Vol. 14.-P.574.
65. Casey G. The BRCA1 and BRCA2 breast cancer genes// Curr. Opin. Oncol. -1997. Vol.9. — P.88-93.
66. Champault G., Loygue J. Cancer multiples et familieux //Med.chir.gig/1977.-Vol.276.-P.404-407/
67. Chassagne D., Sismondi P.J.C. et al. A glossary for complications of ment in gynecological cancers //Radiother.Oncol.-1993.-Vol.26.-P. 195-202/
68. Chlebowski R.T., Butler J., Nelson A., Lillington L. Breast cancer chemoprevention. Tamoxifen: current and future prospective. //Cancer,1993, 72 (3 suppl): 1032-7
69. Crowe J.P Jr., Godon N.H., Stenk R.R. et al.Short-term tamoxifen plus chemotherapy: Superior results in node-positive breast cancer.// Surgery,1990,108/4,619-628.
70. Di Saia P.J., Creasman W.T. Clinical Gynecologic Oncology.-St/ Louis: Mosby Cjmr any ,1992
71. Eng C., Mulligan L. M. Mutations of the RET proto-oncogene in the multiple endocrine neoplasia type 2 syndromes, related sporadic tumours, and hirschsprung disease// Hum. Mutat. 1997. — Vol. 9. -P.97-109.
72. Fisher В Experimental and clinical justification for the use of tamoxifen in a breast cancer prevention trial: a description of the NSABP effort(meeling abstract). //Proc. Annu Meet. Am. Assoc. Cancer. Res., 1992,33:A 567-8
73. Fisher B.,Carbone P., Economon S.G. L-Phenilalanine mustard (L-PAM) in the management of primary breast cancer.N. Engl.Med.,1975,292,117.
74. FribergB. et al.,//ActaObstet.Gynecol.Scand.-1997.-Vol.76.Suppl.l67.
75. Fritsche H.A. Serum tumor markers for patient monitoring : a case-oriented approach illustrated with carcinoembryonic antigen.Clin.Chem., 1993,39, IIB, Pi 2, p.2431 2434.
76. Gben S., Lee L. Incidence of paraaortic and pelvic lymph node metastases in epithelial carcinoma of the ovary. Gyn Oncol 1983; 16: 95-100.
77. Grimes E.M. Richardson M.R. //Gynecology and Obstetrics./Eds J .J.Sciarra.-Philadelphia,l992.-Vol. 5 .-P.65.
78. Halsted W.S.: The results of Operations for the Care of Cancer of the Breast Performed at the Johns Hopkins Hospital from June 1889 to January 1894. Arch.S urg., 1894,20:497.
79. Hata K„ Hata T.,Kitao M.//Am.J.Obstet.Gynecol. 1995.-Vol 172.-№5.-P. 1469-1500.
80. Hickey J., Goldberg F. Ultrasound Review of Obstetrics and Gynecology.-Philadelphia; New York,l996/
81. Hurt H.H., Broders A.C. Multiple primary malignant neoplasms //J. Lab. Clin.Med.-1953.-Vol.13.-P.765.
82. Kennedy A. W., Markman M., Webster K. D., et al. Combination chemotherapy of ovarian and fallopian tybe cancer and primary peritoneal carcinoma with carboplatin and docetaxel.//Proc. ASCO. 2000.
83. Lee Т.К., Myers R.T., Schaiyj M., Marshall R.B. Multiple primary malignant tumors (MPMT): study of 68 autopsy cases (1963-1980)//J.Amer.Geriat.Soc.-1982.-Vol.30.-P.744.
84. Jordan V.C. Preclinical and clinical pharmacology of tamoxifen (meeting abstract). // CCPC-93: Second International Cancer Chemo Prevention Conference. April 28-30, 1993, Berlin, Germany,p.51,1993
85. Jurkovic D., Jauniaux E., Campbell S.// The Fetus as a Patient / Eds A.KuijakF.A. Chervenak. 1994. P. 135.
86. Madden J.L. Modified radical mastectomy. Surg. Gynec. And Abstr. Dec. 1965, Vol.121, 1221-1231.
87. Madden J.L., Kandalaf Z.S., Bourgue R. Modified Radical Mastectomy. Ann. Surg., May 1972, vol. 175, №5, 624-634.
88. Mauriiac L., Durand M., Avril A. Effect of primary chemotherapy in conservative treatment of breast cancer patients with operable tumor larger than 3 cm: results of a randomized trial in a srugle center. Am. Oncol., 1991, 2, 347.
89. Malrnio K.Multiple primary cancer.A clinical-statistical investigation based on 650 cases //Ann. chirurgie Gynecol. Penniae.Helsinki.-1959.-Vol.48, N3.-P.56-60.
90. Markman M. Intraperitoneal therapy of ovarian cancer.// Semin. Oncol. — 1998. Vol. 25. — P. 356 — 360.
91. Markman M., Bookman M. A., Second-line treatment of ovarian cancer.// The Oncologist. 2000 — Vol. 5. — P. 26 — 35.
92. Minderhoud-Bassie W., Treurniet F.E., Koops W et al.//Acta Obstet.Gynecol.Scand.-1995.-Vol.74.-№10.-P.827-831.
93. Moertel С., Dockerty M., Baggenstoss A.//Cancer.-1961-Vol.l4.-P.238-248/
94. Morrow G.P., Curtin J.P. Gynecologis Cancer Surgery. Cburcbill Livingstone 1996.
95. Nengut A., Robinson E. Multiple primary neoplasms // Cancer J. -1992-Vol. 5, N 5.- P.245-248.
96. Paley D., Dyson W. The prognosis of carcinoma of the breast in relation to the type of operation performed. Brit. J. Cancer, 1948,v.2,7-13/
97. Pearl M., Johnston C., Frank Т., Roberts I.//Int. J. Gynaecol. Obstetr.-1993/-Vol 43, N 3.-P.305-312.
98. Powell D.E., Puis L., Ragell I. Current concept in epithelial ovarian tumours: does benignto malignant transformation occur? Human Pathol., 1992, v. 23, p.846-847.
99. Rose P.G., Fraire A.E. Multiple primary gynaecologic neoplasms in a young HIV-positive patient.- J. Surg/Oncol.-1993.-Vol.53, N 4.-P.269-272.
100. Rubagotti A., Perrota A., Casella C.,Boccardo F. Risk of primaries after chemotherapy and/or tamoxifen treatment for early breast cancer//
101. Ann. On col. -1996. Vol .7. -P.239-244/
102. Rusin G. J. S., Nelstrop A. E., Benzen S. M. et al. Use of tumor markers in monitoring the course of ovarian cancer.// Ann. Oncol. 1999. — Vol. 10 (suppl. 1).-P. 21-27.
источник
Рак молочной железы в сочетании с опухолевыми заболеваниями матки и яичников Лещев Василий Васильевич
Данный автореферат диссертации должен поступить в библиотеки в ближайшее время
Уведомить о поступлении
480 руб. | 150 грн. | 7,5 долл. ‘, MOUSEOFF, FGCOLOR, ‘#FFFFCC’,BGCOLOR, ‘#393939’);» onMouseOut=»return nd();»> Диссертация — 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
240 руб. | 75 грн. | 3,75 долл. ‘, MOUSEOFF, FGCOLOR, ‘#FFFFCC’,BGCOLOR, ‘#393939’);» onMouseOut=»return nd();»> Автореферат — 240 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Лещев Василий Васильевич. Рак молочной железы в сочетании с опухолевыми заболеваниями матки и яичников : диссертация . кандидата медицинских наук : 14.00.14 / Лещев Василий Васильевич; [Место защиты: ГУ «Российский онкологический научный центр РАМН»]. — Москва, 2005. — 113 с. : 10 ил. РГБ ОД,
1.1. Некоторые особенности клинического течения диагностики лечения и прогноза первично-множественных злокачественных новообразований молочной железы, шейки матки, тела матки и яичников 9
Глава II. Материалы и методы исследования результаты собственных исследований 24
Глава III. Первично-множественный рак молочной железы и шейки матки
III.1. Общая характеристика материала 30
III.2. Синхронный рак молочной железы и шейки матки 32
III.3. Метахронный рак молочной железы и шейки матки 34
Глава IV. Первично-множественный рак молочной железы и тела матки
IV.1. Общая харакгерисшка материала 44
IV.2. Рак молочной железы и тела матки 47
IV.3. Метахронный рак молочной железы и тела матки 49
Глава V. Первично-множественный рак молочной железы и яичников
V.1. Общая характеристика материала 65
V.2. Синхронный рак молочной железы и яичников 67
V.3. Метахронный рак молочной железы и яичников 71
Глава VI. Рак молочной железы в сочетании с миомой матки и кистами яичников
VI. 1 Общая характеристика материала 86
VI.2. Рак молочной железы в сочетании с миомой матки 87
VI.3. Рак молочной железы в сочетании с кистами яичников 91
Глава VII. Рак молочной железы без сопутствующей гинекологической патологии (контрольная группа) 99
Актуальность проблемы. Среди множества проблем клинической онкологии в настоящее время одной из основных остается проблема своевременной диагностики и эффективного лечения первичной множественности злокачественных опухолей.
Для практического врача остаются спорными и нерешенными вопросы этой проблемы. Практические врачи лечебно-профилактических учреждений общего профиля и врачи-онкологи недостаточно осведомлены о методах диагностики и лечения больных с первично-множественнылш злокачественными опухолями. Противоречивость публикуемых: материалов по даяшйг проблеме, большой процент врачебных ошибок и низкие показатели ранней выявляемости заболевания, особенно опухолей второй- локализации,- а также- высокий процент-смертности этой категории больных указывают на необходимость обобщения накопленных к настоящему моменту сведений. В полной мере все сказанное относится к случаям сочетанных опухолевых поражений молочной железы, матки и яичников. На наш взгляд, среди данной категории больных особо следует вьіделйть
груішу жешціщг сірадатошдіХ’ракой»молочнШ»железьти^ймеютіщх»кшш
е» — либо опухолевые изменения в матке и яичниках. Общеизвестно, что на протяжении последних лет в- структуре заболеваемости злокачественными новообразованиями у женщин рак молочной железы занимает первое место, составляя 19,3%. [52]. В мире ежегодно выявляется до 1 миллиона новых злокачественных опухолей, и прогнозируется в 2010 году 1,45 миллиона новых злокачественных опухолей и по мере нарастания заболеваемости раком молочной железы увеличивается частота первично-мнижественньог опухолей: [29,52,25] Среди всех первично-множественных злокачественных новообразований на долю рака молочной железы прігходится, по данным различных авторов, от 9,5% до 21,9% [52,4;45].
В настоящее время можно говорить о значительных успехах, достигнутых в лечении этой группы онкологических больных. Однако по-прежнему показатели смертности остаются высокими. [34,29,24,25]. С учетом этого, по нашему мнению,
5 необходимо уделять пристальное внимание и наиболее тщательно изучать все патологические процессы, обнаруженные в шейке матки, эндометрии и яичниках, сопутствующие раку молочной железы, так как именно им принадлежит основная роль в течение злокачественного процесса в молочной железе. [37, 54,38].
Причины возникновения первичной множественности еще не установлены, но существует ряд факторов, способствующих развитию данной патологии. Основными» этиологическими факторами при первично-множественных опухолях молочной железы, матки и яичников считают генетические, гормональные, а также факторы внешней среды [8, 9, 45].
В патогенезе этих опухолей ведущую роль играет повышенная активность гипоталямо — гипофизарной системы, которая приводит к повышенной секреции пролактина, гормона роста, кортизола и хронической гиперэстрогенизации. Но особую значимость придают изучению роли гормональных нарушений в возникновении первично-множественного рака. Недостаточная реализация детородной функции, многократные аборты, отказ от кормления грудью, поздние первые роды, заболевания женских половых органов влияют на гормональный фон [7,41, 42].
Н.М. Годорожа [21] считает, что развитию метахронного рака молочных желез после излечения первой опухоли способствуют кисты яичников, новые беременности, повышение уровня аланинаминотрансферазы перед лечением первого рака, а также рак» других органов у^ кровных родственников» [36>. Значение лучевого- и хилшотерапевтического воздействия в развитии метахронно-развившегося- рака при комбинированном лечении первой опухоли не- находит достоверного подтверждения [34].
В большинстве работ, посвященных этой проблеме, приводятся результаты изучения поражений различных органов, целостного организма человека множественными опухолями, не имеющих анатомической и функциональной взаимосвязи. Однако ЭТИ р&бвШ имею Г в’Основном fOjibKO ОІШсательньій характер. Мы акцентируем- внимание на склонности к возникновению множественности опухолей в системе органов, вьшолняющих одну функцию.
«Если рак появляется в- одном- органе системы, другая* первичная опухоль наиболее часто появляется в органе той же системы», — отмечали еще в 1932 году Н. Hurt и A. Broders [77].
Лечебную тактику при первично- множественных опухолях необходимо определять с учетом наиболее важных прогностических факторов: степени распространенности опухоли;^ункіщ61ішшной значимости пораженного органа; перспективы’ &’ тяжести предстоящей операции. Этот принцип’ позволяет» индашидуализіфовать лечение каждой больной. Несомненно, при всех равных условиях в первую очередь следует провести лечение опухоли, клинические проявления которой более выражены. Только в случае успешного радикального ее излечения создаются предпосылки для лечения второй опухоли. В. И. Чиссов., А. X. Трахтенберг [52].
Цель и задачи работы. Целью работы явилось изучение особенностей течения и результатов лечения больных раком молочной железы в сочетании с опухолевыми заболеваниями матки и яичников.
Для достижения поставленной цели нами были решены следующие задачи.
Сравнить отдаленные результаты лечения больных первично-множественным раком молочной железы и тела матки с таковыми у больных раком молочной железы без патологических изменений матки и яичников, составивших контрольную группу.
Оценить 5-ти и 10-ти летние результаты лечения больных первично-множественным раком молочной железы и шейки матки, и больных контрольной группы.
Сравнить показатели выживаемости больных первично-множественным раком молочной железы и яичников, и больных контрольной группы.
Сравнить отдаленные результаты лечения больных раком молочной железы в сочетании с доброкачественными опухолями матки и яичников и больных контрольной группы.
Оценить диагностическую значимость СА-125, РЭ, РП у больных раком молочной железы в сочетании с опухолевой патологией матки и яичников.
Впервые определены и проанализированы особенности клинического течения и результаты лечения больных первичко-множествеїшьтми злокачественными новообразованиями молочной железы, матки и яичников. При этом выявлено, что общая и безрецидивная выживаемость этой категории больных достоверно хуже аналогичных показателей больных, страдающих только раком молочной железы, (контрольная группа). При оценке выживаемости нами отмечена следующая тенденция: трех- и пятилетняя общая и безрецидивная выживаемость больных метахронным раком молочной железы в сочетании с раком тела, шейки матки и яичников, превышает соответствующие данные больных синхронными опухолями.
Впервые на большом количестве больных проанализированы особенности клинического течения и выживаемость больных раком молочной железы в сочетании с миомой матки и кистами яичников. Показано, что общая и безрецидивная выживаемость данной категории пациенток достоверно не отличается от показателей выживаемости больных раком молочной железы контрольной группы в аналогичные сроки.
В случаях первично-множественных злокачественных новообразований молочной железы, матки и яичников не было зарегистрировано какой-либо зависимости результатов общей и безрецидивной выживаемости больных от содержания рецепторов эстрогенов и прогестерона в ткани опухоли молочной железы.
Полученные данные свидетельствуют о том, что выживаемость больных раком молочной железы в сочетании со злокачественными опухолевыми заболеваниями матки и яичников достоверно хуже аналогичных показателей у больных контрольной группы. Следовательно, наличие злокачественных патологических изменений в матке и яичниках можно расценить как фактор, ухудшающий течение и прогноз рака молочной железы.
Практическая значимость
Таким образом, в результате проведенного исследования получены веские
доказательства того, что успех лечения пациенток с первично-множественными
злокачественными опухолями молочной железы матки и яичников зависит в
первую очередь от своевременности выявления множественных неоплазип на
ранних стадиях их развития. Активный поиск у каждой жешцины особенно с
эндокринно-обменными нарушениями, генетической предрасположенностью
должен быть направлен как минимум на три органа: эндометрий, яичники,
молочные железы. Углубленные обследования (маммоірафия, цитологическое
исследование аспиратов из полости матки, УЗИ органов брюшной полости и
органов малого таза, исследование опухолевых маркеров) показано всем
женщинам, заболевшим раком молочной железы. Нами разработан алгоритм
обследования больных первично-множественными опухолями молочной железы,
матки и яичников, который облегчит работу врачей общей лечебной сети,
гинекологов и онкологов в вопросе ранней диагностики первично-
множественных опухолей молочной железы, матки и яичников.
Некоторые особенности клинического течения диагностики лечения и прогноза первично-множественных злокачественных новообразований молочной железы, шейки матки, тела матки и яичников
Злокачественные новообразования являются сложнейшей медицинской и социальной проблемой современного общества. Общеизвесшо, что на протяжении последних нескольких лет в структуре заболеваемости злокачественными новообразованиями у женщин рак молочной железы занимает первое место, составляя 19,3% [20, 24, 25, 29]. По мере нарастания заболеваемости раком молочной железы увеличивается частота первично-множественных поражений органов репродуктивной системы. Среди всех первично-множественных злокачественных новообразований злокачественные первично-множественные опухоли органов репродуктивной системы составляют 20 %. [7,45,24, 25].
Злокачественные опухоли лишь в небольшом числе наблюдений являются случайной находкой и возникают на фоне полного здоровья. Гораздо чаще до развития злокачественного новообразования у пациентки уже имеются одно или несколько хронических заболеваний, многие развиваются впоследствии [1, 2, 3, 19]. При этом не всегда именно опухоль в наибольшей степени влияет на качество жизни заболевшего, определяет прогноз для его жизни. В этой связи становится понятна актуальность проблемы сочетанных опухолевых и неопухолевых поражений у онкологических больных и, в частности, проблемы первично-множественных опухолей. [22].
Проблема первичной множественности злокачественных опухолей привлекает внимание исследователей давно. Вплоть до 50-х годов XX века публикации носили лишь казуистический характер, а первичную множественность выявляли в основном на аутопсии [1, 2, 3]. В отечественной литературе частота встречаемости первичной множественности опухолей впервые была указана Е. А. Цель в 1947 году [56].
Еще J. Warren и О. Gates [112] установили, что частота встречаемости первично — множественных злокачественных опухолей, по результатам изучения операционных препаратов, составляет — 0,76 %, а согласно результатам вскрытия, достигает — 3,9%.
Вопросы профилактики и лечения сочетанных опухолей женской репродуктивной системы относятся к числу наиболее актуальных и приоритетных задач современной медицины [6, 22, 35].
Достигнутые успехи в лечении онкологических больных, а, следовательно, увеличение продолжительности их жизни привели к повышению вероятности возникновения новой опухоли [1, 2, 3, 7, 27]. Как отмечает Lee Т. К., [86] больные, прожившие после установления диагноза и лечения по поводу злокачественной опухоли двадцать лет и более, имеют повышенный риск возникновения второго новообразования, составляющий 51% для женщин. Причины этого можно разделить на генетически обусловленные, гормональные, связанные с условиями окружающей среды и ранее проведенным лечением [8, 9, 12]. Изучение особенностей распространения первично-множественных опухолей становится все более актуальным в связи с существенным эффектом лечения онкологических больных, а следовательно, увеличением продолжительности их жизни и увеличением вероятности возникновения новой опухоли [10, 25,26].
В последнее время обращает на себя внимание большая склонность к возникновению множественных неоплазий в одном органе или системе органов, тесно связанных друг с другом общей структурой или функцией. «Если рак появляется в одном органе системы, другая первичная опухоль наиболее часто появляется в органе той — же системы» — отмечали еще в 1932 году Hurt и Brodes. [84]. Такая многоочаговая малигнизация является ответом морфологической и функционально однородных тканей на экзогенное и (или) эндогенное воздействие [27].
Реальная опасность и клиническое значение первично-множественных (как синхронных, так и метахронных) злокачественных опухолей женских половых органов обусловлены ростом заболеваемости и отсутствием тенденции к снижению смертности от рака гениталий. Этому способствует и рост числа больных с множественными ыеоплазиями [24, 25,29,35].
Совершенствование имеющихся и разработка новых методов комбинированного и комплексного лечения злокачественных опухолей у женщин приводит к увеличению показателей выживаемости пациенток, что повышает потенциальные возможности возникновения и клинического проявления новых опухолей [8, 31].
По сводным данным, частота множественных опухолей, по данным различных авторов, колеблется от 0,3 до 12 % [1, 2, 3, 24, 25, 48].Средняя вероятность возникновения первично-множественных опухолей органов репродуктивной системы составляет 3 — 4 % по отношению к больным, излеченным от рака в течение 5 лет и более [1,5, 40].
У больных с нейроэндокринными гинекологическими заболеваниями патологическая перестройка молочных желез выявляется в 97,8 % [20]. Большинство исследователей обоснованно полагают, что развитие дисгормональной патологии молочных желез и возникновение заболеваний со стороны гениталий являются звеньями одной патогенетической цепи [18, 20, 22, 27, 35].
Установлено, что при повышении степени пролиферативной активности эндометрия в постменопаузальном периоде возрастает частота рака молочной железы: в группе больных железистой гиперплазией и полшгозом, рак молочной железы диагностирован у 8,7 %, при раке эндометрия у 12,5 %. [28].
Сведения о взаимосвязи между особенностями метаболизма эстрогенов и риском возникновения гормонозависимых опухолей, в частности рака молочной железы, яичников и эндометрия, можно на сегодняшний день считать твердо установленными [27]. Женщины с нарушением жирового и углеводного обмена, страдающие ожирением, сахарным диабетом и гипертонической болезнью в период пред- и постменопаузы, составляют группы риска развития как одиночных, так и первично — множественных опухолей молочной железы, матки и яичников.
Метахронное сочетание злокачественных опухолей молочных желез и шейки матки (23 больных 76,7 %) в нашем исследовании встретилось чаще синхронного (7 больных 23,3%) более чем в 3 раза. Для метахрошюго рака молочной железы и шейки матки характерен более молодой возраст пациенток. На момент выявления первой опухоли возраст пациенток колебался от 35 до 63 лет (в среднем 47,8 лет). При синхронном поражении (в среднем 52,7), что на 4,9 лет меньше, чем при метахронном.( р 0,05) Во время выявления первой опухоли больные находились в возрасте от 35 до 63 лет (в среднем 47,8 лет). Во время выявления второй опухоли больные находились в возрасте от 40 до 75 лег (в среднем 52 года). Интервал между выявлением двух опухолей колебался от 1 года до 32 лет и в среднем составил 8 лет. Наиболее часто второй рак выявлен в сроки от 5 до 10 лет — 8 человек, до 5 лет — 4 человека, от 10 до 20 лет — 4 человека, от 20 до 35 лет — 7 человек. При метахронном раке 13 (56,3 %) женщин заболели сначала раком молочной железы и . 10 (33,3 %) заболели сначала раком шейки матки.
Стадии первой опухоли, развившейся в молочной железе: I ст (T1N0M0) — 2; II«A»(T2N0M0 У 5; II«B»(T2N1M0) — 5; III«;A»(T3N1M0) — 1), Стадии первой опухоли, развившейся в шейке матки: I ст (Tla,6N0M0)-6; II ст (T2a,6N0M0)-2, III ст (T36N1M0HU IVCT. (T4N1M1H-Средний возраст больных, заболевших раком молочной железы, — 50,8 лет, а средний возраст больных, заболевших раком шейки матки, — 45,1 лет (разница 5,7 года). Средний возраст больных, у которых второй опухолью был рак молочной железы, — 52,7 лет. Средний возраст больных, второй опухолью у которых был рак шейки матки, — 54,6 лет (разница 1,9 года). Интервал между выявлением двух опухолей в случаях, если первой обнаруженной опухолью был рак молочной железы, составил 7,4 года, в случаях, если первой выявленной опухолью был рак шейки матки, — 9,3 года (разница 1,9 года) (р 0,05).
Стадии второй опухоли, развившейся в молочной железе: П«А» (T2N0M0 У 4; П«В» (T2N1M0) — 4;III«A»(T3N1M0) — l;IVcr.(T4N2Ml)-l. Стадии второй опухоли, развившейся в шейке матки: I ст (Tla,6N0M0)-4; II ст. (T2a,6N0M0)-4, III ст. (T36N1M0H. IVCT. (T4N1M1)-1. По гистологической структуре опухоли в молочной железе представлены: — протоковый рак-11, — дольковый рак-9, — медуллярный рак-2, -ракПеджета-1. Опухоли шейки матки во всех случаях представлены плоскоклеточным раком. Всем пациенткам проведено лечение первой опухоли в соответствии со стадией заболевания и общим состоянием. Восьми больным с локализацией первой опухоли в молочной железе лечение начато с хирургического: — радикальная мастэктомия с сохранением обеих грудных мыпщ-2, — радикальная резекция молочных желез-3, — радикальная мастэктомия (по Пейти)-2, — радикальная мастзктомия(ію Холстеду)-1 Адьювантное лечение (химиотерапия, лучевая терапия, гормонотерапия и различные их сочетания) проведено 8 из 13 больным. Пяти больным с метастазами рака молочной железы в регионарные лимфоузлы проведено от 4 до 6 курсов химиотерапии по схеме CMFH CAF, 4 из этих женщин назначена гормонотерапия тамоксифеном по 20 мг/сут., в течение 2 лет. После радикальной резекции молочной железы 3 больным вьшолнена дистанционная гамма-терапия на молочную железу и зоны регионарного метастазирования РОД= 2 Гр., СОД=50 Гр. Больной с Ш«А» стадией рака молочной железы проведена дистанционная гамма-терапия на молочную железу РОД=2 Гр., СОД=40 Гр., после чего вьшолнена радикальная мастэктомия по Холстеду и проведено 6 курсов химиотерапии по схеме CAF. Результаты лечения первого новообразования 10 из 13 женщин (1 женщина жива менее 5 лет и не прослеживается, 2 женщины живы менее 5 лет, но прослеживаются на момент окончания лечения), если первой опухолью был рак молочной железы следующие: независимо от стадии заболевания молочной железы 5 лет прожили 8 больных, без прогрессирования опухолевого процесса 7 больных, одна больная жива с проірессированием рака молочной железы. Причины смерти двух больных неизвестны. Через 10 лет из 8 пациенток, проживших 5 лет, не прослеживается одна женщина с П«В» стадией рака молочной железы. Вторая опухоль (рак шейки матки) у этих больных развивалась в среднем через 7,4 года. Лечение данной категории пациенток проводилось по тем же принципам, что и в случае с первой возникшей опухолью. Двум больным с I «А» сг (Tla,N0M0)- стадией рака шейки матки вьшолнена высокая ножевая ампутация шейки матки, 2 больным выполена экстирпация матки с придатками. Трем больным с I «В» ст (T1B,N0M0)— рака шейки матки вьшолнена операция Вертгейма и в послеоперационном периоде проведена дистанционная гамма -терапия. Трем больным со II «А» стадией рака шейки матки выполнены предоперационная лучевая терапия и операция Вертгейма. Двум, больным со II «В» и III ст. рака шейки матки проведена сочетанная лучевая терапия в виде наружного дистанционного облучения малого таза и внутриполостного введения радаоактивішх источников с последующей химиотерапией. Больной с IV стадией рака шейки матки проведена пшшиативная лучевая терапия и курс химиотерапии (винкристин, платидиам, метотрексат, 5-фторурацил). Пять больных получали гормонотерапию тамоксифеном по 20 мг/сут. Результаты лечения больных метахронным раком молочной железы и шейки матки. (В случае, если первой опухолью был рак молочной железы). На срок 3 года из 13 больных получены сведения о 9 больных (2 женщины живы без прогрессирования опухолевого процесса менее трех лет, но прослежішаются на момент окончания исследования, 1 женщина жива без ііроірессирования и не прослеживаегся, 1 женщина умерла от ироіреесирования рака шейки матіси IVCT. в сроки до 3 лет), 9 женщин живы, одна из них с прогрессированием рака шейки матки II «Б» стадии (инфильтрат в малом тазу), получила курс гамма -терапии на малый таз СОД=30 Гр. На срок 5 лет получены сведения о 5 больных (3 женщины живы после лечения второй опухоли менее 5 лет, но прослеживаются на момент окончания исследования, I женщина жива менее 5 лет без прогрессирования и не прослеживаегся). 5 больных живы. (Одна из них с ироірессированием рака молочной железы II «В» стадии) Семь лет живы 4 больных (1 умерла от прогрессирования рака молочной железы, 1 больная жива менее 7 лет и не прослеживается). Через 10 лет 2 больные не прослеживаются. 10 лет без прогрессирования живы 2 больных. Лечение 10 больных с локализацией первой опухоли в шейке матки проводилось по общепринятым положениям и у 6 больных начато с хирургического. Больным с-1 ст. рака шейки матки выполнены: экстирпация матки с првдатками-1.эоперащш Вертгейма-3, и расширенная экстирпация матки-2.
Синхронное сочетание злокачественных опухолей в молочной железе и теле матки 7 больных из 37 пациенток в нашем исследовании встречались реже метастатического более чем в 4 раза (30 больных).Возраст больных синхронным раком составил от 32 до 65 лет (в среднем 46,7 г.). У 4 женщин из 7 (57,1%) при гистологическом исследовании отсутствовали метастазы рака молочной железы в регионарные лимфоузлы (стадия рака I и II «А»). Выявленные стадии рака молочной железы: I ст. (T1N0M0) — 4, II «А» ст. (T2N0M0) — 1, IV ст. (T4N1M1) -і. У одной женщины выявлены синхронные опухоли обеих молочных желез: справа-ІСГ. (T1N0M0) и слева- II «A» cr.(T2NOM0) . Стадии рака эндомегрия: I «А» ст.(ТШ0М0)-4 II «A» CT.(T2N0M0) -1, у 2 женщин , IV «А» ст. (T4N1M0)-1, и IV«B»(T4N1M1.)-1
Лечение проводилось раздельно для каждого пораженного органа, исходя из общих принципов лечения больных с солитарными опухолями. Выбор лечебной тактики зависни от возраста, общего состояния пациенток, гистологической структуры опухолей молочной железы, и эндометрия от степени диффереіщировки опухолей и распространенности опухолевого процесса. Использовался хирургический, лучевой и лекарственный методы в отдельности или в различных комбинациях. 4 больным с I ст. рака молочной железы иі «А» ст. рака эндометрия — выполнены одномоментно: радикальная резекция молочной железы-1, радикальная мастэктомия с сохранением обеих грудных мьшщ-3 и по поводу рака эндометрия экстирпация матки с придатками. Больной с IV ст. рака молочной железы хирургический этап лечения не проводился. Пациентке с синхронным поражением обеих молочных желез: справа -1 ст. и слева — II «А» ст. выполнена радикальная мастэктомия с сохранением грудных мышц с обеих сторон и отсрочено экстирпация матки с придатками.
Адьювантное лечение (химиотерапия, лучевая терапия, гормонотерапия и различные их сочетания) выполнены не всем больным. После радикальн зекции молочной железы, проведен послеоперационный курс гамма — терашш на молочную железу и зоны лнмфоотока РОД-2Гр., СОД-40 Гр Больной со стадией рака молочной железы, IV ст. и раком эндометрия IV ст. проведено 4 курса химиотерапии по схеме CAF, ей же назначен тамоксифен по 20мг/сут. до двух лет. В течение одного года эта больная умерла. Одной пациентке со ст. II «А» в молочной железе и , IV ст. эндометрия из-за выраженной сердечно-сосудистой патологии назначено только гормонотерапия: тамоксифен по 20мг/сут. до двух лет и гормональная терапия прогестипами 17-ОПК. У больной с 1ст. рака молочной железы и1«А» ст. рака эндометрия — возникли метастазы в поясничный отдел позвоночника через 1,5 года после проведенного лечения, по поводу чего выполнено 3 цикла химиотерапии по схеме CAF, дистанционная гамма-терапия на поясничный отдел позвоночника РОД=4 Гр., СОД=24 Гр. Больным раком молочной железы и раком эндометрия I ст. в послеоперационном периоде назначена гормонотерапия 17-ОПК, Депо-Провера до двух лет.
Пять лет прожили 5 из 7 больных без прогрессироваїшя этот срок. Одна женщина жива с метастазами рака молочной железы в кости. Семь лет живы без прогрессирования 3 больные из 4. Сведений об одной женщине нет. У 4 из 7 женщин на момент начала лечения менопауза была больше 5 лет, рецепторный статус у 4 из них был положительным. Все эти пациентки с положительным рецепторным статусом живы без прогрессирования опухолевого процесса 5 лет. Необходимо отметить, что уровень рецепторов ирогесгерона (РП+) у 4 женщин, находящихся в постменопаузе достоверно снижен (менее 10 ф.моль-мг. белка). Уровень рецепторов прогестерона у больных в пременопаузе был выше, чем у женщин в менопаузе. Через 7 лет две больные живы без прогрессирования, одна больная умерла от множественных метастазов рака молочной железы в легкие и печень. Через 10 лет живы две больных без прогрессирования опухолевого процесса.
Метахронное сочетание злокачественных опухолей молочной железы и тела матки (30 больных) встречалось чаще синхронного(7больных) в нашем исследовании более чем в 4 раза.
Для метахронного рака молочной железы и тела матки характерен более пожилой возраст больных, чем и при синхронном раке. На момент выявления первой опухоли, возраст женщин составлял от 30 до 71 года (в среднем 47,6 лет), что на 1,5 года больше, чем при синхронном. Первичный очаг возникал в относительно молодом возрасте. Возраст больных при выявлении второй опухоли колебался от 35 до 72 лет, в среднем составил 49,7 года, тогда как при синхронном 46,1 года. Интервал между выявлением двух опухолей колебался от 1 года до 26 лет, в среднем составил 9,7 лет. По — видимому, этот временной интервал не является случайным и может быть связан с какими-то обшими патогенетическими механизмами развития метахронного рака не только в молочных железах. Наиболее часто второй рак выявлен в сроки от 1 года до 5 лет — 15 женщин (50%), от 7-10 лет — у 6 женщин из 30 (20%) и от 10-26 лет — у 9 женщин из 30 (30%).
При мегахронном раке 16 (53,3%) женщин заболели сначала раком молочной железы и 14 (46,6%) женщин заболели раком эндометрия. Средний возраст больных, заболевших сначала раком молочной железы доставил 58,6 года, раком эндометрия 47,4 года (разница 11,2 года). Средний возраст женщин, у которых второй опухолью был рак молочной железы, — составил 60,8 лет и рак эндометрия — 60,1 лет (разница 0,7 лет). Интервал между выявлением вторых опухолей, в случаях, если первой обнаруженной опухолью был рак молочной железы составил 5,8 года, еели первой опухолью был рак эндометрия — 9,6 хода (разница 3,8 года)
Синхронное сочетание опухолей молочной железы и яичников (10 больных, 23,8%) в нашем исследовании встретилось реже метахронного более чем в 3 раза (32 больных 76,2%) Возраст больных синхронным раком составил от 28 до 50 лет ( в среднем 48,5). У большинства женщин (6 из 10, 60%) при гистологическом исследовании отсутствовали метастазы рака молочной железы в регионарные лимфатические узлы (стадия рака Ост — 1, П«А» — 3, Выявленные стадии рака молочной железы больных синхронным раком молочной железы и яичников: Ост (TinsNOMO) — 1, II «A» (T1N1M0 и T2N0M0) — 3, II «В» (T2N1M0) — 1, III «В» (T4N0M0 )- 2, у 3 больных отмечено синхронное поражение молочных желез: III «В» (T4N3M0 и- T4N1M0)- 2, IV CT.(T3N0M1) — 1. Стадии рака яичников II «А» (T2aN0M0)- 2, III CT.(T3a.6N0M0) — 5, IV ст (T4N0M1) — 3.
У 6 больных III и IV стадии рака яичников, отмечался аспит, выявлены метастазы в большой сальник, метастазы по брюшине. И у 2 больных отмечено наличие плеврита. По гистологической структуре опухоли молочной железы в подавляющем большинстве случаев — 5 пациенток представлены дольковым раком, у 1 больной дольково — нротоковым раком, у 2 больной протоковым раком.).
Лечение проводилось раздельно для каждого пораженного органа в соответствии со стадией заболевания и обшим состоянием больной. В зависимости от гистологического типа опухолей, распространенности процесса. На первом этапе 5 больным синхронным раком молочной железы и раком яичников выполнено хирургическое лечение: радикальная резекция молочной железы-3 радикальная мастэктомия с сохранением обеих грудных мышц -3 ,радикальная мастэктомия (по Пейти)-1, секторальная резекция молочной железы-1 Экстирпация матки с придатками и удаление большого сальника-4, надвлагалищная ампутапдя матки с придатками и удаление большого сальника-2. У одной пациентки интервал между операциями составил 3 месяца Больной с ТТТ «В» стадия рака молочной железы проведено 2 курса химиотерапии по схеме CAF, выполнена радикальная мастэктомия с сохранением обеих грудных мышц и лапаротомия, при этом отмечен канцероматоз брюшины. 4 больным хирургический этап лечеїшя не выполнялся.
Адьювантное лечение (химиотерапия, лучевая терапия, гормонотерапия и различные их сочетания) выполнено 10 больным. 4 курса химиотерапии по схеме CAF-3.?4 курса химиотерапии (платидиам — 150 мг + доксорубицин — 40 мг) -2. 3 больным назначена гормонотерапия тамоксифен но 20 мг/сут. до 2 лет. Больной с Ш «В» ст. рака молочной железы проведено 3 курса химиотерапии по схеме CAF, отмечен положительный эффект. Выполнена надвлагшгшцная ампутация матки с придатками назначена химиотерапия (метотрексат 60 мг.+карбоплатин 300 мг.) на фоне гормонотерапии тамоксифеном по 20 мг/сут. Трем больным хирургический этап лечения не выполнялся, выполнена пробная лапаротомия, при этом выявлена диссиминация рака яичников по брюшине и опухолевый конгломерат в малом тазу, в который врасгает матка, яичники и петли кишечника, проведен 1 курс химиотерапии AVC и 2 курса (карбоплатин по 500 мг. в/в + доксорубицин 70 мг. в/в) — умерла от прогрессирования. Больной с инфильтративно-отечной формой рака обеих молочных желез и яичников IV ст., асцит, плеврит. Проведено 2 курса химиотерапии (циклофосфан — 1 гр., платидиам — 200мг.) ей же назначена гормонотерапия тамоксифен по 20 мг/сут. и медротестостерон — 100,0. Больной (рак обеих молочных желез III «В» ст.) и. рак левого яичника II «В» ст. Асцит. Плеврит. Проведена химиотерапия: (зофран 16 мг. в/в, доксалем — 8 мг. в/в, цисплатин — 120 мг. в/в, адриамицин — 65 мг. в/в, циклофосфан — 600 мг. в/в), ей же назначена гормонотерапия тамоксифен по 20 мг./сут. Больной с диагнозом рак обеих молочных желез IV ст. (множественные метастазы в печень) и рак яичников IV ст. ( метастазы по брюшине, асцит), учитывая крайнюю степень тяжести и бесперспективность дальнейшего специального лечения назначена гормонотерапия нольвадекс + депо — провера и симптоматическая терапия.
Результаты лечения больных синхронным раком молочной железы и яичников были следующими: 3 года из 10 женщин прожили 4 больные, 2 больные живы без прогрессирования менее 3 лет, но прослеживаются на момент окончания исследования. 4 больных умерло от прогрессирования: 3 больных в сроки до 1 года и 1 больная через 1,5 года. Из 4 пациенток 5 лет живы 3 больньїе, у одной-отмечен; рецидив оігухоли в малом тазу, получила курс гамма — терапии малого таза СОД=40 Тр. и облучение брюшной полости и малого таза СОД=24-36 Fp.
7 лет жива одна больная- Результаты лечения 10 больных прослеживаются в течение 7 лет. Умерло 5 больных от прогрессирования обоих заболеваний; одновременно. (средняя продолжительность жизни умерших-1 год). Живы 5 больных в сроки от 1 года до 8 лег (в среднем 4,5 года). больных синхронным раком молочной железы и яичников на момент, лечения находились в менопаузе,; рецепторньш статус опухоли молочной железы был положительным у 5 из 6 больных, а у одной больной определяли рецепторный статус в молочной железе и яичниках: рецепторный статус опухоли в: молочной железы был отрицательным, а опухоли в- яичниках — выявлены положительные рецепторы эстрогена. Одна женщина:жива 5 лет. Две живы на момент окончания исследования по одному году, три умерли/в сроки от 1 года до 3 лет. 4 из 10 женщин, больных сшіхроїшьімраісом; молочной, железы и яичшшов на момент лечения были ,с сохраненной менструальной .функцией. В трех случаях рецепторный статус опухолей был положительным, в одном случае отрицательным.
источник