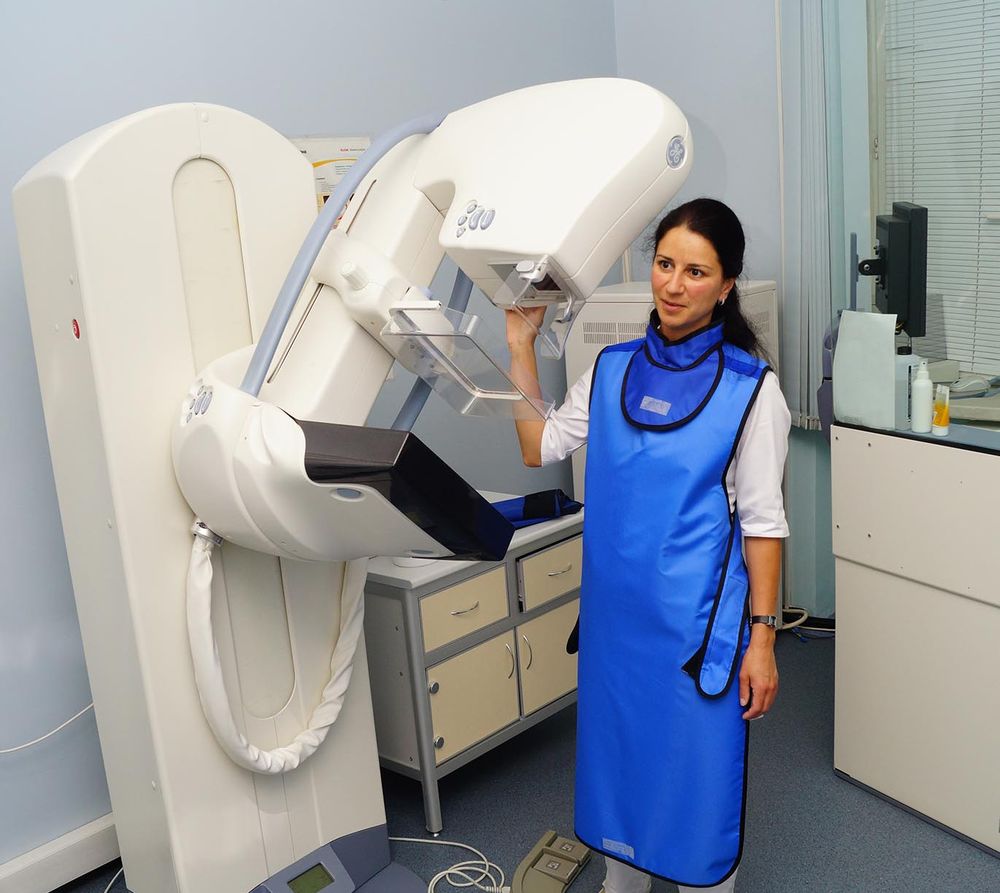
«Результаты УЗИ молочных желез выявили образование, подозрительное на онкологию», «результаты маммографии не позволяют однозначно исключить наличие злокачественного образования», «биопсия показала наличие раковых изменений в молочной железе и требуется расширенное обследование». Это лишь немногие из самых страшных слов, которые женщина может услышать от своего врача.
Молочные железы состоят из трех основных типов тканей — жировой, соединительной и железистой. Раком молочной железы (РМЖ) называют злокачественные опухоли, развивающиеся именно из клеток железистой ткани. Вопреки расхожему мнению, РМЖ заболевают как женщины, так и мужчины, однако у женщин он встречается примерно в 100 раз чаще.
Рак груди развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги — метастазы.
Мутации, которые приводят к РМЖ, бывают наследственными и приобретенными.
Распространенными наследственными генетическими причинами рака молочной железы становятся мутации в генах BRCA1 и BRCA2. Носительницы мутации BRCA1 имеют риск заболеть раком молочной железы 55–65%, а носительницы BRCA2 — 45%. Такие генетические дефекты передаются по наследству от родителей детям, они становятся причиной рака молочной железы примерно в 15% случаев.
Намного чаще опухоль возникает из-за приобретенных мутаций: они возникают в клетках молочной железы и не передаются по наследству. Например, в 20% случаев увеличено количество копий гена, кодирующего HER2 — белок-рецептор, который находится на поверхности клеток и стимулирует их размножение.
«Молекулярно-генетический портрет» опухоли имеет важное значение при выборе оптимального лечения.
Чаще всего опухоли молочных желёз развиваются из клеток молочных протоков — в этом случае врачи говорят о протоковом раке молочной железы или протоковой карциноме. Довольно часто злокачественные опухоли вырастают из клеток долек молочной железы, этот тип рака называют инвазивной лобулярной карциномой (инвазивный рак молочной железы). Стоит отметить, что рост опухоли возможен и из других клеток железистой ткани.
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление. К ним относятся:
- Возраст. Большинство случаев РМЖ приходятся на женщин в возрасте 55 лет и старше.
- Наследственность. Если РМЖ диагностирован у кого-то из близких родственников, риск повышается вдвое.
- Рак молочной железы в анамнезе.
- Повышенная плотность ткани молочной железы по результатам маммографии.
- Некоторые доброкачественные новообразования в молочной железе.
- Раннее начало менструаций — до 12 лет.
- Поздняя менопауза — после 55 лет.
- Отсутствие детей или поздние (после 35 лет) первые роды.
- Воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака.
- Курение и злоупотребление алкоголем. Если женщина ежедневно потребляет 28–42 г этилового спирта, ее риски повышаются на 20%.
- Лишний вес и низкая физическая активность.
- Использование гормональных препаратов: оральные контрацептивы, заместительная гормональная терапия в постменопаузе.
- Травмы молочных желез.
- Сахарный диабет.
- Работа по графику с ночными сменами.
Довольно часто на ранних стадиях рак молочной железы протекает бессимптомно. Но в ряде случаев признаки, указывающие на наличие заболевания, все же есть, и их можно заметить.
В первую очередь, к симптомам, которые должны насторожить, относят уплотнения в молочных железах, рядом с ними или в подмышечной впадине. В 9 случаях из 10 уплотнения бывают доброкачественными, однако установить это наверняка можно только на осмотре у маммолога.
К симптомам рака молочной железы относят:
- Отвердение кожи
- Участок втяжения кожи
- Эрозия кожи
- Покраснение кожи
- Выделения из соска
- Деформация молочной железы по типу ряби
- Припухлость кожи
- Увеличенные в размерах вены
- Втяжение соска
- Нарушение симметрии молочных желез
- Симптом лимонной корки
- Пальпируемый узел внутри молочной железы.
При появлении указанных симптомов, а также любых других изменений в молочных железах (например, необычных или болезненных ощущений) нужно немедленно проконсультироваться с маммологом.
В Европейской клинике ведёт консультативный приём и выполняет операции известный российский хирург-маммолог, доктор медицинских наук Сергей Михайлович Портной (автор более 300 печатных работ, член правления Российского общества онкомаммологов, автор трех патентов на изобретения).
Сергей Михайлович выполняет весь объем оперативных вмешательств на молочной железе, включая органосохраняющие и реконструктивные пластические операции.
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц, по окончании менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
Порядок проведения самообследования молочных желез:
- Разденьтесь выше пояса и встаньте перед зеркалом.
- Поднимите руки вверх и заведите их за голову. Внимательно осмотрите грудь. Повернитесь правым, левым боком.
- Ощупайте молочные железы в положении стоя сложенными указательным, средним и безымянным пальцем. Начинайте с верхней наружной части груди и двигайтесь по часовой стрелке.
- Сожмите сосок двумя пальцами. Проверьте, выделяется ли из него что-нибудь.
- Снова ощупайте молочные железы — теперь в положении лежа.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
О роли биопсии в диагностике рака молочной железы рассказывает врач Европейской клиники Портной С.М.:
Для подтверждения или исключения диагноза в первую очередь проводится мануальное обследование груди. Затем, при наличии подозрений или в качестве скрининговой процедуры, может быть назначена маммография, рентгенологическое исследование молочных желез. Как правило, женщинам до 35 лет ее выполнение не рекомендуется, в молодости ткань молочных желез особенно чувствительна к радиоактивному облучению.
Ультразвуковое исследование (УЗИ) молочных желез позволяет оценить структуру их ткани и отличить, например, опухоль от кисты, наполненной жидкостью.
Если результаты маммографии или УЗИ указывают на наличие новообразований в молочной железе, врач, как правило, назначает биопсию, лабораторное исследование образца тканей из молочной железы. Биопсия позволяет выяснить, является ли опухоль злокачественной, а также определить ее тип и стадию. Кроме того, исследование биопсийного материала дает ответ на вопрос, является ли опухоль гормонозависимой, что также влияет на схему лечения.
При необходимости могут использоваться и другие диагностические методы, например, магнитно-резонансная томография (МРТ).
После постановки диагноза основной задачей лечащего врача является определение стадии онкологического заболевания, то есть размера опухоли, ее расположения, наличия метастазов и агрессивности. От этих факторов зависит прогноз лечения и подбор оптимальных методов терапии. Как правило, для уточнения стадии проводятся анализы крови, маммография другой молочной железы, сканирование костей, а также компьютерная или позитронно-эмиссионная томография. В некоторых случаях определить стадию опухоли можно только при проведении операции.
Стратегия лечения рака молочной железы зависит от многих факторов — типа рака, стадии, чувствительности клеток опухоли к гормонам, а также общего состояния здоровья пациентки.
Основной метод лечения рака груди — хирургическая операция. Если болезнь удалось диагностировать на ранней стадии, хирург может выполнить лампэктомию, удаление тканей опухоли и небольшой части окружающей ее здоровой ткани. При более крупных опухолях молочная железа удаляется целиком (такая операция называется мастэктомией), равно как и ближайшие к ней лимфатические узлы. Если по оценке врача риск развития рака во второй молочной железе достаточно высок, пациентке может быть рекомендовано удаление обеих молочных желез сразу.
Чтобы разобраться, распространились ли раковые клетки в лимфатические узлы, и определиться с объемом хирургического вмешательства, может быть проведена сентинель-биопсия, или биопсия сторожевого лимфоузла. Во время операции в опухоль вводят радиофармпрепарат или флуоресцентный краситель — это помогает визуализировать лимфоузел, который первым принимает лимфу от ткани молочной железы. Его удаляют и проводят гистологическое исследование. Если в сторожевом лимфоузле не обнаруживают опухолевых клеток, можно ограничиться удалением очага в молочной железе. В противном случае показано иссечение регионарных лимфоузлов.
Лучевую терапию (то есть воздействие на опухоль ионизирующим излучением) при раке молочной железы, как правило, используют после проведения хирургической операции. Терапия проводится с целью уничтожения раковых клеток, которые могли остаться в организме.
Химиотерапия, то есть использование препаратов, убивающих раковые клетки, может проводиться после операции по удалению опухоли, как и лучевая терапия. В некоторых случаях химиотерапию проводят до оперативного лечения для того, чтобы уменьшить размер слишком крупной для удаления опухоли.
В Европейской клинике для лечения рака молочной железы применяются наиболее современные, оригинальные европейские и американские химиопрепараты. У нас есть возможность составить «молекулярный отпечаток» опухоли, подобрать на основании его анализа наиболее эффективные и безопасные комбинации лекарств.
Для лечения рака молочной железы, чувствительного к гормонам, используют гормональную терапию — к ней относится несколько разных методов, останавливающих выработку гормонов в организме или блокирующих их поступление к опухоли. Гормональная терапия позволяет снизить вероятность рецидива опухоли, а также, в случае выявления неоперабельной опухоли, помогает контролировать ее рост.
Для лечения рака молочной железы применяют также таргетную терапию — препараты, поступающие непосредственно к тканям опухоли и минимально воздействующие на здоровые клетки организма. Таргетную терапию используют либо отдельно, либо в комбинации с другими методами лечения — в зависимости от того, какая схема лучше всего подойдет пациенту.
Если рак молочной железы диагностирован на ранних стадиях (0-I), пятилетняя выживаемость приближается к 100%. То есть, можно сказать, что удается вылечить практически всех женщин. Далее, в зависимости от стадии, прогноз относительно пятилетней выживаемости ухудшается:
- На II стадии — 93%.
- На III стадии — 72%.
- На IV стадии — 22%.
Совокупность имеющихся в арсенале онкологов методов лечения рака молочной железы позволяет в большинстве случаев добиться ремиссии заболевания или, как минимум, продлить жизнь с сохранением ее качества. Однако следует помнить, что эффективность лечения в целом напрямую зависит от того, было ли лечение начато своевременно, то есть на ранних стадиях заболевания.
Максимальная эффективность противоопухолевого лечения достигается только в том случае, если оно проводится в соответствии с международными протоколами, при этом учитываются индивидуальные особенности каждого пациента. Именно так назначают лечение онкологи Европейской клиники.
источник
Опухоль в груди – один из частых вариантов онкологии у женщин. Факторы риска рака молочной железы помогают своевременно выявить предрасположенность к опасной болезни.
Знать факторы риска, чтобы предупредить болезнь
Злокачественное новообразование в железистой ткани груди никогда не возникает неожиданно: в тотальном большинстве случаев у женщины возникают различные изменения и болезни, на фоне которых развивается канцерогенез. Выделяют следующие факторы риска рака молочной железы:
- Эндокринные расстройства, обусловленные внешними или внутренними причинами;
- Наследственная предрасположенность;
- Образ жизни и негативное действие внешних средовых факторов;
- Болезни молочных желез.
Определенную отрицательную роль играет возраст – чем старше женщина, тем вероятность онкологии выше. Крайне опасна ситуация, когда выявлены злокачественные опухоли в яичниках: риск онкологии груди резко возрастает.
Железистая ткань груди гормонозависима: эстрогены провоцируют пролиферацию клеток, а гестагены защищают от злокачественного перерождения. Нарушение гормонального равновесия в сторону гиперэстрогении (увеличение концентрации в крови) стимулирует онкологические процессы. Эндокринные факторы риска рака молочной железы разделяются на 2 вида:
- Внутренние (ранний приход первой в жизни менструации, чересчур поздняя менопауза, отказ от лактации, отсутствие беременностей, поздний возраст первого деторождения, ожирение, эндокринопатии);
- Внешние (неправильный прием гормональных таблеток в климаксе, бесконтрольное использование оральной контрацепции).
Риск онкопатологии в груди крайне высок у женщин, которые сознательно отказались от выполнения репродуктивной функции: когда не было беременностей и кормления грудью, необходимо регулярно проводить обследование молочных желез у врача-маммолога. Прекращение месячных в возрасте 55 лет повышает вероятность рака груди на 10% по сравнению с менопаузой в 45 лет.
Образ жизни может стать провоцирующей причиной онкологии. Выделяют следующие средовые факторы риска рака молочной железы:
- неправильное пищевое поведение (преобладание в рационе мясной и жирной пищи, недостаток овощей и морепродуктов);
- низкая физическая активность (гиподинамия);
- злоупотребление алкоголем;
- воздействие радиации.
У женщин, регулярно выпивающих крепкие спиртные напитки (ежедневно или через день), риск повышается в 2 раза. Железистая ткань груди после 35 лет устойчива к рентгеновским лучам, поэтому можно не опасаться за последствия при ежегодном проведении маммографии (но до 35 лет ММГ делать только по строгим показаниям).
Даже при отсутствии риска ММГ надо делать регулярно
Важнейшие факторы риска рака молочной железы – наследственность, которую можно определить по случаям онкологии груди у близких родственниц. Если в семье есть случаи карциномы желез, то вероятность опасной патологии резко возрастает для всех женщин 1 степени родства (дочь, родная сестра). Когда 2 и более родственницы заболевают, то риск повышается в 10 раз. Оптимально сделать анализ на наличие генов, которые определяют предрасположенность к онкопатологии груди.
Доброкачественные заболевания молочных желез далеко не всегда провоцируют развитие злокачественного новообразования. Не надо опасаться перерождения при выявлении:
- мастита;
- протоковой метаплазии;
- расширенных протоков (эктазия).
Риск возникает на фоне пролиферации в молочных железах (фиброаденома, гиперплазия протокового и долькового эпителия), особенно при выявлении атипических вариантов патологии. В 10 раз увеличивается вероятность возникновения злокачественной неоплазии при раке in situ.
Для каждой женщины можно высчитать индивидуальный риск онкологии груди: систематизировав все факторы риска рака молочной железы, врач определит вероятность обнаружения карциномы и предложит варианты предупреждения злокачественного перерождения.
источник
Рак молочной железы – наиболее распространенное злокачественное новообразование среди женщин, которое вызывает наибольшие опасения и характеризуется способностью к активному метастазированию и достаточно агрессивным ростом. В мире ежегодно диагностируется порядка одного миллиона новых случаев данного заболевания, и каждый год от него умирает около полумиллиона женщин (гораздо больше, чем от какого – либо другого вида рака). Рак молочной железы является наиболее распространенной причиной единичной смертности среди женщин в возрастном промежутке от 35 до 55 лет. Вероятность заболеть данной онкологией составляет 1:12, однако у некоторых групп женщин она существенно возрастает
Рак молочной железы – причины развития
Возникновению и последующему развитию рака молочной железы способствуют следующие факторы:
— Гормональные факторы → Как результат различных наблюдений и исследований было точно установлено, что между развитием рака молочной железы и уровнем половых гормонов (эстрогенов) существует прямая зависимость. Данное утверждение основывается на том, что раковые клетки молочной железы содержат вызываемые рецепторами эстрогена белки, которые способствуют росту опухоли.
Помимо этого, очень важным фактором, который определяет у женщины риск развития рака молочной железы, является так называемый «гормональный анамнез». В случае если у женщины менструации начались в очень молодом возрасте или/и менопауза наступила значительно позже, существует гораздо больший риск развития данного новообразования вследствие того, что ее организм подвержен значительным колебаниям уровня эстрогена (связанно с менструальным циклом) в сравнении со средним периодом на протяжении гораздо более длительного промежутка времени. Тоже самое может относиться как к бездетным женщинам, так и к родившим своего первого ребенка в очень позднем возрасте. Несколько детей, раннее деторождение и грудное вскармливание значительно снижают риск развития данного заболевания, вследствие того, что значительно увеличивается свободный от менструальных циклов период времени.
Существует распространенное мнение, что впервые появившиеся некоторые формы контрацептивных таблеток также влияют на возникновение рака молочной железы. Препараты, созданные позднее, сочетаясь с другим гормоном (прогестероном), содержат гораздо более низкие дозы эстрогена, поэтому их влияние на возможное развитие болезни рассматривается очень низко. Заместительная гормональная терапия, проводимая для устранения эффектов менопаузы и восполнения гомона эстрогена в постклимактерический период, представляет собой достаточно незначительный риск. К так называемому «гормональному взрыву» приводят аборты, поэтому их принято также относить к провоцирующим развитию опухоли факторам
— Возраст → С возрастом вероятность развития рака молочной железы существенно повышается. У женщин моложе 20 лет он встречается очень редко, а вот начиная с 35-го возраста, наблюдается резкий скачек заболеваемости и к 85 и более годам она составляет 300 случаев на 100000 женщин
— Алиментарные факторы → Раковое поражение молочной железы является болезнью развитых западных стран, так как более 50% рака молочной железы в мире регистрируется в Европе и Северной Америке. В связи с этим существуют достаточные основания, чтобы предположить наличие связи между характерными для этих стран реалиями жизни и развитием раковой опухоли молочной железы.
Прямой зависимости между заболеванием раком и пищевым рационом выявлено не было, однако существуют веские основания утверждать, что употребление жиров животного происхождения в больших количествах (с молочными продуктами и мясом), и как следствие значительное повышение циркулирующего в организме уровня эстрогена, может способствовать развитию данного новообразования. Отличающиеся тучностью люди, из – за того, что существенную часть их рациона составляют животные жиры, подвержены гораздо более высокому риску развития этого онкологического заболевания
— Генетические факторы → Под влиянием наследственного фактора у некоторых женщин серьезно возрастает вероятность развития рака молочной железы. Женщины, которые имеют одну/более ближайших родственниц (сестра/мать) больных раком груди, подвергаются незначительно большему риску; в случае если раковое поражение у родственницы развилось в постклимактерический период и тем более, если при этом рак охватил обе молочные железы, риск немного возрастает
— Прочие факторы → Если у женщины в прошлом наблюдались доброкачественные заболевания молочной железы (кисты, доброкачественные опухоли, мастит), она подвержена гораздо более высокому риску возникновения злокачественного новообразования в данном органе. Данных, которые бы свидетельствовали о том, что рак данной локализации вызывают какие – либо повреждения молочной железы (удары, сдавливания и пр.) отсутствуют. Также к причинам развития злокачественного новообразования молочной железы относят: частые/длительные рентгенологические исследования грудной клетки, проводимые при туберкулезе или воспалительных заболеваний легких; лучевые воздействия, проводимые при других заболеваниях (опухоли лимфатической системы и легких)
— Метаболические и эндокринные расстройства → Метаболический сидром, ожирение, сахарный диабет, патологии поджелудочной железы и печени, хроническая артериальная гипертензия, иммунодефицит, атеросклероз
— Неспецифические канцерогенные факторы → Несбалансированная высококалорийная диета (бедная белками и богатая углеводами), курение, работа не в соответствии с биоритмами, ионизирующая радиация, химические яды
Рак молочной железы – симптомы
На ранних стадиях развития, данное злокачественное новообразование практически никак себя не проявляет, лишь при пальпации в ткани железы можно обнаружить постороннее плотное образование.
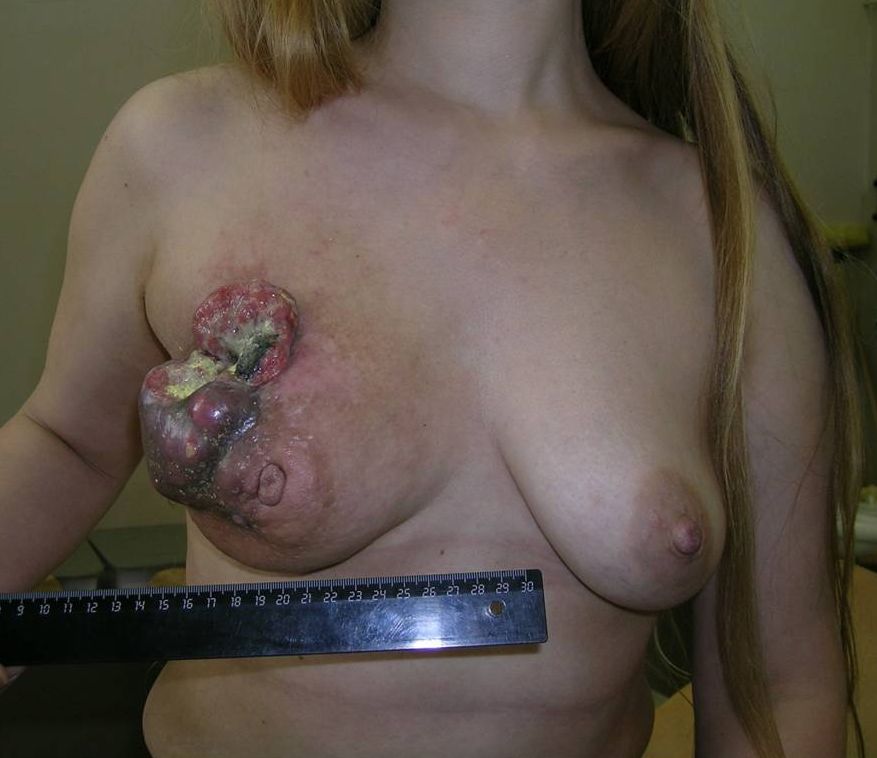
Наиболее характерной и часто встречающейся формой рака молочной железы является узловая форма, для которой характерно наличие плотного узелка от 5 миллиметров до 5 и более сантиметров. Все нижеперечисленные признаки рака молочной железы являются характерными для данной формы.
Панцирная, рожистоподобная и маститоподобная формы характеризуются крайне агрессивным молниеносным ростом, при этом опухоль не имеет четких границ и расходится по всей молочной железе и коже. Для рожистоподобной и маститоподобной форм характерна явная симптоматика воспалительной реакции: повышение температуры тела до 39 градусов, ярко – красный окрас кожи молочной железы и ее болезненность. Исходя из данных симптомов, зачастую случаются диагностические ошибки и пациентки получают лечение от воспалительных заболеваний, которые и дали название данным формам рака груди. Панцирная форма рака как «корка» покрывает молочную железу, при этом стягивая и уменьшая ее в размерах.
При наличии небольших опухолей молочной железы, какая – либо симптоматика отсутствует. Наиболее внимательные к своему здоровью женщины, могут самостоятельно обнаружить в железе опухолевый узел при пальпации (в большой молочной железе это сделать чрезвычайно сложно). Если узелок ровный, круглый и болезненный при нажатии – это доброкачественная опухоль. К признакам злокачественности опухоли относят: на ощупь узел неподвижен или склонен к незначительному смещению, его поверхность неровная, он плотный как камень, чаще всего безболезненный, может достигать трех и более (иногда до пятнадцати) сантиметров. Также при злокачественном процессе наблюдается втяжение кожи над опухолью, она собирается в морщинки и складочки (симптом «лимонной корки»), может наблюдаться прямое прорастание новообразования на поверхность кожи (поверхностный компонент проросшей опухоли может нагнаиваться и кровоточить).
Со стороны подмышечных лимфатических узлов могут быть следующие проявления: если они безболезненны, подвижны или даже незначительно увеличены – опасаться не стоит; если же узлы определяются в виде плотных и крупных, а порой и сливающихся друг с другом – следует бить тревогу, так как это говорит о метастатическом поражении.
В некоторых случаях со стороны опухоли может возникнуть отек руки, что говорит о зашедшей далеко стадии рака, так как возникает при метастатическом поражении подмышечных лимфатических узлов (от верхней конечности блокируется отток лимфатической жидкости и крови, развивается лимфостаз)
Самообследование молочной железы
С целью выявления на ранних стадиях развития патологических опухолей, очень важно выполнять некоторые приемы самообследования, так как возможность (а иногда и желание) обратиться для профилактического диагностирования в специализированное медицинское учреждение не всегда есть. Чем чаще женщина обследует молочную железу, тем быстрее она может заметить появление в ней различных изменений.
Методика самообследования молочных желез:
— Производится оценка визуальных изменений в органе. Для этого необходимо встать перед зеркалом и сравнить симметричность желез в окрасе, размерах, контурах, в цвете и размерах сосков.
— Следующим моментом является ощупывание. Необходимо двумя руками поочередно с каждой стороны сверху вниз приминать молочные железы, после чего обращать пристальное внимание на подмышечные впадины. В случае обнаружения болезненности, втяжения кожи, узелков или опухолей – необходимо незамедлительно обратиться к врачу. Рекомендуется проведение самообследования не реже одного раза в месяц
Стадии рака молочной железы
Существует 4 стадии рака молочной железы, каждая из которых подразделяется на А и В
1 стадия → Опухоль не превышает двух сантиметров в диаметре и при этом не захватывает лимфатические узлы, расположенные в подмышечной впадине. Окружающую железу клетчатку, раковые клетки не затрагивают, метастазирования не наблюдается. На протяжении пяти лет выживаемость 75- 90%
2 стадия → Размеры опухоли при стадии 2А колеблются от двух до пяти сантиметров и лимфатические узлы не поражены, или опухоль достигает менее двух сантиметров с метастазами не более чем в четырех лимфатических узлах. Стадия 2В характеризуется появлением метастазов в подмышечных лимфатических узлах, возможно проникновение метастазов во внутригрудные парастернальные лимфатические узлы. На протяжении пяти лет выживаемость 73 – 85%
3 стадия → При стадии 3А опухоль превышает пять сантиметров в диаметре, прорастает в лимфатические узлы и в мышечный слой под молочной железой (могут наблюдаться выделения из соска, его вытяжение, отечность и изъязвления на коже железы). Региональные метастазы отсутствуют. Стадия 3В характеризуется наличием множественных метастазов в подмышечных лимфатических узлах, или/и одиночными метастазами в надключичных узлах. На протяжении пяти лет выживаемость 40 – 57%
4 стадия → По своему размеру опухоль может быть различна, при этом поражая всю молочную железу и метастазируя в другие органы и ткани. На протяжении пяти лет выживаемость менее 1%
Панцирные, рожистоподобные и маститоподобные формы рака молочной железы с самого момента их появления относят не менее чем к третьей стадии рака. При данных формах рака также как и при раке молочной железы 4 степени, выживаемость пациентов составляет менее 10%, причем из заболевших пять лет не проживает никто
Диагностика рака молочной железы
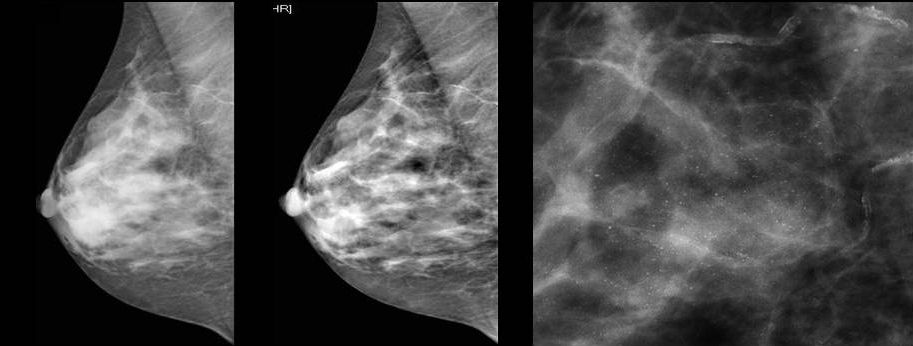
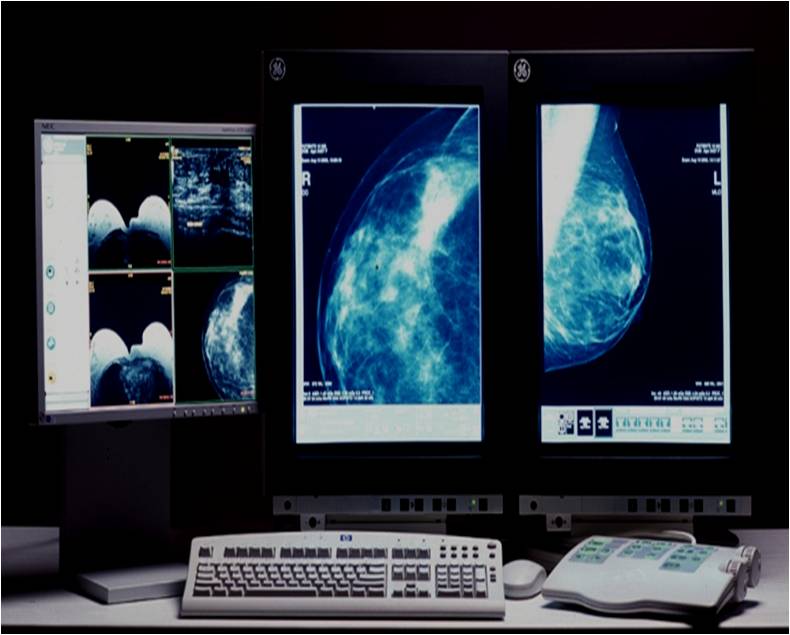
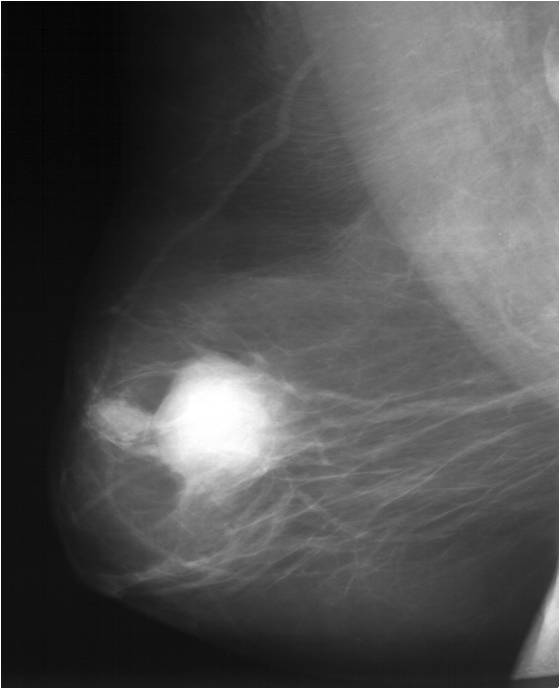
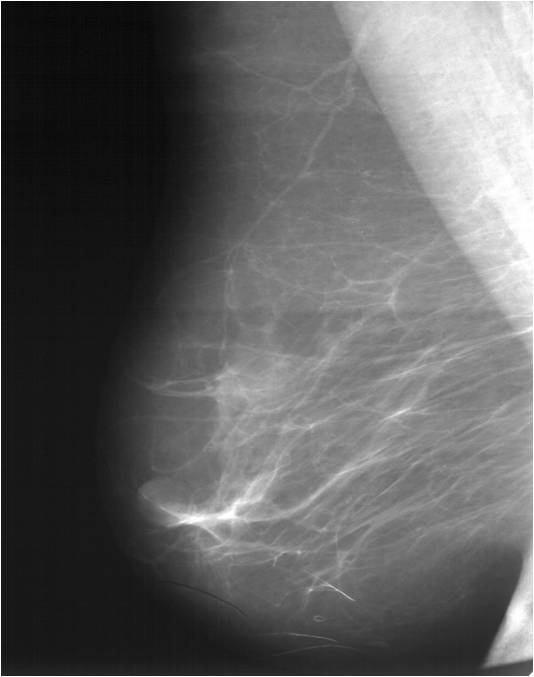
После обнаружения в молочной железе опухоли, первым делом выполняется рентгенологическое исследование молочной железы (маммография). Альтернативой маммографии (для женщин до 45 лет) является ультразвуковое исследование. При данном исследовании возможно выявление минимальных изменений в тканях железы и по определенным рентгенологическим признакам их классификация (определение злокачественности или доброкачественности обнаруженного новообразования).
Следующим этапом обнаружения опухолевой патологии является биопсия опухоли — для дальнейшего исследования под микроскопом тонкой иглой берут маленький кусочек интересующей ткани. После проведенной биопсии уже можно более достоверно говорить о природе опухоли, однако наиболее точный ответ можно получить лишь после хирургического удаления опухолевого узла.
В некоторых случаях показано проведение дуктографии – предварительно введя в протоки молочной железы рентгеноконтрастное вещество, делается рентгеновский снимок. Данное исследование используется для выявления доброкачественной опухоли млечных протоков – внутрипротоковой папилломы, которая может проявляться кровянистыми выделениями из соска и зачастую перерождается в рак.
При подтвержденном раке или только при подозрении на него, показано проведение минимума необходимых исследований: для выявления метастазов проводится УЗИ подмышечных лимфатических узлов; с целью исключения присутствия отдаленного метастатического поражения отдаленных органов, проводится УЗИ брюшной полости и рентгенологическое исследование грудной летки.
В некоторых случаях показано использование онкомаркеров – проводится исследование крови на белки, которые отсутствуют в здоровом организме и вырабатываются исключительно опухолью.
В случае выявления патологических образований в молочных железах, рекомендуется без промедления обратиться к врачу – онкологу. Всем женщинам, достигшим пятидесяти лет (или после наступления климакса), для выявления злокачественных новообразований на ранних стадиях, необходимо выполнять плановую ежегодную маммографию
Лечение рака молочной железы
Рак молочной железы, из всех плотных злокачественных новообразований лучше всего поддается лечению. Основным методом в лечении данного онкологического заболевания является хирургический, при котором удаляется пораженный опухолью орган. Проведение любого другого лечения дает лишь временный поддерживающий эффект
Методы лечения рака молочной железы:
Практические всем женщинам, которые страдают раком молочной железы, показано проведение хирургической операции для удаления злокачественного новообразования. Еще совсем недавно, операция представляла собой полную радикальную мастэктомию (полное удаление молочной железы, желез в подмышечной впадине и мышц на стенке грудной клетки). Удаление настолько обширного участка производилось вследствие того, что при удалении лишь одной опухоли остаются небольшие незаметные очаги раковых клеток, приводящие в скором времени к рецидиву заболевания. Именно поэтому для ликвидации всего ракового поражения применялась исключительно радикальная мастэктомия.
В настоящее время, необходимость в подобном радикальном вмешательстве возникает достаточно редко, так как для избавления от оставшихся после оперативного вмешательства раковых клеток можно прибегнуть к гормональной терапии, химиотерапии и радиотерапии. Показатели выживаемости у женщин с проведенной радикальной мастэктомией, и теми женщинами, которым была проведена менее радикальная операция – равны
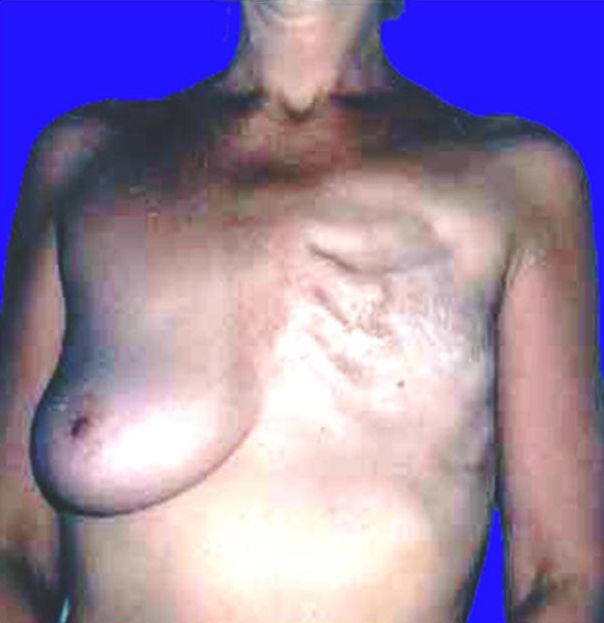
Данный метод лечения вследствие различных факторов является наиболее подходящим. Мастэктомия проводится при поражении соска или участка расположенного непосредственно под ним, а также если у женщины маленькая молочная железа и в ней наблюдается крупная опухоль. На сегодняшний день в большинстве случаев эта операция представлена простой мастэктомией (удаляется ткань молочной железы) или радикальной модифицированной мастэктомией (вместе с тканью молочной железы удаляется малая мышца грудной клетки). В случае существующего риска рецидива рака, данные оперативные вмешательства сочетаются с радиотерапией. Во время проведения такой операции чаще всего удаляются и лимфатические железы, расположенные в подмышечной впадине
Данное оперативное вмешательство заключается в удалении припухлости на молочной железе и окружающих ее тканях. При этом проводится иссечение наименьшего количества ткани молочной железы из всех подобных операций, что после заживления делает внешний вид груди более удовлетворительным (данный фактор для женщины имеет сильное психологическое значение). Для удаления всех возможных оставшихся после операции очагов рака, одновременно с лампэктомией проводится радиотерапия молочной железы
Данные оперативные вмешательства имеют сходство с лампэктомией, однако при их проведении происходит удаление большего количества тканей и вследствие этого конечный результат становится более заметен. После данных видов хирургического вмешательства также положено проведение радиотерапии
Радиотерапия практически всегда проводится после всех хирургических операций у пациенток с раком молочной железы. Целью радиотерапевтического метода является обработка конкретного участка подмышечной впадины (при удалении не всех лимфатических узлов) и молочной железы, для уничтожения возможных оставшихся раковых клеток. Наиболее важным является проведение радиотерапии после незначительных оперативных вмешательств (сегментэктомии, лампэктомии). Обычно дистанционная лучевая терапия проводится амбулаторно, ежедневными сеансами на протяжении нескольких недель. Проведение внутренней радиотерапии требует госпитализации больного. Женщины, которым после операции была проведена дистанционная радиотерапия молочной железы, может быть назначено проведение внутренней радиотерапии (такая тактика на данный момент встречается очень редко). В исключительных случаях показано проведение только внутренней радиотерапии.
Внутренняя радиотерапия представляет собой имплантируемые (под общим наркозом) в молочную железу узкие трубки, в которых располагаются провода с радиоактивным источником (чаще иридием). Трубки находятся в молочной железе на протяжении трех – четырех дней, в течение которых женщина помещается в отдельную палату с постоянным сестринским уходом
Адьювантная терапия проводится после хирургического вмешательства, при отсутствии данных о дальнейшем распространении ракового процесса, но при высокой вероятности возникновения со временем рецидива заболевания. Причиной рецидива могут послужить оставшиеся микрометастазы (небольшие скопления раковых клеток), которые из-за своего малого размера не могут быть выявлены даже при помощи современных сканирующих устройств. Адьювантная терапия после лечения первичного рака для снижения риска рецидива проводится большинству женщин. Несмотря на это, также назначается химиотерапия или/гормональная терапия (тип лечения зависит от возраста женщины и наличия или отсутствия у нее менопаузы)
Гормональное лечение наиболее часто проводится женщинам, которые находятся в постклимактерическом периоде, что приводит в этой группе женщин к значительному снижению смертности (порядка на 25%). Проведение гормональной терапии на продвинутой стадии заболевания приводит к эффективному сдерживанию развития метастазов в мягких тканях и костях. В целом эти методы достаточно безопасные, лишь у некоторых женщин могут возникнуть незначительные побочные эффекты, которые редко бывают серьезными.
Наиболее распространенным и известным гормоном, который назначается в качестве средства для проведения гормональной терапии как женщинам в постклимактерическом периоде, так и на продвинутой стадии заболевания, вне зависимости достигла ли женщина менопаузы, является Тамоксифен
Как метод адьювантной терапии, медикаментозное лечение наибольший эффект дает у молодых женщин, которые еще не достигли менопаузы. При далеко зашедшей стадии болезни, химиотерапия обычно применяется при наличии метастазов в легких или печени, а также в случае отсутствия положительной динамики при лечении гормональными препаратами
Восстановительная хирургическая операция молочной железы
В настоящий момент существует возможность проведения восстановительной хирургической операции одновременно с проведением мастэктомии, или же немного позже. В психологическом плане восстановительная операция для большинства женщин чрезвычайно важна. Хирурги применяют два основных метода для восстановления. Первый метод заключается в использовании мышц самой пациентки (в большинстве случаев это мышца спины, которая направляется в новое положение, при этом сохраняется кровоснабжение). Ко второму методу относят вживление имплантата
Профилактика рака молочной железы
Наиболее надежной профилактической мерой рака молочной железы является систематическое обследование женщин маммологом, проводимое ежемесячное самообследование и своевременная коррекция гормонального фона. К естественной профилактике различных опухолей женской репродуктивной системы относят беременность и роды, так как риск развития злокачественного новообразования существенно возрастает у нерожавших и поздно рожавших (после 30 – 35 лет) женщин. Также стоит по возможности избегать абортов и использовать контрацепцию. Пациенткам с семейным анамнезом рака показано ежегодное прохождение маммографии (рентгенологического исследования молочных желез).
источник
По распространенности рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний. Он поражает ежегодно 1 млн. 600 тыс. женщин в мире и свыше 66 тыс. в Российской Федерации.
В ближайшие 20 лет во всех странах прогнозируется почти двукратное увеличение заболеваемости женщин раком груди, что объясняется увеличением продолжительности жизни и улучшением методов диагностики.
За последние годы, благодаря более раннему выявлению опухолей, смертность от рака груди у женщин снижается. В развитых странах, где применяется маммографический скрининг населения, этот показатель снизился на 30–50%.
Рак молочной железы – это не единообразное заболевание. При лечении клиницисты учитывают принадлежность опухоли к конкретному подтипу. Генетическое тестирование и иммуногистохимический метод, позволяют надежно определить биологические подтипы РМЖ. Эти подтипы сами по себе включают многие факторы риска и предсказывающие признаки, что позволяет выбрать наиболее эффективную терапию для больного.
Доказанное с помощью молекулярно-генетического анализа и иммуногистохимического исследования патогенетическое разнообразие РМЖ позволяет индивидуализировать лечение.
Увеличение выживаемости при раке молочной железы связано не только с широкомасштабным внедрением маммографического скрининга, но и адекватным использованием системных видов лечения.
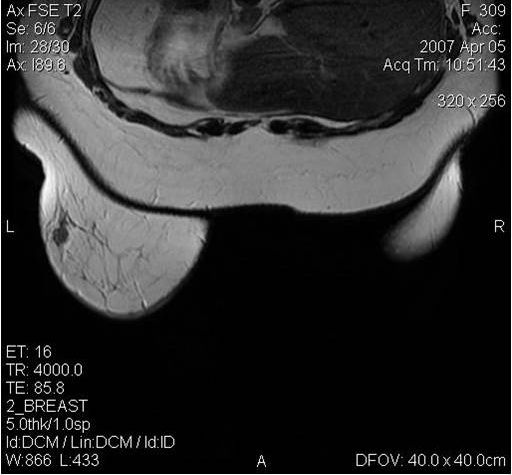
Для выявления злокачественных опухолей молочной железы существует определенный алгоритм диагностики, и его первичный элемент — маммографический скрининг. Чувствительность этого метода диагностики для опухолей от 2 мм до 5 мм составляет около 85%. Маммографическое исследование выполняют в двух проекциях.
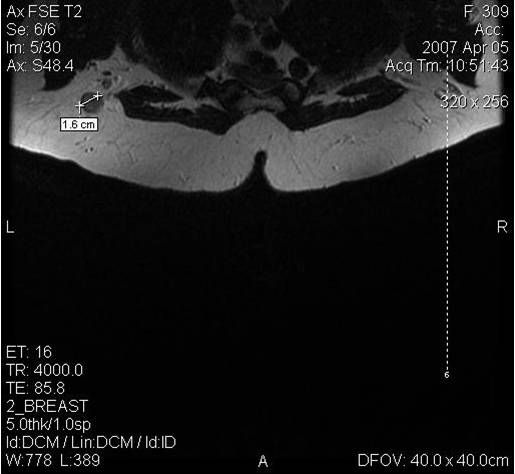
Молодым женщинам с плотным строением молочной железы необходимо включение в программу наблюдения методов УЗИ и МРТ.
Поскольку традиционный маммографический скрининг у женщин до 40 лет малоэффективен, для скрининга может понадобиться альтернативная методика — МРТ. Современная контрастная магнитно-резонансная томография — высокочувствительный метод диагностики заболеваний молочной железы.
МРТ-диагностика рака молочной железы
У женщин с мутациями BRCA1 или BRCA2 при проведении МРТ возможно диагностировать рак молочной железы на самых ранних стадиях.
При ряде показаний женщинам назначается биопсия молочной железы под контролем УЗИ. Это исследование позволяет прицельно брать биологический материал для гистологического исследования, определения уровня экспрессии стероидных гормонов и статуса Her-2.
Известно множество факторов, повышающих риск возникновения рака молочной железы. На некоторые из них повлиять невозможно:
- семейная история по РМЖ,
- раннее менархе (начало месячных),
- позднее наступление менопаузы.
В то же время существуют и модифицируемые факторы, такие как:
- избыточный вес в постменопаузе,
- использование заместительной гормонотерапии,
- потребление алкоголя,
- курение
Стратегические шаги, направленные на снижение риска возникновения РМЖ включают контроль веса и борьбу с ожирением, регулярную физическую активность, уменьшение потребления алкоголя.
Большинство факторов риска рака молочной железы связано с действием гормонов на ткань молочной железы (раннее менархе, позднее наступление менопаузы, ожирение, применение гормональных препаратов). Считается, что именно женские половые гормоны, стимулируют процессы клеточного роста и повышают риски повреждения ДНК, что может привести к развитию злокачественного новообразования.
Только 5–10% случаев рака молочной железы обусловлены унаследованными мутантными генами BRCA. Но при этом, среди носителей мутаций риск возникновения заболевания может достигать 80%.
Чем младше возраст выявления первичного заболевания рака груди, тем выше вероятность заболеть контралатеральным раком, т.е. противоположной молочной железы.
Семейная история с наличием заболеваний раком молочной железы у кровных родственников, даже без ассоциации с мутациями BRCA, также повышает риск возникновения РМЖ.
Ожирение
Различными исследованиями доказано существование связи между заболеваемостью первичным РМЖ в постменопаузе и ожирением. Есть подтверждение связи между избыточным весом и низкой выживаемостью при всевозможных видах РМЖ.
Алкоголь
Алкоголь — также установленный фактор риска возникновения первичного РМЖ. Достоверность его отрицательного воздействия на пациентов, перенесших рак молочной железы, убедительна, так как он влияет на увеличение количества циркулирующих эстрогенов.
Только врач может оценить значимость различных симптомов. Однако каждой женщине необходимо знать, при каких симптомах надо обращаться к маммологу:
- «Образование», уплотнения, узел, инфильтрат, опухоль, «шарик» — что-то подобные этому вы обнаружили. Это еще не повод решить, что у вас РМЖ, но повод показаться специалисту.
- Деформация контура молочной железы, ареолы или соска (втяжение кожи или наоборот выбухание)
- Втяжение соска; особенно, если появилось недавно
- Выделение крови из соска
- Отек кожи всей молочной железы или ее локального участка
- Появление раздражения, мокнутые «ранки», язвочки, корочки на соске или ареоле
- Изъязвления (длительные, без видимой причины) на коже груди
- Дискомфорт в подмышечной области и обнаружение лимфоузлов ( «шариков» ) в подмышечной области
- Изменение цвета кожи молочной железы — покраснение, повышение температуры кожи в этой области.
Все эти симптомы могут быть проявлениями различных заболеваний (их насчитывается несколько десятков), возможно, не злокачественной природы. Однако, это может решить только специалист по заболеваниям молочной железы.
Признаки и симптомы рака молочной железы
0 стадия
Это стадия, когда не выявлена первичная опухоль, или она не может быть оценена, а также в случае неинвазивного рака молочной железы (что означает опухоль не выходит за границы своего появления, так называемый рак in situ).
1 стадия
Раковые клетки в этой стадии инвазируют или прорастают в соседние ткани. Опухолевый узел не более 2 см, лимфоузлы при этой стадии не поражены.
2 стадия
В этой стадии опухолевый узел превышает 2см и может достигать до 5см. При этой стадии могут быть поражены лимфоузлы, но поражение лимфоузлов носит одиночный характер, они не спаяны друг с другом и находятся на той же стороне, что и опухоль. В случае поражения лимфоузлов размер опухоли может быть и менее 2см.
3 стадия
Инвазивный рак, более 5 см или с явным и значительным поражением лимфатических узлов. При этом лимфоузлы могут быть спаяны между собой.
4 стадия
На этой стадии опухоль прорастает в кожу груди, грудную стенку либо во внутренние грудные лимфатические узлы. Она может быть любых размеров.
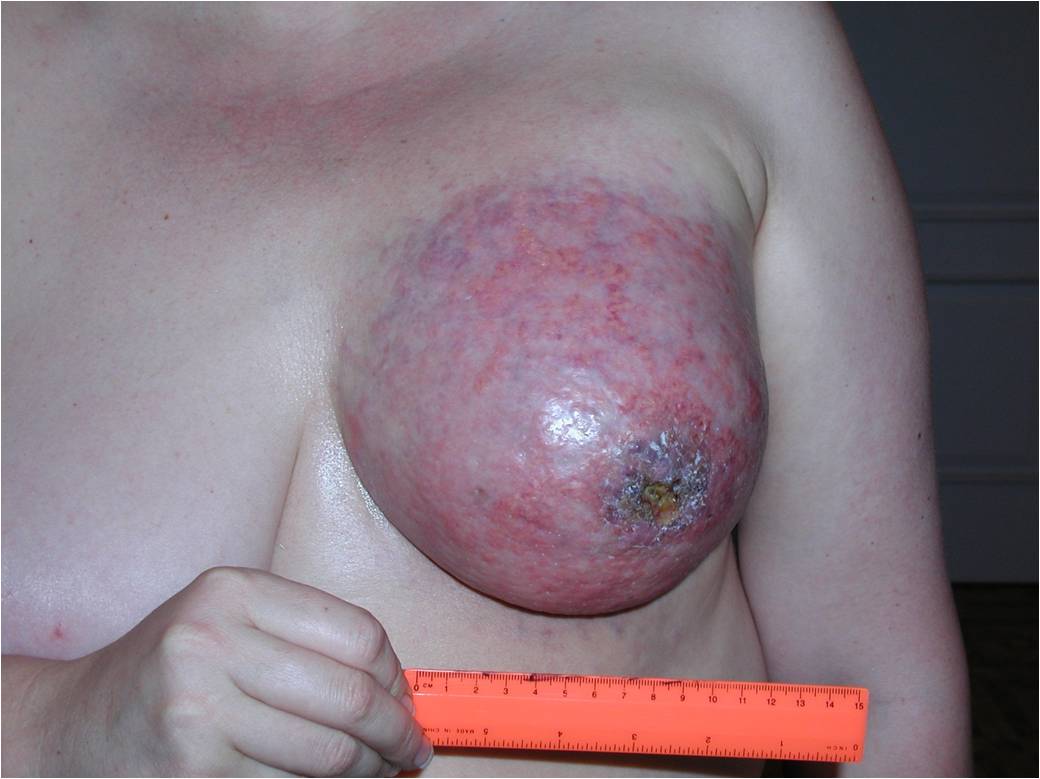
К 4 стадии рака молочной железы относится воспалительный рак, он встречается до 10 % всех случаев. Симптомы воспалительной формы рака груди это покраснение кожных покровов, железа становится теплой, отмечается увеличение и/или уплотнение части либо всей молочной железы. Кожа приобретает вид апельсиновой корки. Эту форму рака надо дифференцировать с воспалением молочной железы – маститом.
Также при 4 стадии опухоль может распространяться за пределы грудной клетки, в подмышечную область, внутренние грудные лимфатические узлы. Возможны метастазы в надключичные лимфатические узлы, а также в легкие, печень, кости или головной мозг.
Как выглядит рак груди в разных стадиях:
Хирургическая операция — основной метод лечения при опухолях груди, и от качества его проведения во многом зависит исход заболевания. По данным некоторых штатов Индии, в которых по религиозным мотивам не проводится хирургическое лечение, показатели заболеваемости практически равняются показателям смертности. Обычно смертность от РМЖ в два — четыре раза уступает заболеваемости.
Однако, после хирургического лечения чаще всего следует лучевое. Местное лечение без послеоперационной лучевой терапии часто приводит к локально-регионарным рецидивам заболевания. Дело в том, что после завершения хирургической операции невозможно исключить существования скрытых отдаленных метастазов. Даже у больных с опухолями менее 1 см в диаметре в 10% случаев возможен рецидив заболевания.
Локализация отдаленных метастазов при РМЖ
Сейчас во всем мире наблюдается тенденция к сокращению объема хирургического вмешательства без потери эффективности. Хирургическое и лучевое лечение РМЖ развивается и совершенствуется в направлении органосохранения.
Благодаря внедрению маммографического скрининга, резко возросло число больных с ранней стадией заболевания, когда лимфоузлы не поражены метастазами. В этом случае «классическое» удаление всех уровней лимфоузлов было бы избыточной калечащей процедурой. На помощь хирургам пришел метод биопсии сигнальных (сторожевых) лимфатических узлов.
Поскольку, метастазы в подмышечных лимфоузлах появляются последовательно от первого ко второму, затем к третьему уровню, то достаточно определить наличие метастазов именно в первом лимфоузле. Его назвали «сигнальным»: если сигнальный лимфатический узел не содержит метастазов, то другие лимфоузлы также не метастатические.
Благодаря этому органосохраняющему методу, тысячи пациенток избежали избыточной полной хирургической диссекции, удаление раковой опухоли не привело к удалению груди.
Последние результаты клинических испытаний, в том числе и при участии НИИ онкологии им. Н.Н. Петрова, подтвердили безопасность отказа от полной подмышечной диссекции. Биопсия сигнальных (сторожевых) лимфатических узлов постепенно вытесняет подмышечную диссекцию как стандартную процедуру стадирования РМЖ.
Концепция биопсии сигнальных лимфатических узлов приобретает все большее признание и введена для многих локализаций опухолей в стандарты хирургического лечения Европейской Организацией по Изучению и Лечению Рака (EORTC).
Химиотерапия, наряду с хирургическим вмешательством, является одним из основных методов терапии рака. Послеоперационная химиотерапия улучшает результаты хирургического лечения, как и прогноз заболевания.
Ранее решение о назначении химиотерапии основывалось на двух факторах:
- стадия заболевания
- состояние регионарных лимфоузлов.
Благодаря многочисленным исследованиям ученых изменяются представления о биологии рака молочной железы, и выбор режимов химиотерапии значительно расширяется. И сегодня химиотерапевтическое лечение назначают даже при отсутствии метастазов в лимфоузлах, если небольшие по размеру опухоли обладают агрессивными биологическими характеристиками.
Люминальный А рак
При люминальном А раке избегают назначать проведение химиотерапии, особенно при негативных лимфоузлах, и применяют одну эндокринотерапию.
Люминальный В рак
Люминальные В опухоли характеризуются высокой агрессивностью. В этом случае чаще всего будет назначена химиотерапия, а выбор лечения основывается на оценке риска развития рецидива.
HER2-позитивный рак молочной железы
Лечение HER2-позитивного рака молочной железы основано на применении стандартных схем химиотерапии – трастузумаб и ХТ, основанная на антрациклинах и таксанах. Однако, только небольшой процент пациентов выигрывает от лечения, но все подвержены связанной с этим токсичностью.
Трижды негативный РМЖ
Трижды негативный рак молочной железы обычно ассоциируется с плохим прогнозом. Из-за редкой встречаемости особых типов РМЖ нет достаточных данных о роли адъювантной химиотерапии.
Химиотерапия при РМЖ у очень молодых женщин
Рак молочной железы в молодом возрасте обычно протекает агрессивно, часто встречаются гормонорезистеные и HER2-позитивные опухоли с иными свойствами, чем у более пожилых женщин. Для таких пациенток, моложе 35 лет, адъювантная полихимиотерапия почти всегда является необходимым методом лечения.
Химиотерапия пожилых пациенток
У пожилых пациенток (старше 65 лет) при решении вопроса о назначении адъювантной химиотерапии обязательно учитываются общее состояние организма и наличие сопутствующих хронических заболеваний.
В идеале пожилые пациенты должны подвергаться гериатрической оценке для определения их «пригодности» к адъювантому лечению. Потенциальный эффект лечения должен быть сбалансирован с теми рисками для организма, которые несет химиотерапия. Врач определяет наиболее эффективный и при этом наиболее безопасный специфический режим, основываясь на подтипе опухоли и индивидуальных характеристиках пациента.
Гормонотерапия
Молодые женщины с гормоноположительным раком молочной железы сохраняют риск рецидива заболевания на протяжении по крайней мере 15 лет после первичного заболевания. Онкологи должны определить, кто из пациентов нуждается в долгосрочной адъювантной терапии тамоксифеном или ингибиторами ароматазы.
Неоадъюватная (предоперационная) терапия
Неоадъюватная терапия занимает ведущую роль в лечении женщин с неоперабельным раком молочной железы, а также имеет важное значение при операбельных опухолях, когда выполняются органосохраняющие операции.
Эффект неоадъювантного лечения ДО (слева) и ПОСЛЕ (справа)
Лучевое лечение после проведенного хирургического вмешательства играет важную роль в терапии рака молочной железы и прогнозе заболевания. В НМИЦ онкологии им. Н.Н. Петрова было проведено исследование роли лучевой терапии после органосохраняющих операций (секторальная резекция с аксиллярной лимфоаденэктомией) у пациенток с минимальным РМЖ.
Анализ десятилетней безрецидивной выживаемости доказал более высокую эффективность лечения в группе больных, где применялась послеоперационная лучевая терапия.
Использование лекарственных препаратов для снижения риска заболевания называется химиопрофилактикой. На сегодняшний день одобренными препаратами для профилактики рака молочной железы являются тамоксифен и ралоксифен.
Тамоксифен может использоваться как пременопаузальными, так и постменопаузальными женщинами. Прием тамоксифена приводит к снижению риска РМЖ на 38% на более чем 10 летний период. Наиболее распространенными нежелательными явлениями на фоне приема препарата являются приливы.
В настоящее время клинические исследования изучают роль другого класса препаратов – ингибиторов ароматазы для оценки эффектов снижения риска РМЖ, которые сегодня используются только для лечения РМЖ. Предварительные результаты оказываются многообещающими. Ингибиторы ароматазы действуют только у женщин с нефункционирующими яичниками.
Профилактические хирургические операции по удалению молочных желез проводятся только в одном случае – если женщина является носителем мутаций в генах BRCA1 и BRCA2, известных как «синдром Анджелины Джоли». Мировой практикой доказано, что при удалении ткани обеих молочных желез риски РМЖ снижаются более чем на 90%. Такие операции выполняются в клиниках США и Израиля. В Европе подход к этому вопросу более консервативный.
В НМИЦ онкологии им. Н.Н. Петрова при проведении хирургического лечения женщинам с мутациями BRCA1 предлагается профилактическое удаление и реконструкция молочной железы.

Можете сохранить памятку-картинку о факторах риска рака молочной железы, она находится в конце статьи. Просто переместите картинку мышкой на рабочий стол.
Как ни странно, но многие специалисты ставят эту причину одной из первых. Сюда относится неврастения, неврозы и другие причины психических травм, перегрузок человека. Конечно, современная жизнь насыщенна стрессами. Но помните, что стрессы вызывают сильный выброс гормонов, а именно гормоны приводят к развитию рака описываемого вида.
Продукты питания – это другие факторы риска рака молочной железы, которые обращают на себя повышенное внимание. Многое зависит от того, как много воды в течение суток пьет человек. Данные статистики ООН утверждают, что употребление кофе увеличивает выработку эстрогена на 68%, а это значит, что появляется благоприятная среда для развития злокачественной опухоли. Вызывать появление болезни может постоянное переедание продуктов с высоким содержанием сахара и холестерина. В группе риска по возникновению рака груди находятся женщины, которые постоянно кушают жареную пищу.
Также обратите внимание на недостаток витаминов, которые может вызывать многие формы рака. Развитие рака молочной железы связано с недостаточным количеством в организме человека бета-каротина.
90% диагностируемых случаев встречается у женщин после сорока лет. Наибольший пик заболевания приходится на период 40-60 лет. В этот период в организме происходят гормональные изменения, связанные с наступление менопаузы. Климакс – это нормальный процесс, но в этот период защитные функции организма значительно снижаются, из-за чего увеличивается риск возникновения рака в разы.
В эту группу риска женщин включают также, исходя из четких данных статистики. Следует отметить раннее начало менструации (до 12 лет) или позднее ее прекращение (после 50 лет). Если женщина начинает половую жизнь после 25 лет, то риск развития рака также увеличивается. Увеличивают риск появления опухоли и поздние роды (после 30 лет) или вообще отсутствие беременностей в течение жизни, отсутствие кормления грудью после родов.
Почему данный фактор, способствующий возникновению рака молочной железы, выделяется отдельно? Все очень просто, ведь лишняя масса тела – это отложение жировой ткани. Она накапливает в теле человека токсины. Также в жировой ткани нарушен обмен гормонов, увеличивается производство эстрогена, который специфически влияет на ткани молочной железы.
Частая причина возникновения описываемого вида рака. Конечно, простое механическое воздействие не может обычные клетки превратить в клетки раковой опухоли. Но, частые механические травмы способствуют тому, что структура молочной железы меняется. Получается, что травмы могут стимулировать рост опухоли.
Рак молочной железы передается по женской линии. Если у бабушки или матери, сестры или тети были такое заболевание, то возможность возникновения рака у родственницы достаточно велика. Но, помните, что рак не является исключительно наследственным заболеванием и не обязательно передается во всех случаях. Передается только предрасположенность. В дальнейшем же все зависит от образа жизни, питания и многих других значений.
Тут стоит отметить курение. Исследования показали, что особенно опасно курение перед наступлением климакса. Что касается исследований, относительно алкогольных напитков и рака молочной железы, то были получены следующие результаты. Употребление чистого этилового спирта в дозе более 30 грамм в сутки существенно увеличивает риск возникновения заболевания. Кстати, сюда же можно отнести привычку носить красивое, но не удобное нижнее белье. Неправильные бюстгальтеры нарушают кровообращение в тканях, а это может приводить к развитию рака.
Когда известны потенциальные причины возникновения рака молочной железы, то можно скорректировать свой образ жизни. Конечно, профилактика полностью не исключит возможность появления рака. Но, когда женщина следит за собой и своим здоровьем, она на раннем этапе заметит какие-то изменения. Это приведет к увеличению положительного результата от дальнейшего лечения.
источник
Согласно современным концепциям, морфологическое и функциональное состояние молочных желез находится в прямой зависимости от стероидных гормонов яичников и пролактина, в меньшей степени — от гормонов щитовидной железы, коры надпочечников и поджелудочной железы.
Об этом свидетельствуют данные о наличии в клетках рецепторов этих гормонов.
Регулирующее влияние вышеперечисленных гормонов зависит от функционального состояния гипоталамо-гипофизарной и гонадной систем.
Эти взаимоотношения настолько сложны, что не всегда удается объяснить причину «поведения» железы в норме и патологии.
Среди органов женской половой системы ведущее положение по эндокринной активности занимают яичники, различные клетки которых являются источником более чем 30 гормонов и биорегуляторов, влияющих на циклическое осуществление женских половых функций.
Внутрисекреторная деятельность яичников состоит в продукции эстрогенов и прогестинов и осуществляется под контролем гипоталамуса и гипофиза. В норме в половозрелом женском организме гонадолиберин стимулирует в гипофизе продукцию гонадотропинов: преимущественно фолликулостимулирующего гормона (ФСГ) при низком уровне эстрогенов, а при высоком — в основном лютеинизирующий гормон (ЛГ).
ФСГ для яичника является стимулятором роста и пролиферации клеток гранупезы и активатором конверсии андрогенов в эстрогены (ароматазная реакция). ЛГ для яичника служит стимулятором андростероидогенеза и способствует формированию желтого тела. Оба гонадотропина через специфические рецепторы семейства G-белков оказывают свое действие на продукцию яичниками ряда других гормонов.
Андростендион — главный овариальный андроген (С-19-стероид). Его собственная андрогенная активность чрезвычайно мала, а сам он преобразуется в эстрогены, в основном яичником, а также жировой тканью и другими органами. В связи с этим необходимо отметить, что в организме здоровых женщин единственным эндогенным источником андрогенов служит кора надпочечников. Физиологическая роль андрогенов в половой системе женщин заключается в активации скорости синтеза белков в матке и яйцеводах.
Эстрогены яичников (С-18-стероиды) в нормальном женском организме синтезируются из андрогенов. Эстрогены представлены образуемым из андростендиона эстроном (Е1) и из тестостерона — эстрадиолом (Е2). Из Е1 и Е2 в печени и жировой ткани может формироваться эстриол (ЕЗ). Биологическая активность Е1/Е2УЕЗ соотносится, примерно, как 1/10/3.
У женщин детородного возраста преобладает Е2, синтезируемый фолликулом и желтым телом. В постменопаузальный период, при отсутствии функционирующих фолликулов, доминирует Е1. который образуют адипоциты и другие экстраовариапьные ткани. Печень — главный орган катаболизма эстрогенов. При ее функциональных нарушениях может развиваться относительная гиперэстрогенемия.
Эстрогены — гормоны-индукторы генетических программ, ответственных за развитие вторичных женских половых признаков, стимуляцию роста матки. Эстрогены также стимулируют пролиферативные процессы в эпителии системы протоков молочных желез путем активации синтеза ДНК.
В связи с этим, гиперастрогенемия является фактором риска для развития миом матки и рака молочной железы. Кроме того, эстрогены стимулируют окостенение метаэпифизарных хрящей и останавливают рост тела в длину у девушек. При нехватке эстрогенов отложение кальция в костях нарушается, что лежит в основе остеопороза у женщин в постменопаузальный период.
Прогестины (С-21-стероиды) в организме женщины представлены прогестероном и 17-гидроксипрогестероном В основном их вырабатывает желтое тело (временная эндокринная железа, формируемая внутри яичника из остатков фолликула после овуляции), где биосинтез прогестерона примерно в 30-40 раз эффективнее, чем в других овариальных структурах.
В норме прогестины осуществляют комплекс изменений, которые нужны для имплантации и гестации: активируют секрецию желез эндометрия, ингибируют сокращения миометрия и др. В молочных железах прогестины стимулируют рост эпителиальных клеток в дольках железы.
Интегральной характеристикой ритмических эндокринных взаимодействий гипоталамуса, гипофиза, яичников и матки служит овариально-менструальный цикл. Ритмичность деятельности яичника, а также клеток-мишеней его гормонов, связана с необходимостью обеспечить оптимальные условия, с одной стороны, для полового акта и оплодотворения яйцеклетки, с другой — для сохранения и развития зиготы.
Циклизм заключается в чередовании фолликулярной фазы (когда преобладает продукция андрогенов в теке яичника и их ароматизация в эстрогены в гранулезе) и лютеальной фазы, когда остатки разорванного при овуляции зрелого фолликула (желтое тело) насыщают организм прогестероном. Эти колебания заставляют эстрогензависимые ткани и органы претерпевать специфические фазовые изменения.
Циклическая деятельность гипоталамо-гипофизарно-овариального аппарата и тканей-мишеней овариальных гормонов продолжается вплоть до возрастного уменьшения гонадотропной и гонадной эндокринной активности (климактерического периода). За всю предстоящую жизнь половозрелой женщины только немногим более 400 яйцеклеток будет использовано в цикле.
Таким образом, если мужчина, при длящемся много десятилетий процессе самообновления сперматогенного эпителия яичек, имеет буквально миллиарды шансов стать отцом, у женщин, даже идеального здоровья, это число шансов ограничено всего лишь сотнями Следует отметить, что большое количество сперматозоидов уравновешивает то обстоятельство, что каждый из них намного более уязвим для неблагоприятных влияний, чем отдельно взятая яйцеклетка.
Поэтому, частота женского и мужского бесплодия, практически, одинакова, несмотря на разительные отличия в количественных результатах ово- и сперматогенеза. В постменопаузальном периоде из-за израсходования фолликулов, продукция овариальных гормонов резко снижается, а аденогипофизарных гонадотропинов — наоборот, значительно возрастает.
Изложение происходящих под влиянием гормонов изменений в контролируемых ими органах-мишенях (молочная железа, матка, яичники) позволит лучше понять основные принципы проведения гормональной терапии при раке этих органов Периодически повторяющиеся колебания активности гипоталамуса, гипофиза и яичников и соответствующие им функционально-морфологические изменения в органах-мишенях в норме сводятся к следующему (рис. 9.28).
Рис. 9.28. Ритмические гормональные и физиологические изменения в яичниках, матке и молочных железах при овариально-менструальном цикле [Уайт А. и соавт. 1981; Пищулин А.А., 1991].
В начале очередного цикла, под влиянием гонадолиберина, усиливаются секреция фолликулостимулирующего гормона и, с некоторым отставанием по фазе, — лютеинизирующего гормона. Под влиянием ФСГ в яичнике группа примордиальных фолликулов (от 3 до 30 за один раз) начинает созревать и расти.
Обычно, из этой группы лишь один проходит стадии первичного, вторичного и третичного (граафов пузырек) фолликула и дает начало зрелой яйцеклетке, которая и выйдет в половые пути женщины в день овуляции, на границе фолликулярной и лютеальной фаз.
В это же время, ЛГ (при участии фолликулостимулирующего гормона) стимулирует в фолликулах синтез андрогенов и их превращение с участием фермента ароматазы в эстрогены. В результате уровень эстрогенов нарастает в течение всей фолликулярной фазы.
Под влиянием эстрогенов эндометрий в матке пролиферирует, утолщается и приобретает прямые железы, содержащие жидкий секрет (пролиферативная фаза развития эндометрия). В молочных железах эстрогены прогрессивно (до окончания цикла) стимулируют пролиферацию эпителиальных клеток протоков.
В самом яичнике эстрогены стимулируют пролиферацию фолликулярных клеток, вследствие чего появляется опережающий в росте все прочие доминантный фолликул, в котором лютеинизирующий гормон стимулирует, помимо андрогенов, продукцию эстрогенов и, особенно, — прогестерона.
В середине цикла (на 11-13 день) граафов пузырек разрывается, нарушая целостность стенки яичника. Яйцеклетка выходит в яйцевод и далее движется к эндометрию Создается возможность ее оплодотворения.
Остаток фолликула превращается в желтое тело. Клетки его, под действием ЛГ и пролактина, синтезируют и выделяют эстрогены и большое количество прогестерона, который инактивирует положительный механизм обратной связи и уровень ФСГ и лютеинизирующего гормона снижается.
В фазе функционирующего желтого тела под влиянием прогестерона и эстрогенов в эндометрии происходит превращение прямых желез в извитые, жидкий секрет трансформируется в густой, начинается его активное выделение (секреторная фаза развития эндометрия).
Продолжаются стимулированные гормонами пролиферативные процессы в молочных железах и достигают они максимума в течение второй половины лютеиновой фазы цикла. Чрезмерная выраженность морфо-функциональных изменений в железах может быть одним из проявлений синдрома предменструального напряжения.
При быстром ингибировании прогестинами и эстрогенами секреции ЛГ, желтое тело, зависящее от его тройного действия, сохраняется лишь недолгое время и инволюцирует, что ведет к стремительному падению концентраций эстрогенов и прогестерона. В отсутствие этих гормонов эндометрий не может больше поддерживаться в секреторной фазе и отторгается.
Следует менструация, которая начинается на фоне быстро снижающегося уровня прогестинов и эстрогенов и знаменует окончание трехфазного цикла, средняя общая продолжительность которого составляет около 28 суток. Сама менструальная фаза цикла длится 3-5 дней.
Активированные пролиферативные процессы в молочных железах также начинают уменьшаться и в период с 6 по 10 сутки от начала менструации железы находятся под наименьшим влиянием эстрогенов и прогестерона. Именно поэтому эти сроки являются оптимальным для физикального и инструментального обследования молочных желез при подозрении на различную патологию и профилактическом самообследовании.
Установлено, что более 150 показателей функционирования женского организма циклически изменяются при осуществлении овариально-менструального цикла. Не удивительно, что так называемый синдром пременструального напряжения, отмечаемый почти у 10% женщин, характеризуется разнообразными проявлениями.
Наиболее типична эмоционально-поведенческая сторона этого симптомокомппекса, выражающаяся в тревожности, раздражительности, эмоциональной лабильности. У очень женственных пациенток с перевесом эстрогенов может быть выраженное нагрубание молочных желез. У женщин с перевесом прогестинов/андрогенов (мальчишеский хабитус) симптомы включают депрессию и боли в животе и пояснице.
По современным представлениям, в основе синдрома лежат особенности гормонального фона в конце лютеальной фазы цикла — пониженная продукция эндогенных опиатов и повышенная — пролактина, вазопрессина, ведущих к метаболические изменениям (тенденция к гипогликемии, задержка натрия и воды и др.).
Прошло уже 100 лет с тех пор. как G. Beatson, хирург из Глазго, впервые опубликовал детальное описание удачного лечения трех больных распространенным раком молочной железы (РМЖ) с помощью овариэктомии. Опираясь на ветеринарный опыт о кастрированных коровах, он интуитивно угадал вероятность атрофии молочных желез (включая опухоль) и у овариэктомированных женщин.
По мере прогресса эндокринологии, открытия механизма регуляции выработки гормонов яичниками, выявления других источников продукции эстрогенов, появились многочисленные методы эндокринотерапии, основанные, однако, на одной идее — эстрогенозависимости РМЖ.
Патогенетическая роль эндогенных эстрогенов в развитии и прогрессировании РМЖ в настоящее время не вызывает сомнений и заключается в обеспечении этапа промоции канцерогенеза (рис. 9.29). Более того, эстрогены по современным представлениям являются обязательным элементом развития рака железы.
Рис. 9.29. Роль эстрогенов в канцерогенезе рака молочной железы.
Имеющиеся данные свидетельствуют, что механизм действия эндогенных эстрогенов на раковую клетку достаточно сложный и не ограничивается прямым влиянием на рецепторы эстрогенов (ER). Помимо этого существуют аутокринные и паракринные механизмы влияния на опухолевый рост.
Рис. 9.30. Механизмы регуляции роста клеток рака молочной железы [Martin P. et al., 1993].
Как видно из рисунка 9.30, под влиянием эстрогенов происходит выделение раковой клеткой ряда факторов роста, способных стимулировать через соответствующие рецепторы собственный рост и функционирование (аутокринные факторы) или рост и функционирование соседних клеток (паракринные факторы).
Среди них наиболее изучены эпидермальный (EGF), трансформирующие — альфа (TGF-) и бета (TGF-) и инсулиноподобные факторы роста (IGF-I и II). При этом установлено, что гормоночувствительные клетки продуцируют эти факторы в меньшем количестве, чем гормонорезистентные.
Помимо эстрогенов определенную роль в реализации эндокринологических опухолевых эффектов могут играть и другие гормоны Например, андрогены способны ингибировать рост опухоли путем непрямого эффекта на окружающие ее ткани.
Достаточно высокая эффективность гормонотерапии при раке молочной железы позволяет отнести эту опухоль к гормонозависимым. При этом у 30-35% больных только с помощью этого метода можно добиться лечебного эффекта.
При огромном разнообразии методов гормонотерапии РМЖ основу их составляют два основных направления:
• прекращение или торможение продукции эстрогенов в организме больной,
• использование препаратов, конкурирующих с эстрогенами за контроль над опухолевой клеткой.
В настоящее время гормонотерапия является одним из основных компонентов комплексного лечения метастатического РМЖ. В таблице 9.13 представлена хронология развития этого метода.
Таблица 9.13. Этапы развития гормонотерапии рака молочной железы [Stein R. et al., 1995].
Механизмы реализации противоопухолевых эффектов гормонов при РМЖ. Принимая во внимание тот факт, что каждый отдельный вид гормонотерапии сопровождается приблизительно одинаковой частотой и продолжительностью объективных лечебных эффектов, было предположено, что в основе этого вида лечения лежит единый механизм подавления уровня эндогенных эстрогенов или устранения их эффекта в отношении клеток рака молочной железы.
Данная гипотеза, на первый взгляд убедительно объясняющая близкую эффективность различных видов гормонотерапии одинаковым механизмом ее реализации, входит в противоречие с некоторыми хорошо известными фактами.
Так, если различные виды гормонотерапии имеют одинаковый механизм действия, то трудно объяснить лечебный эффект препаратов II линии после прогрессирования на I линии, или почему у 20% больных, негативно отреагировавших на гормонотерапию I линии, при смене препарата наблюдается положительный лечебный эффект.
Как в настоящее время считается, реализация противоопухолевого эффекта гормонотерапии при РМЖ осуществляется посредством устранения стимулирующего влияния эстрогенов на опухоль, что приводит гормоночувствительные раковые клетки к переходу в фазу покоя G0 или гибели путем аутофагоцитоза. Возможны и другие механизмы.
Так известно, что эстрогены, как и другие стероидные гормоны, имеют «колоколообразную» кривую доза-эффект. А это означает, что они оказывают стимулирующее действие на пролиферацию клеток в физиологических концентрациях и ингибируют ее — в высоких.
Механизм подавления роста опухолевых клеток высокими дозами эстрогенов полностью не ясен, но предполагается, что в его основе лежит «разрегуляция» синтеза рецепторов эстрогенов. Считается, что аналогичным образом могут действовать андрогены и прогестины, которые также могут оказывать негативное воздействие на синтез ER, что приводит к потере их чувствительности к стимулирующему влиянию эндогенных эстрогенов.
Наряду с антиэстрогенным, некоторые методы гормонотерапии имеют дополнительные механизмы, например, через факторы роста подавляют пролиферацию раковых клеток и этим усиливают антиэстрогенное действие препарата.
Отсутствие эффекта гормонального лечения связано с гормонорезистентностью, причины которой изучены недостаточно. Предполагается, что она может быть вследствие исходного отсутствия рецепторов гормонов (ER-, PgR-), или к утрате рецепторов приводят мутации и селекция опухолевых клонов в процессе опухолевого роста и лечения.
Объясняют гормонорезистентность также гетерогенной природой РМЖ. При этом клоны опухолевых клеток, имеющие одинаковый рецепторный статус и гистологические характеристики, в силу гетерогенности по другим параметрам могут по-разному реагировать на лечение.
Современные возможности эндокринной терапии рака молочной железы достаточно эффективны и могут реализоваться различными способами, которые схематично представлены на рисунке 9.31.
Рис. 9.31. Принципиальная схема различных эндокринных воздействий при раке молочной железы.
Как уже отмечалось, овариэктомия является самым старым методом гормонотерапии, но и до настоящего времени активно используется во всем мире. Овариэктомия эффективна только у больных репродуктивного и пременопаузального периода (32% объективных лечебных эффектов).
Это связано с тем, что основным ее эндокринологическим эффектом является снижение уровня «классических» эндогенных эстрогенов, продуцируемых яичниками. Логичным поэтому представляется отсутствие положительного лечебного эффекта от применения этого метода у женщин в постменопаузе.
После прекращения менструальной функции в течение нескольких лет наблюдается падение уровня эстрогенов, но далее отмечается их медленный рост до тех пор, пока не достигнет уровня, минимального для женщин репродуктивного периода. При этом в постменопаузе изменяется соотношение фракций эстрогенов с преобладанием эстрона над эстрадиолом. Основным местом образования эстрона являются не яичники, которые постепенно атрофируются, а надпочечники и жировая ткань.
Понятно поэтому, что после овариэктомии снижение уровня эндогенных эстрогенов у больных в постменопаузе не наблюдается и попытки выполнения овариэктомии у них неэффективны. Однако также не высока (от 15 до 25%) эффективность овариэктомии и у молодых (менее 35 лет) больных.
Выключение функции яичников может быть произведено также и с помощью лучевой терапии. Основной особенностью лучевой кастрации является отсрочка лечебного эффекта на 2-8 недель, тогда как после хирургического удаления яичников эффект наблюдается практически немедленно.
Поэтому, когда необходимо быстро достичь лечебного эффекта у больных с удовлетворительным общим статусом, но с выраженной клиникой заболевания, целесообразно отдавать предпочтение хирургической кастрации. У больных с незначительными клиническими симптомами или в случае противопоказаний для хирургического лечения, облучение яичников, по-видимому, можно считать методом выбора, так как не требует госпитализации и нет послеоперационных осложнений, в том числе и летальных (2,5-4,5% при овариэктомии).
В тоже время, имеющиеся данные показывают, что при метастатическом РМЖ хирургическая кастрация не эффективнее лучевой, особенно среди больных 35-45 лет, «Выключение» яичников может быть осуществлено и лекарственным способом — агонистами рилизинг-гормона.
Ранее хирургическое удаление надпочечников и гипофиза рассматривалось в качестве гормонотерапии у постмено-паузальных больных РМЖ и было популярно на Западе. Гипофизэктомия выполнялась через транссфеноидальный или через трансфронтальный доступ или путем лучевой аблации (имплантация иттрия-90 или облучение пучком протонов) Адреналэктомия производилась в двух вариантах (удаление обеих надпочечников или удаление правого с пересадкой левого в брюшную полость).
Общий их лечебный эффект мало отличался от результатов других видов гормонотерапии, а побочные эффекты (тошнота, рвота, маскулинизация, задержка жидкости) наблюдались значительно реже, чем при применении стандартной для тех пет аддитивной гормонотерапии эстрогенами и андрогенами.
Однако послеоперационные осложнения, в том числе летальность, были достаточно высокими (5,5% — после адреналэктомий и 4,0% — после транссфеноидальных гипофизэктомий). Кроме того, в ряде случаев наблюдались тяжелые хронические осложнения. Наиболее значимыми были повторяющиеся кризы Аддисоновой болезни после адреналэктомий (у 17% больных).
Гипофизэктомия сопровождалась несахарным диабетом, нарушением обоняния и менингитом. Все перечисленное явилось главной причиной ограниченного применения, а появление новых малотоксичных методов лекарственной гормонотерапии привело к полному отказу от этих видов лечения.
В настоящее время хирургические адренал- и гипофизэктомия представляют исторический интерес, так как аналогичного эффекта удается добиться современными лекарственными препаратами (ингибиторы ароматазы, аналоги LHRH).
До появления современных препаратов эстрогенотерапия у больных в глубокой менопаузе была методом выбора. У больных репродуктивного периода эстрогены неэффективны даже в очень высоких дозах, и их применение нецелесообразно.
Механизм действия фармакологических доз эстрогенов точно неизвестен, но предполагается, что может быть связан с нарушением механизмов регуляции синтеза стероидных рецепторов. При проведении терапии эстрогенами следует учитывать, что у 20-25% больных с положительным лечебным эффектом, в последующем, при отмене препарата из-за прогрессирования процесса, может быть регрессия опухоли (феномен «регрессии на отмену»).
Именно поэтому после отмены эстрогенов по причине прогрессирования рекомендуется перед назначением другого вида лечения сделать перерыв в 1-2 месяца. Эстрогены до настоящего времени не потеряли своего значения при лечении метастатического РМЖ и могут использоваться в качестве терапии IV-V линии.
Антиэстрогены первоначально разрабатывались как противозачаточные средства. Потом обнаружилось, что они способны приводить к регрессу опухоли молочной железы посредством блокады ER. Один из них — тамоксифен — стал препаратом выбора при гормонотерапии метастатического рака молочной железы и основным — при адъювантном лечении операбельного РМЖ. Тамоксифен является, вне всяких сомнений, одним из важнейших достижений в онкологии в XX столетии.
У постменопаузальных больных с метастатическим РМЖ тамоксифен является препаратом выбора для I линии, поскольку он достаточно эффективен как с точки зрения частоты объективных ответов (31%), так и их продолжительности (13-23 месяца), и в целом сопоставим с эффективностью овариэктомии.
Кроме того, положительный лечебный ответ на терапию тамоксифеном позволяет прогнозировать после прогрессирования последующий благоприятный эффект овариэктомии. У пременопауэальных больных сопоставление тамоксифена и овариэктомии не выявило различий ни в частоте положительных лечебных эффектов, ни их продолжительности, ни выживаемости.
А появление агонистов LHRH-рилизинг гормонов (золадекс) отодвинуло тамоксифен у больных репродуктивного периода на второй план. В настоящее время в пременопаузе этот препарат или комбинируется с агонистами LHRH-рилизинг гормонов, или назначается в качестве гормонотерапии второй линии. Как и при эстрогенотерапии, после прекращения приема тамоксифена возможны отдельные случаи регресса опухоли.
О возможности эффекта «отмены» следует помнить у больных РМЖ, особенно а случае выраженного и продолжительного лечебного эффекта тамоксифена. Поэтому после прогрессирования не следует спешить с нялначонием нового вида терапии, особенно токсичного, у бессимптомных или малосимптомных больных. Одним из наиболее перспективных пропаратов группы ашизстрогпнов, изучаемых в настоящей время, является торамифен (фарестон).
Первоначальные исследования по применению прогестинов свидетельствовали об их неоффективности при метастатическом раке молочной железы. Однако после того, как в 70-е годы XX в. были получены новые синтетические препараты этой группы (мегейс, провара) — это мнение изменилось. При их использовании в качестве гормонотерапии I линии частота положительных лечебных эффектов достигают 30%.
Точный механизм противоопухолевого действия этих препаратов при РМЖ неизвестен. При применении прогестинов наблюдается широкий спектр эндокринологических изменений: снижаются и уровни эндогенных эстрогенов, и тканевая конверсия андрогенов в эстрогены, и секреция гонадотропинов (фолликулостимулирующий гормон, ЛГ, АКТГ).
Основным является снижение уровня эстрогенов. Наряду с этим наблюдается также андрогено- и гпюкокортикоидоподобное действие. Сравнительное изучение эффективности провера, мегейса и тамоксифена не выявило преимуществ ни одного из них при одинаковой частоте побочных эффектов.
В связи с лучшей переносимостью тамоксифен остается препаратом выбора для I линии гормонотерапии у больных в постменопаузе. Прогестины должны использоваться в качестве II или III линии гормонотерапии. На этом этапе им отдается предпочтение перед ингибиторами ароматазы, которые обладают аналогичной эффективностью, но значительно хуже переносятся больными.
Андрогены также являются достаточно эффективными препаратами при РМЖ и с 60-х годов XX в. использовались в практической онкологии. В основе механизма действия андрогенов лежит антиэстрогенный эффект. Несмотря на многочисленные усилия, эффективный андрогенный препарат, лишенный маскулинизирующего влияния, так и не удалось синтезировать.
Препараты этой группы следует применять в качестве средств IV-V линии у больных репродуктивного периода после овариэктомии, когда исчерпаны терапевтические возможности современной химио- и гормонотерапии. Терапия андрогенами. как и другие виды гормонотерапии, проводится до начала прогрессирования опухолевого роста, а лечебный эффект оценивается не ранее, чем через 6-8 недель.
В случае лечения андрогенами, как и при эстрогенотерапии, наблюдается характерный феномен на отмену препарата, переставшего оказывать терапевтический эффект.
Как уже указывалось, ключевым механизмом действия гормонотерапии при РМЖ является снижение уровня эндогенных эстрогенов. У постменопаузальных женщин биосинтез эстрогенов осуществляется не в яичниках, а преимущественно в других органах и тканях (жировая ткань, мышцы, печень и надпочечники), где андрогены, связываясь с ферментом ароматазой, превращаются в эстрогены. Таким образом, ароматаза играет ключевую роль в образовании эстрогенов в постменопаузе,
Следовательно, прямое ингибирование ароматазы является основным в механизме действия ингибиторов ароматазы, представленных препаратами нескольких групп.
До последнего времени основным представителем этой группы в клинической практике оставался аминоглютетимид (ориметен, мамомит), который является конкурентным нестероидным неселективным ингибитором ароматазы.
Появление аминоглютетимида, вызывающего лекарственную адреналэктомию, значительно расширило возможности гормонотерапии и позволило отказаться от хирургического удаления надпочечников. Однако большее значение с точки зрения эффективности этого препарата при раке молочной железы имеет ингибирование ароматазы, которое происходит при значительно более низкой концентрации препарата, чем подавление функции надпочечников.
По этой причине отождествление эндокринологического эффекта аминоглютетимида и адреналэктомии не совсем верно. После хирургической адреналэктомии наблюдается снижение уровня, как эстрона. так и андростендиона. Усредненный лечебный эффект аминоглютетимида при метастатическом РМЖ составил 31% при продолжительности 11-14 мес, что сопоставимо с другими видами гормонотерапии.
Эффективность аминоглютетимида и хирургической адреналэктомии или гипофизэктомии практически одинаковы, но оба хирургических метода более «токсичны». Поэтому появление аминоглютетимида практически вытеснило их из клинической практики. У больных в пременопаузе аминоглютетимид неэффективен, предположительно потому, что не может полностью блокировать синтез эстрогенов в яичниках.
Аминоглютетимид рекомендуется в качестве гормонотерапии II-III линии. В последние годы все большее распространение в лечении диссеминированных форм РМЖ получают селективные нестероидные фемара и аримидекс и стероидные («суицидные») инактиваторы ароматазы — форместан и аромазин.
Применение препаратов этой группы при РМЖ основано на подавлении функции гипофиза Так же, как и при других видах гормонотерапии, ключевым в механизме их действия является снижение уровня эндогенных эстрогенов. Стимулированное снижение уровня гонадолиберинов сопровождается падением эстрогенов только у пременопаузальных больных.
В настоящее время несколько агонистов рилизинг-гормонов доступны для практического использования или проходят клинические испытания. Наиболее активно в клинической практике используется зопадекс (гозерелин).
Изучение активности препаратов этой группы у пременопаузальных больных показало, что они являются высокоэффективными при метастатическом раке молочной железы.
Суммарная частота лечебных эффектов составляет в среднем 40% (32-50%), что соответствует эффективности овариэктомии. Лечебный эффект эоладекса мало зависит от уровня рецепторов стероидных гормонов в первичной опухоли. Широкое практическое применение эоладекса в нашей стране пока ограничено высокой стоимостью препарата, который необходимо вводить в течение многих месяцев ежемесячно.
Однако препарат с успехом может использоваться при решении вопроса о целесообразности выполнения хирургической овариэктомии. С этой целью больным выполняются 3-4 инъекции эоладекса с интервалом в 28 дней и при наличии лечебного эффекта или стабилизации процесса хирургическое удаление яичников может оказаться эффективным. В случае неуклонного прогрессирования опухоли от операции следует воздержаться в связи с низкой вероятностью получения лечебного эффекта.
Пролактин играет важную роль в патогенезе РМЖ. Известно, что увеличение уровня пролактина сопровождается ускорением роста опухоли. Как физиологические, так и фармакологические дозы пролактина оказывают стимулирующее влияние на рост клеток РМЖ через рецепторы, которые выявляются в 20-50%.
К препаратам, подавляющим уровень пролактина, относятся леводопа, бромкриптин, даназол. Их использование в монорежиме крайне редко позволяет достигать лечебного эффекта при РМЖ. Вместе с тем, хорошо известно лечебное действие ингибиторов пролактина при болевом синдроме, обусловленном метастатическим поражением костей.
В настоящее время клиническое значение препаратов этой группы весьма ограниченно, однако они могут использоваться у больных с метастазами в кости или в качестве терапии для больных, резистентных к современным методам лечения.
Противоопухолевая активность кортикостероидов при раке молочной железы известна давно. При монотерапии этими препаратами частота объективных эффектов колебалась от 0% до 62%, но реальная противоопухолевая активность кортикостероидов при РМЖ, вероятно, невысока, поэтому практически препараты этой группы используются в основном с паллиативной и симптоматической целью.
Например, при метастазах в головной мозг или легкие для уменьшения неврологической симптоматики и одышки, а также при метастазах в кости с целью уменьшения болевого синдрома.
В последние десятилетия проведены многочисленные исследования с целью поиска факторов, позволяющих прогнозировать чувствительность опухоли к гормонотерапии.
В общем, можно констатировать, что абсолютных тестов гормоночувствительности выявить так и не удалось.
Однако известны косвенные признаки, несомненно, полезные в выборе гормонотерапии:
1. Длительность безрецидивного периода. Интервал между окончанием первичного лечения рака молочной железы и появлением рецидива называется «безрецидивным интервалом (периодом)».
Границей между длительным и коротким безрецидивным интервалом принято считать 2 года. Это искусственно выбранный срок, однако, чем он длительнее, тем выше вероятность ответа на гормонотерапию. Предполагается, что длительность безрецидивного интервала отражает биологические особенности опухоли, и в частности темп роста и степень злокачественности и в какой-то степени эстрогенную зависимость.
Короткий безрецидивный интервал означает высокую агрессивность опухоли и низкую эстрогенную зависимость. Длительный интервал между операцией и клинической манифестацией метастазов свидетельствует об относительно доброкачественном течении рака с сохранением эстрогенной зависимости.
Именно эти больные имеют высокий шанс положительного лечебного эффекта гормонотерапии. Следует учитывать, что больные с безрецидивным интервалом, равным нулю, те. те, у которых одновременно с выявлением первичной опухоли были обнаружены отдаленные метастазы, имеют более высокую вероятность ответа на гормонотерапию, чем пациентки с безрецидивным интервалом менее одного года.
2. Возраст больных до 35 лет традиционно считается важным прогностическим параметром. Объективный лечебный ответ на овариэктомию у женщин моложе 35 лет ниже, чем в старшей возрастной группе с сохраненной менструальной функцией (40-45 лет).
3. Продолжительность менопаузы. Больные пременопаузального периода (45-55 лет) имеют наименьший шанс лечебного ответа на все виды гормонотерапии, включая и аблативную. Частота положительных лечебных эффектов на гормонотерапию нарастает по мере увеличения возраста и «углубления» постменопаузы.
В целом, чем старше больные и продолжительнее менопауза, тем больше вероятность эффективного ответа на терапию тамоксифеном, прогестинами, эстрогенами, андрогенами, аминоглютетимидом. Наиболее гормоночувствительными принято считать женщин 60-70 лет в постменопаузе более 10-15 пет.
При этом, конечно, не имеется в виду гормонотерапия в «репродуктивном» возрасте, когда овариэктомия (хирургическая, лучевая или с помощью золадекса) сопровождается таким же объективным ответом, как и применение тамоксифена или ингибиторов ароматазы в глубокой (5-10 лет) постменопаузе.
4. Локализация метастазов. При висцеральных поражениях (печень, легкие) вероятность положительного лечебного эффекта на гормонотерапию ниже, чем при метастазах в лимфоузлы и мягкие ткани. Однако наличие метастазов во внутренних органах не может быть противопоказанием для гормонотерапии, т.к. имеются описанные случаи полного и частичного регресса метастазов в печень на фоне ее применения.
5. Эффективность предшествующей гормонотерапии является значимым прогностическим фактором гормоночувствительности. Средняя продолжительность положительного лечебного эффекта на гормонотерапию I линии составляет 1-2 года.
Этот показатель мало зависит от вида гормонального лечения. Один из основополагающих принципов лечения гормонами заключается в том, что больные, однажды ответившие на один вид гормонотерапии, имеют значительно больший, чем все остальные, шанс ответа в случае рецидива на другой ее вид.
Правда, продолжительность второго ответа в большинстве случаев бывает короче, но после второго прогрессирования сохраняется вероятность ответа на третью и даже на четвертую линию гормонотерапии, Так, если на первую линию больные с ER+ опухолями отвечали эффективно, то при последующем прогрессировании до 50% больных отвечают и на вторую линию.
Больные, у которых не было ответа на первую пинию, имеют очень невысокий шанс лечебного эффекта от любого другого вида гормонального лечения. Однако отсутствие ответа на первую линию не исключает полностью вероятность положительного эффекта второй и третьей пинии, хотя и снижает ее в 2-3 раза.
Например, при неэффективности тамоксифена аминоглютетимид может дать лечебный эффект не более чем у 22% больных, а в случае позитивного первоначального эффекта тамоксифена — может достигать 63%.
6. Степень гистологической дифференцировки опухоли. Чувствительные к гормонотерапии опухоли характеризуются, как правило, высокой степенью дифференцировки, которая оценивается как высокозначимый признак гормоночувствительности. Больные с объективными ответами на гормонотерапию, имеют, как правило, медленно развивающиеся формы рака, характеризующиеся доброкачественным течением.
7. Рецепторы стероидных гормонов в первичной опухоли. Рецепторы эстрогенов, прогестерона на поверхностной мембране клеток РМЖ являются важнейшим прогностическим параметром гормоночувствительности независимо от вида гормонотерапии. Однако полностью, как это предполагалось, с их помощью решить проблему не удалось.
Уровень ER и PgR является наиболее важным прогностическим фактором не столько с точки зрения предсказания эффективности гормонотерапии, сколько с точки зрения прогнозирования ее неэффективности. В среднем вероятность лечебного эффекта гормонотерапии составляет около 30%. При этом для больных с ER-негативными опухолями вероятность ответа не превышает 10%, а при ER+-опухолях удваивается и обычно колеблется от 50% до 60%.
Оптимальная последовательность различных методов гормонотерапии. В
большинстве случаев имеется небольшая разница в вероятности ответа на различные виды гормонотерапии. Поэтому подбор препаратов должен основываться в первую очередь на их токсичности, методами выбора обычно являются тамоксифен, овариэктомия и прогестины.
Для больных репродуктивного возраста относительная опасность (в смысле осложнений) хирургической или лучевой кастрации и тамоксифена не высока. Для постменопаузапьных женщин в настоящее время препаратом выбора является тамоксифен. Конкуренцию тамоксифену могут составлять прогестины, которые имеют аналогичную эффективность и низкую токсичность.
Для постменопаузальных больных, у которых наблюдался лечебный эффект от применения тамоксифена или прогестинов в качестве препарата III линии могут быть рекомендованы ингибиторы ароматазы. Назначение последних целесообразно также при лечении больных репродуктивного возраста, ранее подвергшихся овариэктомии.
Оптимальная последовательность различных вариантов гормонотерапии представлена в таблице 9.14.
Таблица 9.14. Последовательность применения различных вариантов гормонотерапии у больных местно-распространенным и метастатическим РМЖ.
В целом можно констатировать, что и у больных местно-распространенными, и метастатическими формами РЫЖ с отягощенным прогнозом адекватно выбранный вид эндокринотерапии является чуть пи не единственным нетоксичным методом лечения, приводящим нередко к стойкому лечебному эффекту на месяцы, а иногда и годы.
1. Эндокринная терапия проводится в основном при местно-распространенном и метастатическом раке. В качестве адьювантного лечения при операбельных формах используется антиэстроген тамоксифен.
2. Лечебный эффект гормонотерапии будет приблизительно у 30% больных, а при высоком содержании ER+ — более, чем у 60%. Больные, у которых будет эффект от одной линии гормонотерапии, с высокой вероятностью ответят и на другие ее виды.
3. Эффективность гормонотерапии следует оценивать не ранее, чем через 6-8 недель, а в случае метастазов в кости и печень — через 10-12 недель. Прерывать лечение в более ранние сроки можно только при абсолютной убежденности в прогрессировании процесса.
4. Начало гормонального лечения может сопровождаться обострением симптомов опухолевого процесса уже в первые часы и продолжаться до 1 месяца. Этот синдром называется «Пате» («вспышка»), наблюдается у 3-9% больных во время лечения эстрогенами, тамоксифеном, андрогенами и прогестинами, но никогда не бывает при назначении ингибиторов ароматазы и считается признаком гормоночувствительности. Прекращение аддитивной гормонотерапии (эстрогены, тамоксифен, андрогены) может сопровождаться феноменом «регрессии опухоли на отмену» препарата.
5. В качестве первой пинии в большинстве случаев один вид гормонотерапии по частоте объективных лечебных эффектов и их продолжительности не имеет преимуществ перед другими. Выбор или смена вида гормонотерапии основывается, прежде всего, на ее токсичности.
Исключением являются следующие клинические ситуации:
• овариэктомия эффективна только у женщин с сохраненным менструальным циклом или в течение первого года менопаузы:
• ингибиторы ароматазы и эстрогены эффективны только у больных в постменопаузе;
• аналоги LHRH-гормонов эффективны только у больных репродуктивного возраста;
• ингибиторы ароматазы более эффективны при метастатическом поражении костей.
6. Современные тенденции развития эндокринотерапии РМЖ отражают внедрение более простых, менее агрессивных и токсичных методов: ингибиторы ароматазы заменили адреналэктомию; агонисты рилизинг-гормонов — овариэктомию; антиэстрогены — эстрогены в постменопаузе; прогестины отчасти заменили андрогены.
7. Принципы эндокринотерапии распространенных форм РМЖ не вступают в конфликт с показаниями к полихимиотерапии (ПХТ). Правилом надо считать последовательное использование обеих методов и переходить от одного к другому только при установленном прогрессировании рака. Исключение из этого правила, когда допустимо сочетание гормоно- и химиотерапии, представляют ER-негативные и клинически агрессивные варианты рака.
Они характеризуются коротким (менее года) безрецидивным периодом после радикальной операции, манифестацией на фоне выраженной интоксикации (анемия, похудение) симптомов множественных метастазов и значительным местным распространением.
8. Вопрос о целесообразности альтернирующей гормонотерапии РМЖ путем чередования препаратов в целях предупреждения резистентности к лечению до конца не решен. Не вызывает возражений положение, что последовательное применение эстрогенов и антиэстрогенов должно производиться только после оценки эффекта «отмены», нередко весьма продолжительного.
В целом, считается, что средства I линии (антиэстрогены), II (ингибиторы ароматазы) и III (прогестины) необходимо назначать последовательно, после исчерпанного эффекта предыдущего этапа.
9. Отсутствие у тамоксифена клинически значимой острой и хронической токсичности стало определяющим для использования его в качестве единственного пока средства для длительной (5 лет) адьювантной гормонотерапии в обычных дозах (20 мг в сутки) после сберегательных операций и радикальной мастэктомии.
Адъювантная терапия тамоксифеном назначается больным в менопаузе с метастазами в лимфоузлах и ER+опухолями, что приводит к уменьшению летальных исходов в течение 5 лет почти на 20%. Интересно, что при ER+ и N1,2 опухолях дополнительное применение «стандартной» ПХТ не улучшает результатов, получаемых от одного тамоксифена.
В последние годы адъювантная терапия тамоксифеном проводится также больным в пре- и постменопаузе при ER+ опухолях, но без метастазов в лимфоузлы. Тамоксифен у пациенток этой группы достоверно увеличивает продолжительность периода без рецидивов и метастазов, а также снижает частоту рецидивов после сберегательных операций с последующим облучением.
10. Тамоксифен широко изучается в качестве средства профилактики рака молочной железы у женщин группы высокого риска. Этому способствовали клинические данные о способности адьювантной терапии препаратом предотвращать развитие рака в контрлатеральной железе.
А профилактическое назначение тамоксифена показало, что у женщин с высоким риском частота возникновения инвазивного рака в «тамоксифеновой» группе снизилась на 49%. По совокупности этих материалов в США в 1998 г. разрешено применение тамоксифена для профилактики РМЖ у женщин с высокой вероятностью его возникновения.
Рак молочной железы у мужчин также является гормонозависимой опухолью. Частота выявления рецепторов эстрогенов в опухоли составляет около 87%, андрогенов — 36%, прогестинов — 72%.
Эти цифры несколько выше, чем у женщин, что может свидетельствовать о более высокой гормоночувствительности опухолей у мужчин и очень важной роли гормонотерапии в комплексном лечении местно-распространенных и диссеминированных форм рака.
Считается, что эндокринная терапия рака железы у мужчин должна проводиться по тем же принципам, что и у женщин. Эстрогенная и андрогенная зависимость большинства опухолей предполагает у мужчин орхиэктомию в качестве первого этапа гормонального лечения далеко зашедшего рака молочной железы. Она эффективнее овариэктомии и вызывает регрессию опухоли у 45-68% больных.
Наибольшая частота ремиссий после радикальной мастэктомии регистрируется у больных с длительным безрецидивным и безметастатическим периодом и наличием костных, но не мягкотканных и висцеральных поражений. Следующим этапом после орхиэктомии может быть адреналэктомия (лекарственная или хирургическая).
Однако надо отметить, что любые виды гормонального лечения у мужчин малоэффективны при быстро прогрессирующем раке с метастазами в печень, головной мозг и в легкие (лимфангитические формы), когда интенсивная полихимиотерапия вынужденно оказывается единственно возможным методом лечения.
Угляница К.Н., Луд Н.Г., Угляница Н.К
источник